引用本文: 羅向東, 陳秀菊, 龔頌建, 黎曉新. 兩切口無玻璃體切除的視網膜下注射治療Bietti結晶樣視網膜營養不良. 中華眼底病雜志, 2024, 40(6): 429-433. doi: 10.3760/cma.j.cn511434-20240109-00012 復制
版權信息: ?四川大學華西醫院華西期刊社《中華眼底病雜志》版權所有,未經授權不得轉載、改編
視網膜下注射(SRI)是遺傳性視網膜疾病(IRD)基因治療的常用給藥方法[1-5]。該方法可將治療藥物直接注入光感受器和視網膜色素上皮(RPE)層之間的視網膜下空間,精準作用于靶目標區域,提高藥物吸收率和轉染效率;同時視網膜下腔具有一定的免疫豁免性,可以減少局部及全身不良反應[6-10] 。目前,通過SRI完成的轉基因治療均需先完成標準經睫狀體平坦部三切口玻璃體切割手術(PPV)后再行SRI,注射完畢后行氣液交換,患者需保持24 h仰臥位,促進視網膜下藥物吸收和視網膜復位[7, 11-12]。然而,PPV中可能會發生醫源性視網膜裂孔、手術后早發白內障等[3, 13-15]。我國視網膜變性疾病轉基因治療尚處于探索研究或1/2期臨床試驗階段,通常需觀察3~5年。PPV后發生的白內障會干擾基因治療后視功能的長期觀察。我們采用一種簡化替代手術方法,即兩切口無玻璃體切除的SRI治療了一組Bietti結晶樣視網膜營養不良(BCD)患者。現將結果報道如下。
1 對象和方法
探索性臨床研究。本研究遵循《赫爾辛基宣言》原則,獲得廈門大學附屬廈門眼科中心倫理委員會審核(批準號2022-005-05),并于ClinicalTrial.gov登記(NCT-06302608)。患者均簽署書面知情同意書。
2023年2~5月于廈門大學附屬廈門眼科中心臨床和基因檢查確診并接受SRI腺相關病毒(AAV)載體轉基因藥物治療的BCD患者6例6只眼納入本研究。其中,男性2例,女性4例;年齡(43±10)(34~60)歲。納入標準:(1)眼底彩色照相檢查可見RPE、脈絡膜萎縮,伴或不伴視網膜黃白色細小顆粒樣結晶沉積;眼底自身熒光(AF)檢查可見后極部大范圍熒光缺失,萎縮范圍超過后極部,臨床分期為Ⅲ期[3]。(2)基因檢測結果為CYP4V2基因變異。排除標準:(1)存在BCD導致的脈絡膜新生血管病變或其他眼部病變。(2) 治療眼曾接受過PPV、眼周血管搭橋等內眼手術,或在臨床研究過程中需要進行白內障手術、視網膜激光治療等眼內治療者。患眼均行最佳矯正視力(BCVA)、眼壓、裂隙燈顯微鏡、眼底彩色照相、近紅外AF(NIR-AF)、光相干斷層掃描(OCT)檢查。BCVA檢查采用早期治療糖尿病視網膜病變研究組視力表進行。
所有患眼均給予SRI AAV載體轉基因治療,其中病例1~3、4~6 SRI的病毒滴度分別為1.5×1011、3.0×1011 vg/ml。手術由1名具有8年PPV經驗的副主任醫師操作完成。常規手術消毒鋪巾麻醉;25G套管針距角膜緣3.5 mm做2個鞏膜切口,分別置入光纖和38G SRI針。SRI前,15度刀行前房穿刺,引流房水降低眼壓。38G注射針頭連接至1 ml AAV載體注射器,在硅油注入模式下,根據預先設計的視網膜注射部位將注射針頭直接穿刺到近血管弓部視網膜下間隙。設定最大推注壓強為20~25 psi(1 psi=6.89 kPa),通過玻璃體切割機腳踏控制注射速度,緩慢注入基因治療藥物300 μl。SRI開始可觀察到 1個小的泡狀視網膜脫離區,隨注射量增加視網膜隆起高度逐漸增加,泡狀脫離區范圍逐漸擴大(圖1)。注射完畢后針頭停留于注射口約1 min,以減少藥物返流。注射結束時手指觸診進行眼壓評估,若偏高則通過壓角膜切口進行房水引流直至眼壓正常。手術完畢拔出套管。圍手術期未給予口服糖皮質激素;手術后醋酸潑尼松滴眼液滴眼,4次/d,連續7 d 。
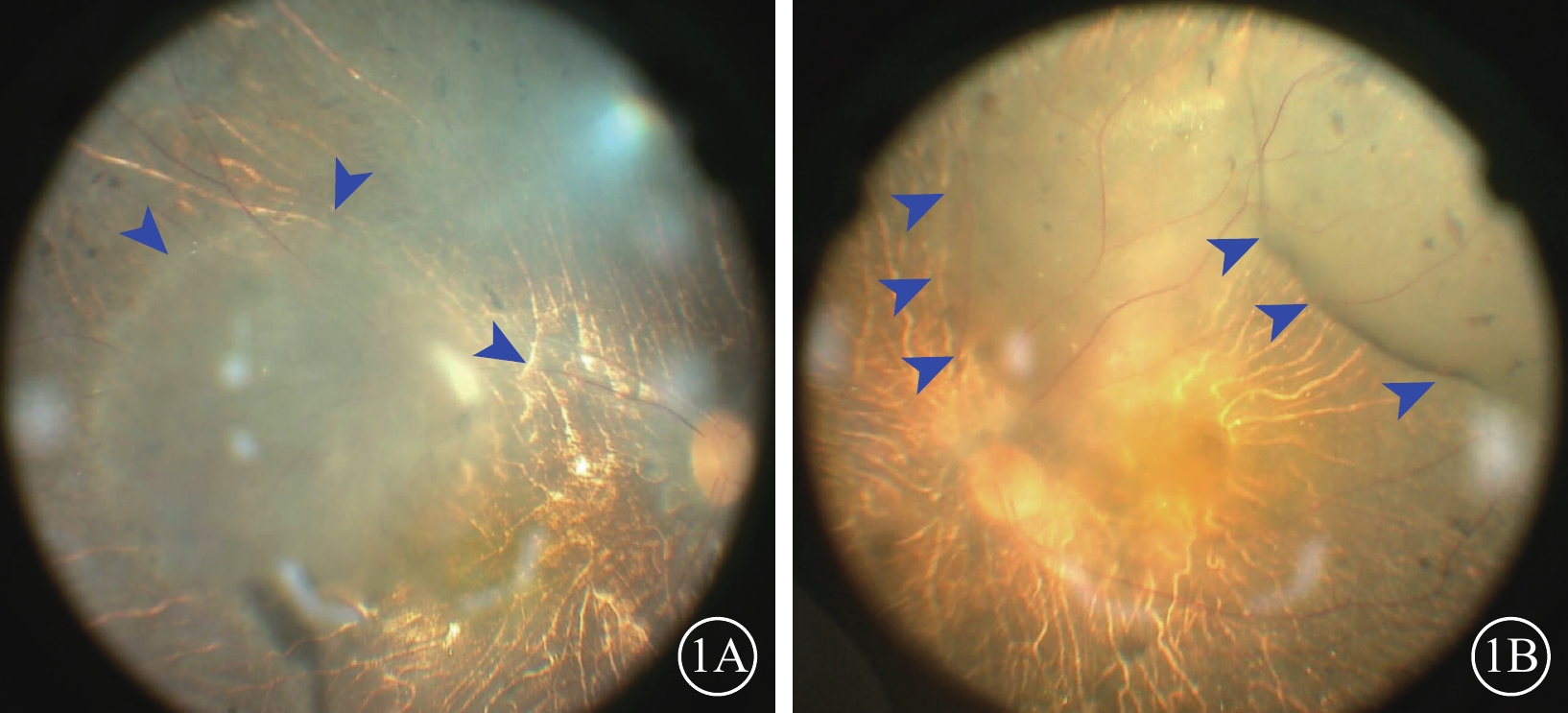
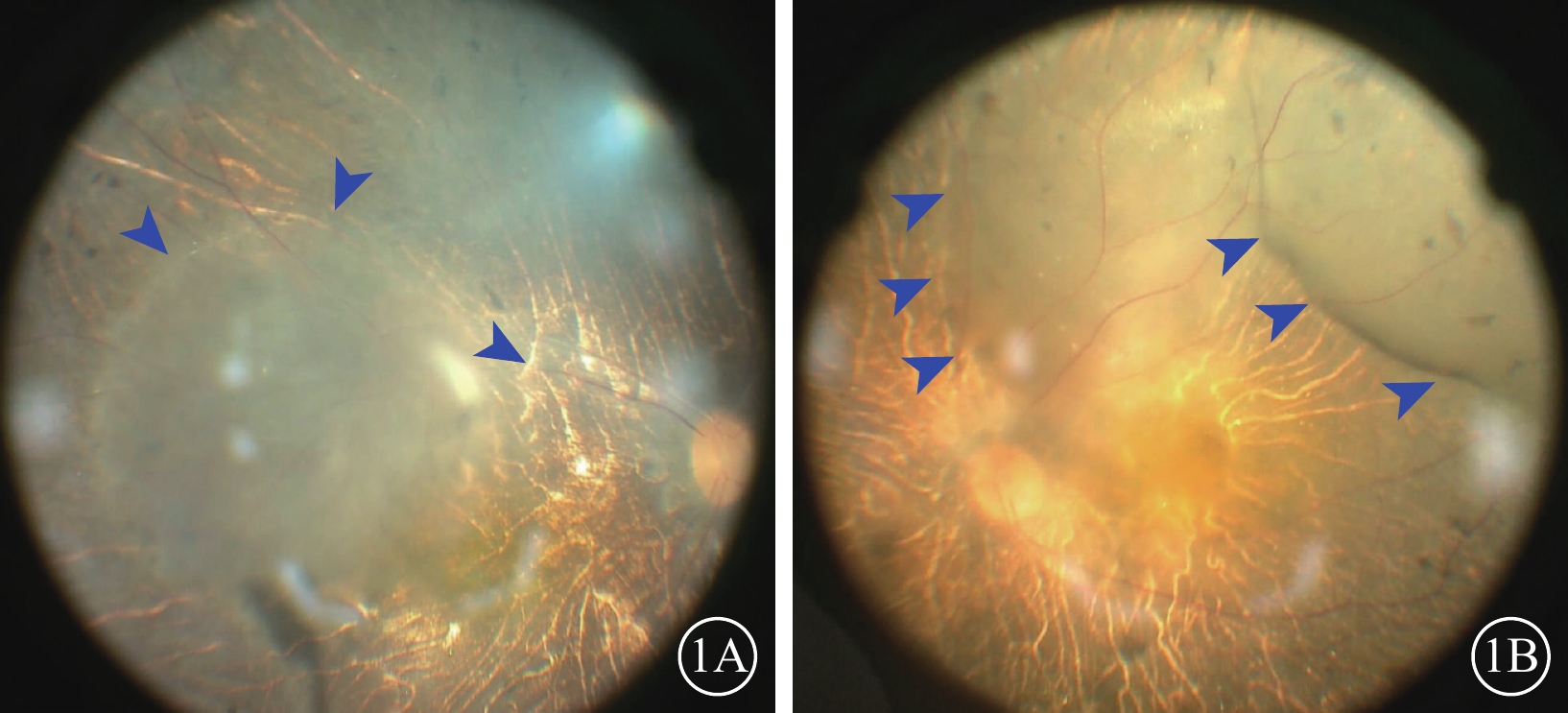 圖1
BCD患眼視網膜下注射手術視頻截圖
圖1
BCD患眼視網膜下注射手術視頻截圖
1A示單個視網膜下隆起泡;1B示2個視網膜下隆起泡融合交通,藍箭頭示氣泡邊界 BCD:Bietti結晶樣視網膜營養不良
治療后隨訪時間9~12個月,其中治療后1個月每周隨訪1次。隨訪時采用治療前相同設備和方法行相關檢查。觀察手術時長、手術中及手術后并發癥、不良事件、手術后6個月BCVA。手術時長定義為制作鞏膜切口至拔出套管的時間。
2 結果
患眼BCVA為手動/眼前~64個字母。眼底可見RPE和脈絡膜萎縮,伴或不伴視網膜黃白色細小顆粒樣結晶沉積。SRI均順利完成;手術時長9~14 min(表1)。手術中未見玻璃體脫垂、視網膜出血或視網膜裂孔。套管針頭無阻塞,拔出未見視網膜脫垂。
手術后24 h,所有患眼視網膜隆起泡完全吸收,視網膜平伏(圖2);手術后1個月,患眼無角膜后沉著,未見前房、玻璃體細胞等炎癥反應;9個月觀察期內,患眼無高眼壓、白內障、黃斑裂孔、視網膜裂孔等并發癥發生。
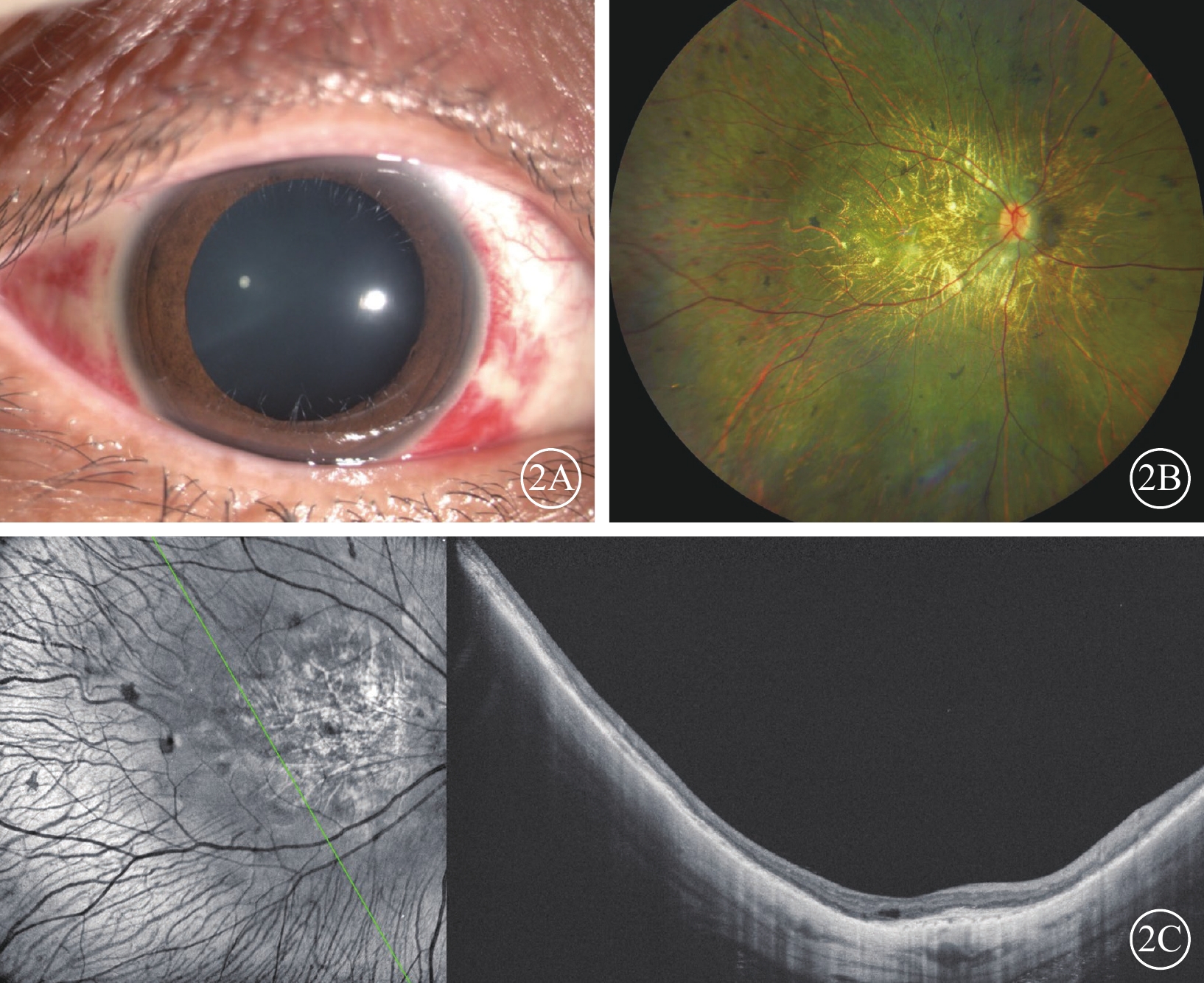
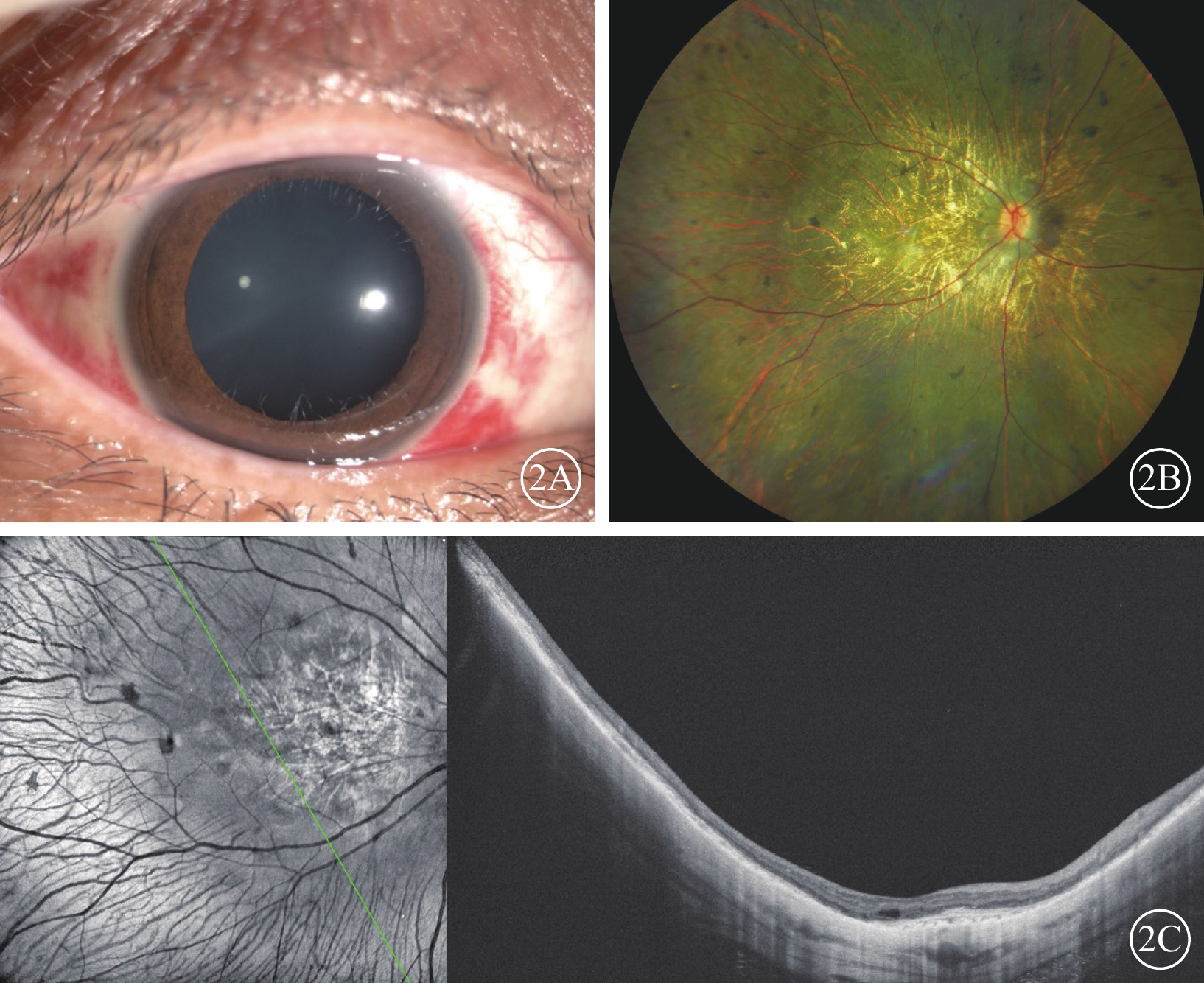 圖2
BCD患眼SRI后24 h眼前節、彩色眼底、NIR-AF聯合OCT像
圖2
BCD患眼SRI后24 h眼前節、彩色眼底、NIR-AF聯合OCT像
2A、2B、2C分別示眼前節、彩色眼底、NIR-AF聯合OCT像。無角膜后沉著,前房、玻璃體未見細胞,視網膜下液吸收,視網膜復位 BCD:Bietti結晶樣視網膜營養不良;SRI:視網膜下注射;NIR-AF:近紅外自身熒光;OCT:光相干斷層掃描
手術后6個月,6只眼中,BCVA手動/眼前者1只眼;BCVA不同程度提高5只眼,提高范圍為2~12個字母(表1)。
3 討論
視網膜下給藥是治療多種視網膜疾病的有效方法,該方法最初于SRI組織纖溶酶原激活劑(tPA)治療黃斑下大出血患眼中取得成功[16]。1991年,Peyman等[16]首次采用標準經平坦部PPV在視網膜上制造小孔,通過小孔進行視網膜下操作,去除4例年齡相關性黃斑變性終末期患者的視網膜下出血和盤狀斑痕,手術完畢時玻璃體腔填充惰性氣體。此種方法一般需先行玻璃體切除,手術完畢時行氣體填充以及手術后保持頭低位。在基因治療臨床試驗中,Russell等[3]在RPE65基因突變相關遺傳性視網膜營養不良基因治療3期臨床試驗中,制定的方案包括PPV、玻璃體后脫離、SRI和氣液交換。干預組患者中位年齡11歲。1年內眼部不良事件包括眼壓升高(4例,20%)、白內障(3例,15%)、視網膜撕裂(2例,10%)、視網膜前膜(1例,5%)和視網膜出血(1例,5%)。Ducloyer等[17]報道1例23歲男性患者在SRI Luxturna后出現黃斑折疊,考慮該并發癥由玻璃體腔氣泡和視網膜下藥物泡之間的沖突所致。切除玻璃體后視網膜下給藥聯合氣液交換和氣體填充是目前SRI主要的手術方法。
未經玻璃體切除的SRI用于轉基因治療尚未見報道。有玻璃體狀態下,眼內器械的操作和移動造成視網膜撕裂的風險可能更高。幾項研究表明,在無玻璃體切除下行眼內操作是安全可行的[18-21]。采用平坦部鞏膜切口置入光纖進行吊頂燈下扣帶手術,未出現視網膜撕裂等并發癥,證明該手術方式有效且安全[18]。對于進展期Coats病青少年患者,有研究采用兩切口平坦部無玻璃體切除,玻璃體腔內激光光凝,未出現視網膜撕裂等并發癥[19]。無論是扣帶手術還是Coats病玻璃體腔激光光凝操作均較SRI簡單。2022年,Wood等[20]在無玻璃體切除下,使用納米玻璃體視網膜下通道裝置行SRI tPA和玻璃體腔空氣填充,成功治療2例黃斑變性伴黃斑下出血患者。余曉等[21]在SRI阿柏西普治療難治性息肉樣脈絡膜血管病變的研究中,采取兩鞏膜切口聯合48G超精微針成功進行SRI。玻璃體阻塞針孔影響藥物進入視網膜下也是手術者的顧慮,本組所有患眼藥物均通過3~4個位置注射順利進入視網膜下腔。本組患者年齡34~60歲,說明該年齡段患者行兩切口無玻璃體切除SRI安全可靠。
目前IRD基因治療引起的相關并發癥除炎癥反應外,還有白內障形成的問題。手術后因內環境變化可在短期或長期形成白內障,兩切口保留玻璃體行SRI可減少玻璃體內環境的變化。目前本組患者隨訪觀察9~12個月,尚未出現白內障,亦未見視網膜撕裂的發生。
本研究結果表明,簡化的兩切口無玻璃體切除SRI方法在BCD基因治療中安全可行、操作簡單,可縮短手術時間,證明了該技術操作的可能性和安全性,對于今后開展經玻璃體入路的SRI技術提供了一個有利的選擇路徑。盡管如此,該技術目前面臨一定的局限性,主要是SRI操作期間難以維持眼壓的持續穩定。針對這一挑戰,當前實踐采取的策略是在SRI前執行前房穿刺以引流房水,預防性降低眼壓,并在手術結束后重新評估,必要時通過壓迫角膜切口進一步引流,確保眼壓維持在正常范圍內。未來的研究重點可能集中于優化SRI手術中的眼壓控制機制,探索更加高效和自動化的眼壓調節方法,以減少手術并發癥并提升患者舒適度。同時,隨著IRD基因治療技術的不斷成熟,深化對不同基因治療載體遞送效率與生物相容性的研究,結合SRI手術技術的精細化發展,將成為拓寬治療范圍、提升治療效果的關鍵。此外,長期跟蹤研究這些患者的治療效果和安全性,以及開發針對更廣泛遺傳性眼病的新型基因療法與手術整合方案,亦是未來研究的重要議題。
視網膜下注射(SRI)是遺傳性視網膜疾病(IRD)基因治療的常用給藥方法[1-5]。該方法可將治療藥物直接注入光感受器和視網膜色素上皮(RPE)層之間的視網膜下空間,精準作用于靶目標區域,提高藥物吸收率和轉染效率;同時視網膜下腔具有一定的免疫豁免性,可以減少局部及全身不良反應[6-10] 。目前,通過SRI完成的轉基因治療均需先完成標準經睫狀體平坦部三切口玻璃體切割手術(PPV)后再行SRI,注射完畢后行氣液交換,患者需保持24 h仰臥位,促進視網膜下藥物吸收和視網膜復位[7, 11-12]。然而,PPV中可能會發生醫源性視網膜裂孔、手術后早發白內障等[3, 13-15]。我國視網膜變性疾病轉基因治療尚處于探索研究或1/2期臨床試驗階段,通常需觀察3~5年。PPV后發生的白內障會干擾基因治療后視功能的長期觀察。我們采用一種簡化替代手術方法,即兩切口無玻璃體切除的SRI治療了一組Bietti結晶樣視網膜營養不良(BCD)患者。現將結果報道如下。
1 對象和方法
探索性臨床研究。本研究遵循《赫爾辛基宣言》原則,獲得廈門大學附屬廈門眼科中心倫理委員會審核(批準號2022-005-05),并于ClinicalTrial.gov登記(NCT-06302608)。患者均簽署書面知情同意書。
2023年2~5月于廈門大學附屬廈門眼科中心臨床和基因檢查確診并接受SRI腺相關病毒(AAV)載體轉基因藥物治療的BCD患者6例6只眼納入本研究。其中,男性2例,女性4例;年齡(43±10)(34~60)歲。納入標準:(1)眼底彩色照相檢查可見RPE、脈絡膜萎縮,伴或不伴視網膜黃白色細小顆粒樣結晶沉積;眼底自身熒光(AF)檢查可見后極部大范圍熒光缺失,萎縮范圍超過后極部,臨床分期為Ⅲ期[3]。(2)基因檢測結果為CYP4V2基因變異。排除標準:(1)存在BCD導致的脈絡膜新生血管病變或其他眼部病變。(2) 治療眼曾接受過PPV、眼周血管搭橋等內眼手術,或在臨床研究過程中需要進行白內障手術、視網膜激光治療等眼內治療者。患眼均行最佳矯正視力(BCVA)、眼壓、裂隙燈顯微鏡、眼底彩色照相、近紅外AF(NIR-AF)、光相干斷層掃描(OCT)檢查。BCVA檢查采用早期治療糖尿病視網膜病變研究組視力表進行。
所有患眼均給予SRI AAV載體轉基因治療,其中病例1~3、4~6 SRI的病毒滴度分別為1.5×1011、3.0×1011 vg/ml。手術由1名具有8年PPV經驗的副主任醫師操作完成。常規手術消毒鋪巾麻醉;25G套管針距角膜緣3.5 mm做2個鞏膜切口,分別置入光纖和38G SRI針。SRI前,15度刀行前房穿刺,引流房水降低眼壓。38G注射針頭連接至1 ml AAV載體注射器,在硅油注入模式下,根據預先設計的視網膜注射部位將注射針頭直接穿刺到近血管弓部視網膜下間隙。設定最大推注壓強為20~25 psi(1 psi=6.89 kPa),通過玻璃體切割機腳踏控制注射速度,緩慢注入基因治療藥物300 μl。SRI開始可觀察到 1個小的泡狀視網膜脫離區,隨注射量增加視網膜隆起高度逐漸增加,泡狀脫離區范圍逐漸擴大(圖1)。注射完畢后針頭停留于注射口約1 min,以減少藥物返流。注射結束時手指觸診進行眼壓評估,若偏高則通過壓角膜切口進行房水引流直至眼壓正常。手術完畢拔出套管。圍手術期未給予口服糖皮質激素;手術后醋酸潑尼松滴眼液滴眼,4次/d,連續7 d 。
 圖1
BCD患眼視網膜下注射手術視頻截圖
圖1
BCD患眼視網膜下注射手術視頻截圖
1A示單個視網膜下隆起泡;1B示2個視網膜下隆起泡融合交通,藍箭頭示氣泡邊界 BCD:Bietti結晶樣視網膜營養不良
治療后隨訪時間9~12個月,其中治療后1個月每周隨訪1次。隨訪時采用治療前相同設備和方法行相關檢查。觀察手術時長、手術中及手術后并發癥、不良事件、手術后6個月BCVA。手術時長定義為制作鞏膜切口至拔出套管的時間。
2 結果
患眼BCVA為手動/眼前~64個字母。眼底可見RPE和脈絡膜萎縮,伴或不伴視網膜黃白色細小顆粒樣結晶沉積。SRI均順利完成;手術時長9~14 min(表1)。手術中未見玻璃體脫垂、視網膜出血或視網膜裂孔。套管針頭無阻塞,拔出未見視網膜脫垂。
手術后24 h,所有患眼視網膜隆起泡完全吸收,視網膜平伏(圖2);手術后1個月,患眼無角膜后沉著,未見前房、玻璃體細胞等炎癥反應;9個月觀察期內,患眼無高眼壓、白內障、黃斑裂孔、視網膜裂孔等并發癥發生。
 圖2
BCD患眼SRI后24 h眼前節、彩色眼底、NIR-AF聯合OCT像
圖2
BCD患眼SRI后24 h眼前節、彩色眼底、NIR-AF聯合OCT像
2A、2B、2C分別示眼前節、彩色眼底、NIR-AF聯合OCT像。無角膜后沉著,前房、玻璃體未見細胞,視網膜下液吸收,視網膜復位 BCD:Bietti結晶樣視網膜營養不良;SRI:視網膜下注射;NIR-AF:近紅外自身熒光;OCT:光相干斷層掃描
手術后6個月,6只眼中,BCVA手動/眼前者1只眼;BCVA不同程度提高5只眼,提高范圍為2~12個字母(表1)。
3 討論
視網膜下給藥是治療多種視網膜疾病的有效方法,該方法最初于SRI組織纖溶酶原激活劑(tPA)治療黃斑下大出血患眼中取得成功[16]。1991年,Peyman等[16]首次采用標準經平坦部PPV在視網膜上制造小孔,通過小孔進行視網膜下操作,去除4例年齡相關性黃斑變性終末期患者的視網膜下出血和盤狀斑痕,手術完畢時玻璃體腔填充惰性氣體。此種方法一般需先行玻璃體切除,手術完畢時行氣體填充以及手術后保持頭低位。在基因治療臨床試驗中,Russell等[3]在RPE65基因突變相關遺傳性視網膜營養不良基因治療3期臨床試驗中,制定的方案包括PPV、玻璃體后脫離、SRI和氣液交換。干預組患者中位年齡11歲。1年內眼部不良事件包括眼壓升高(4例,20%)、白內障(3例,15%)、視網膜撕裂(2例,10%)、視網膜前膜(1例,5%)和視網膜出血(1例,5%)。Ducloyer等[17]報道1例23歲男性患者在SRI Luxturna后出現黃斑折疊,考慮該并發癥由玻璃體腔氣泡和視網膜下藥物泡之間的沖突所致。切除玻璃體后視網膜下給藥聯合氣液交換和氣體填充是目前SRI主要的手術方法。
未經玻璃體切除的SRI用于轉基因治療尚未見報道。有玻璃體狀態下,眼內器械的操作和移動造成視網膜撕裂的風險可能更高。幾項研究表明,在無玻璃體切除下行眼內操作是安全可行的[18-21]。采用平坦部鞏膜切口置入光纖進行吊頂燈下扣帶手術,未出現視網膜撕裂等并發癥,證明該手術方式有效且安全[18]。對于進展期Coats病青少年患者,有研究采用兩切口平坦部無玻璃體切除,玻璃體腔內激光光凝,未出現視網膜撕裂等并發癥[19]。無論是扣帶手術還是Coats病玻璃體腔激光光凝操作均較SRI簡單。2022年,Wood等[20]在無玻璃體切除下,使用納米玻璃體視網膜下通道裝置行SRI tPA和玻璃體腔空氣填充,成功治療2例黃斑變性伴黃斑下出血患者。余曉等[21]在SRI阿柏西普治療難治性息肉樣脈絡膜血管病變的研究中,采取兩鞏膜切口聯合48G超精微針成功進行SRI。玻璃體阻塞針孔影響藥物進入視網膜下也是手術者的顧慮,本組所有患眼藥物均通過3~4個位置注射順利進入視網膜下腔。本組患者年齡34~60歲,說明該年齡段患者行兩切口無玻璃體切除SRI安全可靠。
目前IRD基因治療引起的相關并發癥除炎癥反應外,還有白內障形成的問題。手術后因內環境變化可在短期或長期形成白內障,兩切口保留玻璃體行SRI可減少玻璃體內環境的變化。目前本組患者隨訪觀察9~12個月,尚未出現白內障,亦未見視網膜撕裂的發生。
本研究結果表明,簡化的兩切口無玻璃體切除SRI方法在BCD基因治療中安全可行、操作簡單,可縮短手術時間,證明了該技術操作的可能性和安全性,對于今后開展經玻璃體入路的SRI技術提供了一個有利的選擇路徑。盡管如此,該技術目前面臨一定的局限性,主要是SRI操作期間難以維持眼壓的持續穩定。針對這一挑戰,當前實踐采取的策略是在SRI前執行前房穿刺以引流房水,預防性降低眼壓,并在手術結束后重新評估,必要時通過壓迫角膜切口進一步引流,確保眼壓維持在正常范圍內。未來的研究重點可能集中于優化SRI手術中的眼壓控制機制,探索更加高效和自動化的眼壓調節方法,以減少手術并發癥并提升患者舒適度。同時,隨著IRD基因治療技術的不斷成熟,深化對不同基因治療載體遞送效率與生物相容性的研究,結合SRI手術技術的精細化發展,將成為拓寬治療范圍、提升治療效果的關鍵。此外,長期跟蹤研究這些患者的治療效果和安全性,以及開發針對更廣泛遺傳性眼病的新型基因療法與手術整合方案,亦是未來研究的重要議題。