采用造孔劑方法,制備羥基磷灰石-聚二甲基硅氧烷(HA-PDMS)彈性多孔細胞支架,并將大鼠骨髓間充質干細胞(rBMSCs)接種到材料上,研究細胞的黏附狀態。制備的彈性材料孔隙率可調,調節范圍為62%~76%。采用不同造孔劑(NaCl、石蠟),可制備出不同孔型(方形、圓形)的材料。三維支架孔內壁在SBF溶液中能夠長出羥基磷灰石(HA)晶體,表明其具有良好的生物相容性,且支持rBMSCs的黏附鋪展。
引用本文: 楊楊, 藍鼎, 黃艷, 李延明, 王育人, 孫聯文, 樊瑜波. 羥基磷灰石-聚二甲基硅氧烷彈性多孔細胞支架的制備. 生物醫學工程學雜志, 2014, 31(3): 625-631. doi: 10.7507/1001-5515.20140117 復制
版權信息: ?四川大學華西醫院華西期刊社《生物醫學工程學雜志》版權所有,未經授權不得轉載、改編
引言
生物支架作為組織工程中的重要組成部分,一方面提供細胞成長的支撐環境,另一方面提供細胞新陳代謝的物質交換通道,同時為新生組織提供立足空間。因此,通常要求支架材料具有生物相容性、生物可降解性、可控的孔隙率以及一定的力學性能等。在細胞生物力學領域,目前的研究多是關注細胞在二維基質表面,由于表面特殊拓撲結構或者在外加力學刺激下的生長分化問題[1-6]。而真實的生物體內部,細胞位于一個三維的多孔組織內,其受力環境和組織受力后的物質輸運變化與二維基質有較大的差別。因此,營造一個細胞三維受力環境需要對材料進行特別的制作。這一材料需要滿足如下條件:具有良好的生物相容性和一定的強度,在外力作用下能進行一定范圍的形變,同時物質輸運保持順暢。
目前,制備支架所用的材料包括高分子材料(多糖、水凝膠、熱塑性橡膠等)以及無機活性材料(磷酸鈣、生物玻璃等)[7-12]。為了改善支架材料的力學性能,研究者將高分子材料和無機材料復合,制備力學性能優異的支架材料[13-14]。
羥基磷灰石(hydroxyapatite,HA)是人體骨組織的主要無機成分。人工合成的HA作為一種重要的生物材料在很多方面都有重要的應用,例如與高分子材料復合制備成骨水泥來對骨損傷部位進行修復,也可以制備成多孔支架。聚二甲基硅氧烷(polydimethylsiloxane,PDMS)膜是常用的研究細胞二維受力的基質,具有良好的生物惰性、較大的彈性形變以及良好的可加工性[15-16]。本實驗研究中將PDMS與HA按一定比例復合,通過造孔劑法制備成孔徑均一的彈性多孔細胞支架材料。通過生理溶液灌流實驗研究其生物相容性,并在支架材料中進行了大鼠骨髓間充質干細胞(rat bone marrow derived mesenchymal stem cells,rBMSCs)培養實驗。
1 材料和方法
1.1 材料
PDMS(道康寧184),預聚體與固化劑按照10∶1的質量比混合使用;乙酸乙酯(北京化工廠);HA(國藥集團化學試劑有限公司);NaCl(中鹽工業食鹽);石蠟(河南東洋蠟業有限公司)。不銹鋼模具:模具內徑為6 mm。
1.2 制備
PDMS/HA漿料制備:乙酸乙酯與PDMS混合,PDMS∶乙酸乙酯= 3∶1(質量比)。加入一定量HA后球磨混合5 h。
多孔材料制備:將篩分后的NaCl與PDMS/HA漿料灌入模具中,在80 ℃施加一定壓力(約1.77 MPa)以保證孔的連通性,2 h后固化。將固化后的材料從模具中取出,浸泡于超純水中,超聲處理,每2 h換水一次,NaCl完全溶解后(1~2 d)得到所需的彈性多孔材料。
1.3 支架力學性能表征
壓縮試樣是長度為6 mm、直徑為6 mm的圓柱體,造孔劑為NaCl,在力學性能測試儀上測試其壓縮力學曲線。試樣中HA的含量分別為0%、40%和45%。
1.4 支架孔隙率的測定
測定了支架材料的孔隙率,造孔劑為NaCl,將材料烘干后稱重W0,再放入超純水中浸泡,抽真空,支架內部充滿水后將樣品取出,用濾紙吸干表面水分,稱重W1,V為測量得到的樣品的體積,孔隙率按以下公式計算:
| $p=\frac{{{W}_{1}}-{{W}_{0}}}{v}\times 100%~$ |
1.5 孔型控制
球型造孔劑制備:將40 g固體石蠟和200 mL一定濃度(1%或2%)的明膠溶液置于錐形瓶中,水浴加熱至80 ℃,石蠟變為液態。加熱的過程中攪拌,將液態的石蠟分散為小液滴。等懸浮液穩定以后,快速倒入0 ℃的冰水中淬冷。過濾,烘干,得到固體的石蠟微球。
球形孔材料的制備:將石蠟球置于模具中,堆積加壓,成型后,邊抽真空邊灌入漿料,60 ℃固化3 h。將固化后的材料從模具中取出,浸泡于甲苯溶液中,超聲處理,并定時更換溶液,將石蠟球去除,得到連通孔的多孔彈性材料。
1.6 生理溶液灌流培養實驗
將彈性多孔材料(NaCl造孔劑)放置在灌流器中,進行生理溶液灌流培養。SBF溶液置于37 ℃的恒溫水槽中,在蠕動泵的作用下,溶液在支架材料的連通孔內流動,灌流3 d。圖 1為灌流培養器的裝置圖及樣品放置情況,生理溶液配比[17]按照順序在1 L超純水中依次加入下列物質:NaCl(8.035 g)、NaHCO3(8.035 g)、KCl(0.225 g)、K2HPO4·3H2O(0.231 g)、MgCl2·6H2O(0.311 g)、1.0 mol/L HCl(39 mL)、CaCl2(0.292 g)、Na2SO4(0.072 g)、Tris(6.118 g)、1.0 mol/L HCl(0~5 mL)。
 圖1
灌流培養器裝置
Figure1.
The perfusion culture device
圖1
灌流培養器裝置
Figure1.
The perfusion culture device
1.7 rBMSCs的分離培養
rBMSCs原代培養方法與之前工作類似[18],本實驗把2~4代的rBMSCs接種到上述材料中(造孔劑為NaCl),用含10%血清的DMEM培養基培養,培養時間為3 d,然后用2.5%的戊二醛固定30 min后,梯度脫水,噴金,進行掃描電鏡(scanning electron microscope,SEM)觀察。
2 實驗結果
2.1 造孔劑
圖 2為分篩前后造孔劑NaCl的光學顯微圖像。NaCl為晶體結構,分篩前NaCl的粒徑為50~600 μm不等,經分篩后,造孔劑的粒徑較為均一。
 圖2
分篩前后造孔劑NaCl光學顯微圖像
圖2
分篩前后造孔劑NaCl光學顯微圖像
(a)分篩前;(b)分篩后
Figure2. Optical microscopy images of pore-forming agent NaCl before and after subsieve(a) before subsieve; (b) after subsieve
2.2 支架外觀及力學性能
圖 3為制備的支架材料的外觀及切片,支架的結構完整,直徑為6 mm,支架長度可調,且支架材料為彈性材料,可進行彎曲、拉伸、壓縮等,便于力的施加。
 圖3
支架材料的外觀及切片形貌圖
圖3
支架材料的外觀及切片形貌圖
(a)支架外觀;(b)切片外觀;(c)支架大撓度變形
Figure3. Appearance of the scaffold and the slice(a) appearance of the scaffold; (b) appearance of the slice;(c) scaffold in large deflection deformation
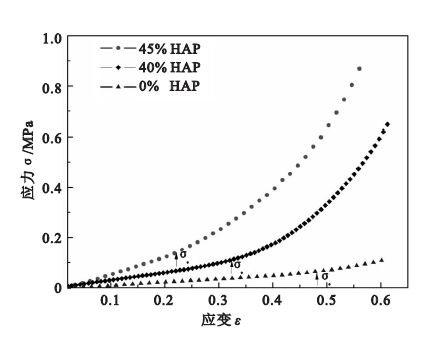
圖 4為支架材料壓縮時的應力應變曲線,三條線對應的支架材料中HA的含量分別為0%、40%和45%。初始的線性階段對應材料的彈性變形,在彈性極限的范圍內,應力與支架的應變成正比。
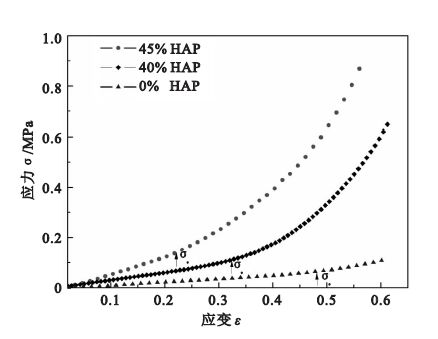 圖4
支架材料的應力應變曲線
Figure4.
Stress-strain curve of the scaffold
圖4
支架材料的應力應變曲線
Figure4.
Stress-strain curve of the scaffold
2.3 多孔材料SEM圖
圖 5為以NaCl為造孔劑制得的多孔材料的剖面SEM掃描圖,孔的形貌取決于造孔劑的形貌。
 圖5
多孔材料SEM掃描圖(造孔劑為不同尺寸NaCl晶體)
Figure5.
Scanning electron microscope (SEM) images of the scaffold cross-section (pore-forming agent:v NaCl crystal)
圖5
多孔材料SEM掃描圖(造孔劑為不同尺寸NaCl晶體)
Figure5.
Scanning electron microscope (SEM) images of the scaffold cross-section (pore-forming agent:v NaCl crystal)
2.4 材料孔隙率
根據造孔劑量的不同,制備所得的多孔支架的孔隙率可達到60%~80%。混合漿料與造孔劑(NaCl)的質量比分別為1∶2、1∶2.5、1∶3、1∶3.5、1∶4時,對應的孔隙率分別為62.30%、66.79%、68.02%、71.04%、76.27%。孔隙的形狀取決于造孔劑的形狀,而孔隙率與造孔劑的含量有關。
2.5 孔型控制
為了改善孔型及連通性,我們利用球型造孔劑石蠟制備了支架材料。
圖 6為經分篩后幾種不同粒徑的石蠟球的光學顯微圖像。制得的石蠟球為規則的球型,且經分篩后,粒徑較為均一。
 圖6
自制石蠟球分篩后的光學顯微圖像
Figure6.
Optical microscopy images of the paraffin spheres
圖6
自制石蠟球分篩后的光學顯微圖像
Figure6.
Optical microscopy images of the paraffin spheres
圖 7為采用石蠟造孔劑制備的多孔支架材料。孔為規則的球型,且孔的連通性較好,連通孔為圓形。
 圖7
多孔材料SEM掃描圖(造孔劑為不同粒徑石蠟球)
圖7
多孔材料SEM掃描圖(造孔劑為不同粒徑石蠟球)
(a)粒徑450~500
(a) 450-500
2.6 生理溶液灌流培養
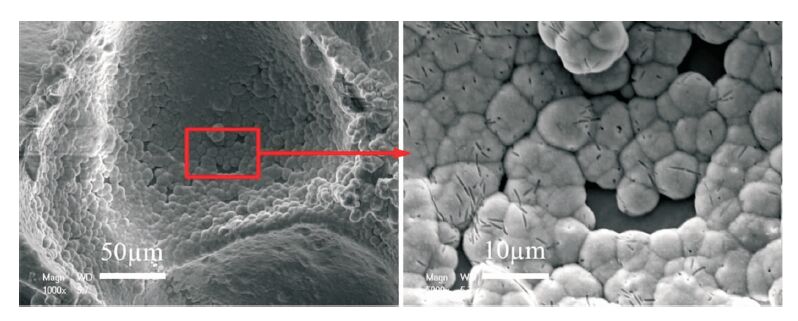
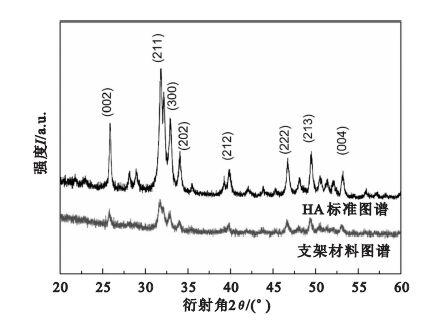
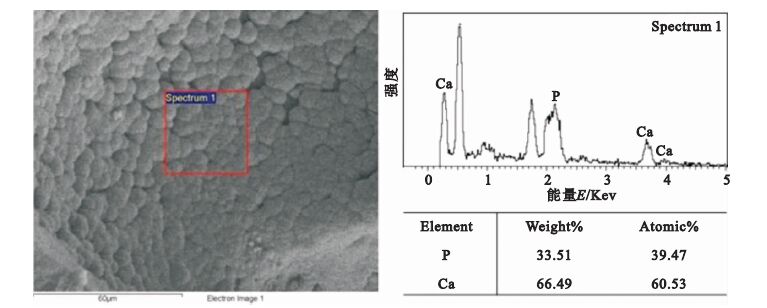
按照上述生理溶液灌流培養的方法,灌流3 d后,孔內壁長滿了島狀晶體,如圖 8所示。圖 9為材料的XRD結果,支架材料的各衍射峰的晶面間距、強度等與HA的標準圖譜一致。圖 10為生長的晶體的EDS圖譜,結果顯示Ca/P為1.53。
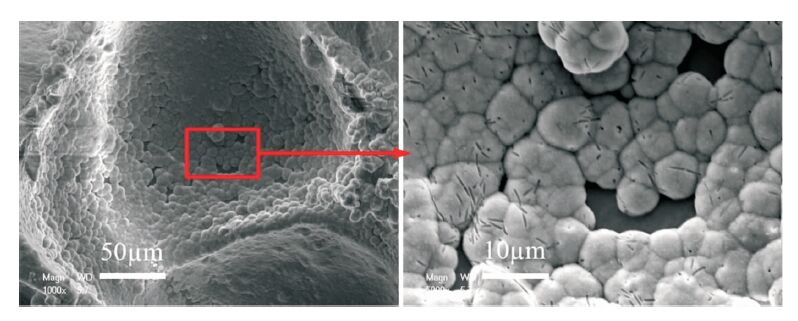 圖8
孔內壁HA生長SEM圖
Figure8.
SEM images of the HA crystals growing on the wall of the hole
圖8
孔內壁HA生長SEM圖
Figure8.
SEM images of the HA crystals growing on the wall of the hole
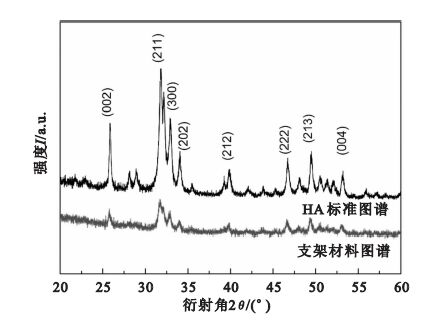 圖9
支架材料XRD圖譜
Figure9.
XRD pattern of the scaffold
圖9
支架材料XRD圖譜
Figure9.
XRD pattern of the scaffold
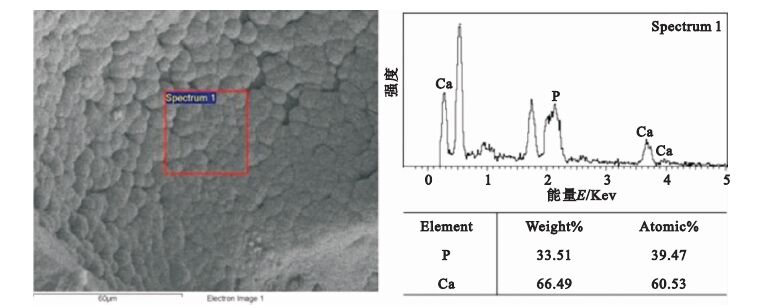 圖10
支架材料孔內壁EDS圖譜
Figure10.
Energy Dispersive Spectroscopy of apatite formed on pore inner wall
圖10
支架材料孔內壁EDS圖譜
Figure10.
Energy Dispersive Spectroscopy of apatite formed on pore inner wall
2.7 rBMSCs的分離培養
圖 11為三維彈性材料內部細胞狀態。材料為PDMS-HA復合材料,孔徑為300 μm。
 圖11
細胞在支架中培養的SEM圖
Figure11.
SEM images of the cell adhesion on the porous scaffold
圖11
細胞在支架中培養的SEM圖
Figure11.
SEM images of the cell adhesion on the porous scaffold
3 討論
細胞與細胞支架之間的相互作用力是影響細胞增殖、分化的重要因素。為研究細胞在各種力學刺激下增殖分化等生物行為,力學性能優異的細胞支架顯得尤為重要。在本文中,所制備的支架材料結構完整,長度可調,具備良好的力學性能,可以進行壓縮、彎曲、拉伸等力學刺激下的細胞培養實驗。如圖 3(c)所示,所制備的支架材料在大撓度變形下仍能恢復,證明其具備良好彈性。為進一步定量研究該類型支架材料在不同HA含量時的力學行為,利用力學性能測試儀進行壓縮實驗予以表征,如圖 4所示。實驗所得三條應力應變曲線對應的支架材料中HA的含量分別為0%、40%和45%。三條應力應變曲線都表現出兩個變形階段:彈性變形段和密實強化段。在彈性極限的范圍內,應力與支架的應變成正比,應力除去時無殘余應變,在應力應變曲線上表現為直線段,該直線斜率代表了材料彈性模量。通過計算彈性段的斜率,可以得到三個試樣的彈性模量分別為0.128、0.336和0.556 MPa,其數量級和高分子材料接近,證明所制備生物支架具有優異的柔度。同時可以看出,所制備支架材料在不含HA時,彈性段應變約為0.5,加入45% HA時,彈性段變形仍可維持在0.2左右,證明該支架材料優異的彈性變形能力。在第二階段變形過程中,由于
孔隙被壓縮,材料變得密實,從曲線上表現不再是直線段,出現密實強化。HA含量為45%的彈性支架擁有最大的彈性模量和彈性極限,而不含HA的彈性支架擁有最大的彈性變形范圍。HA對支架材料有強化作用,隨著HA含量的增多,支架材料強度上升同時喪失了一部分的彈性變形能力,調控支架材料中HA含量,可以得到不同力學性能的支架材料。通過力學性能表征可以看出,本文中所制備的生物支架材料具有優異的彈性變形能力,且可以通過調節HA含量來制備不同力學性能的支架材料,為研究細胞在大變形環境中的生物學行為提供可能。
孔的形態會影響細胞的黏附生長狀態,好的連通性能夠保證在細胞培養過程中生理溶液輸運及細胞代謝廢物的排放等,因此孔隙形態、孔隙率和連通性對于生物支架材料是非常重要的參數。所制備生物支架SEM掃描如圖 5所示,當造孔劑采用NaCl時,由于其結晶結構為方形,孔型取決于造孔劑形狀故為方形。同時由于NaCl變形能力較差,造孔劑堆積多為點接觸,連通性相對較差。為了改進該類型彈性支架材料的孔型及連通性,我們利用球型造孔劑石蠟制備了具有優良連通性和球形孔隙的支架材料(見圖 7)。經實驗發現,孔的連通性取決于粒子間相互作用力,當石蠟球堆積后施加的壓力較大時,連通孔較大。而不施加外力時,孔間的連通性會較差,甚至出現閉孔。因此在制備球形孔三維支架材料過程中,首先要將球形造孔劑石蠟微球放置模具中外加震動,使得粒子之間保持充分接觸;再通過施加外力使得粒子發生變形,粒子間形成面接觸;最后利用負壓進行漿料灌注。對比圖 5和圖 7可以看出,通過改進,利用球形造孔劑石蠟微球制備的生物支架材料具有更好的連通性。
生物相容性是生物支架材料的基本要求之一。為驗證所制備生物支架材料的生物相容性,本文分別進行了生理溶液灌流培養實驗和細胞培養實驗,對形貌和成分分別進行了分析和觀察。XRD結果顯示(見圖 9),支架材料的各衍射峰的晶面間距、強度等與HA的標準圖譜一致,證明支架材料中含有HA。因為生長的晶體較薄,衍射峰的強度并不強,并且包含了復合HA信息。生長晶體的EDS結果(見圖 10)表明Ca/P為1.53,接近HA完整晶體的Ca/P=1.67,從而證明經過培養孔內壁生成的晶體為磷灰石[17]。Ca/P小于1.67也說明生理溶液灌流生長的磷灰石結晶并不完善。支架材料中的成分之一HA為HA晶體的生長提供成核位點,SBF溶液中的Ca2+與PO43-在孔內壁表面沉積,形成HA,表明制備的多孔材料具有良好的生物相容性。在SBF灌流處理以后,孔內壁形成的島狀HA為細胞提供了立足點,利于細胞的黏附生長。
細胞培養實驗結果如圖 11所示,可以看出電鏡下細胞以點狀接觸的模式黏附在支架材料內壁上,形成了具有三維立體結構的生物復合體。細胞在三維支架中的黏附狀態與在二維平面上的黏附明顯不同。二維基質培養時,細胞鋪展在二維平面上。在三維的孔腔里,細胞可以黏附在不同面上,可以呈現一定的立體構型,這表明細胞能夠在此三維彈性支架材料內部較好地黏附,證明了該支架具有良好的生物相容性。PDMS具有高彈性和生物惰性,對細胞無毒害,在細胞生物力學研究中常用作培養基底[15]。在該生物支架制備過程中,采用PDMS與HA等生物活性材料復合的制備工藝,生物活性材料可以改善材料的表面浸潤性,使細胞很好地黏附生長,有利于排除這些表面修飾物質對細胞分化的影響。可以看出,HA的加入在改善材料強度的同時也提高了所制備支架材料的生物相容性。
4 結論
本文將PDMS與HA復合,分別以NaCl與石蠟球為造孔劑制備了不同孔型的三維彈性細胞支架材料。通過壓縮試驗證明該種類支架材料具有優異的彈性變形能力,且可以通過調節HA含量來制備不同力學性能的支架材料。同時,該類生物支架材料孔隙率可調,調節范圍為62%~76%。經SBF溶液灌流,孔內壁HA晶體生長表明材料具有良好的生物相容性。rBMSCs經培養貼附在支架材料三維孔內壁中,未經修飾的支架內壁,細胞仍然可以很好地黏附在三維孔腔內的不同面上,形成了具有三維立體結構的生物復合體,表明細胞能夠在此三維彈性支架材料內部較好地黏附。實驗證明該類生物支架材料具有良好的彈性和生物相容性,同時有利于細胞進行表面黏附等,可以作為研究力學刺激對細胞生物行為影響的三維支架材料。
引言
生物支架作為組織工程中的重要組成部分,一方面提供細胞成長的支撐環境,另一方面提供細胞新陳代謝的物質交換通道,同時為新生組織提供立足空間。因此,通常要求支架材料具有生物相容性、生物可降解性、可控的孔隙率以及一定的力學性能等。在細胞生物力學領域,目前的研究多是關注細胞在二維基質表面,由于表面特殊拓撲結構或者在外加力學刺激下的生長分化問題[1-6]。而真實的生物體內部,細胞位于一個三維的多孔組織內,其受力環境和組織受力后的物質輸運變化與二維基質有較大的差別。因此,營造一個細胞三維受力環境需要對材料進行特別的制作。這一材料需要滿足如下條件:具有良好的生物相容性和一定的強度,在外力作用下能進行一定范圍的形變,同時物質輸運保持順暢。
目前,制備支架所用的材料包括高分子材料(多糖、水凝膠、熱塑性橡膠等)以及無機活性材料(磷酸鈣、生物玻璃等)[7-12]。為了改善支架材料的力學性能,研究者將高分子材料和無機材料復合,制備力學性能優異的支架材料[13-14]。
羥基磷灰石(hydroxyapatite,HA)是人體骨組織的主要無機成分。人工合成的HA作為一種重要的生物材料在很多方面都有重要的應用,例如與高分子材料復合制備成骨水泥來對骨損傷部位進行修復,也可以制備成多孔支架。聚二甲基硅氧烷(polydimethylsiloxane,PDMS)膜是常用的研究細胞二維受力的基質,具有良好的生物惰性、較大的彈性形變以及良好的可加工性[15-16]。本實驗研究中將PDMS與HA按一定比例復合,通過造孔劑法制備成孔徑均一的彈性多孔細胞支架材料。通過生理溶液灌流實驗研究其生物相容性,并在支架材料中進行了大鼠骨髓間充質干細胞(rat bone marrow derived mesenchymal stem cells,rBMSCs)培養實驗。
1 材料和方法
1.1 材料
PDMS(道康寧184),預聚體與固化劑按照10∶1的質量比混合使用;乙酸乙酯(北京化工廠);HA(國藥集團化學試劑有限公司);NaCl(中鹽工業食鹽);石蠟(河南東洋蠟業有限公司)。不銹鋼模具:模具內徑為6 mm。
1.2 制備
PDMS/HA漿料制備:乙酸乙酯與PDMS混合,PDMS∶乙酸乙酯= 3∶1(質量比)。加入一定量HA后球磨混合5 h。
多孔材料制備:將篩分后的NaCl與PDMS/HA漿料灌入模具中,在80 ℃施加一定壓力(約1.77 MPa)以保證孔的連通性,2 h后固化。將固化后的材料從模具中取出,浸泡于超純水中,超聲處理,每2 h換水一次,NaCl完全溶解后(1~2 d)得到所需的彈性多孔材料。
1.3 支架力學性能表征
壓縮試樣是長度為6 mm、直徑為6 mm的圓柱體,造孔劑為NaCl,在力學性能測試儀上測試其壓縮力學曲線。試樣中HA的含量分別為0%、40%和45%。
1.4 支架孔隙率的測定
測定了支架材料的孔隙率,造孔劑為NaCl,將材料烘干后稱重W0,再放入超純水中浸泡,抽真空,支架內部充滿水后將樣品取出,用濾紙吸干表面水分,稱重W1,V為測量得到的樣品的體積,孔隙率按以下公式計算:
| $p=\frac{{{W}_{1}}-{{W}_{0}}}{v}\times 100%~$ |
1.5 孔型控制
球型造孔劑制備:將40 g固體石蠟和200 mL一定濃度(1%或2%)的明膠溶液置于錐形瓶中,水浴加熱至80 ℃,石蠟變為液態。加熱的過程中攪拌,將液態的石蠟分散為小液滴。等懸浮液穩定以后,快速倒入0 ℃的冰水中淬冷。過濾,烘干,得到固體的石蠟微球。
球形孔材料的制備:將石蠟球置于模具中,堆積加壓,成型后,邊抽真空邊灌入漿料,60 ℃固化3 h。將固化后的材料從模具中取出,浸泡于甲苯溶液中,超聲處理,并定時更換溶液,將石蠟球去除,得到連通孔的多孔彈性材料。
1.6 生理溶液灌流培養實驗
將彈性多孔材料(NaCl造孔劑)放置在灌流器中,進行生理溶液灌流培養。SBF溶液置于37 ℃的恒溫水槽中,在蠕動泵的作用下,溶液在支架材料的連通孔內流動,灌流3 d。圖 1為灌流培養器的裝置圖及樣品放置情況,生理溶液配比[17]按照順序在1 L超純水中依次加入下列物質:NaCl(8.035 g)、NaHCO3(8.035 g)、KCl(0.225 g)、K2HPO4·3H2O(0.231 g)、MgCl2·6H2O(0.311 g)、1.0 mol/L HCl(39 mL)、CaCl2(0.292 g)、Na2SO4(0.072 g)、Tris(6.118 g)、1.0 mol/L HCl(0~5 mL)。
 圖1
灌流培養器裝置
Figure1.
The perfusion culture device
圖1
灌流培養器裝置
Figure1.
The perfusion culture device
1.7 rBMSCs的分離培養
rBMSCs原代培養方法與之前工作類似[18],本實驗把2~4代的rBMSCs接種到上述材料中(造孔劑為NaCl),用含10%血清的DMEM培養基培養,培養時間為3 d,然后用2.5%的戊二醛固定30 min后,梯度脫水,噴金,進行掃描電鏡(scanning electron microscope,SEM)觀察。
2 實驗結果
2.1 造孔劑
圖 2為分篩前后造孔劑NaCl的光學顯微圖像。NaCl為晶體結構,分篩前NaCl的粒徑為50~600 μm不等,經分篩后,造孔劑的粒徑較為均一。
 圖2
分篩前后造孔劑NaCl光學顯微圖像
圖2
分篩前后造孔劑NaCl光學顯微圖像
(a)分篩前;(b)分篩后
Figure2. Optical microscopy images of pore-forming agent NaCl before and after subsieve(a) before subsieve; (b) after subsieve
2.2 支架外觀及力學性能
圖 3為制備的支架材料的外觀及切片,支架的結構完整,直徑為6 mm,支架長度可調,且支架材料為彈性材料,可進行彎曲、拉伸、壓縮等,便于力的施加。
 圖3
支架材料的外觀及切片形貌圖
圖3
支架材料的外觀及切片形貌圖
(a)支架外觀;(b)切片外觀;(c)支架大撓度變形
Figure3. Appearance of the scaffold and the slice(a) appearance of the scaffold; (b) appearance of the slice;(c) scaffold in large deflection deformation
圖 4為支架材料壓縮時的應力應變曲線,三條線對應的支架材料中HA的含量分別為0%、40%和45%。初始的線性階段對應材料的彈性變形,在彈性極限的范圍內,應力與支架的應變成正比。
 圖4
支架材料的應力應變曲線
Figure4.
Stress-strain curve of the scaffold
圖4
支架材料的應力應變曲線
Figure4.
Stress-strain curve of the scaffold
2.3 多孔材料SEM圖
圖 5為以NaCl為造孔劑制得的多孔材料的剖面SEM掃描圖,孔的形貌取決于造孔劑的形貌。
 圖5
多孔材料SEM掃描圖(造孔劑為不同尺寸NaCl晶體)
Figure5.
Scanning electron microscope (SEM) images of the scaffold cross-section (pore-forming agent:v NaCl crystal)
圖5
多孔材料SEM掃描圖(造孔劑為不同尺寸NaCl晶體)
Figure5.
Scanning electron microscope (SEM) images of the scaffold cross-section (pore-forming agent:v NaCl crystal)
2.4 材料孔隙率
根據造孔劑量的不同,制備所得的多孔支架的孔隙率可達到60%~80%。混合漿料與造孔劑(NaCl)的質量比分別為1∶2、1∶2.5、1∶3、1∶3.5、1∶4時,對應的孔隙率分別為62.30%、66.79%、68.02%、71.04%、76.27%。孔隙的形狀取決于造孔劑的形狀,而孔隙率與造孔劑的含量有關。
2.5 孔型控制
為了改善孔型及連通性,我們利用球型造孔劑石蠟制備了支架材料。
圖 6為經分篩后幾種不同粒徑的石蠟球的光學顯微圖像。制得的石蠟球為規則的球型,且經分篩后,粒徑較為均一。
 圖6
自制石蠟球分篩后的光學顯微圖像
Figure6.
Optical microscopy images of the paraffin spheres
圖6
自制石蠟球分篩后的光學顯微圖像
Figure6.
Optical microscopy images of the paraffin spheres
圖 7為采用石蠟造孔劑制備的多孔支架材料。孔為規則的球型,且孔的連通性較好,連通孔為圓形。
 圖7
多孔材料SEM掃描圖(造孔劑為不同粒徑石蠟球)
圖7
多孔材料SEM掃描圖(造孔劑為不同粒徑石蠟球)
(a)粒徑450~500
(a) 450-500
2.6 生理溶液灌流培養
按照上述生理溶液灌流培養的方法,灌流3 d后,孔內壁長滿了島狀晶體,如圖 8所示。圖 9為材料的XRD結果,支架材料的各衍射峰的晶面間距、強度等與HA的標準圖譜一致。圖 10為生長的晶體的EDS圖譜,結果顯示Ca/P為1.53。
 圖8
孔內壁HA生長SEM圖
Figure8.
SEM images of the HA crystals growing on the wall of the hole
圖8
孔內壁HA生長SEM圖
Figure8.
SEM images of the HA crystals growing on the wall of the hole
 圖9
支架材料XRD圖譜
Figure9.
XRD pattern of the scaffold
圖9
支架材料XRD圖譜
Figure9.
XRD pattern of the scaffold
 圖10
支架材料孔內壁EDS圖譜
Figure10.
Energy Dispersive Spectroscopy of apatite formed on pore inner wall
圖10
支架材料孔內壁EDS圖譜
Figure10.
Energy Dispersive Spectroscopy of apatite formed on pore inner wall
2.7 rBMSCs的分離培養
圖 11為三維彈性材料內部細胞狀態。材料為PDMS-HA復合材料,孔徑為300 μm。
 圖11
細胞在支架中培養的SEM圖
Figure11.
SEM images of the cell adhesion on the porous scaffold
圖11
細胞在支架中培養的SEM圖
Figure11.
SEM images of the cell adhesion on the porous scaffold
3 討論
細胞與細胞支架之間的相互作用力是影響細胞增殖、分化的重要因素。為研究細胞在各種力學刺激下增殖分化等生物行為,力學性能優異的細胞支架顯得尤為重要。在本文中,所制備的支架材料結構完整,長度可調,具備良好的力學性能,可以進行壓縮、彎曲、拉伸等力學刺激下的細胞培養實驗。如圖 3(c)所示,所制備的支架材料在大撓度變形下仍能恢復,證明其具備良好彈性。為進一步定量研究該類型支架材料在不同HA含量時的力學行為,利用力學性能測試儀進行壓縮實驗予以表征,如圖 4所示。實驗所得三條應力應變曲線對應的支架材料中HA的含量分別為0%、40%和45%。三條應力應變曲線都表現出兩個變形階段:彈性變形段和密實強化段。在彈性極限的范圍內,應力與支架的應變成正比,應力除去時無殘余應變,在應力應變曲線上表現為直線段,該直線斜率代表了材料彈性模量。通過計算彈性段的斜率,可以得到三個試樣的彈性模量分別為0.128、0.336和0.556 MPa,其數量級和高分子材料接近,證明所制備生物支架具有優異的柔度。同時可以看出,所制備支架材料在不含HA時,彈性段應變約為0.5,加入45% HA時,彈性段變形仍可維持在0.2左右,證明該支架材料優異的彈性變形能力。在第二階段變形過程中,由于
孔隙被壓縮,材料變得密實,從曲線上表現不再是直線段,出現密實強化。HA含量為45%的彈性支架擁有最大的彈性模量和彈性極限,而不含HA的彈性支架擁有最大的彈性變形范圍。HA對支架材料有強化作用,隨著HA含量的增多,支架材料強度上升同時喪失了一部分的彈性變形能力,調控支架材料中HA含量,可以得到不同力學性能的支架材料。通過力學性能表征可以看出,本文中所制備的生物支架材料具有優異的彈性變形能力,且可以通過調節HA含量來制備不同力學性能的支架材料,為研究細胞在大變形環境中的生物學行為提供可能。
孔的形態會影響細胞的黏附生長狀態,好的連通性能夠保證在細胞培養過程中生理溶液輸運及細胞代謝廢物的排放等,因此孔隙形態、孔隙率和連通性對于生物支架材料是非常重要的參數。所制備生物支架SEM掃描如圖 5所示,當造孔劑采用NaCl時,由于其結晶結構為方形,孔型取決于造孔劑形狀故為方形。同時由于NaCl變形能力較差,造孔劑堆積多為點接觸,連通性相對較差。為了改進該類型彈性支架材料的孔型及連通性,我們利用球型造孔劑石蠟制備了具有優良連通性和球形孔隙的支架材料(見圖 7)。經實驗發現,孔的連通性取決于粒子間相互作用力,當石蠟球堆積后施加的壓力較大時,連通孔較大。而不施加外力時,孔間的連通性會較差,甚至出現閉孔。因此在制備球形孔三維支架材料過程中,首先要將球形造孔劑石蠟微球放置模具中外加震動,使得粒子之間保持充分接觸;再通過施加外力使得粒子發生變形,粒子間形成面接觸;最后利用負壓進行漿料灌注。對比圖 5和圖 7可以看出,通過改進,利用球形造孔劑石蠟微球制備的生物支架材料具有更好的連通性。
生物相容性是生物支架材料的基本要求之一。為驗證所制備生物支架材料的生物相容性,本文分別進行了生理溶液灌流培養實驗和細胞培養實驗,對形貌和成分分別進行了分析和觀察。XRD結果顯示(見圖 9),支架材料的各衍射峰的晶面間距、強度等與HA的標準圖譜一致,證明支架材料中含有HA。因為生長的晶體較薄,衍射峰的強度并不強,并且包含了復合HA信息。生長晶體的EDS結果(見圖 10)表明Ca/P為1.53,接近HA完整晶體的Ca/P=1.67,從而證明經過培養孔內壁生成的晶體為磷灰石[17]。Ca/P小于1.67也說明生理溶液灌流生長的磷灰石結晶并不完善。支架材料中的成分之一HA為HA晶體的生長提供成核位點,SBF溶液中的Ca2+與PO43-在孔內壁表面沉積,形成HA,表明制備的多孔材料具有良好的生物相容性。在SBF灌流處理以后,孔內壁形成的島狀HA為細胞提供了立足點,利于細胞的黏附生長。
細胞培養實驗結果如圖 11所示,可以看出電鏡下細胞以點狀接觸的模式黏附在支架材料內壁上,形成了具有三維立體結構的生物復合體。細胞在三維支架中的黏附狀態與在二維平面上的黏附明顯不同。二維基質培養時,細胞鋪展在二維平面上。在三維的孔腔里,細胞可以黏附在不同面上,可以呈現一定的立體構型,這表明細胞能夠在此三維彈性支架材料內部較好地黏附,證明了該支架具有良好的生物相容性。PDMS具有高彈性和生物惰性,對細胞無毒害,在細胞生物力學研究中常用作培養基底[15]。在該生物支架制備過程中,采用PDMS與HA等生物活性材料復合的制備工藝,生物活性材料可以改善材料的表面浸潤性,使細胞很好地黏附生長,有利于排除這些表面修飾物質對細胞分化的影響。可以看出,HA的加入在改善材料強度的同時也提高了所制備支架材料的生物相容性。
4 結論
本文將PDMS與HA復合,分別以NaCl與石蠟球為造孔劑制備了不同孔型的三維彈性細胞支架材料。通過壓縮試驗證明該種類支架材料具有優異的彈性變形能力,且可以通過調節HA含量來制備不同力學性能的支架材料。同時,該類生物支架材料孔隙率可調,調節范圍為62%~76%。經SBF溶液灌流,孔內壁HA晶體生長表明材料具有良好的生物相容性。rBMSCs經培養貼附在支架材料三維孔內壁中,未經修飾的支架內壁,細胞仍然可以很好地黏附在三維孔腔內的不同面上,形成了具有三維立體結構的生物復合體,表明細胞能夠在此三維彈性支架材料內部較好地黏附。實驗證明該類生物支架材料具有良好的彈性和生物相容性,同時有利于細胞進行表面黏附等,可以作為研究力學刺激對細胞生物行為影響的三維支架材料。