熱敏性蛋白藥物日益在疾病的預防、診斷和治療方面表現出重要的作用。然而,熱敏藥物的不穩定性給它們的推廣和應用帶來巨大難題。本文擬以氨基酸為干燥活性保護劑研究其對熱敏性胰島蛋白活性結構的保護作用,利用Gromacs軟件和Gromos96(53a6)簡化分子力場,通過REMD分子模擬方法詳細研究了氨基酸對胰島蛋白藥物的干燥活性保護效果。研究結果表明,相對于沒有保護的干燥胰島蛋白樣品,氨基酸的保護有效防止了胰島蛋白在干燥過程中的親疏水表面翻轉。添加氨基酸保護劑后,胰島蛋白不僅三維整體結構得到了很好的保持,而且二級結構改變也很小。由此可見,氨基酸是一種很好的干燥活性保護劑。
引用本文: 李代禧, 翟振, 郭柏松, 劉寶林, 張燕, 余華星, 劉立, 楊春生. 氨基酸對胰島素單體活性結構的干燥保護作用研究. 生物醫學工程學雜志, 2014, 31(4): 822-826. doi: 10.7507/1001-5515.20140154 復制
版權信息: ?四川大學華西醫院華西期刊社《生物醫學工程學雜志》版權所有,未經授權不得轉載、改編
引言
胰島素[1]是由胰島β細胞受內源性或外源性物質如葡萄糖、乳糖、核糖、精氨酸、胰高血糖素等的刺激而分泌的一種蛋白質激素。胰島素是機體內唯一降低血糖的激素。胰島素于1922年開始用于糖尿病患者的臨床治療。從此,胰島素成為糖尿病患者的常規有效治療藥物。糖尿病患者通常每天需注射2~3次胰島素,才能維持自身正常的血糖水平,用藥比較繁瑣。同時,胰島素又是一種熱敏性的蛋白藥物,易于變性失活。這給糖尿病患者帶來一系列的不便。因此,國外早已開展胰島素凍干粉劑的研究,并開發出吸入式[2]和口服式[1]兩種胰島素制劑。但是該藥劑的穩定性和長期有效性還一直存在爭議。
因此,本文擬通過分子模擬方法從微觀結構和理論層面研究胰島素的干燥和結構變性過程,尋求一種安全有效的干燥保護劑來穩定胰島蛋白的活性結構,防止其變性和失活。我們的研究結果表明,氨基酸對胰島蛋白的活性保護符合“水替代學說”,即在干燥末期,失去絕大部分水分子后,氨基酸可以通過氫鍵作用和靜電相互作用,取代水分子,吸附在胰島蛋白表面,限制了胰島蛋白結構的變性,從而保護了其活性結構和生物功能。
1 理論與方法
1.1 理論與方法
本文采用Gromacs軟件包[3]和REMD(Replica-Exchange Molecular Dynamics)[4]分子模擬方法,詳細研究了組成LEA蛋白[5]的66個氨基酸在干燥過程中對胰島蛋白的活性保護作用。其中,胰島蛋白和氨基酸采用Gromos96(53a6)[6]簡化原子力場,水分子采用TIP3P模型[7]。時間步長為2 fs。模擬溫度采用velocity-rescaling方法[8]控制在胰島蛋白的常見保存和使用溫度:280~310 K。范德華分子間相互作用和靜電相互作用的截距分別設為1.4 nm和1.0 nm。為了修正范德華分子間遠程相互作用,鄰近作用半徑設為1.0 ~1.4 nm,每10步重建一次鄰近列表。而靜電相互作用的遠程修正采用Particle Mesh Ewald[9]方法。
首先,進行了1 000步的結構優化;然后,通過LINCS方法限制所有化學鍵的鍵長,利用Maxwell分布方法設置體系中各原子的初始速度。并設定體系溫度為300 K,進行5 ns的預平衡過程;預平衡結束后,再分別在 280、282、284、286、288、290、292、294、296、298、300、302、304、306、308和310 K進行10 ns的平衡過程,從而獲得各對應溫度下的穩定胰島素體系。最后,以各溫度下平衡后的構象為初始構象,再進行50 ns的REMD模擬。以上模擬過程每1 ps采樣1次。體系約在30 ns后達到完全平衡,用最后5 ns的軌跡來進行數據統計和分析。
1.2 模型的建立
為了研究氨基酸對胰島蛋白的干燥保護作用,胰島素采用蛋白質數據庫中的晶體結構(3inc[10])作為初始結構。選用組成LEA蛋白的66個氨基酸作為胰島蛋白的干燥活性保護劑。為了研究胰島蛋白的干燥過程和氨基酸的干燥保護效果,首先建立一系列氨基酸含量不同、水分子數目不同的胰島素體系,并用鈉離子平衡其凈電荷。然后在不同的水分含量下進行具體的模擬計算。各體系的詳細組成如表 1所示。
2 結果與分析
2.1 干燥前后胰島素三維結構的變化
蛋白藥物干燥一般要求水分含量在2%左右。因此,對水分含量在2%左右的所有胰島蛋白樣品的干燥情況進行了重點分析。沒有添加保護劑和添加了一定量的氨基酸保護劑的干燥胰島蛋白樣品的三維結構匯總于圖 1。
 圖1
干燥后的胰島蛋白三維結構的比較
Figure1.
Conformations of insulin with maximal RMSD at three water content levels
圖1
干燥后的胰島蛋白三維結構的比較
Figure1.
Conformations of insulin with maximal RMSD at three water content levels
從圖 1 中的結果可以看出,沒有氨基酸保護的胰島素樣品,干燥后整體結構變化很大,α-螺旋明顯減少,并大部分轉化為無規卷曲或β-扭轉,而且這種變性趨勢隨著干燥程度的增加而增加。添加氨基酸保護劑后,胰島蛋白的三維結構得到了很好的保持。從三種保護情況的結構保持效果來看,干燥后的樣品與原始活性樣品在整體結構和二級結構上沒有非常明顯的區別。這說明利用氨基酸做活性保護劑,即使是在1∶1.29(氨基酸數目之比)的保護情況下,也會表現出良好的干燥保護效果。
2.2 不同干燥率下氨基酸對胰島蛋白的保護效果
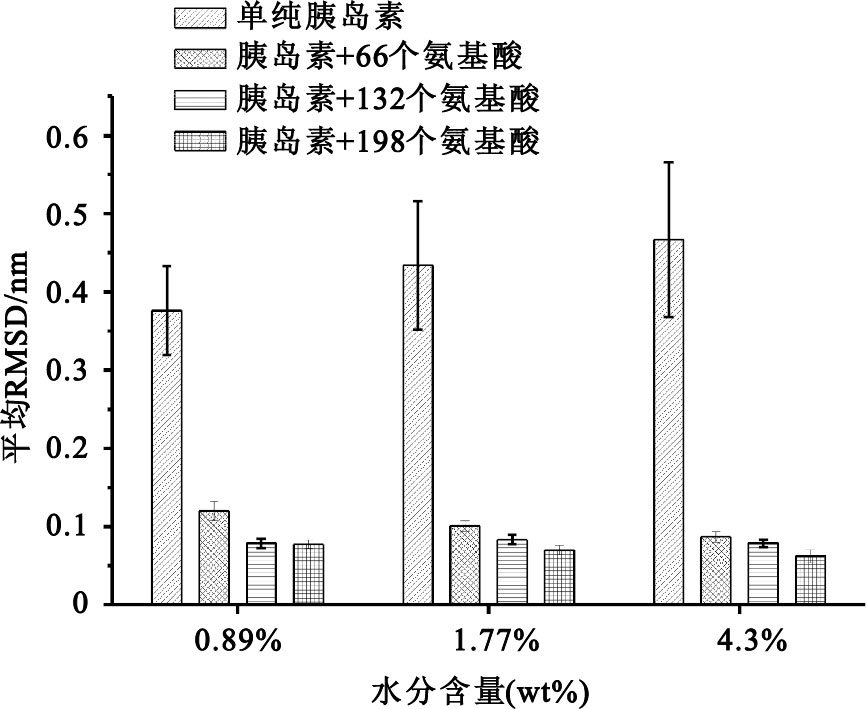
為了分析氨基酸對胰島蛋白的干燥保護效果,我們將干燥率分別為0.89%、1.77%和4.30%的胰島素三維結構的RMSD結果如圖 2所示。從該圖可以看出,不論是添加66個、132個還是198個氨基酸做干燥保護劑,相對于沒有保護劑的胰島蛋白產品,均表現出非常顯著的干燥保護效果。在相同干燥率下,氨基酸的添加量愈大,顯示出對胰島蛋白保護效果愈佳的趨勢。隨干燥程度的增加,不同劑量的氨基酸對胰島素蛋白的保護效果趨于接近,特別是水分含量僅為0.89%時,添加132個氨基酸和添加198個氨基酸對胰島素蛋白的干燥保護效果基本一致。
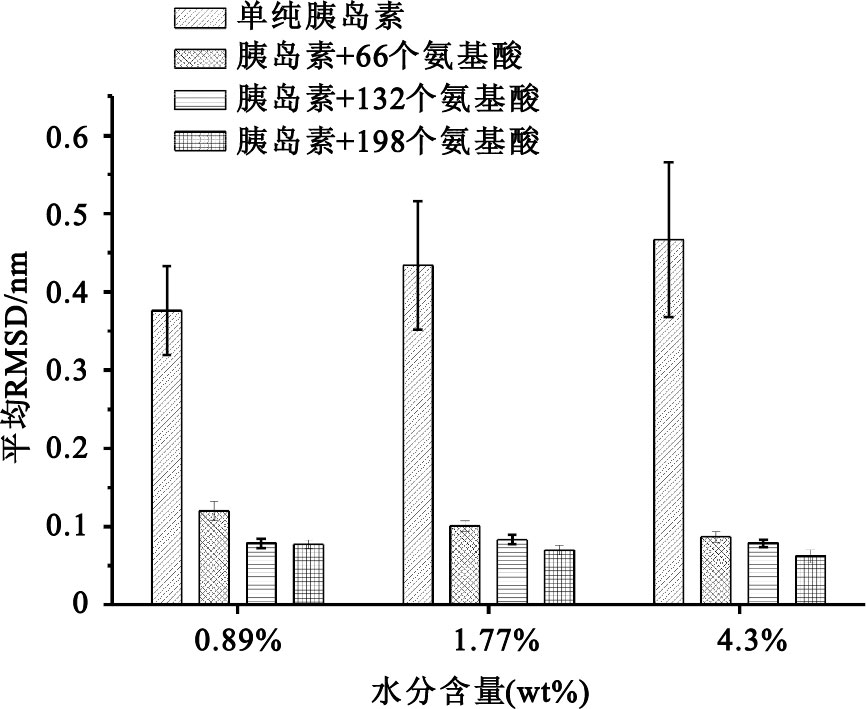 圖2
干燥率在0.89%、1.77%和4.30%條件下,氨基酸對胰島蛋白的干燥保護效果
Figure2.
RMSD histograms of insulin with/without amino acids at water contents as 0.89%,1.77% and 4.30%,respectively
圖2
干燥率在0.89%、1.77%和4.30%條件下,氨基酸對胰島蛋白的干燥保護效果
Figure2.
RMSD histograms of insulin with/without amino acids at water contents as 0.89%,1.77% and 4.30%,respectively
2.3 不同干燥率下胰島蛋白親疏水面積的變化
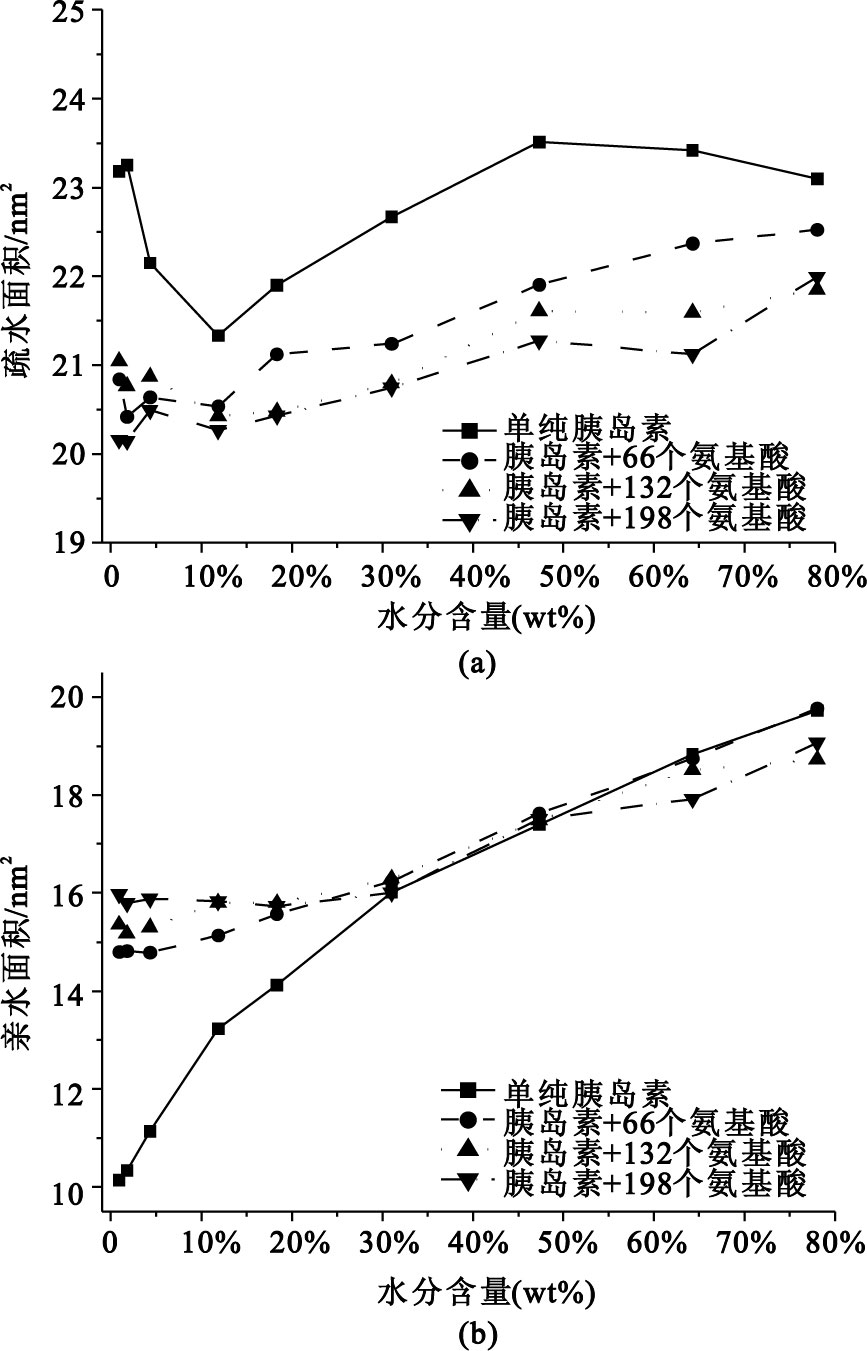
從圖 3可以看出,干燥過程前期(水分變化區間為78.07%~31.01%),不論是胰島素的疏水面積還是親水面積,均隨水分含量的減少而減小。這說明胰島蛋白的體積隨干燥程度的增加而收縮。當干燥到水分含量10%以下時,沒有保護劑的胰島素蛋白的疏水面積迅速增大[見圖 3(a)],同時親水面積迅速減小[見圖 3(b)]。該結果說明干燥過程中,隨胰島蛋白表面溶劑環境的轉變,胰島蛋白內部的疏水氨基酸外翻,整體結構開始發生實質性的變化或變性,從而導致疏水面積明顯增大,親水面積明顯減小。相反,有氨基酸保護的胰島素,其親水面積在干燥到水分含量約30%時,基本趨于恒定;且不同劑量的氨基酸在干燥過程中對胰島蛋白疏親水面積的影響是基本相當的。同樣,氨基酸保護劑對胰島蛋白疏水面積的翻轉也有明顯的抑制。添加氨基酸保護劑后,胰島蛋白疏水面積在干燥到水分含量20%以后稍有波動,但變化遠沒有參照體系大。由此可見,氨基酸對胰島蛋白的干燥表現出了良好的活性保護作用。
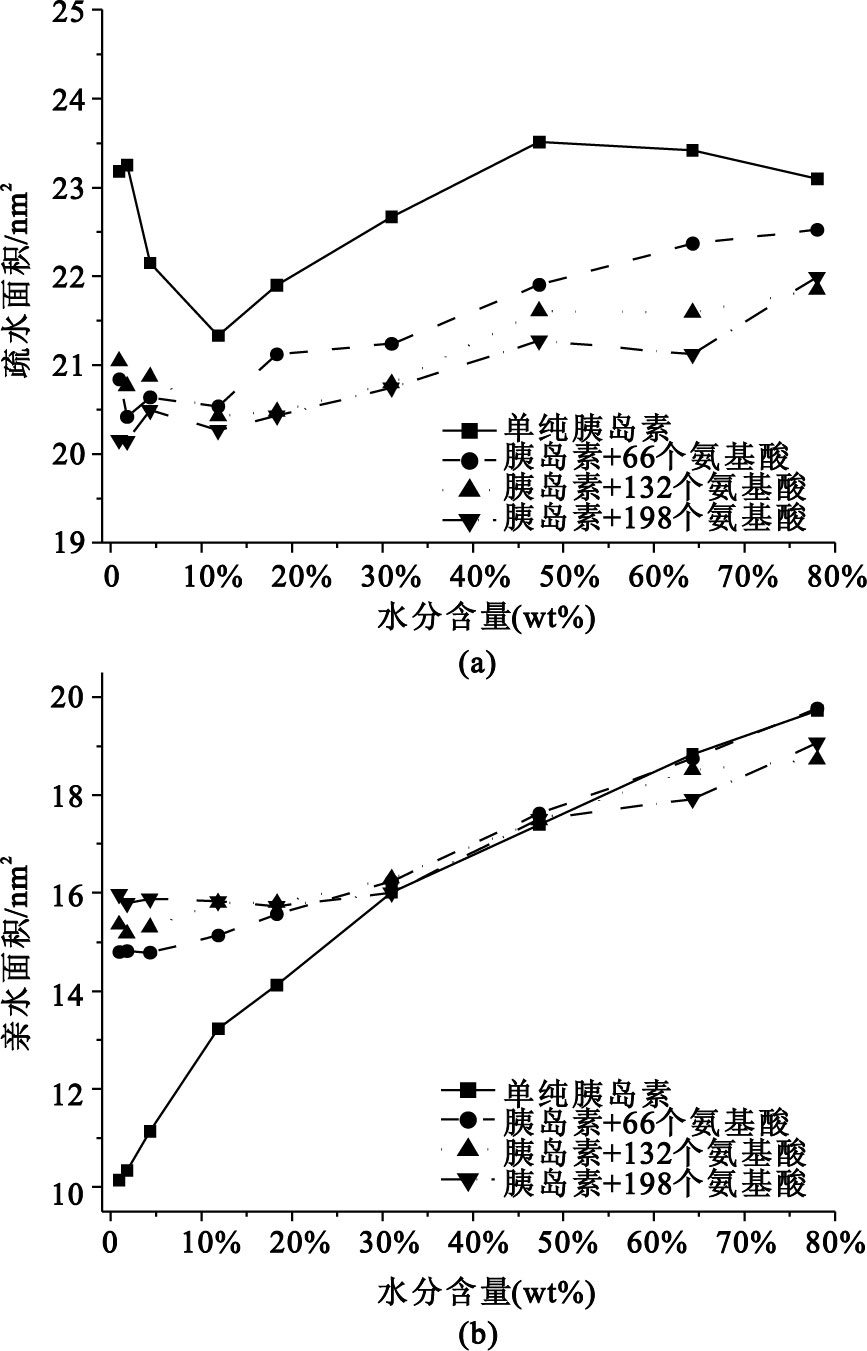 圖3
胰島蛋白干燥過程中分子表面的變化曲線
圖3
胰島蛋白干燥過程中分子表面的變化曲線
(a)胰島蛋白的疏水面積;(b)胰島蛋白的親水面積
Figure3. Alteration of surface area of insulin during desiccation(a) hydrophobic area of insulin; (b) hydrophilic area of insulin
2.4 不同干燥率下氫鍵相互作用的變化
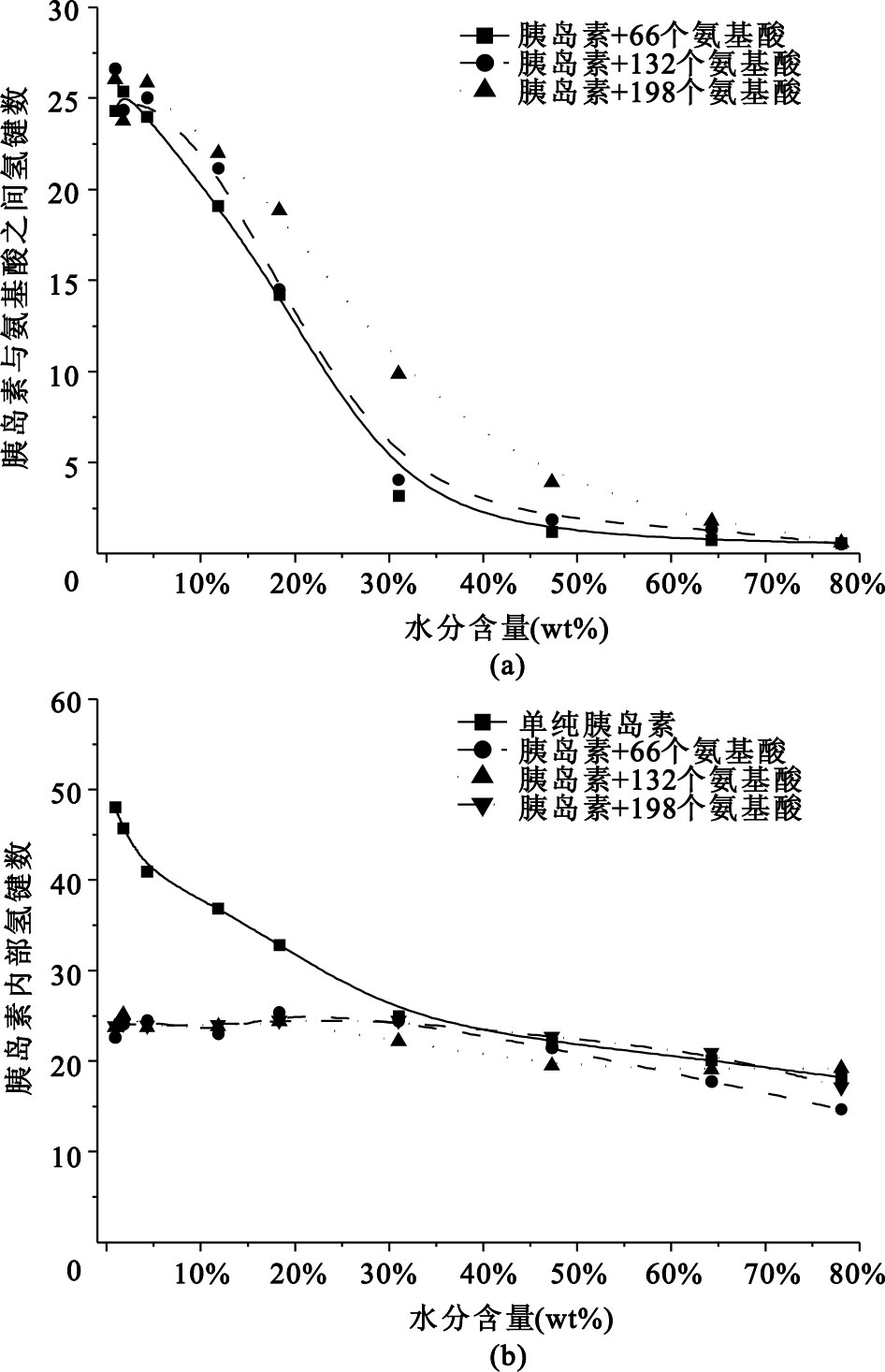
保護劑對蛋白藥物的保護作用主要是通過分子間相互作用實現的。其中,氫鍵是主要的分子間相互作用。胰島蛋白和氨基酸保護劑之間以及胰島蛋白內部的氫鍵相互作用如圖 4所示。
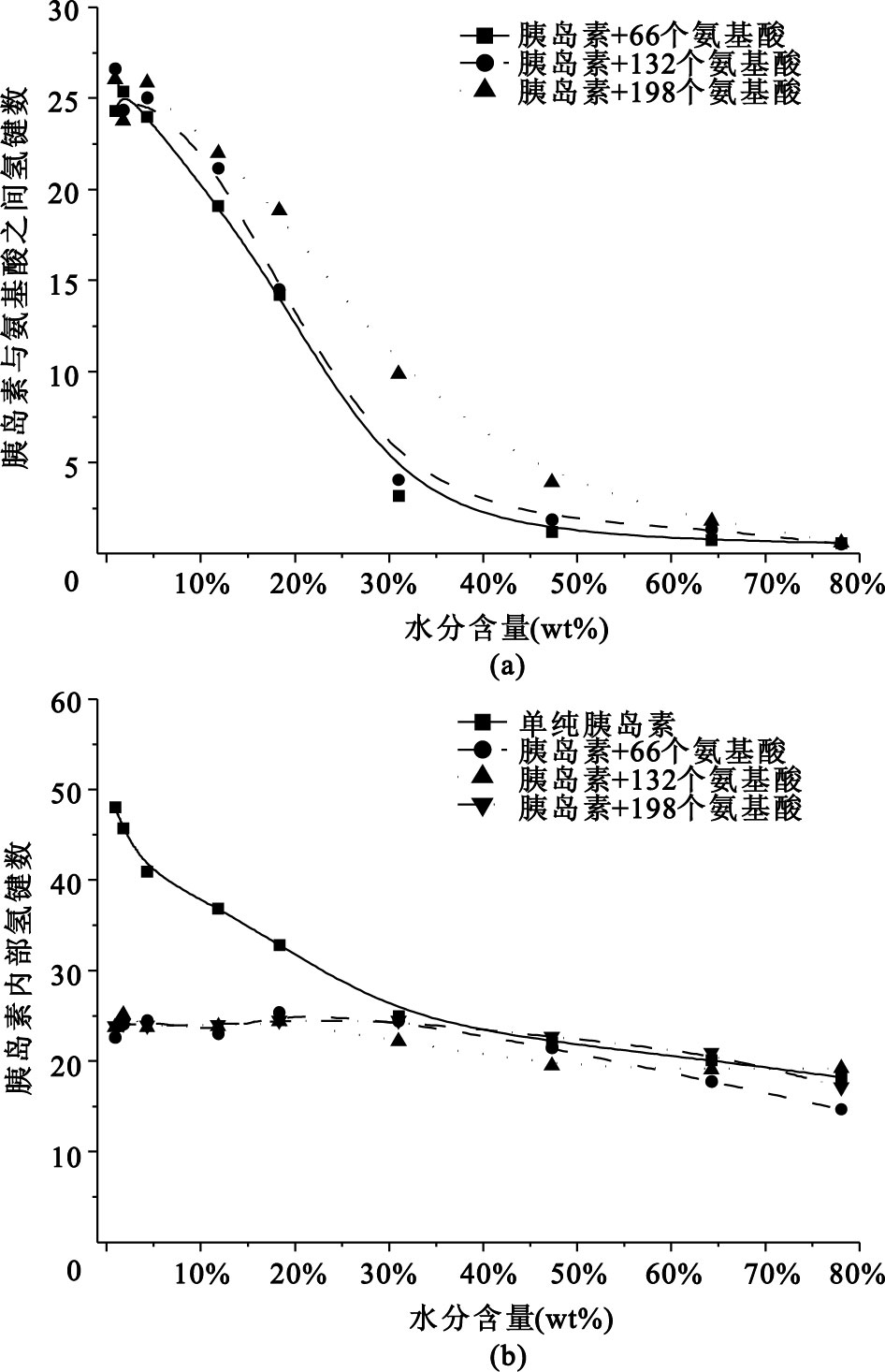 圖4
胰島蛋白干燥過程中體系內氫鍵數目的變化曲線
圖4
胰島蛋白干燥過程中體系內氫鍵數目的變化曲線
(a)胰島素和氨基酸之間的分子間氫鍵;(b)胰島素內部主鏈上的分子內氫鍵
Figure4. Alteration of intermolecular and intramolecular H-bonding numbers during desiccation(a) intermolecular H-bonding numbers between insulin and amino acids; (b) intramolecular H-bonding numbers on the main chain of insulin
從圖 4可以看出,干燥前期,氨基酸與胰島蛋白之間的氫鍵作用很小;干燥末期,氨基酸與胰島蛋白之間的氫鍵作用比胰島蛋白分子內的氫鍵作用大,并且氨基酸保護劑吸附在胰島素分子表面對保持胰島蛋白內部的氫鍵作用起到了很好的保護效果。除氫鍵作用外,氨基酸作為兩性分子,與胰島素之間的強靜電相互作用也具有實質性的保護效果。結合RMSD的分析結果:不同添加量的氨基酸保護劑在干燥到水分含量30%以后的保護效果幾乎沒有明顯差異,說明只要氨基酸保護劑能把胰島素分子完全包埋,就能起到良好的干燥保護效果。
以上結果說明水分含量較大時,氨基酸是完全溶解在水中的,與蛋白藥物的相互作用非常小;隨干燥過程中水分子的逐漸減少,氨基酸分子才慢慢吸附到胰島素分子的表面,替代水分子,形成新的親水環境,進而與胰島素分子結合,抑制了干燥末期胰島蛋白的親疏水表面翻轉和結構的改變,展現了良好的保護效果。這現象與“水替代假說”[11]非常一致。
3 結論
本文利用分子模擬方法詳細研究了氨基酸對胰島蛋白藥物的干燥活性保護效果。研究結果表明,相對于沒有保護的干燥胰島蛋白樣品,氨基酸的保護有效防止了胰島蛋白在干燥過程中的親疏水表面翻轉,并且很少量的氨基酸保護劑即可達到良好保護效果。添加氨基酸保護劑后,胰島蛋白不僅整體三維結構得到了很好的保持,而且二級結構改變也很小。氨基酸對胰島素蛋白的干燥保護機制支持和驗證了“水替代假說”。由此可見,氨基酸是一種很好的干燥活性保護劑。
引言
胰島素[1]是由胰島β細胞受內源性或外源性物質如葡萄糖、乳糖、核糖、精氨酸、胰高血糖素等的刺激而分泌的一種蛋白質激素。胰島素是機體內唯一降低血糖的激素。胰島素于1922年開始用于糖尿病患者的臨床治療。從此,胰島素成為糖尿病患者的常規有效治療藥物。糖尿病患者通常每天需注射2~3次胰島素,才能維持自身正常的血糖水平,用藥比較繁瑣。同時,胰島素又是一種熱敏性的蛋白藥物,易于變性失活。這給糖尿病患者帶來一系列的不便。因此,國外早已開展胰島素凍干粉劑的研究,并開發出吸入式[2]和口服式[1]兩種胰島素制劑。但是該藥劑的穩定性和長期有效性還一直存在爭議。
因此,本文擬通過分子模擬方法從微觀結構和理論層面研究胰島素的干燥和結構變性過程,尋求一種安全有效的干燥保護劑來穩定胰島蛋白的活性結構,防止其變性和失活。我們的研究結果表明,氨基酸對胰島蛋白的活性保護符合“水替代學說”,即在干燥末期,失去絕大部分水分子后,氨基酸可以通過氫鍵作用和靜電相互作用,取代水分子,吸附在胰島蛋白表面,限制了胰島蛋白結構的變性,從而保護了其活性結構和生物功能。
1 理論與方法
1.1 理論與方法
本文采用Gromacs軟件包[3]和REMD(Replica-Exchange Molecular Dynamics)[4]分子模擬方法,詳細研究了組成LEA蛋白[5]的66個氨基酸在干燥過程中對胰島蛋白的活性保護作用。其中,胰島蛋白和氨基酸采用Gromos96(53a6)[6]簡化原子力場,水分子采用TIP3P模型[7]。時間步長為2 fs。模擬溫度采用velocity-rescaling方法[8]控制在胰島蛋白的常見保存和使用溫度:280~310 K。范德華分子間相互作用和靜電相互作用的截距分別設為1.4 nm和1.0 nm。為了修正范德華分子間遠程相互作用,鄰近作用半徑設為1.0 ~1.4 nm,每10步重建一次鄰近列表。而靜電相互作用的遠程修正采用Particle Mesh Ewald[9]方法。
首先,進行了1 000步的結構優化;然后,通過LINCS方法限制所有化學鍵的鍵長,利用Maxwell分布方法設置體系中各原子的初始速度。并設定體系溫度為300 K,進行5 ns的預平衡過程;預平衡結束后,再分別在 280、282、284、286、288、290、292、294、296、298、300、302、304、306、308和310 K進行10 ns的平衡過程,從而獲得各對應溫度下的穩定胰島素體系。最后,以各溫度下平衡后的構象為初始構象,再進行50 ns的REMD模擬。以上模擬過程每1 ps采樣1次。體系約在30 ns后達到完全平衡,用最后5 ns的軌跡來進行數據統計和分析。
1.2 模型的建立
為了研究氨基酸對胰島蛋白的干燥保護作用,胰島素采用蛋白質數據庫中的晶體結構(3inc[10])作為初始結構。選用組成LEA蛋白的66個氨基酸作為胰島蛋白的干燥活性保護劑。為了研究胰島蛋白的干燥過程和氨基酸的干燥保護效果,首先建立一系列氨基酸含量不同、水分子數目不同的胰島素體系,并用鈉離子平衡其凈電荷。然后在不同的水分含量下進行具體的模擬計算。各體系的詳細組成如表 1所示。
2 結果與分析
2.1 干燥前后胰島素三維結構的變化
蛋白藥物干燥一般要求水分含量在2%左右。因此,對水分含量在2%左右的所有胰島蛋白樣品的干燥情況進行了重點分析。沒有添加保護劑和添加了一定量的氨基酸保護劑的干燥胰島蛋白樣品的三維結構匯總于圖 1。
 圖1
干燥后的胰島蛋白三維結構的比較
Figure1.
Conformations of insulin with maximal RMSD at three water content levels
圖1
干燥后的胰島蛋白三維結構的比較
Figure1.
Conformations of insulin with maximal RMSD at three water content levels
從圖 1 中的結果可以看出,沒有氨基酸保護的胰島素樣品,干燥后整體結構變化很大,α-螺旋明顯減少,并大部分轉化為無規卷曲或β-扭轉,而且這種變性趨勢隨著干燥程度的增加而增加。添加氨基酸保護劑后,胰島蛋白的三維結構得到了很好的保持。從三種保護情況的結構保持效果來看,干燥后的樣品與原始活性樣品在整體結構和二級結構上沒有非常明顯的區別。這說明利用氨基酸做活性保護劑,即使是在1∶1.29(氨基酸數目之比)的保護情況下,也會表現出良好的干燥保護效果。
2.2 不同干燥率下氨基酸對胰島蛋白的保護效果
為了分析氨基酸對胰島蛋白的干燥保護效果,我們將干燥率分別為0.89%、1.77%和4.30%的胰島素三維結構的RMSD結果如圖 2所示。從該圖可以看出,不論是添加66個、132個還是198個氨基酸做干燥保護劑,相對于沒有保護劑的胰島蛋白產品,均表現出非常顯著的干燥保護效果。在相同干燥率下,氨基酸的添加量愈大,顯示出對胰島蛋白保護效果愈佳的趨勢。隨干燥程度的增加,不同劑量的氨基酸對胰島素蛋白的保護效果趨于接近,特別是水分含量僅為0.89%時,添加132個氨基酸和添加198個氨基酸對胰島素蛋白的干燥保護效果基本一致。
 圖2
干燥率在0.89%、1.77%和4.30%條件下,氨基酸對胰島蛋白的干燥保護效果
Figure2.
RMSD histograms of insulin with/without amino acids at water contents as 0.89%,1.77% and 4.30%,respectively
圖2
干燥率在0.89%、1.77%和4.30%條件下,氨基酸對胰島蛋白的干燥保護效果
Figure2.
RMSD histograms of insulin with/without amino acids at water contents as 0.89%,1.77% and 4.30%,respectively
2.3 不同干燥率下胰島蛋白親疏水面積的變化
從圖 3可以看出,干燥過程前期(水分變化區間為78.07%~31.01%),不論是胰島素的疏水面積還是親水面積,均隨水分含量的減少而減小。這說明胰島蛋白的體積隨干燥程度的增加而收縮。當干燥到水分含量10%以下時,沒有保護劑的胰島素蛋白的疏水面積迅速增大[見圖 3(a)],同時親水面積迅速減小[見圖 3(b)]。該結果說明干燥過程中,隨胰島蛋白表面溶劑環境的轉變,胰島蛋白內部的疏水氨基酸外翻,整體結構開始發生實質性的變化或變性,從而導致疏水面積明顯增大,親水面積明顯減小。相反,有氨基酸保護的胰島素,其親水面積在干燥到水分含量約30%時,基本趨于恒定;且不同劑量的氨基酸在干燥過程中對胰島蛋白疏親水面積的影響是基本相當的。同樣,氨基酸保護劑對胰島蛋白疏水面積的翻轉也有明顯的抑制。添加氨基酸保護劑后,胰島蛋白疏水面積在干燥到水分含量20%以后稍有波動,但變化遠沒有參照體系大。由此可見,氨基酸對胰島蛋白的干燥表現出了良好的活性保護作用。
 圖3
胰島蛋白干燥過程中分子表面的變化曲線
圖3
胰島蛋白干燥過程中分子表面的變化曲線
(a)胰島蛋白的疏水面積;(b)胰島蛋白的親水面積
Figure3. Alteration of surface area of insulin during desiccation(a) hydrophobic area of insulin; (b) hydrophilic area of insulin
2.4 不同干燥率下氫鍵相互作用的變化
保護劑對蛋白藥物的保護作用主要是通過分子間相互作用實現的。其中,氫鍵是主要的分子間相互作用。胰島蛋白和氨基酸保護劑之間以及胰島蛋白內部的氫鍵相互作用如圖 4所示。
 圖4
胰島蛋白干燥過程中體系內氫鍵數目的變化曲線
圖4
胰島蛋白干燥過程中體系內氫鍵數目的變化曲線
(a)胰島素和氨基酸之間的分子間氫鍵;(b)胰島素內部主鏈上的分子內氫鍵
Figure4. Alteration of intermolecular and intramolecular H-bonding numbers during desiccation(a) intermolecular H-bonding numbers between insulin and amino acids; (b) intramolecular H-bonding numbers on the main chain of insulin
從圖 4可以看出,干燥前期,氨基酸與胰島蛋白之間的氫鍵作用很小;干燥末期,氨基酸與胰島蛋白之間的氫鍵作用比胰島蛋白分子內的氫鍵作用大,并且氨基酸保護劑吸附在胰島素分子表面對保持胰島蛋白內部的氫鍵作用起到了很好的保護效果。除氫鍵作用外,氨基酸作為兩性分子,與胰島素之間的強靜電相互作用也具有實質性的保護效果。結合RMSD的分析結果:不同添加量的氨基酸保護劑在干燥到水分含量30%以后的保護效果幾乎沒有明顯差異,說明只要氨基酸保護劑能把胰島素分子完全包埋,就能起到良好的干燥保護效果。
以上結果說明水分含量較大時,氨基酸是完全溶解在水中的,與蛋白藥物的相互作用非常小;隨干燥過程中水分子的逐漸減少,氨基酸分子才慢慢吸附到胰島素分子的表面,替代水分子,形成新的親水環境,進而與胰島素分子結合,抑制了干燥末期胰島蛋白的親疏水表面翻轉和結構的改變,展現了良好的保護效果。這現象與“水替代假說”[11]非常一致。
3 結論
本文利用分子模擬方法詳細研究了氨基酸對胰島蛋白藥物的干燥活性保護效果。研究結果表明,相對于沒有保護的干燥胰島蛋白樣品,氨基酸的保護有效防止了胰島蛋白在干燥過程中的親疏水表面翻轉,并且很少量的氨基酸保護劑即可達到良好保護效果。添加氨基酸保護劑后,胰島蛋白不僅整體三維結構得到了很好的保持,而且二級結構改變也很小。氨基酸對胰島素蛋白的干燥保護機制支持和驗證了“水替代假說”。由此可見,氨基酸是一種很好的干燥活性保護劑。