本文的目的是分析脾靜脈血栓(SVT)對肝門靜脈系統血流動力學參數的影響。根據某肝門靜脈高壓癥患者的CT圖像和商業軟件MIMICS重建了其真實的肝門靜脈系統模型, 采用彩色多普勒超聲法測出了肝門靜脈系統內的血流速度, 作為模擬的入口邊界條件, 應用計算流體力學(CFD)方法模擬了肝門靜脈系統內血流動力學參數的變化并分析了對生理過程的影響。結果顯示:SVT會對肝門靜脈系統的血流動力學參數造成嚴重影響, 血液流經SVT時壓強降低、流速和壁面剪切力增加, 血液流動的阻力增加, 門靜脈主干內血流速度減緩、壓力梯度減小、壁面剪切力的分布更加均勻。SVT會導致對肝臟的供血能力下降, 在血栓的周圍和門靜脈主干內形成新血栓的可能性增加。
引用本文: 周洪煜, 公丕運, 杜學森, 王萌. 脾靜脈血栓對血流動力學影響的分析及計算流體力學模擬. 生物醫學工程學雜志, 2015, 32(1): 43-47. doi: 10.7507/1001-5515.20150008 復制
版權信息: ?四川大學華西醫院華西期刊社《生物醫學工程學雜志》版權所有,未經授權不得轉載、改編
引言
脾切除斷流術是治療肝門靜脈高壓癥的有效手術方式,但肝門靜脈系統血栓(portal venous system thrombosis,PVST)是門靜脈高壓癥脾切除斷流術的主要并發癥之一[1]。PVST蔓延到門靜脈主干及腸系膜上靜脈可引起腸壞死而危及生命[2]。PVST中發生最多的是脾靜脈血栓(splenic vein thrombosis,SVT),Ikeda等[3]通過術后磁共振檢查發現,脾切除斷流手術后PVST的發生率高達55%, 且所有血栓形成的患者均患有SVT。
血栓的形成與血液的流動特性密切相關,研究發現血栓形成的三大危險因素為血流緩慢、血管內膜損傷和血流異常[4]。在門靜脈高壓脾切除斷流術后三大危險因素均存在[5],脾切除術后減少了脾靜脈血液的回流量,脾靜脈呈一盲端,血液流動緩慢易形成SVT。另外手術導致局部的血管內膜損傷,膠原纖維暴露激活凝血系統,從而易促進血栓形成。臨床統計發現脾切除斷流術后,PVST最多見于脾靜脈[6]。SVT形成后會導致肝門靜脈系統的血流動力學參數發生變化,而這些變化又可能產生生理和病理上的影響。
目前,對于血栓的研究主要是以臨床治療和護理的方法為主,極少采用計算流體力學(computational fluid dynamics,CFD)方法[7]。CFD能夠幫助我們分析與血栓形成密切相關的血流動力學參數的變化,為探索血栓的發病機制和形成過程提供了一種新的方法,計算結果也可用于指導血栓的預防和治療[8]。由于壓強、壁面剪切力等血流動力學參數無法通過測量的方法直接得到,利用測得的血流速度作為邊界條件,應用CFD方法可以對血流動力學參數進行計算。
為了分析SVT對肝門靜脈系統血流動力學參數的影響,我們根據某肝門靜脈高壓癥患者的CT圖像,應用商業軟件MIMICS重建了患者SVT形成前后真實的肝門靜脈系統仿真模型。然后采用彩色多普勒超聲法測出了患者肝門靜脈系統內的血流速度,以作為模擬的入口邊界條件。最后用CFD方法分別模擬出了SVT形成前后肝門靜脈系統中血流速度、壓強和壁面剪切力等血流動力學參數的變化情況,并分析了對生理過程的影響。
1 材料與方法
1.1 肝門靜脈系統模型重建
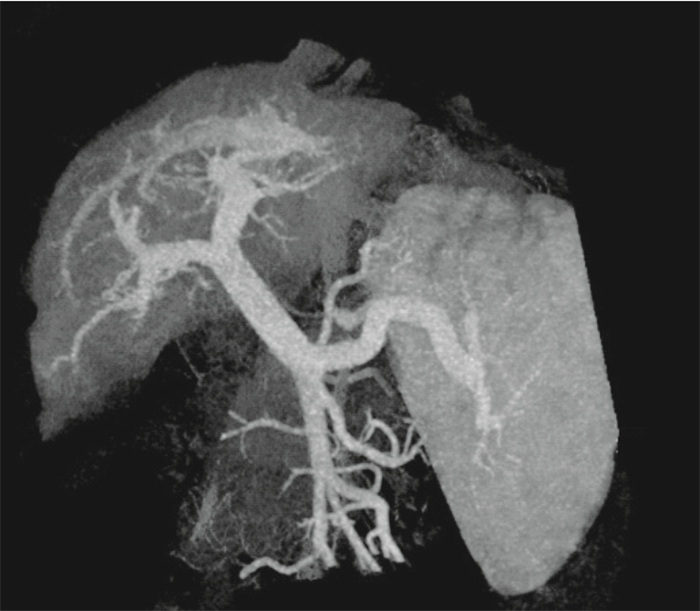
研究某肝門靜脈高壓癥患者的CT圖像,該患者因肝硬化導致肝門靜脈高壓癥并伴有食管胃底靜脈曲張,經臨床診斷決定采用脾切除加斷流的方法降低門靜脈高壓。圖像的空間分辨率為0.879 mm×0.879 mm×0.625 mm,如圖 1所示,是一張典型的肝門靜脈系統的CT圖像。
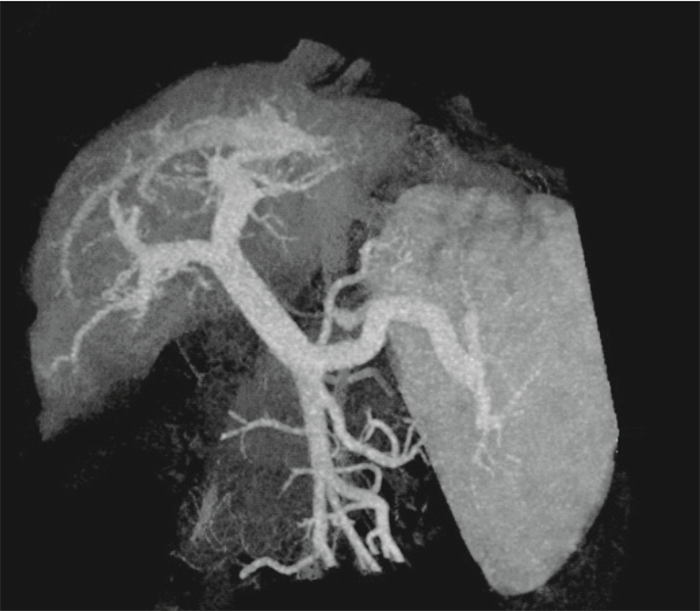 圖1
肝門靜脈系統的CT圖像
Figure1.
CT image of portal venous system
圖1
肝門靜脈系統的CT圖像
Figure1.
CT image of portal venous system
利用商業軟件MIMICS,從CT圖像中分隔出患者的肝門靜脈系統并建立3D模型,然后對模型表面進行網格劃分。在MIMICS的有限元分析模塊中,利用網格重新劃分功能對有限元分析的輸入數據進行最大限度的優化,最后將重建模型的面網格導入生成計算網格的軟件ANSYS ICEM中進行體網格的生成、優化并進行邊界條件的設定。該建模方法已經被證明在病理學上進行詳細的3D微循環檢查方面是一個很好的方法。
1.2 肝門靜脈系統血流速度的超聲波檢測
采用ATL公司HDI-3500型彩色多普勒超聲系統測量血液的流速,探頭頻率為3.75 MHz。HDI-3500系統是一個易于使用且圖像質量出色,彩色多普勒性能和灰階分辨率都不錯的超聲系統,能為肝門靜脈系統提供準確的診斷信息。對肝門靜脈系統內的血流速度重復進行了5次測量,將測得的主要血管內的血流速度匯總于表 1。
1.3 控制方程和數值計算方法
當前的模擬中用到的控制方程包括連續性方程和動量方程。
連續性方程:
| $ \nabla \cdot \boldsymbol{U}=0 $ |
動量方程:
| $ \frac{\partial \boldsymbol{U}}{\partial t}+\nabla \cdot \left(\boldsymbol{U}\otimes \boldsymbol{U} \right)=-\nabla p+\mu {{\nabla }^{2}}\boldsymbol{U} $ |
其中向量U=(u, v, w),為血流速度,p為血液的壓力,μ為血液的黏度。
根據以上公式,應用商業軟件ANSYS CFX-14.5,在離散化的控制體內對血流動力學參數進行了計算。首先,將在ANSYS ICEM中生成體網格的模型導入到ANSYS CFX-14.5的前處理軟件中進行邊界條件、流體屬性等的設置,然后用求解器進行求解計算,最后利用后處理功能顯示計算所得的結果。
已證明在大的肝門靜脈分支中血液的非牛頓性影響很小[9],為了簡化計算,在模擬中血液被設定為牛頓型流體,計算模型選用層流模型。在入口邊界條件的設定中,以流速作為入口邊界條件,流速的大小為所測得的數值(見表 1)。血液的密度和黏度分別為1 050 kg/m3和0.004 5 kg/(m·s)。出口定義為自由流出口邊界條件,這是由于相比于脈動的肝動脈,在肝門靜脈連續流動的系統中單位距離內的壓降很小。壁面設置為無滑移固體壁面邊界條件,因為血液的流動是穩定的,不會引起血管較大的變形。迭代誤差設置為10-8。
2 結果與分析
2.1 重建的肝門靜脈系統模型
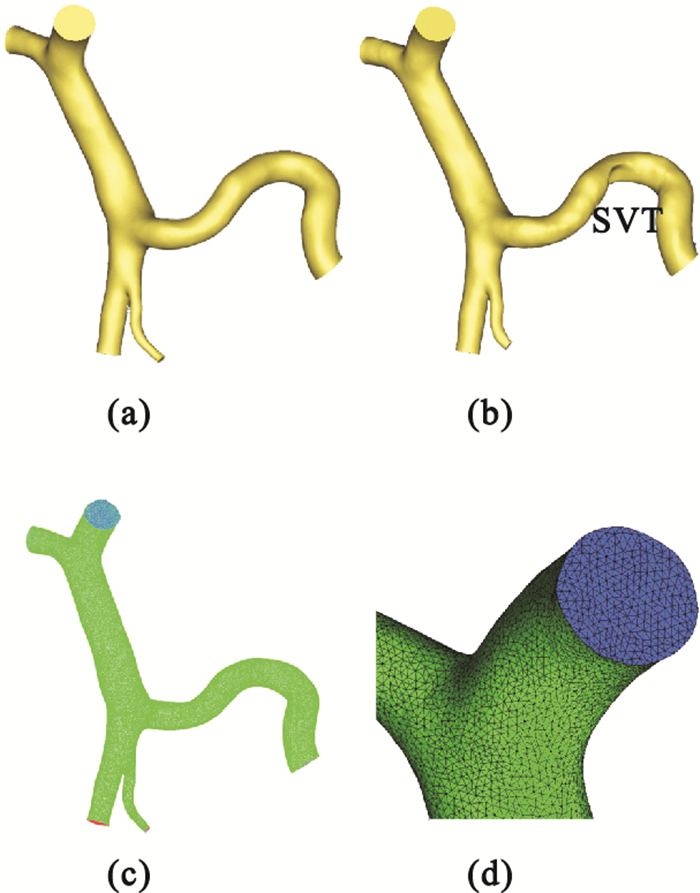
重建的肝門靜脈系統3D模型如圖 2所示。圖 2(a)、(b)分別顯示的是SVT形成前后的肝門靜脈系統模型,其中,SVT是在原有模型的基礎上創建的理想模型。劃分完體網格并定義好邊界條件后的結構如圖 2(c)、(d)所示。
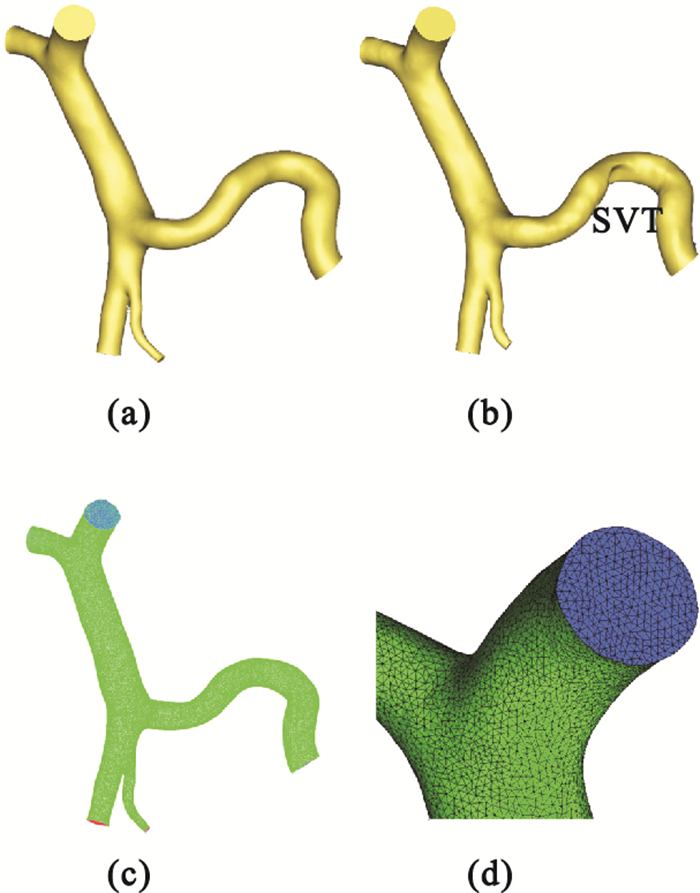 圖2
肝門靜脈系統及劃分完網格后的仿真模型
圖2
肝門靜脈系統及劃分完網格后的仿真模型
(a)SVT形成前;(b)SVT形成后;(c)肝門靜脈系統網格;(d)局部放大圖
Figure2. Simulation model and computational grid of hepatic portal vein system(a) pre-SVT; (b) post-SVT; (c) grid of hepatic portal vein system; (d) drawing of partial enlargement
模擬的目的是研究SVT對肝門靜脈系統中大血管內血流動力學參數的影響,細小血管對仿真結果準確性的影響很小,因此,在建模過程中舍棄了肝門靜脈系統的一些細小分支。
2.2 仿真結果
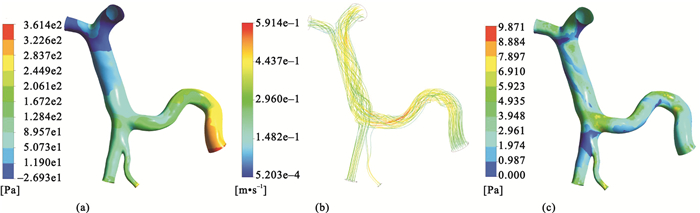
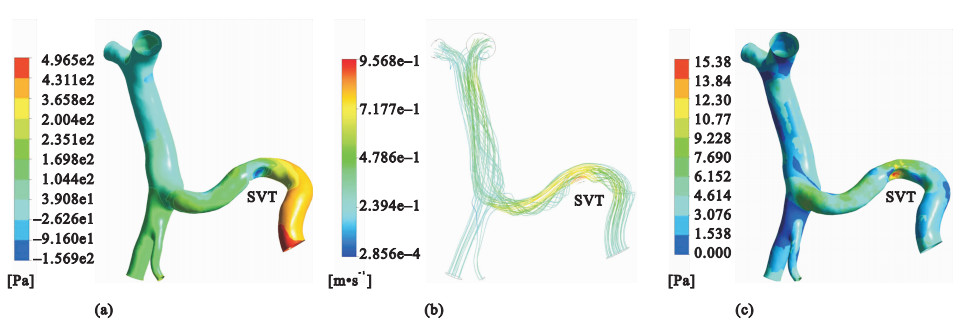
對仿真模型的求解結果包括一系列的流體力學參數,如壓強、流速及壁面剪切力等,將仿真結果中的流速與用彩色多普勒超聲法測得的速度進行對比,二者在不同血管處均基本保持一致,說明仿真結果與實際情況相符。仿真結果如圖 3和圖 4所示。
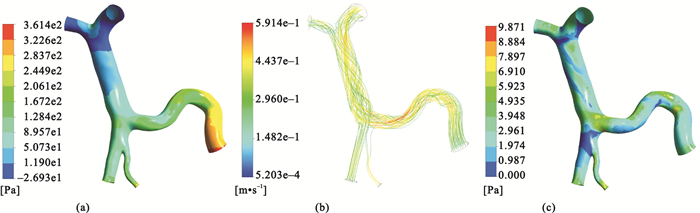 圖3
SVT形成前的仿真結果
圖3
SVT形成前的仿真結果
(a)壓強的分布云圖;(b)流線的分布圖;(c)壁面剪切力的分布云圖
Figure3. Simulation results of pre-SVT(a) contours of pressure; (b) velocity streamlines; (c) wall shear stress
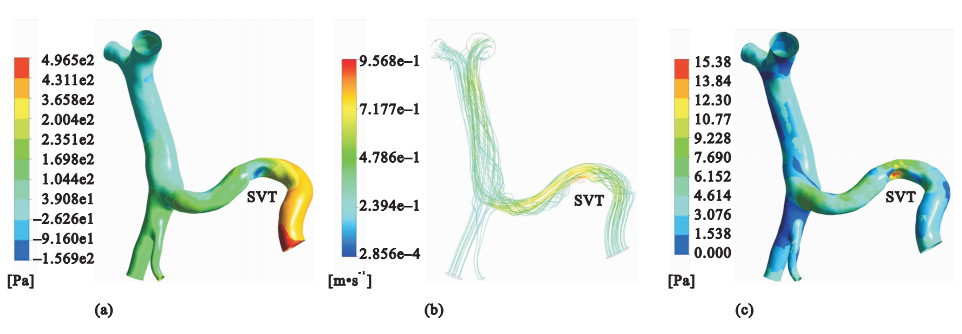 圖4
SVT形成后的仿真結果
圖4
SVT形成后的仿真結果
(a)壓強的分布云圖;(b)流線的分布圖;(c)壁面剪切力的分布云圖
Figure4. Simulation results of post-SVT(a) contours of pressure; (b) velocity streamlines; (c) contours of wall shear stress
圖 3(a)和圖 4(a)分別顯示的是SVT形成前后肝門靜脈系統壓強的分布,血液流經血栓時會導致壓強降低,之后隨著流動截面積的增加壓強又升高。SVT存在時,肝門靜脈主干上壓強的分布更加均勻,壓力梯度減小。圖 3(b)和圖 4(b)分別顯示的是SVT形成前后流線的分布,當血液流經血栓時,隨著流動截面積的突然減小,血流速度會突然增大, 之后隨著流動截面積的增加,流速又隨著降低。當血液流經血栓時,在血栓的表面會存在一層很薄的邊界層,而邊界層會在流動中的某一位置脫離血栓的表面,在下游形成一個低壓的尾渦區,導致血栓上下游的壓強分布不對稱,于是物體就將受到一個沿流動方向的阻力。另外,在血栓表面還存在沿流動方向的黏性應力,黏性應力的合力也是沿流動方向的阻力。因此,SVT的存在會導致血液流動過程中阻力增加。仿真結果顯示,SVT存在時肝門靜脈主干內的血液流速低于正常情況。圖 3(c)和圖 4(c)分別顯示的是SVT形成前后壁面剪切力的分布,在血栓處,壁面剪切力突然增大,SVT存在時,肝門靜脈主干上壁面剪切力的分布也變得更加均勻。
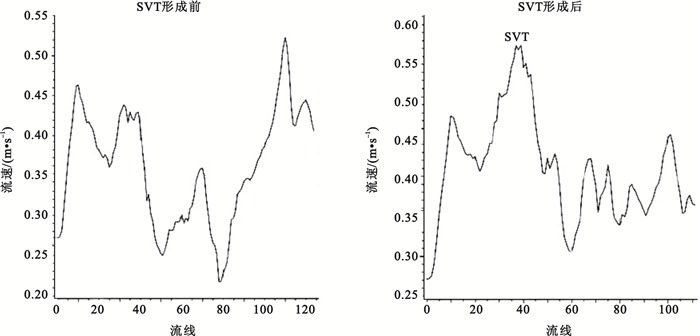
圖 5所示為追蹤的兩條從脾靜脈流入的流線上的速度變化情況,當血液流經血栓時流速會突然增大,隨后又降低,在肝門靜脈主干內血液的流速低于正常情況。
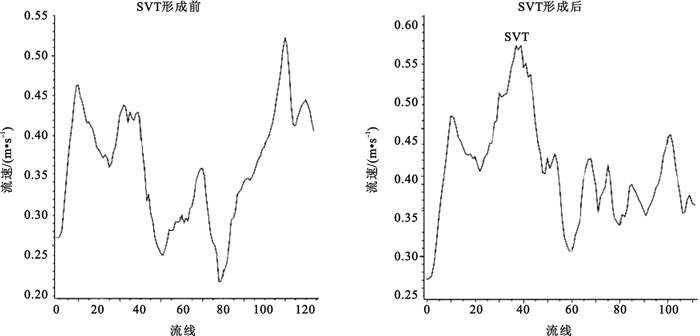 圖5
脾靜脈流入肝門靜脈的流線上的速度變化
Figure5.
Velocity changes in streamline flow from splenic vein into hepatic portal vein
圖5
脾靜脈流入肝門靜脈的流線上的速度變化
Figure5.
Velocity changes in streamline flow from splenic vein into hepatic portal vein
2.3 結果分析
在SVT周圍,血液的流速加快、壁面剪切力增加,血管內壁受到血液的沖擊力增大,容易導致血管內壁受損,因此,在SVT的附近容易形成新的血栓。SVT還會導致血液在流動過程中阻力增加,肝門靜脈主干內血液的流速降低,不僅會導致對肝的供血能力下降,血流緩慢還會導致在門靜脈主干內形成PVST的可能性增加[10]。
3 討論
血流動力學參數的變化對生理和病理方面的影響都很大[11]。脾切除斷流術是降低肝門靜脈高壓的一種有效的手術方式,但PVST是該手術方式的一種常見的并發癥[12]。脾切除后容易形成SVT,SVT會對肝門靜脈系統的血流動力學參數產生影響。本文根據肝門靜脈高壓癥患者的CT圖像和商業軟件MIMICS重建了肝門靜脈系統真實的仿真模型,采用彩色多普勒超聲法測出了患者肝門靜脈系統內的血流速度,作為模擬的入口邊界條件,應用CFD方法模擬了SVT對肝門靜脈系統血流動力學參數的影響,得出了SVT形成后壓強、流速和壁面剪切力等參數的變化情況。將模擬結果中的流速與采用彩色多普勒超聲法測得的結果進行比較,驗證了仿真結果的準確性。
本文的模擬結果表明,在SVT附近血液的流速加快、壁面剪切力增加,血管內壁受到的沖擊力增大,容易導致血管內壁受損,在其附近形成新血栓的可能性增加。SVT還導致血液流動阻力增加,肝門靜脈主干內血流速度降低,不僅會導致對肝的供血能力下降,而且在門靜脈主干內形成PVST的可能性增加。脾切除斷流術后SVT形成的可能性很高,而SVT形成后又會導致形成新的SVT和PVST的可能性增加,因此,斷流術后應進行早期抗凝以降低門脈高壓脾切除斷流術后血栓的發生率。Wang等[13]研究發現,經脾靜脈置管早期灌注D-二聚體和P-選擇素能有效降低門脈高壓脾切除斷流術后PVST的發生率。以上仿真結果具有普遍的適用性,能夠為血栓的預防和治療提供理論指導。
引言
脾切除斷流術是治療肝門靜脈高壓癥的有效手術方式,但肝門靜脈系統血栓(portal venous system thrombosis,PVST)是門靜脈高壓癥脾切除斷流術的主要并發癥之一[1]。PVST蔓延到門靜脈主干及腸系膜上靜脈可引起腸壞死而危及生命[2]。PVST中發生最多的是脾靜脈血栓(splenic vein thrombosis,SVT),Ikeda等[3]通過術后磁共振檢查發現,脾切除斷流手術后PVST的發生率高達55%, 且所有血栓形成的患者均患有SVT。
血栓的形成與血液的流動特性密切相關,研究發現血栓形成的三大危險因素為血流緩慢、血管內膜損傷和血流異常[4]。在門靜脈高壓脾切除斷流術后三大危險因素均存在[5],脾切除術后減少了脾靜脈血液的回流量,脾靜脈呈一盲端,血液流動緩慢易形成SVT。另外手術導致局部的血管內膜損傷,膠原纖維暴露激活凝血系統,從而易促進血栓形成。臨床統計發現脾切除斷流術后,PVST最多見于脾靜脈[6]。SVT形成后會導致肝門靜脈系統的血流動力學參數發生變化,而這些變化又可能產生生理和病理上的影響。
目前,對于血栓的研究主要是以臨床治療和護理的方法為主,極少采用計算流體力學(computational fluid dynamics,CFD)方法[7]。CFD能夠幫助我們分析與血栓形成密切相關的血流動力學參數的變化,為探索血栓的發病機制和形成過程提供了一種新的方法,計算結果也可用于指導血栓的預防和治療[8]。由于壓強、壁面剪切力等血流動力學參數無法通過測量的方法直接得到,利用測得的血流速度作為邊界條件,應用CFD方法可以對血流動力學參數進行計算。
為了分析SVT對肝門靜脈系統血流動力學參數的影響,我們根據某肝門靜脈高壓癥患者的CT圖像,應用商業軟件MIMICS重建了患者SVT形成前后真實的肝門靜脈系統仿真模型。然后采用彩色多普勒超聲法測出了患者肝門靜脈系統內的血流速度,以作為模擬的入口邊界條件。最后用CFD方法分別模擬出了SVT形成前后肝門靜脈系統中血流速度、壓強和壁面剪切力等血流動力學參數的變化情況,并分析了對生理過程的影響。
1 材料與方法
1.1 肝門靜脈系統模型重建
研究某肝門靜脈高壓癥患者的CT圖像,該患者因肝硬化導致肝門靜脈高壓癥并伴有食管胃底靜脈曲張,經臨床診斷決定采用脾切除加斷流的方法降低門靜脈高壓。圖像的空間分辨率為0.879 mm×0.879 mm×0.625 mm,如圖 1所示,是一張典型的肝門靜脈系統的CT圖像。
 圖1
肝門靜脈系統的CT圖像
Figure1.
CT image of portal venous system
圖1
肝門靜脈系統的CT圖像
Figure1.
CT image of portal venous system
利用商業軟件MIMICS,從CT圖像中分隔出患者的肝門靜脈系統并建立3D模型,然后對模型表面進行網格劃分。在MIMICS的有限元分析模塊中,利用網格重新劃分功能對有限元分析的輸入數據進行最大限度的優化,最后將重建模型的面網格導入生成計算網格的軟件ANSYS ICEM中進行體網格的生成、優化并進行邊界條件的設定。該建模方法已經被證明在病理學上進行詳細的3D微循環檢查方面是一個很好的方法。
1.2 肝門靜脈系統血流速度的超聲波檢測
采用ATL公司HDI-3500型彩色多普勒超聲系統測量血液的流速,探頭頻率為3.75 MHz。HDI-3500系統是一個易于使用且圖像質量出色,彩色多普勒性能和灰階分辨率都不錯的超聲系統,能為肝門靜脈系統提供準確的診斷信息。對肝門靜脈系統內的血流速度重復進行了5次測量,將測得的主要血管內的血流速度匯總于表 1。
1.3 控制方程和數值計算方法
當前的模擬中用到的控制方程包括連續性方程和動量方程。
連續性方程:
| $ \nabla \cdot \boldsymbol{U}=0 $ |
動量方程:
| $ \frac{\partial \boldsymbol{U}}{\partial t}+\nabla \cdot \left(\boldsymbol{U}\otimes \boldsymbol{U} \right)=-\nabla p+\mu {{\nabla }^{2}}\boldsymbol{U} $ |
其中向量U=(u, v, w),為血流速度,p為血液的壓力,μ為血液的黏度。
根據以上公式,應用商業軟件ANSYS CFX-14.5,在離散化的控制體內對血流動力學參數進行了計算。首先,將在ANSYS ICEM中生成體網格的模型導入到ANSYS CFX-14.5的前處理軟件中進行邊界條件、流體屬性等的設置,然后用求解器進行求解計算,最后利用后處理功能顯示計算所得的結果。
已證明在大的肝門靜脈分支中血液的非牛頓性影響很小[9],為了簡化計算,在模擬中血液被設定為牛頓型流體,計算模型選用層流模型。在入口邊界條件的設定中,以流速作為入口邊界條件,流速的大小為所測得的數值(見表 1)。血液的密度和黏度分別為1 050 kg/m3和0.004 5 kg/(m·s)。出口定義為自由流出口邊界條件,這是由于相比于脈動的肝動脈,在肝門靜脈連續流動的系統中單位距離內的壓降很小。壁面設置為無滑移固體壁面邊界條件,因為血液的流動是穩定的,不會引起血管較大的變形。迭代誤差設置為10-8。
2 結果與分析
2.1 重建的肝門靜脈系統模型
重建的肝門靜脈系統3D模型如圖 2所示。圖 2(a)、(b)分別顯示的是SVT形成前后的肝門靜脈系統模型,其中,SVT是在原有模型的基礎上創建的理想模型。劃分完體網格并定義好邊界條件后的結構如圖 2(c)、(d)所示。
 圖2
肝門靜脈系統及劃分完網格后的仿真模型
圖2
肝門靜脈系統及劃分完網格后的仿真模型
(a)SVT形成前;(b)SVT形成后;(c)肝門靜脈系統網格;(d)局部放大圖
Figure2. Simulation model and computational grid of hepatic portal vein system(a) pre-SVT; (b) post-SVT; (c) grid of hepatic portal vein system; (d) drawing of partial enlargement
模擬的目的是研究SVT對肝門靜脈系統中大血管內血流動力學參數的影響,細小血管對仿真結果準確性的影響很小,因此,在建模過程中舍棄了肝門靜脈系統的一些細小分支。
2.2 仿真結果
對仿真模型的求解結果包括一系列的流體力學參數,如壓強、流速及壁面剪切力等,將仿真結果中的流速與用彩色多普勒超聲法測得的速度進行對比,二者在不同血管處均基本保持一致,說明仿真結果與實際情況相符。仿真結果如圖 3和圖 4所示。
 圖3
SVT形成前的仿真結果
圖3
SVT形成前的仿真結果
(a)壓強的分布云圖;(b)流線的分布圖;(c)壁面剪切力的分布云圖
Figure3. Simulation results of pre-SVT(a) contours of pressure; (b) velocity streamlines; (c) wall shear stress
 圖4
SVT形成后的仿真結果
圖4
SVT形成后的仿真結果
(a)壓強的分布云圖;(b)流線的分布圖;(c)壁面剪切力的分布云圖
Figure4. Simulation results of post-SVT(a) contours of pressure; (b) velocity streamlines; (c) contours of wall shear stress
圖 3(a)和圖 4(a)分別顯示的是SVT形成前后肝門靜脈系統壓強的分布,血液流經血栓時會導致壓強降低,之后隨著流動截面積的增加壓強又升高。SVT存在時,肝門靜脈主干上壓強的分布更加均勻,壓力梯度減小。圖 3(b)和圖 4(b)分別顯示的是SVT形成前后流線的分布,當血液流經血栓時,隨著流動截面積的突然減小,血流速度會突然增大, 之后隨著流動截面積的增加,流速又隨著降低。當血液流經血栓時,在血栓的表面會存在一層很薄的邊界層,而邊界層會在流動中的某一位置脫離血栓的表面,在下游形成一個低壓的尾渦區,導致血栓上下游的壓強分布不對稱,于是物體就將受到一個沿流動方向的阻力。另外,在血栓表面還存在沿流動方向的黏性應力,黏性應力的合力也是沿流動方向的阻力。因此,SVT的存在會導致血液流動過程中阻力增加。仿真結果顯示,SVT存在時肝門靜脈主干內的血液流速低于正常情況。圖 3(c)和圖 4(c)分別顯示的是SVT形成前后壁面剪切力的分布,在血栓處,壁面剪切力突然增大,SVT存在時,肝門靜脈主干上壁面剪切力的分布也變得更加均勻。
圖 5所示為追蹤的兩條從脾靜脈流入的流線上的速度變化情況,當血液流經血栓時流速會突然增大,隨后又降低,在肝門靜脈主干內血液的流速低于正常情況。
 圖5
脾靜脈流入肝門靜脈的流線上的速度變化
Figure5.
Velocity changes in streamline flow from splenic vein into hepatic portal vein
圖5
脾靜脈流入肝門靜脈的流線上的速度變化
Figure5.
Velocity changes in streamline flow from splenic vein into hepatic portal vein
2.3 結果分析
在SVT周圍,血液的流速加快、壁面剪切力增加,血管內壁受到血液的沖擊力增大,容易導致血管內壁受損,因此,在SVT的附近容易形成新的血栓。SVT還會導致血液在流動過程中阻力增加,肝門靜脈主干內血液的流速降低,不僅會導致對肝的供血能力下降,血流緩慢還會導致在門靜脈主干內形成PVST的可能性增加[10]。
3 討論
血流動力學參數的變化對生理和病理方面的影響都很大[11]。脾切除斷流術是降低肝門靜脈高壓的一種有效的手術方式,但PVST是該手術方式的一種常見的并發癥[12]。脾切除后容易形成SVT,SVT會對肝門靜脈系統的血流動力學參數產生影響。本文根據肝門靜脈高壓癥患者的CT圖像和商業軟件MIMICS重建了肝門靜脈系統真實的仿真模型,采用彩色多普勒超聲法測出了患者肝門靜脈系統內的血流速度,作為模擬的入口邊界條件,應用CFD方法模擬了SVT對肝門靜脈系統血流動力學參數的影響,得出了SVT形成后壓強、流速和壁面剪切力等參數的變化情況。將模擬結果中的流速與采用彩色多普勒超聲法測得的結果進行比較,驗證了仿真結果的準確性。
本文的模擬結果表明,在SVT附近血液的流速加快、壁面剪切力增加,血管內壁受到的沖擊力增大,容易導致血管內壁受損,在其附近形成新血栓的可能性增加。SVT還導致血液流動阻力增加,肝門靜脈主干內血流速度降低,不僅會導致對肝的供血能力下降,而且在門靜脈主干內形成PVST的可能性增加。脾切除斷流術后SVT形成的可能性很高,而SVT形成后又會導致形成新的SVT和PVST的可能性增加,因此,斷流術后應進行早期抗凝以降低門脈高壓脾切除斷流術后血栓的發生率。Wang等[13]研究發現,經脾靜脈置管早期灌注D-二聚體和P-選擇素能有效降低門脈高壓脾切除斷流術后PVST的發生率。以上仿真結果具有普遍的適用性,能夠為血栓的預防和治療提供理論指導。