為研究流體剪切力對喉鱗癌細胞(Hep2)緊密連接的影響, 對Hep2細胞施加1.4 dyn/cm2的流體剪切力, 倒置顯微鏡觀察不同時間點細胞的形態學變化; 透射電鏡(TEM)觀察剪切力加載和松弛后細胞胞間緊密連接的變化規律; Western blot檢測緊密連接蛋白(Occludin、Claudin-5和ZO-1)的表達; 共聚焦顯微鏡下觀察Claudin-5分布及表達情況。結果表明, 在流體剪切力作用下, 細胞形態由多邊形呈梭形變化, 撤銷力學刺激后, 細胞呈向初始形態恢復的趨勢; 透射電鏡觀察隨剪切力加載時間的增加, 細胞間連接更為緊密; Western blot結果顯示剪切力誘導緊密連接蛋白Occludin、Claudin-5和ZO-1的表達增加, 而撤銷剪切力后, 其表達均呈現出顯著下調; 免疫熒光結果表明Claudin-5表達趨勢與Western blot結果一致, 靜態時Claudin-5均勻分布在胞漿, 加載剪切力后其分布易位于胞間, 撤銷力學刺激后, 在胞間和胞漿區域仍有Claudin-5的表達。因此, 剪切力可改變Hep2細胞形態, 并且通過上調Occludin、Claudin-5和ZO-1蛋白增加細胞間的緊密連接。
引用本文: 周法庭, 尹紅梅, 劉雙鳳, 沈陽, 洪錦勇, 夏慶, 劉肖珩. 流體剪切力對喉鱗癌Hep2細胞形態和緊密連接的影響. 生物醫學工程學雜志, 2015, 32(1): 104-109. doi: 10.7507/1001-5515.20150019 復制
版權信息: ?四川大學華西醫院華西期刊社《生物醫學工程學雜志》版權所有,未經授權不得轉載、改編
引言
腫瘤的遷移和侵襲是一個復雜、連續的生物學過程,也是導致癌癥治療失敗和患者死亡率增加的主要原因。在特定的條件下,腫瘤細胞脫離原發灶發生遷移,通過分泌基質金屬蛋白酶降解不完善的血管基質膜,從而進入血液循環系統,轉移到其他組織。
腫瘤細胞發生上皮-間充質轉化(epithelial-mesenchymal transition, EMT),是其遷移和侵襲的首要過程[1-2]。腫瘤細胞發生EMT,失去上皮特征,獲得間充質細胞表型,除遷移、侵襲能力增強外,還包括細胞形態和通透性改變、細胞極性消失、骨架重排和細胞周期變化等[3]。其中,細胞通透性的變化對于早期診斷腫瘤和監測抗癌藥物療效是至關重要的[4]。細胞通透性的改變與細胞間的連接相關,涉及黏附連接(adherence junction)和緊密連接(tight junction)兩種方式。緊密連接又被稱為緊密連接帶,它將相鄰的細胞膜封閉成不透水的結構,從而保障細胞生理功能。
目前研究發現,閉合蛋白(Claudin)、咬合蛋白(Occludin)和閉鎖小帶(ZO-1)是參與調控細胞間緊密連接最關鍵的3個蛋白家族[5]。Claudin是緊密連接的主要組成部分,它通過氨基和羧基末端胞外環的“順-反”作用模式形成了拉鏈式結構,與細胞水分子和鎂離子的通透性變化密切相關[6]。成纖維細胞導入外源性claudin基因,可以促使緊密連接的形成[7]。Occludin是緊密連接另一重要家族,研究發現,Occludin具有增加細胞電阻和促進小分子親水性物質細胞旁擴散的功能,該功能由兩個胞外環所決定[8]。體外實驗表明,敲除occludin基因后,細胞對二價有機陽離子和小分子物質通透性明顯增加[9]。ZO-1在緊密連接的結構中起著中樞作用。ZO-1借助SH3和GuK之間的U5結構,調控緊密連接的組裝。研究發現,在過低表達ZO-1蛋白的細胞中不能有效地形成緊密連接,敲除ZO-1的胚胎鼠,出現卵黃囊血管生成減少和細胞增殖障礙等現象而死于胚胎期[10]。此外,上述3種蛋白的協同作用共同調節細胞的緊密連接,Occludin與Claudin相互作用后,Claudin維持細胞緊密連接的功能明顯增強;Claudin-5和Occludin與細胞內的ZO-1、ZO-2及ZO-3等配體相連;ZO-1通過PDZ結構域與Claudin相互作用,借助Occludin與細胞骨架相連[11]。由此可見,Claudin-5、Occludin和ZO-1在調控緊密連接和細胞通透性方面具有重要作用。
腫瘤細胞在體內處于一個力——化學耦合的微環境,細胞所受到的剪切力主要是由相鄰腫瘤細胞相互擠壓以及腫瘤內新生血管、淋巴及組織間液緩慢流動所產生的,大小為0.01~1.0 Pa[12]。研究表明,TGF-β、IL-8等生化因子可增加腫瘤細胞通透性,并伴有細胞間緊密連接的改變[13-14],而對于流體剪切力(fluid shear stress)等生物物理因素對腫瘤細胞緊密連接改變及相關機制的研究鮮有報道。因此本研究以喉鱗癌細胞(Hep2)為模式細胞,采用流動腔在體外模擬腫瘤的力學微環境,從生物力學角度研究剪切力對腫瘤細胞形態學變化及Occludin、Claudin-5和ZO-1蛋白表達和分布的影響,初步探討力學調控腫瘤細胞緊密連接的分子機制。
1 材料和方法
1.1 材料和試劑
喉鱗癌細胞株(Hep2)為本實驗室保存;RPMI 1640培養基、胰蛋白酶和胎牛血清購自Invitrogen公司;ZO-1(H-300)、Claudin-5(H-52)多克隆IgG、Occludin(F-7)單克隆IgG均購自Santa公司;辣根過氧化物酶標記的二抗購自北京鼎國生物科技有限公司,封閉血清、FITC標記的山羊抗兔IgG購自北京中杉公司。
1.2 Hep2細胞培養
Hep2細胞接種于含10%胎牛血清、10×104 U/L青霉素、100 mg/mL鏈霉素的RPMI 1640完全培養基中,置飽和濕度條件下,37℃、5% CO2的孵箱中靜置培養。當細胞長至80%~90%時,采用2.5%的胰蛋白酶消化后傳代培養,取對數生長期細胞進行實驗。
1.3 實驗分組
將對數生長期的Hep2細胞接種于25.4 mm×76.2 mm的載玻片上培養,待Hep2細胞融合至90%時,通過蠕動泵控制流速,對Hep2細胞加載大小為1.4 dyn/cm2的剪切力,使用倒置顯微鏡觀察細胞形態、透射電鏡檢測細胞間連接和Western blot檢測緊密連接蛋白的表達。實驗細胞共分為6組,為對照組(靜態培養不加載剪切力),有力學加載的2 h組、4 h組、8 h組(分別加載剪切力2 h、4 h和8 h),以及先力學加載再松弛的8+4 h組和8+8 h組(分別于加載剪切力8 h后再靜態培養4 h和8 h)。
1.4 剪切力對Hep2細胞形態的影響
取對照組、8 h組和8+8 h組細胞玻片,PBS洗滌3次,每次5 min。倒置顯微鏡下觀察Hep2的細胞形態,分別以200×、400×視野隨機選取5個區域拍照。
1.5 透射電鏡測定剪切力對Hep2胞間連接的影響
取對照組、8 h組、8+8 h組的細胞培養載玻片以PBS洗滌,細胞刮子收集細胞于1.5 mL EP管,1 500 r/min離心15 min,棄上清液。加入0.5%戊二醛固定液,4℃下靜置10 min,12 000 r/min離心12 min,棄上清液。1%四氧化鋨再固定,丙酮逐級脫水,Epon812包埋,半薄切片,醋酸鈾及枸櫞鉛雙重染色,透射電鏡(transmission electron microscope, TEM)(H-600IV,Japan)下觀察各組Hep2細胞連接的超微結構。隨機選取兩細胞間區域拍照,采用Picpic圖像分析軟件測量胞間距離,對所得數據進行統計學分析。
1.6 Western blot測定剪切力對緊密連接蛋白表達的影響
取對照組、2 h組、4 h組、8 h組、8+4 h組、8+8 h組細胞,RIPA裂解液收集總蛋白,BCA法進行蛋白定量后,95℃變性,經Western blot跑膠、轉膜、封閉后孵育一抗(ZO-1, Occludin, Claudin-5,1 :200),4℃過夜。TBST洗滌后,室溫孵育二抗2 h(1 :5 000),增強化學發光(enhanced chemiluminescence, ECL)在凝膠成像儀(ChemiDocTM XRS+with Image Lab TM, Bio-Rad, Inc., USA)上顯影。對條帶進行灰度分析后,將目的蛋白條帶與內參的比值作為半定量指標。
1.7 免疫熒光分析剪切力對Claudin-5分布的影響
取對照組、8 h組、8+8 h組細胞,以PBS洗滌2次,每次8 min。4%多聚甲醛固定,PBS洗滌,BSA封閉后一抗孵育(1 :200),4℃過夜。PBS洗滌,37℃孵育FITC標記的二抗(1 :100)40 min,避光PBS洗滌后,加入DAPI染細胞核,37℃孵育20 min,PBS洗滌,甘油封片。激光共聚焦顯微鏡(Leica TCS SP5,Germany)下觀察Hep2細胞內Claudin-5蛋白的表達及分布。
1.8 統計學分析
上述所有實驗均重復3次以上,數據以均數±標準差(
2 結果
2.1 剪切力對Hep2形態的影響
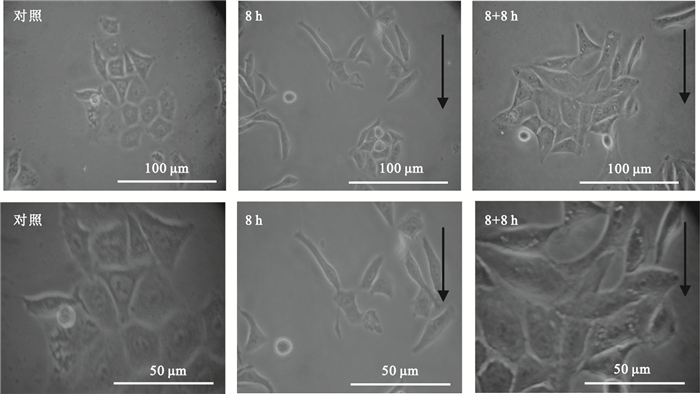
研究表明,流體剪切力可誘導細胞骨架的重排,從而改變細胞形態[15]。如圖 1所示,對照組細胞排列緊密,細胞形態主要為多邊形。與對照組相比,剪切力加載8 h后,細胞順應剪切力的方向(圖 1中黑色箭頭所示),多數細胞呈梭狀排布,長短軸比增加。而在撤銷剪切力8 h后,細胞仍然保持著梭狀排布,但呈向初始形態恢復的趨勢。
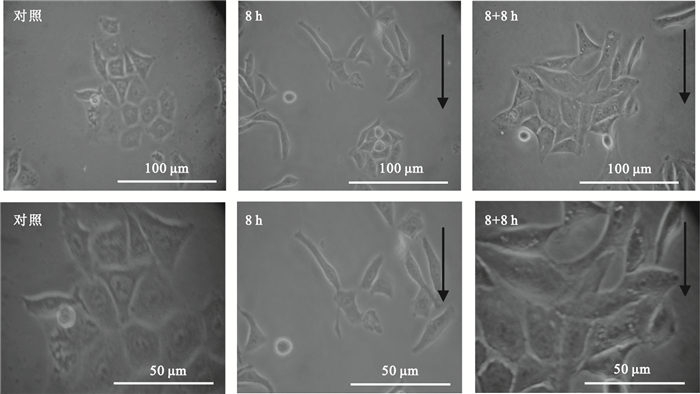 圖1
剪切力對Hep2細胞形態的影響
圖1
剪切力對Hep2細胞形態的影響
黑色箭頭示剪切力方向
Figure1. Effects of shear stress on the morphology of Hep2 cellsblack arrows indicating the direction of shear stress
2.2 剪切力對胞間連接的影響
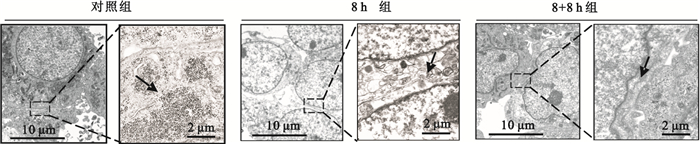
進一步采用TEM觀察Hep2胞間連接。如圖 2所示,靜態培養的Hep2細胞間連接較為緊密[(31.33±7.02)μm,黑色箭頭],而加載8 h的剪切力后,細胞間連接的縫隙變窄,胞間連接更為緊密[(16.33±5.54)μm]。撤銷力學加載8 h后,胞間連接寬度增加[(27.67±2.08)μm],通透性增大。結果說明剪切力對Hep2細胞間隙有影響,剪切力的加載使Hep2細胞之間的連接更為緊密。
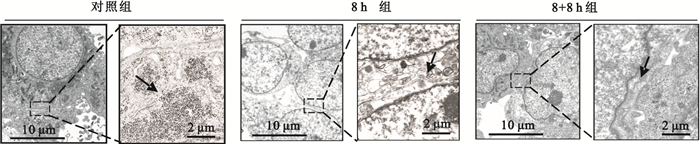 圖2
TEM觀察剪切力對Hep2細胞間連接的影響
圖2
TEM觀察剪切力對Hep2細胞間連接的影響
黑色箭頭示細胞間連接
Figure2. TEM images of cell-cell junctionsblack arrows indicate the cell-cell junctions
2.3 剪切力對緊密連接蛋白表達的影響
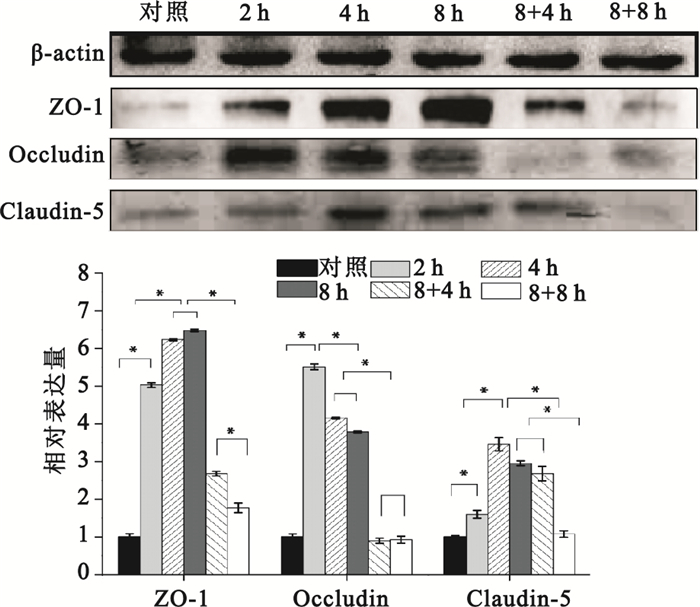
采用Western blot檢測對照組、2 h組、4 h組、8 h組、8+4 h組和8+8 h組細胞胞內緊密連接ZO-1、Occludin、Claudin-5蛋白的表達。由圖 3可以看出,剪切力的加載均能明顯上調3種緊密連接蛋白的表達。其中,Occludin蛋白在剪切力加載2 h時,表達顯著上調,與對照組比較差異有統計學意義(P<0.05),隨后出現緩慢下降趨勢,但8 h時水平仍明顯高于對照組。Claudin-5蛋白在4 h時達到最大值,而ZO-1蛋白隨著剪切力加載時間的延長,呈現出明顯的時間依賴性上調趨勢,在8 h時達到最大值。三種緊密連接蛋白均在撤銷力學刺激后表達水平降低。其中,ZO-1在撤銷力學刺激后呈現逐漸降低的趨勢,在撤銷剪切力4 h時,表達顯著降低,但高于對照組,在撤銷剪切力8 h時,接近對照組水平。Occludin在撤銷剪切力后表達水平降低趨勢明顯,在撤銷剪切力4 h時,其表達已低至對照組,而在撤銷剪切力8 h后,其水平有所恢復,但與8+4 h組比較差異無統計學意義。Claudin-5在撤銷剪切力4 h后并沒有明顯減少,與8 h組的差異無統計學意義,在撤銷力學刺激8 h恢復至對照組水平。該結果提示:剪切力的加載促進了Hep2細胞緊密連接蛋白的上調,而撤銷剪切力后,其表達水平呈現明顯下調。幾種蛋白的表達均依賴于剪切力加載時間的變化,呈時序性差異,其中Occludin對剪切力變化的響應更為迅速。
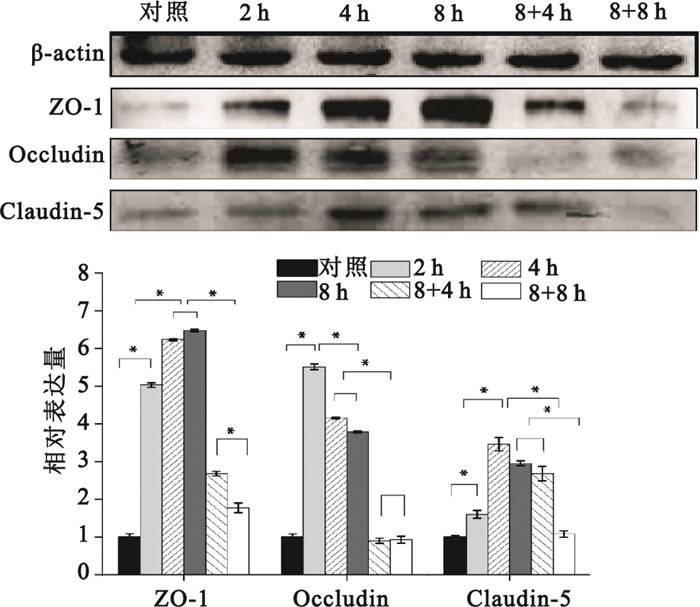 圖3
剪切力對緊密連接蛋白影響
Figure3.
Effects of shear stress on the expression of tight junction proteins
圖3
剪切力對緊密連接蛋白影響
Figure3.
Effects of shear stress on the expression of tight junction proteins
2.4 剪切力對Hep2細胞Claudin-5的影響
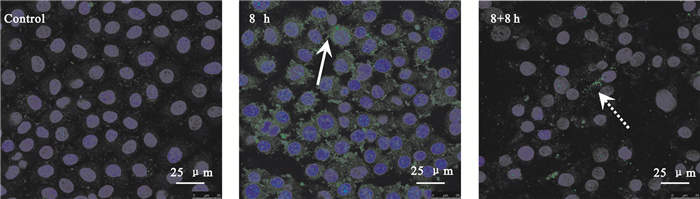
采用FITC綠色熒光標記Claudin-5,共聚焦顯微鏡觀察其在剪切力作用下的表達和分布情況。如圖 4所示,靜態培養的對照組Claudin-5主要均勻分布在胞質內;加載剪切力8 h后,Claudin-5的表達增強,且在胞間連接處可以明顯觀察到綠色熒光的Claudin-5分布(圖 4中白色實線箭頭所示);取消力學加載8 h后,Claudin-5表達的水平降低,但細胞與細胞間仍可觀察到明顯的綠色熒光表達(圖 4中白色虛線箭頭所示)。該結果表示,剪切力能夠促進緊密連接蛋白主要成員Claudin-5的表達上調,并聚集在細胞與細胞的連接處。
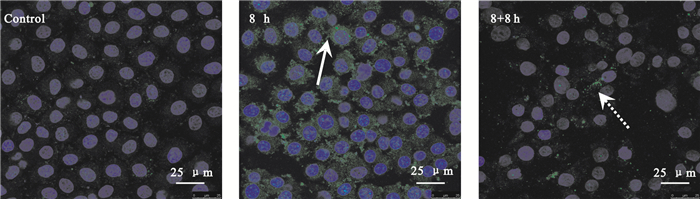 圖4
剪切力對Claudin-5表達的影響
圖4
剪切力對Claudin-5表達的影響
白色箭頭示Claudin-5的分布
Figure4. Effects of shear stress on the expression of Claudin-5white arrows indicating the distribution of Claudin-5
3 討論
細胞骨架與細胞間連接維持著細胞通透性穩定,并調節水、電解質在細胞內的動態平穩。細胞通透性失衡常伴隨各類疾病的發生,如炎癥、燒傷、腫瘤及動脈粥樣硬化等。緊密連接是由很多跨膜及膜周圍蛋白復合物組成的動態結構,其改變是引起細胞通透性異常的重要原因[16]。與緊密連接相關的蛋白可分成3組,即跨膜蛋白、胞漿支架蛋白和骨架蛋白。其中常見的跨膜蛋白是Claudins、Occludin蛋白家族,而ZO蛋白家族在緊密連接復合物中起橋梁作用。研究表明,緊密連接蛋白受各種因素影響,其中剪切力可通過小G蛋白募集活化下游信號分子來調節Occludin的表達水平[17]。
本文結果顯示,剪切力影響Hep2細胞的形態和緊密連接。加載剪切力8 h后,細胞形態發生改變,由原來的多邊形逐漸轉變為長梭形,沿力學刺激方向排列。TEM圖像顯示,加載剪切力8 h后,細胞間的連接更加緊密,停止力學刺激后,胞間連接寬度增加,呈現與緊密連接蛋白表達量一致的趨勢,細胞間的連接直接受緊密連接影響。我們的研究結果發現,3種蛋白的表達水平均依賴于剪切力加載時間,且呈現出明顯的時序性差異。ZO-1蛋白隨著剪切力加載時間延長逐漸上調,撤消剪切力后逐漸降低。Occludin對于剪切力最為敏感,在加載剪切力2h時,Occludin水平顯著上調,而后隨加載時間延長有所減少。但在停止力學刺激4 h后降低,在停止力學刺激8 h時,其表達水平略有上升。Claudin-5在加載剪切力4 h時表達水平最高,但在撤銷剪切力4 h時并沒有明顯減少,與8 h組的差異無統計學意義,在撤銷力學刺激8 h低至對照組水平。細胞免疫熒光結果進一步顯示了Claudin-5的表達受剪切力影響變化的趨勢。Yu等[18]證實IL-8可降低血管內皮細胞通透性,且具有濃度和時間依賴性,在200 ng/mL時ZO-1、Occludin和Claudin-5表達水平最低,在100 ng/mL濃度下作用2、4、6、8 h的內皮細胞,上述3種蛋白表達呈逐漸下降趨勢。Brians等[17]研究結果表明,在1.5 dyn/cm2的低剪切力中,豬的主動脈內皮細胞通透性增加2.8倍。與生理環境中的剪切力刺激結果比較,以低剪切力刺激12 h、24 h后,Occludin的mRNA和蛋白表達水平均顯著降低,但未分析8 h時Occludin的表達情況。此外,DeMiao等[19]用10 dyn/cm2剪切力刺激內皮細胞,3 h后Occludin表達水平與靜止狀態比較顯著下調。由此可見,剪切力對不同細胞緊密連接蛋白影響的結果不完全相同,可能因細胞的力學微環境而異。然而上述研究均未檢測撤銷剪切力后,緊密連接蛋白的表達水平的變化。
本文從生物力學角度出發,通過體外模擬喉鱗癌細胞所處的力學微環境,分別研究加載流體剪切力和撤銷流體剪切力后對Hep2細胞形態和緊密連接的影響,初步探討剪切力調控Hep2細胞緊密連接的分子機制。研究結果為了解腫瘤細胞的轉移過程提供了一定的理論依據,對防治腫瘤細胞轉移具有重要意義。
引言
腫瘤的遷移和侵襲是一個復雜、連續的生物學過程,也是導致癌癥治療失敗和患者死亡率增加的主要原因。在特定的條件下,腫瘤細胞脫離原發灶發生遷移,通過分泌基質金屬蛋白酶降解不完善的血管基質膜,從而進入血液循環系統,轉移到其他組織。
腫瘤細胞發生上皮-間充質轉化(epithelial-mesenchymal transition, EMT),是其遷移和侵襲的首要過程[1-2]。腫瘤細胞發生EMT,失去上皮特征,獲得間充質細胞表型,除遷移、侵襲能力增強外,還包括細胞形態和通透性改變、細胞極性消失、骨架重排和細胞周期變化等[3]。其中,細胞通透性的變化對于早期診斷腫瘤和監測抗癌藥物療效是至關重要的[4]。細胞通透性的改變與細胞間的連接相關,涉及黏附連接(adherence junction)和緊密連接(tight junction)兩種方式。緊密連接又被稱為緊密連接帶,它將相鄰的細胞膜封閉成不透水的結構,從而保障細胞生理功能。
目前研究發現,閉合蛋白(Claudin)、咬合蛋白(Occludin)和閉鎖小帶(ZO-1)是參與調控細胞間緊密連接最關鍵的3個蛋白家族[5]。Claudin是緊密連接的主要組成部分,它通過氨基和羧基末端胞外環的“順-反”作用模式形成了拉鏈式結構,與細胞水分子和鎂離子的通透性變化密切相關[6]。成纖維細胞導入外源性claudin基因,可以促使緊密連接的形成[7]。Occludin是緊密連接另一重要家族,研究發現,Occludin具有增加細胞電阻和促進小分子親水性物質細胞旁擴散的功能,該功能由兩個胞外環所決定[8]。體外實驗表明,敲除occludin基因后,細胞對二價有機陽離子和小分子物質通透性明顯增加[9]。ZO-1在緊密連接的結構中起著中樞作用。ZO-1借助SH3和GuK之間的U5結構,調控緊密連接的組裝。研究發現,在過低表達ZO-1蛋白的細胞中不能有效地形成緊密連接,敲除ZO-1的胚胎鼠,出現卵黃囊血管生成減少和細胞增殖障礙等現象而死于胚胎期[10]。此外,上述3種蛋白的協同作用共同調節細胞的緊密連接,Occludin與Claudin相互作用后,Claudin維持細胞緊密連接的功能明顯增強;Claudin-5和Occludin與細胞內的ZO-1、ZO-2及ZO-3等配體相連;ZO-1通過PDZ結構域與Claudin相互作用,借助Occludin與細胞骨架相連[11]。由此可見,Claudin-5、Occludin和ZO-1在調控緊密連接和細胞通透性方面具有重要作用。
腫瘤細胞在體內處于一個力——化學耦合的微環境,細胞所受到的剪切力主要是由相鄰腫瘤細胞相互擠壓以及腫瘤內新生血管、淋巴及組織間液緩慢流動所產生的,大小為0.01~1.0 Pa[12]。研究表明,TGF-β、IL-8等生化因子可增加腫瘤細胞通透性,并伴有細胞間緊密連接的改變[13-14],而對于流體剪切力(fluid shear stress)等生物物理因素對腫瘤細胞緊密連接改變及相關機制的研究鮮有報道。因此本研究以喉鱗癌細胞(Hep2)為模式細胞,采用流動腔在體外模擬腫瘤的力學微環境,從生物力學角度研究剪切力對腫瘤細胞形態學變化及Occludin、Claudin-5和ZO-1蛋白表達和分布的影響,初步探討力學調控腫瘤細胞緊密連接的分子機制。
1 材料和方法
1.1 材料和試劑
喉鱗癌細胞株(Hep2)為本實驗室保存;RPMI 1640培養基、胰蛋白酶和胎牛血清購自Invitrogen公司;ZO-1(H-300)、Claudin-5(H-52)多克隆IgG、Occludin(F-7)單克隆IgG均購自Santa公司;辣根過氧化物酶標記的二抗購自北京鼎國生物科技有限公司,封閉血清、FITC標記的山羊抗兔IgG購自北京中杉公司。
1.2 Hep2細胞培養
Hep2細胞接種于含10%胎牛血清、10×104 U/L青霉素、100 mg/mL鏈霉素的RPMI 1640完全培養基中,置飽和濕度條件下,37℃、5% CO2的孵箱中靜置培養。當細胞長至80%~90%時,采用2.5%的胰蛋白酶消化后傳代培養,取對數生長期細胞進行實驗。
1.3 實驗分組
將對數生長期的Hep2細胞接種于25.4 mm×76.2 mm的載玻片上培養,待Hep2細胞融合至90%時,通過蠕動泵控制流速,對Hep2細胞加載大小為1.4 dyn/cm2的剪切力,使用倒置顯微鏡觀察細胞形態、透射電鏡檢測細胞間連接和Western blot檢測緊密連接蛋白的表達。實驗細胞共分為6組,為對照組(靜態培養不加載剪切力),有力學加載的2 h組、4 h組、8 h組(分別加載剪切力2 h、4 h和8 h),以及先力學加載再松弛的8+4 h組和8+8 h組(分別于加載剪切力8 h后再靜態培養4 h和8 h)。
1.4 剪切力對Hep2細胞形態的影響
取對照組、8 h組和8+8 h組細胞玻片,PBS洗滌3次,每次5 min。倒置顯微鏡下觀察Hep2的細胞形態,分別以200×、400×視野隨機選取5個區域拍照。
1.5 透射電鏡測定剪切力對Hep2胞間連接的影響
取對照組、8 h組、8+8 h組的細胞培養載玻片以PBS洗滌,細胞刮子收集細胞于1.5 mL EP管,1 500 r/min離心15 min,棄上清液。加入0.5%戊二醛固定液,4℃下靜置10 min,12 000 r/min離心12 min,棄上清液。1%四氧化鋨再固定,丙酮逐級脫水,Epon812包埋,半薄切片,醋酸鈾及枸櫞鉛雙重染色,透射電鏡(transmission electron microscope, TEM)(H-600IV,Japan)下觀察各組Hep2細胞連接的超微結構。隨機選取兩細胞間區域拍照,采用Picpic圖像分析軟件測量胞間距離,對所得數據進行統計學分析。
1.6 Western blot測定剪切力對緊密連接蛋白表達的影響
取對照組、2 h組、4 h組、8 h組、8+4 h組、8+8 h組細胞,RIPA裂解液收集總蛋白,BCA法進行蛋白定量后,95℃變性,經Western blot跑膠、轉膜、封閉后孵育一抗(ZO-1, Occludin, Claudin-5,1 :200),4℃過夜。TBST洗滌后,室溫孵育二抗2 h(1 :5 000),增強化學發光(enhanced chemiluminescence, ECL)在凝膠成像儀(ChemiDocTM XRS+with Image Lab TM, Bio-Rad, Inc., USA)上顯影。對條帶進行灰度分析后,將目的蛋白條帶與內參的比值作為半定量指標。
1.7 免疫熒光分析剪切力對Claudin-5分布的影響
取對照組、8 h組、8+8 h組細胞,以PBS洗滌2次,每次8 min。4%多聚甲醛固定,PBS洗滌,BSA封閉后一抗孵育(1 :200),4℃過夜。PBS洗滌,37℃孵育FITC標記的二抗(1 :100)40 min,避光PBS洗滌后,加入DAPI染細胞核,37℃孵育20 min,PBS洗滌,甘油封片。激光共聚焦顯微鏡(Leica TCS SP5,Germany)下觀察Hep2細胞內Claudin-5蛋白的表達及分布。
1.8 統計學分析
上述所有實驗均重復3次以上,數據以均數±標準差(
2 結果
2.1 剪切力對Hep2形態的影響
研究表明,流體剪切力可誘導細胞骨架的重排,從而改變細胞形態[15]。如圖 1所示,對照組細胞排列緊密,細胞形態主要為多邊形。與對照組相比,剪切力加載8 h后,細胞順應剪切力的方向(圖 1中黑色箭頭所示),多數細胞呈梭狀排布,長短軸比增加。而在撤銷剪切力8 h后,細胞仍然保持著梭狀排布,但呈向初始形態恢復的趨勢。
 圖1
剪切力對Hep2細胞形態的影響
圖1
剪切力對Hep2細胞形態的影響
黑色箭頭示剪切力方向
Figure1. Effects of shear stress on the morphology of Hep2 cellsblack arrows indicating the direction of shear stress
2.2 剪切力對胞間連接的影響
進一步采用TEM觀察Hep2胞間連接。如圖 2所示,靜態培養的Hep2細胞間連接較為緊密[(31.33±7.02)μm,黑色箭頭],而加載8 h的剪切力后,細胞間連接的縫隙變窄,胞間連接更為緊密[(16.33±5.54)μm]。撤銷力學加載8 h后,胞間連接寬度增加[(27.67±2.08)μm],通透性增大。結果說明剪切力對Hep2細胞間隙有影響,剪切力的加載使Hep2細胞之間的連接更為緊密。
 圖2
TEM觀察剪切力對Hep2細胞間連接的影響
圖2
TEM觀察剪切力對Hep2細胞間連接的影響
黑色箭頭示細胞間連接
Figure2. TEM images of cell-cell junctionsblack arrows indicate the cell-cell junctions
2.3 剪切力對緊密連接蛋白表達的影響
采用Western blot檢測對照組、2 h組、4 h組、8 h組、8+4 h組和8+8 h組細胞胞內緊密連接ZO-1、Occludin、Claudin-5蛋白的表達。由圖 3可以看出,剪切力的加載均能明顯上調3種緊密連接蛋白的表達。其中,Occludin蛋白在剪切力加載2 h時,表達顯著上調,與對照組比較差異有統計學意義(P<0.05),隨后出現緩慢下降趨勢,但8 h時水平仍明顯高于對照組。Claudin-5蛋白在4 h時達到最大值,而ZO-1蛋白隨著剪切力加載時間的延長,呈現出明顯的時間依賴性上調趨勢,在8 h時達到最大值。三種緊密連接蛋白均在撤銷力學刺激后表達水平降低。其中,ZO-1在撤銷力學刺激后呈現逐漸降低的趨勢,在撤銷剪切力4 h時,表達顯著降低,但高于對照組,在撤銷剪切力8 h時,接近對照組水平。Occludin在撤銷剪切力后表達水平降低趨勢明顯,在撤銷剪切力4 h時,其表達已低至對照組,而在撤銷剪切力8 h后,其水平有所恢復,但與8+4 h組比較差異無統計學意義。Claudin-5在撤銷剪切力4 h后并沒有明顯減少,與8 h組的差異無統計學意義,在撤銷力學刺激8 h恢復至對照組水平。該結果提示:剪切力的加載促進了Hep2細胞緊密連接蛋白的上調,而撤銷剪切力后,其表達水平呈現明顯下調。幾種蛋白的表達均依賴于剪切力加載時間的變化,呈時序性差異,其中Occludin對剪切力變化的響應更為迅速。
 圖3
剪切力對緊密連接蛋白影響
Figure3.
Effects of shear stress on the expression of tight junction proteins
圖3
剪切力對緊密連接蛋白影響
Figure3.
Effects of shear stress on the expression of tight junction proteins
2.4 剪切力對Hep2細胞Claudin-5的影響
采用FITC綠色熒光標記Claudin-5,共聚焦顯微鏡觀察其在剪切力作用下的表達和分布情況。如圖 4所示,靜態培養的對照組Claudin-5主要均勻分布在胞質內;加載剪切力8 h后,Claudin-5的表達增強,且在胞間連接處可以明顯觀察到綠色熒光的Claudin-5分布(圖 4中白色實線箭頭所示);取消力學加載8 h后,Claudin-5表達的水平降低,但細胞與細胞間仍可觀察到明顯的綠色熒光表達(圖 4中白色虛線箭頭所示)。該結果表示,剪切力能夠促進緊密連接蛋白主要成員Claudin-5的表達上調,并聚集在細胞與細胞的連接處。
 圖4
剪切力對Claudin-5表達的影響
圖4
剪切力對Claudin-5表達的影響
白色箭頭示Claudin-5的分布
Figure4. Effects of shear stress on the expression of Claudin-5white arrows indicating the distribution of Claudin-5
3 討論
細胞骨架與細胞間連接維持著細胞通透性穩定,并調節水、電解質在細胞內的動態平穩。細胞通透性失衡常伴隨各類疾病的發生,如炎癥、燒傷、腫瘤及動脈粥樣硬化等。緊密連接是由很多跨膜及膜周圍蛋白復合物組成的動態結構,其改變是引起細胞通透性異常的重要原因[16]。與緊密連接相關的蛋白可分成3組,即跨膜蛋白、胞漿支架蛋白和骨架蛋白。其中常見的跨膜蛋白是Claudins、Occludin蛋白家族,而ZO蛋白家族在緊密連接復合物中起橋梁作用。研究表明,緊密連接蛋白受各種因素影響,其中剪切力可通過小G蛋白募集活化下游信號分子來調節Occludin的表達水平[17]。
本文結果顯示,剪切力影響Hep2細胞的形態和緊密連接。加載剪切力8 h后,細胞形態發生改變,由原來的多邊形逐漸轉變為長梭形,沿力學刺激方向排列。TEM圖像顯示,加載剪切力8 h后,細胞間的連接更加緊密,停止力學刺激后,胞間連接寬度增加,呈現與緊密連接蛋白表達量一致的趨勢,細胞間的連接直接受緊密連接影響。我們的研究結果發現,3種蛋白的表達水平均依賴于剪切力加載時間,且呈現出明顯的時序性差異。ZO-1蛋白隨著剪切力加載時間延長逐漸上調,撤消剪切力后逐漸降低。Occludin對于剪切力最為敏感,在加載剪切力2h時,Occludin水平顯著上調,而后隨加載時間延長有所減少。但在停止力學刺激4 h后降低,在停止力學刺激8 h時,其表達水平略有上升。Claudin-5在加載剪切力4 h時表達水平最高,但在撤銷剪切力4 h時并沒有明顯減少,與8 h組的差異無統計學意義,在撤銷力學刺激8 h低至對照組水平。細胞免疫熒光結果進一步顯示了Claudin-5的表達受剪切力影響變化的趨勢。Yu等[18]證實IL-8可降低血管內皮細胞通透性,且具有濃度和時間依賴性,在200 ng/mL時ZO-1、Occludin和Claudin-5表達水平最低,在100 ng/mL濃度下作用2、4、6、8 h的內皮細胞,上述3種蛋白表達呈逐漸下降趨勢。Brians等[17]研究結果表明,在1.5 dyn/cm2的低剪切力中,豬的主動脈內皮細胞通透性增加2.8倍。與生理環境中的剪切力刺激結果比較,以低剪切力刺激12 h、24 h后,Occludin的mRNA和蛋白表達水平均顯著降低,但未分析8 h時Occludin的表達情況。此外,DeMiao等[19]用10 dyn/cm2剪切力刺激內皮細胞,3 h后Occludin表達水平與靜止狀態比較顯著下調。由此可見,剪切力對不同細胞緊密連接蛋白影響的結果不完全相同,可能因細胞的力學微環境而異。然而上述研究均未檢測撤銷剪切力后,緊密連接蛋白的表達水平的變化。
本文從生物力學角度出發,通過體外模擬喉鱗癌細胞所處的力學微環境,分別研究加載流體剪切力和撤銷流體剪切力后對Hep2細胞形態和緊密連接的影響,初步探討剪切力調控Hep2細胞緊密連接的分子機制。研究結果為了解腫瘤細胞的轉移過程提供了一定的理論依據,對防治腫瘤細胞轉移具有重要意義。