本研究用聚乙烯亞胺(PEI)介導表達綠色熒光蛋白(GFP)的rAAV包裝系統(pAAV-CMV-GFP、pAAV-RC和pHelper)轉染人胚腎293細胞(HEK293細胞)。用ImagePro Plus6.0圖像分析軟件計算表達GFP的細胞比例來測定1、2、3、4、5、6μg/孔不同質粒劑量, 1∶1、3∶1、5∶1、7∶1不同PEI/質粒比值及轉染12、24、36、48、60、72 h不同時間三個變量對轉染效率的影響, 以優化PEI介導三質粒共轉染HEK293細胞的條件。結果顯示, 質粒劑量為4μg/孔、PEI/質粒比值為3∶1~5∶1時轉染效率維持較高水平; 轉染效率-轉染時間曲線為S型增長曲線, 轉染效率于60 h達到平臺期。優化PEI轉染條件能增加三質粒共轉染HEK293細胞的轉染效率。
引用本文: 付強, 李艷, 鄭昭芬, 劉愛忠, 袁振華, 彭建強, 何晉. 聚乙烯亞胺介導三質粒共轉染HEK293細胞的條件優化. 生物醫學工程學雜志, 2015, 32(1): 137-141. doi: 10.7507/1001-5515.20150025 復制
版權信息: ?四川大學華西醫院華西期刊社《生物醫學工程學雜志》版權所有,未經授權不得轉載、改編
引言
近年來,腺相關病毒(adeno-associated virus, AAV)作為基因治療的載體,由于具有良好的安全性及較弱的免疫原性等優點,在動物實驗、臨床試驗中應用漸多[1-3]。目前制備重組AAV(recombinant AAV, rAAV)主要采用一種三質粒共轉染人胚腎293(HEK293)細胞的包裝系統[4]。如何讓三質粒高效共轉染HEK293宿主細胞是制備高滴度rAAV的關鍵。包裝系統rAAV使用的轉染試劑主要有商業化轉染試劑lipofectamine 2000[5]、磷酸鈣[4, 6]和聚乙烯亞胺(polyethyleneimine, PEI)[7-8]。商業化轉染試劑雖然轉染效率高,但由于價格昂貴,限制了其廣泛應用;而磷酸鈣法的轉染效率受轉染體系中pH值、溫度等諸多因素的影響。已有應用PEI轉染懸浮細胞[7-8]的報道,但PEI轉染貼壁細胞報道少見。本實驗擬用PEI在不同的轉染條件下轉染HEK293細胞以探索rAAV包裝條件。
1 材料與方法
1.1 材料
rAAV包裝系統(pAAV-RC、pHelper、pAAV-CMV-GFP)由袁振華博士饋贈;HEK293細胞儲存于中國科學院深圳先進技術研究院;高糖DMEM培養基(HG-DMEM)、胎牛血清(FBS)購自Hyclone公司;青鏈霉素混合液(P/S)購自Solarbio公司;胰蛋白酶(trypsin)購自Amresco公司;PEI購自Sigma公司;細胞培養耗材購自Corning公司。
1.2 方法
1.2.1 HEK293細胞培養
液氮罐中取出凍存的HEK293細胞,于37℃恒溫水浴箱中迅速解凍;然后用37℃預熱的HG-DMEM 1 000 r/min,離心5 min;去上清,將細胞重懸于HG-DMEM(含10% FBS和100 U/mL P/S)中再接種于10 cm培養皿,于37℃、5% CO2培養,根據營養狀況適時更換培養基;培養至細胞約80%融合后用0.25% trypsin-EDTA消化傳代于6孔細胞培養板(面積為9.6 cm2)。
1.2.2 三質粒共轉染293細胞
待6孔細胞培養板中HEK293細胞約80%融合開始轉染,轉染前2 h更換HG-DMEM(含2% FBS和100 U/mL P/S);制備PEI質粒轉染體系并渦旋振蕩混勻,室溫避光孵育15 min;然后將轉染復合物均勻滴加入6孔細胞培養板,在37℃、5% CO2培養6 h后更換HG-DMEM(含10% FBS和100 U/mL P/S)繼續培養。
1.2.3 檢測項目
①質粒總劑量(μg)對轉染效率的影響:轉染時三種質粒的物質的量比值為1 :1 :1時其轉染效率最佳[9]。據此,制備如表 1所示的不同質粒總劑量轉染體系,其中三種質粒pHelper、pAAV-RC和pAAV-CMV-GFP的物質的量比值為1 :1 :1,即質量比值為3 :2 :1。轉染后36 h檢測轉染效率。②PEI(μg)/質粒(μg)比值對轉染效率的影響:制備總質粒量為4.00μg,PEI分別為4.00、12.00、20.00、28.00μg的轉染復合物,即轉染體系中PEI(μg)/質粒(μg)比值分別為1 :1、3 :1、5 :1、7 :1。轉染后36 h檢測不同PEI(μg)/質粒(μg)比值的轉染效率。③轉染時間對轉染效率的影響:制備總質粒量為4.00μg、PEI為20.00μg的轉染復合物,轉染后檢測不同時間(12、24、36、48、60、72 h)的轉染效率,以確定轉染效率何時達到穩定水平。
1.2.4 轉染效率觀察與定量
倒置熒光顯微鏡下觀察和采集圖像,各轉染體系隨機采集6幅圖片;用ImagePro Plus6.0圖像分析軟件計算帶熒光細胞的面積占總面積的比例定量轉染效率。
1.2.5 統計學分析
各組實驗重復5次,采用SPSS 17.0統計學軟件處理數據,所有數據均用
2 結果
2.1 質粒總劑量對轉染效率的影響
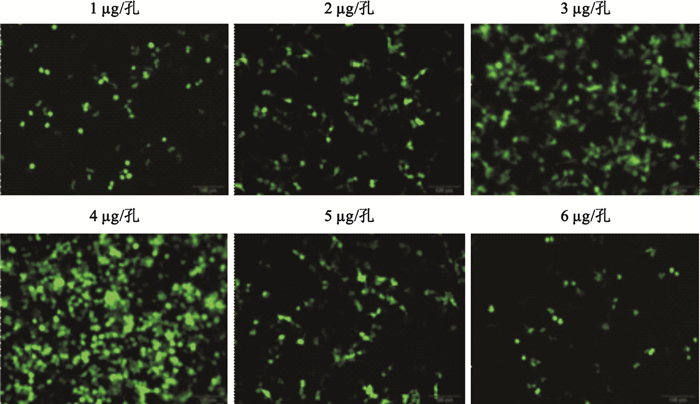
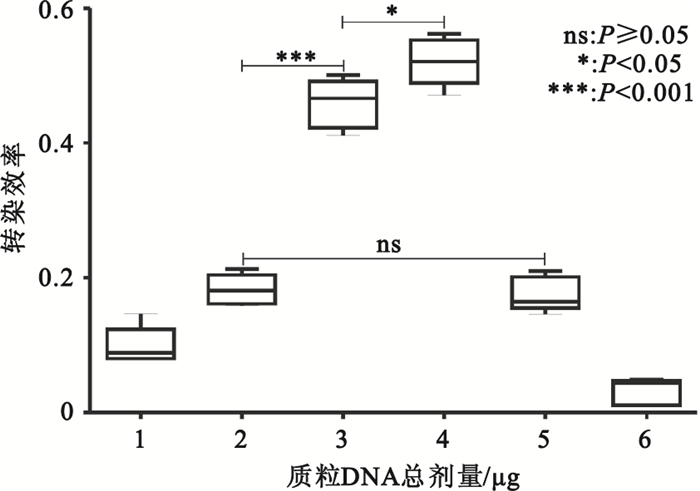
質粒總劑量為1~4μg/孔時,轉染效率隨轉染體系中質粒總劑量的增加而增高,在質粒劑量為3μg/孔時迅速增高,并于4μg/孔時達到高峰,隨后轉染效率隨質粒劑量增加迅速下降(見圖 1、圖 2)。
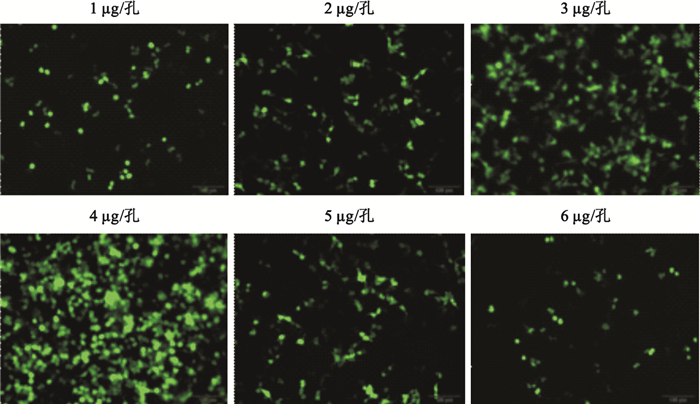 圖1
不同質粒劑量包裝體系轉染HEK293細胞的熒光顯微圖(標尺為100μm)
Figure1.
Representative fluorescence microscopic images of HEK293 cells transfected with packaging systems being subject to different plasmid DNA dosages (scale bars represents 100μm)
圖1
不同質粒劑量包裝體系轉染HEK293細胞的熒光顯微圖(標尺為100μm)
Figure1.
Representative fluorescence microscopic images of HEK293 cells transfected with packaging systems being subject to different plasmid DNA dosages (scale bars represents 100μm)
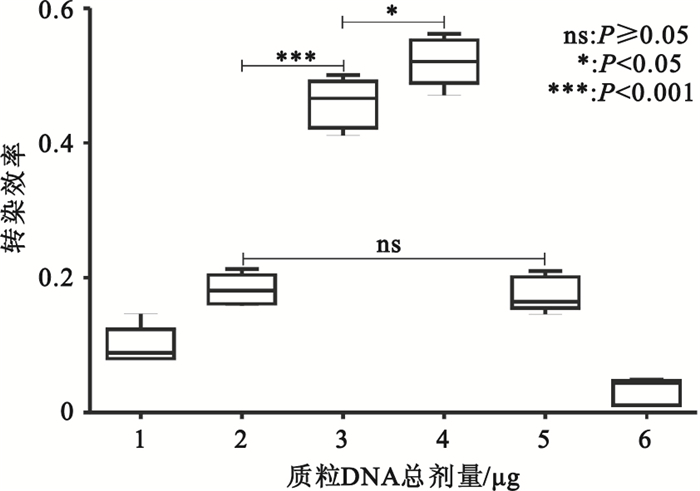 圖2
轉染后36 h不同質粒劑量的轉染效率
Figure2.
Transfection efficiency of different plasmid DNA dose at 36 h after transfection
圖2
轉染后36 h不同質粒劑量的轉染效率
Figure2.
Transfection efficiency of different plasmid DNA dose at 36 h after transfection
2.2 PEI/質粒比值對轉染效率的影響
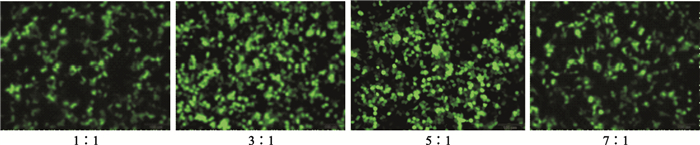
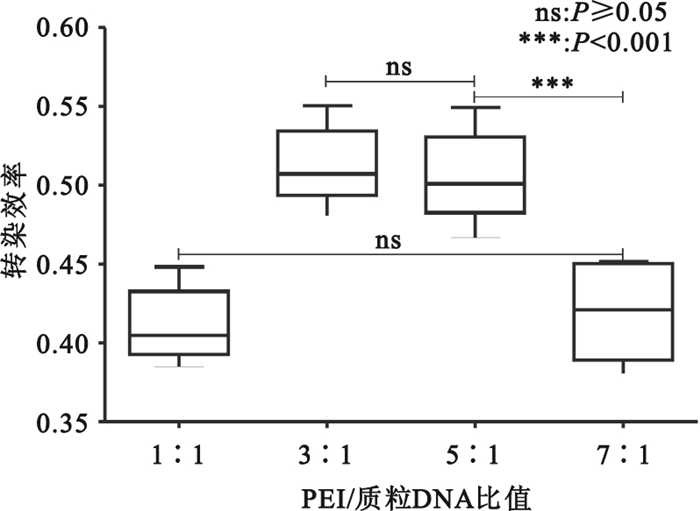
轉染體系中PEI/質粒比值為1 :1時,轉染效率較低;增加至3 :1、5 :1時,轉染效率增高,但進一步增加PEI/質粒比值,轉染效率顯著下降(見圖 3、圖 4)。
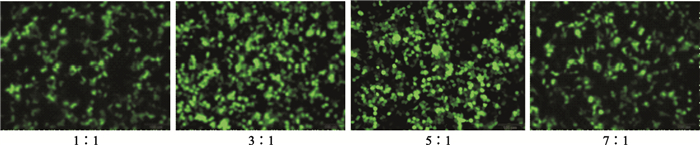 圖3
不同PEI/Plasmid比值包裝體系轉染HEK293細胞的熒光顯微圖(標尺為100μm)
Figure3.
Representative fluorescence microscopic images of HEK293 cells transfected with packaging systems being subject to different PEI/Plasmid ratios (scale bars represents 100μm)
圖3
不同PEI/Plasmid比值包裝體系轉染HEK293細胞的熒光顯微圖(標尺為100μm)
Figure3.
Representative fluorescence microscopic images of HEK293 cells transfected with packaging systems being subject to different PEI/Plasmid ratios (scale bars represents 100μm)
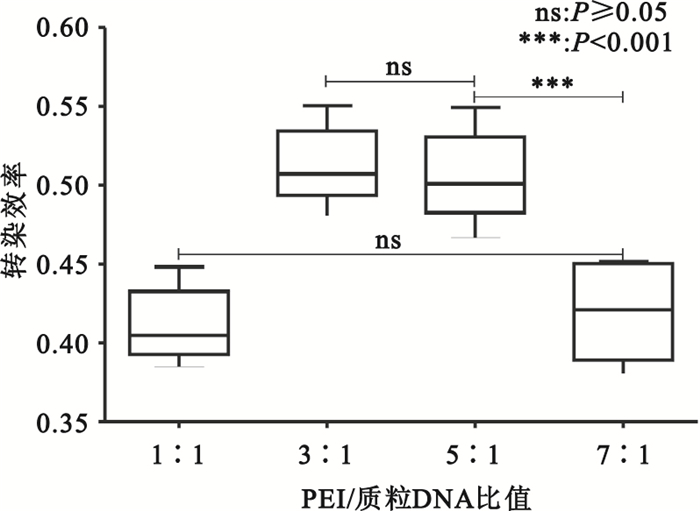 圖4
轉染后36 h不同PEI/Plasmid比值的轉染效率
Figure4.
Transfection efficiency of different PEI/Plasmid value at 36 h after transfection
圖4
轉染后36 h不同PEI/Plasmid比值的轉染效率
Figure4.
Transfection efficiency of different PEI/Plasmid value at 36 h after transfection
2.3 轉染時間對轉染效率的影響
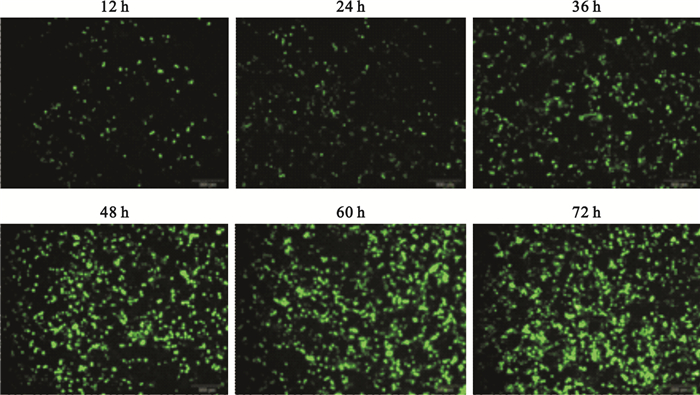
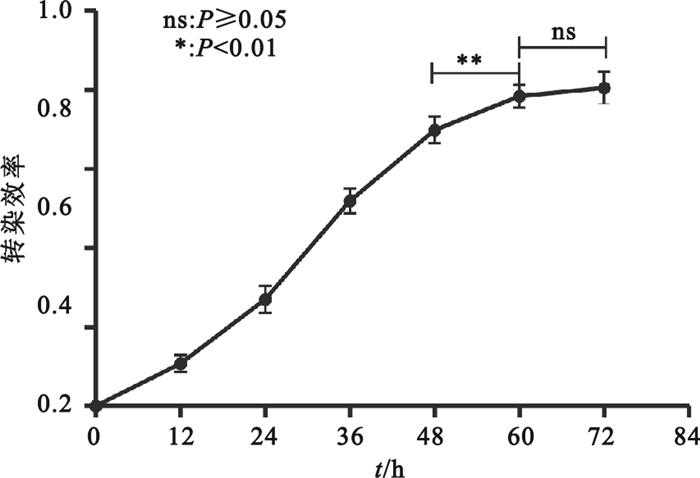
PEI介導pAAV-RC、pHelper、pAAV-CMV-GFP三質粒共轉染HEK293細胞,轉染效率-轉染時間曲線為S型增長曲線,轉染效率在轉染后48 h內呈指數增高,隨后轉染效率增長減慢,轉染后60 h轉染效率達到平臺期(見圖 5、圖 6)。
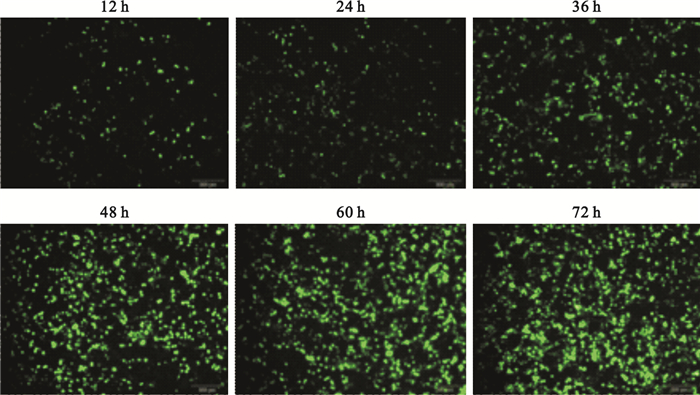 圖5
PEI介導三質粒包裝系統轉染HEK293細胞不同時間的熒光顯微圖(標尺為200μm)
Figure5.
Representative fluorescence microscopic images of HEK293 cells transfected with PEI-mediated triple plasmids packaging system in different time points (scale bars represent 200μm)
圖5
PEI介導三質粒包裝系統轉染HEK293細胞不同時間的熒光顯微圖(標尺為200μm)
Figure5.
Representative fluorescence microscopic images of HEK293 cells transfected with PEI-mediated triple plasmids packaging system in different time points (scale bars represent 200μm)
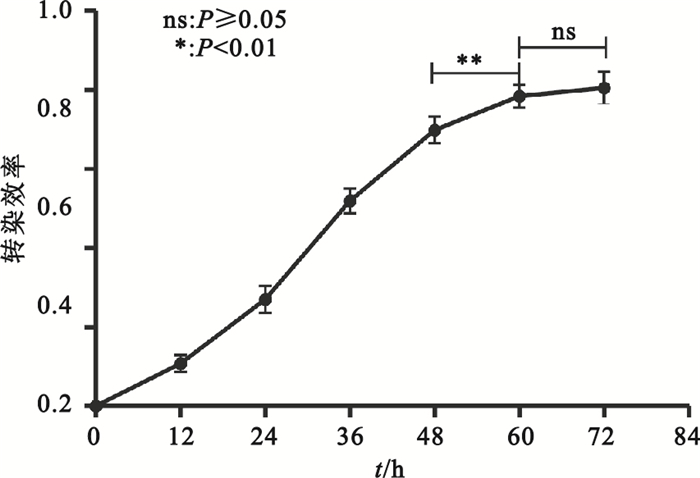 圖6
PEI介導三質粒共轉染的轉染效率-轉染時間曲線
Figure6.
Transfection efficiency-time curve of PEI-mediated triple plasmids cotransfection
圖6
PEI介導三質粒共轉染的轉染效率-轉染時間曲線
Figure6.
Transfection efficiency-time curve of PEI-mediated triple plasmids cotransfection
3 討論
AAV作為基因治療的載體已應用于Ⅰ期~Ⅲ期臨床試驗中[1-3],但尚未大規模制備rAAV是限制其臨床應用的主要因素之一。實驗室中的rAAV生產系統主要是一種三質粒共轉染HEK293宿主細胞的包裝系統[4]。這一包裝系統由4部分組成:①外源基因載體質粒,由兩個ITR序列及位于兩個ITR序列之間取代野生型AAV編碼序列的外源基因表達盒構成;②包裝質粒pAAV-RC,攜帶表達AAV復制蛋白和外殼蛋白的Rep和Cap基因;③輔助質粒pHelper,攜帶提供輔助功能的腺病毒E2a、E4和VA RNA基因;④宿主細胞HEK293細胞,攜帶提供輔助功能的腺病毒E1基因。大規模制備rAAV最先需要解決的問題是,如何使三種質粒高效轉染宿主細胞HEK293細胞。而運用何種方法轉染HEK293細胞尚無統一的標準方法。本試驗對PEI法轉染HEK293細胞的轉染條件進行優化,篩選出高效穩定的rAAV包裝條件。
PEI通過與DNA結合形成帶正電荷的微粒,黏合到帶有負電荷的細胞表面殘基,并經胞吞作用進入細胞。復合物在胞質中拆解后,DNA即可自由地融合到細胞核中[10-11]。因此,PEI轉染效率的提高與帶正電荷的轉染復合物微粒的形成密切相關。質粒的量直接影響轉染復合物顆粒的形成的多少。質粒劑量過少,轉染復合物微粒形成則較少,轉染效率則低。而質粒劑量過多,由于外源基因表達受攝入細胞的轉染復合物量的影響,即過量的轉染復合物能抑制外源基因的表達[12],因此,同樣不利于轉染效率的提高。本實驗中PEI的轉染效率在低劑量質粒(1、2μg/孔)時轉染效率很低(0.099±0.028、0.182±0.022),但在質粒劑量為3μg/孔時迅速增高(0.459±0.036),并于4μg/孔時達到高峰(0.521±0.035)。但進一步增加質粒劑量(5、6μg/孔)轉染效率顯著下降(0.176±0.026、0.032±0.019)。表明只有合適的質粒劑量才能提高轉染效率。
轉染體系中即使質粒劑量合適,PEI/質粒比值也影響著轉染效率。比值過低,一方面少量PEI僅能結合少量質粒,轉染復合物微粒形成較少;另一方面,未結合的質粒DNA所帶的負電荷也不利于有效轉染。比值過高,雖然能形成足夠的帶正電荷轉染復合物微粒,但由于PEI具有細胞毒性[13],能直接使細胞膜破碎導致細胞壞死(即刻效應),或胞吞后間接使線粒體膜破碎,最終引起細胞凋亡(延遲效應)[14]。因此,過高劑量的PEI也不會提高轉染效率。本實驗顯示,轉染體系中PEI/質粒比值較低(1 :1)時,轉染效率也較低(0.411±0.024);隨著比值增加(3 :1、5 :1),轉染效率增高并維持在穩定水平(0.513±0.025、0.506±0.030),但該比值進一步增加至7:1時轉染效率反而降低(0.420±0.031)。提示適中的PEI(μg)/質粒(μg)比值對轉染效率至關重要。
此外,本實驗通過優化PEI轉染體系探索了轉染效率與時間之間的關系。實驗顯示,轉染效率-轉染時間曲線呈S型增長曲線,轉染效率在轉染后48 h內呈指數增高(12 h:0.108±0.022;24 h:0.270±0.034;36 h:0.520±0.032),隨后轉染效率增長減慢,于轉染后60 h轉染效率達到平臺期(60 h:0.784±0.028;72 h:0.806±0.040)。因此,轉染后72 h收獲病毒較為合適。
綜上所述,質粒劑量、PEI/質粒比值和轉染時間均影響轉染效率,通過優化這些變量可以提高轉染效率,增加病毒產量。
引言
近年來,腺相關病毒(adeno-associated virus, AAV)作為基因治療的載體,由于具有良好的安全性及較弱的免疫原性等優點,在動物實驗、臨床試驗中應用漸多[1-3]。目前制備重組AAV(recombinant AAV, rAAV)主要采用一種三質粒共轉染人胚腎293(HEK293)細胞的包裝系統[4]。如何讓三質粒高效共轉染HEK293宿主細胞是制備高滴度rAAV的關鍵。包裝系統rAAV使用的轉染試劑主要有商業化轉染試劑lipofectamine 2000[5]、磷酸鈣[4, 6]和聚乙烯亞胺(polyethyleneimine, PEI)[7-8]。商業化轉染試劑雖然轉染效率高,但由于價格昂貴,限制了其廣泛應用;而磷酸鈣法的轉染效率受轉染體系中pH值、溫度等諸多因素的影響。已有應用PEI轉染懸浮細胞[7-8]的報道,但PEI轉染貼壁細胞報道少見。本實驗擬用PEI在不同的轉染條件下轉染HEK293細胞以探索rAAV包裝條件。
1 材料與方法
1.1 材料
rAAV包裝系統(pAAV-RC、pHelper、pAAV-CMV-GFP)由袁振華博士饋贈;HEK293細胞儲存于中國科學院深圳先進技術研究院;高糖DMEM培養基(HG-DMEM)、胎牛血清(FBS)購自Hyclone公司;青鏈霉素混合液(P/S)購自Solarbio公司;胰蛋白酶(trypsin)購自Amresco公司;PEI購自Sigma公司;細胞培養耗材購自Corning公司。
1.2 方法
1.2.1 HEK293細胞培養
液氮罐中取出凍存的HEK293細胞,于37℃恒溫水浴箱中迅速解凍;然后用37℃預熱的HG-DMEM 1 000 r/min,離心5 min;去上清,將細胞重懸于HG-DMEM(含10% FBS和100 U/mL P/S)中再接種于10 cm培養皿,于37℃、5% CO2培養,根據營養狀況適時更換培養基;培養至細胞約80%融合后用0.25% trypsin-EDTA消化傳代于6孔細胞培養板(面積為9.6 cm2)。
1.2.2 三質粒共轉染293細胞
待6孔細胞培養板中HEK293細胞約80%融合開始轉染,轉染前2 h更換HG-DMEM(含2% FBS和100 U/mL P/S);制備PEI質粒轉染體系并渦旋振蕩混勻,室溫避光孵育15 min;然后將轉染復合物均勻滴加入6孔細胞培養板,在37℃、5% CO2培養6 h后更換HG-DMEM(含10% FBS和100 U/mL P/S)繼續培養。
1.2.3 檢測項目
①質粒總劑量(μg)對轉染效率的影響:轉染時三種質粒的物質的量比值為1 :1 :1時其轉染效率最佳[9]。據此,制備如表 1所示的不同質粒總劑量轉染體系,其中三種質粒pHelper、pAAV-RC和pAAV-CMV-GFP的物質的量比值為1 :1 :1,即質量比值為3 :2 :1。轉染后36 h檢測轉染效率。②PEI(μg)/質粒(μg)比值對轉染效率的影響:制備總質粒量為4.00μg,PEI分別為4.00、12.00、20.00、28.00μg的轉染復合物,即轉染體系中PEI(μg)/質粒(μg)比值分別為1 :1、3 :1、5 :1、7 :1。轉染后36 h檢測不同PEI(μg)/質粒(μg)比值的轉染效率。③轉染時間對轉染效率的影響:制備總質粒量為4.00μg、PEI為20.00μg的轉染復合物,轉染后檢測不同時間(12、24、36、48、60、72 h)的轉染效率,以確定轉染效率何時達到穩定水平。
1.2.4 轉染效率觀察與定量
倒置熒光顯微鏡下觀察和采集圖像,各轉染體系隨機采集6幅圖片;用ImagePro Plus6.0圖像分析軟件計算帶熒光細胞的面積占總面積的比例定量轉染效率。
1.2.5 統計學分析
各組實驗重復5次,采用SPSS 17.0統計學軟件處理數據,所有數據均用
2 結果
2.1 質粒總劑量對轉染效率的影響
質粒總劑量為1~4μg/孔時,轉染效率隨轉染體系中質粒總劑量的增加而增高,在質粒劑量為3μg/孔時迅速增高,并于4μg/孔時達到高峰,隨后轉染效率隨質粒劑量增加迅速下降(見圖 1、圖 2)。
 圖1
不同質粒劑量包裝體系轉染HEK293細胞的熒光顯微圖(標尺為100μm)
Figure1.
Representative fluorescence microscopic images of HEK293 cells transfected with packaging systems being subject to different plasmid DNA dosages (scale bars represents 100μm)
圖1
不同質粒劑量包裝體系轉染HEK293細胞的熒光顯微圖(標尺為100μm)
Figure1.
Representative fluorescence microscopic images of HEK293 cells transfected with packaging systems being subject to different plasmid DNA dosages (scale bars represents 100μm)
 圖2
轉染后36 h不同質粒劑量的轉染效率
Figure2.
Transfection efficiency of different plasmid DNA dose at 36 h after transfection
圖2
轉染后36 h不同質粒劑量的轉染效率
Figure2.
Transfection efficiency of different plasmid DNA dose at 36 h after transfection
2.2 PEI/質粒比值對轉染效率的影響
轉染體系中PEI/質粒比值為1 :1時,轉染效率較低;增加至3 :1、5 :1時,轉染效率增高,但進一步增加PEI/質粒比值,轉染效率顯著下降(見圖 3、圖 4)。
 圖3
不同PEI/Plasmid比值包裝體系轉染HEK293細胞的熒光顯微圖(標尺為100μm)
Figure3.
Representative fluorescence microscopic images of HEK293 cells transfected with packaging systems being subject to different PEI/Plasmid ratios (scale bars represents 100μm)
圖3
不同PEI/Plasmid比值包裝體系轉染HEK293細胞的熒光顯微圖(標尺為100μm)
Figure3.
Representative fluorescence microscopic images of HEK293 cells transfected with packaging systems being subject to different PEI/Plasmid ratios (scale bars represents 100μm)
 圖4
轉染后36 h不同PEI/Plasmid比值的轉染效率
Figure4.
Transfection efficiency of different PEI/Plasmid value at 36 h after transfection
圖4
轉染后36 h不同PEI/Plasmid比值的轉染效率
Figure4.
Transfection efficiency of different PEI/Plasmid value at 36 h after transfection
2.3 轉染時間對轉染效率的影響
PEI介導pAAV-RC、pHelper、pAAV-CMV-GFP三質粒共轉染HEK293細胞,轉染效率-轉染時間曲線為S型增長曲線,轉染效率在轉染后48 h內呈指數增高,隨后轉染效率增長減慢,轉染后60 h轉染效率達到平臺期(見圖 5、圖 6)。
 圖5
PEI介導三質粒包裝系統轉染HEK293細胞不同時間的熒光顯微圖(標尺為200μm)
Figure5.
Representative fluorescence microscopic images of HEK293 cells transfected with PEI-mediated triple plasmids packaging system in different time points (scale bars represent 200μm)
圖5
PEI介導三質粒包裝系統轉染HEK293細胞不同時間的熒光顯微圖(標尺為200μm)
Figure5.
Representative fluorescence microscopic images of HEK293 cells transfected with PEI-mediated triple plasmids packaging system in different time points (scale bars represent 200μm)
 圖6
PEI介導三質粒共轉染的轉染效率-轉染時間曲線
Figure6.
Transfection efficiency-time curve of PEI-mediated triple plasmids cotransfection
圖6
PEI介導三質粒共轉染的轉染效率-轉染時間曲線
Figure6.
Transfection efficiency-time curve of PEI-mediated triple plasmids cotransfection
3 討論
AAV作為基因治療的載體已應用于Ⅰ期~Ⅲ期臨床試驗中[1-3],但尚未大規模制備rAAV是限制其臨床應用的主要因素之一。實驗室中的rAAV生產系統主要是一種三質粒共轉染HEK293宿主細胞的包裝系統[4]。這一包裝系統由4部分組成:①外源基因載體質粒,由兩個ITR序列及位于兩個ITR序列之間取代野生型AAV編碼序列的外源基因表達盒構成;②包裝質粒pAAV-RC,攜帶表達AAV復制蛋白和外殼蛋白的Rep和Cap基因;③輔助質粒pHelper,攜帶提供輔助功能的腺病毒E2a、E4和VA RNA基因;④宿主細胞HEK293細胞,攜帶提供輔助功能的腺病毒E1基因。大規模制備rAAV最先需要解決的問題是,如何使三種質粒高效轉染宿主細胞HEK293細胞。而運用何種方法轉染HEK293細胞尚無統一的標準方法。本試驗對PEI法轉染HEK293細胞的轉染條件進行優化,篩選出高效穩定的rAAV包裝條件。
PEI通過與DNA結合形成帶正電荷的微粒,黏合到帶有負電荷的細胞表面殘基,并經胞吞作用進入細胞。復合物在胞質中拆解后,DNA即可自由地融合到細胞核中[10-11]。因此,PEI轉染效率的提高與帶正電荷的轉染復合物微粒的形成密切相關。質粒的量直接影響轉染復合物顆粒的形成的多少。質粒劑量過少,轉染復合物微粒形成則較少,轉染效率則低。而質粒劑量過多,由于外源基因表達受攝入細胞的轉染復合物量的影響,即過量的轉染復合物能抑制外源基因的表達[12],因此,同樣不利于轉染效率的提高。本實驗中PEI的轉染效率在低劑量質粒(1、2μg/孔)時轉染效率很低(0.099±0.028、0.182±0.022),但在質粒劑量為3μg/孔時迅速增高(0.459±0.036),并于4μg/孔時達到高峰(0.521±0.035)。但進一步增加質粒劑量(5、6μg/孔)轉染效率顯著下降(0.176±0.026、0.032±0.019)。表明只有合適的質粒劑量才能提高轉染效率。
轉染體系中即使質粒劑量合適,PEI/質粒比值也影響著轉染效率。比值過低,一方面少量PEI僅能結合少量質粒,轉染復合物微粒形成較少;另一方面,未結合的質粒DNA所帶的負電荷也不利于有效轉染。比值過高,雖然能形成足夠的帶正電荷轉染復合物微粒,但由于PEI具有細胞毒性[13],能直接使細胞膜破碎導致細胞壞死(即刻效應),或胞吞后間接使線粒體膜破碎,最終引起細胞凋亡(延遲效應)[14]。因此,過高劑量的PEI也不會提高轉染效率。本實驗顯示,轉染體系中PEI/質粒比值較低(1 :1)時,轉染效率也較低(0.411±0.024);隨著比值增加(3 :1、5 :1),轉染效率增高并維持在穩定水平(0.513±0.025、0.506±0.030),但該比值進一步增加至7:1時轉染效率反而降低(0.420±0.031)。提示適中的PEI(μg)/質粒(μg)比值對轉染效率至關重要。
此外,本實驗通過優化PEI轉染體系探索了轉染效率與時間之間的關系。實驗顯示,轉染效率-轉染時間曲線呈S型增長曲線,轉染效率在轉染后48 h內呈指數增高(12 h:0.108±0.022;24 h:0.270±0.034;36 h:0.520±0.032),隨后轉染效率增長減慢,于轉染后60 h轉染效率達到平臺期(60 h:0.784±0.028;72 h:0.806±0.040)。因此,轉染后72 h收獲病毒較為合適。
綜上所述,質粒劑量、PEI/質粒比值和轉染時間均影響轉染效率,通過優化這些變量可以提高轉染效率,增加病毒產量。