由于具有高強度的靶向性與優良的生物相容性等優勢, 納米載藥顆粒已被廣泛應用于癌癥的診斷和治療中。然而當納米顆粒被癌細胞識別并內吞后, 其對癌細胞遷移行為的影響卻鮮有報道。在本研究中, 我們采用自組裝技術(SAMs)成功制備了具有不同化學官能團(CH3、OH、COOH和NH2)的納米金顆粒(Au NPs), 通過透射電鏡觀察Au NPs在人肝癌細胞株HepG2細胞內的分布情況, 采用MTT法檢測其對該細胞增殖的影響, 同時利用劃痕損傷實驗模型和Transwell小室模型法觀察Au NPs對該細胞遷移的影響。結果顯示, 不同化學官能團修飾的納米金顆粒被細胞內吞后主要分布在囊泡邊緣或胞間連接處。此外, 我們發現不同化學官能團修飾的納米金均會對HepG2細胞的活性起到一定的抑制作用, 且隨著納米金粒子濃度的升高, 其細胞增殖能力逐漸降低。劃痕模型和Transwell模型結果證實不同表面化學官能團修飾的納米金顆粒對細胞遷移的影響均有差異, 與對照組比較, NH2-NPs、OH-NPs組顯著抑制了人肝癌細胞株HepG2的遷移行為。
引用本文: 洪錦勇, 尹紅梅, 沈陽, 閆志平, 劉靜霞, 周法庭, 夏慶, 劉肖珩. 表面化學修飾納米金粒子對肝癌細胞增殖和遷移的影響. 生物醫學工程學雜志, 2015, 32(2): 373-379. doi: 10.7507/1001-5515.20150068 復制
版權信息: ?四川大學華西醫院華西期刊社《生物醫學工程學雜志》版權所有,未經授權不得轉載、改編
引言
原發性肝癌是十分常見的惡性腫瘤,近年來在所有癌癥引起的死亡率中,肝癌僅次于肺癌排第二位。據統計,全世界每年有超過70萬病例死于肝癌[1]。在巴塞羅那肝癌不同期分類治療指南中指出,局部消融以及手術切除是治療極早期肝癌的首選方式,患者五年生存率達到50%左右;而處于晚期的肝癌患者,手術切除不再是首選,患者三年生存率不足40% [2]。由于肝癌細胞發生轉移是導致上述諸多治療方式失敗的最主要原因,因此尋求具有高效性和低毒性且能靶向治療的能夠抑制肝癌細胞遷移的方法尤為重要。用于臨床治療的抗腫瘤藥物,由于在體內循環中的溶解度低、穩定性差、半衰期短以及缺乏對腫瘤細胞的靶向性等缺點,在實際應用中具有很大的局限性。近年來,大量研究表明納米材料作為新型的藥物載體具有高度靶向定位的優勢,可以顯著提高藥物的利用率,減少藥物用量,并能夠實現對藥物的釋放控制,原本溶解迅速的藥物通過納米載體包被以后可以實現藥物的緩慢釋放,從而以最少的藥物劑量達到治療疾病的目的。除此之外,納米顆粒載體還能降低藥物對靶向位置的副作用和減小對其他相關器官的毒性作用,且成本較其他方法更為低廉。近年來,關于納米材料臨床應用的研究主要集中在化學傳感、成像以及靶向治療等方面[3]。最近有報道,納米顆粒(nanoparticles, NPs)被細胞內吞后具有一定的細胞毒性,并可誘導細胞凋亡、引起炎癥和DNA損傷等[4-5]。因此,關于納米顆粒在生物體內的相容性及其對細胞和靶向器官的安全性還需要繼續考察。由于納米載藥顆粒主要用于腫瘤的治療,在發揮其載藥及控釋作用的同時是否會對癌細胞的生物學行為特別是遷移能力有所影響,特別值得研究者關注。
1 材料與方法
1.1 材料
采用的人肝癌細胞株HepG2為本實驗室保存;胎牛血清購自復蒙公司;1640培養基和胰蛋白酶購自Invitrogen公司;Transwell小室購自Thermo公司;3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴鹽(MTT)購自Amresco公司,納米金(Au NPs)懸液(濃度100μg/mL,直徑15~20 nm)購自中科院物理研究所;正十二烷基硫醇[HS(CH2)11CH3]、11-氨基-1-十一烷硫醇[HS(CH2)11NH2]、11-巰基-1-十一烷醇[HS(CH2)11OH]、11-巰基十一烷酸[HS(CH2)11COOH]購自Sigma公司。
1.2 細胞培養
將HepG2細胞接種于50 mL規格的培養瓶中,加入7 mL 1640完全培養基(10%胎牛血清,100 mg/mL的鏈霉素,1×104 U/L青霉素),靜置培養于細胞培養箱中(37℃、5% CO2、飽和濕度)。待細胞株生長至鋪滿培養瓶培養面90%左右,用2.5%的胰蛋白酶處理至細胞形態變圓后終止消化,傳代培養,取對數生長期細胞進行實驗研究。
1.3 制備不同化學表面修飾的納米金懸液
我們采用自組裝技術(self-assembly techniques, SAMs)制備了5種具有不同表面化學官能團的納米金懸液:第1種為裸金(Au-NPs);第2種為帶有甲基的納米金(CH3-NPs),在裸金懸液中加入1 mmol/L的HS(CH2)11CH3,靜置過夜,然后加入0.25 mmol/L檸檬酸鈉、0.05% Tween 20,1 000 r/min離心5 min,除上清后再用純水重懸;第3種為帶有氨基的納米金(NH2-NPs),在裸金懸液中加入1 mmol/L的HS(CH2)11NH2,靜置過夜,然后加入0.25 mmol/L檸檬酸鈉、0.05% Tween,4 500 r/min離心1 h,除上清后再用純水重懸;第4種為帶有羧基的納米金(COOH-NPs),在裸金懸液中加1 mmol/L的HS(CH2)10COOH,靜置過夜,之后4 500 r/min離心30 min,除上清后再用純水重懸;第5種為帶有羥基的納米金(OH-NPs),在裸金懸液中加入1 mmol/L的HS(CH2)11OH,靜置過夜,1 000 r/min離心5 min,除上清后再用純水重懸。
1.4 表征不同化學表面修飾的納米金
量取5種納米金懸液各6 mL,稀釋于去離子水中至合適濃度后,超聲8 min使其分散均勻,靜置4 min。取少量上層液體中的樣品,緩慢放在玻片上,使其沉降8 min,并于烘箱中使其充分干燥,然后通過透射電子顯微鏡(transmission electron microscope, TEM,H-600IV,Japan)觀察并拍照。
分別取5種納米金懸液于1 mL離心管中,12 000 r/min離心12 min后去上清,加入0.9 mL二氯甲烷,10 000 r/min離心8 min,用以除掉懸液中的剩余硫醇,接著各組納米金中加入相同量的二氯甲烷,超聲15 min使其分散,然后將金納米顆粒懸浮液滴至膜片上,充分干燥,然后采用傅里葉變換紅外光譜儀(fourier transform infrared spectrometer, FTIR,Nicolet 6700,Thermo,USA)測定在波數4 000~400 cm-1的吸收光譜。
1.5 觀察納米金顆粒在HepG2細胞中的分布
將HepG2細胞計數后等量接種于6孔板上培養,待細胞融合度達到90%左右,六孔板6個孔分設為6個分組,每組均更換2 mL1640完全培養基,對照組加入200μL純水,5個實驗組中分別加入相應的納米金懸液200μL,培養24 h。用4℃PBS清洗3次6孔板,再用冰凍處理的刮子將細胞緩慢刮下,將刮下的細胞懸液移至1 mL離心管中,1800 r/min離心12 min,去掉上清液;緩緩加入0.5%戊二醛,4℃靜置10 min,12 000 r/min離心12 min,去掉上清液;用3%戊二醛處理使其固定,1%的四氧化鋨(OsO4)處理再次固定,利用丙酮依次脫水,Epon812包埋,半薄切片光學定位,超薄切片,醋酸鈾及枸櫞酸鉛雙重染色,TEM觀察不同納米金顆粒在HepG2細胞中的分布。
1.6 納米金顆粒對肝癌細胞HepG2活性的影響
取對數期HepG2細胞并調整其最佳細胞懸液濃度為1.5×105個/mL(我們通過設置幾組細胞濃度梯度,采用MTT比色法檢測體外細胞毒性后確定該最佳細胞懸液濃度),在96孔板的5個實驗組孔中加入100μL細胞懸液,同時設置調零孔(只含培養基)和對照孔(只含細胞懸液和相同濃度的藥物溶解介質),每孔設5個相同重復的孔,待其貼壁單層鋪滿后加入不同濃度的5種納米金顆粒懸液,濃度分別設置為1.875、3.75、7.5、15、30 mg/L。于孵箱中培養24 h后,每孔均加入20μL 0.5% MTT溶液,繼續培養4 h。然后終止培養,小心吸去孔中液體,每個孔中均加入150μL DMSO,避光慢速搖晃15 min,待觀察到結晶物充分溶解消失后,使用酶標儀測出各孔在570 nm波長處的吸光值,記錄數據,統計分析。
1.7 納米金顆粒對肝癌細胞HepG2橫向遷移的影響
將HepG2細胞計數后等量接種于6孔板上培養,待細胞融合度達到90%左右時,換不含血清的1640培養基饑餓處理12 h。10μL的槍頭刮出約500μm的損傷區域后用PBS洗凈懸浮的細胞,將6孔板設為6個組,均加入2 mL 1640完全培養基,其中對照組加入200μL純水,5個實驗組中上下室分別加入相應的納米金懸液200μL,重復該實驗3次,采用Picpic圖像分析軟件測量劃痕兩側的細胞遷移距離,并對所得數據進行統計學分析。
1.8 納米金顆粒對細胞縱向遷移的影響
將HepG2肝癌細胞接種于培養瓶中,待其融合度達到80%后,用胰蛋白酶將其消化制成細胞懸液,通過細胞計數板將細胞懸液中細胞數目控制為2×105個/mL,取200μL細胞懸液接種于Transwell小室中,小室置于24孔板中的小孔中,同時取600μL 1640完全培養基于24孔板中。待細胞融合度達到80%時,棄去培養基,用PBS洗兩次,再次在Transwell小室和24孔板中分別加入20μL和60μL培養基。設了6個分組,其中對照組中在Transwell小室和對應的24孔板小孔中分別加入20μL和60μL純水,5個實驗組則分別在Transwell小室和對應的24孔板小孔中加入20μL和60μL相應的納米金懸液,之后置于37℃、5% CO2的孵箱中于飽和濕度條件下靜置培養24 h。取出Transwell小室,棄去孔中培養基,用PBS洗兩遍,多聚甲醛固定30 min,將小室適當風干。0.1%的結晶紫染色25 min,然后用棉簽小心擦掉小室上層未遷移的細胞,PBS清洗3~5遍。400倍顯微鏡下隨機取5個視野觀察細胞,并照相計數。
1.9 統計分析
本實驗所有數據均為重復3次以上結果,表示為均數±標準差,采用SPSS 13.0統計軟件對數據采用一維方差分析組間差別比較和SNK法進行組間兩兩比較,以P<0.05為差異有統計學意義。
2 結果
2.1 不同化學表面納米金顆粒的材料學表征
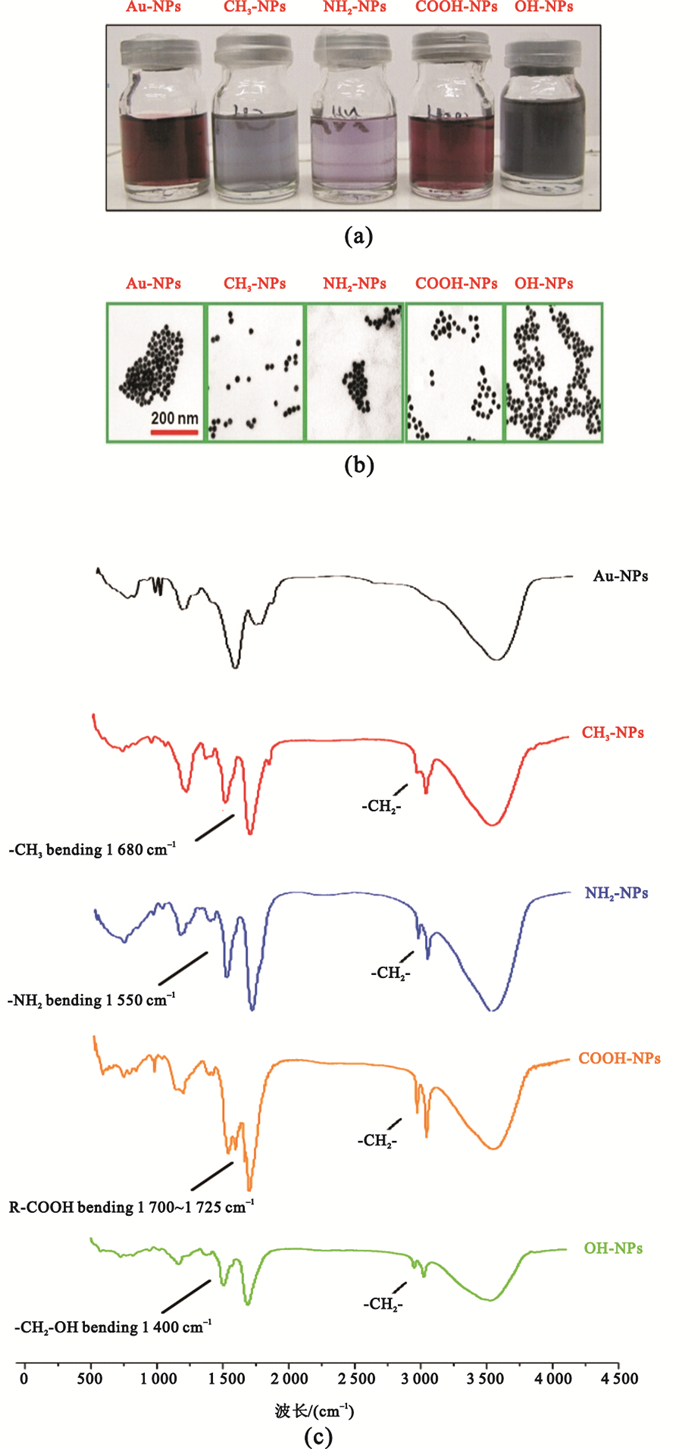
采用SAMs技術制備的納米顆粒懸浮溶液體系如圖 1(a)所示。由圖可見,5種納米金的純水懸浮溶液體系呈現出不同的顏色差異,初步證明了端基具有不同化學官能團的烷基硫醇已通過S-Au共價鍵結合到了納米金上。其中CH3-NPs和NH2-NPs組溶液顏色較淺,而COOH表面修飾的納米金(COOH-NPs組)和Au-NPs組為紫紅色,OH-NPs組呈現出較深的藍黑色。TEM觀察可知[見圖 1(b)],幾種納米金分散情況均較好,顆粒邊界清晰,沒有嚴重的聚集現象。不同官能團的Au-NPs顆粒形態并無顯著變化,根據標尺可辨析出其直徑仍保持15~20 nm。FTIR的結果可以看出[見圖 1(c)],組裝了不同官能團的4組樣品CH3-NPs、NH2-NPs、COOH-NPs和OH-NPs在2 918 cm-1和2 849 cm-1均出現了明顯的亞甲基(-CH2-)的反對稱和對稱伸縮振動峰νas(CH2)和νs(CH2),而Au-NPs組無此峰的存在。在4組樣品中2 584 cm-1未觀察到硫醇鍵(-S-H)的特征峰,證明烷基硫醇的-S-H已與Au-NPs結合,形成了新的共價Au-S鍵。此外,各組納米金均能發現其官能團的紅外特征峰,分別是-CH3的1 680 cm-1,-NH2在1 550 cm-1,-CH2-OH在1 400 cm-1以及-COOH在1 700~1 725 cm-1的特征吸收峰。該結果表明:SAMs技術能夠成功在納米金表面制備不同的化學官能團。
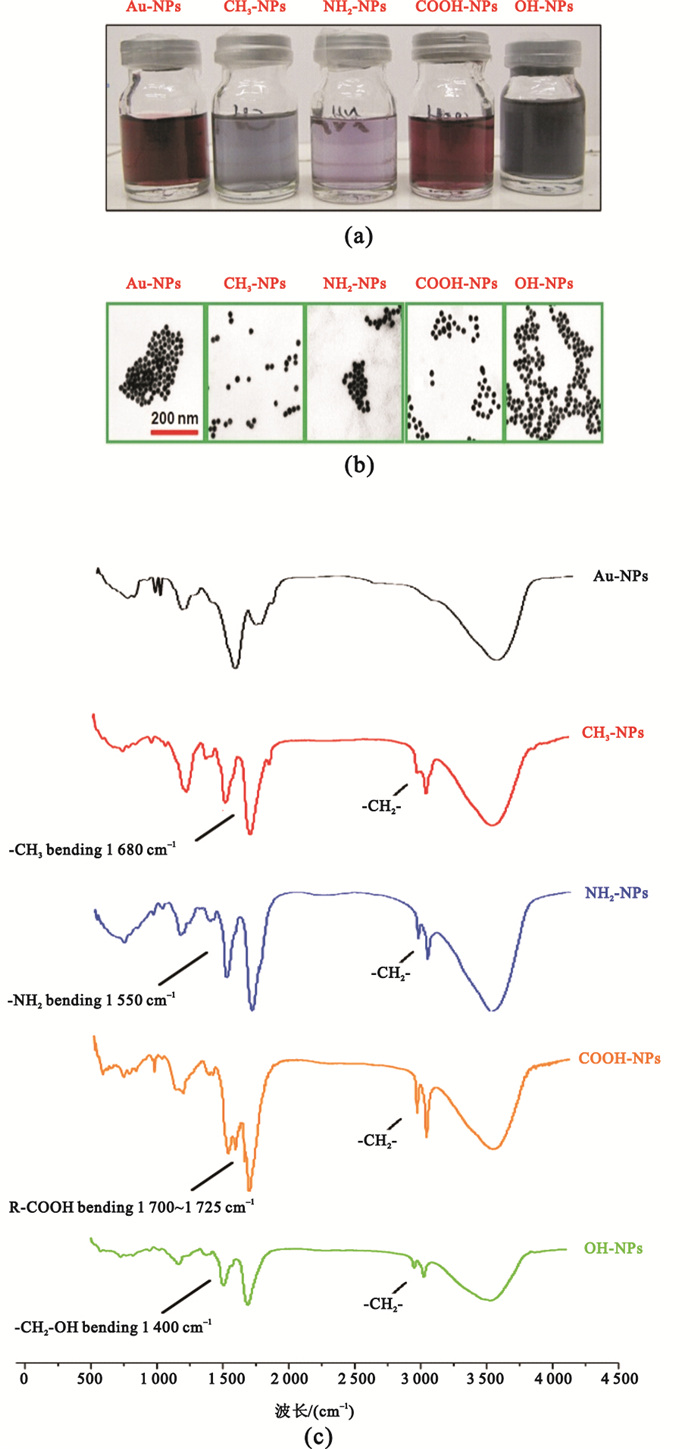 圖1
不同化學表面修飾納米金顆粒的表征
圖1
不同化學表面修飾納米金顆粒的表征
(a)不同納米金顆粒懸浮溶液的顏色變化;(b)不同納米金顆粒的透射電鏡圖;(c)不同納米金顆粒的紅外光譜圖
Figure1. characterization of Au NPs with different chemical function groups(a) the classical images of Au NPs; (b) TEM images of Au NPs; (c) FTIR Spectrum of Au NPs
2.2 納米金在HepG2細胞內的分布
用上述5種納米金處理HepG2細胞24 h后,TEM觀察細胞內納米金的分布。由圖 2可知,各組納米金均能有效地被HepG2細胞識別并吞噬,在24 h后仍能在細胞內觀察到大量聚集的納米金。這些納米金均主要分布在胞內的囊泡邊緣或細胞與細胞的連接處,而不是被囊泡所包裹(見圖 2中箭頭所示)。在細胞內分布的大量囊泡中均未觀察到納米金顆粒,這與本研究所選擇TEM觀察的時間點有關,在相對較長的24 h后,溶酶體無法降解納米金顆粒而將其排除胞外。同時,排除到胞外的納米金將可能被其他HepG2細胞所識別而再次內吞至胞內,完成多次循環。
 圖2
透射電鏡觀察不同化學官能團的納米金顆粒在肝癌細胞胞內的分布。
Figure2.
Uptake and distribution of Au NPs with different chemical function groups in HepG2 cells by TEM.
圖2
透射電鏡觀察不同化學官能團的納米金顆粒在肝癌細胞胞內的分布。
Figure2.
Uptake and distribution of Au NPs with different chemical function groups in HepG2 cells by TEM.
2.3 不同化學表面修飾的納米金顆粒對HepG2細胞增殖影響
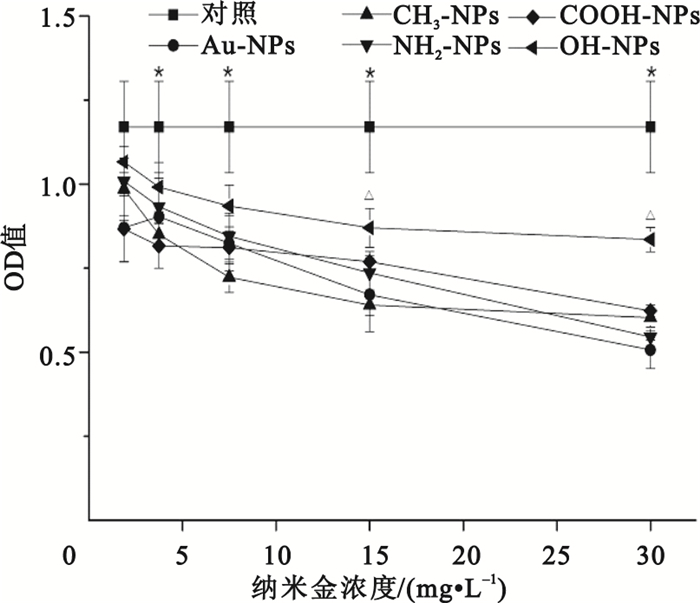
圖 3所示是5種不同化學表面修飾的納米金加入培養基與HepG2細胞接觸培養24 h后對細胞增殖的影響。由圖可知,經過24 h的培養后,不同濃度的納米金組與對照組相比其OD值均有一定程度上降低,呈濃度依賴性,該結果表明不同濃度的納米金對HepG2細胞的增殖均有一定程度的影響。進一步對結果進行統計分析發現,當納米金濃度為1.875μg/mL時,我們發現COOH-NPs組的OD值小于對照組(P<0.05),說明COOH-NPs組顯著降低了HepG2細胞的活性和增殖,而其他幾組(Au-NPs、CH3-NPs、NH2-NPs和OH-NPs組)與對照組之間的差異不具有統計學意義(P>0.05),證明以上幾組納米金在低濃度下不影響細胞的活性及增殖。而當Au-NPs濃度增至3.75 mg/L時,所有實驗組的OD值均小于對照組(P<0.05),證明在較高濃度下各組納米金均會影響細胞的活性,降低HepG2細胞活性和增殖。在幾組樣品中,OH-NPs相對于其它組對細胞的增殖影響最小。在15、30 mg/L的高濃度納米金作用下,OH-NPs組的細胞活性均顯著高于其余幾組納米金顆粒組(P<0.05)。而在相同濃度下Au-NPs、CH3-NPs、NH2-NPs、COOH-NPs各組間的細胞活性之間差異不具有統計學意義(P>0.05)。
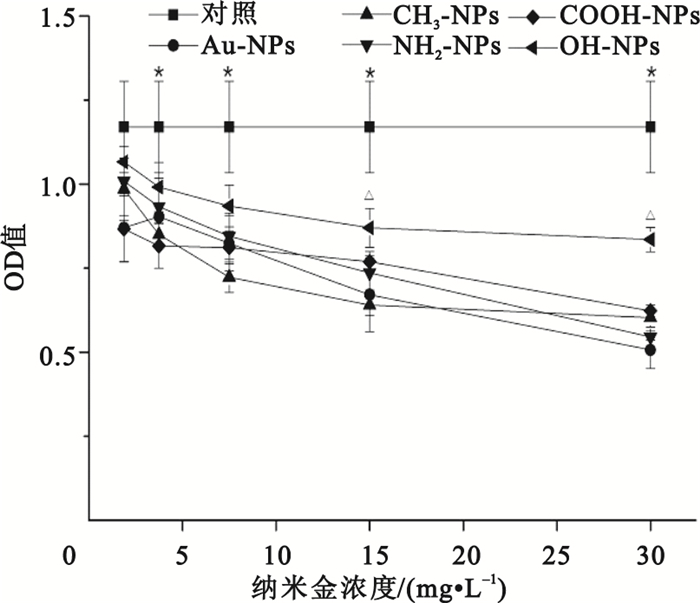 圖3
MTT比色法測定不同的納米金對HepG2細胞增殖的影響
圖3
MTT比色法測定不同的納米金對HepG2細胞增殖的影響
*
*
2.4 不同化學表面修飾的納米金對HepG2細胞橫向遷移的影響
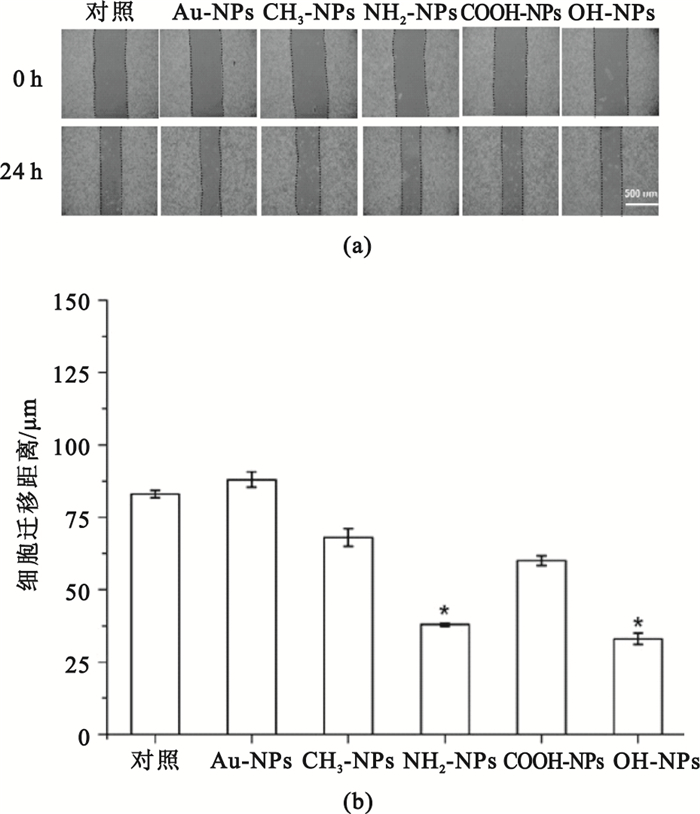
圖 4(a)所示的是劃痕法測定Au-NPs、CH3-NPs、NH2-NPs、COOH-NPs和OH-NPs分別與肝癌細胞HepG2接觸培養24 h后細胞的橫向遷移圖片。由圖 4(b)統計結果可知,NH2-NPs和OH-NPs組的遷移距離小于對照組(P<0.05),即顯著抑制了HepG2細胞遷移。而Au-NPs、CH3-NPs、COOH-NPs組與對照組之間的差異不具有統計學意義(P>0.05),說明它們對HepG2細胞的遷移無明顯的作用。
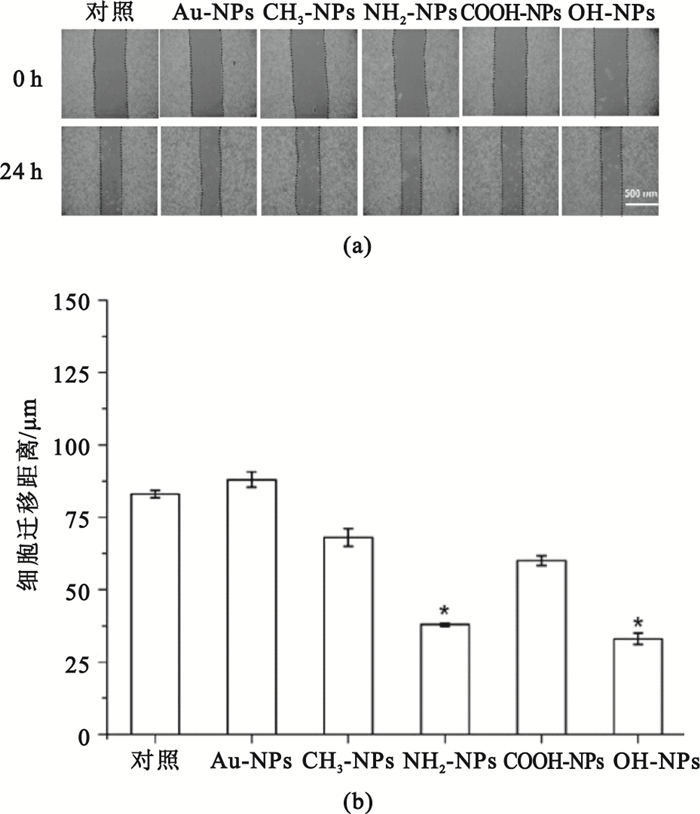 圖4
劃痕法測定不同化學表面官能團修飾的納米金對HepG2細胞橫向遷移的影響
圖4
劃痕法測定不同化學表面官能團修飾的納米金對HepG2細胞橫向遷移的影響
(a)不同表面化學的納米金對HepG2細胞橫向遷移的影響;(b)HepG2細胞遷移距離統計圖(*
(a) HepG2 cell migration in parallel direction at 0 and 24 h, respectively; (b) statistical results of cell migration distance (*
2.5 不同化學表面官能團修飾的納米金對細胞縱向遷移的影響
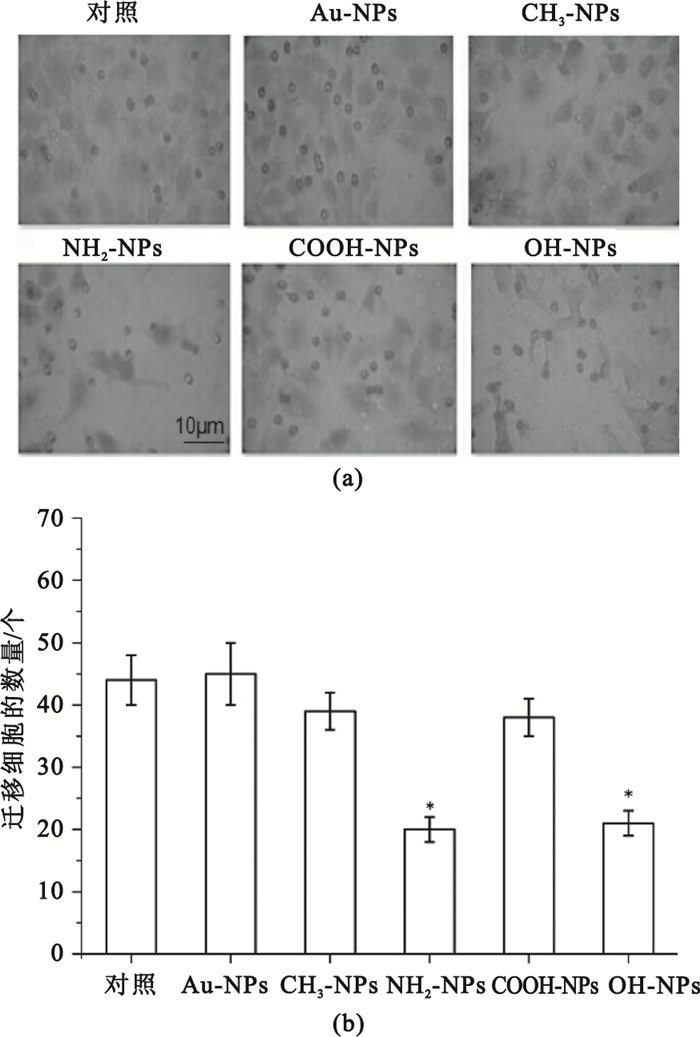
圖 5所示是采用Transwell小室模型測定Au-NPs、CH3-NPs、NH2-NPs、COOH-NPs和OH-NPs分別與肝癌細胞接觸培養24 h后肝癌細胞縱向遷移的情況。由圖 5統計結果可知,Au-NPs、CH3-NPs、COOH-NPs組在24 h后穿過Transwell小室膜的HepG2細胞的個數較為相近,與對照組之間的差異不具有統計學意義(P>0.05),而NH2-NPs和OH-NPs組細胞遷移數量明顯少于對照組(P<0.05),其結果與橫向遷移一致,證明了NH2-NPs和OH-NPs組能夠顯著抑制HepG2細胞遷移。
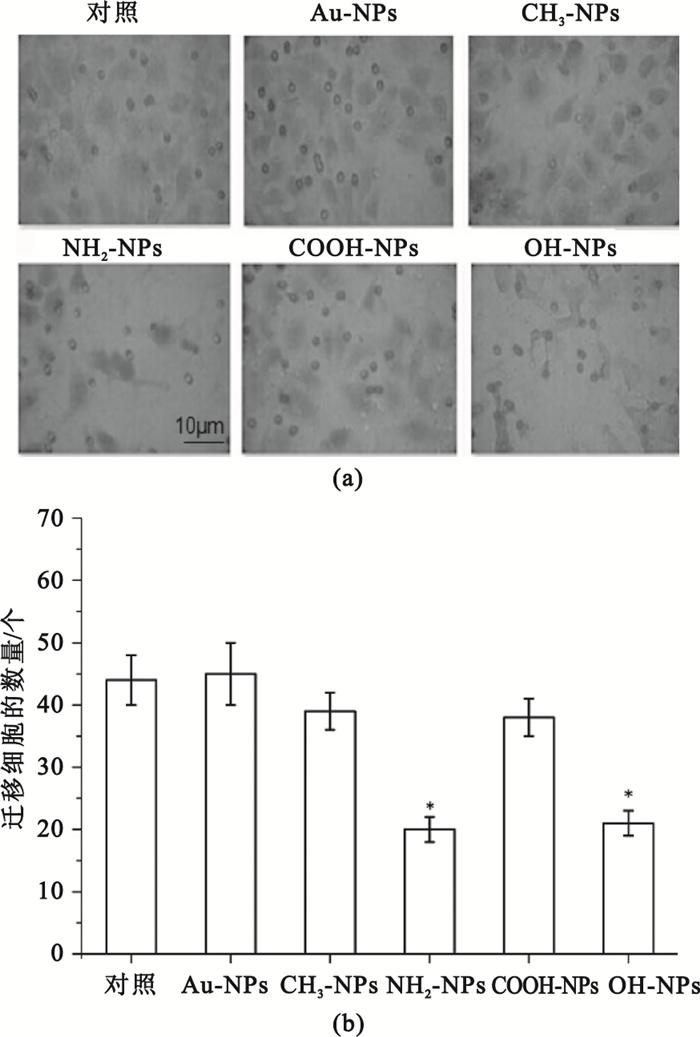 圖5
Transwell測定不同表面化學的納米金對HepG2細胞縱向遷移的影響
圖5
Transwell測定不同表面化學的納米金對HepG2細胞縱向遷移的影響
(a)不同表面化學的納米金對HepG2細胞縱向遷移的影響;(b)HepG2細胞遷移數量統計圖(*
(a) images illustrating HepG2 cell migration in vertical direction at 0 and 24 h, respectively; (b) statistical results of numbers of cell in migration(*
3 討論
近些年來,作為腫瘤診斷以及治療的藥物載體,納米材料在臨床上已經得到了十分廣泛的應用。納米材料載體在病灶部位的定位具有靶向性的優勢,從而能夠達到以微劑量靶向治療癌癥的目的。其不僅可以減小藥物的副作用,而且能夠提高藥物的吸收和利用率,同時還可以降低其自身的細胞毒性。納米金作為其中一種納米材料載體,不僅制備方法
簡便,結構穩定,外形規則,而且便于使用紫外可見分光光度、核磁共振和紅外光譜分析等幾種表征分析手段。同時納米金具有低細胞毒性、良好的吸收率和分散率等優勢,作為模式材料被廣泛用于納米材料方面的研究,備受研究者的青睞[6]。1994年,首次有文獻報道在納米金表面成功自組裝上的烷基硫醇單分子層[7]是通過S-Au鍵的強吸附力制備而成的自組裝單分子層,這種通過控制材料表面的修飾組成從而獲得預期表面化學性質的方法,為研究構建生物大分子與材料表面之間互相作用的良好材料模型奠定了基礎[8]。納米金顆粒采用了SAMs技術可以使其具有很多不同的特性,是改性方法中應用較多的一種[9-11]。我們可以根據自己的需求來改變SAMs的組裝成分,從而使納米金表面具有我們想要的化學性質。例如,我們可以組裝親/疏水性不同的基團(OH、NH2、COOH和CH3)[12],不同的官能團由于其自身的親/疏水性而使材料表面的親/疏水性也發生變化,同時納米金表面的各向異性表面能可以有效地被硫醇分子消除,從而使表面性質幾乎趨于一致,進而獲得較為整齊均勻的攜有硫醇單分子層的納米金[13-14]。
在本研究中,我們采用SAMS技術成功制備了修飾有不同官能團(CH3、OH、COOH和NH2)的納米金懸液。不同納米金懸浮液呈現出不同顏色,與文獻報道中描述相符,并且我們通過透射電鏡觀察納米金懸液,發現其分散情況均較為理想。納米材料進入細胞以及在細胞內作為載體的運輸途徑取決于其結構和物理化學性質,比如大小、成分、形狀、表面電荷以及親/疏水性等,此外,細胞的種類也決定了材料的內吞和其在胞內的存在和排出方式。那么,我們制備的納米金的這些理化性質對肝癌細胞HepG2攝入該顆粒及其在胞內的分布有什么影響呢?通過透射電鏡我們觀察到與HepG2細胞接觸培養24 h后的各種納米金均能有效地被HepG2細胞識別并吞噬,在24 h時大量聚集,聚集處主要是胞內的囊泡邊緣或細胞與細胞的連接處,而不是囊泡內部。這可能與本研究所選擇TEM觀察的時間點有關,在相對較長的24 h后,溶酶體無法降解納米金顆粒而將其排除胞外。納米金顆粒在先前的研究中常被默認無毒的,但是我們從最近的研究中發現,直徑為1.4 nm的納米金具有較高的毒性,可以迅速誘導細胞死亡,但是直徑為15 nm的納米金顆粒則是相對無毒的[15]。同時還有研究表明,納米顆粒主要有4個方面的致毒機制:①是納米尺寸效應;②是氧化應激效應;③是金屬離子的毒性效應;④是當納米顆粒被細胞攝入后,它能與細胞內的大分子物質如蛋白質或DNA相互作用,從而喪失或改變其某種特定的功能[16]。我們采用MTT法發現不同濃度的納米金,均會對HepG2細胞的增殖和活性產生一定的影響,并且證明修飾了不同的納米金對HepG2細胞活性和增殖的影響呈一定的劑量依賴性,其中以OH-NPs對HepG2細胞的活性影響最低。此外,本研究還探索了不同納米金對肝癌細胞遷移的影響,結果表明,NH2-NPs和OH-NPs組與對照組相比,明顯抑制了HepG2細胞的遷移。而Au-NPs、CH3-NPs、COOH-NPs組對HepG2細胞的遷移無明顯的作用,這可能和納米金表面修飾官能團的親/疏水性有一定相關性。本研究結果為納米載藥體系的表面改性提供了實驗依據,同時也為進一步研究材料表面化學修飾納米顆粒調控腫瘤細胞遷移的分子機制奠定了基礎。
引言
原發性肝癌是十分常見的惡性腫瘤,近年來在所有癌癥引起的死亡率中,肝癌僅次于肺癌排第二位。據統計,全世界每年有超過70萬病例死于肝癌[1]。在巴塞羅那肝癌不同期分類治療指南中指出,局部消融以及手術切除是治療極早期肝癌的首選方式,患者五年生存率達到50%左右;而處于晚期的肝癌患者,手術切除不再是首選,患者三年生存率不足40% [2]。由于肝癌細胞發生轉移是導致上述諸多治療方式失敗的最主要原因,因此尋求具有高效性和低毒性且能靶向治療的能夠抑制肝癌細胞遷移的方法尤為重要。用于臨床治療的抗腫瘤藥物,由于在體內循環中的溶解度低、穩定性差、半衰期短以及缺乏對腫瘤細胞的靶向性等缺點,在實際應用中具有很大的局限性。近年來,大量研究表明納米材料作為新型的藥物載體具有高度靶向定位的優勢,可以顯著提高藥物的利用率,減少藥物用量,并能夠實現對藥物的釋放控制,原本溶解迅速的藥物通過納米載體包被以后可以實現藥物的緩慢釋放,從而以最少的藥物劑量達到治療疾病的目的。除此之外,納米顆粒載體還能降低藥物對靶向位置的副作用和減小對其他相關器官的毒性作用,且成本較其他方法更為低廉。近年來,關于納米材料臨床應用的研究主要集中在化學傳感、成像以及靶向治療等方面[3]。最近有報道,納米顆粒(nanoparticles, NPs)被細胞內吞后具有一定的細胞毒性,并可誘導細胞凋亡、引起炎癥和DNA損傷等[4-5]。因此,關于納米顆粒在生物體內的相容性及其對細胞和靶向器官的安全性還需要繼續考察。由于納米載藥顆粒主要用于腫瘤的治療,在發揮其載藥及控釋作用的同時是否會對癌細胞的生物學行為特別是遷移能力有所影響,特別值得研究者關注。
1 材料與方法
1.1 材料
采用的人肝癌細胞株HepG2為本實驗室保存;胎牛血清購自復蒙公司;1640培養基和胰蛋白酶購自Invitrogen公司;Transwell小室購自Thermo公司;3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴鹽(MTT)購自Amresco公司,納米金(Au NPs)懸液(濃度100μg/mL,直徑15~20 nm)購自中科院物理研究所;正十二烷基硫醇[HS(CH2)11CH3]、11-氨基-1-十一烷硫醇[HS(CH2)11NH2]、11-巰基-1-十一烷醇[HS(CH2)11OH]、11-巰基十一烷酸[HS(CH2)11COOH]購自Sigma公司。
1.2 細胞培養
將HepG2細胞接種于50 mL規格的培養瓶中,加入7 mL 1640完全培養基(10%胎牛血清,100 mg/mL的鏈霉素,1×104 U/L青霉素),靜置培養于細胞培養箱中(37℃、5% CO2、飽和濕度)。待細胞株生長至鋪滿培養瓶培養面90%左右,用2.5%的胰蛋白酶處理至細胞形態變圓后終止消化,傳代培養,取對數生長期細胞進行實驗研究。
1.3 制備不同化學表面修飾的納米金懸液
我們采用自組裝技術(self-assembly techniques, SAMs)制備了5種具有不同表面化學官能團的納米金懸液:第1種為裸金(Au-NPs);第2種為帶有甲基的納米金(CH3-NPs),在裸金懸液中加入1 mmol/L的HS(CH2)11CH3,靜置過夜,然后加入0.25 mmol/L檸檬酸鈉、0.05% Tween 20,1 000 r/min離心5 min,除上清后再用純水重懸;第3種為帶有氨基的納米金(NH2-NPs),在裸金懸液中加入1 mmol/L的HS(CH2)11NH2,靜置過夜,然后加入0.25 mmol/L檸檬酸鈉、0.05% Tween,4 500 r/min離心1 h,除上清后再用純水重懸;第4種為帶有羧基的納米金(COOH-NPs),在裸金懸液中加1 mmol/L的HS(CH2)10COOH,靜置過夜,之后4 500 r/min離心30 min,除上清后再用純水重懸;第5種為帶有羥基的納米金(OH-NPs),在裸金懸液中加入1 mmol/L的HS(CH2)11OH,靜置過夜,1 000 r/min離心5 min,除上清后再用純水重懸。
1.4 表征不同化學表面修飾的納米金
量取5種納米金懸液各6 mL,稀釋于去離子水中至合適濃度后,超聲8 min使其分散均勻,靜置4 min。取少量上層液體中的樣品,緩慢放在玻片上,使其沉降8 min,并于烘箱中使其充分干燥,然后通過透射電子顯微鏡(transmission electron microscope, TEM,H-600IV,Japan)觀察并拍照。
分別取5種納米金懸液于1 mL離心管中,12 000 r/min離心12 min后去上清,加入0.9 mL二氯甲烷,10 000 r/min離心8 min,用以除掉懸液中的剩余硫醇,接著各組納米金中加入相同量的二氯甲烷,超聲15 min使其分散,然后將金納米顆粒懸浮液滴至膜片上,充分干燥,然后采用傅里葉變換紅外光譜儀(fourier transform infrared spectrometer, FTIR,Nicolet 6700,Thermo,USA)測定在波數4 000~400 cm-1的吸收光譜。
1.5 觀察納米金顆粒在HepG2細胞中的分布
將HepG2細胞計數后等量接種于6孔板上培養,待細胞融合度達到90%左右,六孔板6個孔分設為6個分組,每組均更換2 mL1640完全培養基,對照組加入200μL純水,5個實驗組中分別加入相應的納米金懸液200μL,培養24 h。用4℃PBS清洗3次6孔板,再用冰凍處理的刮子將細胞緩慢刮下,將刮下的細胞懸液移至1 mL離心管中,1800 r/min離心12 min,去掉上清液;緩緩加入0.5%戊二醛,4℃靜置10 min,12 000 r/min離心12 min,去掉上清液;用3%戊二醛處理使其固定,1%的四氧化鋨(OsO4)處理再次固定,利用丙酮依次脫水,Epon812包埋,半薄切片光學定位,超薄切片,醋酸鈾及枸櫞酸鉛雙重染色,TEM觀察不同納米金顆粒在HepG2細胞中的分布。
1.6 納米金顆粒對肝癌細胞HepG2活性的影響
取對數期HepG2細胞并調整其最佳細胞懸液濃度為1.5×105個/mL(我們通過設置幾組細胞濃度梯度,采用MTT比色法檢測體外細胞毒性后確定該最佳細胞懸液濃度),在96孔板的5個實驗組孔中加入100μL細胞懸液,同時設置調零孔(只含培養基)和對照孔(只含細胞懸液和相同濃度的藥物溶解介質),每孔設5個相同重復的孔,待其貼壁單層鋪滿后加入不同濃度的5種納米金顆粒懸液,濃度分別設置為1.875、3.75、7.5、15、30 mg/L。于孵箱中培養24 h后,每孔均加入20μL 0.5% MTT溶液,繼續培養4 h。然后終止培養,小心吸去孔中液體,每個孔中均加入150μL DMSO,避光慢速搖晃15 min,待觀察到結晶物充分溶解消失后,使用酶標儀測出各孔在570 nm波長處的吸光值,記錄數據,統計分析。
1.7 納米金顆粒對肝癌細胞HepG2橫向遷移的影響
將HepG2細胞計數后等量接種于6孔板上培養,待細胞融合度達到90%左右時,換不含血清的1640培養基饑餓處理12 h。10μL的槍頭刮出約500μm的損傷區域后用PBS洗凈懸浮的細胞,將6孔板設為6個組,均加入2 mL 1640完全培養基,其中對照組加入200μL純水,5個實驗組中上下室分別加入相應的納米金懸液200μL,重復該實驗3次,采用Picpic圖像分析軟件測量劃痕兩側的細胞遷移距離,并對所得數據進行統計學分析。
1.8 納米金顆粒對細胞縱向遷移的影響
將HepG2肝癌細胞接種于培養瓶中,待其融合度達到80%后,用胰蛋白酶將其消化制成細胞懸液,通過細胞計數板將細胞懸液中細胞數目控制為2×105個/mL,取200μL細胞懸液接種于Transwell小室中,小室置于24孔板中的小孔中,同時取600μL 1640完全培養基于24孔板中。待細胞融合度達到80%時,棄去培養基,用PBS洗兩次,再次在Transwell小室和24孔板中分別加入20μL和60μL培養基。設了6個分組,其中對照組中在Transwell小室和對應的24孔板小孔中分別加入20μL和60μL純水,5個實驗組則分別在Transwell小室和對應的24孔板小孔中加入20μL和60μL相應的納米金懸液,之后置于37℃、5% CO2的孵箱中于飽和濕度條件下靜置培養24 h。取出Transwell小室,棄去孔中培養基,用PBS洗兩遍,多聚甲醛固定30 min,將小室適當風干。0.1%的結晶紫染色25 min,然后用棉簽小心擦掉小室上層未遷移的細胞,PBS清洗3~5遍。400倍顯微鏡下隨機取5個視野觀察細胞,并照相計數。
1.9 統計分析
本實驗所有數據均為重復3次以上結果,表示為均數±標準差,采用SPSS 13.0統計軟件對數據采用一維方差分析組間差別比較和SNK法進行組間兩兩比較,以P<0.05為差異有統計學意義。
2 結果
2.1 不同化學表面納米金顆粒的材料學表征
采用SAMs技術制備的納米顆粒懸浮溶液體系如圖 1(a)所示。由圖可見,5種納米金的純水懸浮溶液體系呈現出不同的顏色差異,初步證明了端基具有不同化學官能團的烷基硫醇已通過S-Au共價鍵結合到了納米金上。其中CH3-NPs和NH2-NPs組溶液顏色較淺,而COOH表面修飾的納米金(COOH-NPs組)和Au-NPs組為紫紅色,OH-NPs組呈現出較深的藍黑色。TEM觀察可知[見圖 1(b)],幾種納米金分散情況均較好,顆粒邊界清晰,沒有嚴重的聚集現象。不同官能團的Au-NPs顆粒形態并無顯著變化,根據標尺可辨析出其直徑仍保持15~20 nm。FTIR的結果可以看出[見圖 1(c)],組裝了不同官能團的4組樣品CH3-NPs、NH2-NPs、COOH-NPs和OH-NPs在2 918 cm-1和2 849 cm-1均出現了明顯的亞甲基(-CH2-)的反對稱和對稱伸縮振動峰νas(CH2)和νs(CH2),而Au-NPs組無此峰的存在。在4組樣品中2 584 cm-1未觀察到硫醇鍵(-S-H)的特征峰,證明烷基硫醇的-S-H已與Au-NPs結合,形成了新的共價Au-S鍵。此外,各組納米金均能發現其官能團的紅外特征峰,分別是-CH3的1 680 cm-1,-NH2在1 550 cm-1,-CH2-OH在1 400 cm-1以及-COOH在1 700~1 725 cm-1的特征吸收峰。該結果表明:SAMs技術能夠成功在納米金表面制備不同的化學官能團。
 圖1
不同化學表面修飾納米金顆粒的表征
圖1
不同化學表面修飾納米金顆粒的表征
(a)不同納米金顆粒懸浮溶液的顏色變化;(b)不同納米金顆粒的透射電鏡圖;(c)不同納米金顆粒的紅外光譜圖
Figure1. characterization of Au NPs with different chemical function groups(a) the classical images of Au NPs; (b) TEM images of Au NPs; (c) FTIR Spectrum of Au NPs
2.2 納米金在HepG2細胞內的分布
用上述5種納米金處理HepG2細胞24 h后,TEM觀察細胞內納米金的分布。由圖 2可知,各組納米金均能有效地被HepG2細胞識別并吞噬,在24 h后仍能在細胞內觀察到大量聚集的納米金。這些納米金均主要分布在胞內的囊泡邊緣或細胞與細胞的連接處,而不是被囊泡所包裹(見圖 2中箭頭所示)。在細胞內分布的大量囊泡中均未觀察到納米金顆粒,這與本研究所選擇TEM觀察的時間點有關,在相對較長的24 h后,溶酶體無法降解納米金顆粒而將其排除胞外。同時,排除到胞外的納米金將可能被其他HepG2細胞所識別而再次內吞至胞內,完成多次循環。
 圖2
透射電鏡觀察不同化學官能團的納米金顆粒在肝癌細胞胞內的分布。
Figure2.
Uptake and distribution of Au NPs with different chemical function groups in HepG2 cells by TEM.
圖2
透射電鏡觀察不同化學官能團的納米金顆粒在肝癌細胞胞內的分布。
Figure2.
Uptake and distribution of Au NPs with different chemical function groups in HepG2 cells by TEM.
2.3 不同化學表面修飾的納米金顆粒對HepG2細胞增殖影響
圖 3所示是5種不同化學表面修飾的納米金加入培養基與HepG2細胞接觸培養24 h后對細胞增殖的影響。由圖可知,經過24 h的培養后,不同濃度的納米金組與對照組相比其OD值均有一定程度上降低,呈濃度依賴性,該結果表明不同濃度的納米金對HepG2細胞的增殖均有一定程度的影響。進一步對結果進行統計分析發現,當納米金濃度為1.875μg/mL時,我們發現COOH-NPs組的OD值小于對照組(P<0.05),說明COOH-NPs組顯著降低了HepG2細胞的活性和增殖,而其他幾組(Au-NPs、CH3-NPs、NH2-NPs和OH-NPs組)與對照組之間的差異不具有統計學意義(P>0.05),證明以上幾組納米金在低濃度下不影響細胞的活性及增殖。而當Au-NPs濃度增至3.75 mg/L時,所有實驗組的OD值均小于對照組(P<0.05),證明在較高濃度下各組納米金均會影響細胞的活性,降低HepG2細胞活性和增殖。在幾組樣品中,OH-NPs相對于其它組對細胞的增殖影響最小。在15、30 mg/L的高濃度納米金作用下,OH-NPs組的細胞活性均顯著高于其余幾組納米金顆粒組(P<0.05)。而在相同濃度下Au-NPs、CH3-NPs、NH2-NPs、COOH-NPs各組間的細胞活性之間差異不具有統計學意義(P>0.05)。
 圖3
MTT比色法測定不同的納米金對HepG2細胞增殖的影響
圖3
MTT比色法測定不同的納米金對HepG2細胞增殖的影響
*
*
2.4 不同化學表面修飾的納米金對HepG2細胞橫向遷移的影響
圖 4(a)所示的是劃痕法測定Au-NPs、CH3-NPs、NH2-NPs、COOH-NPs和OH-NPs分別與肝癌細胞HepG2接觸培養24 h后細胞的橫向遷移圖片。由圖 4(b)統計結果可知,NH2-NPs和OH-NPs組的遷移距離小于對照組(P<0.05),即顯著抑制了HepG2細胞遷移。而Au-NPs、CH3-NPs、COOH-NPs組與對照組之間的差異不具有統計學意義(P>0.05),說明它們對HepG2細胞的遷移無明顯的作用。
 圖4
劃痕法測定不同化學表面官能團修飾的納米金對HepG2細胞橫向遷移的影響
圖4
劃痕法測定不同化學表面官能團修飾的納米金對HepG2細胞橫向遷移的影響
(a)不同表面化學的納米金對HepG2細胞橫向遷移的影響;(b)HepG2細胞遷移距離統計圖(*
(a) HepG2 cell migration in parallel direction at 0 and 24 h, respectively; (b) statistical results of cell migration distance (*
2.5 不同化學表面官能團修飾的納米金對細胞縱向遷移的影響
圖 5所示是采用Transwell小室模型測定Au-NPs、CH3-NPs、NH2-NPs、COOH-NPs和OH-NPs分別與肝癌細胞接觸培養24 h后肝癌細胞縱向遷移的情況。由圖 5統計結果可知,Au-NPs、CH3-NPs、COOH-NPs組在24 h后穿過Transwell小室膜的HepG2細胞的個數較為相近,與對照組之間的差異不具有統計學意義(P>0.05),而NH2-NPs和OH-NPs組細胞遷移數量明顯少于對照組(P<0.05),其結果與橫向遷移一致,證明了NH2-NPs和OH-NPs組能夠顯著抑制HepG2細胞遷移。
 圖5
Transwell測定不同表面化學的納米金對HepG2細胞縱向遷移的影響
圖5
Transwell測定不同表面化學的納米金對HepG2細胞縱向遷移的影響
(a)不同表面化學的納米金對HepG2細胞縱向遷移的影響;(b)HepG2細胞遷移數量統計圖(*
(a) images illustrating HepG2 cell migration in vertical direction at 0 and 24 h, respectively; (b) statistical results of numbers of cell in migration(*
3 討論
近些年來,作為腫瘤診斷以及治療的藥物載體,納米材料在臨床上已經得到了十分廣泛的應用。納米材料載體在病灶部位的定位具有靶向性的優勢,從而能夠達到以微劑量靶向治療癌癥的目的。其不僅可以減小藥物的副作用,而且能夠提高藥物的吸收和利用率,同時還可以降低其自身的細胞毒性。納米金作為其中一種納米材料載體,不僅制備方法
簡便,結構穩定,外形規則,而且便于使用紫外可見分光光度、核磁共振和紅外光譜分析等幾種表征分析手段。同時納米金具有低細胞毒性、良好的吸收率和分散率等優勢,作為模式材料被廣泛用于納米材料方面的研究,備受研究者的青睞[6]。1994年,首次有文獻報道在納米金表面成功自組裝上的烷基硫醇單分子層[7]是通過S-Au鍵的強吸附力制備而成的自組裝單分子層,這種通過控制材料表面的修飾組成從而獲得預期表面化學性質的方法,為研究構建生物大分子與材料表面之間互相作用的良好材料模型奠定了基礎[8]。納米金顆粒采用了SAMs技術可以使其具有很多不同的特性,是改性方法中應用較多的一種[9-11]。我們可以根據自己的需求來改變SAMs的組裝成分,從而使納米金表面具有我們想要的化學性質。例如,我們可以組裝親/疏水性不同的基團(OH、NH2、COOH和CH3)[12],不同的官能團由于其自身的親/疏水性而使材料表面的親/疏水性也發生變化,同時納米金表面的各向異性表面能可以有效地被硫醇分子消除,從而使表面性質幾乎趨于一致,進而獲得較為整齊均勻的攜有硫醇單分子層的納米金[13-14]。
在本研究中,我們采用SAMS技術成功制備了修飾有不同官能團(CH3、OH、COOH和NH2)的納米金懸液。不同納米金懸浮液呈現出不同顏色,與文獻報道中描述相符,并且我們通過透射電鏡觀察納米金懸液,發現其分散情況均較為理想。納米材料進入細胞以及在細胞內作為載體的運輸途徑取決于其結構和物理化學性質,比如大小、成分、形狀、表面電荷以及親/疏水性等,此外,細胞的種類也決定了材料的內吞和其在胞內的存在和排出方式。那么,我們制備的納米金的這些理化性質對肝癌細胞HepG2攝入該顆粒及其在胞內的分布有什么影響呢?通過透射電鏡我們觀察到與HepG2細胞接觸培養24 h后的各種納米金均能有效地被HepG2細胞識別并吞噬,在24 h時大量聚集,聚集處主要是胞內的囊泡邊緣或細胞與細胞的連接處,而不是囊泡內部。這可能與本研究所選擇TEM觀察的時間點有關,在相對較長的24 h后,溶酶體無法降解納米金顆粒而將其排除胞外。納米金顆粒在先前的研究中常被默認無毒的,但是我們從最近的研究中發現,直徑為1.4 nm的納米金具有較高的毒性,可以迅速誘導細胞死亡,但是直徑為15 nm的納米金顆粒則是相對無毒的[15]。同時還有研究表明,納米顆粒主要有4個方面的致毒機制:①是納米尺寸效應;②是氧化應激效應;③是金屬離子的毒性效應;④是當納米顆粒被細胞攝入后,它能與細胞內的大分子物質如蛋白質或DNA相互作用,從而喪失或改變其某種特定的功能[16]。我們采用MTT法發現不同濃度的納米金,均會對HepG2細胞的增殖和活性產生一定的影響,并且證明修飾了不同的納米金對HepG2細胞活性和增殖的影響呈一定的劑量依賴性,其中以OH-NPs對HepG2細胞的活性影響最低。此外,本研究還探索了不同納米金對肝癌細胞遷移的影響,結果表明,NH2-NPs和OH-NPs組與對照組相比,明顯抑制了HepG2細胞的遷移。而Au-NPs、CH3-NPs、COOH-NPs組對HepG2細胞的遷移無明顯的作用,這可能和納米金表面修飾官能團的親/疏水性有一定相關性。本研究結果為納米載藥體系的表面改性提供了實驗依據,同時也為進一步研究材料表面化學修飾納米顆粒調控腫瘤細胞遷移的分子機制奠定了基礎。