介紹了一種新的基于阻抗控制算法的冷極射頻消融治療儀的研制。儀器分為硬件系統和軟件系統兩大塊,硬件部分完成射頻功率輸出、實時數據采集等;軟件部分主要完成對消融范圍的控制,以及實驗過程中的實時曲線顯示等,核心是阻抗控制算法。阻抗算法解決了射頻消融過程中腫瘤組織阻抗急劇升高的問題,擴大了消融范圍。離體豬肝實驗證明,阻抗控制算法適應性強,使用14 G冷極射頻針可取得單針消融范圍達3.5~4.5 cm的一致性研究成果,對于臨床上一次性滅活3~5 cm的腫瘤具有較高的實用價值。
引用本文: 鄭丹平, 朱名日, 劉文彬, 姚鑫, 潘凱, 龔慧斌. 基于阻抗控制算法的冷極射頻消融治療儀. 生物醫學工程學雜志, 2015, 32(4): 905-909. doi: 10.7507/1001-5515.20150161 復制
版權信息: ?四川大學華西醫院華西期刊社《生物醫學工程學雜志》版權所有,未經授權不得轉載、改編
引言
近幾年來隨著影像技術的發展,CT、超聲等引導下的射頻消融(radiofrequency ablation,RFA)技術有了巨大的發展。計算機技術的引入,使得射頻消融治療儀的各個設備也得到了更好的控制。射頻消融技術是將作用于腫瘤組織上的交變電流轉化為組織的熱能,通過提升腫瘤組織的溫度使之產生凝固性壞死,達到治愈腫瘤的目的。因其具有微創、高效等特點,已被廣泛應用于人體肝、腎、乳腺、前列腺等組織或器官的腫瘤治療[1] 。
目前,臨床醫學中應用最多的國內外射頻消融治療儀,其控制模式主要有功率控制和溫度控制兩種控制模式。功率控制模式采用固定的功率輸出,通過監控治療過程中局部組織的阻抗變化來控制射頻能量輸出的停斷。而溫度控制模式是通過監控局部組織的溫度自動調整射頻功率輸出,控制靶組織局部溫度,使其溫度在目標溫度范圍內[2]。
對于現有的射頻腫瘤治療儀,臨床上的效果是小于3 cm的腫瘤能達到一次性滅活,而對于3~5 cm的腫瘤卻無法達到一次性治愈,主要表現為癌灶殘留和復發。翟博等[3]對1 341例經RFA治療的原發性肝癌患者進行研究分析,對于<3 cm、3~4 cm、4~5 cm、>5 cm者,其術后殘留率分別為4.0%、11.8%、21.8%和45.7%。即腫瘤越大,RFA治療后的殘留率越高。為了擴大消融范圍,減少癌灶殘留率,特設計了一款基于阻抗控制算法的冷極射頻消融治療儀。阻抗控制算法主要是根據消融過程中組織阻抗值的變化來實時調整射頻功率的輸出,達到擴大消融范圍的效果。
1 冷極射頻消融治療儀的構成
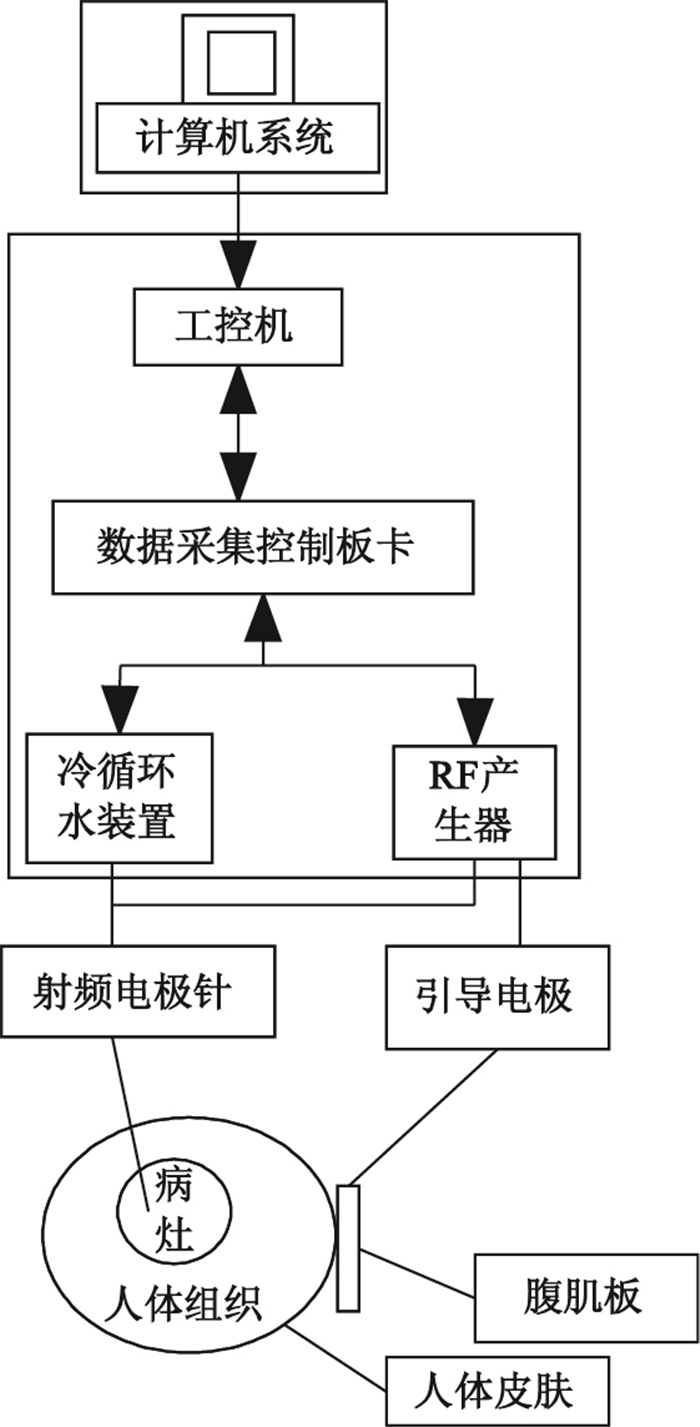
該儀器主要由兩大塊組成,分為硬件系統和軟件系統。從硬件架構來說分為工控機、液晶顯示屏、射頻源系統(包括放大電路等)、制冷系統以及治療終端的射頻針管及腹肌板等。這些子系統或通過電路,或通過AD/DA,或通過串口等通信總線與工控機聯系,共同構成冷極射頻消融治療儀的硬件系統框架。
從軟件系統角度來說,核心是對消融范圍進行控制的阻抗算法。此外還有對實驗過程的阻抗、功率、溫度的實時曲線顯示以及病歷管理等功能模塊。
其系統框圖如圖 1所示。
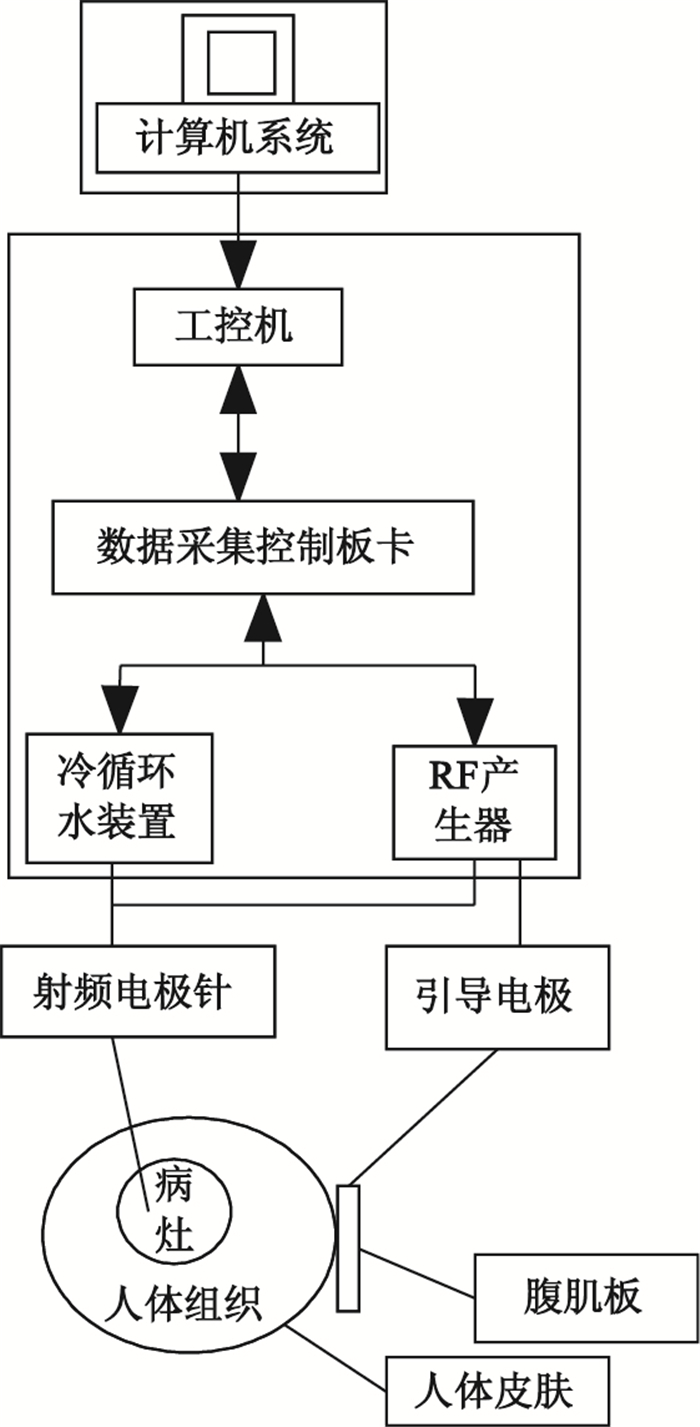 圖1
射頻消融治療儀系統框圖
Figure1.
System diagram of the RFA therapeutic instrument
圖1
射頻消融治療儀系統框圖
Figure1.
System diagram of the RFA therapeutic instrument
2 冷極射頻消融治療的原理
射頻消融技術治療的原理是在超聲、CT或內腔鏡的引導下,將射頻電極針穿刺插入到患者腫瘤組織部位,通過射頻消融系統和軟件控制,將大功率射頻能量通過消融電極傳送到腫瘤組織內,再經輔助電極形成回路,通過周圍組織中的分子摩擦和離子逸散而產熱,使局部組織溫度達到60 ℃以上時,腫瘤組織將產生不可逆的凝固性壞死,從而產生熱消融效應[4]。由于腫瘤周圍血管組織凝固,不能繼續向腫瘤供血,這有利于防止腫瘤轉移;同時,壞死組織在患者體內將部分被吸收,壞死組織周圍形成纖維化胞膜,胞膜內聚集了中性DNA,它能增強患者的免疫功能。
冷極射頻消融技術是采用針尖帶有循環水的射頻電極針進行治療。針尖的冷循環水可帶走部分熱量,使針尖周圍組織局部溫度降低,避免針尖周圍組織迅速炭化結痂,達到增大消融范圍的目的[5]。冷極射頻消融靠熱積累達到一定程度來滅活癌細胞。
3 阻抗控制算法
3.1 阻抗算法的理論依據
人體組織在熱學中粗略地可以等效為一個熱阻和一個熱容的并聯[6]。
向其施加一個恒定的功率時,由于熱容的作用,其溫度將緩慢上升;另外由于熱阻的存在,負載將對環境(如血液、更外圍的低溫組織)散熱,因此在其溫度達到某一個平衡點時,其溫度將不再上升。當負載發生變化時,需要調節其功率,才能使溫度相對穩定。
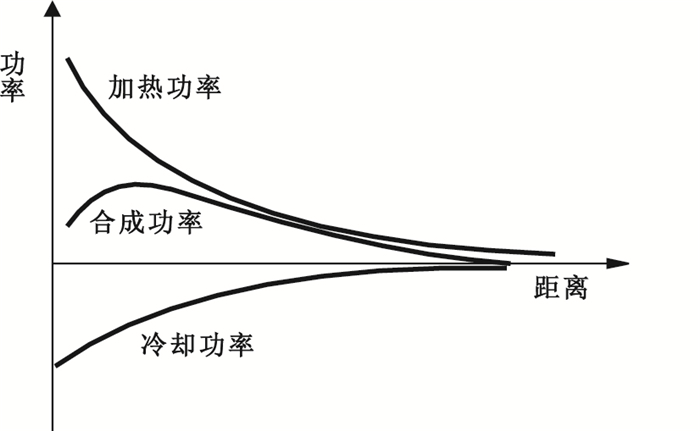
若直接輸出射頻能量,由于負載的溫度上升至沸點后靶點組織會發生嚴重的脫水,使其炭化,阻抗上升,有效功率下降,因此其消融范圍(癌細胞失活的范圍)會非常小,無法滿足臨床需求。為了抑制這種現象、擴大消融范圍,這里采用冷循環水射頻電極針,冷卻水循環流動,用于冷卻針尖周圍組織,其冷卻功率與加熱功率疊加后如圖 2所示。
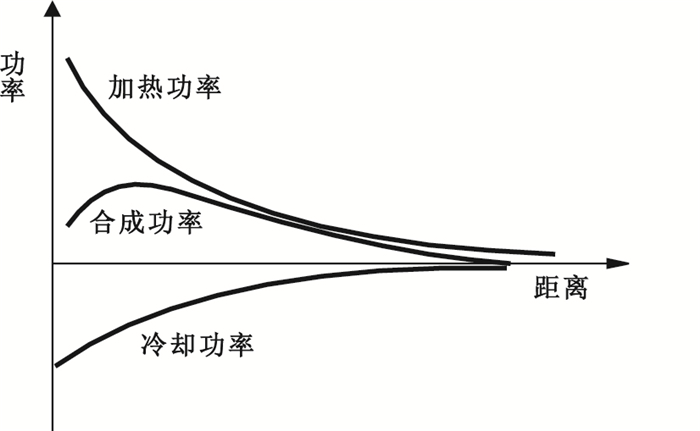 圖2
冷卻功率與加熱功率的合成功率
Figure2.
Synthetic power of cooling power and heating power
圖2
冷卻功率與加熱功率的合成功率
Figure2.
Synthetic power of cooling power and heating power
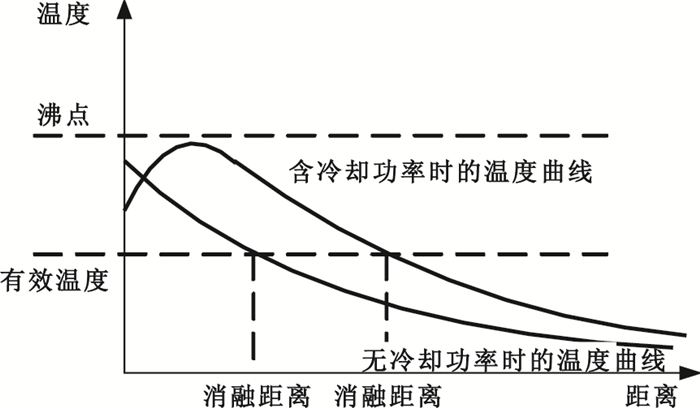
由于加熱功率和冷卻功率同時存在,其合成功率的曲線比加熱功率更為平緩。加入冷卻功率和未加入冷卻功率的溫度曲線對比如圖 3所示。
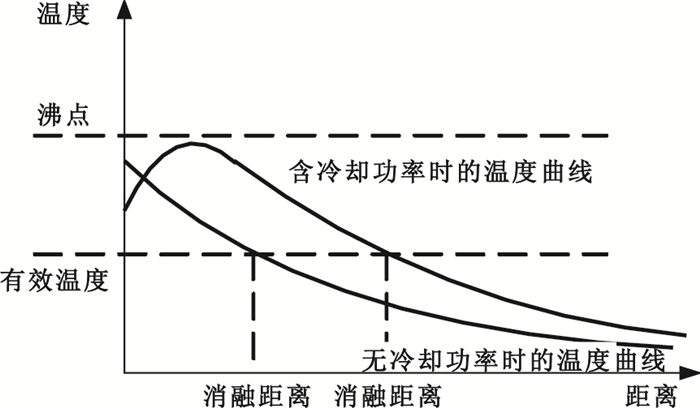 圖3
含冷卻功率與不含冷卻功率時的溫度曲線圖
Figure3.
Temperature curve with cooling power and the curve without cooling power
圖3
含冷卻功率與不含冷卻功率時的溫度曲線圖
Figure3.
Temperature curve with cooling power and the curve without cooling power
從圖 3可以看出,帶冷循環水的針尖溫度與不帶冷循環水的針尖溫度有很大差別,因此,帶冷循環的針尖溫度反應的不是真實的針尖溫度,采用傳統的針尖溫度控制將不準確。而傳統的功率控制也存在一定的不足。功率控制模式,采用輸出功率恒定,通過設定的恒定功率對穿刺點進行迅速消融[7]。由于組織不同部位的生物學特性不同[8],相同的參數設置有可能在某些組織上導致組織過早脫水炭化,射頻能量得不到很好的輸出與擴散。
如果輸出能量大,局部溫度尤其是鄰近針尖周圍組織溫度會升高過快,使得組織迅速脫水炭化,脫水組織在針尖周圍形成炭圈,從而影響消融體積。雖然功率控制模式的射頻消融時間短,但其消融范圍也小,不能達到一次性滅活整個癌細胞的目的。而阻抗控制算法,是根據消融過程中,阻抗的實時變化調整射頻功率的輸出。當射頻能量輸出時,根據傳熱學的原理,能量會從高處向低處傳遞,由于針尖有冷循環水,所以針尖周圍組織溫度不會過高,組織不會迅速炭化,在持續功率輸入的情況下,熱量可以繼續向外傳遞,當熱量累積到一定程度時即可將癌細胞殺死,達到增大消融范圍的目的。Haemmerich.D通過數學建模,對阻抗控制進行了仿真分析,并進行了相關離體實驗的驗證[9]。
3.2 阻抗算法的基本思想以及算法流程
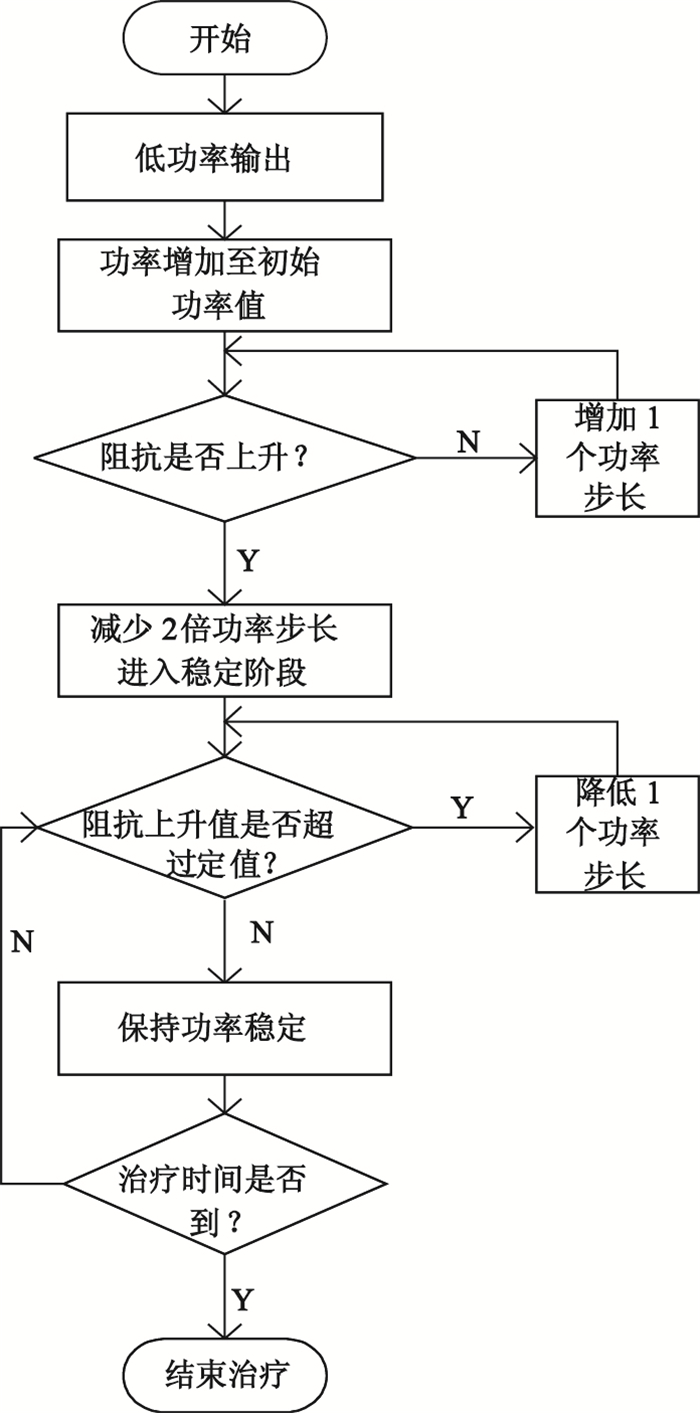
阻抗算法的基本思想:開始治療一段時間,低功率運行大約幾十秒,此時阻抗會下降,功率持續小幅度上升,待功率上升到設定的初始功率后,再根據阻抗走向的趨勢來調整功率,如果阻抗沒有上升趨勢(一直下降),每隔一定時間增加一個功率步長(大約2 W),直至阻抗下降到最低拐點處開始上升;當阻抗高于最低拐點處一個值(大約5 W),將功率降低一個步長值,然后功率一直保持穩定輸出;如果阻抗后面下降比較多,給予一個功率補償(即阻抗下降達到一個設定值,增加一個功率步長。比如,設定阻抗下降3 Ω,功率增加2 W),否則,保持恒定功率輸出;如果阻抗達到設定的目標阻抗值附近(設置為150 Ω),將調整射頻源電壓輸出,使阻抗保持在設定值附近運行,直到結束治療。上述設定值均為我們在離體豬肝實驗過程中探索所得,后續通過活體以及臨床如果效果較好,可以將設定值固化在軟件程序中。阻抗算法的流程框圖如圖 4所示。
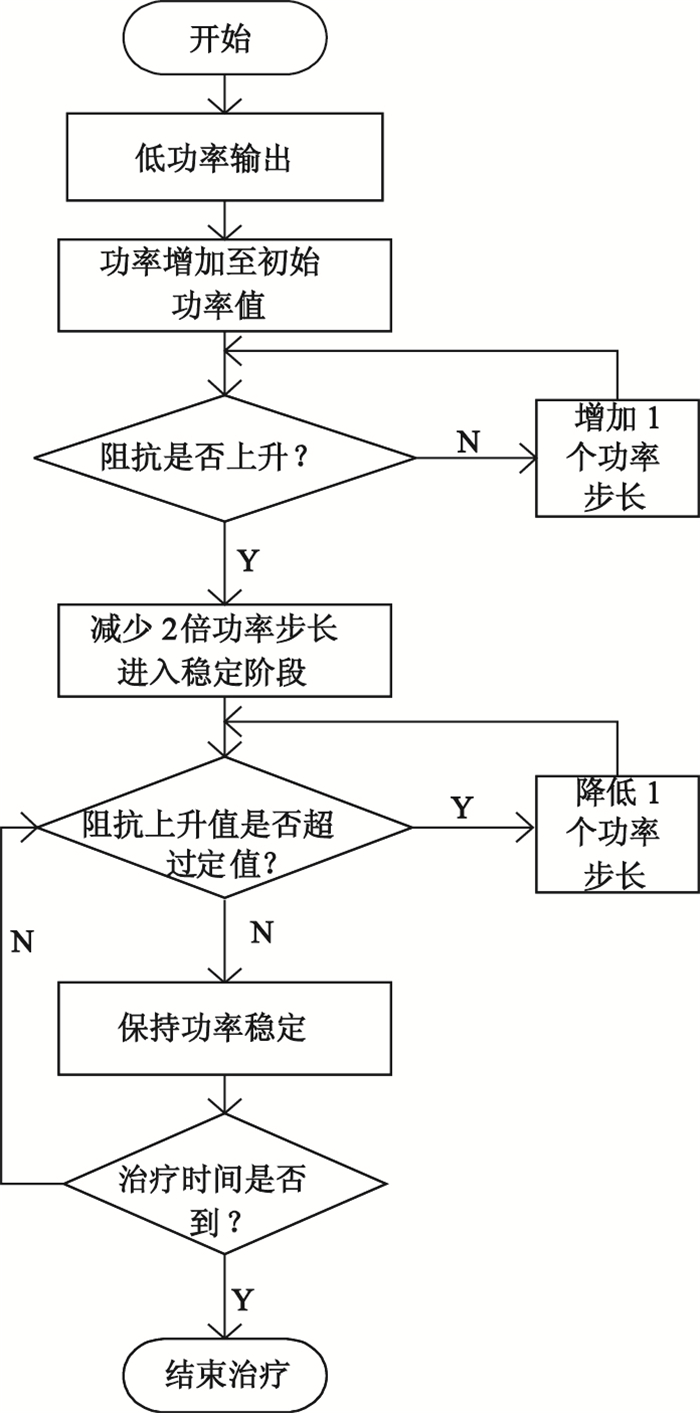 圖4
阻抗算法的流程框圖
Figure4.
Flow diagram of impedance algorithms
圖4
阻抗算法的流程框圖
Figure4.
Flow diagram of impedance algorithms
4 阻抗算法的實驗驗證
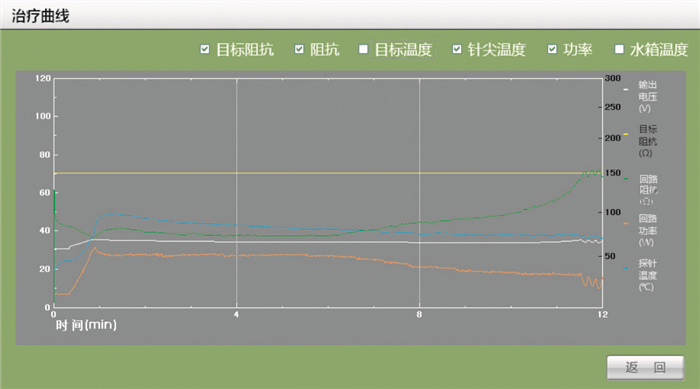
單極14 G(HG-25)可控冷極針射頻消融離體豬肝的實驗曲線如圖 5所示。圖中縱軸左邊刻度表示功率/溫度,右邊刻度表示阻抗,橫軸為時間。12 min治療時間下,回路阻抗曲線先下降后上升,這符合生物組織阻抗在射頻電流作用下的特性[10]。在開始治療的時候,由于射頻電流使豬肝組織中帶電離子高速運轉,所以阻抗下降;隨著射頻功率的增加,由傳熱原理[11],熱量會向周圍組織傳遞,組織自身水分散失,阻抗上升。回路阻抗值達到最低拐點,說明冷卻功率與加熱功率的有效功率達到一個動態平衡,此時如果射頻功率繼續增加,動態平衡將會被破壞,所以要采取減功率方式。圖 5中可以看出阻抗拐點值之后回路功率是減小的,這表明曲線與我們算法思想一致。最后阻抗會上升較大值,是因為熱積累使組織趨于炭化焦化,組織導電性能變差,導致阻抗值上升[12]。一旦阻抗急劇上升,將導致阻抗值不可控,這就是我們設定目標阻抗的目的所在。當阻抗值達到我們設定的目標阻抗值之后,功率將在設定最小值范圍內波動輸出,回路阻抗也將在設定阻抗范圍內來回波動。
針尖溫度曲線顯示:開始治療后,溫度逐漸上升,當溫度上升達到一個最大值后有所下降,之后一直比較平穩。這是由于冷循環水帶走熱量的緣故。溫度曲線在回路功率開始下降一段時間之后才達到最大值,是因為有熱積累的過程。
從圖 5可以看出當穩定之后,回路阻抗、針尖溫度、回路功率幾乎是持平的穩定狀態。這里的輸出電壓曲線是作為實驗過程的參考所用。
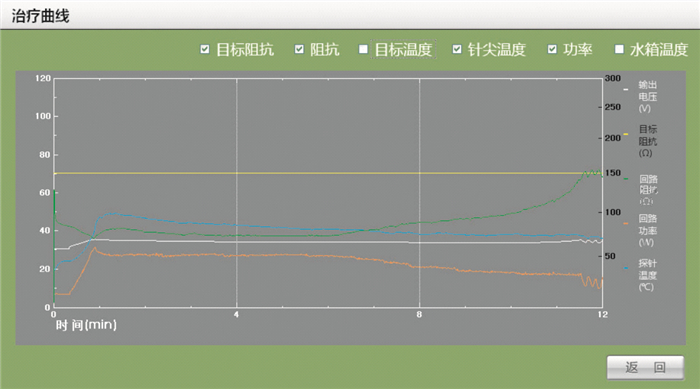 圖5
離體豬肝實驗曲線圖
Figure5.
Experiment curves of in vitro pig liver
圖5
離體豬肝實驗曲線圖
Figure5.
Experiment curves of in vitro pig liver
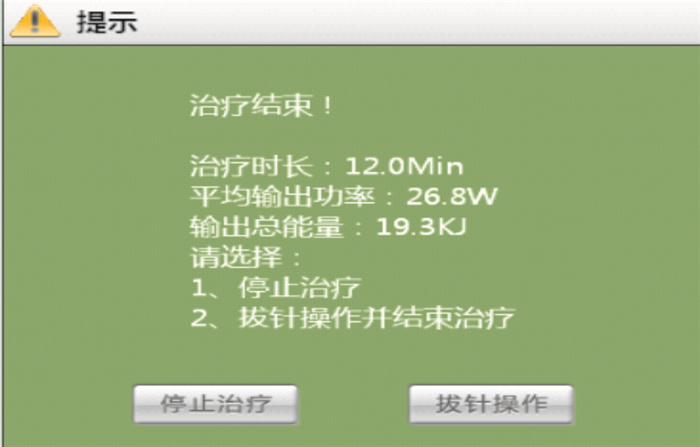
算法的主要目的是控制阻抗,避免阻抗急劇上升炭化。對于本儀器中的溫度,是合成功率之后的溫度,故溫度只是作為消融過程中的一個監控條件,在治療參數設定時,如果設定溫度最高值為120 ℃,一旦溫度達到之后,將停止治療。在治療結束時,軟件界面會彈出一個提示窗體,顯示治療時間、平均輸出功率、輸出總的能量以及下一步要采取的操作,如圖 6所示。
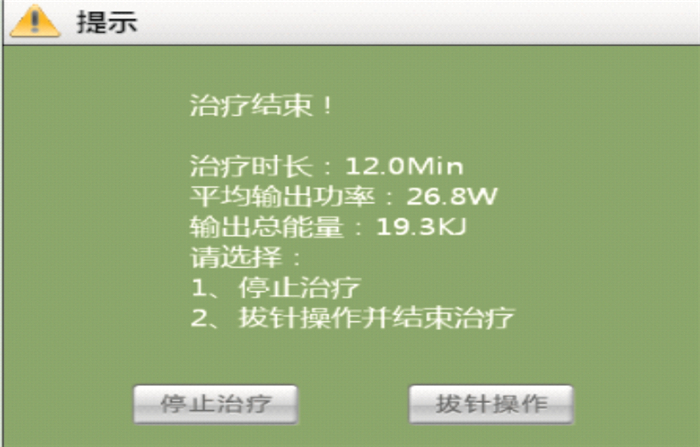 圖6
提示信息窗體圖
Figure6.
Form diagram of prompt information
圖6
提示信息窗體圖
Figure6.
Form diagram of prompt information
圖 6中的輸出總能量可以反映出射頻功率對腫瘤組織所做的功,即總能量間接反應了消融范圍的大小。相同條件下,總能量越大,消融范圍越大。所以實時曲線顯示也是此儀器設計的一大突出點。
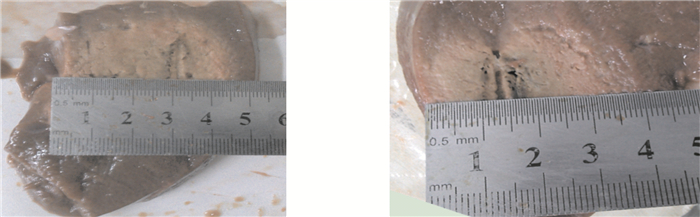
對離體豬肝進行解剖之后可以看到,焦化炭化區并非針尖處,而是離針尖一段距離,在拔針操作時可以避免針尖組織粘連,這是冷循環針的優勢之一。圖 7是阻抗控制算法下,單針(14 G)冷極射針兩次射頻消融的效果圖。本組使用14 G冷極射頻針,單針消融橫徑平均值可達3.5~4.5 cm。
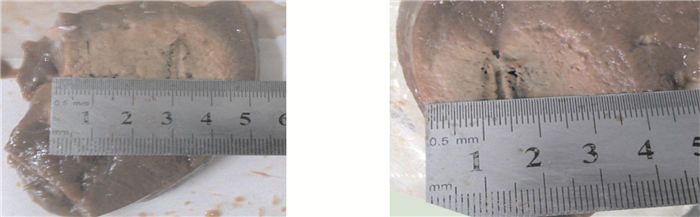 圖7
兩例離體豬肝消融效果圖
Figure7.
Effect charts of RFA for 2 cases of in-vitro pig liver
圖7
兩例離體豬肝消融效果圖
Figure7.
Effect charts of RFA for 2 cases of in-vitro pig liver
5 結論
阻抗控制算法解決了在射頻消融過程中腫瘤組織阻抗急劇升高的問題,擴大了消融范圍。100多次離體豬肝實驗證明,阻抗控制算法適應性強、一致性好、可靠性高。使用14 G冷極射頻針可取得單針消融橫徑平均值達3.5~4.5 cm的一致性研究成果。這對于臨床上一次性滅活3~5 cm腫瘤具有較高的實用價值。
引言
近幾年來隨著影像技術的發展,CT、超聲等引導下的射頻消融(radiofrequency ablation,RFA)技術有了巨大的發展。計算機技術的引入,使得射頻消融治療儀的各個設備也得到了更好的控制。射頻消融技術是將作用于腫瘤組織上的交變電流轉化為組織的熱能,通過提升腫瘤組織的溫度使之產生凝固性壞死,達到治愈腫瘤的目的。因其具有微創、高效等特點,已被廣泛應用于人體肝、腎、乳腺、前列腺等組織或器官的腫瘤治療[1] 。
目前,臨床醫學中應用最多的國內外射頻消融治療儀,其控制模式主要有功率控制和溫度控制兩種控制模式。功率控制模式采用固定的功率輸出,通過監控治療過程中局部組織的阻抗變化來控制射頻能量輸出的停斷。而溫度控制模式是通過監控局部組織的溫度自動調整射頻功率輸出,控制靶組織局部溫度,使其溫度在目標溫度范圍內[2]。
對于現有的射頻腫瘤治療儀,臨床上的效果是小于3 cm的腫瘤能達到一次性滅活,而對于3~5 cm的腫瘤卻無法達到一次性治愈,主要表現為癌灶殘留和復發。翟博等[3]對1 341例經RFA治療的原發性肝癌患者進行研究分析,對于<3 cm、3~4 cm、4~5 cm、>5 cm者,其術后殘留率分別為4.0%、11.8%、21.8%和45.7%。即腫瘤越大,RFA治療后的殘留率越高。為了擴大消融范圍,減少癌灶殘留率,特設計了一款基于阻抗控制算法的冷極射頻消融治療儀。阻抗控制算法主要是根據消融過程中組織阻抗值的變化來實時調整射頻功率的輸出,達到擴大消融范圍的效果。
1 冷極射頻消融治療儀的構成
該儀器主要由兩大塊組成,分為硬件系統和軟件系統。從硬件架構來說分為工控機、液晶顯示屏、射頻源系統(包括放大電路等)、制冷系統以及治療終端的射頻針管及腹肌板等。這些子系統或通過電路,或通過AD/DA,或通過串口等通信總線與工控機聯系,共同構成冷極射頻消融治療儀的硬件系統框架。
從軟件系統角度來說,核心是對消融范圍進行控制的阻抗算法。此外還有對實驗過程的阻抗、功率、溫度的實時曲線顯示以及病歷管理等功能模塊。
其系統框圖如圖 1所示。
 圖1
射頻消融治療儀系統框圖
Figure1.
System diagram of the RFA therapeutic instrument
圖1
射頻消融治療儀系統框圖
Figure1.
System diagram of the RFA therapeutic instrument
2 冷極射頻消融治療的原理
射頻消融技術治療的原理是在超聲、CT或內腔鏡的引導下,將射頻電極針穿刺插入到患者腫瘤組織部位,通過射頻消融系統和軟件控制,將大功率射頻能量通過消融電極傳送到腫瘤組織內,再經輔助電極形成回路,通過周圍組織中的分子摩擦和離子逸散而產熱,使局部組織溫度達到60 ℃以上時,腫瘤組織將產生不可逆的凝固性壞死,從而產生熱消融效應[4]。由于腫瘤周圍血管組織凝固,不能繼續向腫瘤供血,這有利于防止腫瘤轉移;同時,壞死組織在患者體內將部分被吸收,壞死組織周圍形成纖維化胞膜,胞膜內聚集了中性DNA,它能增強患者的免疫功能。
冷極射頻消融技術是采用針尖帶有循環水的射頻電極針進行治療。針尖的冷循環水可帶走部分熱量,使針尖周圍組織局部溫度降低,避免針尖周圍組織迅速炭化結痂,達到增大消融范圍的目的[5]。冷極射頻消融靠熱積累達到一定程度來滅活癌細胞。
3 阻抗控制算法
3.1 阻抗算法的理論依據
人體組織在熱學中粗略地可以等效為一個熱阻和一個熱容的并聯[6]。
向其施加一個恒定的功率時,由于熱容的作用,其溫度將緩慢上升;另外由于熱阻的存在,負載將對環境(如血液、更外圍的低溫組織)散熱,因此在其溫度達到某一個平衡點時,其溫度將不再上升。當負載發生變化時,需要調節其功率,才能使溫度相對穩定。
若直接輸出射頻能量,由于負載的溫度上升至沸點后靶點組織會發生嚴重的脫水,使其炭化,阻抗上升,有效功率下降,因此其消融范圍(癌細胞失活的范圍)會非常小,無法滿足臨床需求。為了抑制這種現象、擴大消融范圍,這里采用冷循環水射頻電極針,冷卻水循環流動,用于冷卻針尖周圍組織,其冷卻功率與加熱功率疊加后如圖 2所示。
 圖2
冷卻功率與加熱功率的合成功率
Figure2.
Synthetic power of cooling power and heating power
圖2
冷卻功率與加熱功率的合成功率
Figure2.
Synthetic power of cooling power and heating power
由于加熱功率和冷卻功率同時存在,其合成功率的曲線比加熱功率更為平緩。加入冷卻功率和未加入冷卻功率的溫度曲線對比如圖 3所示。
 圖3
含冷卻功率與不含冷卻功率時的溫度曲線圖
Figure3.
Temperature curve with cooling power and the curve without cooling power
圖3
含冷卻功率與不含冷卻功率時的溫度曲線圖
Figure3.
Temperature curve with cooling power and the curve without cooling power
從圖 3可以看出,帶冷循環水的針尖溫度與不帶冷循環水的針尖溫度有很大差別,因此,帶冷循環的針尖溫度反應的不是真實的針尖溫度,采用傳統的針尖溫度控制將不準確。而傳統的功率控制也存在一定的不足。功率控制模式,采用輸出功率恒定,通過設定的恒定功率對穿刺點進行迅速消融[7]。由于組織不同部位的生物學特性不同[8],相同的參數設置有可能在某些組織上導致組織過早脫水炭化,射頻能量得不到很好的輸出與擴散。
如果輸出能量大,局部溫度尤其是鄰近針尖周圍組織溫度會升高過快,使得組織迅速脫水炭化,脫水組織在針尖周圍形成炭圈,從而影響消融體積。雖然功率控制模式的射頻消融時間短,但其消融范圍也小,不能達到一次性滅活整個癌細胞的目的。而阻抗控制算法,是根據消融過程中,阻抗的實時變化調整射頻功率的輸出。當射頻能量輸出時,根據傳熱學的原理,能量會從高處向低處傳遞,由于針尖有冷循環水,所以針尖周圍組織溫度不會過高,組織不會迅速炭化,在持續功率輸入的情況下,熱量可以繼續向外傳遞,當熱量累積到一定程度時即可將癌細胞殺死,達到增大消融范圍的目的。Haemmerich.D通過數學建模,對阻抗控制進行了仿真分析,并進行了相關離體實驗的驗證[9]。
3.2 阻抗算法的基本思想以及算法流程
阻抗算法的基本思想:開始治療一段時間,低功率運行大約幾十秒,此時阻抗會下降,功率持續小幅度上升,待功率上升到設定的初始功率后,再根據阻抗走向的趨勢來調整功率,如果阻抗沒有上升趨勢(一直下降),每隔一定時間增加一個功率步長(大約2 W),直至阻抗下降到最低拐點處開始上升;當阻抗高于最低拐點處一個值(大約5 W),將功率降低一個步長值,然后功率一直保持穩定輸出;如果阻抗后面下降比較多,給予一個功率補償(即阻抗下降達到一個設定值,增加一個功率步長。比如,設定阻抗下降3 Ω,功率增加2 W),否則,保持恒定功率輸出;如果阻抗達到設定的目標阻抗值附近(設置為150 Ω),將調整射頻源電壓輸出,使阻抗保持在設定值附近運行,直到結束治療。上述設定值均為我們在離體豬肝實驗過程中探索所得,后續通過活體以及臨床如果效果較好,可以將設定值固化在軟件程序中。阻抗算法的流程框圖如圖 4所示。
 圖4
阻抗算法的流程框圖
Figure4.
Flow diagram of impedance algorithms
圖4
阻抗算法的流程框圖
Figure4.
Flow diagram of impedance algorithms
4 阻抗算法的實驗驗證
單極14 G(HG-25)可控冷極針射頻消融離體豬肝的實驗曲線如圖 5所示。圖中縱軸左邊刻度表示功率/溫度,右邊刻度表示阻抗,橫軸為時間。12 min治療時間下,回路阻抗曲線先下降后上升,這符合生物組織阻抗在射頻電流作用下的特性[10]。在開始治療的時候,由于射頻電流使豬肝組織中帶電離子高速運轉,所以阻抗下降;隨著射頻功率的增加,由傳熱原理[11],熱量會向周圍組織傳遞,組織自身水分散失,阻抗上升。回路阻抗值達到最低拐點,說明冷卻功率與加熱功率的有效功率達到一個動態平衡,此時如果射頻功率繼續增加,動態平衡將會被破壞,所以要采取減功率方式。圖 5中可以看出阻抗拐點值之后回路功率是減小的,這表明曲線與我們算法思想一致。最后阻抗會上升較大值,是因為熱積累使組織趨于炭化焦化,組織導電性能變差,導致阻抗值上升[12]。一旦阻抗急劇上升,將導致阻抗值不可控,這就是我們設定目標阻抗的目的所在。當阻抗值達到我們設定的目標阻抗值之后,功率將在設定最小值范圍內波動輸出,回路阻抗也將在設定阻抗范圍內來回波動。
針尖溫度曲線顯示:開始治療后,溫度逐漸上升,當溫度上升達到一個最大值后有所下降,之后一直比較平穩。這是由于冷循環水帶走熱量的緣故。溫度曲線在回路功率開始下降一段時間之后才達到最大值,是因為有熱積累的過程。
從圖 5可以看出當穩定之后,回路阻抗、針尖溫度、回路功率幾乎是持平的穩定狀態。這里的輸出電壓曲線是作為實驗過程的參考所用。
 圖5
離體豬肝實驗曲線圖
Figure5.
Experiment curves of in vitro pig liver
圖5
離體豬肝實驗曲線圖
Figure5.
Experiment curves of in vitro pig liver
算法的主要目的是控制阻抗,避免阻抗急劇上升炭化。對于本儀器中的溫度,是合成功率之后的溫度,故溫度只是作為消融過程中的一個監控條件,在治療參數設定時,如果設定溫度最高值為120 ℃,一旦溫度達到之后,將停止治療。在治療結束時,軟件界面會彈出一個提示窗體,顯示治療時間、平均輸出功率、輸出總的能量以及下一步要采取的操作,如圖 6所示。
 圖6
提示信息窗體圖
Figure6.
Form diagram of prompt information
圖6
提示信息窗體圖
Figure6.
Form diagram of prompt information
圖 6中的輸出總能量可以反映出射頻功率對腫瘤組織所做的功,即總能量間接反應了消融范圍的大小。相同條件下,總能量越大,消融范圍越大。所以實時曲線顯示也是此儀器設計的一大突出點。
對離體豬肝進行解剖之后可以看到,焦化炭化區并非針尖處,而是離針尖一段距離,在拔針操作時可以避免針尖組織粘連,這是冷循環針的優勢之一。圖 7是阻抗控制算法下,單針(14 G)冷極射針兩次射頻消融的效果圖。本組使用14 G冷極射頻針,單針消融橫徑平均值可達3.5~4.5 cm。
 圖7
兩例離體豬肝消融效果圖
Figure7.
Effect charts of RFA for 2 cases of in-vitro pig liver
圖7
兩例離體豬肝消融效果圖
Figure7.
Effect charts of RFA for 2 cases of in-vitro pig liver
5 結論
阻抗控制算法解決了在射頻消融過程中腫瘤組織阻抗急劇升高的問題,擴大了消融范圍。100多次離體豬肝實驗證明,阻抗控制算法適應性強、一致性好、可靠性高。使用14 G冷極射頻針可取得單針消融橫徑平均值達3.5~4.5 cm的一致性研究成果。這對于臨床上一次性滅活3~5 cm腫瘤具有較高的實用價值。