將分離到的1株對地塞米松有降解作用的產堿假單胞菌進一步馴化。采用滲透休克法分離該菌各區域蛋白,將分離的具有高酶活性的胞內蛋白用硫酸銨鹽析、離子交換層析和葡聚糖凝膠層析提取和純化。純化蛋白用HPLC檢測其對地塞米松的降解活性,酶切后質譜鑒定。結果表明馴化后的產堿假單胞菌對地塞米松的降解率從23.63%提高到52.84%,降解地塞米松的酶主要存在于該菌胞質內,分子量約為41 kD;純化后的酶蛋白比活力達到1.02 U·mg-1,該蛋白的5條肽段的氨基酸序列與異戊酰輔酶A脫氫酶的部分序列匹配,可能是一種新的甾體類化合物降解酶。本文為用微生物修復技術清除水環境的地塞米松污染提供了新策略。
引用本文: 朱黎黎, 楊致邦, 楊茜, 石中全, 鄧西川. 一種產堿假單胞菌產生的地塞米松降解酶的提取純化和鑒定. 生物醫學工程學雜志, 2015, 32(5): 1044-1049. doi: 10.7507/1001-5515.20150185 復制
版權信息: ?四川大學華西醫院華西期刊社《生物醫學工程學雜志》版權所有,未經授權不得轉載、改編
引言
近年來,面對環境激素的嚴重污染和危害,國內外學者開始探索利用微生物自身的代謝過程來降解污染物,并以研究降解的關鍵酶為主[1]。地塞米松(dexamethasone)是以天然的氫化可的松為原料人工合成的長效皮質激素,臨床常用制劑為易溶于水的地塞米松磷酸鈉(dexamethasone sodium phosphate)。地塞米松類藥物是世界范圍內臨床上廣泛應用的激素,常用于臨床各科多種疾病的治療。在應用過程中,地塞米松類藥物的殘液可經各種途徑污染環境,特別是醫院的廢水,也可從應用者體內經分泌液和尿液排出,污染更廣泛的水環境[2]。國內外多篇資料報道,在醫院廢水、城市污水及江水中存在不同程度的地塞米松及其它糖皮質類激素污染[3-4]。目前,醫院廢水的處理主要采用的是物理、生物化學和消毒的方法,這些方法可清除廢水中的病原體、放射性物質、重金屬等,但尚未對激素類污染物進行有效處理[5],也未見清除廢水中地塞米松以及其它糖皮質類激素的方法和制劑的報道。本文在從污染地塞米松的醫院廢水中分離到1株可降解地塞米松磷酸鈉和地塞米松的產堿假單胞菌(本文中簡稱降解菌)的基礎上[6],提取、純化和鑒定其降解地塞米松的酶,為制備清除環境中地塞米松類藥物污染的生物凈化劑,甚至消除應用地塞米松類藥物的臨床副作用提供新策略。
1 材料與方法
1.1 材料
1.1.1 菌種與主要培養基
降解地塞米松磷酸鈉和地塞米松的產堿假單胞菌(2012YZB2)為本實驗室分離后保存,并同時保藏于中國典型培養物保藏中心,編號CCTCCNO:M2014231;該菌對地塞米松磷酸鈉的轉化率為50.86%,對地塞米松的降解率為23.63%[6]。缺碳培養基,成分為K2HPO4 1.6 g,KH2PO4 0.4 g,MgSO4·7H2O 0.2 g,NaCl 0.1g,(NH4)2SO4 0.5 g[7],為本實驗室配制。LB(Luria-Bertani)固體培養基干粉為青島海博生物技術有限公司售品,按說明書配制;地塞米松磷酸鈉培養液為在缺碳培養液中加入500 μg/mL地塞米松磷酸鈉,于使用前配制。
1.1.2 其它實驗材料與儀器
Agilent1100高效液相色譜系統,美國Agilent公司;KQ-3200E型超聲儀,江蘇醫療儀器廠;垂直電泳儀,美國BIO-RAD公司;蛋白質譜分析儀(4800 Plus MALDI TOF/TOFTM),ABI Foster City公司;地塞米松磷酸鈉、地塞米松(HPLC用純品,批號:100016-201015),Sigma公司;陰離子交換纖維素(DEAE-52)、葡聚糖凝膠(Sephadex G-100)、層析柱(1×30 cm)、透析袋(孔徑為0.45 μm)和Ziptip過濾器均購于重慶韻博科技有限公司。
1.2 方法
1.2.1 降解菌的進一步馴化
為提高降解菌對地塞米松的降解率,以利于提取降解酶,將降解菌進一步馴化。取LB瓊脂平板上生長的降解菌菌落,參照Wang等[6]的方法反復馴化10次,再將培養的菌液轉種LB平板,置37℃培養2 d后,取平板上生長的菌落,用新配制的地塞米松磷酸鈉培養液配成4.2×109 cfu/mL濃度的菌液。取1 mL菌液加入含9 mL新配制的地塞米松磷酸鈉培養基液中,同時以不加菌液的含10 mL新配制的地塞米松磷酸鈉培養液為對照培養液,37 ℃培養15 d后,以新配制的含280 μg/mL地塞米松磷酸鈉的甲醇溶解液為標準液,采用高效液相色譜法(high performance liquid chromatography,HPLC)測定對照培養液、培養液中的地塞米松磷酸鈉和地塞米松,以色譜圖中的峰面積計算其含量[6]。通過公式計算出降解率:地塞米松磷酸鈉降解率(%)=(對照培養液地塞米松磷酸鈉濃度-降解菌培養液地塞米松磷酸鈉濃度)÷對照培養液地塞米松磷酸鈉濃度×100%;降解菌降解地塞米松為其它物質的降解率(%)=(降解菌培養液地塞米松磷酸鈉降解量-降解菌培養液地塞米松含量)×地塞米松磷酸鈉分子量÷地塞米松分子量÷降解菌地塞米松磷酸鈉降解量×100%。
1.2.2 降解酶的提取
參照Quan等[8]方法采用滲透休克法分離降解菌各區域蛋白質。取在地塞米松磷酸鈉培養液中最佳生長時期的降解菌菌液[6],4 ℃、6 000 r/min離心10 min,取上清液(A1)凍存。將沉淀液(B1)用0.05 mol/L pH8.0的Tris-HCl緩沖液5 mL重懸,4℃、6 000 r/min離心10 min,用相同緩沖液洗滌2次,取上清液(A2)凍存。其沉淀液(B2)再用20%蔗糖重懸,于37℃震蕩10 min,4 ℃、15 000 r/min離心10 min,取上清液(A3)凍存,其沉淀液(B3)用于提取周質蛋白。將凍存的上清液A1、A2和A3混合,即含該菌的胞外蛋白質。將沉淀液(B3)用冷凍雙蒸水重懸,在冰浴中震蕩10 min后,4 ℃、15 000 r/min離心10 min,取上清液(A4)即含該菌的周質蛋白;將其沉淀液(B4)用0.01 mol/mL、pH 7.5的Tris-HCl重懸,在冰浴中超聲破碎細菌,破碎條件為:破碎時間4 s,間隔10 s,重復10次,功率200 W。將碎菌液4 ℃、15 000 r/min離心20 min,取上清液(A5)即含該菌的胞內蛋白質;棄去沉淀。用BCA法測定各區域分離液的蛋白濃度,SDS-PAGE電泳,考馬斯亮藍染色,凝膠圖像分析儀分析其蛋白成分。
分別取分離的各區域蛋白液400 μL,加入400 μL含500 μg/mL地塞米松甲醇溶解液的pH7.5Tris-HCl緩沖液中,37 ℃作用24 h,100 ℃水浴終止反應。以加500 μg/mL地塞米松的相同緩沖液為空白對照,用HPLC檢測對照液和試驗液中地塞米松含量。以比活力(U·mg-1)為評價標準,即每毫克蛋白中所含的酶活性單位;1個酶活性單位(U)為在pH 7.5、37 ℃條件下,1 min內降解地塞米松的微克量。
1.2.3 降解酶的純化
取胞內蛋白液,分別用含20%、30%、40%、50%、60%硫酸銨的溶液分級沉淀24 h后,4 ℃、15 000 r/min離心20 min,將上清液再分別用在前述濃度各增加10%硫酸銨的溶液再沉淀24 h,4 ℃、15 000 r/min離心20 min,棄上清液,其沉淀液用pH 7.5的Tris-HCl液溶解重懸[9]。用HPLC分別檢測用不同濃度硫酸銨沉淀的蛋白液對地塞米松的降解作用,并計算酶活性,以確定胞內蛋白液鹽析的最適硫酸銨濃度。
先用DEAE-52對硫酸銨鹽析后的蛋白液進行層析。將DEAE-52用0.5 mol/mL的氫氧化鈉與0.5 mol/mL的鹽酸反復膨脹活化直到中性,再將膨脹活化后的DEAE-52凝膠緩慢倒入層析柱,用pH 7.5的Tris-HCl緩沖液平衡2 h,再加入用最適硫酸銨鹽析后的蛋白液。待蛋白液全部進入DEAE-52柱后,再用兩倍柱體積的相同緩沖液洗脫未結合蛋白,然后用0~0.5 mol/mL的氯化鈉液進行梯度洗脫,流速為0.4 mL/min,回收洗脫液,并檢測洗脫液的酶活性。將有酶活性的洗脫液混合后用包有聚乙二醇粉末的透析袋進行濃縮[10],取濃縮后的酶蛋白用SDS-PAGE電泳檢測其純度。最后用Sephadex G-100層析濃縮后的酶蛋白。先將膨脹活化后的Sephadex G-100凝膠緩慢倒入層析柱中,然后用pH 7.5的Tris-HCl緩沖液平衡2 h,再加入濃縮后的酶蛋白。待樣品完全進入層析柱后,用相同緩沖液洗脫蛋白,流速為0.5 mL/min,回收洗脫液,檢測洗脫液中的酶活性。將有酶活性的洗脫液混合,用前述方法濃縮,SDS-PAGE電泳分析蛋白純度,HPLC檢測純化蛋白對地塞米松的降解作用,計算酶活性。
1.2.4 純化蛋白的酶切及質譜鑒定
將純化后的蛋白液經SDS-PAGE電泳的蛋白條帶切下,用200 μL濃度為100 mmol/L的NH4HCO3乙腈脫色后,將凝膠凍干,加入胰蛋白酶,37 ℃反應20 h,再加入60%乙腈與0.1%三氟乙酸的混合液100 μL,超聲15 min后,用Ziptip過濾器進行脫鹽,然后質譜分析。質譜分析儀激光源的波長為355 nm,加速電壓為2 kV。采用正離子和自動獲取數據的模式采集數據,肽指紋圖譜質量掃描范圍為800~4 000 Da,用信噪比大于50的母離子進行二級質譜(MS/MS)分析。每個樣品點上選擇8個母離子,MS/MS激光激發2 500次,碰撞能量為2 kV。將質譜分析后的數據用MSCOT收索引擎檢索鑒定。在檢索過程中,系統根據提供的肽段數量和匹配率綜合考慮,得出一個分值,若該分值大于61分為可信,小于61分則為不可信[11]。
2 結果
2.1 降解菌馴化后的降解作用
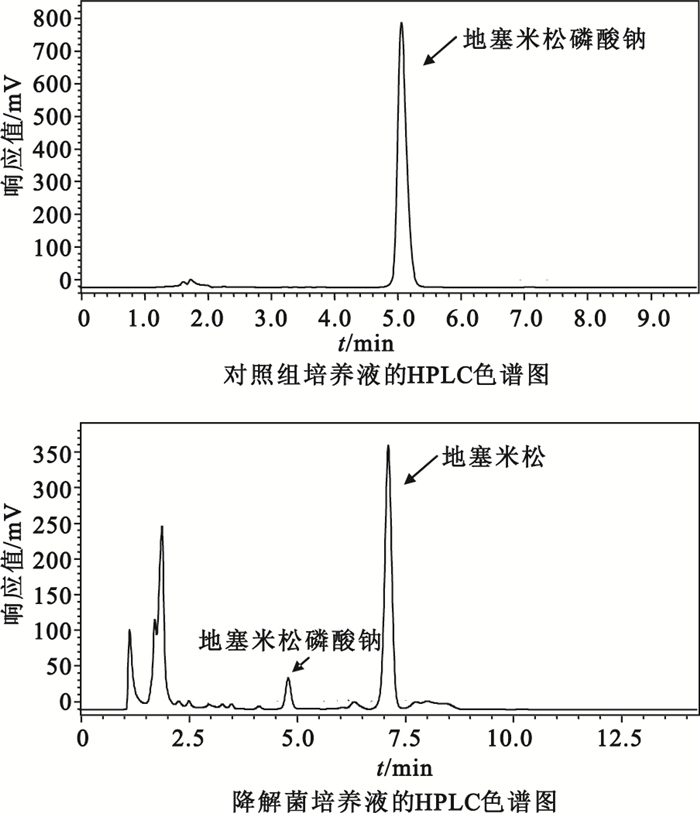
HPLC檢測結果顯示,進一步馴化后的降解菌對地塞米松磷酸鈉的降解率從馴化前的50.86%[6]提高到97.96%,將地塞米松降解為其它物質的降解率從馴化前的23.63%[6]提高到52.84%,HPLC檢測結果如圖 1所示。
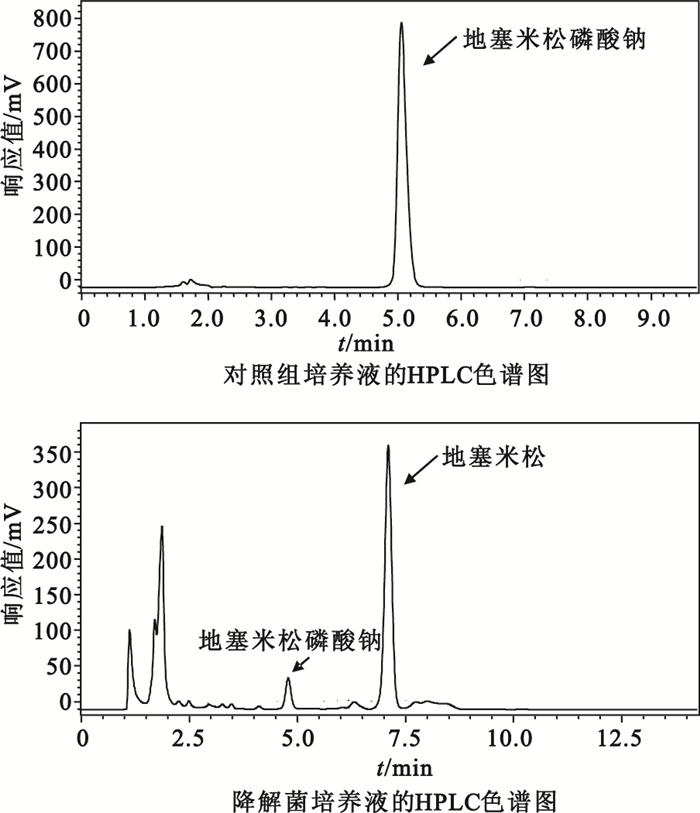 圖1
降解菌對地塞米松磷酸鈉降解作用
Figure1.
Effect of degrading bacteria on dexamethasone sodium phosphate
圖1
降解菌對地塞米松磷酸鈉降解作用
Figure1.
Effect of degrading bacteria on dexamethasone sodium phosphate
2.2 降解菌各區域蛋白的酶活性
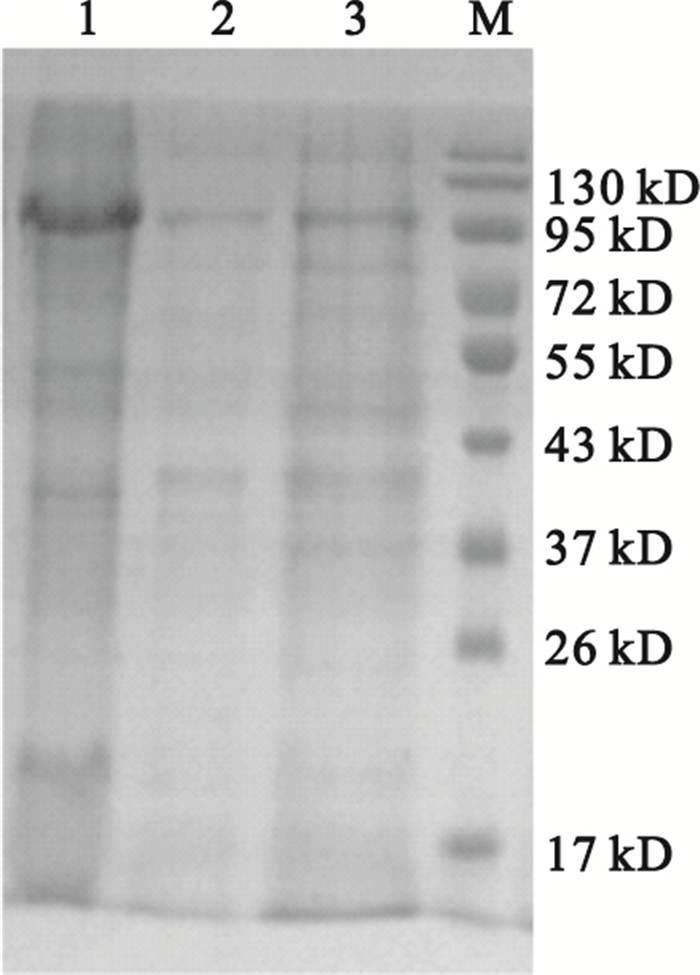
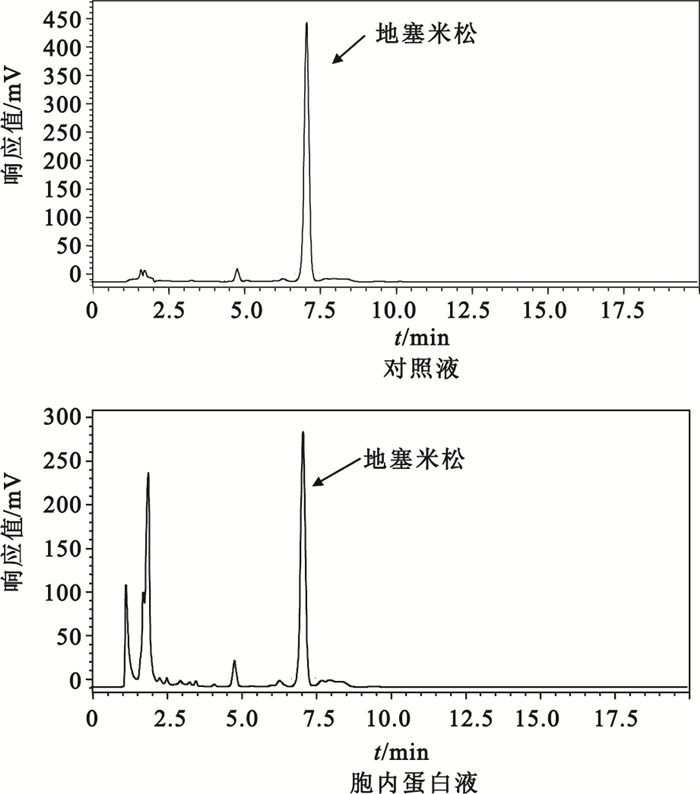
用滲透休克法從降解菌各區域分離到的蛋白液經SDS-PAGE電泳分析顯示,各區域均有大量不同分子量的蛋白質,以分離的胞外液含量最高,其次為胞內液,周質液最少,如圖 2所示。通過對地塞米松降解率以及酶活性的檢測,降解菌中的地塞米松降解酶活性主要分布在胞內液中,其降解率為36%,其HPLC檢測圖,如圖 3所示。周質液中酶活性較少,胞外液中未檢測到酶活性。各區域蛋白液對地塞米松的降解率、酶活性、比活力如表 1所示。
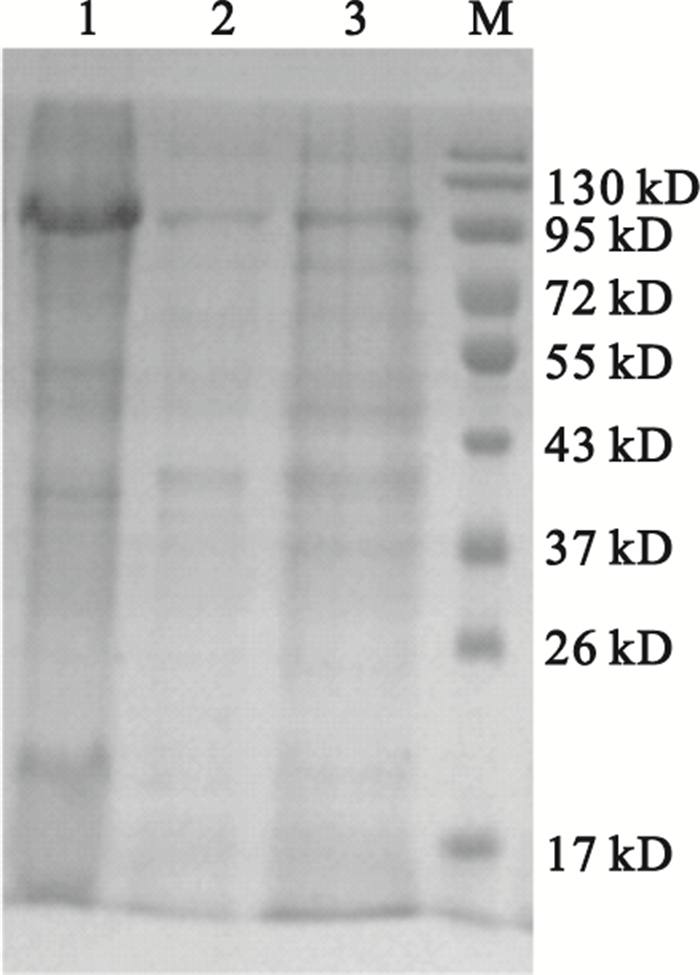 圖2
降解菌各部位蛋白的SDS-PAGE電泳分析
圖2
降解菌各部位蛋白的SDS-PAGE電泳分析
1:胞外蛋白;2:周質蛋白;3:胞內蛋白;M:蛋白marker
Figure2. SDS-PAGE analysis of proteins of every position in the bacteria1: extracellular protein; 2: periplasm protein; 3: intracellular protein; M: protein marke
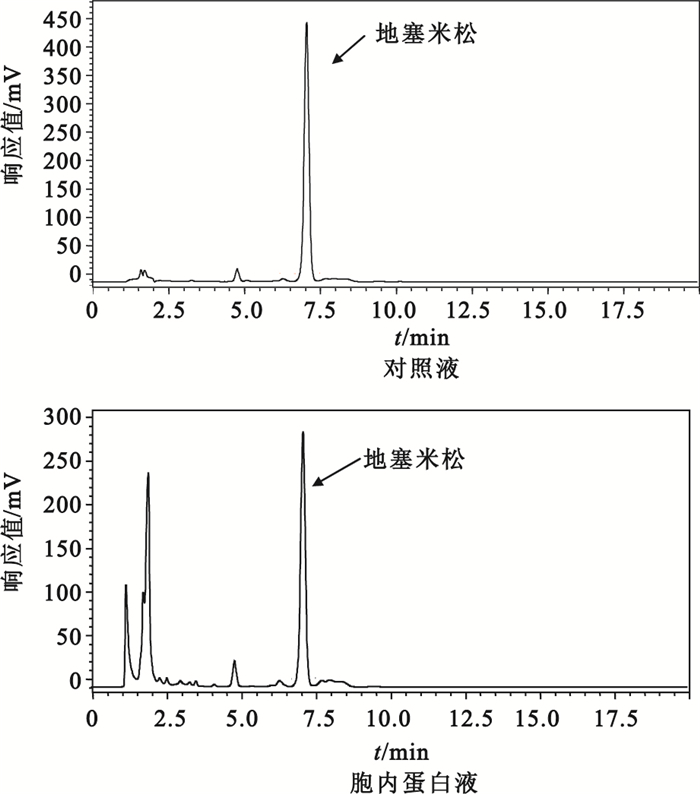 圖3
胞內蛋白降解地塞米松的高效液相色譜圖譜
Figure3.
HPLC chromatogram of the degradation to dexamethasone of the intracellular
圖3
胞內蛋白降解地塞米松的高效液相色譜圖譜
Figure3.
HPLC chromatogram of the degradation to dexamethasone of the intracellular
2.3 降解酶的提取與純化
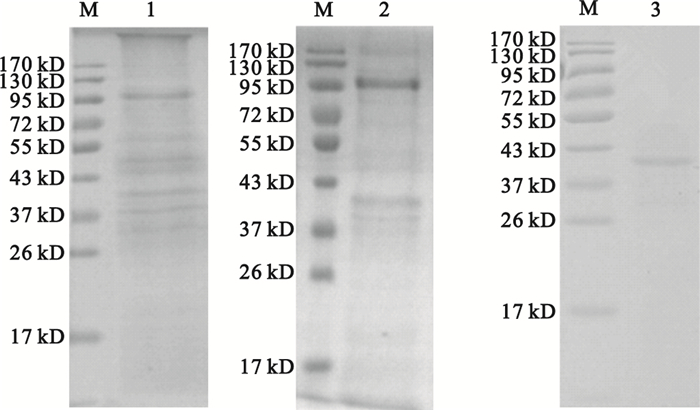
用不同濃度的硫酸銨鹽析含有降解酶活性的胞內液,結果顯示最適鹽析濃度為30%~40%。用最適硫酸銨濃度鹽析、DEAE-52層析、Sephadex G-100層析后,隨著胞內液酶活性蛋白的提取和逐步層析,雖然蛋白含量和總的酶活性逐漸減少,但比活力明顯增高,如表 2所示。SDS-PAGE分析顯示,硫酸銨鹽析后還存在大量蛋白帶,DEAE-52層析后存在少量蛋白帶,Sephadex-100層析后只剩1條蛋白帶,分子量大約為41 KD,如圖 4所示,其純度約為96%,表明已獲得具有較高純度的蛋白酶。
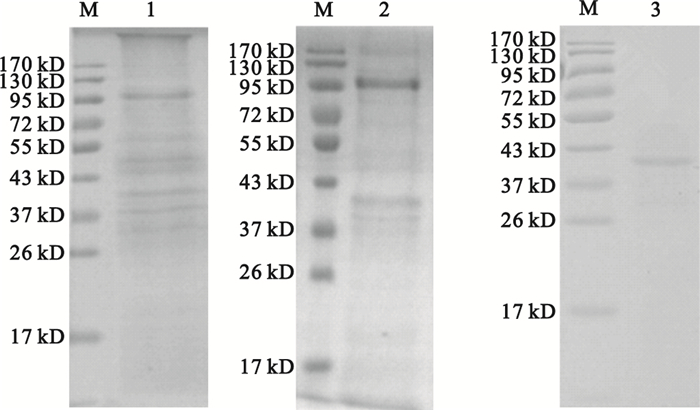 圖4
純化蛋白的SDS-PAGE電泳分析
圖4
純化蛋白的SDS-PAGE電泳分析
M:蛋白marker;1:硫酸銨鹽析液;2:DEAE-52層析;3:Sephadex-100層析
Figure4. SDS-PAGE analysis of the purified proteinM: protein marker; 1: protein after salting-out; 2: protein after DEAE-52; 3: protein after Sephadex-100
2.4 質譜鑒定結果
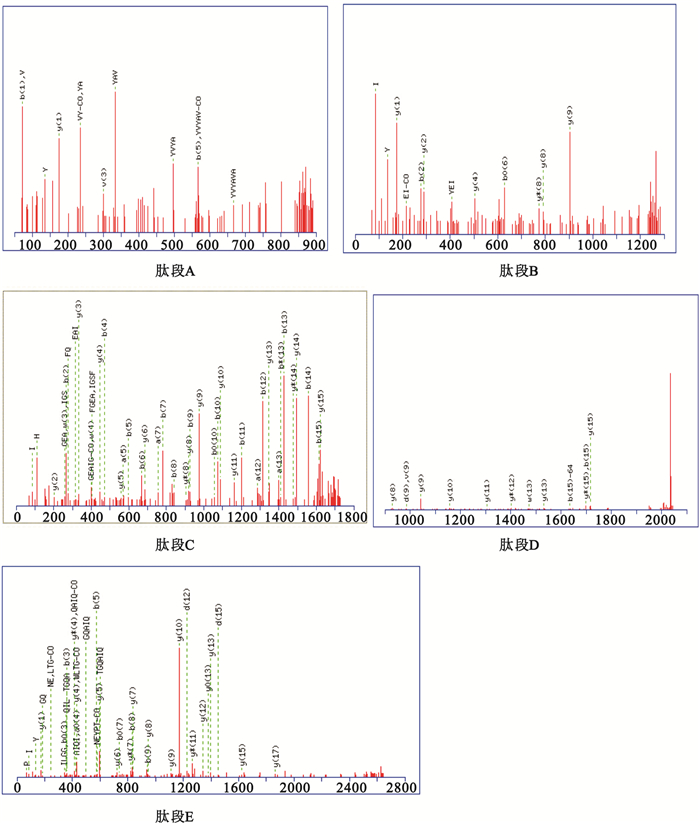
純化后的41 kD蛋白帶經酶切后質譜分析,獲得多條肽段的氨基酸序列數據。用MSCOT收索引擎檢索鑒定,結果顯示該蛋白有五條肽段與異戊酰輔酶A脫氫酶(NCBI,WP-010487056)的部分氨基酸序列完全匹配,覆蓋率為56%,其得分為273分,P<0.05,鑒定為可信。匹配的5條肽段的氨基酸序列分別為:A: MHVPSLNFDLGEDIDLLR;B: RHQFGEAIGSFQLIQGKI;C: RAYVYAVARA;D: KATWLTGQAIQILGGNGYINEYPTGRL;E: KLYEIGAGTSEIRR。匹配肽段的二級質譜(MS/MS)圖如圖 5所示。
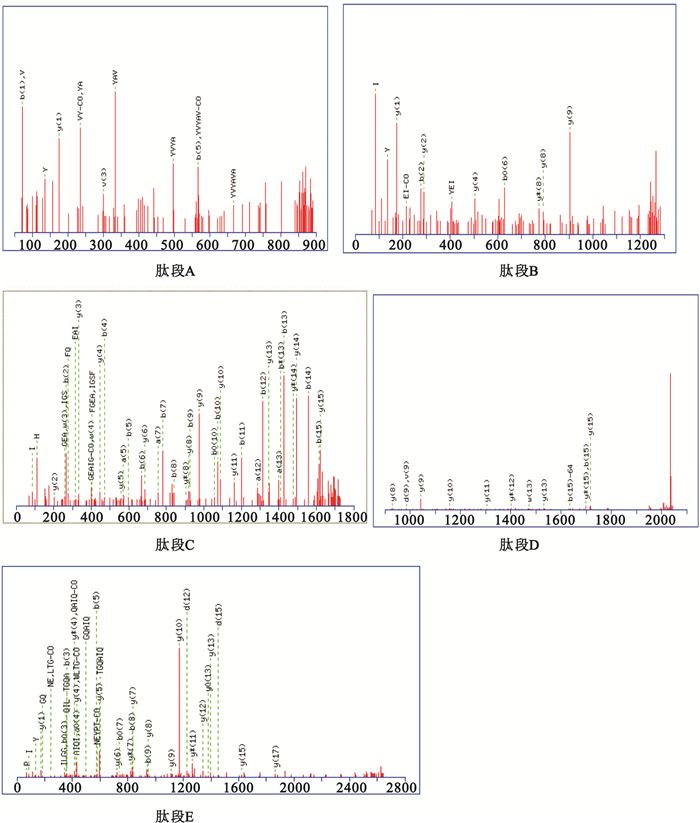 圖5
匹配肽段的MS/MS質譜圖
Figure5.
MS/MS spectrogram of matched peptides
圖5
匹配肽段的MS/MS質譜圖
Figure5.
MS/MS spectrogram of matched peptides
3 討論
本實驗為獲得更多的地塞米松降解酶,先將分離到的地塞米松降解菌進一步馴化,經多次馴化培養后,降解菌對地塞米松的降解作用明顯提高。為探討降解菌的地塞米松降解酶產生的部位,采用滲透休克法提取降解菌的各區域蛋白質。滲透休克法的基本原理是革蘭陰性菌在液體環境突然發生滲透壓改變時,細菌出現質璧分離,再突然降溫,使外膜破裂而釋放出周質蛋白[8]。對降解菌各區域蛋白的降解酶活性檢測結果顯示其酶活性主要存在于胞內液中,因此,對地塞米松降解酶的進一步提取和純化均采用胞內液。
因為地塞米松難溶于水,若用甲醇等溶解地塞米松后再加入培養基中,會影響細菌的生長;但在對酶的活性檢測中,雖然用甲醇溶解地塞米松,但量少,并不影響酶的活性。因此本實驗在細菌的培養中僅應用了地塞米松磷酸鈉培養基,而在酶活性檢測中,還應用了地塞米松。經硫酸銨鹽析后的蛋白液,雖然降解酶的活性較高,但酶的純度不高。為了進一步提高酶的純度,采用了蛋白純化最有效的離子交換層析和葡聚糖凝膠層析相結合的方法進一步純化。離子交換蛋白層析的基本原理是帶電的蛋白質和離子交換劑的基團進行交換而被分離純化[12],葡聚糖凝膠層析的基本原理是以多孔珠為固定相,根據蛋白的不同分子大小而對蛋白進行分離純化。純化后的蛋白液雖然酶的活性有所降低,但是純度提高了19.62倍。
Tanaka等[13]發現異戊酰輔酶A脫氫酶可以黃素腺嘌呤二核苷酸為輔助因子將異戊酰輔酶A脫氫為3-甲基巴豆酰輔酶A,Forster等[14-15]在銅綠假單胞菌中也發現了異戊酰輔酶A脫氫酶,該酶在有機物的利用中,起著關鍵的作用。本文提取純化的蛋白酶經質譜鑒定,再與蛋白數據庫對比結果表明,純化后蛋白有5條肽段的氨基酸序列與異戊酰輔酶A脫氫酶的部分氨基酸序列完全匹配,覆蓋率為56%,由此可推斷該酶具有與異戊酰輔酶A脫氫酶相似的功能,但其氨基酸序列尚存在44%的不匹配,由此推測可能是一種新的甾體類化合物降解酶。本文的結果為采用微生物修復技術清除水環境污染的地塞米松磷酸鈉和地塞米松,以及治理其它甾體類化合物的環境污染提供了一種新策略。
引言
近年來,面對環境激素的嚴重污染和危害,國內外學者開始探索利用微生物自身的代謝過程來降解污染物,并以研究降解的關鍵酶為主[1]。地塞米松(dexamethasone)是以天然的氫化可的松為原料人工合成的長效皮質激素,臨床常用制劑為易溶于水的地塞米松磷酸鈉(dexamethasone sodium phosphate)。地塞米松類藥物是世界范圍內臨床上廣泛應用的激素,常用于臨床各科多種疾病的治療。在應用過程中,地塞米松類藥物的殘液可經各種途徑污染環境,特別是醫院的廢水,也可從應用者體內經分泌液和尿液排出,污染更廣泛的水環境[2]。國內外多篇資料報道,在醫院廢水、城市污水及江水中存在不同程度的地塞米松及其它糖皮質類激素污染[3-4]。目前,醫院廢水的處理主要采用的是物理、生物化學和消毒的方法,這些方法可清除廢水中的病原體、放射性物質、重金屬等,但尚未對激素類污染物進行有效處理[5],也未見清除廢水中地塞米松以及其它糖皮質類激素的方法和制劑的報道。本文在從污染地塞米松的醫院廢水中分離到1株可降解地塞米松磷酸鈉和地塞米松的產堿假單胞菌(本文中簡稱降解菌)的基礎上[6],提取、純化和鑒定其降解地塞米松的酶,為制備清除環境中地塞米松類藥物污染的生物凈化劑,甚至消除應用地塞米松類藥物的臨床副作用提供新策略。
1 材料與方法
1.1 材料
1.1.1 菌種與主要培養基
降解地塞米松磷酸鈉和地塞米松的產堿假單胞菌(2012YZB2)為本實驗室分離后保存,并同時保藏于中國典型培養物保藏中心,編號CCTCCNO:M2014231;該菌對地塞米松磷酸鈉的轉化率為50.86%,對地塞米松的降解率為23.63%[6]。缺碳培養基,成分為K2HPO4 1.6 g,KH2PO4 0.4 g,MgSO4·7H2O 0.2 g,NaCl 0.1g,(NH4)2SO4 0.5 g[7],為本實驗室配制。LB(Luria-Bertani)固體培養基干粉為青島海博生物技術有限公司售品,按說明書配制;地塞米松磷酸鈉培養液為在缺碳培養液中加入500 μg/mL地塞米松磷酸鈉,于使用前配制。
1.1.2 其它實驗材料與儀器
Agilent1100高效液相色譜系統,美國Agilent公司;KQ-3200E型超聲儀,江蘇醫療儀器廠;垂直電泳儀,美國BIO-RAD公司;蛋白質譜分析儀(4800 Plus MALDI TOF/TOFTM),ABI Foster City公司;地塞米松磷酸鈉、地塞米松(HPLC用純品,批號:100016-201015),Sigma公司;陰離子交換纖維素(DEAE-52)、葡聚糖凝膠(Sephadex G-100)、層析柱(1×30 cm)、透析袋(孔徑為0.45 μm)和Ziptip過濾器均購于重慶韻博科技有限公司。
1.2 方法
1.2.1 降解菌的進一步馴化
為提高降解菌對地塞米松的降解率,以利于提取降解酶,將降解菌進一步馴化。取LB瓊脂平板上生長的降解菌菌落,參照Wang等[6]的方法反復馴化10次,再將培養的菌液轉種LB平板,置37℃培養2 d后,取平板上生長的菌落,用新配制的地塞米松磷酸鈉培養液配成4.2×109 cfu/mL濃度的菌液。取1 mL菌液加入含9 mL新配制的地塞米松磷酸鈉培養基液中,同時以不加菌液的含10 mL新配制的地塞米松磷酸鈉培養液為對照培養液,37 ℃培養15 d后,以新配制的含280 μg/mL地塞米松磷酸鈉的甲醇溶解液為標準液,采用高效液相色譜法(high performance liquid chromatography,HPLC)測定對照培養液、培養液中的地塞米松磷酸鈉和地塞米松,以色譜圖中的峰面積計算其含量[6]。通過公式計算出降解率:地塞米松磷酸鈉降解率(%)=(對照培養液地塞米松磷酸鈉濃度-降解菌培養液地塞米松磷酸鈉濃度)÷對照培養液地塞米松磷酸鈉濃度×100%;降解菌降解地塞米松為其它物質的降解率(%)=(降解菌培養液地塞米松磷酸鈉降解量-降解菌培養液地塞米松含量)×地塞米松磷酸鈉分子量÷地塞米松分子量÷降解菌地塞米松磷酸鈉降解量×100%。
1.2.2 降解酶的提取
參照Quan等[8]方法采用滲透休克法分離降解菌各區域蛋白質。取在地塞米松磷酸鈉培養液中最佳生長時期的降解菌菌液[6],4 ℃、6 000 r/min離心10 min,取上清液(A1)凍存。將沉淀液(B1)用0.05 mol/L pH8.0的Tris-HCl緩沖液5 mL重懸,4℃、6 000 r/min離心10 min,用相同緩沖液洗滌2次,取上清液(A2)凍存。其沉淀液(B2)再用20%蔗糖重懸,于37℃震蕩10 min,4 ℃、15 000 r/min離心10 min,取上清液(A3)凍存,其沉淀液(B3)用于提取周質蛋白。將凍存的上清液A1、A2和A3混合,即含該菌的胞外蛋白質。將沉淀液(B3)用冷凍雙蒸水重懸,在冰浴中震蕩10 min后,4 ℃、15 000 r/min離心10 min,取上清液(A4)即含該菌的周質蛋白;將其沉淀液(B4)用0.01 mol/mL、pH 7.5的Tris-HCl重懸,在冰浴中超聲破碎細菌,破碎條件為:破碎時間4 s,間隔10 s,重復10次,功率200 W。將碎菌液4 ℃、15 000 r/min離心20 min,取上清液(A5)即含該菌的胞內蛋白質;棄去沉淀。用BCA法測定各區域分離液的蛋白濃度,SDS-PAGE電泳,考馬斯亮藍染色,凝膠圖像分析儀分析其蛋白成分。
分別取分離的各區域蛋白液400 μL,加入400 μL含500 μg/mL地塞米松甲醇溶解液的pH7.5Tris-HCl緩沖液中,37 ℃作用24 h,100 ℃水浴終止反應。以加500 μg/mL地塞米松的相同緩沖液為空白對照,用HPLC檢測對照液和試驗液中地塞米松含量。以比活力(U·mg-1)為評價標準,即每毫克蛋白中所含的酶活性單位;1個酶活性單位(U)為在pH 7.5、37 ℃條件下,1 min內降解地塞米松的微克量。
1.2.3 降解酶的純化
取胞內蛋白液,分別用含20%、30%、40%、50%、60%硫酸銨的溶液分級沉淀24 h后,4 ℃、15 000 r/min離心20 min,將上清液再分別用在前述濃度各增加10%硫酸銨的溶液再沉淀24 h,4 ℃、15 000 r/min離心20 min,棄上清液,其沉淀液用pH 7.5的Tris-HCl液溶解重懸[9]。用HPLC分別檢測用不同濃度硫酸銨沉淀的蛋白液對地塞米松的降解作用,并計算酶活性,以確定胞內蛋白液鹽析的最適硫酸銨濃度。
先用DEAE-52對硫酸銨鹽析后的蛋白液進行層析。將DEAE-52用0.5 mol/mL的氫氧化鈉與0.5 mol/mL的鹽酸反復膨脹活化直到中性,再將膨脹活化后的DEAE-52凝膠緩慢倒入層析柱,用pH 7.5的Tris-HCl緩沖液平衡2 h,再加入用最適硫酸銨鹽析后的蛋白液。待蛋白液全部進入DEAE-52柱后,再用兩倍柱體積的相同緩沖液洗脫未結合蛋白,然后用0~0.5 mol/mL的氯化鈉液進行梯度洗脫,流速為0.4 mL/min,回收洗脫液,并檢測洗脫液的酶活性。將有酶活性的洗脫液混合后用包有聚乙二醇粉末的透析袋進行濃縮[10],取濃縮后的酶蛋白用SDS-PAGE電泳檢測其純度。最后用Sephadex G-100層析濃縮后的酶蛋白。先將膨脹活化后的Sephadex G-100凝膠緩慢倒入層析柱中,然后用pH 7.5的Tris-HCl緩沖液平衡2 h,再加入濃縮后的酶蛋白。待樣品完全進入層析柱后,用相同緩沖液洗脫蛋白,流速為0.5 mL/min,回收洗脫液,檢測洗脫液中的酶活性。將有酶活性的洗脫液混合,用前述方法濃縮,SDS-PAGE電泳分析蛋白純度,HPLC檢測純化蛋白對地塞米松的降解作用,計算酶活性。
1.2.4 純化蛋白的酶切及質譜鑒定
將純化后的蛋白液經SDS-PAGE電泳的蛋白條帶切下,用200 μL濃度為100 mmol/L的NH4HCO3乙腈脫色后,將凝膠凍干,加入胰蛋白酶,37 ℃反應20 h,再加入60%乙腈與0.1%三氟乙酸的混合液100 μL,超聲15 min后,用Ziptip過濾器進行脫鹽,然后質譜分析。質譜分析儀激光源的波長為355 nm,加速電壓為2 kV。采用正離子和自動獲取數據的模式采集數據,肽指紋圖譜質量掃描范圍為800~4 000 Da,用信噪比大于50的母離子進行二級質譜(MS/MS)分析。每個樣品點上選擇8個母離子,MS/MS激光激發2 500次,碰撞能量為2 kV。將質譜分析后的數據用MSCOT收索引擎檢索鑒定。在檢索過程中,系統根據提供的肽段數量和匹配率綜合考慮,得出一個分值,若該分值大于61分為可信,小于61分則為不可信[11]。
2 結果
2.1 降解菌馴化后的降解作用
HPLC檢測結果顯示,進一步馴化后的降解菌對地塞米松磷酸鈉的降解率從馴化前的50.86%[6]提高到97.96%,將地塞米松降解為其它物質的降解率從馴化前的23.63%[6]提高到52.84%,HPLC檢測結果如圖 1所示。
 圖1
降解菌對地塞米松磷酸鈉降解作用
Figure1.
Effect of degrading bacteria on dexamethasone sodium phosphate
圖1
降解菌對地塞米松磷酸鈉降解作用
Figure1.
Effect of degrading bacteria on dexamethasone sodium phosphate
2.2 降解菌各區域蛋白的酶活性
用滲透休克法從降解菌各區域分離到的蛋白液經SDS-PAGE電泳分析顯示,各區域均有大量不同分子量的蛋白質,以分離的胞外液含量最高,其次為胞內液,周質液最少,如圖 2所示。通過對地塞米松降解率以及酶活性的檢測,降解菌中的地塞米松降解酶活性主要分布在胞內液中,其降解率為36%,其HPLC檢測圖,如圖 3所示。周質液中酶活性較少,胞外液中未檢測到酶活性。各區域蛋白液對地塞米松的降解率、酶活性、比活力如表 1所示。
 圖2
降解菌各部位蛋白的SDS-PAGE電泳分析
圖2
降解菌各部位蛋白的SDS-PAGE電泳分析
1:胞外蛋白;2:周質蛋白;3:胞內蛋白;M:蛋白marker
Figure2. SDS-PAGE analysis of proteins of every position in the bacteria1: extracellular protein; 2: periplasm protein; 3: intracellular protein; M: protein marke
 圖3
胞內蛋白降解地塞米松的高效液相色譜圖譜
Figure3.
HPLC chromatogram of the degradation to dexamethasone of the intracellular
圖3
胞內蛋白降解地塞米松的高效液相色譜圖譜
Figure3.
HPLC chromatogram of the degradation to dexamethasone of the intracellular
2.3 降解酶的提取與純化
用不同濃度的硫酸銨鹽析含有降解酶活性的胞內液,結果顯示最適鹽析濃度為30%~40%。用最適硫酸銨濃度鹽析、DEAE-52層析、Sephadex G-100層析后,隨著胞內液酶活性蛋白的提取和逐步層析,雖然蛋白含量和總的酶活性逐漸減少,但比活力明顯增高,如表 2所示。SDS-PAGE分析顯示,硫酸銨鹽析后還存在大量蛋白帶,DEAE-52層析后存在少量蛋白帶,Sephadex-100層析后只剩1條蛋白帶,分子量大約為41 KD,如圖 4所示,其純度約為96%,表明已獲得具有較高純度的蛋白酶。
 圖4
純化蛋白的SDS-PAGE電泳分析
圖4
純化蛋白的SDS-PAGE電泳分析
M:蛋白marker;1:硫酸銨鹽析液;2:DEAE-52層析;3:Sephadex-100層析
Figure4. SDS-PAGE analysis of the purified proteinM: protein marker; 1: protein after salting-out; 2: protein after DEAE-52; 3: protein after Sephadex-100
2.4 質譜鑒定結果
純化后的41 kD蛋白帶經酶切后質譜分析,獲得多條肽段的氨基酸序列數據。用MSCOT收索引擎檢索鑒定,結果顯示該蛋白有五條肽段與異戊酰輔酶A脫氫酶(NCBI,WP-010487056)的部分氨基酸序列完全匹配,覆蓋率為56%,其得分為273分,P<0.05,鑒定為可信。匹配的5條肽段的氨基酸序列分別為:A: MHVPSLNFDLGEDIDLLR;B: RHQFGEAIGSFQLIQGKI;C: RAYVYAVARA;D: KATWLTGQAIQILGGNGYINEYPTGRL;E: KLYEIGAGTSEIRR。匹配肽段的二級質譜(MS/MS)圖如圖 5所示。
 圖5
匹配肽段的MS/MS質譜圖
Figure5.
MS/MS spectrogram of matched peptides
圖5
匹配肽段的MS/MS質譜圖
Figure5.
MS/MS spectrogram of matched peptides
3 討論
本實驗為獲得更多的地塞米松降解酶,先將分離到的地塞米松降解菌進一步馴化,經多次馴化培養后,降解菌對地塞米松的降解作用明顯提高。為探討降解菌的地塞米松降解酶產生的部位,采用滲透休克法提取降解菌的各區域蛋白質。滲透休克法的基本原理是革蘭陰性菌在液體環境突然發生滲透壓改變時,細菌出現質璧分離,再突然降溫,使外膜破裂而釋放出周質蛋白[8]。對降解菌各區域蛋白的降解酶活性檢測結果顯示其酶活性主要存在于胞內液中,因此,對地塞米松降解酶的進一步提取和純化均采用胞內液。
因為地塞米松難溶于水,若用甲醇等溶解地塞米松后再加入培養基中,會影響細菌的生長;但在對酶的活性檢測中,雖然用甲醇溶解地塞米松,但量少,并不影響酶的活性。因此本實驗在細菌的培養中僅應用了地塞米松磷酸鈉培養基,而在酶活性檢測中,還應用了地塞米松。經硫酸銨鹽析后的蛋白液,雖然降解酶的活性較高,但酶的純度不高。為了進一步提高酶的純度,采用了蛋白純化最有效的離子交換層析和葡聚糖凝膠層析相結合的方法進一步純化。離子交換蛋白層析的基本原理是帶電的蛋白質和離子交換劑的基團進行交換而被分離純化[12],葡聚糖凝膠層析的基本原理是以多孔珠為固定相,根據蛋白的不同分子大小而對蛋白進行分離純化。純化后的蛋白液雖然酶的活性有所降低,但是純度提高了19.62倍。
Tanaka等[13]發現異戊酰輔酶A脫氫酶可以黃素腺嘌呤二核苷酸為輔助因子將異戊酰輔酶A脫氫為3-甲基巴豆酰輔酶A,Forster等[14-15]在銅綠假單胞菌中也發現了異戊酰輔酶A脫氫酶,該酶在有機物的利用中,起著關鍵的作用。本文提取純化的蛋白酶經質譜鑒定,再與蛋白數據庫對比結果表明,純化后蛋白有5條肽段的氨基酸序列與異戊酰輔酶A脫氫酶的部分氨基酸序列完全匹配,覆蓋率為56%,由此可推斷該酶具有與異戊酰輔酶A脫氫酶相似的功能,但其氨基酸序列尚存在44%的不匹配,由此推測可能是一種新的甾體類化合物降解酶。本文的結果為采用微生物修復技術清除水環境污染的地塞米松磷酸鈉和地塞米松,以及治理其它甾體類化合物的環境污染提供了一種新策略。