本研究旨在探討納秒電脈沖(nsEP)對人卵巢癌細胞鉑敏感株A2780及鉑耐藥株C30的DNA損傷效應。將A2780和C30分別作用于場強為6 kV/cm,脈寬為24 ns的脈沖電場處理60 s。假處理組予假脈沖處理。nsEP處理后0 h、4 h、8 h、12 h和24 h采用CCK-8法檢測細胞生存率;采用堿性單細胞凝膠電泳實驗(彗星實驗)檢測細胞DNA損傷,測定彗星尾長(TL)、尾矩(TM)和Olive尾矩(OTM)的75th百分位數。結果顯示隨著時間增加,A2780和C30細胞的生存率和彗星形成率均先降低后增加,8 h時最低(P<0.05);C30細胞的生存率高于A2780細胞(P<0.05),彗星形成率低于A2780細胞(P<0.05);C30細胞的TL、TM和OTM均低于A2780細胞(P<0.05);細胞死亡率和彗星形成率呈正相關(r=0.997,P<0.05;r=0.998,P<0.05)。結果表明,nsEP對人卵巢癌鉑敏感細胞株和鉑耐藥細胞株的DNA損傷效應存在差異;nsEP致細胞死亡與DNA損傷相關。
引用本文: 劉紹麗, 付曉, 任學毅, 于廷和, 胡麗娜. 納秒電脈沖致人卵巢癌細胞DNA損傷的時間效應. 生物醫學工程學雜志, 2015, 32(5): 1075-1078. doi: 10.7507/1001-5515.20150190 復制
版權信息: ?四川大學華西醫院華西期刊社《生物醫學工程學雜志》版權所有,未經授權不得轉載、改編
引言
卵巢癌是女性生殖器常見惡性腫瘤之一,盡管已有多種治療應用于臨床,但其5年生存率仍僅為45%[1]。卵巢癌的化療是一種聯合化療,以鉑類為基礎,其中順鉑是比較有效且廣泛應用于臨床的一線藥物,但長期化療患者及卵巢癌復發患者的耐藥情況十分普遍,故療效不盡如人意[2]。因此,尋求新的、非藥物的治療方案甚有必要。Beebe等[3]發現單獨使用脈沖電場可致腫瘤細胞死亡。根據脈沖電場參數(強度或脈寬)的不同,可產生不同的生物效應。微秒(μs)強度的電脈沖可產生電穿孔效應(electroporation);納秒(ns)強度的電脈沖對細胞膜的影響極小而能夠對細胞核產生較大影響,從而有效抑制腫瘤的生長。理論計算表明納秒電脈沖(nanosecond electric pulses,nsEP)可跨膜影響細胞內結構[4]。nsEP作為一種不需要藥物的純電場治療,且無熱消融,有望成為腫瘤治療的一種新型手段[5]。為進一步研究卵巢癌順鉑耐藥細胞的治療,本文選擇人卵巢癌鉑敏感細胞株A2780和人卵巢癌鉑耐藥細胞株C30作為研究對象,旨在通過研究nsEP對人卵巢癌鉑敏感和鉑耐藥細胞株DNA損傷的時間效應,探討nsEP引起的DNA損傷與細胞死亡之間的相關性。
1 材料與方法
1.1 材料
1.1.1 試劑RPMI
1640培養基(Hyclone,美國),胎牛血清(四季青,中國),胰蛋白酶(Hyclone,美國),DAPI(Biotium,美國),順鉑注射液(云南個舊生物藥業有限公司,中國),CCK-8試劑盒(同仁,日本),低熔點瓊脂糖(Promega,美國),正常熔點瓊脂糖(TIANGEN,中國),TritonX-100(北京鼎國昌盛生物技術有限責任公司,中國)。
1.1.2 儀器
納秒脈沖電源(本實驗室自主研制)[4],CO2細胞培養箱、全波長酶標儀(Thermo Scientific,美國),電泳儀(BIO-RAD,美國),熒光顯微鏡(Nikon Ti-E,日本)。
1.1.3 細胞系
人卵巢癌鉑敏感細胞株A2780購于中國典型培養物保藏中心(China Center for Type Culture Collection,CCTCC),鉑耐藥株C30為重慶醫科大學第二附屬醫院婦產科重點實驗室保存。
1.2 方法
1.2.1 細胞培養
A2780和C30細胞以含體積分數為10%胎牛血清,5%雙抗(100 U/mL青霉素和0.1 mg/mL鏈霉素)的RPMI 1640培養基,于37 ℃、 5% CO2培養條件下培養,每2~3 d換液,并觀察其生長狀態。C30細胞培養基中加入9 μg/mL順鉑,實驗前48 h更換為無藥培養基。
1.2.2 nsEP處理
取對數生長期的細胞制備密度為5×105個/mL的單細胞懸液,取1 mL細胞于24孔板中,調整電極間距離為1 cm,電壓6 kV(即場強6 kV/cm),脈寬為24 ns的脈沖電場處理60 s。假處理組細胞給予假脈沖處理。
1.2.3 CCK-8法檢測細胞死亡率
nsEP處理后繼續培養細胞于0、4、8、12和24 h用CCK-8試劑盒測定細胞活性,并計算細胞死亡率[6]。每個時間點均設置有實驗組(nsEP處理后)、假處理組(nsEP假處理)和空白組(不含細胞,僅加入100 μL實驗用培養基)。具體步驟:①將上述nsEP處理后的細胞調整密度為3.5×105個/mL的單細胞懸液,接種于96孔板中,設置3個復孔;②在相同時間點的96孔板每孔中加入CCK-8試劑10 μL,包括空白組;③將孔板中的細胞放置于37 ℃細胞培養箱中繼續孵育2 h后,用全波長酶標儀于450 nm測定吸光度(A)。
細胞存活率(%)=[(A實驗孔-A空白孔)/(A對照孔-A空白孔)]×100%。
細胞死亡率(%) =1-細胞存活率(%)
1.2.4 單細胞凝膠電泳實驗
于nsEP處理后4、8、12、24 h,參照Singh等[7]描述的方法行單細胞凝膠電泳。具體步驟如下:第一層膠的制備:于自制的光面載玻片上滴加150 μL 1%的正常熔點瓊脂糖,加蓋蓋玻片。4 ℃固化20 min。第二層膠的制備:輕輕揭去蓋玻片,在第一層膠上滴加1∶5(細胞∶低熔點瓊脂糖)比例配制的含有8×104個細胞的75 μL低熔點瓊脂糖,加蓋蓋玻片,4 ℃固化20 min。裂解:輕輕揭去蓋玻片,將制好的凝膠玻片浸入冰冷的堿性(pH 10.0)裂解液中(臨用前加1% Triton X-100),4 ℃裂解2 h。解旋:取出凝膠玻片,PBS漂洗3次后置于水平電泳槽內,加入pH 13的堿性電泳緩沖液(高于玻片2~3 mm),避光放置20 min。電泳:設置電壓25 V,電流300 mA,電泳20 min。漂洗:pH 7.5的Tris-HCl漂洗3次,每次5 min,室溫晾干。染色:膠上滴加濃度為5 μg/mL DAPI染色15 min,雙蒸水漂洗3次,每次5 min,室溫晾干。圖像采集:采用倒置熒光顯微鏡觀察、攝像。每組至少采集100個細胞作彗星分析。
單細胞凝膠電泳后得到的彗星圖像用CASP(http://casplab.com)軟件分析,測量尾長(tail length,TL)、尾矩(tail moment,TM,尾部DNA%×尾長)以及Olive尾矩(Olive tail moment,OTM,尾部DNA%×尾矩長),并計算彗星形成率(%)[
1.3 統計學方法
采用SPSS 21.0統計學軟件進行統計學處理,組間均數比較采用ANOVA檢驗。對細胞死亡率和彗星形成率之間的關系采用線性相關分析。非正態數據采用Kruskal-Wallis檢驗。P<0.05表示差異有統計學意義。
2 結果
2.1 細胞生存率
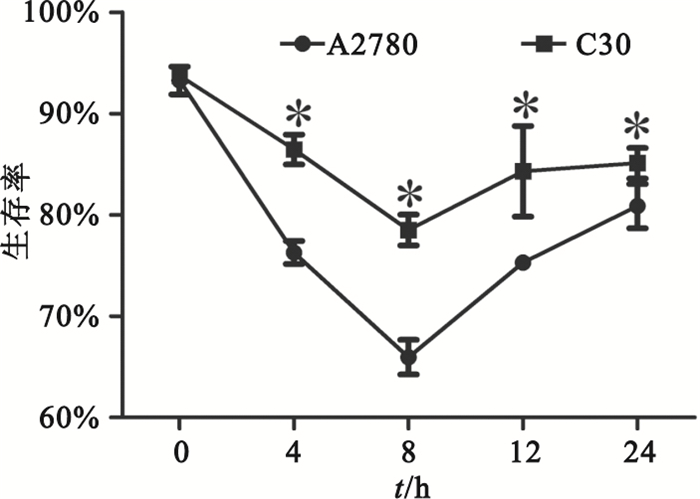
nsEP處理后0~8 h,A2780和C30細胞的生存率逐漸降低,8~24 h逐漸上升,8 h時細胞生存率最低。C30細胞的生存率明顯高于A2780細胞(P<0.05),如圖 1所示。
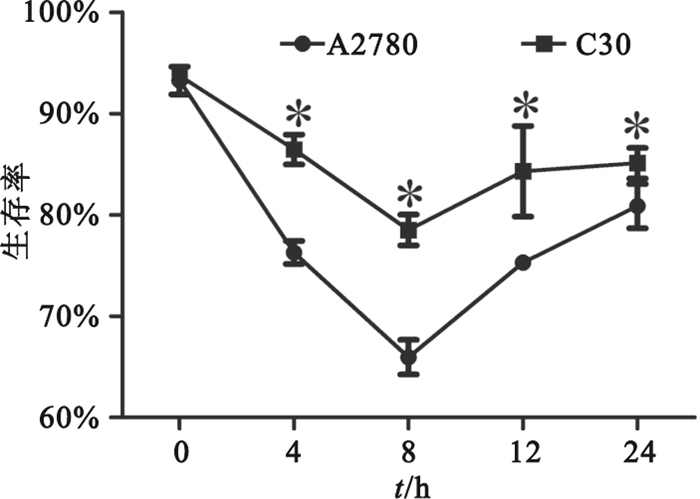 圖1
nsEP處理后A2780和C30在不同時間點的生存率*P<0.05,與A2780細胞株相比
Figure1.
Cell viability of A2780 and C30 vary with time after nsEP *P<0.05, vs. A2780
圖1
nsEP處理后A2780和C30在不同時間點的生存率*P<0.05,與A2780細胞株相比
Figure1.
Cell viability of A2780 and C30 vary with time after nsEP *P<0.05, vs. A2780
2.2 細胞死亡率與彗星形成率
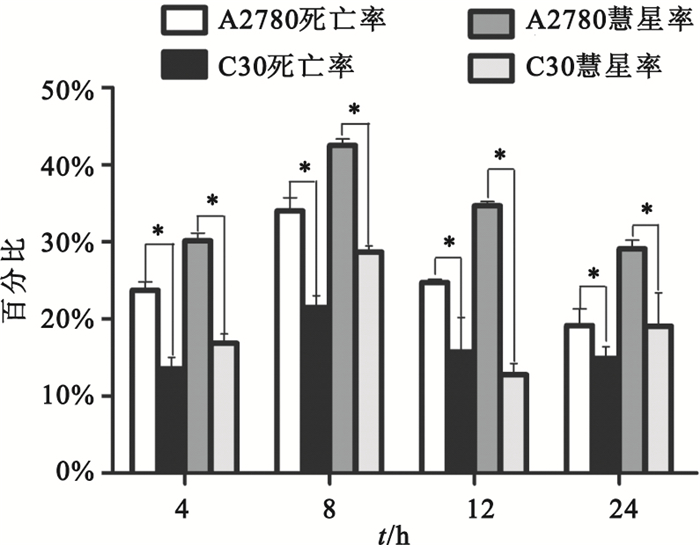
單細胞凝膠電泳結果,如圖 2所示,可明顯看出A2780細胞在4、8、12和24 h都表觀出彗星圖像的尾長比C30細胞長。A2780細胞的死亡率與彗星形成率在4~24 h均高于C30細胞,如圖 3所示;A2780和C30細胞的死亡率均與彗星形成率呈正相關(r=0.997,P<0.05;r=0.998,P<0.05)。
 圖2
nsEP處理后A2780和C30在不同時間點的單細胞凝膠電泳結果
Figure2.
Comet assay figure of A2780 and C30 vary with time
圖2
nsEP處理后A2780和C30在不同時間點的單細胞凝膠電泳結果
Figure2.
Comet assay figure of A2780 and C30 vary with time
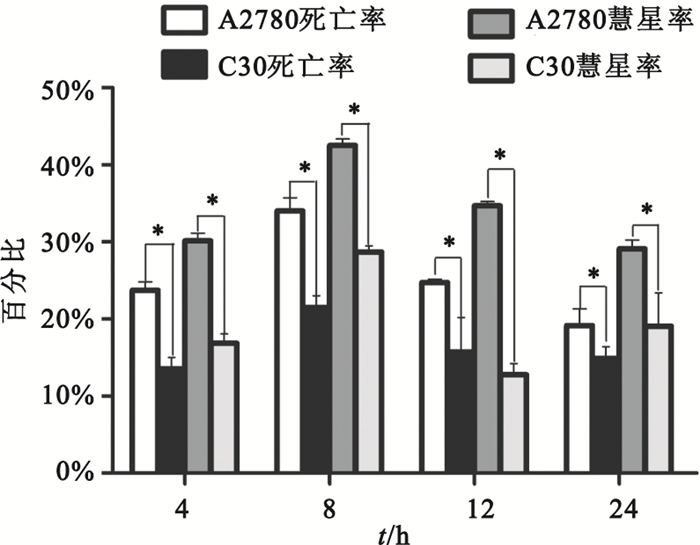 圖3
nsEP處理后A2780和C30在不同時間點的細胞死亡率與彗星形成率*P<0.05,與A2780細胞株相比
Figure3.
Percentage of dead cells and comet-formed of A2780 and C30 in 4, 8, 12 and 24 h *P<0.05, vs. A2780
圖3
nsEP處理后A2780和C30在不同時間點的細胞死亡率與彗星形成率*P<0.05,與A2780細胞株相比
Figure3.
Percentage of dead cells and comet-formed of A2780 and C30 in 4, 8, 12 and 24 h *P<0.05, vs. A2780
2.3 TL、TM和OTM
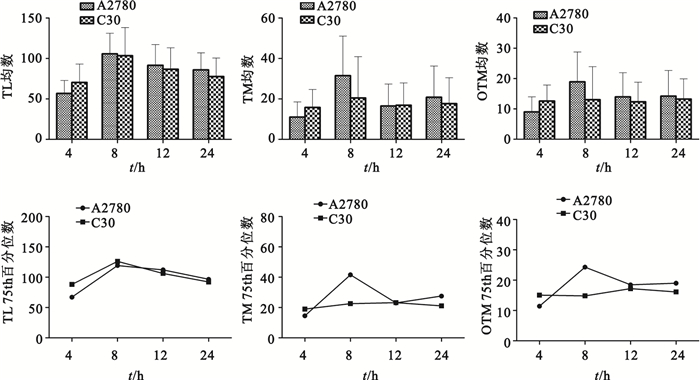
A2780和C30細胞的TL、TM、OTM及其75 th百分位數均隨時間變化而變化,最大值出現于8 h,如圖 4所示。A2780的TL、TM和OTM均高于C30(P<0.05)。秩相關分析顯示C30的TL、TM、OTM(r=0.4,r=0.2,r=0.8,P>0.05)以及A2780的TL、TM、OTM(r=0.8,r=0.4,r=0.4,P>0.05)與其彗星形成率無相關性。
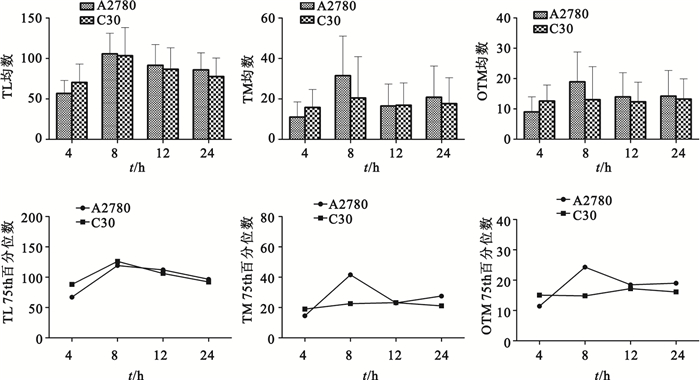 圖4
A2780和C30細胞的TL、TM、OTM均數及其75th百分位數
Figure4.
Means and 75th percentiles of TL, TM and OTM in A2780 and C30
圖4
A2780和C30細胞的TL、TM、OTM均數及其75th百分位數
Figure4.
Means and 75th percentiles of TL, TM and OTM in A2780 and C30
3 討論
本文比較了nsEP對鉑敏感和鉑耐藥人卵巢癌細胞DNA損傷的時間效應。彗星形成率可以用來評估DNA的損傷程度[9]。研究發現,nsEP處理后,A2780和C30細胞的DNA損傷率和細胞死亡率均先升高,后降低,彗星形成率與細胞死亡率成正相關,DNA損傷率高于細胞死亡率。提示部分出現DNA損傷的細胞并未死亡,可能是由于損傷程度較輕,未達到死亡“閾值”,細胞通過啟動修復功能而存活[10]。因此,為提高抑瘤效應,應在修復完成前重復給予nsEP或其他治療,降低修復細胞的比例。本研究結果提示僅有部分細胞的死亡率可歸結于DNA損傷,其他細胞死亡機制需進一步研究。以往研究認為,DNA損傷可能并不是nsEP直接作用的結果,而是一個由損傷亞細胞結構變化所引起的后續生物效應[11]。我們前期研究發現,nsEP可引起細核質內高電壓,提示DNA斷裂可直接由電效應引起[4]。
本研究發現,相同的脈沖條件處理后,A2780細胞的死亡率及彗星形成率均明顯高于C30細胞,表明nsEP對鉑敏感細胞的損傷高于鉑耐藥細胞。因此,對鉑耐藥細胞應根據其絕對和相對尺寸,調整場強、脈寬和脈沖作用時間,從而實現有效的亞細胞結構損傷。兩株細胞的TL、TM 和 OTM值與相應的彗星形成率均無相關性,說明脈沖所致DNA損傷具有異質性,在治療性應用中應予以考慮。
綜上所述,nsEP對鉑敏感和鉑耐藥卵巢癌細胞的DNA損傷具有時間效應,nsEP對鉑敏感細胞株的損傷高于鉑耐藥細胞株;nsEP所致細胞死亡與DNA損傷有關。
引言
卵巢癌是女性生殖器常見惡性腫瘤之一,盡管已有多種治療應用于臨床,但其5年生存率仍僅為45%[1]。卵巢癌的化療是一種聯合化療,以鉑類為基礎,其中順鉑是比較有效且廣泛應用于臨床的一線藥物,但長期化療患者及卵巢癌復發患者的耐藥情況十分普遍,故療效不盡如人意[2]。因此,尋求新的、非藥物的治療方案甚有必要。Beebe等[3]發現單獨使用脈沖電場可致腫瘤細胞死亡。根據脈沖電場參數(強度或脈寬)的不同,可產生不同的生物效應。微秒(μs)強度的電脈沖可產生電穿孔效應(electroporation);納秒(ns)強度的電脈沖對細胞膜的影響極小而能夠對細胞核產生較大影響,從而有效抑制腫瘤的生長。理論計算表明納秒電脈沖(nanosecond electric pulses,nsEP)可跨膜影響細胞內結構[4]。nsEP作為一種不需要藥物的純電場治療,且無熱消融,有望成為腫瘤治療的一種新型手段[5]。為進一步研究卵巢癌順鉑耐藥細胞的治療,本文選擇人卵巢癌鉑敏感細胞株A2780和人卵巢癌鉑耐藥細胞株C30作為研究對象,旨在通過研究nsEP對人卵巢癌鉑敏感和鉑耐藥細胞株DNA損傷的時間效應,探討nsEP引起的DNA損傷與細胞死亡之間的相關性。
1 材料與方法
1.1 材料
1.1.1 試劑RPMI
1640培養基(Hyclone,美國),胎牛血清(四季青,中國),胰蛋白酶(Hyclone,美國),DAPI(Biotium,美國),順鉑注射液(云南個舊生物藥業有限公司,中國),CCK-8試劑盒(同仁,日本),低熔點瓊脂糖(Promega,美國),正常熔點瓊脂糖(TIANGEN,中國),TritonX-100(北京鼎國昌盛生物技術有限責任公司,中國)。
1.1.2 儀器
納秒脈沖電源(本實驗室自主研制)[4],CO2細胞培養箱、全波長酶標儀(Thermo Scientific,美國),電泳儀(BIO-RAD,美國),熒光顯微鏡(Nikon Ti-E,日本)。
1.1.3 細胞系
人卵巢癌鉑敏感細胞株A2780購于中國典型培養物保藏中心(China Center for Type Culture Collection,CCTCC),鉑耐藥株C30為重慶醫科大學第二附屬醫院婦產科重點實驗室保存。
1.2 方法
1.2.1 細胞培養
A2780和C30細胞以含體積分數為10%胎牛血清,5%雙抗(100 U/mL青霉素和0.1 mg/mL鏈霉素)的RPMI 1640培養基,于37 ℃、 5% CO2培養條件下培養,每2~3 d換液,并觀察其生長狀態。C30細胞培養基中加入9 μg/mL順鉑,實驗前48 h更換為無藥培養基。
1.2.2 nsEP處理
取對數生長期的細胞制備密度為5×105個/mL的單細胞懸液,取1 mL細胞于24孔板中,調整電極間距離為1 cm,電壓6 kV(即場強6 kV/cm),脈寬為24 ns的脈沖電場處理60 s。假處理組細胞給予假脈沖處理。
1.2.3 CCK-8法檢測細胞死亡率
nsEP處理后繼續培養細胞于0、4、8、12和24 h用CCK-8試劑盒測定細胞活性,并計算細胞死亡率[6]。每個時間點均設置有實驗組(nsEP處理后)、假處理組(nsEP假處理)和空白組(不含細胞,僅加入100 μL實驗用培養基)。具體步驟:①將上述nsEP處理后的細胞調整密度為3.5×105個/mL的單細胞懸液,接種于96孔板中,設置3個復孔;②在相同時間點的96孔板每孔中加入CCK-8試劑10 μL,包括空白組;③將孔板中的細胞放置于37 ℃細胞培養箱中繼續孵育2 h后,用全波長酶標儀于450 nm測定吸光度(A)。
細胞存活率(%)=[(A實驗孔-A空白孔)/(A對照孔-A空白孔)]×100%。
細胞死亡率(%) =1-細胞存活率(%)
1.2.4 單細胞凝膠電泳實驗
于nsEP處理后4、8、12、24 h,參照Singh等[7]描述的方法行單細胞凝膠電泳。具體步驟如下:第一層膠的制備:于自制的光面載玻片上滴加150 μL 1%的正常熔點瓊脂糖,加蓋蓋玻片。4 ℃固化20 min。第二層膠的制備:輕輕揭去蓋玻片,在第一層膠上滴加1∶5(細胞∶低熔點瓊脂糖)比例配制的含有8×104個細胞的75 μL低熔點瓊脂糖,加蓋蓋玻片,4 ℃固化20 min。裂解:輕輕揭去蓋玻片,將制好的凝膠玻片浸入冰冷的堿性(pH 10.0)裂解液中(臨用前加1% Triton X-100),4 ℃裂解2 h。解旋:取出凝膠玻片,PBS漂洗3次后置于水平電泳槽內,加入pH 13的堿性電泳緩沖液(高于玻片2~3 mm),避光放置20 min。電泳:設置電壓25 V,電流300 mA,電泳20 min。漂洗:pH 7.5的Tris-HCl漂洗3次,每次5 min,室溫晾干。染色:膠上滴加濃度為5 μg/mL DAPI染色15 min,雙蒸水漂洗3次,每次5 min,室溫晾干。圖像采集:采用倒置熒光顯微鏡觀察、攝像。每組至少采集100個細胞作彗星分析。
單細胞凝膠電泳后得到的彗星圖像用CASP(http://casplab.com)軟件分析,測量尾長(tail length,TL)、尾矩(tail moment,TM,尾部DNA%×尾長)以及Olive尾矩(Olive tail moment,OTM,尾部DNA%×尾矩長),并計算彗星形成率(%)[
1.3 統計學方法
采用SPSS 21.0統計學軟件進行統計學處理,組間均數比較采用ANOVA檢驗。對細胞死亡率和彗星形成率之間的關系采用線性相關分析。非正態數據采用Kruskal-Wallis檢驗。P<0.05表示差異有統計學意義。
2 結果
2.1 細胞生存率
nsEP處理后0~8 h,A2780和C30細胞的生存率逐漸降低,8~24 h逐漸上升,8 h時細胞生存率最低。C30細胞的生存率明顯高于A2780細胞(P<0.05),如圖 1所示。
 圖1
nsEP處理后A2780和C30在不同時間點的生存率*P<0.05,與A2780細胞株相比
Figure1.
Cell viability of A2780 and C30 vary with time after nsEP *P<0.05, vs. A2780
圖1
nsEP處理后A2780和C30在不同時間點的生存率*P<0.05,與A2780細胞株相比
Figure1.
Cell viability of A2780 and C30 vary with time after nsEP *P<0.05, vs. A2780
2.2 細胞死亡率與彗星形成率
單細胞凝膠電泳結果,如圖 2所示,可明顯看出A2780細胞在4、8、12和24 h都表觀出彗星圖像的尾長比C30細胞長。A2780細胞的死亡率與彗星形成率在4~24 h均高于C30細胞,如圖 3所示;A2780和C30細胞的死亡率均與彗星形成率呈正相關(r=0.997,P<0.05;r=0.998,P<0.05)。
 圖2
nsEP處理后A2780和C30在不同時間點的單細胞凝膠電泳結果
Figure2.
Comet assay figure of A2780 and C30 vary with time
圖2
nsEP處理后A2780和C30在不同時間點的單細胞凝膠電泳結果
Figure2.
Comet assay figure of A2780 and C30 vary with time
 圖3
nsEP處理后A2780和C30在不同時間點的細胞死亡率與彗星形成率*P<0.05,與A2780細胞株相比
Figure3.
Percentage of dead cells and comet-formed of A2780 and C30 in 4, 8, 12 and 24 h *P<0.05, vs. A2780
圖3
nsEP處理后A2780和C30在不同時間點的細胞死亡率與彗星形成率*P<0.05,與A2780細胞株相比
Figure3.
Percentage of dead cells and comet-formed of A2780 and C30 in 4, 8, 12 and 24 h *P<0.05, vs. A2780
2.3 TL、TM和OTM
A2780和C30細胞的TL、TM、OTM及其75 th百分位數均隨時間變化而變化,最大值出現于8 h,如圖 4所示。A2780的TL、TM和OTM均高于C30(P<0.05)。秩相關分析顯示C30的TL、TM、OTM(r=0.4,r=0.2,r=0.8,P>0.05)以及A2780的TL、TM、OTM(r=0.8,r=0.4,r=0.4,P>0.05)與其彗星形成率無相關性。
 圖4
A2780和C30細胞的TL、TM、OTM均數及其75th百分位數
Figure4.
Means and 75th percentiles of TL, TM and OTM in A2780 and C30
圖4
A2780和C30細胞的TL、TM、OTM均數及其75th百分位數
Figure4.
Means and 75th percentiles of TL, TM and OTM in A2780 and C30
3 討論
本文比較了nsEP對鉑敏感和鉑耐藥人卵巢癌細胞DNA損傷的時間效應。彗星形成率可以用來評估DNA的損傷程度[9]。研究發現,nsEP處理后,A2780和C30細胞的DNA損傷率和細胞死亡率均先升高,后降低,彗星形成率與細胞死亡率成正相關,DNA損傷率高于細胞死亡率。提示部分出現DNA損傷的細胞并未死亡,可能是由于損傷程度較輕,未達到死亡“閾值”,細胞通過啟動修復功能而存活[10]。因此,為提高抑瘤效應,應在修復完成前重復給予nsEP或其他治療,降低修復細胞的比例。本研究結果提示僅有部分細胞的死亡率可歸結于DNA損傷,其他細胞死亡機制需進一步研究。以往研究認為,DNA損傷可能并不是nsEP直接作用的結果,而是一個由損傷亞細胞結構變化所引起的后續生物效應[11]。我們前期研究發現,nsEP可引起細核質內高電壓,提示DNA斷裂可直接由電效應引起[4]。
本研究發現,相同的脈沖條件處理后,A2780細胞的死亡率及彗星形成率均明顯高于C30細胞,表明nsEP對鉑敏感細胞的損傷高于鉑耐藥細胞。因此,對鉑耐藥細胞應根據其絕對和相對尺寸,調整場強、脈寬和脈沖作用時間,從而實現有效的亞細胞結構損傷。兩株細胞的TL、TM 和 OTM值與相應的彗星形成率均無相關性,說明脈沖所致DNA損傷具有異質性,在治療性應用中應予以考慮。
綜上所述,nsEP對鉑敏感和鉑耐藥卵巢癌細胞的DNA損傷具有時間效應,nsEP對鉑敏感細胞株的損傷高于鉑耐藥細胞株;nsEP所致細胞死亡與DNA損傷有關。