探討外源性神經生長因子(NGF)在大鼠心肌梗死后延遲再灌注治療中的作用及機制。通過建立大鼠心梗延遲再灌注模型, 構建重組腺病毒Ad-NGF基因并進行基因轉染, 使大鼠心梗延遲再灌注后體內NGF持續高表達。在術后第3、7、和/或14、28天檢測NGF蛋白表達、微血管增生數量, 觀察心肌細胞凋亡情況、心臟結構及功能的變化。我們發現, 給予NGF治療的過表達組, NGF各時間點含量均高于對照組(P<0.01), 凋亡率均低于模型對照組(P<0.01或P<0.05);過表達組新生微血管數量在第14天、28天明顯高于模型對照組(P<0.01, P<0.05)。超聲心動圖記錄第28天時模型對照組左室舒張/收縮末期內徑測值明顯高于過表達組(P<0.05), 左室舒張/收縮末期容積測值明顯高于過表達組(P<0.01), 即模型對照組心臟結構改變明顯; 第14天和第28天時過表達組左室射血分數、短軸縮短率均明顯高于模型對照組(P<0.01), 即過表達組心功能較模型對照組明顯改善。因此我們認為, 外源性NGF通過促進血管增生和抑制心肌細胞凋亡等途徑改善了大鼠心肌重塑及心臟功能。
引用本文: 劉洋, 張紹敏, 孫春麗, 吳錦暉, LIUYang, ZHANGShaomin, SUNChunli, WUJinhui. 補充外源性神經生長因子對大鼠心肌梗死后延遲再灌注的影響. 生物醫學工程學雜志, 2015, 32(6): 1294-1301. doi: 10.7507/1001-5515.20150230 復制
版權信息: ?四川大學華西醫院華西期刊社《生物醫學工程學雜志》版權所有,未經授權不得轉載、改編
0 引言
神經生長因子(nerve growth factor, NGF)是一種神經營養因子,具有營養神經元和促突觸生長的生物學功能。目前已有研究觀察到NGF對心肌梗死或梗死后再灌注的作用,結果提示NGF可以減少心肌細胞凋亡,改善心梗后心室重塑及心功能,對受損心肌具有保護作用[1]。但國內外尚未見NGF對心肌梗死后延遲再灌注的研究報道。相較早期再灌注,延遲再灌注更接近于臨床事件,預后較差,極大地增加了患者的負擔。NGF是否也能提高延遲再灌注的獲益性在臨床中具有重要的意義,亟需明確。本研究擬采用重組腺病毒載體技術,通過外源性補充NGF,觀察NGF對延遲再灌注后心臟結構和功能的影響,探討NGF在心梗后延遲再灌注中是否干預凋亡和血管增生,及其對心室重塑和心功能的影響。
1 材料及實驗方法
1.1 實驗動物與材料
健康清潔級Sprague Dawley(SD)雄性大鼠(四川大學科技園實驗動物中心);動物電生理檢測系統(成都泰盟);-30℃恒冷低溫切片機(CM69001德國Cleica);顯微鏡(DP71日本OLYMPUS);腺病毒介導的NGF基因注射液,陰性對照腺病毒液(沈陽萬類生物公司);神經生長因子(04-1119美國Millpore);Ⅷ因子(bs-0434R北京博奧森);細胞凋亡檢測試劑盒(AR0010 TUNEL武漢博士德)。
1.2 實驗方法
1.2.1 腺病毒載體構建
根據Genbank中人NGF的基因序列(XP_011539820.1)設計PCR引物。上游引物(5′-3′):CTCGGATCCAGGACGCAGCTTTCTAT;下游引物(5′-3′):CATGGAATTCGTGGAGGGGGCAGGT,引物由生工生物工程(上海)有限公司合成。①基因擴增:建立PCR反應體系,將引物稀釋至10μmol/L;在PCR管中加入基因組模板、上下游引物、2×Taq PCR Master-mix(BioTeke)、ddH2O進行30個循環的擴增反應,反應程序為:95℃預變性5 min, 55℃退火30 s, 72℃延伸60 s,30個循環;72℃再延伸10 min得到產物。②TA克隆:將PCR產物用DNA純化回收試劑盒(BioTeke)與pUM-T simple vector(BioTeke)連接,重組子轉化大腸桿菌感受態JM109,提取質粒后,選取陽性克隆,標記為T-NGF,測序。③質粒提取:利用質粒大量制備試劑盒(DP2802,BioTeke)提取目的質粒(T-NGF、pHBAd-MCMV-GFP),并用紫外分光光度計(Thermo)檢測質粒濃度。④基因重組:根據實驗設計的酶切位點用FastDigest BamHⅠ、FastDigest EcoRⅠ(Fermetas)對T-NGF、pHBAd-MCMV-GFP質粒進行雙酶切;回收酶切片段(NGF基因及pHBAd-MCMV-GFP),將得到的目的基因與pHBAd-MCMV-GFP連接,連接產物轉化大腸桿菌感受態JM109,PCR鑒定插入片段長度,選取陽性克隆,標記為pHBAd-MCMV-GFP-NGF,測序。⑤對目的基因、TA克隆、基因重組進行鑒定。最終實現腺病毒載體的構建。NGF基因序列如下:GTAATGTCCATGTTGTTCTAC ACTCTGATCACAGCGTTTTTGATCGGCGTAC AGGCAGAACCGTACACAGATAGCAATGTCCC AGAGGGAGACTCTGTCCCTGAAGCCCACTGG ACTAAACTTCAGCATTCCCTTGACACAGCCC TCCGCAGAGCCCGCAGTGCCCCTGCTGAACC AATAGCTGCCCGTGTGACAGGGCAGACCCGC AACATCACTGTGGACCCCAAACTGTTTAAG AAACGGAGACTCCGTTCACCCCGCGTGCTGT TTAGCACCCAGCCTCCACCCACCTCTTCGGA CACTCTGGATTTAGACTTCCAGGCCCATGGT ACAATCTCCTTCAACAGGACTCACAGGAGC AAGCGCTCATCCACCCACCCAGTCTTCCACA TGGGGGAGTTTTCAGTGTGTGACAGTGTCA GTGTGTGGGTTGGAGATAAGACCACAGCCA CGGACATCAAGGGCAAGGAGGTGACAGTGC TGGGCGAGGTGAACATTAACAACAGTGTAT TCAAACAGTATTTTTTTGAGACCAAGTGCC GAGCCCCGAATCCTGTAGAGAGTGGATGCC GGGGCATTGACTCCAAGCACTGGAACTCAT ACTGCACCACGACTCACACCTTTGTCAAGGC GTTGACAACAGACGACAAACAGGCTGCCTG GAGGTTCATCAGGATAGATACAGCCTGCGTG TGTGTGCTCAGCAGGAAGGCTGCAAGAAGAG GCTGACTT。
1.2.2 動物分組與模型建立
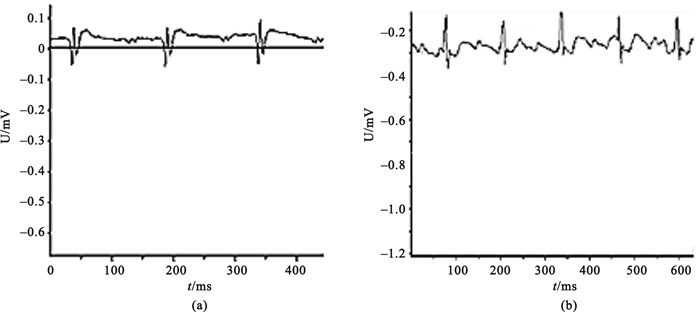
采用隨機數字表法將大鼠分為假手術組、空載病毒組、過表達組和模型對照組。每組保證存活20只。以左冠脈主干為標志,假手術組穿線不結扎阻塞,其余組穿線結扎,并于冠脈阻塞2 h后再解開結扎線。觀察到心肌由紅色變為蒼白和/或心電圖示有ST段抬高或T波高聳。心率:394次/分,ST段電壓最大值0.12 mV, ST段電壓最小值-0.09 mV, QRS波峰值0.20 mV, 如圖 1(a)所示。同時結合組別,在心肌梗死周邊分四點注射相應液體。2 h后放松結扎線可見蒼白區心肌充血或出現心律失常或抬高的ST段下降1/2以上, 心率:426次/分,ST段電壓最大值0.10 mV, ST段電壓最小值-0.26 mV, QRS波峰值0.31 mV, 如圖 1(b)所示。假手術組:穿線不結扎,2 h后予生理鹽水心肌注射。模型對照組、空載病毒組、過表達組結扎冠狀動脈,2 h后再灌注,再分別給予生理鹽水、空載病毒注射液及Ad-NGF注射液心肌注射。模型制作完畢后第3、7、14、28天各組取5只測定相關指標。
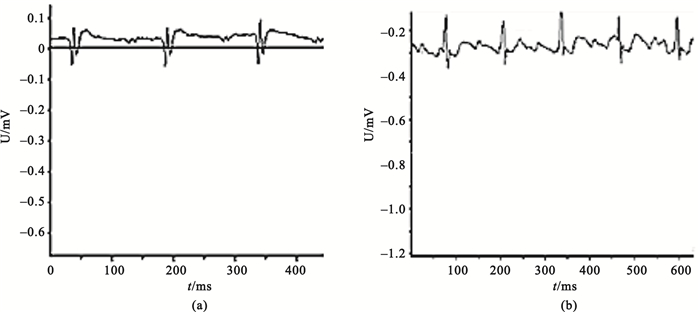 圖1
大鼠肢導聯心電圖
圖1
大鼠肢導聯心電圖
(a)結扎冠脈后的肢導聯心電圖;(b)結扎2 h后再灌注的肢導聯心電圖
Figure1. Electrocardiogram (ECG) of rats(a) ECG after ligation of coronary artery; (b) ECG of late reperfusion after cutting the suture 2 hours after coronary artery ligation
1.2.3 免疫組化法檢測NGF、Ⅷ因子的表達
于各時間點對大鼠心肌取材,固定于4%多聚甲醛溶液中石蠟包埋后切片,免疫組化步驟按照常規方法進行,具體參照試劑盒說明。NGF的每個切片隨機取5個高倍視野, 使用Image Pro-Plus圖像分析軟件測定NGF蛋白表達平均光密度值(mean optical density, MOD)作為其表達水平。MOD=區域內特定染色部分的累計光密度(IOD)/該區域面積(Area)[2],并于400倍鏡下拍照。
Ⅷ因子陽性染色使微血管呈現深淺不一的棕褐色,凡棕色內皮細胞群者(線狀排列)或單個內皮細胞作為一個微血管計數,在100倍視野下選擇染色切片的微血管密集區,在400倍視野下,計數每個視野中微血管數量,并求其平均值[3]。
1.2.4 TUNEL法檢測心肌細胞凋亡
TUNEL是一種快速識別和量化細胞凋亡的方法。包埋切片制作方法同免疫組化組,具體操作步驟參照說明書[4]。在顯微鏡(OLYMPUS, DP71, JAPAN)下觀察染色效果,每個切片隨機取5個高倍視野, 記錄陽性細胞核數和總細胞核數, 計算凋亡指數(apoptosis index, AI)=凋亡細胞核數/總細胞核數×100%[5]。
1.2.5 心功能的檢測
有實驗報道心功能測定在梗死2周時大鼠的心功能最差,心梗面積大小穩定不變, 梗死4周時大鼠的心功能有所恢復[6-7]。因此選擇這兩個時間點檢測各組大鼠的心功能指標。各組大鼠在缺血再灌注第14、28天后行心臟超聲檢查,戊巴比妥鈉麻醉后,以HP小動物超聲探頭在大鼠胸骨旁進行心臟形態和功能檢測。測定值包括:左室舒張末期內徑(left ventricular end-diastolic diameter, LVEDD)、左室收縮末期內徑(left ventricular end-systolic diameter, LVESD)、左室收縮末期容積(left ventricular end-systolic volume, LVESV)、左室舒張末期容積(left ventricular end-diastolic volume, LVEDV);心臟功能指標:短軸縮短率(fractional shortening, FS)、左室射血分數(left vetricular ejection fraction, LVEF),取5個心動周期平均值。
1.3 統計學處理
采用SPSS 17.0統計軟件,正態分布方差齊的計量資料,以
2 結果
2.1 大鼠心梗再灌注后NGF的表達狀態及趨勢
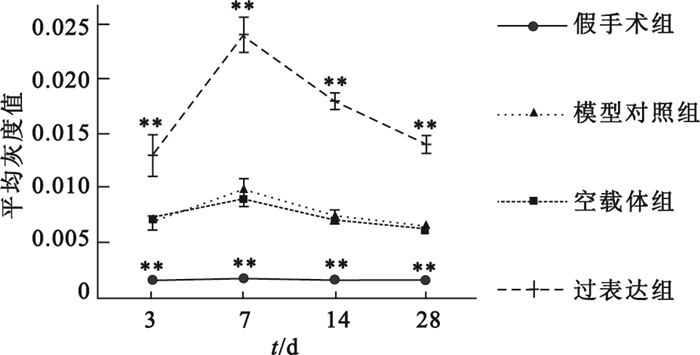
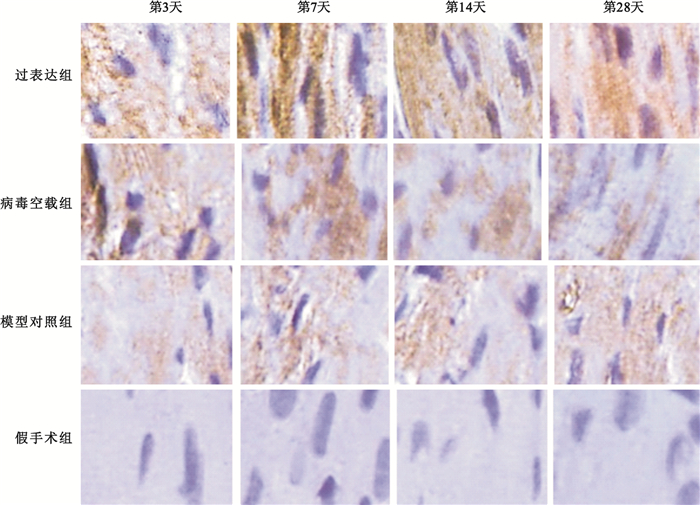
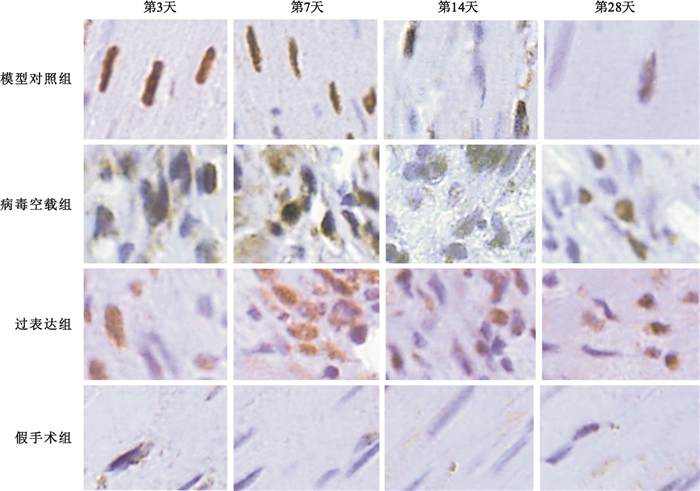
心肌損傷后NGF蛋白的表達呈動態變化趨勢,且在損傷后第7天達到頂峰。機體自身NGF代償性增加的持續時間相對較短,在各時間點,模型對照組NGF表達均低于過表達組(P<0.01),腺病毒介導的NGF在大鼠體內表達,具體如圖 2所示。圖 3中棕褐色染色即為NGF陽性表達,可見延遲再灌注后,過表達組NGF表達明顯高于模型對照組。
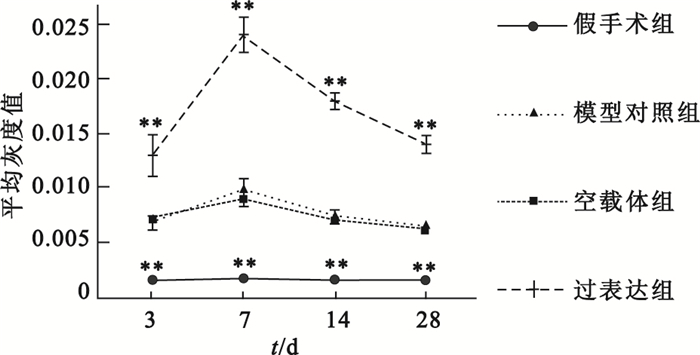 圖2
各組大鼠心肌細胞NGF表達情況
圖2
各組大鼠心肌細胞NGF表達情況
相同時間點各組分別與模型對照組比較,**
compared with late reperfusion group at the same time point, **
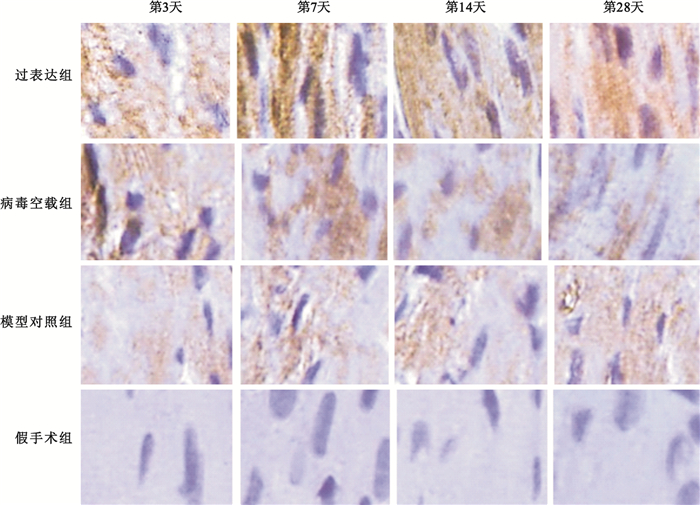 圖3
光學顯微鏡下NGF因子在大鼠心肌細胞中的表達狀態(免疫組化法,400×)
圖3
光學顯微鏡下NGF因子在大鼠心肌細胞中的表達狀態(免疫組化法,400×)
棕褐色代表NGF陽性表達
Figure3. NGF factor expression states in myocardial cells of rats under microscope (immunohistochemical method, 400×)dark brown areas indicate positive expression of NGF
2.2 大鼠心梗延遲再灌注后免疫組化法檢測Ⅷ因子表達狀態
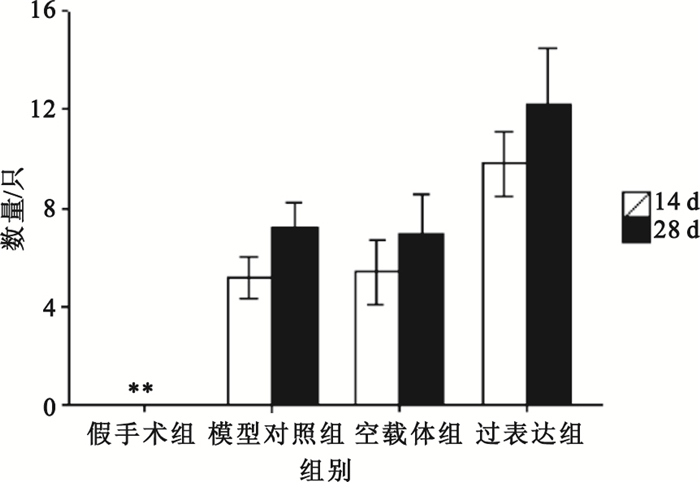
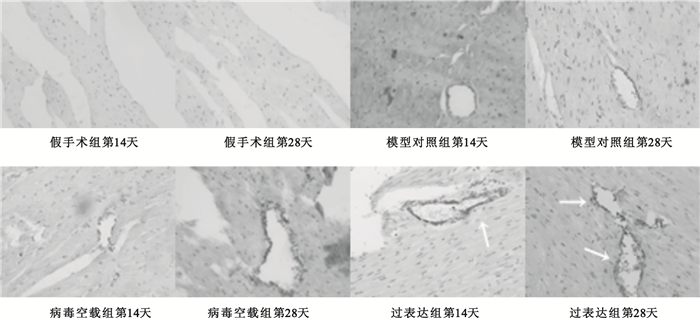
在梗死延遲再灌注后相同時間點,過表達組較模型對照組比較血管均有增生,差異有統計學意義(P<0.01),具體如圖 4所示。圖 5為400倍光學顯微鏡下Ⅷ因子表達狀態,圖中白色箭頭指向增生的微血管,過表達組明顯高于對照組。
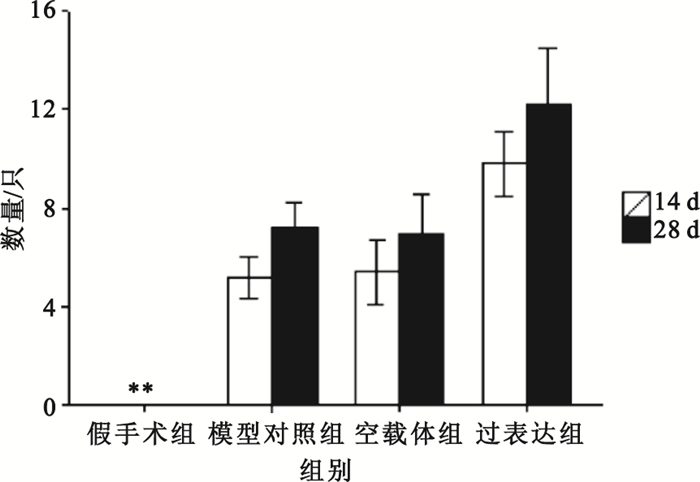 圖4
各組大鼠心肌微血管數量
圖4
各組大鼠心肌微血管數量
相同時間點各組分別與模型對照組比較,*
compared with late reperfusion group at the same time point, *
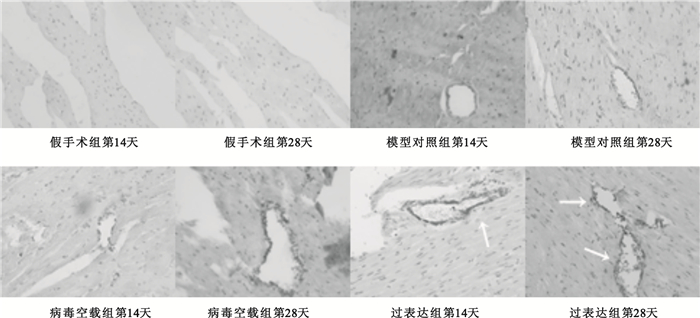 圖5
光學顯微鏡下心臟內皮細胞Ⅷ因子表達狀態(免疫組化法,400×)
圖5
光學顯微鏡下心臟內皮細胞Ⅷ因子表達狀態(免疫組化法,400×)
箭頭指向增生的微血管
Figure5. Ⅷfactor expression states of endothelial cell under microscope (immunohistochemical method, 400×)white arrows indicate microvascular
2.3 大鼠心梗延遲再灌注后TUNEL法檢測心肌細胞凋亡
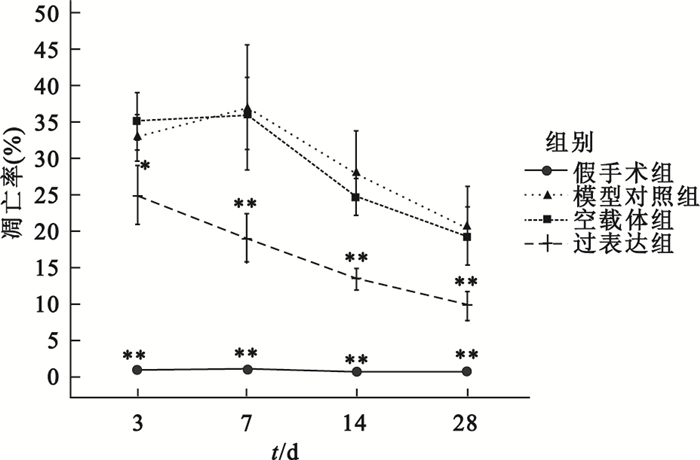
延遲再灌注后各時間點,過表達組凋亡率均低于模型對照組, 具體如圖 6所示。圖 7中棕褐色代表凋亡細胞,可見過表達組明顯少于模型對照組。
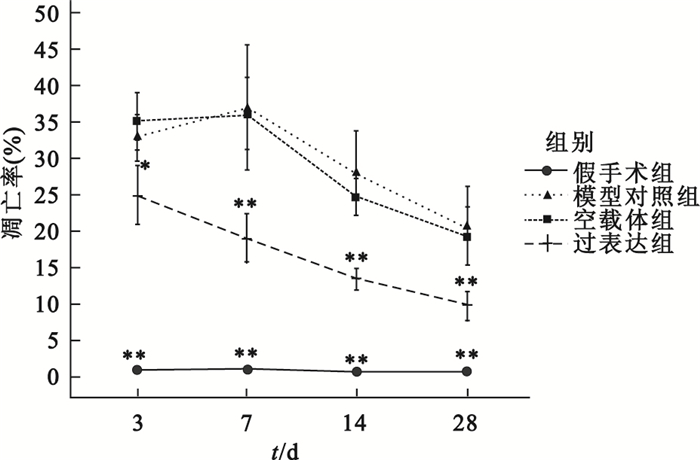 圖6
心肌梗死延遲再灌注后心肌細胞凋亡率
圖6
心肌梗死延遲再灌注后心肌細胞凋亡率
相同時間點各組分別與模型對照組比較, *
compared with late reperfusion group at the same time point, *
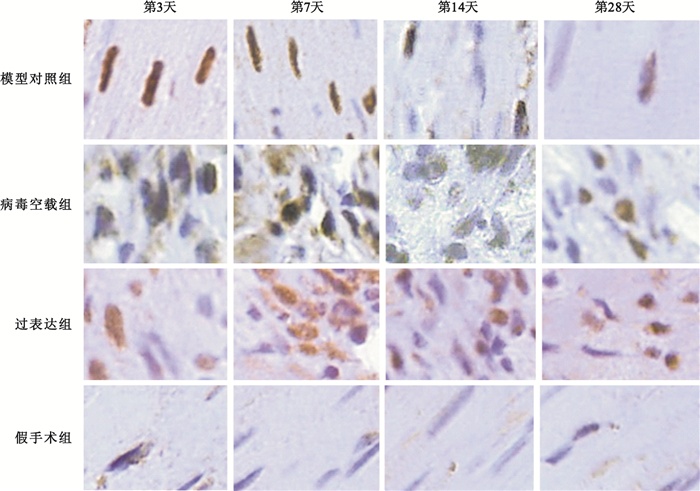 圖7
光學顯微鏡下心肌細胞凋亡狀態(TUNEL法,400×)
圖7
光學顯微鏡下心肌細胞凋亡狀態(TUNEL法,400×)
棕褐色代表心肌凋亡細胞
Figure7. Myocardial cell apoptosis states under microscope (TUNEL method, 400×)dark brown areas indicate apoptotic myocardial cells
2.4 大鼠心肌梗死延遲再灌注后心臟結構和心臟功能
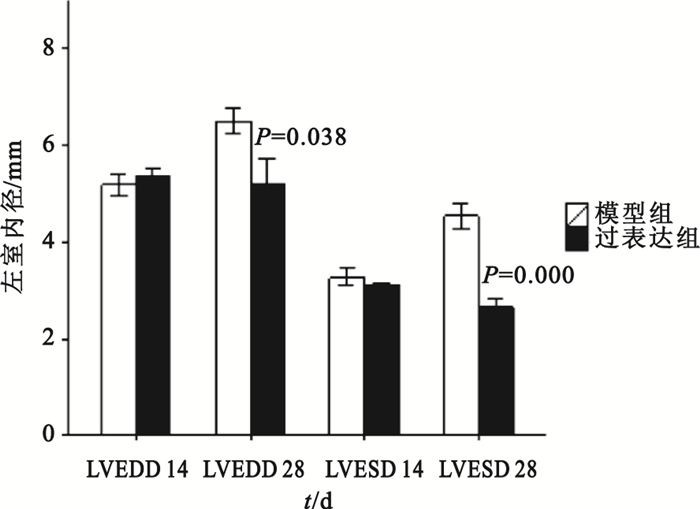
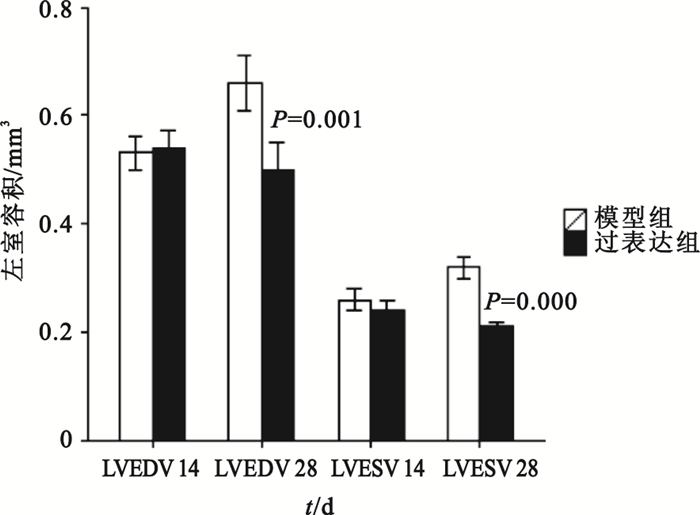
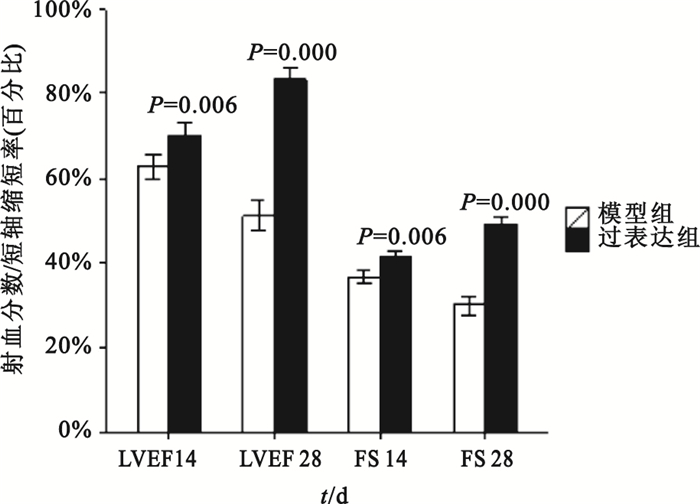
組間比較:第14、28天時模型對照組與假手術組比較,其LVEDD、LVEDV和LVESV值均明顯增大(P<0.01),LVEF、FS均明顯下降(P<0.01);模型對照組與空載組各檢測指標差異則均無統計學意義(P>0.05)。第14天時過表達組與模型對照組比較,LVEDD、LVESD和LVEDV、LVESV值差異無統計學意義(P>0.05);第28天時過表達組LVEDD、LVESD和LVEDV、LVESV測值明顯低于模型對照組(如圖 8、9所示),可見模型對照組心臟結構改變明顯。第14、28天時,過表達組LVEF、FS值明顯高于模型對照組(如圖 10所示),可見過表達組心功能較模型對照組明顯改善。
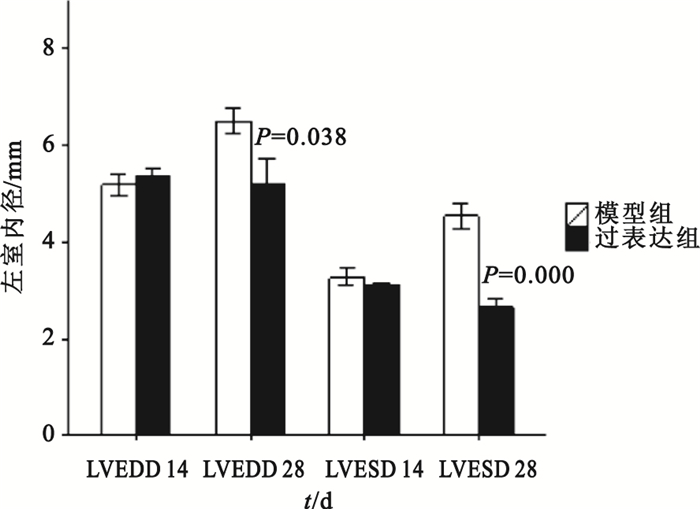 圖8
過表達組與模型對照組大鼠左室舒張末內徑和左室收縮末內徑比較
Figure8.
Comparison of left ventricular end-diastolic/systole diameter between NGF group and late reperfusion group
圖8
過表達組與模型對照組大鼠左室舒張末內徑和左室收縮末內徑比較
Figure8.
Comparison of left ventricular end-diastolic/systole diameter between NGF group and late reperfusion group
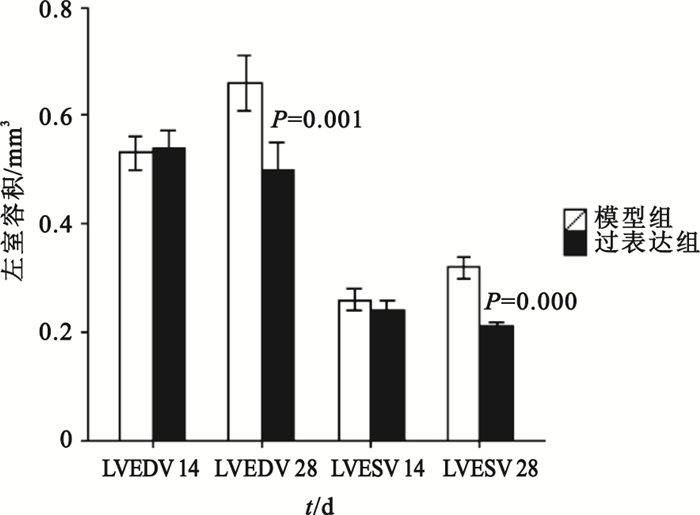 圖9
過表達組與模型對照組大鼠左室舒張末容積和左室收縮末容積比較
Figure9.
Comparison of left ventricular end-diastolic/systole volume between NGF group and late reperfusion group
圖9
過表達組與模型對照組大鼠左室舒張末容積和左室收縮末容積比較
Figure9.
Comparison of left ventricular end-diastolic/systole volume between NGF group and late reperfusion group
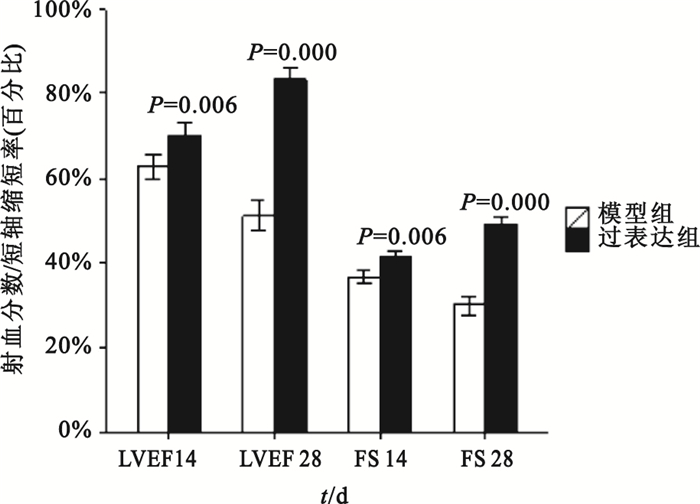 圖10
過表達組與模型對照組大鼠左室射血分數和短軸縮短率比較
Figure10.
Comparison of fractional shortening and left ventricular ejection fraction between NGF group and late reperfusion group
圖10
過表達組與模型對照組大鼠左室射血分數和短軸縮短率比較
Figure10.
Comparison of fractional shortening and left ventricular ejection fraction between NGF group and late reperfusion group
組內比較:模型對照組第28天時LVEDV、LVESV大于自身第14天時(P=0.000,P=0.005),心臟結構較之前改變;模型對照組第28天時LVEF、FS均小于自身第14天時(P=0.000,P=0.000),心功能較之前惡化;過表達組第28天時LVEF、FS均大于自身第14天時(P=0.000,P=0.000),可見心臟功能較前有所改善;模型對照組第28天時LVEDD、LVESD大于自身第28天時(P=0.003,P=0.000)。除此以外,其余時間點的組內比較均無統計學意義。
3 討論
近年研究顯示NGF可促進缺血心肌血管內皮修復,抑制梗死后心肌細胞凋亡,還可通過調節炎癥反應,參與梗死后再灌注并調節交感神經再生和支配,減緩心臟重塑和再灌注心律失常,對梗死及再灌注損傷有一定保護作用[8-9],其中減緩心肌細胞凋亡和延緩心肌重塑是延遲再灌注獲益的重要機制。
本研究顯示模型組NGF表達量較假手術組明顯增高,提示心梗延遲再灌注后,可誘發體內NGF的增加。模型組與空載組比較NGF表達量無明顯差異,排除了腺病毒引起NGF表達增高的可能。整個過程中過表達組NGF的表達量明顯高于模型對照組,提示腺病毒載體攜帶的NGF基因轉染成功,明顯增加了NGF蛋白的表達。觀察同組內各個時間段NGF的變化,我們發現在延遲再灌注7 d后,NGF的表達量達到頂峰,但模型組隨著時間的延長在第14天時降至較低水平,與第3天時水平無明顯差異,說明心肌損傷后NGF蛋白的表達呈動態變化趨勢,且在損傷后的急性期達到頂峰,機體自身NGF代償性增加的高表達狀態時間相對較短,對受損心肌的保護作用可能有限。而過表達組的NGF高表達狀態時間長于模型對照組,直至第28天時開始有明顯下降,這與腺病毒不整合進入宿主細胞基因中及腺病毒引起的免疫反應有一定的相關性。過表達組NGF在體內高表達狀態的時間得到了延長,同時在促進微血管增生、抑制心肌細胞、改善心肌重塑等方面都優于模型組,根據本實驗的初步結果,我們認為在一定劑量和時間段內,體內NGF高表達狀態對大鼠心肌梗死后延遲再灌注有一定保護作用。根據延遲再灌注可能獲益的機制,我們認為最大限度地挽救瀕死心肌及延緩心肌重塑可能是提高延遲再灌注治療效果的重要途徑之一。
我們的實驗結果與Caporali等[1]和Meloni等[6]觀察NGF對大鼠心肌梗死作用的結果相似:NGF基因過表達組與對照組比較,在心肌梗死后內皮細胞存活改善,血管新生能力增高,細胞凋亡減少,心肌梗死14 d后心功能有明顯改善。而經NGF中和抗體處理的小鼠,心肌梗死后血管再生修復能力下降,內皮細胞、心肌細胞凋亡增加,心功能極度惡化。既往基礎研究結果提示延遲再灌注可能獲益的機制主要有:①開通的梗死相關血管可以促進梗死區心肌的修復和瘢痕形成。②血管的開通為非梗死區心肌提供側支血流,限制了梗死區域的擴張。③恢復供血區“頓抑”或“冬眠”心肌的功能,挽救瀕死心肌。④血管充盈形成的骨架效應及膠原過度沉積的抑制等因素延緩了心肌重塑[10]。Emanueli等[11]的一項實驗觀察到缺血肌肉組織處NGF及其高親和力受體原肌球蛋白激酶受體A(tropmyosin kinase receptor A, TrkA)表達上調,同時在給予缺血肌肉組織NGF干預后,其毛細血管及小動脈密度增加,缺血組織的血流灌注得到改善,該研究結果提示NGF可以增加微血管內皮生長因子(endothelial endothelial growth factor, VEGF)的表達,并可能通過VEGF-Akt-NO機制間接促進血管內皮細胞的增殖、遷徙以及再生的能力。既往實驗結果提示,NGF可能通過增加VEGF,間接、直接地改善延遲再灌注后非梗死區側枝血流的供應,對限制梗死區擴張具有重要的作用[10, 12]。這與既往研究提示NGF在心肌細胞中可以通過TrkA、PI3K-Akt和Foxo(Forkhead box-o)等信號通路對損傷的心肌起保護作用的結果相吻合[13-14]。當NGF過表達時,Akt磷酸化迅速增加,受Akt介導的Foxo-3a此時發生磷酸化,并從核內溢出,變為失活狀態,從而減少細胞凋亡。
綜上所述,延遲再灌注治療對于心肌梗死后患者有一定必要性,可以減輕細胞凋亡及炎癥反應,減緩心肌重塑,降低終點事件發生率,改善心肌梗死患者的近期和遠期預后。在心肌梗死及再灌注后NGF表達的增加,有利于梗死相關血管的開通,促進心肌組織的修復。NGF表達的增加還能抑制心肌細胞凋亡和心肌重塑,進而提高患者存活率。
0 引言
神經生長因子(nerve growth factor, NGF)是一種神經營養因子,具有營養神經元和促突觸生長的生物學功能。目前已有研究觀察到NGF對心肌梗死或梗死后再灌注的作用,結果提示NGF可以減少心肌細胞凋亡,改善心梗后心室重塑及心功能,對受損心肌具有保護作用[1]。但國內外尚未見NGF對心肌梗死后延遲再灌注的研究報道。相較早期再灌注,延遲再灌注更接近于臨床事件,預后較差,極大地增加了患者的負擔。NGF是否也能提高延遲再灌注的獲益性在臨床中具有重要的意義,亟需明確。本研究擬采用重組腺病毒載體技術,通過外源性補充NGF,觀察NGF對延遲再灌注后心臟結構和功能的影響,探討NGF在心梗后延遲再灌注中是否干預凋亡和血管增生,及其對心室重塑和心功能的影響。
1 材料及實驗方法
1.1 實驗動物與材料
健康清潔級Sprague Dawley(SD)雄性大鼠(四川大學科技園實驗動物中心);動物電生理檢測系統(成都泰盟);-30℃恒冷低溫切片機(CM69001德國Cleica);顯微鏡(DP71日本OLYMPUS);腺病毒介導的NGF基因注射液,陰性對照腺病毒液(沈陽萬類生物公司);神經生長因子(04-1119美國Millpore);Ⅷ因子(bs-0434R北京博奧森);細胞凋亡檢測試劑盒(AR0010 TUNEL武漢博士德)。
1.2 實驗方法
1.2.1 腺病毒載體構建
根據Genbank中人NGF的基因序列(XP_011539820.1)設計PCR引物。上游引物(5′-3′):CTCGGATCCAGGACGCAGCTTTCTAT;下游引物(5′-3′):CATGGAATTCGTGGAGGGGGCAGGT,引物由生工生物工程(上海)有限公司合成。①基因擴增:建立PCR反應體系,將引物稀釋至10μmol/L;在PCR管中加入基因組模板、上下游引物、2×Taq PCR Master-mix(BioTeke)、ddH2O進行30個循環的擴增反應,反應程序為:95℃預變性5 min, 55℃退火30 s, 72℃延伸60 s,30個循環;72℃再延伸10 min得到產物。②TA克隆:將PCR產物用DNA純化回收試劑盒(BioTeke)與pUM-T simple vector(BioTeke)連接,重組子轉化大腸桿菌感受態JM109,提取質粒后,選取陽性克隆,標記為T-NGF,測序。③質粒提取:利用質粒大量制備試劑盒(DP2802,BioTeke)提取目的質粒(T-NGF、pHBAd-MCMV-GFP),并用紫外分光光度計(Thermo)檢測質粒濃度。④基因重組:根據實驗設計的酶切位點用FastDigest BamHⅠ、FastDigest EcoRⅠ(Fermetas)對T-NGF、pHBAd-MCMV-GFP質粒進行雙酶切;回收酶切片段(NGF基因及pHBAd-MCMV-GFP),將得到的目的基因與pHBAd-MCMV-GFP連接,連接產物轉化大腸桿菌感受態JM109,PCR鑒定插入片段長度,選取陽性克隆,標記為pHBAd-MCMV-GFP-NGF,測序。⑤對目的基因、TA克隆、基因重組進行鑒定。最終實現腺病毒載體的構建。NGF基因序列如下:GTAATGTCCATGTTGTTCTAC ACTCTGATCACAGCGTTTTTGATCGGCGTAC AGGCAGAACCGTACACAGATAGCAATGTCCC AGAGGGAGACTCTGTCCCTGAAGCCCACTGG ACTAAACTTCAGCATTCCCTTGACACAGCCC TCCGCAGAGCCCGCAGTGCCCCTGCTGAACC AATAGCTGCCCGTGTGACAGGGCAGACCCGC AACATCACTGTGGACCCCAAACTGTTTAAG AAACGGAGACTCCGTTCACCCCGCGTGCTGT TTAGCACCCAGCCTCCACCCACCTCTTCGGA CACTCTGGATTTAGACTTCCAGGCCCATGGT ACAATCTCCTTCAACAGGACTCACAGGAGC AAGCGCTCATCCACCCACCCAGTCTTCCACA TGGGGGAGTTTTCAGTGTGTGACAGTGTCA GTGTGTGGGTTGGAGATAAGACCACAGCCA CGGACATCAAGGGCAAGGAGGTGACAGTGC TGGGCGAGGTGAACATTAACAACAGTGTAT TCAAACAGTATTTTTTTGAGACCAAGTGCC GAGCCCCGAATCCTGTAGAGAGTGGATGCC GGGGCATTGACTCCAAGCACTGGAACTCAT ACTGCACCACGACTCACACCTTTGTCAAGGC GTTGACAACAGACGACAAACAGGCTGCCTG GAGGTTCATCAGGATAGATACAGCCTGCGTG TGTGTGCTCAGCAGGAAGGCTGCAAGAAGAG GCTGACTT。
1.2.2 動物分組與模型建立
采用隨機數字表法將大鼠分為假手術組、空載病毒組、過表達組和模型對照組。每組保證存活20只。以左冠脈主干為標志,假手術組穿線不結扎阻塞,其余組穿線結扎,并于冠脈阻塞2 h后再解開結扎線。觀察到心肌由紅色變為蒼白和/或心電圖示有ST段抬高或T波高聳。心率:394次/分,ST段電壓最大值0.12 mV, ST段電壓最小值-0.09 mV, QRS波峰值0.20 mV, 如圖 1(a)所示。同時結合組別,在心肌梗死周邊分四點注射相應液體。2 h后放松結扎線可見蒼白區心肌充血或出現心律失常或抬高的ST段下降1/2以上, 心率:426次/分,ST段電壓最大值0.10 mV, ST段電壓最小值-0.26 mV, QRS波峰值0.31 mV, 如圖 1(b)所示。假手術組:穿線不結扎,2 h后予生理鹽水心肌注射。模型對照組、空載病毒組、過表達組結扎冠狀動脈,2 h后再灌注,再分別給予生理鹽水、空載病毒注射液及Ad-NGF注射液心肌注射。模型制作完畢后第3、7、14、28天各組取5只測定相關指標。
 圖1
大鼠肢導聯心電圖
圖1
大鼠肢導聯心電圖
(a)結扎冠脈后的肢導聯心電圖;(b)結扎2 h后再灌注的肢導聯心電圖
Figure1. Electrocardiogram (ECG) of rats(a) ECG after ligation of coronary artery; (b) ECG of late reperfusion after cutting the suture 2 hours after coronary artery ligation
1.2.3 免疫組化法檢測NGF、Ⅷ因子的表達
于各時間點對大鼠心肌取材,固定于4%多聚甲醛溶液中石蠟包埋后切片,免疫組化步驟按照常規方法進行,具體參照試劑盒說明。NGF的每個切片隨機取5個高倍視野, 使用Image Pro-Plus圖像分析軟件測定NGF蛋白表達平均光密度值(mean optical density, MOD)作為其表達水平。MOD=區域內特定染色部分的累計光密度(IOD)/該區域面積(Area)[2],并于400倍鏡下拍照。
Ⅷ因子陽性染色使微血管呈現深淺不一的棕褐色,凡棕色內皮細胞群者(線狀排列)或單個內皮細胞作為一個微血管計數,在100倍視野下選擇染色切片的微血管密集區,在400倍視野下,計數每個視野中微血管數量,并求其平均值[3]。
1.2.4 TUNEL法檢測心肌細胞凋亡
TUNEL是一種快速識別和量化細胞凋亡的方法。包埋切片制作方法同免疫組化組,具體操作步驟參照說明書[4]。在顯微鏡(OLYMPUS, DP71, JAPAN)下觀察染色效果,每個切片隨機取5個高倍視野, 記錄陽性細胞核數和總細胞核數, 計算凋亡指數(apoptosis index, AI)=凋亡細胞核數/總細胞核數×100%[5]。
1.2.5 心功能的檢測
有實驗報道心功能測定在梗死2周時大鼠的心功能最差,心梗面積大小穩定不變, 梗死4周時大鼠的心功能有所恢復[6-7]。因此選擇這兩個時間點檢測各組大鼠的心功能指標。各組大鼠在缺血再灌注第14、28天后行心臟超聲檢查,戊巴比妥鈉麻醉后,以HP小動物超聲探頭在大鼠胸骨旁進行心臟形態和功能檢測。測定值包括:左室舒張末期內徑(left ventricular end-diastolic diameter, LVEDD)、左室收縮末期內徑(left ventricular end-systolic diameter, LVESD)、左室收縮末期容積(left ventricular end-systolic volume, LVESV)、左室舒張末期容積(left ventricular end-diastolic volume, LVEDV);心臟功能指標:短軸縮短率(fractional shortening, FS)、左室射血分數(left vetricular ejection fraction, LVEF),取5個心動周期平均值。
1.3 統計學處理
采用SPSS 17.0統計軟件,正態分布方差齊的計量資料,以
2 結果
2.1 大鼠心梗再灌注后NGF的表達狀態及趨勢
心肌損傷后NGF蛋白的表達呈動態變化趨勢,且在損傷后第7天達到頂峰。機體自身NGF代償性增加的持續時間相對較短,在各時間點,模型對照組NGF表達均低于過表達組(P<0.01),腺病毒介導的NGF在大鼠體內表達,具體如圖 2所示。圖 3中棕褐色染色即為NGF陽性表達,可見延遲再灌注后,過表達組NGF表達明顯高于模型對照組。
 圖2
各組大鼠心肌細胞NGF表達情況
圖2
各組大鼠心肌細胞NGF表達情況
相同時間點各組分別與模型對照組比較,**
compared with late reperfusion group at the same time point, **
 圖3
光學顯微鏡下NGF因子在大鼠心肌細胞中的表達狀態(免疫組化法,400×)
圖3
光學顯微鏡下NGF因子在大鼠心肌細胞中的表達狀態(免疫組化法,400×)
棕褐色代表NGF陽性表達
Figure3. NGF factor expression states in myocardial cells of rats under microscope (immunohistochemical method, 400×)dark brown areas indicate positive expression of NGF
2.2 大鼠心梗延遲再灌注后免疫組化法檢測Ⅷ因子表達狀態
在梗死延遲再灌注后相同時間點,過表達組較模型對照組比較血管均有增生,差異有統計學意義(P<0.01),具體如圖 4所示。圖 5為400倍光學顯微鏡下Ⅷ因子表達狀態,圖中白色箭頭指向增生的微血管,過表達組明顯高于對照組。
 圖4
各組大鼠心肌微血管數量
圖4
各組大鼠心肌微血管數量
相同時間點各組分別與模型對照組比較,*
compared with late reperfusion group at the same time point, *
 圖5
光學顯微鏡下心臟內皮細胞Ⅷ因子表達狀態(免疫組化法,400×)
圖5
光學顯微鏡下心臟內皮細胞Ⅷ因子表達狀態(免疫組化法,400×)
箭頭指向增生的微血管
Figure5. Ⅷfactor expression states of endothelial cell under microscope (immunohistochemical method, 400×)white arrows indicate microvascular
2.3 大鼠心梗延遲再灌注后TUNEL法檢測心肌細胞凋亡
延遲再灌注后各時間點,過表達組凋亡率均低于模型對照組, 具體如圖 6所示。圖 7中棕褐色代表凋亡細胞,可見過表達組明顯少于模型對照組。
 圖6
心肌梗死延遲再灌注后心肌細胞凋亡率
圖6
心肌梗死延遲再灌注后心肌細胞凋亡率
相同時間點各組分別與模型對照組比較, *
compared with late reperfusion group at the same time point, *
 圖7
光學顯微鏡下心肌細胞凋亡狀態(TUNEL法,400×)
圖7
光學顯微鏡下心肌細胞凋亡狀態(TUNEL法,400×)
棕褐色代表心肌凋亡細胞
Figure7. Myocardial cell apoptosis states under microscope (TUNEL method, 400×)dark brown areas indicate apoptotic myocardial cells
2.4 大鼠心肌梗死延遲再灌注后心臟結構和心臟功能
組間比較:第14、28天時模型對照組與假手術組比較,其LVEDD、LVEDV和LVESV值均明顯增大(P<0.01),LVEF、FS均明顯下降(P<0.01);模型對照組與空載組各檢測指標差異則均無統計學意義(P>0.05)。第14天時過表達組與模型對照組比較,LVEDD、LVESD和LVEDV、LVESV值差異無統計學意義(P>0.05);第28天時過表達組LVEDD、LVESD和LVEDV、LVESV測值明顯低于模型對照組(如圖 8、9所示),可見模型對照組心臟結構改變明顯。第14、28天時,過表達組LVEF、FS值明顯高于模型對照組(如圖 10所示),可見過表達組心功能較模型對照組明顯改善。
 圖8
過表達組與模型對照組大鼠左室舒張末內徑和左室收縮末內徑比較
Figure8.
Comparison of left ventricular end-diastolic/systole diameter between NGF group and late reperfusion group
圖8
過表達組與模型對照組大鼠左室舒張末內徑和左室收縮末內徑比較
Figure8.
Comparison of left ventricular end-diastolic/systole diameter between NGF group and late reperfusion group
 圖9
過表達組與模型對照組大鼠左室舒張末容積和左室收縮末容積比較
Figure9.
Comparison of left ventricular end-diastolic/systole volume between NGF group and late reperfusion group
圖9
過表達組與模型對照組大鼠左室舒張末容積和左室收縮末容積比較
Figure9.
Comparison of left ventricular end-diastolic/systole volume between NGF group and late reperfusion group
 圖10
過表達組與模型對照組大鼠左室射血分數和短軸縮短率比較
Figure10.
Comparison of fractional shortening and left ventricular ejection fraction between NGF group and late reperfusion group
圖10
過表達組與模型對照組大鼠左室射血分數和短軸縮短率比較
Figure10.
Comparison of fractional shortening and left ventricular ejection fraction between NGF group and late reperfusion group
組內比較:模型對照組第28天時LVEDV、LVESV大于自身第14天時(P=0.000,P=0.005),心臟結構較之前改變;模型對照組第28天時LVEF、FS均小于自身第14天時(P=0.000,P=0.000),心功能較之前惡化;過表達組第28天時LVEF、FS均大于自身第14天時(P=0.000,P=0.000),可見心臟功能較前有所改善;模型對照組第28天時LVEDD、LVESD大于自身第28天時(P=0.003,P=0.000)。除此以外,其余時間點的組內比較均無統計學意義。
3 討論
近年研究顯示NGF可促進缺血心肌血管內皮修復,抑制梗死后心肌細胞凋亡,還可通過調節炎癥反應,參與梗死后再灌注并調節交感神經再生和支配,減緩心臟重塑和再灌注心律失常,對梗死及再灌注損傷有一定保護作用[8-9],其中減緩心肌細胞凋亡和延緩心肌重塑是延遲再灌注獲益的重要機制。
本研究顯示模型組NGF表達量較假手術組明顯增高,提示心梗延遲再灌注后,可誘發體內NGF的增加。模型組與空載組比較NGF表達量無明顯差異,排除了腺病毒引起NGF表達增高的可能。整個過程中過表達組NGF的表達量明顯高于模型對照組,提示腺病毒載體攜帶的NGF基因轉染成功,明顯增加了NGF蛋白的表達。觀察同組內各個時間段NGF的變化,我們發現在延遲再灌注7 d后,NGF的表達量達到頂峰,但模型組隨著時間的延長在第14天時降至較低水平,與第3天時水平無明顯差異,說明心肌損傷后NGF蛋白的表達呈動態變化趨勢,且在損傷后的急性期達到頂峰,機體自身NGF代償性增加的高表達狀態時間相對較短,對受損心肌的保護作用可能有限。而過表達組的NGF高表達狀態時間長于模型對照組,直至第28天時開始有明顯下降,這與腺病毒不整合進入宿主細胞基因中及腺病毒引起的免疫反應有一定的相關性。過表達組NGF在體內高表達狀態的時間得到了延長,同時在促進微血管增生、抑制心肌細胞、改善心肌重塑等方面都優于模型組,根據本實驗的初步結果,我們認為在一定劑量和時間段內,體內NGF高表達狀態對大鼠心肌梗死后延遲再灌注有一定保護作用。根據延遲再灌注可能獲益的機制,我們認為最大限度地挽救瀕死心肌及延緩心肌重塑可能是提高延遲再灌注治療效果的重要途徑之一。
我們的實驗結果與Caporali等[1]和Meloni等[6]觀察NGF對大鼠心肌梗死作用的結果相似:NGF基因過表達組與對照組比較,在心肌梗死后內皮細胞存活改善,血管新生能力增高,細胞凋亡減少,心肌梗死14 d后心功能有明顯改善。而經NGF中和抗體處理的小鼠,心肌梗死后血管再生修復能力下降,內皮細胞、心肌細胞凋亡增加,心功能極度惡化。既往基礎研究結果提示延遲再灌注可能獲益的機制主要有:①開通的梗死相關血管可以促進梗死區心肌的修復和瘢痕形成。②血管的開通為非梗死區心肌提供側支血流,限制了梗死區域的擴張。③恢復供血區“頓抑”或“冬眠”心肌的功能,挽救瀕死心肌。④血管充盈形成的骨架效應及膠原過度沉積的抑制等因素延緩了心肌重塑[10]。Emanueli等[11]的一項實驗觀察到缺血肌肉組織處NGF及其高親和力受體原肌球蛋白激酶受體A(tropmyosin kinase receptor A, TrkA)表達上調,同時在給予缺血肌肉組織NGF干預后,其毛細血管及小動脈密度增加,缺血組織的血流灌注得到改善,該研究結果提示NGF可以增加微血管內皮生長因子(endothelial endothelial growth factor, VEGF)的表達,并可能通過VEGF-Akt-NO機制間接促進血管內皮細胞的增殖、遷徙以及再生的能力。既往實驗結果提示,NGF可能通過增加VEGF,間接、直接地改善延遲再灌注后非梗死區側枝血流的供應,對限制梗死區擴張具有重要的作用[10, 12]。這與既往研究提示NGF在心肌細胞中可以通過TrkA、PI3K-Akt和Foxo(Forkhead box-o)等信號通路對損傷的心肌起保護作用的結果相吻合[13-14]。當NGF過表達時,Akt磷酸化迅速增加,受Akt介導的Foxo-3a此時發生磷酸化,并從核內溢出,變為失活狀態,從而減少細胞凋亡。
綜上所述,延遲再灌注治療對于心肌梗死后患者有一定必要性,可以減輕細胞凋亡及炎癥反應,減緩心肌重塑,降低終點事件發生率,改善心肌梗死患者的近期和遠期預后。在心肌梗死及再灌注后NGF表達的增加,有利于梗死相關血管的開通,促進心肌組織的修復。NGF表達的增加還能抑制心肌細胞凋亡和心肌重塑,進而提高患者存活率。