采用化學共沉淀法制備由左旋多巴包裹的四氧化三鐵磁性納米粒子,合成磁性納米粒子之后使用1-乙基-(3-二甲基氨基丙基)碳酰二亞胺鹽酸鹽(EDC)活化左旋多巴表面的羧基官能團,與特定的核酸適配子上的氨基發生脫水縮合反應,構建具有核酸適配子與左旋多巴修飾的磁性納米粒子。通過X射線衍射(XRD)、紅外檢測(FT-IR)、 粒徑分析(SEM)、磁性能測定(VSM)等檢測方法對磁性納米粒子制備的各個階段進行檢測,并將改性磁性納米粒子與內皮祖細胞(EPCs)共混培養,評價磁性納米粒子的細胞相容性以及磁性納米粒子與EPCs短時間的結合效果,并在外加磁場的作用下評價改性磁性納米粒子對EPCs的定向引導效果。結果表明,制備的改性后磁性納米粒子有良好的磁響應性,并且在一定的濃度范圍內有較好的細胞相容性,短時間對EPCs具有較好的結合作用,初步實現了在體外動態環境下對EPCs的定向引導。
引用本文: 馬寶龍, 閆維, 陳陳佳龍, 齊鵬凱, 李建輝, 黃楠. 生物功能化磁性納米粒子的制備及對內皮祖細胞定向引導的體外研究. 生物醫學工程學雜志, 2016, 33(1): 136-143. doi: 10.7507/1001-5515.20160025 復制
版權信息: ?四川大學華西醫院華西期刊社《生物醫學工程學雜志》版權所有,未經授權不得轉載、改編
引言
磁性納米粒子由于其獨特的物理化學性質引起研究者們的日益關注,目前已廣泛應用于生物標記與分離[1]、核磁共振成像[2]、組織修復、藥物載體以及疾病的治療診斷[3]等領域的研究,具有廣闊的應用前景。但是,由于磁性納米粒子自身巨大的表面能以及納米顆粒之間相互的吸引力,納米粒子容易產生團聚,從而影響其在生物醫學領域的應用。利用表面修飾的方法,對磁性納米粒子進行表面改性,可達到減少磁粒的團聚、提高納米粒子間分散性的目的。同時,表面改性有助于改善磁性納米粒子的生物相容性,提高其在體內的安全性。
海洋貽貝能夠牢固黏附在巖石表面,這與貽貝黏附蛋白的關鍵成分多巴的作用息息相關。進一步的研究發現多巴可以牢固地黏附在礦物質、金屬及高分子等多種材料表面。左旋多巴(L-DOPA,β-3,4-二羥苯基-α-丙氨酸)具有的兒茶酚結構可以與鐵離子發生螯合,使其能夠緊密地黏附于四氧化三鐵納米粒子的表面[4]。同時左旋多巴自身也能發生聚合反應,使得磁性納米粒子表面生成聚左旋多巴包覆層,初步實現了對磁性納米粒子的表面改性。聚左旋多巴修飾層的引入提高了磁性納米粒子的生物相容性,并且為磁性納米粒子表面構建了氨基、羧基和醌基,為磁性納米粒子進一步的修飾提供了物質基礎。
核酸適配子是通過指數富集配體的系統進化技術,簡稱為SELEX技術,從隨機單鏈寡聚核苷酸庫中篩選出能與靶物質特異、準確、高效結合的配體。本文中使用的是通過SELEX技術篩選出的能與內皮祖細胞(endothelial progenitor cells,EPCs)特異性結合的核酸適配子。利用活化左旋多巴表面羧基,使之與核酸適配子的氨基發生脫水縮合,進一步將核酸適配子引入左旋多巴修飾的磁性納米粒子表面,構建具有與EPCs特異性結合能力的磁性納米粒子,將其與EPCs共培養,以評價改性后磁性納米粒子的細胞相容性,與EPCs的結合效果,及在外加磁場作用下對EPCs的定向引導效果,為后期開展更為深入的應用研究進行初步探索。
1 材料與方法
1.1 實驗試劑
2-嗎啉乙磺酸(MES)、1-乙基-(3-二甲基氨基丙基)碳酰二亞胺鹽酸鹽(EDC)、N-羥基琥珀酰亞胺(NHS)、左旋多巴(L-DOPA)、羅丹明/DAPI染色劑購自Sigma公司,CCK-8指示劑購自同仁化學研究所,核酸適配子(Aptamer)、熒光標記核酸適配子購自生工生物工程(上海)有限公司。
1.2 核酸適配子修飾和多巴包裹磁性納米粒子制備
實驗采用共沉淀法制備磁性納米顆粒。依據物質的量之比為1.75∶1稱取適量的FeCl3·6H2O與FeCl2·4H2O,用20 mL去離子水混勻后加入通有氬氣的三頸燒瓶。反應在恒溫水浴鍋中進行,水浴溫度60 ℃,機械攪拌直至鐵鹽全部溶解,緩慢滴加3 mL氨水,氨水完全加入后升溫至80 ℃加入50 mg左旋多巴反應90 min。反應結束后磁沉降分離磁性納米粒子,去離子水反復清洗5次,分散在去離子水中得到左旋多巴表面改性磁性納米粒子(MNP@DOPA)。對照組磁性納米粒子反應與上述流程相同,不同處在于在氨水完全加入后升溫至80 ℃,不加入多巴,清洗后得到純四氧化三鐵磁性納米粒子(MNP)。
取出一部分制備好的MNP@DOPA粒子,分散于20 mL含有80 mg MES、8 mg EDC和8 mg NHS的去離子水溶液中,磁流體移入三頸燒瓶,在37 ℃恒溫水浴鍋機械攪拌反應2 h,激活DOPA上的羧基,磁沉淀后,加入核酸適配子(Aptamer)工作液,繼續在37 ℃恒溫水浴鍋機械攪拌12 h后取出,用去離子水反復清洗5次,重新分散在去離子水中,得到具有核酸適配子修飾的磁性納米粒子(MNP@DOPA@Aptamer)。
利用有FAM熒光標記的核酸適配子制備具有熒光標記的磁性納米粒子反應與上述反應大致相同,僅在適配子接枝過程中要避光反應,清洗和儲備均進行避光處理。得到熒光標記核酸適配子修飾的磁性納米粒子(MNP@DOPA@Aptamer-FAM)。
1.3 材料學表征
1.3.1 X射線衍射
取制備的MNP、MNP@DOPA、 MNP@DOPA@Aptamer樣品的干燥粉末研磨均勻后,加入樣品框中,壓實,采用X射線衍射測量磁性納米粒子的晶體結構,選取測量2θ角為25°~90°,測量速率為2.5 °/min。 通過Scherrer公式D=Kλ/βcosθ,計算粒度。
1.3.2 紅外檢測
取制備的MNP、MNP@DOPA、MNP@DOPA@Aptamer樣品干粉1~2 mg與200 mg高純度KBr晶體共混研磨,用油壓機制備透明的KBr壓片,磁性納米粒子表面官能團采用傅里葉變換紅外光譜中的漫反射模式檢測,測量范圍設定為4 000~400 cm-1。
1.3.3 磁性能測定
精確稱取一定量的MNP和MNP@DOPA@Aptamer干粉,封入微膠囊中,在室溫下用震動樣品磁強計檢測其磁性能。
1.3.4 納米粒子粒徑分析
取制備的MNP、MNP@DOPA、MNP@DOPA@Aptamer樣品稀釋分散在去離子水中,取10 μL滴加于潔凈的硅片表面,真空干燥處理24 h,采用場發射掃描電鏡對樣品拍照,觀察其形貌與粒子尺寸。
1.3.5 熒光標記核酸適配子檢測
取少量制備的MNP@DOPA@Aptamer-FAM進行稀釋,配置成10 μg/mL的懸液,取出500 μL懸液,加入24孔板內進行熒光顯微鏡觀察。
1.4 細胞學評價
以下細胞學評價中所使用的EPCs細胞均來源于小鼠脛骨骨髓間充質干細胞誘導所得。
1.4.1 磁性納米粒子與EPCs細胞相容性
將制備的MNP以細胞培養基內稀釋至不同濃度,與EPCs共混培養1 d,以無任何磁性納米粒子的培養基作為對照組。將MNP@DOPA@Aptamer以細胞培養基內稀釋至不同濃度,與EPCs共混培養1 d、 2 d、 3 d,無任何磁性納米粒子的培養基作為對照組。在測試時間點提前4小時對24孔板進行換液,每孔加入含有10%的CCK-8的DMEM培養基500 μL,換液后將24孔板重置于37 ℃、CO2濃度5%的細胞培養箱中孵育4 h。取出CCK-8工作液置于96孔板中,在波長450 nm處讀數。孔板中的細胞使用生理鹽水清洗5次,用戊二醛固定12 h,羅丹明和DAPI進行熒光染色,在熒光顯微鏡下進行細胞形態觀察。
1.4.2 磁性納米粒子與EPCs細胞的靜態結合
將制備的MNP@DOPA、MNP@DOPA@Aptamer樣品與培養基共混,稀釋至40 μg/mL,將其與12孔板內培養了24 h的EPCs細胞在37 ℃、CO2濃度5%的細胞培養箱中共同孵育1 min,棄去懸液,用生理鹽水反復清洗5次,37 ℃戊二醛固定細胞2 h,加入普魯士藍染色劑與結晶紫染色劑分別對磁性納米粒子和細胞進行染色,而后用光學顯微鏡進行觀察,對照組為僅為培養基成分的細胞孔板。
1.4.3 外加磁場下改性磁性納米粒子對EPCs的定向引導
在蠕動泵的循環體系下,于管腔中放置鈷鉻合金支架,并將制備的MNP@DOPA@Aptamer樣品與EPCs的細胞懸液共混,通入管腔中,調節流速為13 cm/s,在放置支架處配合強力磁鐵以施加外加磁場,磁場強度為200 mT,磁吸附2 h后取出支架用生理鹽水清洗,戊二醛固定細胞,羅丹明染色,隨后進行熒光觀察,對照組為未加入MNP@DOPA@Aptamer樣品的細胞懸液。
2 結果與討論
2.1 X射線衍射分析
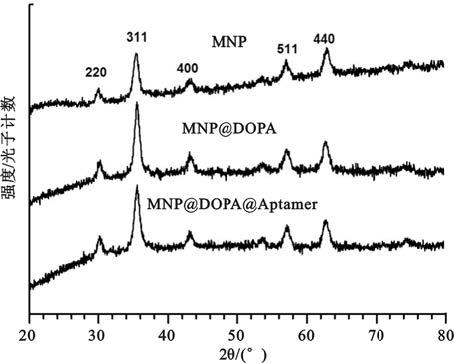
如圖 1所示,制備的MNP、MNP@DOPA、MNP@DOPA@Aptamer的衍射峰2θ出現在30.0°、35.5°、43.1°、57.1°和62.7°處。衍射峰位置分別對應了四氧化三鐵反式尖晶石結構晶面220、311、400、511、440的衍射峰位置,說明所制備樣品為反式尖晶石結構的四氧化三鐵[5]。利用Scherrer公式D=Kλ/βcosθ計算晶粒度,D為晶粒尺寸,K=0.89,β 為積分半高寬度,θ 為布拉格衍射角,λ =0.154 06 nm,計算得到樣品MNP、MNP@DOPA、MNP@DOPA@Aptamer的平均晶粒尺寸分別為12.6、13.6、13.2 nm。表面活性劑的加入并未造成晶體結構的改變,生成的四氧化三鐵磁性納米粒子仍保持其晶體的完整性。
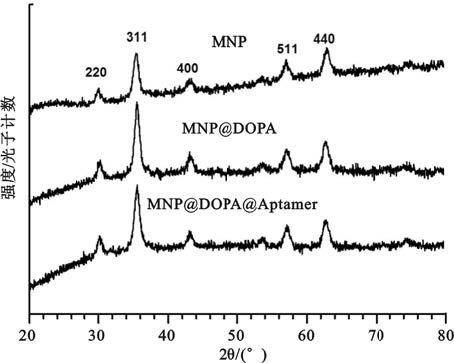 圖1
磁性納米粒子X射線衍射圖譜
Figure1.
X-ray diffraction pattern of MNP,MNP@DOPA and MNP@DOPA@Aptamer
圖1
磁性納米粒子X射線衍射圖譜
Figure1.
X-ray diffraction pattern of MNP,MNP@DOPA and MNP@DOPA@Aptamer
2.2 紅外光譜分析
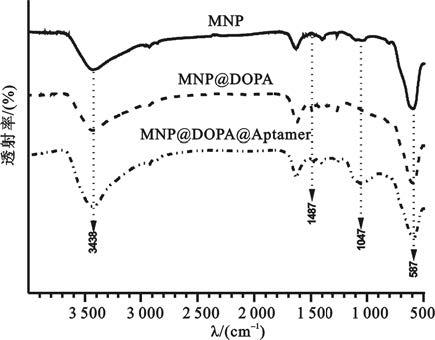
如圖 2所示,樣品在587~593 cm-1處出現Fe-O的伸縮振動峰,在3 438 cm-1處為-OH的特征吸收峰,這是由于采用了共沉淀制備的方法會在其表面吸附大量的-OH[6]。MNP@DOPA與MNP@DOPA@Aptamer在1 487 cm-1處是氨基的特征吸收峰[7],而MNP沒有這一特征峰存在,表明左旋多巴的表面接枝成功,且在進一步的反應中左旋多巴依然能夠穩定地存在。MNP@DOPA@Aptamer在932~1 182 cm-1處出現一個整合的寬峰,可能包含〖CM(81mm〗了1 110 cm-1處來自于核酸適配子中的磷酸基團的PO3-對稱振動峰,1 060 cm-1和1 135 cm-1處的來自脫氧核糖中C-O鍵的伸縮振動動峰[8]。結果表明在左旋多巴改性的納米粒子上成功地引入了核酸適配子。
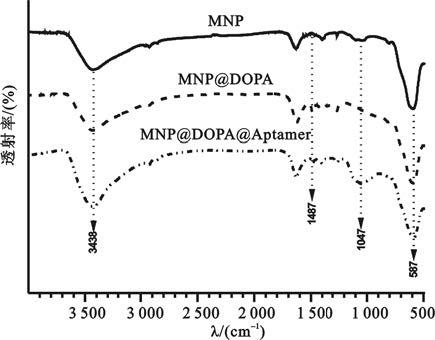 圖2
磁性納米粒子紅外光譜結果
Figure2.
FT-IR spectra of MNP, MNP@DOPA and MNP@DOPA@Aptamer
圖2
磁性納米粒子紅外光譜結果
Figure2.
FT-IR spectra of MNP, MNP@DOPA and MNP@DOPA@Aptamer
2.3 磁性能分析
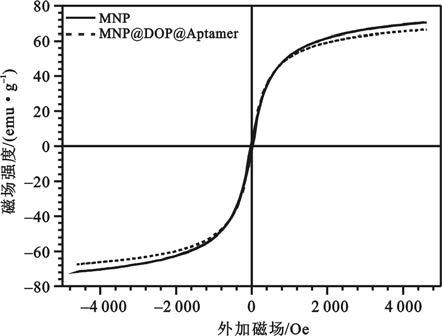
如圖 3所示,MNP的飽和磁化強度Ms=70.64 emu/g,剩余磁化強度Mr=2.89 emu/g,矯頑力Hc=27.43 Oe。MNP@DOPA@Aptamer的飽和磁化強度Ms=66.45 emu/g,剩余磁化強度Mr=2.98 emu/g,矯頑力Hc=22.60 Oe。MNP@DOPA@Aptamer的飽和磁化強度略低于MNP的飽和磁化強度,這是由于左旋多巴修飾層和表面接枝的核酸適配子本身沒有磁性,包裹在磁性納米粒子表面所致[9]。圖中可見隨著外加磁場強度的增加,磁性納米粒子的磁感應強度也隨之增加,直至飽和;當退磁時磁滯回線與磁化曲線基本重合,這也反應了所制備的磁性納米粒子均對于外加磁場具有良好的磁響應性。
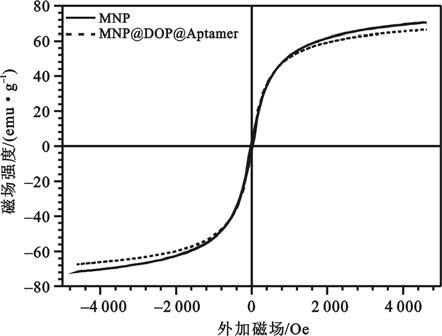 圖3
室溫下磁性納米粒子磁化曲線
Figure3.
Magnetic hysteresis curves at room temperature for MNP and MNP@DOPA@Aptamer
圖3
室溫下磁性納米粒子磁化曲線
Figure3.
Magnetic hysteresis curves at room temperature for MNP and MNP@DOPA@Aptamer
2.4 掃描電鏡結果
如圖 4所示,掃描的結果經軟件統計得MNP樣品的納米粒子平均粒徑為25 nm,MNP@DOPA樣品的納米粒子平均粒徑為30 nm,MNP@DOPA@Aptamer樣品的納米粒子平均粒徑為55 nm。從結果可見隨著左旋多巴的加入,納米粒子的粒徑增長,且分布范圍在20~47 nm。隨著核酸適配子的表面接枝使得納米粒子的粒徑得到進一步的增長,粒徑分布于37~80 nm,這也許與核酸適配子表面的多氨基與左旋多巴改性的納米粒子的羧基發生脫水縮合,使多個納米粒子被聯合所致,也側面反映了生物分子與納米粒子的結合。
 圖4
掃描電鏡結果
Figure4.
Results of scanning electronic microscopy
圖4
掃描電鏡結果
Figure4.
Results of scanning electronic microscopy
2.5 熒光標記的核酸適配子接枝檢測
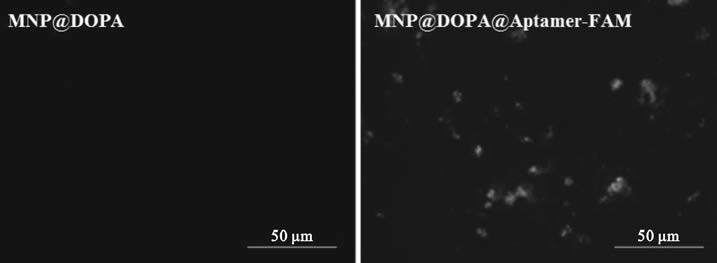
如圖 5所示,可以直觀地發現MNP@DOPA在激發光下并不顯示熒光,而在接枝了帶有FAM熒光標記的核酸適配子的MNP@DOPA@Aptamer-FAM,在激發光下可以看到明顯的熒光斑點,表明核酸適配子成功地接枝在了MNP@DOPA的表面,也與紅外圖譜的結果相吻合。
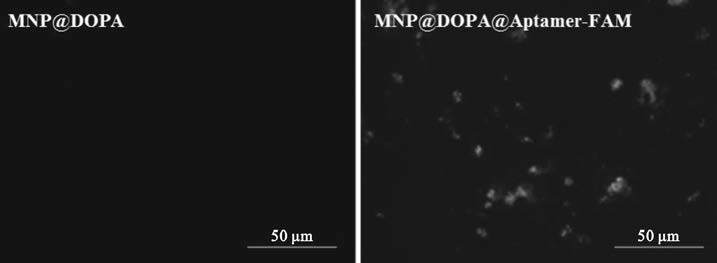 圖5
MNP@DOPA及MNP@DOPA@Aptamer-FAM顯微熒光結果
Figure5.
Fluorescent microphotographs of MNP@DOPA and MNP@DOPA@Aptamer-FAM
圖5
MNP@DOPA及MNP@DOPA@Aptamer-FAM顯微熒光結果
Figure5.
Fluorescent microphotographs of MNP@DOPA and MNP@DOPA@Aptamer-FAM
2.6 磁性納米粒子與EPCs細胞相容性
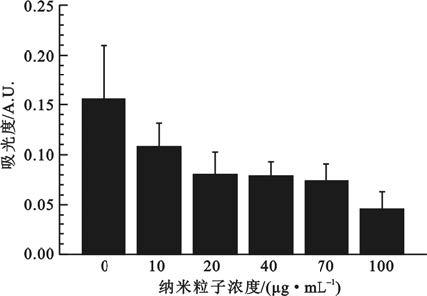
如圖 6所示,隨著MNP在培養基中濃度的增加,所測得的吸光度值在逐漸減小。吸光度值在一定的范圍內與細胞的活性呈正比關系,反映了材料與細胞之間的相容性。可見隨著MNP濃度的增加,磁性納米粒子對EPCs的抑制作用也在增大。當濃度達到最大值100 μg/mL時細胞的活性只有未加入納米粒子組的30%,顯示了對細胞生長強烈的抑制。
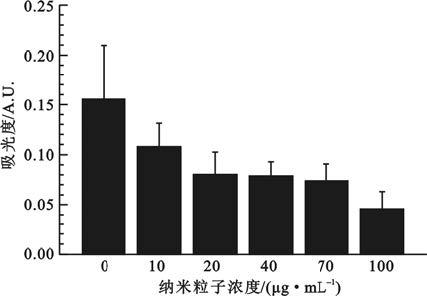 圖6
MNP與EPCs共培養1d的CCK-8結果
Figure6.
CCK-8 results of EPCs incubated with the MNP
圖6
MNP與EPCs共培養1d的CCK-8結果
Figure6.
CCK-8 results of EPCs incubated with the MNP
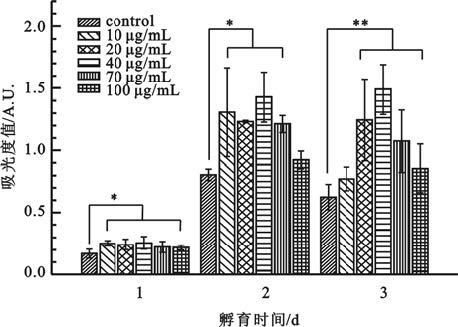
如圖 7所示,顯示各培養時段,實驗組與對照組之間細胞活性均存在明顯差異,而實驗組各濃度亞組間沒有明顯差異。共培養1 d的MNP@DOPA@Aptamer組表現出比對照組更好的細胞活性。共培養2 d后,隨著納米粒子濃度的增加,細胞的活性出現了先上升后下降,在濃度40 μg/mL組呈現出相對較好的細胞活性。共培養3 d后,細胞的活性與共培養2 d細胞的活性一致,呈現了隨著納米粒子濃度增加先上升后下降的趨勢,但細胞整體的活性未見明顯增加,個別濃度下的細胞活性較之共培養2 d時有所降低。
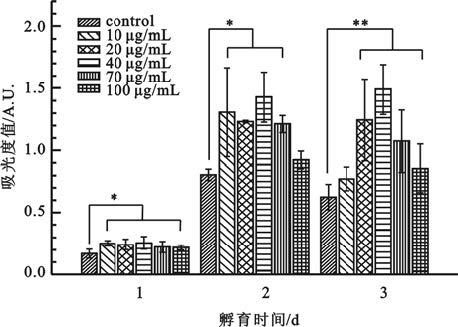 圖7
MNP@DOPA@Aptamer與EPCs3d共培養CCK-8結果
圖7
MNP@DOPA@Aptamer與EPCs3d共培養CCK-8結果
* P<0.05, **
*
MNP@DOPA@Aptamer較之對照組提高了細胞相容性,核酸適配子的引入加強了其與細胞間特異性的結合作用,有利于細胞的黏附與遷移,而隨著濃度的增加MNP@DOPA@Aptamer對細胞的生長呈現出抑制的趨勢,這可能是納米粒子自身的抑制作用造成的細胞活性下降。3 d組細胞活性沒有顯著增長,且個別濃度范圍細胞活性下降。2 d組細胞的生長較之1 d細胞有大幅的提高,其間可能伴隨大量細胞的分裂增殖,而在3 d組細胞生長空間越發受限,大量代謝副產物產生,培養基內營養物質消耗增加,這些不利因素都會造成細胞的生長受限,以及細胞活性降低。
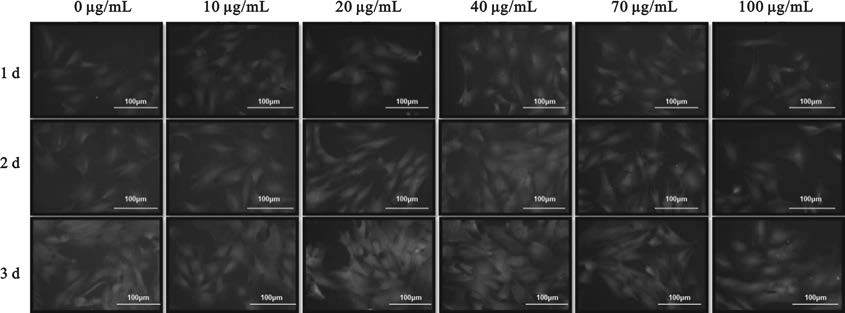
如圖 8所示,DAPI對細胞核特異性熒光染色,在共培養1 d時細胞的數量是比較接近的,且呈現不均勻分布生長,共培養2 d的細胞數量有了很大的提高,細胞分布趨于均勻,共培養3 d時細胞數量增幅不明顯,說明細胞已基本鋪滿孔板。
 圖8
不同濃度MNP@DOPA@Aptamer與EPCs共培養的DAPI熒光染色結果
Figure8.
Fluorescent microphotographs of EPCs incubated with different concentrations of MNP@DOPA@Aptamer stained by DAPI
圖8
不同濃度MNP@DOPA@Aptamer與EPCs共培養的DAPI熒光染色結果
Figure8.
Fluorescent microphotographs of EPCs incubated with different concentrations of MNP@DOPA@Aptamer stained by DAPI
如圖 9所示為羅丹明對細胞染色的結果,共培養1 d時細胞呈現出狹長和鋪展兩種形態,且細胞間的細胞間隙較大;當共培養2 d時,細胞多呈現鋪展的形態,且細胞間隙變小;共培養3 d時,細胞完全鋪展,細胞間多呈緊密排列,甚至局部區域出現多層生長的現象。當MNP@DOPA@Aptamer濃度為40 μg/mL時較其它幾組在細胞數量以及細胞形態上都有明顯的優勢,這也與細胞活性的結果基本一致。
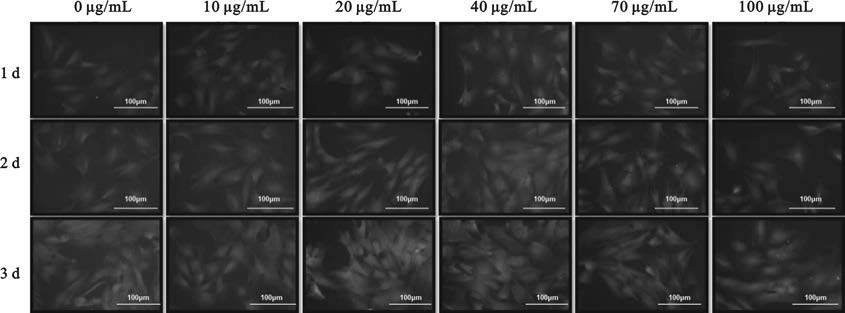 圖9
不同濃度MNP@DOPA@Aptamer與EPCs共培養的DAPI熒光染色結果
Figure9.
Fluorescent microphotographs of EPCs incubated with different concentrations of MNP@DOPA@Aptamer stained by Rhodamine
圖9
不同濃度MNP@DOPA@Aptamer與EPCs共培養的DAPI熒光染色結果
Figure9.
Fluorescent microphotographs of EPCs incubated with different concentrations of MNP@DOPA@Aptamer stained by Rhodamine
2.7 磁性納米粒子與EPCs的靜態結合
如圖 10所示,在只含有培養基的對照組,沒有觀察到被普魯士藍染色呈現墨綠色的磁性納米粒子,EPCs經過24 h的培養,已經鋪展于孔板的底部,且細胞形態良好。加入MNP@DOPA的一組,經過反復的清洗,出現了少量附著于細胞表面的MNP@DOPA,但可以發現其分布不均勻,聚集成簇的情況較多。而加入MNP@DOPA@Aptamer的一組,發現MNP@DOPA@Aptamer的數量較多,分布呈現更為均勻,幾乎每個細胞附近都會有多個納米粒子的聚集,而沒有細胞的空白處,MNP@DOPA@Aptamer幾乎沒有分布。從短時間的磁性納米粒子與EPCs的接觸結果,可以初步證明MNP@DOPA@Aptamer與EPCs細胞具有較好的結合作用,并且能夠增加磁性納米粒子與EPCs的結合的穩定性。
 圖10
普魯士藍與結晶紫對磁性納米粒子與EPCs結合后染色光鏡結果
Figure10.
Prussian Blue and Crystal Violet stained microphotographs of EPCs incubated with magnetic nanoparticles
圖10
普魯士藍與結晶紫對磁性納米粒子與EPCs結合后染色光鏡結果
Figure10.
Prussian Blue and Crystal Violet stained microphotographs of EPCs incubated with magnetic nanoparticles
2.8 外加磁場下磁性納米粒子對EPCs的定向引導
如圖 11所示,在施加相同外加磁場的作用下,MNP@DOPA@Aptamer組的支架經過生理鹽水的清洗后,仍有細胞黏附于其表面,而未加入MNP@DOPA@Aptamer的對照組的支架則很少有細胞黏附。這是由于MNP@DOPA@Aptamer與EPCs細胞能夠緊密地結合,形成磁化細胞,并保持了較好的細胞活性,在外加磁場的引導作用下,磁化細胞更多地富集在支架的表面,并與之形成較為穩定的細胞黏附,從而實現在流動體系下采用MNP@DOPA@Aptamer在外加磁場的作用下對EPCs定向引導,使之黏附生長于支架表面。
 圖11
支架表面EPCs熒光染色結果
Figure11.
Fluorescence microscopic photograph of EPCs on stent surface
圖11
支架表面EPCs熒光染色結果
Figure11.
Fluorescence microscopic photograph of EPCs on stent surface
3 結論
本文以FeCl3·6H2O和FeCl2·4H2O為原料,NH3·H2O為沉淀劑,左旋多巴為表面活性劑,應用化學共沉淀法制備了具有左旋多巴表面改性反式尖晶石結構的四氧化三鐵磁性納米粒子。使用核酸適配子對其表面進行進一步的生物分子修飾,成功制備出了MNP@DOPA@Aptamer,其粒徑分布于37~80 nm,平均粒徑為55 nm,飽和磁化強度達到66.45 emu/g,并展現了良好的磁響應性。
MNP@DOPA@Aptamer與未修飾的MNP進行比較,在與EPCs的共培養中展現出了較好的細胞相容性。
靜態與動態的納米粒子與EPCs結合的實驗結果表明,隨著核酸適配子的引入,提高了磁性納米粒子與EPCs結合的能力,并且在施加外加磁場和動態環境下,可實現對EPCs的磁定向引導。本文研究結果為此類生物功能化的磁性納米粒子在生物醫學材料領域開展更為廣泛的應用奠定了基礎。
引言
磁性納米粒子由于其獨特的物理化學性質引起研究者們的日益關注,目前已廣泛應用于生物標記與分離[1]、核磁共振成像[2]、組織修復、藥物載體以及疾病的治療診斷[3]等領域的研究,具有廣闊的應用前景。但是,由于磁性納米粒子自身巨大的表面能以及納米顆粒之間相互的吸引力,納米粒子容易產生團聚,從而影響其在生物醫學領域的應用。利用表面修飾的方法,對磁性納米粒子進行表面改性,可達到減少磁粒的團聚、提高納米粒子間分散性的目的。同時,表面改性有助于改善磁性納米粒子的生物相容性,提高其在體內的安全性。
海洋貽貝能夠牢固黏附在巖石表面,這與貽貝黏附蛋白的關鍵成分多巴的作用息息相關。進一步的研究發現多巴可以牢固地黏附在礦物質、金屬及高分子等多種材料表面。左旋多巴(L-DOPA,β-3,4-二羥苯基-α-丙氨酸)具有的兒茶酚結構可以與鐵離子發生螯合,使其能夠緊密地黏附于四氧化三鐵納米粒子的表面[4]。同時左旋多巴自身也能發生聚合反應,使得磁性納米粒子表面生成聚左旋多巴包覆層,初步實現了對磁性納米粒子的表面改性。聚左旋多巴修飾層的引入提高了磁性納米粒子的生物相容性,并且為磁性納米粒子表面構建了氨基、羧基和醌基,為磁性納米粒子進一步的修飾提供了物質基礎。
核酸適配子是通過指數富集配體的系統進化技術,簡稱為SELEX技術,從隨機單鏈寡聚核苷酸庫中篩選出能與靶物質特異、準確、高效結合的配體。本文中使用的是通過SELEX技術篩選出的能與內皮祖細胞(endothelial progenitor cells,EPCs)特異性結合的核酸適配子。利用活化左旋多巴表面羧基,使之與核酸適配子的氨基發生脫水縮合,進一步將核酸適配子引入左旋多巴修飾的磁性納米粒子表面,構建具有與EPCs特異性結合能力的磁性納米粒子,將其與EPCs共培養,以評價改性后磁性納米粒子的細胞相容性,與EPCs的結合效果,及在外加磁場作用下對EPCs的定向引導效果,為后期開展更為深入的應用研究進行初步探索。
1 材料與方法
1.1 實驗試劑
2-嗎啉乙磺酸(MES)、1-乙基-(3-二甲基氨基丙基)碳酰二亞胺鹽酸鹽(EDC)、N-羥基琥珀酰亞胺(NHS)、左旋多巴(L-DOPA)、羅丹明/DAPI染色劑購自Sigma公司,CCK-8指示劑購自同仁化學研究所,核酸適配子(Aptamer)、熒光標記核酸適配子購自生工生物工程(上海)有限公司。
1.2 核酸適配子修飾和多巴包裹磁性納米粒子制備
實驗采用共沉淀法制備磁性納米顆粒。依據物質的量之比為1.75∶1稱取適量的FeCl3·6H2O與FeCl2·4H2O,用20 mL去離子水混勻后加入通有氬氣的三頸燒瓶。反應在恒溫水浴鍋中進行,水浴溫度60 ℃,機械攪拌直至鐵鹽全部溶解,緩慢滴加3 mL氨水,氨水完全加入后升溫至80 ℃加入50 mg左旋多巴反應90 min。反應結束后磁沉降分離磁性納米粒子,去離子水反復清洗5次,分散在去離子水中得到左旋多巴表面改性磁性納米粒子(MNP@DOPA)。對照組磁性納米粒子反應與上述流程相同,不同處在于在氨水完全加入后升溫至80 ℃,不加入多巴,清洗后得到純四氧化三鐵磁性納米粒子(MNP)。
取出一部分制備好的MNP@DOPA粒子,分散于20 mL含有80 mg MES、8 mg EDC和8 mg NHS的去離子水溶液中,磁流體移入三頸燒瓶,在37 ℃恒溫水浴鍋機械攪拌反應2 h,激活DOPA上的羧基,磁沉淀后,加入核酸適配子(Aptamer)工作液,繼續在37 ℃恒溫水浴鍋機械攪拌12 h后取出,用去離子水反復清洗5次,重新分散在去離子水中,得到具有核酸適配子修飾的磁性納米粒子(MNP@DOPA@Aptamer)。
利用有FAM熒光標記的核酸適配子制備具有熒光標記的磁性納米粒子反應與上述反應大致相同,僅在適配子接枝過程中要避光反應,清洗和儲備均進行避光處理。得到熒光標記核酸適配子修飾的磁性納米粒子(MNP@DOPA@Aptamer-FAM)。
1.3 材料學表征
1.3.1 X射線衍射
取制備的MNP、MNP@DOPA、 MNP@DOPA@Aptamer樣品的干燥粉末研磨均勻后,加入樣品框中,壓實,采用X射線衍射測量磁性納米粒子的晶體結構,選取測量2θ角為25°~90°,測量速率為2.5 °/min。 通過Scherrer公式D=Kλ/βcosθ,計算粒度。
1.3.2 紅外檢測
取制備的MNP、MNP@DOPA、MNP@DOPA@Aptamer樣品干粉1~2 mg與200 mg高純度KBr晶體共混研磨,用油壓機制備透明的KBr壓片,磁性納米粒子表面官能團采用傅里葉變換紅外光譜中的漫反射模式檢測,測量范圍設定為4 000~400 cm-1。
1.3.3 磁性能測定
精確稱取一定量的MNP和MNP@DOPA@Aptamer干粉,封入微膠囊中,在室溫下用震動樣品磁強計檢測其磁性能。
1.3.4 納米粒子粒徑分析
取制備的MNP、MNP@DOPA、MNP@DOPA@Aptamer樣品稀釋分散在去離子水中,取10 μL滴加于潔凈的硅片表面,真空干燥處理24 h,采用場發射掃描電鏡對樣品拍照,觀察其形貌與粒子尺寸。
1.3.5 熒光標記核酸適配子檢測
取少量制備的MNP@DOPA@Aptamer-FAM進行稀釋,配置成10 μg/mL的懸液,取出500 μL懸液,加入24孔板內進行熒光顯微鏡觀察。
1.4 細胞學評價
以下細胞學評價中所使用的EPCs細胞均來源于小鼠脛骨骨髓間充質干細胞誘導所得。
1.4.1 磁性納米粒子與EPCs細胞相容性
將制備的MNP以細胞培養基內稀釋至不同濃度,與EPCs共混培養1 d,以無任何磁性納米粒子的培養基作為對照組。將MNP@DOPA@Aptamer以細胞培養基內稀釋至不同濃度,與EPCs共混培養1 d、 2 d、 3 d,無任何磁性納米粒子的培養基作為對照組。在測試時間點提前4小時對24孔板進行換液,每孔加入含有10%的CCK-8的DMEM培養基500 μL,換液后將24孔板重置于37 ℃、CO2濃度5%的細胞培養箱中孵育4 h。取出CCK-8工作液置于96孔板中,在波長450 nm處讀數。孔板中的細胞使用生理鹽水清洗5次,用戊二醛固定12 h,羅丹明和DAPI進行熒光染色,在熒光顯微鏡下進行細胞形態觀察。
1.4.2 磁性納米粒子與EPCs細胞的靜態結合
將制備的MNP@DOPA、MNP@DOPA@Aptamer樣品與培養基共混,稀釋至40 μg/mL,將其與12孔板內培養了24 h的EPCs細胞在37 ℃、CO2濃度5%的細胞培養箱中共同孵育1 min,棄去懸液,用生理鹽水反復清洗5次,37 ℃戊二醛固定細胞2 h,加入普魯士藍染色劑與結晶紫染色劑分別對磁性納米粒子和細胞進行染色,而后用光學顯微鏡進行觀察,對照組為僅為培養基成分的細胞孔板。
1.4.3 外加磁場下改性磁性納米粒子對EPCs的定向引導
在蠕動泵的循環體系下,于管腔中放置鈷鉻合金支架,并將制備的MNP@DOPA@Aptamer樣品與EPCs的細胞懸液共混,通入管腔中,調節流速為13 cm/s,在放置支架處配合強力磁鐵以施加外加磁場,磁場強度為200 mT,磁吸附2 h后取出支架用生理鹽水清洗,戊二醛固定細胞,羅丹明染色,隨后進行熒光觀察,對照組為未加入MNP@DOPA@Aptamer樣品的細胞懸液。
2 結果與討論
2.1 X射線衍射分析
如圖 1所示,制備的MNP、MNP@DOPA、MNP@DOPA@Aptamer的衍射峰2θ出現在30.0°、35.5°、43.1°、57.1°和62.7°處。衍射峰位置分別對應了四氧化三鐵反式尖晶石結構晶面220、311、400、511、440的衍射峰位置,說明所制備樣品為反式尖晶石結構的四氧化三鐵[5]。利用Scherrer公式D=Kλ/βcosθ計算晶粒度,D為晶粒尺寸,K=0.89,β 為積分半高寬度,θ 為布拉格衍射角,λ =0.154 06 nm,計算得到樣品MNP、MNP@DOPA、MNP@DOPA@Aptamer的平均晶粒尺寸分別為12.6、13.6、13.2 nm。表面活性劑的加入并未造成晶體結構的改變,生成的四氧化三鐵磁性納米粒子仍保持其晶體的完整性。
 圖1
磁性納米粒子X射線衍射圖譜
Figure1.
X-ray diffraction pattern of MNP,MNP@DOPA and MNP@DOPA@Aptamer
圖1
磁性納米粒子X射線衍射圖譜
Figure1.
X-ray diffraction pattern of MNP,MNP@DOPA and MNP@DOPA@Aptamer
2.2 紅外光譜分析
如圖 2所示,樣品在587~593 cm-1處出現Fe-O的伸縮振動峰,在3 438 cm-1處為-OH的特征吸收峰,這是由于采用了共沉淀制備的方法會在其表面吸附大量的-OH[6]。MNP@DOPA與MNP@DOPA@Aptamer在1 487 cm-1處是氨基的特征吸收峰[7],而MNP沒有這一特征峰存在,表明左旋多巴的表面接枝成功,且在進一步的反應中左旋多巴依然能夠穩定地存在。MNP@DOPA@Aptamer在932~1 182 cm-1處出現一個整合的寬峰,可能包含〖CM(81mm〗了1 110 cm-1處來自于核酸適配子中的磷酸基團的PO3-對稱振動峰,1 060 cm-1和1 135 cm-1處的來自脫氧核糖中C-O鍵的伸縮振動動峰[8]。結果表明在左旋多巴改性的納米粒子上成功地引入了核酸適配子。
 圖2
磁性納米粒子紅外光譜結果
Figure2.
FT-IR spectra of MNP, MNP@DOPA and MNP@DOPA@Aptamer
圖2
磁性納米粒子紅外光譜結果
Figure2.
FT-IR spectra of MNP, MNP@DOPA and MNP@DOPA@Aptamer
2.3 磁性能分析
如圖 3所示,MNP的飽和磁化強度Ms=70.64 emu/g,剩余磁化強度Mr=2.89 emu/g,矯頑力Hc=27.43 Oe。MNP@DOPA@Aptamer的飽和磁化強度Ms=66.45 emu/g,剩余磁化強度Mr=2.98 emu/g,矯頑力Hc=22.60 Oe。MNP@DOPA@Aptamer的飽和磁化強度略低于MNP的飽和磁化強度,這是由于左旋多巴修飾層和表面接枝的核酸適配子本身沒有磁性,包裹在磁性納米粒子表面所致[9]。圖中可見隨著外加磁場強度的增加,磁性納米粒子的磁感應強度也隨之增加,直至飽和;當退磁時磁滯回線與磁化曲線基本重合,這也反應了所制備的磁性納米粒子均對于外加磁場具有良好的磁響應性。
 圖3
室溫下磁性納米粒子磁化曲線
Figure3.
Magnetic hysteresis curves at room temperature for MNP and MNP@DOPA@Aptamer
圖3
室溫下磁性納米粒子磁化曲線
Figure3.
Magnetic hysteresis curves at room temperature for MNP and MNP@DOPA@Aptamer
2.4 掃描電鏡結果
如圖 4所示,掃描的結果經軟件統計得MNP樣品的納米粒子平均粒徑為25 nm,MNP@DOPA樣品的納米粒子平均粒徑為30 nm,MNP@DOPA@Aptamer樣品的納米粒子平均粒徑為55 nm。從結果可見隨著左旋多巴的加入,納米粒子的粒徑增長,且分布范圍在20~47 nm。隨著核酸適配子的表面接枝使得納米粒子的粒徑得到進一步的增長,粒徑分布于37~80 nm,這也許與核酸適配子表面的多氨基與左旋多巴改性的納米粒子的羧基發生脫水縮合,使多個納米粒子被聯合所致,也側面反映了生物分子與納米粒子的結合。
 圖4
掃描電鏡結果
Figure4.
Results of scanning electronic microscopy
圖4
掃描電鏡結果
Figure4.
Results of scanning electronic microscopy
2.5 熒光標記的核酸適配子接枝檢測
如圖 5所示,可以直觀地發現MNP@DOPA在激發光下并不顯示熒光,而在接枝了帶有FAM熒光標記的核酸適配子的MNP@DOPA@Aptamer-FAM,在激發光下可以看到明顯的熒光斑點,表明核酸適配子成功地接枝在了MNP@DOPA的表面,也與紅外圖譜的結果相吻合。
 圖5
MNP@DOPA及MNP@DOPA@Aptamer-FAM顯微熒光結果
Figure5.
Fluorescent microphotographs of MNP@DOPA and MNP@DOPA@Aptamer-FAM
圖5
MNP@DOPA及MNP@DOPA@Aptamer-FAM顯微熒光結果
Figure5.
Fluorescent microphotographs of MNP@DOPA and MNP@DOPA@Aptamer-FAM
2.6 磁性納米粒子與EPCs細胞相容性
如圖 6所示,隨著MNP在培養基中濃度的增加,所測得的吸光度值在逐漸減小。吸光度值在一定的范圍內與細胞的活性呈正比關系,反映了材料與細胞之間的相容性。可見隨著MNP濃度的增加,磁性納米粒子對EPCs的抑制作用也在增大。當濃度達到最大值100 μg/mL時細胞的活性只有未加入納米粒子組的30%,顯示了對細胞生長強烈的抑制。
 圖6
MNP與EPCs共培養1d的CCK-8結果
Figure6.
CCK-8 results of EPCs incubated with the MNP
圖6
MNP與EPCs共培養1d的CCK-8結果
Figure6.
CCK-8 results of EPCs incubated with the MNP
如圖 7所示,顯示各培養時段,實驗組與對照組之間細胞活性均存在明顯差異,而實驗組各濃度亞組間沒有明顯差異。共培養1 d的MNP@DOPA@Aptamer組表現出比對照組更好的細胞活性。共培養2 d后,隨著納米粒子濃度的增加,細胞的活性出現了先上升后下降,在濃度40 μg/mL組呈現出相對較好的細胞活性。共培養3 d后,細胞的活性與共培養2 d細胞的活性一致,呈現了隨著納米粒子濃度增加先上升后下降的趨勢,但細胞整體的活性未見明顯增加,個別濃度下的細胞活性較之共培養2 d時有所降低。
 圖7
MNP@DOPA@Aptamer與EPCs3d共培養CCK-8結果
圖7
MNP@DOPA@Aptamer與EPCs3d共培養CCK-8結果
* P<0.05, **
*
MNP@DOPA@Aptamer較之對照組提高了細胞相容性,核酸適配子的引入加強了其與細胞間特異性的結合作用,有利于細胞的黏附與遷移,而隨著濃度的增加MNP@DOPA@Aptamer對細胞的生長呈現出抑制的趨勢,這可能是納米粒子自身的抑制作用造成的細胞活性下降。3 d組細胞活性沒有顯著增長,且個別濃度范圍細胞活性下降。2 d組細胞的生長較之1 d細胞有大幅的提高,其間可能伴隨大量細胞的分裂增殖,而在3 d組細胞生長空間越發受限,大量代謝副產物產生,培養基內營養物質消耗增加,這些不利因素都會造成細胞的生長受限,以及細胞活性降低。
如圖 8所示,DAPI對細胞核特異性熒光染色,在共培養1 d時細胞的數量是比較接近的,且呈現不均勻分布生長,共培養2 d的細胞數量有了很大的提高,細胞分布趨于均勻,共培養3 d時細胞數量增幅不明顯,說明細胞已基本鋪滿孔板。
 圖8
不同濃度MNP@DOPA@Aptamer與EPCs共培養的DAPI熒光染色結果
Figure8.
Fluorescent microphotographs of EPCs incubated with different concentrations of MNP@DOPA@Aptamer stained by DAPI
圖8
不同濃度MNP@DOPA@Aptamer與EPCs共培養的DAPI熒光染色結果
Figure8.
Fluorescent microphotographs of EPCs incubated with different concentrations of MNP@DOPA@Aptamer stained by DAPI
如圖 9所示為羅丹明對細胞染色的結果,共培養1 d時細胞呈現出狹長和鋪展兩種形態,且細胞間的細胞間隙較大;當共培養2 d時,細胞多呈現鋪展的形態,且細胞間隙變小;共培養3 d時,細胞完全鋪展,細胞間多呈緊密排列,甚至局部區域出現多層生長的現象。當MNP@DOPA@Aptamer濃度為40 μg/mL時較其它幾組在細胞數量以及細胞形態上都有明顯的優勢,這也與細胞活性的結果基本一致。
 圖9
不同濃度MNP@DOPA@Aptamer與EPCs共培養的DAPI熒光染色結果
Figure9.
Fluorescent microphotographs of EPCs incubated with different concentrations of MNP@DOPA@Aptamer stained by Rhodamine
圖9
不同濃度MNP@DOPA@Aptamer與EPCs共培養的DAPI熒光染色結果
Figure9.
Fluorescent microphotographs of EPCs incubated with different concentrations of MNP@DOPA@Aptamer stained by Rhodamine
2.7 磁性納米粒子與EPCs的靜態結合
如圖 10所示,在只含有培養基的對照組,沒有觀察到被普魯士藍染色呈現墨綠色的磁性納米粒子,EPCs經過24 h的培養,已經鋪展于孔板的底部,且細胞形態良好。加入MNP@DOPA的一組,經過反復的清洗,出現了少量附著于細胞表面的MNP@DOPA,但可以發現其分布不均勻,聚集成簇的情況較多。而加入MNP@DOPA@Aptamer的一組,發現MNP@DOPA@Aptamer的數量較多,分布呈現更為均勻,幾乎每個細胞附近都會有多個納米粒子的聚集,而沒有細胞的空白處,MNP@DOPA@Aptamer幾乎沒有分布。從短時間的磁性納米粒子與EPCs的接觸結果,可以初步證明MNP@DOPA@Aptamer與EPCs細胞具有較好的結合作用,并且能夠增加磁性納米粒子與EPCs的結合的穩定性。
 圖10
普魯士藍與結晶紫對磁性納米粒子與EPCs結合后染色光鏡結果
Figure10.
Prussian Blue and Crystal Violet stained microphotographs of EPCs incubated with magnetic nanoparticles
圖10
普魯士藍與結晶紫對磁性納米粒子與EPCs結合后染色光鏡結果
Figure10.
Prussian Blue and Crystal Violet stained microphotographs of EPCs incubated with magnetic nanoparticles
2.8 外加磁場下磁性納米粒子對EPCs的定向引導
如圖 11所示,在施加相同外加磁場的作用下,MNP@DOPA@Aptamer組的支架經過生理鹽水的清洗后,仍有細胞黏附于其表面,而未加入MNP@DOPA@Aptamer的對照組的支架則很少有細胞黏附。這是由于MNP@DOPA@Aptamer與EPCs細胞能夠緊密地結合,形成磁化細胞,并保持了較好的細胞活性,在外加磁場的引導作用下,磁化細胞更多地富集在支架的表面,并與之形成較為穩定的細胞黏附,從而實現在流動體系下采用MNP@DOPA@Aptamer在外加磁場的作用下對EPCs定向引導,使之黏附生長于支架表面。
 圖11
支架表面EPCs熒光染色結果
Figure11.
Fluorescence microscopic photograph of EPCs on stent surface
圖11
支架表面EPCs熒光染色結果
Figure11.
Fluorescence microscopic photograph of EPCs on stent surface
3 結論
本文以FeCl3·6H2O和FeCl2·4H2O為原料,NH3·H2O為沉淀劑,左旋多巴為表面活性劑,應用化學共沉淀法制備了具有左旋多巴表面改性反式尖晶石結構的四氧化三鐵磁性納米粒子。使用核酸適配子對其表面進行進一步的生物分子修飾,成功制備出了MNP@DOPA@Aptamer,其粒徑分布于37~80 nm,平均粒徑為55 nm,飽和磁化強度達到66.45 emu/g,并展現了良好的磁響應性。
MNP@DOPA@Aptamer與未修飾的MNP進行比較,在與EPCs的共培養中展現出了較好的細胞相容性。
靜態與動態的納米粒子與EPCs結合的實驗結果表明,隨著核酸適配子的引入,提高了磁性納米粒子與EPCs結合的能力,并且在施加外加磁場和動態環境下,可實現對EPCs的磁定向引導。本文研究結果為此類生物功能化的磁性納米粒子在生物醫學材料領域開展更為廣泛的應用奠定了基礎。