分光光度法是對新藥、植入性生物醫用材料及血液制品進行溶血性評價的常用簡便方法, 是針對血紅蛋白特征吸收峰進行的定量分析, 因此, 當評價體系對血紅蛋白構象產生影響時, 檢測波長的正確選擇就顯得至關重要。本文通過對在細胞培養液、磷酸鹽緩沖液(PBS)、生理鹽水和庫血保存液四種體系中紅細胞溶血的上清進行連續波長掃描及其特征峰隨時間變化的研究, 提出如下檢測波長的選擇方案:細胞培養液中, 4 h內檢測選415 nm, 4~72 h選408 nm附近; PBS中, 4 h內選541、577或415 nm, 4~72 h選541、577或406 nm附近; 生理鹽水中, 4 h內選414 nm, 4~72 h選405 nm附近, 12 h內還可選541或577 nm; 庫血保存液中, 72 h內選415、540或576 nm。
引用本文: 張紅, 蘇寶倡, 葉迅達, 羅曼. 溶血性評價體系中分光光度法檢測波長的選擇. 生物醫學工程學雜志, 2016, 33(2): 368-372. doi: 10.7507/1001-5515.20160062 復制
版權信息: ?四川大學華西醫院華西期刊社《生物醫學工程學雜志》版權所有,未經授權不得轉載、改編
引言
溶血是血紅蛋白從膜破損的紅細胞中釋放到胞外進入介質的過程[1]。溶血性評價在藥物研發、生物醫用材料篩選及研制等方面均有重要應用[2]。游離血紅蛋白測定是血站全血及成分血質量控制的重要檢查項目[3]。在臨床上,溶血性疾病和輸血反應均需通過檢測游離血紅蛋白來輔助診療[4]。溶血試驗檢測游離血紅蛋白通常是在一定介質體系中進行的,細胞培養液、PBS和生理鹽水是體外實驗常用的介質;庫血保存液是血液制品的儲存介質,直接影響血液質量[5]。
溶血試驗目前已發展有多種方法,包括分光光度法、氰化高鐵法、聯苯胺法等。氰化高鐵法所用試劑穩定性差,有劇毒,對環境有一定的污染[6]。聯苯胺法靈敏度不高,且聯苯胺試劑有致癌性,對操作者健康存在潛在威脅[7]。分光光度法在測定游離血紅蛋白時比化學法更為安全、簡便、準確和精密。該方法用于血紅蛋白定量是基于氧合血紅蛋白在415、541和576 nm存在吸收峰[8]。其中在415 nm附近的峰為Soret帶[9],表征血紅蛋白四級結構的信息[10];在541和576 nm附近的兩個峰分別為β帶和α帶[11],表征血紅蛋白亞基及血紅素口袋[12]的相關信息。在不同的介質體系中由于溶劑組分和環境條件差異可能會對血紅蛋白特征吸收峰產生不同程度影響;血紅蛋白結構的穩定性不僅與體系組成有關,還可能與其在體系中存在的時間長短有關。然而,雖然有多種檢測波長在溶血試驗中被選用,但血紅蛋白在不同介質體系中持續作用后特征峰變化的比較研究未見報道。本文研究了在細胞培養液、PBS、生理鹽水及庫血保存液四種體系中紅細胞溶血上清的連續吸收光譜特征峰及其隨時間變化的規律,為溶血試驗檢測波長和時間的選擇提供依據。
1 材料與方法
1.1 血液樣本來源
新鮮血液(來自健康青年志愿者);庫血(來自廣州血液中心)
1.2 儀器與試劑
紫外-可見分光光度計(TU-1810系列,北京普析通用儀器有限責任公司);CO2培養箱(Thermo Scientific HERAcell i系列);恒溫培養箱(上海智城分析儀器制造有限公司);臺式離心機(80-2型號,常州市華普達教學儀器有限公司)。
生理鹽水(華仁藥業股份有限公司);磷酸鹽緩沖液(PBS,pH值為7.2~7.4);RPMI-1640粉末(Gibco公司);胎牛血清(FBS,浙江天杭生物科技有限公司);青鏈霉素(Gibco公司)。
1.3 實驗方法
1.3.1 血紅蛋白溶液的制備
抗凝管采集20 mL新鮮血液,離心(1 500 r/min,5 min)后取下層富集紅細胞,按1:10(v/v)加入三蒸水使其充分溶血,再次離心(3 500 r/min,5 min)后取上層液即為血紅蛋白溶液。
1.3.2 細胞培養液體系中血紅蛋白的連續吸收光譜掃描
分別取新鮮人血清、胎牛血清、RPMI-1640培養液(不含胎牛血清)和RPMI-1640完全培養液(含10%胎牛血清)到微量比色皿中,用紫外-可見分光光度計進行連續波長掃描(光度方式:Abs,掃描范圍:400~800 nm,間隔:1 nm,下同)。
取1.3.1制得的血紅蛋白溶液2 mL,按1:5(v/v)與RPMI-1640完全培養液混合均勻后,分裝到7個5 mL規格的培養瓶中,每瓶1 mL,置于CO2培養箱(37℃,0.5% CO2)中孵育。分別在第4、12、24、36、48、60、72小時取出其中一個培養瓶,對樣液進行連續波長掃描。
1.3.3 PBS體系中血紅蛋白的連續吸收光譜掃描
取1.3.1制得的血紅蛋白溶液2 mL,按1:5(v/v)與PBS混合均勻后,分裝到8個培養瓶中,每瓶1 mL,置于25℃恒溫培養箱中孵育。分別在第0、4、12、24、36、48、60、72小時取出其中一個培養瓶,對樣液進行連續波長掃描。
1.3.4 生理鹽水體系中血紅蛋白的連續吸收光譜掃描
方法同1.3.3,將PBS替換成生理鹽水。
1.3.5 庫血保存液體系中血紅蛋白的連續吸收光譜掃描
從血袋中取30 mL庫血,離心(1 500 r/min,5 min)后取上層清液到8個培養瓶中,每瓶1 mL,置于25℃恒溫培養箱中孵育。光譜掃描方法同1.3.3。
2 結果
2.1 細胞培養液中隨時間延長血紅蛋白Soret帶藍移且峰強增加,α、β帶消失
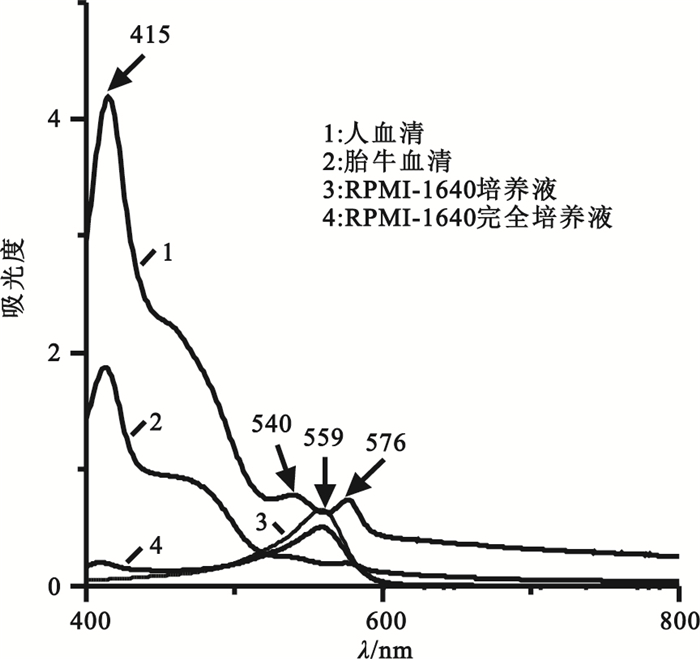
RPMI-1640完全培養液是體外實驗常用的細胞培養液,其主要成分為RPMI-1640培養液和胎牛血清,胎牛血清與人血清吸收光譜相近,如圖 1所示,波長為415 nm的強峰是人血清和胎牛血清吸收光譜中共同的特征吸收峰,在人血清的吸收譜線(1)中還有明顯可見的α帶和β帶,而胎牛血清因其含牛血紅蛋白不高于0.02%[7],故α帶和β帶峰強很弱,并且在RPMI-1640完全培養液中胎牛血清由于RPMI-1640培養液的稀釋作用,其Soret帶的峰強也十分微弱。而559 nm吸收峰顯然為RPMI-1640培養液和RPMI-1640完全培養液的共同特征峰,此峰為細胞培養液中指示劑酚紅的特征吸收峰[13],值得注意的是其恰好介于540~576 nm之間,這會對α和β帶吸收峰檢測造成干擾,因此在細胞培養液體系進行溶血檢測時不宜選擇α帶和β帶,而應選擇Soret帶。
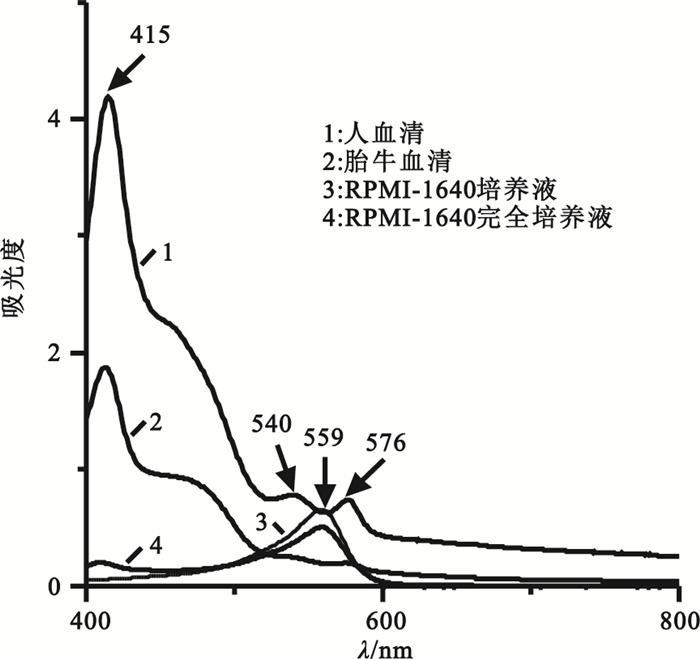 圖1
人血清、胎牛血清、RPMI-1640培養液和RPMI-1640完全培養液的吸收光譜圖
Figure1.
Absorption spectra of human serum, FBS, RPMI-1640 medium and RPMI-1640 complete medium
圖1
人血清、胎牛血清、RPMI-1640培養液和RPMI-1640完全培養液的吸收光譜圖
Figure1.
Absorption spectra of human serum, FBS, RPMI-1640 medium and RPMI-1640 complete medium
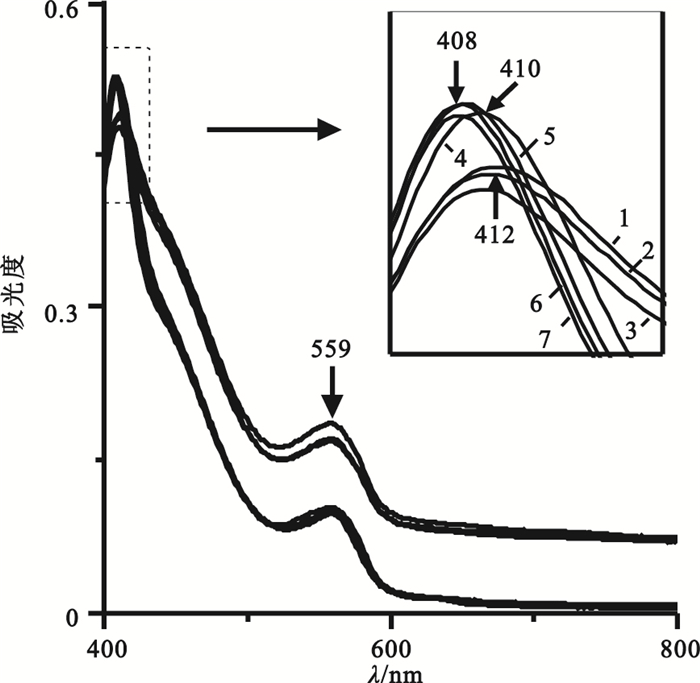
RPMI-1640完全培養液中血紅蛋白吸收光譜如圖 2所示,隨孵育時間推移,血紅蛋白Soret帶有藍移變化趨勢:4 h時由初始的415 nm位移至412 nm,36 h時移至410 nm,48 h時又移至408 nm;隨后一直穩定至72 h。在Soret帶藍移發生的同時,其峰強也隨之增加(I412 < I410 < I408)。這是由于隨時間延長,血紅蛋白變性逐漸遞增[14],鐵自旋增加[15],使得血紅蛋白亞基間相互作用增強,四級結構變得致密,故導致Soret帶強度增加。細胞培養箱中高CO2濃度致環境pH值變低(559 nm峰強隨時間延長下降),血紅素口袋結構改變(被559 nm峰掩蓋的α、β帶強度下降)。綜上所述,在細胞培養液體系中由于血紅蛋白的構象隨時間和環境變化而改變,所以檢測血紅蛋白時應選擇合適的波長,即4 h之內應選擇415 nm附近波長,在4~72 h應選擇408 nm附近波長。
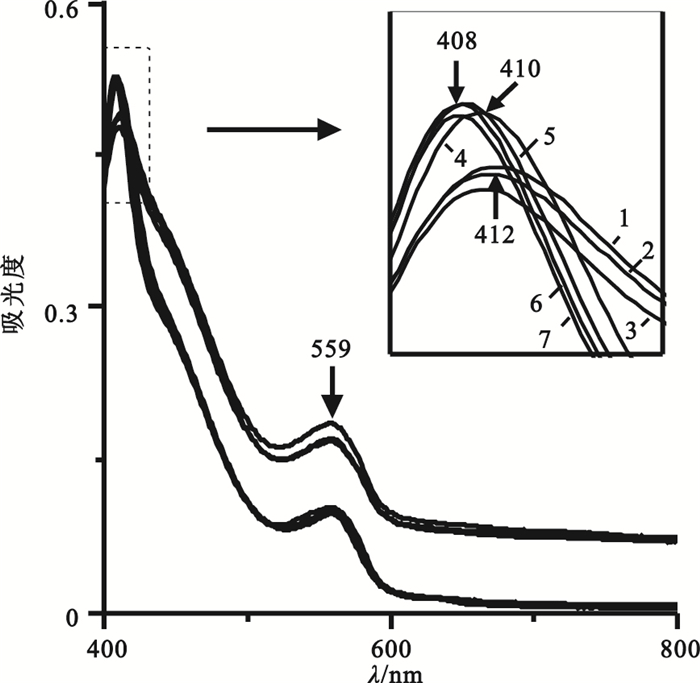 圖2
RPMI-1640完全培養液中不同時間血紅蛋白吸收光譜圖
圖2
RPMI-1640完全培養液中不同時間血紅蛋白吸收光譜圖
1: 4 h; 2: 12 h; 3: 24 h; 4: 36 h; 5: 48 h; 6: 60 h; 7: 72 h
Figure2. Absorption spectra of hemoglobin in RPMI-1640 complete medium at different times1: 4 h; 2: 12 h; 3: 24 h; 4: 36 h; 5: 48 h; 6: 60 h; 7: 72 h
2.2 PBS體系中隨時間延長血紅蛋白Soret帶藍移,α、β帶峰強下降
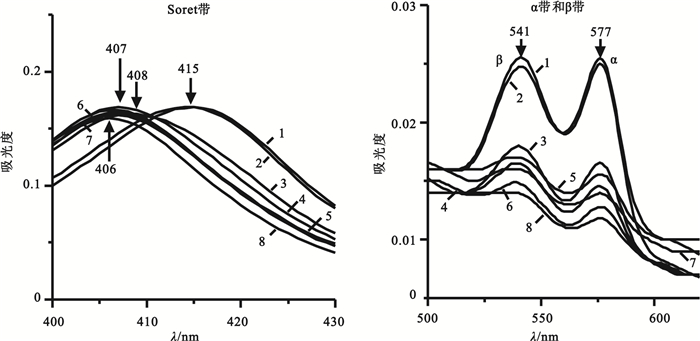
PBS體系的血紅蛋白吸收光譜如圖 3所示,在0~4 h內吸收譜線呈現氧合血紅蛋白的三個典型特征吸收峰,即415、541和577 nm,提示此時氧合血紅蛋白的構象正常。在12 h時Soret帶藍移至408 nm且峰強下降,24~60 h時移至407 nm,72 h時移至406 nm,這是由于在體外室溫條件下,由于溫度、離子強度等的改變使血紅蛋白的四級結構發生了明顯變化,血紅蛋白亞基解聚增加,亞基自身的三級構象也發生明顯崩解[16],具體表現為Soret帶發生藍移的同時峰強發生下降,氧合血紅蛋白的β和α帶在0~4 h時峰強相近,在12 h時峰強顯著下降,峰形由陡變緩,兩峰相對強度也發生改變,這種變化的差異可能是由于血紅蛋白亞基一級結構的不同所致。
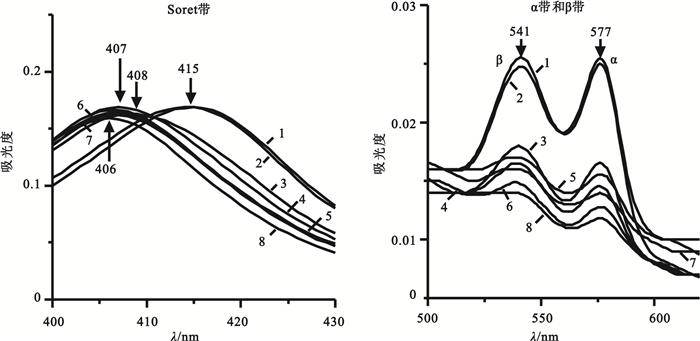 圖3
PBS體系中不同時間血紅蛋白Soret帶和α、β帶吸收光譜圖
圖3
PBS體系中不同時間血紅蛋白Soret帶和α、β帶吸收光譜圖
1: 0 h; 2: 4 h; 3: 12 h; 4: 24 h; 5: 36 h; 6: 48 h; 7: 60 h; 8: 72 h
Figure3. Absorption spectra of hemoglobin Soret andα, βband in PBS system at different times1: 0 h; 2: 4 h; 3: 12 h; 4: 24 h; 5: 36 h; 6: 48 h; 7: 60 h; 8: 72 h
綜上所述,體外PBS體系檢測血紅蛋白,在4 h之內可選擇415、541或577 nm,其中選擇415 nm檢測更加靈敏且能反映血紅蛋白四級結構的整體信息;在4~72 h則不能選擇415 nm,而應選擇406 nm附近波長,此時選擇541或577 nm檢測會更加穩定,而且若選擇541 nm應在72 h之前進行檢測。
2.3 生理鹽水體系中隨時間延長血紅蛋白Soret帶藍移,α、β帶峰強顯著降低
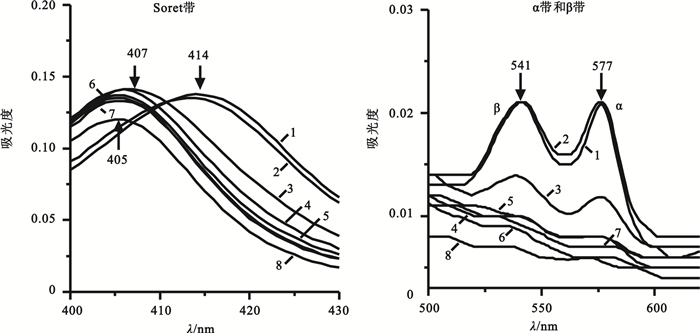
生理鹽水體系的血紅蛋白吸收光譜如圖 4所示,與PSB情況類似,在0~4 h譜線存在三個吸收峰,分別在414、541和577 nm。在4 h時Soret帶即由414 nm藍移至413 nm,較PBS組提早,在12 h時Soret帶發生明顯藍移,并且隨著時間的延長峰強度呈下降趨勢,72 h時Soret帶移至405 nm。由圖 4可知,在24 h時α帶和β帶的峰形即消失,這是由于在生理鹽水體系中同樣存在著血紅蛋白四級構象、亞基三級結構以及血紅素口袋疏水微環境的變化,并且這種變化比PBS組更加顯著,說明生理鹽水的單純鹽溶液體系對血紅蛋白結構的保護作用不及磷酸鹽緩沖體系。
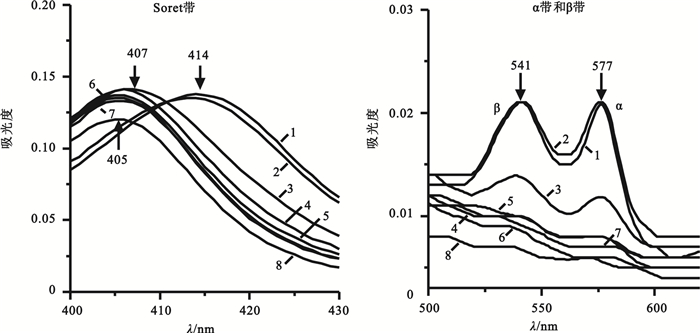 圖4
生理鹽水體系中不同時間血紅蛋白Soret帶和α、β帶吸收光譜圖
圖4
生理鹽水體系中不同時間血紅蛋白Soret帶和α、β帶吸收光譜圖
1: 0 h; 2: 4 h; 3: 12 h; 4: 24 h; 5: 36 h; 6: 48 h; 7: 60 h; 8: 72 h
Figure4. Absorption spectra of hemoglobin Soret andα, βband in physiological saline system at different times1: 0 h; 2: 4 h; 3: 12 h; 4: 24 h; 5: 36 h; 6: 48 h; 7: 60 h; 8: 72 h
綜上所述,建議體外溶血實驗運用PBS體系,若在生理鹽水體系檢測血紅蛋白,在4 h內可選擇414、541或577 nm;在4~72 h選擇405 nm附近波長;12 h之內還可選擇541或577 nm。
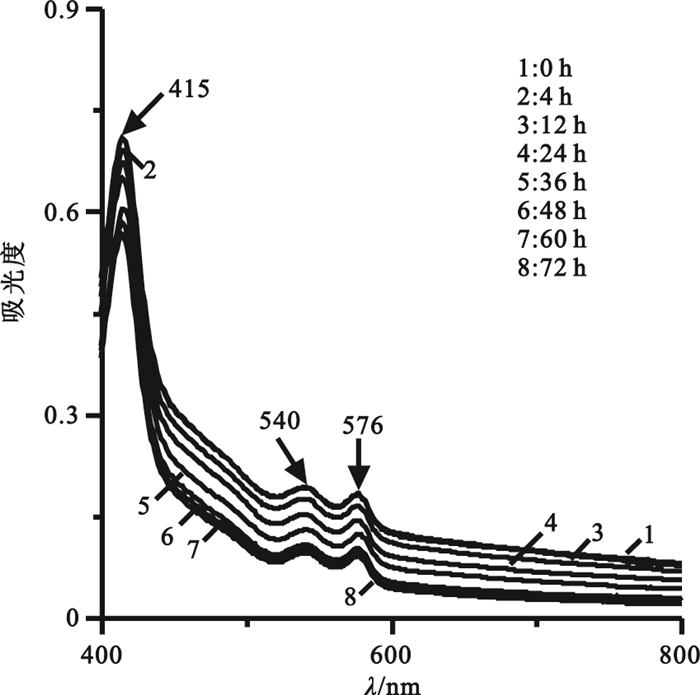
2.4 庫血保存液體系中血紅蛋白3個特征峰隨時間延長不發生位移但峰強下降
庫血保存液體系的血紅蛋白吸收光譜如圖 5所示,在0~72 h范圍內,譜線在415、540和576 nm處的三個吸收峰均十分明顯,其強度隨時間延長逐漸降低,與PBS和生理鹽水組不同的是,隨著時間的延長血紅蛋白Soret帶不發生藍移,α帶和β帶的峰不發生由陡變緩的變化且兩峰的相對強度也很穩定。這說明庫血保存液對血紅蛋白的構象具有顯著的保護作用,但由于在離體的環境中,仍然存在著血紅蛋白四聚體的解聚和三級結構的消失而導致峰強度下降。因此,在對庫血上清進行血紅蛋白檢測時,72 h內可選擇415 nm、540 nm或576 nm。
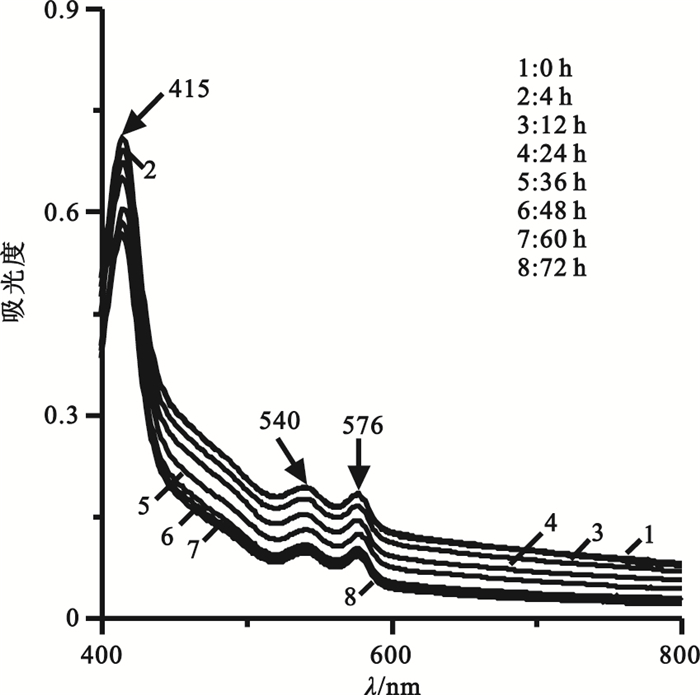 圖5
庫血保存液體系中不同時間血紅蛋白吸收光譜圖
Figure5.
Absorption spectra of hemoglobin in banked blood preservation solution system at different times
圖5
庫血保存液體系中不同時間血紅蛋白吸收光譜圖
Figure5.
Absorption spectra of hemoglobin in banked blood preservation solution system at different times
3 討論
氧合血紅蛋白在415、541和577 nm附近有特征吸收峰,吸收峰的位置和強度由血紅蛋白構象及其卟啉鐵自旋狀態決定,而其所處介質體系的離子強度、pH值和溫度又會對這些因素產生影響啉鐵自旋狀態決定,而其所處介質體系的離子強度、pH值和溫度又會對這些因素產生影響[17]。正常人血紅蛋白為四聚體結構,在一定體外介質條件下,血紅蛋白四聚體能被解聚成二聚體[18],乃至單體。一部分亞基之間發生斷裂,同時由于pH值可能偏離生理條件范圍,導致維系血紅蛋白亞基三級結構的部分化學鍵斷裂,造成α和β帶吸收峰的強度下降。pH值的變化也會使Soret帶發生偏移[19]。在PBS體系下,磷酸鹽的緩沖體系對血紅蛋白的結構產生一定的保護作用,其效果優于生理鹽水的單純鹽溶液體系,而庫血保存液中不僅含有枸櫞酸與枸櫞酸鈉形成緩沖對來調節和穩定pH值,而且葡萄糖、腺嘌呤、磷酸二氫鈉、甘露醇等的加入更有利于血紅蛋白維持其原有的四級構象和三級結構。在細胞培養液體系下,胎牛血清中牛血紅蛋白含量不高于0.02%,且經過培養液的稀釋,其在415 nm處的峰強度非常弱,因此在溶血試驗時對待測血紅蛋白的干擾很小,可將完全培養液作為對照組進行檢測。然而由于指示劑酚紅在559 nm處存在較強的吸收峰,對血紅蛋白α、β帶的吸收峰檢測造成干擾,此時溶血試驗應選Soret帶的吸收峰,若要檢測α和β帶吸收峰需用不含酚紅的培養基。在4種體系中Soret帶和α、β帶峰強度均表現出隨時間延長而降低的趨勢,這可能是由于體外條件下部分血紅蛋白的四級結構解聚和亞基三級結構的消失所致。在Soret帶和α、β帶均可選的情況下,選擇Soret帶可反映血紅蛋白整體四級結構的信息,其變化較α、β帶更為顯著,可提示蛋白質是否變性,而α、β帶則更多地反映血紅蛋白三級結構和血紅素口袋的信息。另外,由于實驗所用的儀器設備和檢測條件差異,血紅蛋白的吸收峰波長也會略有不同,因此在溶血實驗之前建議進行預實驗對血紅蛋白溶液進行全波長掃描,以確定所用條件下血紅蛋白的吸收峰。
引言
溶血是血紅蛋白從膜破損的紅細胞中釋放到胞外進入介質的過程[1]。溶血性評價在藥物研發、生物醫用材料篩選及研制等方面均有重要應用[2]。游離血紅蛋白測定是血站全血及成分血質量控制的重要檢查項目[3]。在臨床上,溶血性疾病和輸血反應均需通過檢測游離血紅蛋白來輔助診療[4]。溶血試驗檢測游離血紅蛋白通常是在一定介質體系中進行的,細胞培養液、PBS和生理鹽水是體外實驗常用的介質;庫血保存液是血液制品的儲存介質,直接影響血液質量[5]。
溶血試驗目前已發展有多種方法,包括分光光度法、氰化高鐵法、聯苯胺法等。氰化高鐵法所用試劑穩定性差,有劇毒,對環境有一定的污染[6]。聯苯胺法靈敏度不高,且聯苯胺試劑有致癌性,對操作者健康存在潛在威脅[7]。分光光度法在測定游離血紅蛋白時比化學法更為安全、簡便、準確和精密。該方法用于血紅蛋白定量是基于氧合血紅蛋白在415、541和576 nm存在吸收峰[8]。其中在415 nm附近的峰為Soret帶[9],表征血紅蛋白四級結構的信息[10];在541和576 nm附近的兩個峰分別為β帶和α帶[11],表征血紅蛋白亞基及血紅素口袋[12]的相關信息。在不同的介質體系中由于溶劑組分和環境條件差異可能會對血紅蛋白特征吸收峰產生不同程度影響;血紅蛋白結構的穩定性不僅與體系組成有關,還可能與其在體系中存在的時間長短有關。然而,雖然有多種檢測波長在溶血試驗中被選用,但血紅蛋白在不同介質體系中持續作用后特征峰變化的比較研究未見報道。本文研究了在細胞培養液、PBS、生理鹽水及庫血保存液四種體系中紅細胞溶血上清的連續吸收光譜特征峰及其隨時間變化的規律,為溶血試驗檢測波長和時間的選擇提供依據。
1 材料與方法
1.1 血液樣本來源
新鮮血液(來自健康青年志愿者);庫血(來自廣州血液中心)
1.2 儀器與試劑
紫外-可見分光光度計(TU-1810系列,北京普析通用儀器有限責任公司);CO2培養箱(Thermo Scientific HERAcell i系列);恒溫培養箱(上海智城分析儀器制造有限公司);臺式離心機(80-2型號,常州市華普達教學儀器有限公司)。
生理鹽水(華仁藥業股份有限公司);磷酸鹽緩沖液(PBS,pH值為7.2~7.4);RPMI-1640粉末(Gibco公司);胎牛血清(FBS,浙江天杭生物科技有限公司);青鏈霉素(Gibco公司)。
1.3 實驗方法
1.3.1 血紅蛋白溶液的制備
抗凝管采集20 mL新鮮血液,離心(1 500 r/min,5 min)后取下層富集紅細胞,按1:10(v/v)加入三蒸水使其充分溶血,再次離心(3 500 r/min,5 min)后取上層液即為血紅蛋白溶液。
1.3.2 細胞培養液體系中血紅蛋白的連續吸收光譜掃描
分別取新鮮人血清、胎牛血清、RPMI-1640培養液(不含胎牛血清)和RPMI-1640完全培養液(含10%胎牛血清)到微量比色皿中,用紫外-可見分光光度計進行連續波長掃描(光度方式:Abs,掃描范圍:400~800 nm,間隔:1 nm,下同)。
取1.3.1制得的血紅蛋白溶液2 mL,按1:5(v/v)與RPMI-1640完全培養液混合均勻后,分裝到7個5 mL規格的培養瓶中,每瓶1 mL,置于CO2培養箱(37℃,0.5% CO2)中孵育。分別在第4、12、24、36、48、60、72小時取出其中一個培養瓶,對樣液進行連續波長掃描。
1.3.3 PBS體系中血紅蛋白的連續吸收光譜掃描
取1.3.1制得的血紅蛋白溶液2 mL,按1:5(v/v)與PBS混合均勻后,分裝到8個培養瓶中,每瓶1 mL,置于25℃恒溫培養箱中孵育。分別在第0、4、12、24、36、48、60、72小時取出其中一個培養瓶,對樣液進行連續波長掃描。
1.3.4 生理鹽水體系中血紅蛋白的連續吸收光譜掃描
方法同1.3.3,將PBS替換成生理鹽水。
1.3.5 庫血保存液體系中血紅蛋白的連續吸收光譜掃描
從血袋中取30 mL庫血,離心(1 500 r/min,5 min)后取上層清液到8個培養瓶中,每瓶1 mL,置于25℃恒溫培養箱中孵育。光譜掃描方法同1.3.3。
2 結果
2.1 細胞培養液中隨時間延長血紅蛋白Soret帶藍移且峰強增加,α、β帶消失
RPMI-1640完全培養液是體外實驗常用的細胞培養液,其主要成分為RPMI-1640培養液和胎牛血清,胎牛血清與人血清吸收光譜相近,如圖 1所示,波長為415 nm的強峰是人血清和胎牛血清吸收光譜中共同的特征吸收峰,在人血清的吸收譜線(1)中還有明顯可見的α帶和β帶,而胎牛血清因其含牛血紅蛋白不高于0.02%[7],故α帶和β帶峰強很弱,并且在RPMI-1640完全培養液中胎牛血清由于RPMI-1640培養液的稀釋作用,其Soret帶的峰強也十分微弱。而559 nm吸收峰顯然為RPMI-1640培養液和RPMI-1640完全培養液的共同特征峰,此峰為細胞培養液中指示劑酚紅的特征吸收峰[13],值得注意的是其恰好介于540~576 nm之間,這會對α和β帶吸收峰檢測造成干擾,因此在細胞培養液體系進行溶血檢測時不宜選擇α帶和β帶,而應選擇Soret帶。
 圖1
人血清、胎牛血清、RPMI-1640培養液和RPMI-1640完全培養液的吸收光譜圖
Figure1.
Absorption spectra of human serum, FBS, RPMI-1640 medium and RPMI-1640 complete medium
圖1
人血清、胎牛血清、RPMI-1640培養液和RPMI-1640完全培養液的吸收光譜圖
Figure1.
Absorption spectra of human serum, FBS, RPMI-1640 medium and RPMI-1640 complete medium
RPMI-1640完全培養液中血紅蛋白吸收光譜如圖 2所示,隨孵育時間推移,血紅蛋白Soret帶有藍移變化趨勢:4 h時由初始的415 nm位移至412 nm,36 h時移至410 nm,48 h時又移至408 nm;隨后一直穩定至72 h。在Soret帶藍移發生的同時,其峰強也隨之增加(I412 < I410 < I408)。這是由于隨時間延長,血紅蛋白變性逐漸遞增[14],鐵自旋增加[15],使得血紅蛋白亞基間相互作用增強,四級結構變得致密,故導致Soret帶強度增加。細胞培養箱中高CO2濃度致環境pH值變低(559 nm峰強隨時間延長下降),血紅素口袋結構改變(被559 nm峰掩蓋的α、β帶強度下降)。綜上所述,在細胞培養液體系中由于血紅蛋白的構象隨時間和環境變化而改變,所以檢測血紅蛋白時應選擇合適的波長,即4 h之內應選擇415 nm附近波長,在4~72 h應選擇408 nm附近波長。
 圖2
RPMI-1640完全培養液中不同時間血紅蛋白吸收光譜圖
圖2
RPMI-1640完全培養液中不同時間血紅蛋白吸收光譜圖
1: 4 h; 2: 12 h; 3: 24 h; 4: 36 h; 5: 48 h; 6: 60 h; 7: 72 h
Figure2. Absorption spectra of hemoglobin in RPMI-1640 complete medium at different times1: 4 h; 2: 12 h; 3: 24 h; 4: 36 h; 5: 48 h; 6: 60 h; 7: 72 h
2.2 PBS體系中隨時間延長血紅蛋白Soret帶藍移,α、β帶峰強下降
PBS體系的血紅蛋白吸收光譜如圖 3所示,在0~4 h內吸收譜線呈現氧合血紅蛋白的三個典型特征吸收峰,即415、541和577 nm,提示此時氧合血紅蛋白的構象正常。在12 h時Soret帶藍移至408 nm且峰強下降,24~60 h時移至407 nm,72 h時移至406 nm,這是由于在體外室溫條件下,由于溫度、離子強度等的改變使血紅蛋白的四級結構發生了明顯變化,血紅蛋白亞基解聚增加,亞基自身的三級構象也發生明顯崩解[16],具體表現為Soret帶發生藍移的同時峰強發生下降,氧合血紅蛋白的β和α帶在0~4 h時峰強相近,在12 h時峰強顯著下降,峰形由陡變緩,兩峰相對強度也發生改變,這種變化的差異可能是由于血紅蛋白亞基一級結構的不同所致。
 圖3
PBS體系中不同時間血紅蛋白Soret帶和α、β帶吸收光譜圖
圖3
PBS體系中不同時間血紅蛋白Soret帶和α、β帶吸收光譜圖
1: 0 h; 2: 4 h; 3: 12 h; 4: 24 h; 5: 36 h; 6: 48 h; 7: 60 h; 8: 72 h
Figure3. Absorption spectra of hemoglobin Soret andα, βband in PBS system at different times1: 0 h; 2: 4 h; 3: 12 h; 4: 24 h; 5: 36 h; 6: 48 h; 7: 60 h; 8: 72 h
綜上所述,體外PBS體系檢測血紅蛋白,在4 h之內可選擇415、541或577 nm,其中選擇415 nm檢測更加靈敏且能反映血紅蛋白四級結構的整體信息;在4~72 h則不能選擇415 nm,而應選擇406 nm附近波長,此時選擇541或577 nm檢測會更加穩定,而且若選擇541 nm應在72 h之前進行檢測。
2.3 生理鹽水體系中隨時間延長血紅蛋白Soret帶藍移,α、β帶峰強顯著降低
生理鹽水體系的血紅蛋白吸收光譜如圖 4所示,與PSB情況類似,在0~4 h譜線存在三個吸收峰,分別在414、541和577 nm。在4 h時Soret帶即由414 nm藍移至413 nm,較PBS組提早,在12 h時Soret帶發生明顯藍移,并且隨著時間的延長峰強度呈下降趨勢,72 h時Soret帶移至405 nm。由圖 4可知,在24 h時α帶和β帶的峰形即消失,這是由于在生理鹽水體系中同樣存在著血紅蛋白四級構象、亞基三級結構以及血紅素口袋疏水微環境的變化,并且這種變化比PBS組更加顯著,說明生理鹽水的單純鹽溶液體系對血紅蛋白結構的保護作用不及磷酸鹽緩沖體系。
 圖4
生理鹽水體系中不同時間血紅蛋白Soret帶和α、β帶吸收光譜圖
圖4
生理鹽水體系中不同時間血紅蛋白Soret帶和α、β帶吸收光譜圖
1: 0 h; 2: 4 h; 3: 12 h; 4: 24 h; 5: 36 h; 6: 48 h; 7: 60 h; 8: 72 h
Figure4. Absorption spectra of hemoglobin Soret andα, βband in physiological saline system at different times1: 0 h; 2: 4 h; 3: 12 h; 4: 24 h; 5: 36 h; 6: 48 h; 7: 60 h; 8: 72 h
綜上所述,建議體外溶血實驗運用PBS體系,若在生理鹽水體系檢測血紅蛋白,在4 h內可選擇414、541或577 nm;在4~72 h選擇405 nm附近波長;12 h之內還可選擇541或577 nm。
2.4 庫血保存液體系中血紅蛋白3個特征峰隨時間延長不發生位移但峰強下降
庫血保存液體系的血紅蛋白吸收光譜如圖 5所示,在0~72 h范圍內,譜線在415、540和576 nm處的三個吸收峰均十分明顯,其強度隨時間延長逐漸降低,與PBS和生理鹽水組不同的是,隨著時間的延長血紅蛋白Soret帶不發生藍移,α帶和β帶的峰不發生由陡變緩的變化且兩峰的相對強度也很穩定。這說明庫血保存液對血紅蛋白的構象具有顯著的保護作用,但由于在離體的環境中,仍然存在著血紅蛋白四聚體的解聚和三級結構的消失而導致峰強度下降。因此,在對庫血上清進行血紅蛋白檢測時,72 h內可選擇415 nm、540 nm或576 nm。
 圖5
庫血保存液體系中不同時間血紅蛋白吸收光譜圖
Figure5.
Absorption spectra of hemoglobin in banked blood preservation solution system at different times
圖5
庫血保存液體系中不同時間血紅蛋白吸收光譜圖
Figure5.
Absorption spectra of hemoglobin in banked blood preservation solution system at different times
3 討論
氧合血紅蛋白在415、541和577 nm附近有特征吸收峰,吸收峰的位置和強度由血紅蛋白構象及其卟啉鐵自旋狀態決定,而其所處介質體系的離子強度、pH值和溫度又會對這些因素產生影響啉鐵自旋狀態決定,而其所處介質體系的離子強度、pH值和溫度又會對這些因素產生影響[17]。正常人血紅蛋白為四聚體結構,在一定體外介質條件下,血紅蛋白四聚體能被解聚成二聚體[18],乃至單體。一部分亞基之間發生斷裂,同時由于pH值可能偏離生理條件范圍,導致維系血紅蛋白亞基三級結構的部分化學鍵斷裂,造成α和β帶吸收峰的強度下降。pH值的變化也會使Soret帶發生偏移[19]。在PBS體系下,磷酸鹽的緩沖體系對血紅蛋白的結構產生一定的保護作用,其效果優于生理鹽水的單純鹽溶液體系,而庫血保存液中不僅含有枸櫞酸與枸櫞酸鈉形成緩沖對來調節和穩定pH值,而且葡萄糖、腺嘌呤、磷酸二氫鈉、甘露醇等的加入更有利于血紅蛋白維持其原有的四級構象和三級結構。在細胞培養液體系下,胎牛血清中牛血紅蛋白含量不高于0.02%,且經過培養液的稀釋,其在415 nm處的峰強度非常弱,因此在溶血試驗時對待測血紅蛋白的干擾很小,可將完全培養液作為對照組進行檢測。然而由于指示劑酚紅在559 nm處存在較強的吸收峰,對血紅蛋白α、β帶的吸收峰檢測造成干擾,此時溶血試驗應選Soret帶的吸收峰,若要檢測α和β帶吸收峰需用不含酚紅的培養基。在4種體系中Soret帶和α、β帶峰強度均表現出隨時間延長而降低的趨勢,這可能是由于體外條件下部分血紅蛋白的四級結構解聚和亞基三級結構的消失所致。在Soret帶和α、β帶均可選的情況下,選擇Soret帶可反映血紅蛋白整體四級結構的信息,其變化較α、β帶更為顯著,可提示蛋白質是否變性,而α、β帶則更多地反映血紅蛋白三級結構和血紅素口袋的信息。另外,由于實驗所用的儀器設備和檢測條件差異,血紅蛋白的吸收峰波長也會略有不同,因此在溶血實驗之前建議進行預實驗對血紅蛋白溶液進行全波長掃描,以確定所用條件下血紅蛋白的吸收峰。