卵母細胞在低溫保護劑的加載和去除過程中,會受到滲透損傷和毒性損傷,采用微流控技術可實現保護劑濃度連續變化,減小細胞損傷。本文設計了用于低溫保護劑加載及去除的5種不同參數的Y型微流控芯片,測定了在不同入口流速、芯片入口角度、通道深寬比及轉彎半徑下,微通道內保護劑溶液和緩沖溶液的混合程度。實驗結果表明:隨著溶液入口流速的減小、通道深寬比的增大及轉彎半徑的減小,溶液在微通道內混合長度減小,混合速度加快,而微通道入口角度對流體混合影響很小。但實際芯片的操作條件及結構參數應根據低溫保護劑加載和去除時需要達到的效果以及芯片加工工藝等因素確定。本文研究結果可為其他用于低溫保護劑混合的微流控芯片的設計提供參考。
引用本文: 周新麗, 衣星越, 周楠峰, 楊云. 用于低溫保護劑混合的微流控芯片設計及優化. 生物醫學工程學雜志, 2016, 33(3): 461-465. doi: 10.7507/1001-5515.20160078 復制
版權信息: ?四川大學華西醫院華西期刊社《生物醫學工程學雜志》版權所有,未經授權不得轉載、改編
引言
卵母細胞的低溫保存研究作為低溫生物學領域的一個重要發展方向,近年來已取得長足進步[1-4]。為了減少低溫保護劑在加載和去除過程中由于滲透作用和化學毒性對卵母細胞造成的損傷,目前低溫保護劑的添加及去除主要以分步法為主。但該方法操作程序繁瑣且容易造成細胞的丟失,對操作人員的熟練程度要求很高[5]。針對上述情況,為減小對細胞的損傷,同時簡化卵母細胞低溫保護劑添加和去除的操作程序,有研究者將微流控芯片技術引入了低溫保存領域[6-8]。
在微流控芯片中,保護劑溶液和緩沖溶液在微流體通道內以層流方式流動,兩流體通過擴散方式混合,能夠實現沿著通道方向保護劑濃度的連續改變。目前國內外研究中,針對臍帶血、紅細胞等小體積細胞的低溫保存,Mata等[9-10]提出了水平兩流的微流控芯片裝置以研究細胞懸浮液中低溫保護劑的去除方式;Hanna等[11]提出了垂直三流的微流控芯片裝置以提高細胞懸浮液中保護劑的去除效率;Song等[12]提出了三入口式微流控芯片裝置以研究低溫保護劑的添加過程。針對卵母細胞等大體積細胞的低溫保存,Heo等[13]提出了尺寸為900 μm×600 μm×200 μm(長×寬×高)的微流控芯片裝置,以研究卵母細胞保護劑在添加過程中細胞體積的變化。然而,以上這些研究并沒有考量或優化其微流控裝置的混合性能,在保護劑與緩沖溶液混合的過程中,芯片的微通道長度、入口形狀、通道結構、入口流速等參數會對混合造成不同的影響。比如有些通道過長,增加了加載和去除的時間[9],使細胞過長時間暴露于保護劑中,增加了保護劑滲透作用和化學毒性對細胞的損傷;有些入口形狀不同[14-16],如三入口式、兩入口式以及T型入口,會引起微通道內流體對流強度的不同;有些通道結構不同[16],如方波形彎曲通道與蛇形通道,會帶來不同的對流情況、流動距離以及接觸面積,從而導致不同的混合效率。
為了能夠深入了解微通道內保護劑溶液和緩沖溶液的混合過程以及到達卵母細胞操作腔時溶液濃度的變化規律,本文設計了一種可用于卵母細胞低溫保護劑添加及去除的微流控芯片,測定了不同流速、入口角度、深寬比和轉彎半徑下,微通道內流體的混合程度,為今后深入優化微流控芯片微通道的結構參數和操作條件提供依據。
1 材料與方法
1.1 Y型微流控芯片的設計與加工
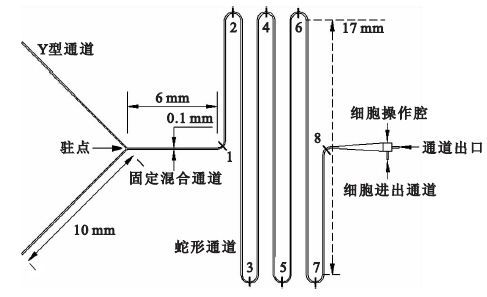
用于卵母細胞低溫保護劑添加及去除的微流控芯片由Y型入口、蛇形混合通道以及細胞操作腔組成,如圖 1所示,Y型通道入口每條長為10 mm,蛇型通道每條長17 mm,整個管道總長約為135 mm,序號1~8標注的分別為通道的8個轉彎處。
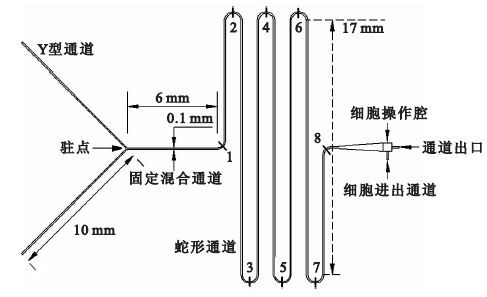 圖1
微流控芯片結構圖
Figure1.
Structure of microfluidic chip
圖1
微流控芯片結構圖
Figure1.
Structure of microfluidic chip
本課題組已經在文獻[17]中采用多物理場耦合數值模擬軟件COMSOL MULTIPHYSIS,模擬了保護劑溶液和緩沖溶液在不同參數芯片微通道中的混合過程。本文從模擬結果中選取具有代表性的參數并考慮芯片加工工藝,設計了5種不同的芯片,具體結構參數如表 1所示。
本文采用軟光刻技術加工微流控芯片,材料為聚二甲基硅氧烷(polydimethylsiloxane,PDMS)和玻璃。首先采用AutoCAD 2007(Autodesk,USA)軟件設計微通道,再通過掩膜制作、勻膠、光刻、PDMS薄層制作、芯片鍵合等步驟,制成微流控芯片。
1.2 微流控混合實驗系統
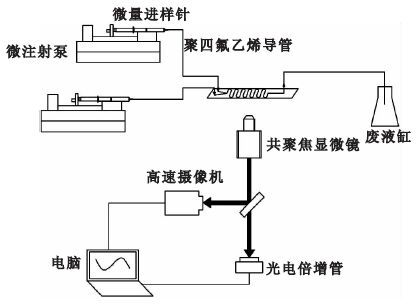
微流控芯片混合實驗平臺如圖 2所示。使用兩個微注射泵Pump 11 Pico Plus Elite(Harvard,USA)和1 mL平頭液相微量進樣針(上海高鴿工貿有限公司,中國),分別將低溫保護劑溶液和緩沖溶液注入PDMS-玻璃微流控芯片。微流控芯片放置于激光共聚焦系統(Nikon A1R,日本)下,顯微鏡和
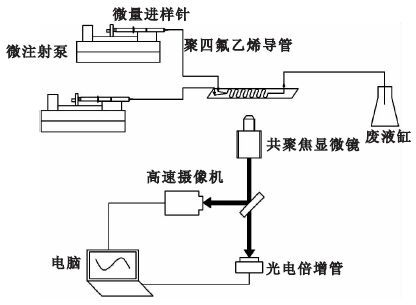 圖2
微流控混合實驗系統
Figure2.
Microfluidic mixing experimental system
圖2
微流控混合實驗系統
Figure2.
Microfluidic mixing experimental system
高速相機(charge coupled device,CCD)與電子計算機相連,使用Nikon NIS-Elements AR軟件觀察并拍攝流體在微流控芯片中的混合情況。成像系統中,明場成像使用的光源為鹵素燈(100 W,Nikon Model:TI-PS,日本),共聚焦成像的激發光是488 nm多線Ar離子激光器,發射光收集設為510~550 nm,使用10×(數值孔徑0.45) 的物鏡。
1.3 低溫保護劑在微流體芯片上的混合實驗
為了觀察兩流體在微通道內的混合情況,本文在4.2 mol/L Me2SO溶液中加入1 mmol/L的熒光染料異硫氰酸熒光素(fluorescein isothiocyanate,FITC)(Sigma,USA),將配制好的Me2SO溶液和緩沖溶液分別載入1 mL的微量進樣針中,打開微注射泵,設置注射模式為恒流速注射,使Me2SO溶液和緩沖溶液以相同流速注入結構參數不同的微流控芯片內。
實驗一:使用芯片1,低溫保護劑和緩沖溶液分別以1×10-4、1×10-3、2×10-3、1×10-2 m/s注入芯片,從兩種液體初始接觸點(駐點)處開始,每隔10 mm設置一個檢測點,計算該處橫截面的混合指數,定量分析不同流速條件下微通道的混合效果。
實驗二:使用芯片1~3,每種低溫保護劑和緩沖溶液分別以三種流速1×10-4、1×10-3、1×10-2 m/s注入芯片,取駐點后5 mm處通道截面為檢測面,計算該處橫截面的混合指數,定量分析不同入口角度條件下微通道的混合效果。
實驗三:使用芯片1、4,低溫保護劑和緩沖溶液以1×10-2 m/s注入芯片,取駐點后5 mm處通道截面為檢測面,計算該處橫截面的混合指數,定量分析不同深寬比條件下微通道的混合效果。
實驗四:使用芯片1、5,低溫保護劑和緩沖溶液以1×10-2 m/s注入芯片,取微通道8個轉彎處的通道截面為檢測面,如圖 1所示,計算各處橫截面的混合指數,定量分析不同轉彎半徑條件下微通道的混合效果。
1.4 混合程度評價方法
當微通道內流體流動穩定時,選擇需要的拍攝模式對芯片進行拍攝,對拍攝得到的熒光圖像使用尼康A1R共聚焦顯微鏡自帶的NIS-Elements AR Analysis軟件進行去背景操作,去除背景熒光后,進行熒光強度分析。
結合Liu等[18]和Lee等[19]的研究,本文以熒光強度值代替灰度值,引入混合指數DM,如式(1) 所示,作為判定微流控芯片混合程度的評價參數。
| ${{D}_{M}}=1-\frac{1}{I}\sqrt{\frac{\underset{i=1}{\overset{n}{\mathop{\sum }}}\,{{({{I}_{i}}-I)}^{2}}}{N}}$ |
其中,Ii為第i個點的熒光強度值,為所研究區域熒光強度均值。當DM=1時,表示流體完全混合;DM=0時,表示流體完全沒有混合。
2 結果與討論
2.1 入口流速對混合的影響
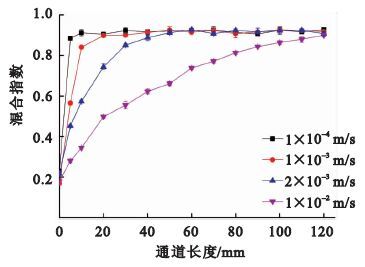
按照實驗一的方法進行實驗,不同流速下混合實驗的結果如圖 3所示。當保護劑和緩沖溶液的流速較小,為1×10-4 m/s時,駐點處的流體擴散現象明顯,混合指數升高得很快,流體完全混合所需的通道長度僅為10 mm。這是因為在微尺度條件下,橫向擴散距離與微通道中的擴散時間成正比,低流速狀態使得流體之間有充分的時間實現分子擴散。但是,由于低流速混合在很短的距離內實現了濃度的快速增加,即形成的濃度梯度較大,不利于實現細胞周圍保護劑濃度的緩慢增加;而且,過慢的流速使混合溶液通過整個芯片通道到達細胞操作腔的時間過長,延長了保護劑加載和去除的時間。
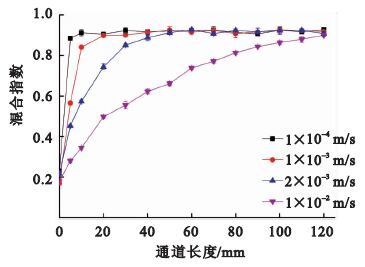 圖3
不同流速下混合指數沿通道方向上的變化
Figure3.
Variation of mixing index along the channel of chip at different flow rates
圖3
不同流速下混合指數沿通道方向上的變化
Figure3.
Variation of mixing index along the channel of chip at different flow rates
隨著保護劑和緩沖溶液流速的增大,駐點處的流體擴散現象減弱,混合指數升高的速率逐漸降低,混合長度增加。流速為1×10-2 m/s時,流體完全混合所需的通道長度為120 mm。此時,混合溶液沿混合通道方向形成了適宜的濃度梯度,能夠實現細胞周圍保護劑濃度適宜的連續性增加。而且,混合溶液通過芯片總通道到達細胞操作腔的時間減少。因此,入口流速可根據芯片總通道長度、能形成的濃度梯度以及混合液到達細胞操作腔的時間進行選擇
2.2 入口角度對混合的影響
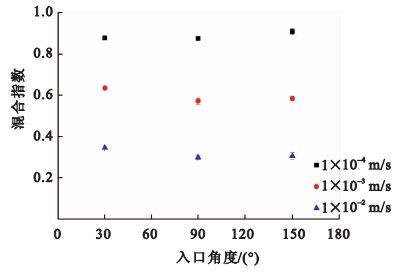
按照實驗二的方法進行實驗,不同入口角度混合實驗的結果如圖 4所示。在30°、90°、150°三種不同入口角度下,距駐點5 mm處的檢測面的混合指數相差不大。三種流速條件下,混合指數的最大值與最小值之差均小于0.063。此結果說明與流速對混合效果的影響相比,入口角度對混合效果的影響可以忽略。
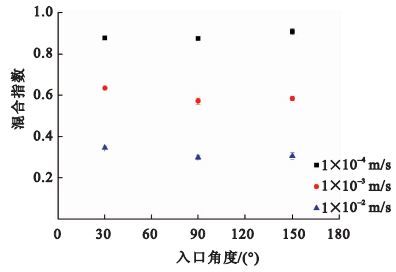 圖4
不同入口角度與混合指數的關系
Figure4.
Variation of mixing index at different entrance angles
圖4
不同入口角度與混合指數的關系
Figure4.
Variation of mixing index at different entrance angles
2.3 深寬比對混合的影響
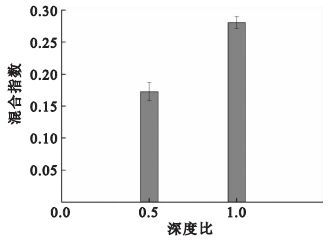
按照實驗三的方法進行實驗,不同深寬比混合實驗的結果如圖 5所示。在通道深度均為100 μm的情況下,通道寬度為200 μm,即深寬比為0.5時,混合指數為0.172 7; 當混合通道的通道寬度為100 μm,即深寬比為1時,混合指數為0.280 6。 根據Einstein公式δ2=2Dt,δ為保護劑橫向擴散長度,D為保護劑的擴散系數,t為擴散時間[19]。擴散時間與擴散長度的平方成正比,因此在深度一定的情況下,通道寬度越窄,即擴散長度越短,深寬比越大,流體擴散所需的時間越少,兩流體混合效果越好。但當混合通道的寬度較小,如50 μm時,通道內流體的阻力增大,系統壓降值將有所升高[17],容易造成微流體芯片的損壞,故在設計微通道深寬比時,深度與寬度的具體數值可根據所研究生物材料的體積以及系統壓降值進行選擇。
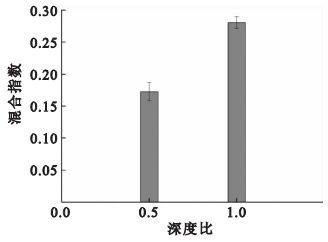 圖5
深寬比與混合指數的關系
Figure5.
Variation of mixing index at different aspect ratios
圖5
深寬比與混合指數的關系
Figure5.
Variation of mixing index at different aspect ratios
2.4 轉彎半徑對混合的影響
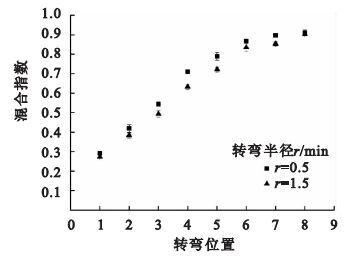
按照實驗四的方法進行實驗,不同轉彎半徑下混合實驗的結果如圖 6所示。在同一轉彎位置處,隨著轉彎半徑的減小,混合指數逐漸變大,表明減小轉彎半徑可以促進微管道內流體混合。這是因為流體在彎曲管道內流動時,會在離心力的作用下產生二次流,二次流會影響微管道內流體的擴散,而且隨著轉彎位置的增加,混合指數散點圖的斜率呈逐漸減小趨勢,這一現象可能是由于隨著轉彎數的增加,混合指數逐漸增加,兩流體的濃度梯度減小造成的。因此,適當減小芯片蛇形通道的轉彎半徑可以提高芯片的混合性能。
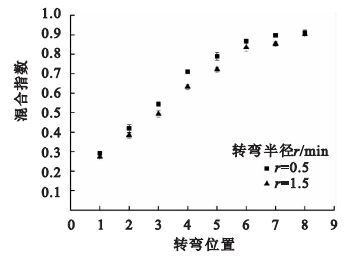 圖6
不同轉彎半徑下溶液混合指數變化關系
Figure6.
Variation of mixing index at different turning radius
圖6
不同轉彎半徑下溶液混合指數變化關系
Figure6.
Variation of mixing index at different turning radius
3 結論
本文設計并加工了可用于卵母細胞低溫保存保護劑添加及去除的Y型PDMS-玻璃微流控芯片,并使用微流控實驗平臺進行了流體混合實驗,研究了流體流速、微通道入口角度、深寬比、轉彎半徑等參數對流體在芯片微通道內混合過程的影響,實驗結果得出以下結論:①隨著入口流速的減小,溶液在微通道內混合長度減小,混合速度加快,但入口流速還要根據芯片總通道長度、能形成的濃度梯度以及混合液到達細胞操作腔的時間進行設置;②微通道入口角度對流體混合影響很小,可選擇加工精度相對較高的角度;③在深度一定的情況下,通道寬度越窄,即深寬比越大,兩流體混合效果越好,但當寬度較小時,對加工精度及注射泵在入口處需提供的壓力要求很高,故深寬比可根據生物細胞的體積、加工技術難度及精度要求進行選擇;④轉彎半徑對保護劑混合影響較小,但適當減小轉彎半徑可以促進微管道內流體混合。以上結論為優化微流控芯片微通道的結構參數和操作條件提供了依據,也為其他用于低溫保護劑混合的微流控芯片的設計提供了參考。
引言
卵母細胞的低溫保存研究作為低溫生物學領域的一個重要發展方向,近年來已取得長足進步[1-4]。為了減少低溫保護劑在加載和去除過程中由于滲透作用和化學毒性對卵母細胞造成的損傷,目前低溫保護劑的添加及去除主要以分步法為主。但該方法操作程序繁瑣且容易造成細胞的丟失,對操作人員的熟練程度要求很高[5]。針對上述情況,為減小對細胞的損傷,同時簡化卵母細胞低溫保護劑添加和去除的操作程序,有研究者將微流控芯片技術引入了低溫保存領域[6-8]。
在微流控芯片中,保護劑溶液和緩沖溶液在微流體通道內以層流方式流動,兩流體通過擴散方式混合,能夠實現沿著通道方向保護劑濃度的連續改變。目前國內外研究中,針對臍帶血、紅細胞等小體積細胞的低溫保存,Mata等[9-10]提出了水平兩流的微流控芯片裝置以研究細胞懸浮液中低溫保護劑的去除方式;Hanna等[11]提出了垂直三流的微流控芯片裝置以提高細胞懸浮液中保護劑的去除效率;Song等[12]提出了三入口式微流控芯片裝置以研究低溫保護劑的添加過程。針對卵母細胞等大體積細胞的低溫保存,Heo等[13]提出了尺寸為900 μm×600 μm×200 μm(長×寬×高)的微流控芯片裝置,以研究卵母細胞保護劑在添加過程中細胞體積的變化。然而,以上這些研究并沒有考量或優化其微流控裝置的混合性能,在保護劑與緩沖溶液混合的過程中,芯片的微通道長度、入口形狀、通道結構、入口流速等參數會對混合造成不同的影響。比如有些通道過長,增加了加載和去除的時間[9],使細胞過長時間暴露于保護劑中,增加了保護劑滲透作用和化學毒性對細胞的損傷;有些入口形狀不同[14-16],如三入口式、兩入口式以及T型入口,會引起微通道內流體對流強度的不同;有些通道結構不同[16],如方波形彎曲通道與蛇形通道,會帶來不同的對流情況、流動距離以及接觸面積,從而導致不同的混合效率。
為了能夠深入了解微通道內保護劑溶液和緩沖溶液的混合過程以及到達卵母細胞操作腔時溶液濃度的變化規律,本文設計了一種可用于卵母細胞低溫保護劑添加及去除的微流控芯片,測定了不同流速、入口角度、深寬比和轉彎半徑下,微通道內流體的混合程度,為今后深入優化微流控芯片微通道的結構參數和操作條件提供依據。
1 材料與方法
1.1 Y型微流控芯片的設計與加工
用于卵母細胞低溫保護劑添加及去除的微流控芯片由Y型入口、蛇形混合通道以及細胞操作腔組成,如圖 1所示,Y型通道入口每條長為10 mm,蛇型通道每條長17 mm,整個管道總長約為135 mm,序號1~8標注的分別為通道的8個轉彎處。
 圖1
微流控芯片結構圖
Figure1.
Structure of microfluidic chip
圖1
微流控芯片結構圖
Figure1.
Structure of microfluidic chip
本課題組已經在文獻[17]中采用多物理場耦合數值模擬軟件COMSOL MULTIPHYSIS,模擬了保護劑溶液和緩沖溶液在不同參數芯片微通道中的混合過程。本文從模擬結果中選取具有代表性的參數并考慮芯片加工工藝,設計了5種不同的芯片,具體結構參數如表 1所示。
本文采用軟光刻技術加工微流控芯片,材料為聚二甲基硅氧烷(polydimethylsiloxane,PDMS)和玻璃。首先采用AutoCAD 2007(Autodesk,USA)軟件設計微通道,再通過掩膜制作、勻膠、光刻、PDMS薄層制作、芯片鍵合等步驟,制成微流控芯片。
1.2 微流控混合實驗系統
微流控芯片混合實驗平臺如圖 2所示。使用兩個微注射泵Pump 11 Pico Plus Elite(Harvard,USA)和1 mL平頭液相微量進樣針(上海高鴿工貿有限公司,中國),分別將低溫保護劑溶液和緩沖溶液注入PDMS-玻璃微流控芯片。微流控芯片放置于激光共聚焦系統(Nikon A1R,日本)下,顯微鏡和
 圖2
微流控混合實驗系統
Figure2.
Microfluidic mixing experimental system
圖2
微流控混合實驗系統
Figure2.
Microfluidic mixing experimental system
高速相機(charge coupled device,CCD)與電子計算機相連,使用Nikon NIS-Elements AR軟件觀察并拍攝流體在微流控芯片中的混合情況。成像系統中,明場成像使用的光源為鹵素燈(100 W,Nikon Model:TI-PS,日本),共聚焦成像的激發光是488 nm多線Ar離子激光器,發射光收集設為510~550 nm,使用10×(數值孔徑0.45) 的物鏡。
1.3 低溫保護劑在微流體芯片上的混合實驗
為了觀察兩流體在微通道內的混合情況,本文在4.2 mol/L Me2SO溶液中加入1 mmol/L的熒光染料異硫氰酸熒光素(fluorescein isothiocyanate,FITC)(Sigma,USA),將配制好的Me2SO溶液和緩沖溶液分別載入1 mL的微量進樣針中,打開微注射泵,設置注射模式為恒流速注射,使Me2SO溶液和緩沖溶液以相同流速注入結構參數不同的微流控芯片內。
實驗一:使用芯片1,低溫保護劑和緩沖溶液分別以1×10-4、1×10-3、2×10-3、1×10-2 m/s注入芯片,從兩種液體初始接觸點(駐點)處開始,每隔10 mm設置一個檢測點,計算該處橫截面的混合指數,定量分析不同流速條件下微通道的混合效果。
實驗二:使用芯片1~3,每種低溫保護劑和緩沖溶液分別以三種流速1×10-4、1×10-3、1×10-2 m/s注入芯片,取駐點后5 mm處通道截面為檢測面,計算該處橫截面的混合指數,定量分析不同入口角度條件下微通道的混合效果。
實驗三:使用芯片1、4,低溫保護劑和緩沖溶液以1×10-2 m/s注入芯片,取駐點后5 mm處通道截面為檢測面,計算該處橫截面的混合指數,定量分析不同深寬比條件下微通道的混合效果。
實驗四:使用芯片1、5,低溫保護劑和緩沖溶液以1×10-2 m/s注入芯片,取微通道8個轉彎處的通道截面為檢測面,如圖 1所示,計算各處橫截面的混合指數,定量分析不同轉彎半徑條件下微通道的混合效果。
1.4 混合程度評價方法
當微通道內流體流動穩定時,選擇需要的拍攝模式對芯片進行拍攝,對拍攝得到的熒光圖像使用尼康A1R共聚焦顯微鏡自帶的NIS-Elements AR Analysis軟件進行去背景操作,去除背景熒光后,進行熒光強度分析。
結合Liu等[18]和Lee等[19]的研究,本文以熒光強度值代替灰度值,引入混合指數DM,如式(1) 所示,作為判定微流控芯片混合程度的評價參數。
| ${{D}_{M}}=1-\frac{1}{I}\sqrt{\frac{\underset{i=1}{\overset{n}{\mathop{\sum }}}\,{{({{I}_{i}}-I)}^{2}}}{N}}$ |
其中,Ii為第i個點的熒光強度值,為所研究區域熒光強度均值。當DM=1時,表示流體完全混合;DM=0時,表示流體完全沒有混合。
2 結果與討論
2.1 入口流速對混合的影響
按照實驗一的方法進行實驗,不同流速下混合實驗的結果如圖 3所示。當保護劑和緩沖溶液的流速較小,為1×10-4 m/s時,駐點處的流體擴散現象明顯,混合指數升高得很快,流體完全混合所需的通道長度僅為10 mm。這是因為在微尺度條件下,橫向擴散距離與微通道中的擴散時間成正比,低流速狀態使得流體之間有充分的時間實現分子擴散。但是,由于低流速混合在很短的距離內實現了濃度的快速增加,即形成的濃度梯度較大,不利于實現細胞周圍保護劑濃度的緩慢增加;而且,過慢的流速使混合溶液通過整個芯片通道到達細胞操作腔的時間過長,延長了保護劑加載和去除的時間。
 圖3
不同流速下混合指數沿通道方向上的變化
Figure3.
Variation of mixing index along the channel of chip at different flow rates
圖3
不同流速下混合指數沿通道方向上的變化
Figure3.
Variation of mixing index along the channel of chip at different flow rates
隨著保護劑和緩沖溶液流速的增大,駐點處的流體擴散現象減弱,混合指數升高的速率逐漸降低,混合長度增加。流速為1×10-2 m/s時,流體完全混合所需的通道長度為120 mm。此時,混合溶液沿混合通道方向形成了適宜的濃度梯度,能夠實現細胞周圍保護劑濃度適宜的連續性增加。而且,混合溶液通過芯片總通道到達細胞操作腔的時間減少。因此,入口流速可根據芯片總通道長度、能形成的濃度梯度以及混合液到達細胞操作腔的時間進行選擇
2.2 入口角度對混合的影響
按照實驗二的方法進行實驗,不同入口角度混合實驗的結果如圖 4所示。在30°、90°、150°三種不同入口角度下,距駐點5 mm處的檢測面的混合指數相差不大。三種流速條件下,混合指數的最大值與最小值之差均小于0.063。此結果說明與流速對混合效果的影響相比,入口角度對混合效果的影響可以忽略。
 圖4
不同入口角度與混合指數的關系
Figure4.
Variation of mixing index at different entrance angles
圖4
不同入口角度與混合指數的關系
Figure4.
Variation of mixing index at different entrance angles
2.3 深寬比對混合的影響
按照實驗三的方法進行實驗,不同深寬比混合實驗的結果如圖 5所示。在通道深度均為100 μm的情況下,通道寬度為200 μm,即深寬比為0.5時,混合指數為0.172 7; 當混合通道的通道寬度為100 μm,即深寬比為1時,混合指數為0.280 6。 根據Einstein公式δ2=2Dt,δ為保護劑橫向擴散長度,D為保護劑的擴散系數,t為擴散時間[19]。擴散時間與擴散長度的平方成正比,因此在深度一定的情況下,通道寬度越窄,即擴散長度越短,深寬比越大,流體擴散所需的時間越少,兩流體混合效果越好。但當混合通道的寬度較小,如50 μm時,通道內流體的阻力增大,系統壓降值將有所升高[17],容易造成微流體芯片的損壞,故在設計微通道深寬比時,深度與寬度的具體數值可根據所研究生物材料的體積以及系統壓降值進行選擇。
 圖5
深寬比與混合指數的關系
Figure5.
Variation of mixing index at different aspect ratios
圖5
深寬比與混合指數的關系
Figure5.
Variation of mixing index at different aspect ratios
2.4 轉彎半徑對混合的影響
按照實驗四的方法進行實驗,不同轉彎半徑下混合實驗的結果如圖 6所示。在同一轉彎位置處,隨著轉彎半徑的減小,混合指數逐漸變大,表明減小轉彎半徑可以促進微管道內流體混合。這是因為流體在彎曲管道內流動時,會在離心力的作用下產生二次流,二次流會影響微管道內流體的擴散,而且隨著轉彎位置的增加,混合指數散點圖的斜率呈逐漸減小趨勢,這一現象可能是由于隨著轉彎數的增加,混合指數逐漸增加,兩流體的濃度梯度減小造成的。因此,適當減小芯片蛇形通道的轉彎半徑可以提高芯片的混合性能。
 圖6
不同轉彎半徑下溶液混合指數變化關系
Figure6.
Variation of mixing index at different turning radius
圖6
不同轉彎半徑下溶液混合指數變化關系
Figure6.
Variation of mixing index at different turning radius
3 結論
本文設計并加工了可用于卵母細胞低溫保存保護劑添加及去除的Y型PDMS-玻璃微流控芯片,并使用微流控實驗平臺進行了流體混合實驗,研究了流體流速、微通道入口角度、深寬比、轉彎半徑等參數對流體在芯片微通道內混合過程的影響,實驗結果得出以下結論:①隨著入口流速的減小,溶液在微通道內混合長度減小,混合速度加快,但入口流速還要根據芯片總通道長度、能形成的濃度梯度以及混合液到達細胞操作腔的時間進行設置;②微通道入口角度對流體混合影響很小,可選擇加工精度相對較高的角度;③在深度一定的情況下,通道寬度越窄,即深寬比越大,兩流體混合效果越好,但當寬度較小時,對加工精度及注射泵在入口處需提供的壓力要求很高,故深寬比可根據生物細胞的體積、加工技術難度及精度要求進行選擇;④轉彎半徑對保護劑混合影響較小,但適當減小轉彎半徑可以促進微管道內流體混合。以上結論為優化微流控芯片微通道的結構參數和操作條件提供了依據,也為其他用于低溫保護劑混合的微流控芯片的設計提供了參考。