為了提升對結核分枝桿菌(MTB)檢測的實用性,本文開展了采用環介導等溫擴增方法(LAMP)對 MTB 進行可視化檢測的研究。首先,根據 MTB 16S rDNA 序列設計 LAMP 引物。然后,收集臨床痰液樣本并進行相應處理。為了評價 LAMP 的特異度和靈敏度,本文用電泳產物進行檢測并用鈣黃綠素進行可視化驗證。最后,以細菌培養結果為金標準,用 SPSS 17.0 軟件比較培養結果與 LAMP 的一致性。結果顯示,特異度實驗中無非特異擴增現象,靈敏度實驗中的檢測極限為 10 拷貝。另外,可視化產物檢測方法和電泳后的靈敏性相一致。進一步進行臨床實用性評價,靈敏性為 94.47%,特異性為 90%,與細菌培養無統計學差異,結果一致性較好(P>0.05)。綜上,LAMP 技術高效而可視,具有在設備匱乏的現場和基層醫療機構的應用前景。
引用本文: 趙娜, 孫殿興, 劉金霞. 環介導等溫擴增技術可視化檢測結核分枝桿菌. 生物醫學工程學雜志, 2017, 34(1): 72-77. doi: 10.7507/1001-5515.201606066 復制
版權信息: ?四川大學華西醫院華西期刊社《生物醫學工程學雜志》版權所有,未經授權不得轉載、改編
引言
分枝桿菌屬是一組抗酸性、呼吸道傳播的桿菌,其中引起肺結核的主要為結核分枝桿菌(mycobacterium tuberculosis,MTB)。據世界衛生組織(world health organization,WHO)報道,2014年新發結核病達 900 萬,而結核病又是位列人類獲得性免疫缺陷綜合癥(acquired immune deficiency syndrome,AIDS)之后的第二大致死性傳染病[1-2]。中國是全球 22 個結核病高負擔國家之一,每年新發病例占全球總數的 16%,每年新增的活動性肺結核患者達 130 萬例,其中涂陽肺結核達 58 萬例,因此越來越多的研究人員開始關注對 MTB 感染的快速診斷[3-6]。然而,針對 MTB 的快速實用檢測在結核病流行的發展中國家仍有一定難度[7-8]。比如,作為“金標準”的培養法需要 4~8 周才能得出結果[9],而近年來發展起來的快速培養系統如BactecTM結核分枝桿菌生長指示管(mycobacteria growth indicator tubes,MGIT),雖然縮短了培養時間(3~7 d),但是會帶來快速增菌造成的氣溶膠污染[10-14]。另一方面,目前應用廣泛的抗酸染色技術是一種在實驗設備匱乏的在中小型基層醫療機構都較為常用的檢測手段,甚至很多專業醫療機構也普遍應用。然而,這種傳統方法的敏感性和特異性較低,常有漏診發生,結果是涂陰者也可能會傳播 MTB,而對涂陰者冒然用藥必然會增加耐藥率甚至導致藥物中毒[15-17]。如今,使用以分子生物學為基礎的技術,不僅可以提高檢出率,而且可以避免因藥物中毒導致的不必要處理措施和費用。但是分子生物學技術,如聚合酶鏈反應(polymerase chain reaction,PCR)和實時 PCR 等,需具備昂貴的設備和技術熟練的操作人員[18-20],因此限制了這類既特異又靈敏的技術在現場和基層醫療機構的應用。
環介導等溫擴增技術(loop-mediated isothermal amplification,LAMP)不僅特異性和靈敏度高,而且操作簡單,操作者使用恒溫裝置在 60~65℃條件下經 30~60 min 即可完成擴增,使用鈣黃綠素染料對產物顯色即可定性指示結果[21-22]。另外,反應中不受溫度浮動和反應體系中血紅素、免疫球蛋白、抗凝劑等的干擾,因此更加適用于條件較差的操作環境[23-25]。
MTB 中 16S 核糖體核糖核酸(16S ribosomal ribonucleic acid,16S rRNA)是由 16S 核糖體脫氧核糖核酸(16S ribosomal desoxyribonucleic acid,16S rDNA)編碼的長約 1 500 bp 的 30S 小亞基元件,具有一定的保守性[26]。雖然 16S rRNA 占總 RNA 的 80%,拷貝數是 DNA 的 1 000~10 000 倍[13],但是 16S rRNA 半衰期短,僅存在于有代謝活性的活菌中,然而,根據 LAMP 的溫度條件(60~65℃),MTB 的 16S rRNA 在 20 min 內即被降解,而 16S rDNA 不受溫度干擾。因此本研究應用 LAMP 技術為手段,開展了針對 MTB 16S rDNA 的可視化檢測 MTB 技術的初步探索,為推進該技術在現場或基層醫療機構的應用奠定了理論基礎。
1 材料和方法
1.1 模板來源
本文使用的臨床樣本來自中國人民解放軍白求恩國際和平醫院感染科2015年 9–11 月經痰培養和電子計算機斷層掃描(computed tomography,CT)等檢查診斷為結核病的患者 95 例,另采集該醫院呼吸科非結核病而有其他肺部疾病患者痰樣本 10 例作為陰性對照,提供痰液者均要求簽署《知情同意書》。用 N-乙酰-L-半胱氨酸(N-acetyl-L-cysteine,NALC)-NaOH 去污染,操作流程為:取 4%(NALC)-NaOH(成分:4% NaOH 1 mL,NALC 0.1 g,2.94%枸櫞酸鈉 1 mL)1 mL,加等量痰液混合震蕩后靜置 20 min,直至完全液化無痰絲。取 1 mL 液化痰液 5 000 rpm 離心,沉淀加入 1.5 mL pH 值為 7.2 的磷酸鹽緩沖液混勻。按照核酸提取試劑盒(MasterPureTM Complete DNA and RNA Purification kits,Epicentre Biotechnologies)操作完成DNA提取。MTB 標準菌株(H37Ra)由本實驗室保存。
1.2 LAMP體系和條件
25 μL LAMP 體系包括:正向內引物(forward inner primer,FIP)和反向內引物(backward inner primer,BIP)各 1.6 μmol/L,正向外引物3(forward outer primer 3,F3)和反向外引物 3(backward outer primer 3,B3)各 0.2 μmol/L,1.6 mol/L甜菜堿(Sigma),6 mmol/L Mg2SO4,1.4 mmol/L 三磷酸脫氧核糖核苷(deoxy-ribonucleosidetriphosphates,dNTPs),8 U Bst DNA 聚合酶 1 μL(New England BioLabs)、20 mmol/L Tris-HCl(pH 8.8)、10 mmol/L(NH4)2SO4、10 mmol/L KCl、0.1% Triton X-100、1 μL 模板 DNA、1 μL 鈣黃綠素和錳離子(manganese ion,Mn2+) 混合染色液 (成分:0.5 mmol/L 鈣黃綠素和10 mmol/L MnCl2)。將反應管置于 65℃ 恒溫水浴箱內反應 60 min 后置于冰盒內滅活酶,以終止反應。
1.3 引物設計
登陸 Genbank 網站搜索 MTB 16S rDNA 全序列并進行下載,用 Clustal Omega 工具(http://www.ebi.ac.uk/Tools/msa/clustalo/)通過序列對比確定相對保守基因區段。然后用 Genbank 號為 KC692362.1 作為代表序列輸入 LAMP 引物設計軟件 PrimerExplorer V5(http://primerexplorer.jp/e/)設計檢測 MTB 的引物。該軟件的最大優點為可以根據人型 MTB 不同于其他 MTB 的核酸位點設計出相對特異的引物。引物由兩條外引物(F3和B3)和兩條內引物(FIP和BIP)組成。內引物組成:FIP 由正向內引物 1 的互補序列(complement of forward inner primer 1,F1c)和正向內引物 2(forward inner primer 2,F2)組成,BIP 由反向內引物 1 的互補序列(complement of backward inner primer 1,B1c)和反向內引物 2(backward inner primer 2,B2)組成,外引物即為 F3 和 B3。因此,這四條引物可識別靶序列上的六個基因區段。引物的圖解如 圖 1 所示,圖中各個引物以彩色條帶標出:紅色條帶代表 F3 和 B3,藍色條帶代表 F2 和 B2,黃色條帶代表 F1c 和 B1c。箭頭表示從 5′ 到 3′ 方向。虛線表示同上列的核苷酸,其中的實線表示缺失的脫氧核糖核苷酸。引物序列和位點如 表 1 所示,所有引物由上海生工公司合成。
 圖1
LAMP 檢測 MTB 的引物分解圖
Figure1.
Diagram of primers for detection of MTB with LAMP
圖1
LAMP 檢測 MTB 的引物分解圖
Figure1.
Diagram of primers for detection of MTB with LAMP
1.4 LAMP 的特異度
分別以 MTB 標準株為陽性對照,對非結核病而有其他肺部疾病患者的痰液 DNA 為擴增模板進行 LAMP 擴增。結果判定:將 2 μL 擴增產物在 2% 瓊脂糖凝膠中電泳約 40 min 并置于紫外光下進行照相,出現 LAMP 特征性梯狀條帶為陽性結果,無梯狀條帶為陰性結果。染色驗證:反應管內液體變綠為陽性,保持淡橙色為陰性。
1.5 LAMP 的靈敏度
使用核酸蛋白分析儀(BioPhotometer,Eppendorf,Germany)對 MTB H37Ra 標準株 DNA 進行重復定量后取平均值作為真實含量,再調整為 1 ng/μL 后用雙蒸水進行倍比稀釋。根據 1 fg 相當于 100 拷貝 DNA 的計算標準 [27],可知 LAMP 反應管中的模板含量分別為 1 ng(108拷貝)、10–1 ng(107拷貝)、10–2 ng(106拷貝)、10–3 ng(105拷貝)、10–4 ng(104拷貝)、10–5 ng(103拷貝)、10–6 ng(100拷貝)、10–7 ng(10拷貝)和 10 –8 ng(1拷貝)。 擴增后產物用電泳和染色方法對靈敏性進行評價,并進行多次重復實驗以驗證其穩定性。
1.6 LAMP 的臨床評價
對采集的 95 例痰樣本和 10 例非結核病患者痰 DNA 用 LAMP 擴增,將其結果和細菌培養結果進行比較,用 SPSS 17.0 統計學軟件的卡方檢驗功能進行一致性檢驗。差異判定:P<0.05 認為差異有統計學意義。一致性評價:Kappa 值 <0.4,一致性較差; Kappa值 0.4~0.7 之間,則一致性一般; Kappa>0.7 說明一致性較好。
2 結果
2.1 LAMP 的特異度
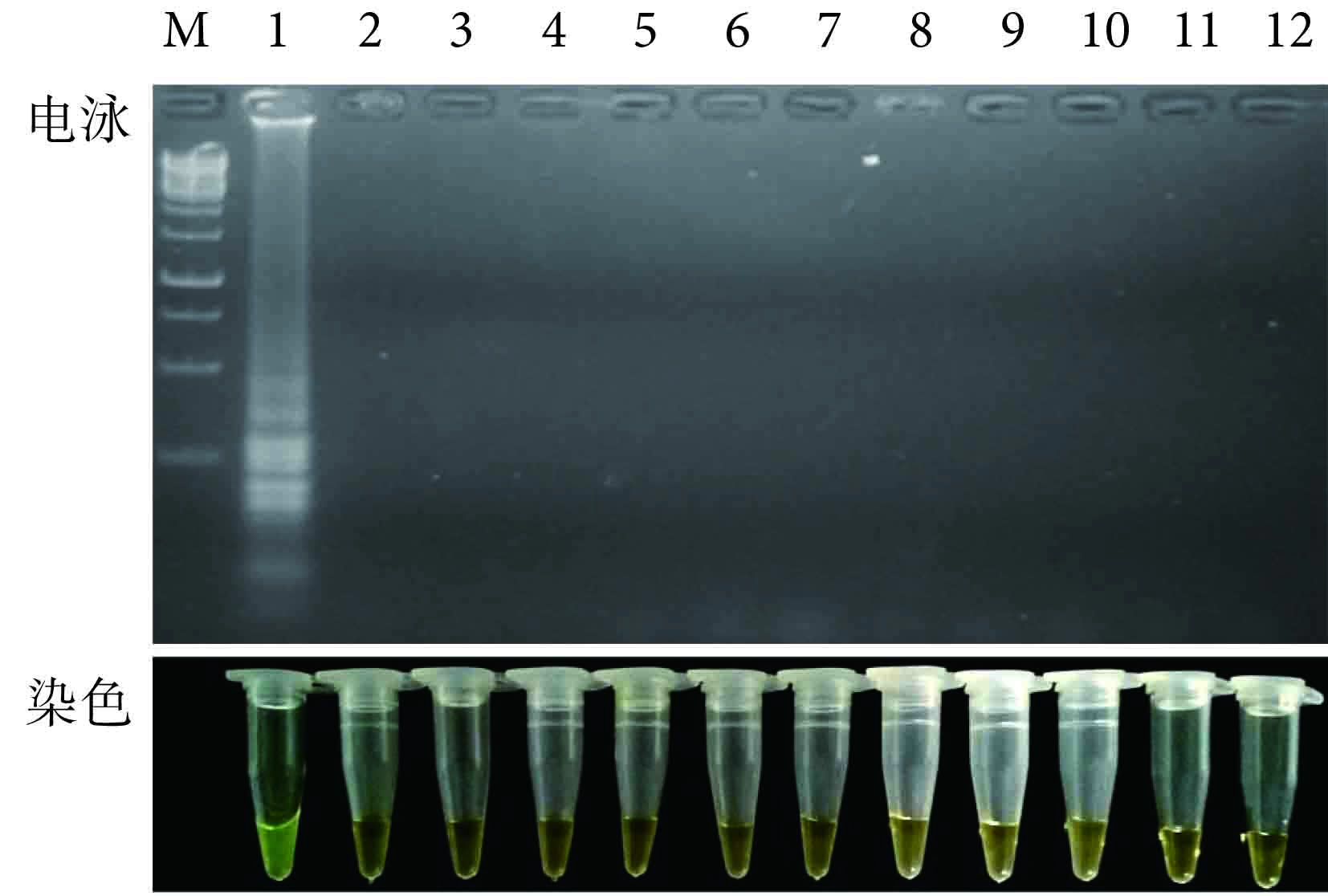
用 LAMP 對 MTB 標準株和 10 例非結核病其他肺病患者痰 16S rDNA 的電泳結果和鈣黃綠素染色的可視效果如圖 2 所示。可以看出,只有 MTB 為模板的 LAMP 體系得出陽性結果(有特征性條帶),而以其他樣本為模板的 LAMP 體系均為陰性結果(無特征性條帶);并且只有 MTB 管中的顏色由淡橙色變為明顯的綠色,而其他樣本管均未發生顏色改變,說明結果為陰性。通過比較圖中結果,可知染色效果和電泳效果相一致。由于此種染色方法快速而簡單,所以可以通過觀察顏色而不必進行電泳即可對結果進行定性判定。
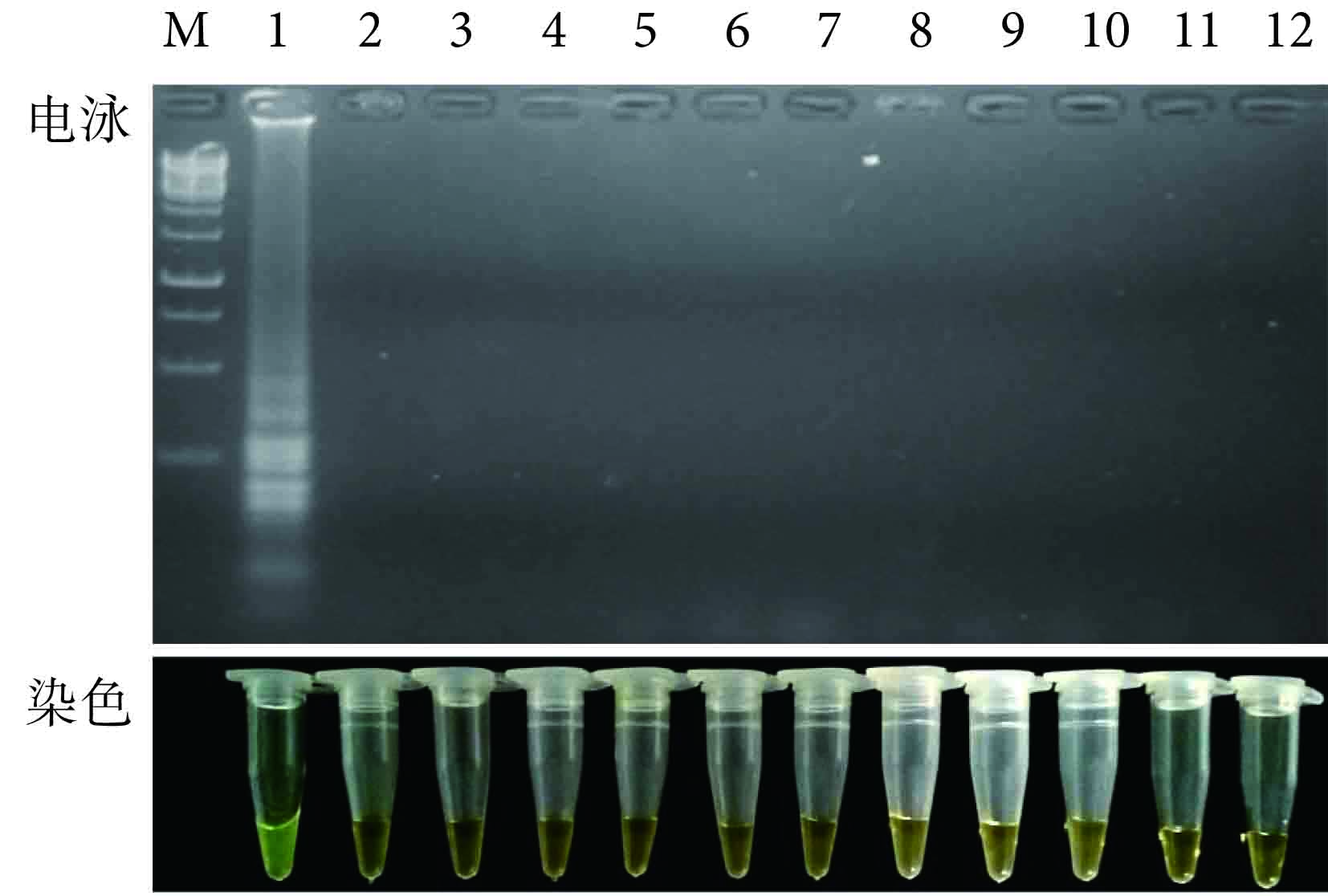 圖2
LAMP 檢測 MTB 的特異度實驗 1:MTB 標準株;2~11:非結核病患者痰模板;12:陰性對照;M:1 kb DNA 標記物
Figure2.
Specificity assay of LAMP for detection of MTB 1: The MTB standard strain; 2~11: templets of the sputum from non-TB patients; 12: Negative control without template; M: 1 kb DNA marker
圖2
LAMP 檢測 MTB 的特異度實驗 1:MTB 標準株;2~11:非結核病患者痰模板;12:陰性對照;M:1 kb DNA 標記物
Figure2.
Specificity assay of LAMP for detection of MTB 1: The MTB standard strain; 2~11: templets of the sputum from non-TB patients; 12: Negative control without template; M: 1 kb DNA marker
2.2 LAMP 的靈敏度
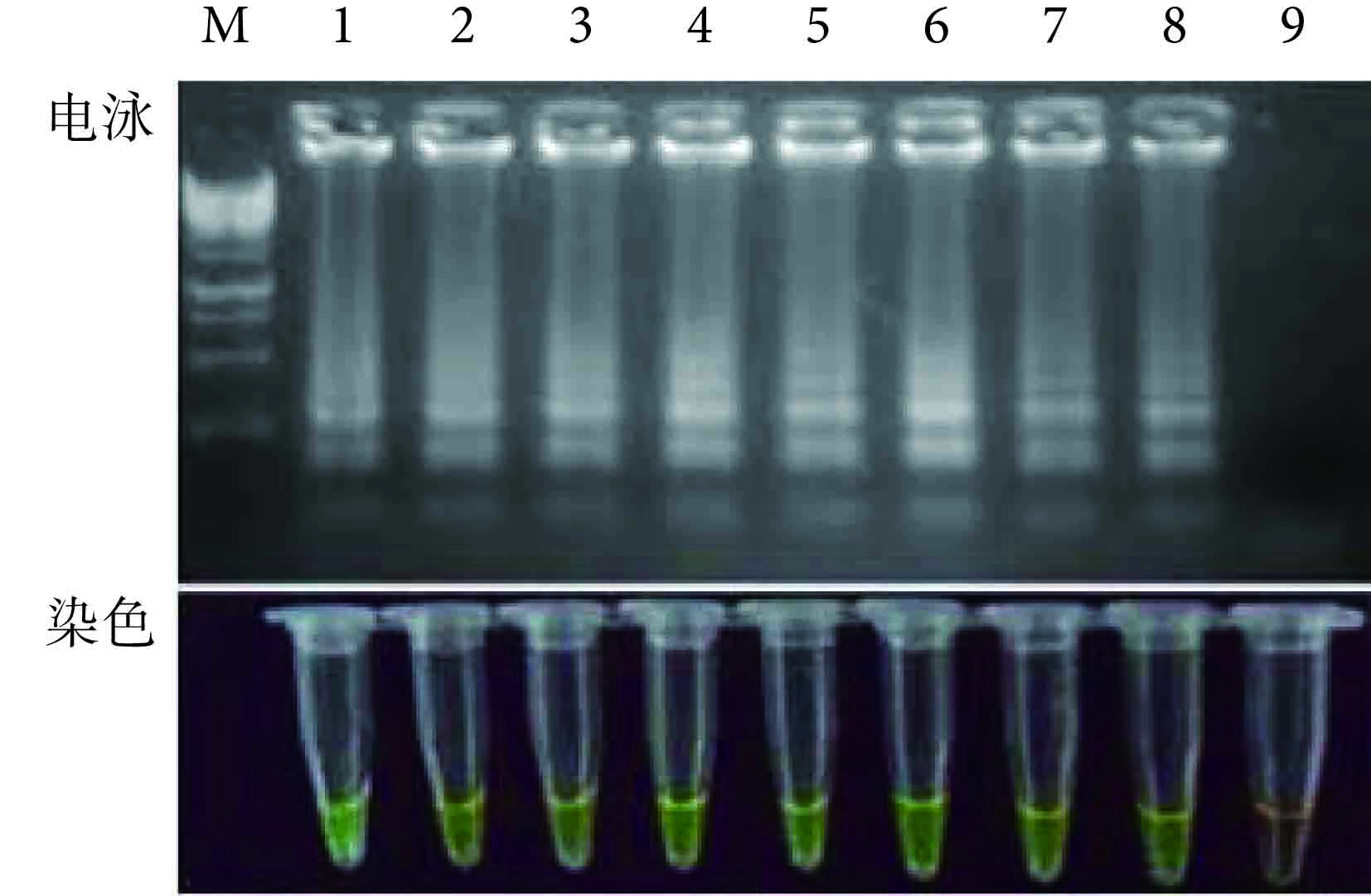
對倍比稀釋后的 MTB 標準株進行 LAMP 擴增后,其結果如 圖 3 所示,電泳后的產物均呈現 LAMP 的特征性梯狀條帶,雖然原始的細菌量無法通過條帶顯現出來,但是從稀釋度最大的第 8 泳道可以看出,LAMP 的檢測極限為 10 拷貝。通過對染色管進行觀察,發現不同的細菌量在 LAMP 擴增后,第 1~8 個擴增管均可見由橙色到綠色的顏色改變,證明染色和電泳效果的檢測極限相一致。雖然只是通過顏色的深淺無法用肉眼判斷具體的細菌含量,但是在沒有氣溶膠污染的前提下,使用不開蓋的染料判定法不失為一種簡單易得的結果判定手段。進一步對該實驗進行多次重復擴增后顯示,結果穩定。
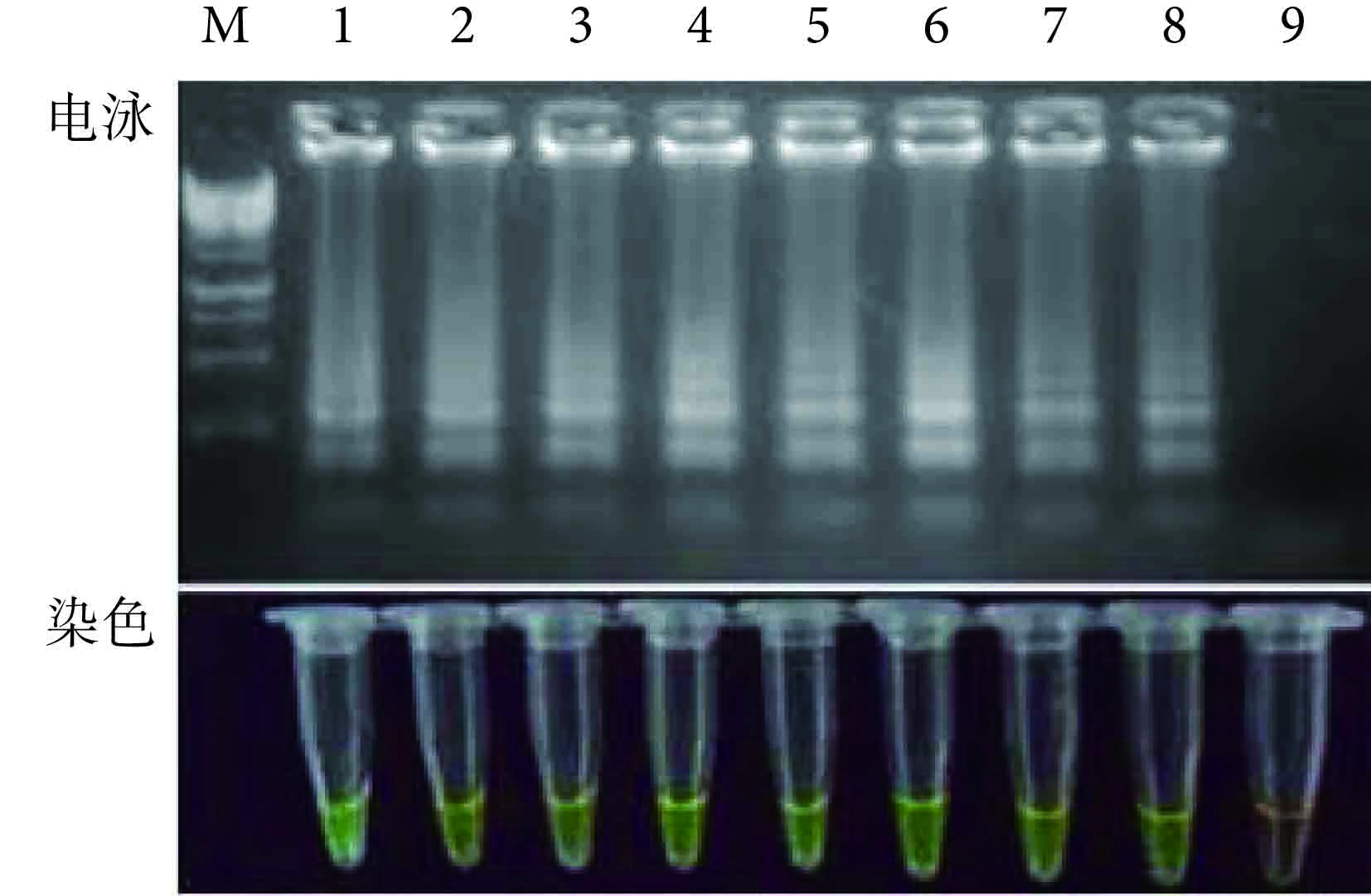 圖3
LAMP 檢測 MTB 的靈敏度實驗 1~9:108拷貝、107拷貝、106拷貝、105拷貝、104拷貝、103拷貝、100拷貝、10拷貝和 1 拷貝;M:1 kb DNA 標記物
Figure3.
Sensitivity assay of LAMP for detection of MTB 1~9: 108 copies, 107 copies, 106 copies, 105 copies, 104 copies, 103 copies, 100 copies, 10 copies and 1 copy; M: 1 kb DNA marker
圖3
LAMP 檢測 MTB 的靈敏度實驗 1~9:108拷貝、107拷貝、106拷貝、105拷貝、104拷貝、103拷貝、100拷貝、10拷貝和 1 拷貝;M:1 kb DNA 標記物
Figure3.
Sensitivity assay of LAMP for detection of MTB 1~9: 108 copies, 107 copies, 106 copies, 105 copies, 104 copies, 103 copies, 100 copies, 10 copies and 1 copy; M: 1 kb DNA marker
2.3 LAMP 的臨床評價
對收集的 95 例 MTB 陽性痰樣本和 10 例非結核病患者的痰樣本 DNA 再次進行 LAMP 擴增,將 LAMP 方法得出的結果和培養后結果進行比較。 所得實驗結果如表 2 所示,在 95 例細菌培養為陽性的樣本中 LAMP 可確定 90 例陽性樣本,剩余 5 例未得擴增, LAMP 的靈敏性為 94.74%。在 10 例非結核病患者樣本中,可用 LAMP 確定出 9 例陰性,特異性為 90%。對這兩種方法經SPSS 17.0 進行一致性檢驗后,得出 P>0.05,說明兩種方法的差異沒有統計學意義。由 Kappa值>0.7 可知,兩種方法的一致性較好。
3 結論
結核病有六高“不改變”,即結核病的感染率、患病率、死亡率、新涂陽率、耐藥率和農村患病率在傳染病中最高且至今不改變。針對結核病的涂片檢測及時方便,然而其靈敏度和特異度僅為 50% 和 80%,況且在肺結核患者中,臨床上有 14.2% 患者無肺結核癥狀。因此臨床上亟需一種更為靈敏、特異的實驗技術以佐證甚至代替傳統的結核桿菌檢測技術。
與其他核酸擴增技術相比,LAMP 技術具有如下三點優勢:首先,由于等溫條件下即可擴增,因此所用裝置廉價、操作簡單,無需昂貴的設備和繁瑣的操作,本實驗就僅用一臺水浴箱完成了所有實驗。第二,由于 LAMP 沒有如 PCR 的變性、退火和延伸等溫度循環步驟,所以擴增效率得到了極度提高,一般使用 4 條引物的 LAMP 在 1 h 內可終止反應,如果再加用兩條引物,可使得其擴增時間縮短到 30 min,但是這種方案對引物的要求十分嚴格,否則容易形成二聚體,會產生類似于假陽性的結果。最后,利用鈣黃綠素的顏色改變進行結果判定,這種方法不但操作簡單,而且不干擾 Bst DNA 聚合酶工作,使 LAMP 可以達到和電泳相一致的靈敏性。按照原理解釋,鈣黃綠素是一種金屬熒光指示劑,在反應尚未開始階段,其和體系中的 Mn2+ 螯合而處于淬滅狀態。隨著反應逐步進行,Mn2+ 被反應過程中生成的焦磷酸鹽替代致使鈣黃綠素游離出來,從而發出綠色熒光。這種游離的鈣黃綠素更傾向于與 LAMP 體系中的鎂離子結合,這種結合可加強熒光效果,使綠光更加鮮艷明亮。
LAMP 具有良好的特異性,從實驗中可看出,其沒有與非目標病毒發生交叉反應,這主要歸功于 4 條引物:F3、B3、FIP 和 BIP。F3 和 B3 的作用是形成莖環結構,而 FIP 和 BIP 通過與莖環結構的內部序列互補而達到擴增靶序列的目的。因此,使用 4 條引物可以使得其擴增特異性高于僅使用兩條引物的普通 PCR 方法。在靈敏性方面, LAMP 對標準株的檢出極限可到 10 拷貝,然而對臨床評價試驗中未檢出的 5 例假陰性痰樣本進行 DNA 定量,發現其細菌含量并不低,分析原因,可能是引物設計時主要是選擇標準株的相對保守的基因區段,再加上 MTB 某基因位點有突變的可能,因此未能得到擴增。而在 10 例非結核病患者的痰擴增實驗中,其中的 1 例痰得出假陽性結果,后經再次實驗和分析,發現是由于在 105 例大量樣本擴增過程中,實驗環境受到了輕度氣溶膠污染。
綜上,本研究證明了 LAMP 具有的高效、省時和經濟等優勢,具有在現場或基層醫療機構的應用價值。然而,LAMP 技術依然面臨幾處不足,例如 DNA 提取過程叫繁瑣,反應試劑需低溫保存,氣溶膠污染容易導致假陽性率升高等問題。所以,今后的研究可以落實在以下幾點:首先,在樣本處理方面,要進一步探索更加簡易的 DNA 提取方法,比如開發出一種僅需把棉簽放入試劑稍加攪拌即可完成 DNA 提取的試劑。第二,在反應液保存方面,開發干燥劑型反應試劑,不但可以使其在常溫保存,而且攜帶方便。第三,由于 MTB 中 16S rRNA 的量遠高于 16S rDNA 的量,如果可以做到同時檢測 16S rRNA 和 16S rDNA,則能進一步提高檢測靈敏性。最后,杜絕擴增產物的氣溶膠污染,比如使用更為密閉的反應管或發明一體化的反應裝置。相信隨著該技術的不斷成熟和改進,相信 LAMP 將會成為現場和基層醫療機構的實用檢測技術,也會成為在流行病學調查中的有力輔助工具。
引言
分枝桿菌屬是一組抗酸性、呼吸道傳播的桿菌,其中引起肺結核的主要為結核分枝桿菌(mycobacterium tuberculosis,MTB)。據世界衛生組織(world health organization,WHO)報道,2014年新發結核病達 900 萬,而結核病又是位列人類獲得性免疫缺陷綜合癥(acquired immune deficiency syndrome,AIDS)之后的第二大致死性傳染病[1-2]。中國是全球 22 個結核病高負擔國家之一,每年新發病例占全球總數的 16%,每年新增的活動性肺結核患者達 130 萬例,其中涂陽肺結核達 58 萬例,因此越來越多的研究人員開始關注對 MTB 感染的快速診斷[3-6]。然而,針對 MTB 的快速實用檢測在結核病流行的發展中國家仍有一定難度[7-8]。比如,作為“金標準”的培養法需要 4~8 周才能得出結果[9],而近年來發展起來的快速培養系統如BactecTM結核分枝桿菌生長指示管(mycobacteria growth indicator tubes,MGIT),雖然縮短了培養時間(3~7 d),但是會帶來快速增菌造成的氣溶膠污染[10-14]。另一方面,目前應用廣泛的抗酸染色技術是一種在實驗設備匱乏的在中小型基層醫療機構都較為常用的檢測手段,甚至很多專業醫療機構也普遍應用。然而,這種傳統方法的敏感性和特異性較低,常有漏診發生,結果是涂陰者也可能會傳播 MTB,而對涂陰者冒然用藥必然會增加耐藥率甚至導致藥物中毒[15-17]。如今,使用以分子生物學為基礎的技術,不僅可以提高檢出率,而且可以避免因藥物中毒導致的不必要處理措施和費用。但是分子生物學技術,如聚合酶鏈反應(polymerase chain reaction,PCR)和實時 PCR 等,需具備昂貴的設備和技術熟練的操作人員[18-20],因此限制了這類既特異又靈敏的技術在現場和基層醫療機構的應用。
環介導等溫擴增技術(loop-mediated isothermal amplification,LAMP)不僅特異性和靈敏度高,而且操作簡單,操作者使用恒溫裝置在 60~65℃條件下經 30~60 min 即可完成擴增,使用鈣黃綠素染料對產物顯色即可定性指示結果[21-22]。另外,反應中不受溫度浮動和反應體系中血紅素、免疫球蛋白、抗凝劑等的干擾,因此更加適用于條件較差的操作環境[23-25]。
MTB 中 16S 核糖體核糖核酸(16S ribosomal ribonucleic acid,16S rRNA)是由 16S 核糖體脫氧核糖核酸(16S ribosomal desoxyribonucleic acid,16S rDNA)編碼的長約 1 500 bp 的 30S 小亞基元件,具有一定的保守性[26]。雖然 16S rRNA 占總 RNA 的 80%,拷貝數是 DNA 的 1 000~10 000 倍[13],但是 16S rRNA 半衰期短,僅存在于有代謝活性的活菌中,然而,根據 LAMP 的溫度條件(60~65℃),MTB 的 16S rRNA 在 20 min 內即被降解,而 16S rDNA 不受溫度干擾。因此本研究應用 LAMP 技術為手段,開展了針對 MTB 16S rDNA 的可視化檢測 MTB 技術的初步探索,為推進該技術在現場或基層醫療機構的應用奠定了理論基礎。
1 材料和方法
1.1 模板來源
本文使用的臨床樣本來自中國人民解放軍白求恩國際和平醫院感染科2015年 9–11 月經痰培養和電子計算機斷層掃描(computed tomography,CT)等檢查診斷為結核病的患者 95 例,另采集該醫院呼吸科非結核病而有其他肺部疾病患者痰樣本 10 例作為陰性對照,提供痰液者均要求簽署《知情同意書》。用 N-乙酰-L-半胱氨酸(N-acetyl-L-cysteine,NALC)-NaOH 去污染,操作流程為:取 4%(NALC)-NaOH(成分:4% NaOH 1 mL,NALC 0.1 g,2.94%枸櫞酸鈉 1 mL)1 mL,加等量痰液混合震蕩后靜置 20 min,直至完全液化無痰絲。取 1 mL 液化痰液 5 000 rpm 離心,沉淀加入 1.5 mL pH 值為 7.2 的磷酸鹽緩沖液混勻。按照核酸提取試劑盒(MasterPureTM Complete DNA and RNA Purification kits,Epicentre Biotechnologies)操作完成DNA提取。MTB 標準菌株(H37Ra)由本實驗室保存。
1.2 LAMP體系和條件
25 μL LAMP 體系包括:正向內引物(forward inner primer,FIP)和反向內引物(backward inner primer,BIP)各 1.6 μmol/L,正向外引物3(forward outer primer 3,F3)和反向外引物 3(backward outer primer 3,B3)各 0.2 μmol/L,1.6 mol/L甜菜堿(Sigma),6 mmol/L Mg2SO4,1.4 mmol/L 三磷酸脫氧核糖核苷(deoxy-ribonucleosidetriphosphates,dNTPs),8 U Bst DNA 聚合酶 1 μL(New England BioLabs)、20 mmol/L Tris-HCl(pH 8.8)、10 mmol/L(NH4)2SO4、10 mmol/L KCl、0.1% Triton X-100、1 μL 模板 DNA、1 μL 鈣黃綠素和錳離子(manganese ion,Mn2+) 混合染色液 (成分:0.5 mmol/L 鈣黃綠素和10 mmol/L MnCl2)。將反應管置于 65℃ 恒溫水浴箱內反應 60 min 后置于冰盒內滅活酶,以終止反應。
1.3 引物設計
登陸 Genbank 網站搜索 MTB 16S rDNA 全序列并進行下載,用 Clustal Omega 工具(http://www.ebi.ac.uk/Tools/msa/clustalo/)通過序列對比確定相對保守基因區段。然后用 Genbank 號為 KC692362.1 作為代表序列輸入 LAMP 引物設計軟件 PrimerExplorer V5(http://primerexplorer.jp/e/)設計檢測 MTB 的引物。該軟件的最大優點為可以根據人型 MTB 不同于其他 MTB 的核酸位點設計出相對特異的引物。引物由兩條外引物(F3和B3)和兩條內引物(FIP和BIP)組成。內引物組成:FIP 由正向內引物 1 的互補序列(complement of forward inner primer 1,F1c)和正向內引物 2(forward inner primer 2,F2)組成,BIP 由反向內引物 1 的互補序列(complement of backward inner primer 1,B1c)和反向內引物 2(backward inner primer 2,B2)組成,外引物即為 F3 和 B3。因此,這四條引物可識別靶序列上的六個基因區段。引物的圖解如 圖 1 所示,圖中各個引物以彩色條帶標出:紅色條帶代表 F3 和 B3,藍色條帶代表 F2 和 B2,黃色條帶代表 F1c 和 B1c。箭頭表示從 5′ 到 3′ 方向。虛線表示同上列的核苷酸,其中的實線表示缺失的脫氧核糖核苷酸。引物序列和位點如 表 1 所示,所有引物由上海生工公司合成。
 圖1
LAMP 檢測 MTB 的引物分解圖
Figure1.
Diagram of primers for detection of MTB with LAMP
圖1
LAMP 檢測 MTB 的引物分解圖
Figure1.
Diagram of primers for detection of MTB with LAMP
1.4 LAMP 的特異度
分別以 MTB 標準株為陽性對照,對非結核病而有其他肺部疾病患者的痰液 DNA 為擴增模板進行 LAMP 擴增。結果判定:將 2 μL 擴增產物在 2% 瓊脂糖凝膠中電泳約 40 min 并置于紫外光下進行照相,出現 LAMP 特征性梯狀條帶為陽性結果,無梯狀條帶為陰性結果。染色驗證:反應管內液體變綠為陽性,保持淡橙色為陰性。
1.5 LAMP 的靈敏度
使用核酸蛋白分析儀(BioPhotometer,Eppendorf,Germany)對 MTB H37Ra 標準株 DNA 進行重復定量后取平均值作為真實含量,再調整為 1 ng/μL 后用雙蒸水進行倍比稀釋。根據 1 fg 相當于 100 拷貝 DNA 的計算標準 [27],可知 LAMP 反應管中的模板含量分別為 1 ng(108拷貝)、10–1 ng(107拷貝)、10–2 ng(106拷貝)、10–3 ng(105拷貝)、10–4 ng(104拷貝)、10–5 ng(103拷貝)、10–6 ng(100拷貝)、10–7 ng(10拷貝)和 10 –8 ng(1拷貝)。 擴增后產物用電泳和染色方法對靈敏性進行評價,并進行多次重復實驗以驗證其穩定性。
1.6 LAMP 的臨床評價
對采集的 95 例痰樣本和 10 例非結核病患者痰 DNA 用 LAMP 擴增,將其結果和細菌培養結果進行比較,用 SPSS 17.0 統計學軟件的卡方檢驗功能進行一致性檢驗。差異判定:P<0.05 認為差異有統計學意義。一致性評價:Kappa 值 <0.4,一致性較差; Kappa值 0.4~0.7 之間,則一致性一般; Kappa>0.7 說明一致性較好。
2 結果
2.1 LAMP 的特異度
用 LAMP 對 MTB 標準株和 10 例非結核病其他肺病患者痰 16S rDNA 的電泳結果和鈣黃綠素染色的可視效果如圖 2 所示。可以看出,只有 MTB 為模板的 LAMP 體系得出陽性結果(有特征性條帶),而以其他樣本為模板的 LAMP 體系均為陰性結果(無特征性條帶);并且只有 MTB 管中的顏色由淡橙色變為明顯的綠色,而其他樣本管均未發生顏色改變,說明結果為陰性。通過比較圖中結果,可知染色效果和電泳效果相一致。由于此種染色方法快速而簡單,所以可以通過觀察顏色而不必進行電泳即可對結果進行定性判定。
 圖2
LAMP 檢測 MTB 的特異度實驗 1:MTB 標準株;2~11:非結核病患者痰模板;12:陰性對照;M:1 kb DNA 標記物
Figure2.
Specificity assay of LAMP for detection of MTB 1: The MTB standard strain; 2~11: templets of the sputum from non-TB patients; 12: Negative control without template; M: 1 kb DNA marker
圖2
LAMP 檢測 MTB 的特異度實驗 1:MTB 標準株;2~11:非結核病患者痰模板;12:陰性對照;M:1 kb DNA 標記物
Figure2.
Specificity assay of LAMP for detection of MTB 1: The MTB standard strain; 2~11: templets of the sputum from non-TB patients; 12: Negative control without template; M: 1 kb DNA marker
2.2 LAMP 的靈敏度
對倍比稀釋后的 MTB 標準株進行 LAMP 擴增后,其結果如 圖 3 所示,電泳后的產物均呈現 LAMP 的特征性梯狀條帶,雖然原始的細菌量無法通過條帶顯現出來,但是從稀釋度最大的第 8 泳道可以看出,LAMP 的檢測極限為 10 拷貝。通過對染色管進行觀察,發現不同的細菌量在 LAMP 擴增后,第 1~8 個擴增管均可見由橙色到綠色的顏色改變,證明染色和電泳效果的檢測極限相一致。雖然只是通過顏色的深淺無法用肉眼判斷具體的細菌含量,但是在沒有氣溶膠污染的前提下,使用不開蓋的染料判定法不失為一種簡單易得的結果判定手段。進一步對該實驗進行多次重復擴增后顯示,結果穩定。
 圖3
LAMP 檢測 MTB 的靈敏度實驗 1~9:108拷貝、107拷貝、106拷貝、105拷貝、104拷貝、103拷貝、100拷貝、10拷貝和 1 拷貝;M:1 kb DNA 標記物
Figure3.
Sensitivity assay of LAMP for detection of MTB 1~9: 108 copies, 107 copies, 106 copies, 105 copies, 104 copies, 103 copies, 100 copies, 10 copies and 1 copy; M: 1 kb DNA marker
圖3
LAMP 檢測 MTB 的靈敏度實驗 1~9:108拷貝、107拷貝、106拷貝、105拷貝、104拷貝、103拷貝、100拷貝、10拷貝和 1 拷貝;M:1 kb DNA 標記物
Figure3.
Sensitivity assay of LAMP for detection of MTB 1~9: 108 copies, 107 copies, 106 copies, 105 copies, 104 copies, 103 copies, 100 copies, 10 copies and 1 copy; M: 1 kb DNA marker
2.3 LAMP 的臨床評價
對收集的 95 例 MTB 陽性痰樣本和 10 例非結核病患者的痰樣本 DNA 再次進行 LAMP 擴增,將 LAMP 方法得出的結果和培養后結果進行比較。 所得實驗結果如表 2 所示,在 95 例細菌培養為陽性的樣本中 LAMP 可確定 90 例陽性樣本,剩余 5 例未得擴增, LAMP 的靈敏性為 94.74%。在 10 例非結核病患者樣本中,可用 LAMP 確定出 9 例陰性,特異性為 90%。對這兩種方法經SPSS 17.0 進行一致性檢驗后,得出 P>0.05,說明兩種方法的差異沒有統計學意義。由 Kappa值>0.7 可知,兩種方法的一致性較好。
3 結論
結核病有六高“不改變”,即結核病的感染率、患病率、死亡率、新涂陽率、耐藥率和農村患病率在傳染病中最高且至今不改變。針對結核病的涂片檢測及時方便,然而其靈敏度和特異度僅為 50% 和 80%,況且在肺結核患者中,臨床上有 14.2% 患者無肺結核癥狀。因此臨床上亟需一種更為靈敏、特異的實驗技術以佐證甚至代替傳統的結核桿菌檢測技術。
與其他核酸擴增技術相比,LAMP 技術具有如下三點優勢:首先,由于等溫條件下即可擴增,因此所用裝置廉價、操作簡單,無需昂貴的設備和繁瑣的操作,本實驗就僅用一臺水浴箱完成了所有實驗。第二,由于 LAMP 沒有如 PCR 的變性、退火和延伸等溫度循環步驟,所以擴增效率得到了極度提高,一般使用 4 條引物的 LAMP 在 1 h 內可終止反應,如果再加用兩條引物,可使得其擴增時間縮短到 30 min,但是這種方案對引物的要求十分嚴格,否則容易形成二聚體,會產生類似于假陽性的結果。最后,利用鈣黃綠素的顏色改變進行結果判定,這種方法不但操作簡單,而且不干擾 Bst DNA 聚合酶工作,使 LAMP 可以達到和電泳相一致的靈敏性。按照原理解釋,鈣黃綠素是一種金屬熒光指示劑,在反應尚未開始階段,其和體系中的 Mn2+ 螯合而處于淬滅狀態。隨著反應逐步進行,Mn2+ 被反應過程中生成的焦磷酸鹽替代致使鈣黃綠素游離出來,從而發出綠色熒光。這種游離的鈣黃綠素更傾向于與 LAMP 體系中的鎂離子結合,這種結合可加強熒光效果,使綠光更加鮮艷明亮。
LAMP 具有良好的特異性,從實驗中可看出,其沒有與非目標病毒發生交叉反應,這主要歸功于 4 條引物:F3、B3、FIP 和 BIP。F3 和 B3 的作用是形成莖環結構,而 FIP 和 BIP 通過與莖環結構的內部序列互補而達到擴增靶序列的目的。因此,使用 4 條引物可以使得其擴增特異性高于僅使用兩條引物的普通 PCR 方法。在靈敏性方面, LAMP 對標準株的檢出極限可到 10 拷貝,然而對臨床評價試驗中未檢出的 5 例假陰性痰樣本進行 DNA 定量,發現其細菌含量并不低,分析原因,可能是引物設計時主要是選擇標準株的相對保守的基因區段,再加上 MTB 某基因位點有突變的可能,因此未能得到擴增。而在 10 例非結核病患者的痰擴增實驗中,其中的 1 例痰得出假陽性結果,后經再次實驗和分析,發現是由于在 105 例大量樣本擴增過程中,實驗環境受到了輕度氣溶膠污染。
綜上,本研究證明了 LAMP 具有的高效、省時和經濟等優勢,具有在現場或基層醫療機構的應用價值。然而,LAMP 技術依然面臨幾處不足,例如 DNA 提取過程叫繁瑣,反應試劑需低溫保存,氣溶膠污染容易導致假陽性率升高等問題。所以,今后的研究可以落實在以下幾點:首先,在樣本處理方面,要進一步探索更加簡易的 DNA 提取方法,比如開發出一種僅需把棉簽放入試劑稍加攪拌即可完成 DNA 提取的試劑。第二,在反應液保存方面,開發干燥劑型反應試劑,不但可以使其在常溫保存,而且攜帶方便。第三,由于 MTB 中 16S rRNA 的量遠高于 16S rDNA 的量,如果可以做到同時檢測 16S rRNA 和 16S rDNA,則能進一步提高檢測靈敏性。最后,杜絕擴增產物的氣溶膠污染,比如使用更為密閉的反應管或發明一體化的反應裝置。相信隨著該技術的不斷成熟和改進,相信 LAMP 將會成為現場和基層醫療機構的實用檢測技術,也會成為在流行病學調查中的有力輔助工具。