為了減小低溫保護劑去除過程對卵母細胞造成的滲透損傷和毒性損傷,本文利用微流控芯片對豬二次減數分裂中期(MⅡ-stage)卵母細胞低溫保護劑的去除方案進行了優化研究。首先分析了微流控去除方法中去除時間、去除液成分及濃度對卵母細胞存活率及體外發育情況的影響,然后將微流控去除方法與傳統的一步法、兩步法進行了比較。研究結果表明,微流控法中去除總時間為 8 min 時,卵母細胞存活率(95.99% ± 4.64%)及桑椹胚率(74.17% ± 1.18%)與新鮮細胞(98.53% ± 2.94%;78.22% ± 1.34%)相比,差異無統計學意義;1 mol/L 蔗糖去除液最有利于卵母細胞低溫保護劑去除后的存活及體外發育;微流控法去除低溫保護劑后,卵母細胞的存活率、體外發育情況等,均好于傳統去除方法。本文研究結果提示,以微流控法去除低溫保護劑可減小對卵母細胞的損傷,從而可能進一步提高卵母細胞的低溫保存效果。
引用本文: 衣星越, 周新麗, 楊云, 戴建軍, 張德福. 微流控法去除低溫保護劑對卵母細胞發育的影響. 生物醫學工程學雜志, 2018, 35(1): 123-130. doi: 10.7507/1001-5515.201608014 復制
版權信息: ?四川大學華西醫院華西期刊社《生物醫學工程學雜志》版權所有,未經授權不得轉載、改編
引言
自從 1986 年 Chen[1]低溫保存人類卵母細胞并最終成功實現妊娠以來,卵母細胞的低溫保存成為低溫生物醫學研究的重要內容,在臨床上逐漸呈現出大量的需求。雖然這一領域已經有了一系列重要突破[2-4],但卵母細胞低溫保存后的發育能力還是不高。影響卵母細胞冷凍效果的因素有很多,特別是在低溫保護劑的添加和去除過程中,滲透壓的急劇變化和高濃度低溫保護劑的化學毒性對卵母細胞造成的損傷很大。
為了減小細胞在低溫保護劑加載/去除操作中受到的損傷,有研究者將微流控芯片技術引入低溫保存領域[5-7]。該技術能使保護劑溶液和緩沖溶液在微流體通道內通過擴散方式混合,實現沿著通道方向保護劑濃度的連續改變,相比于需要將細胞在不同濃度溶液間轉移的傳統分步加載(去除)保護劑方式,可以大幅度減小分步法中由于溶液濃度突然變化造成的細胞體積突然變化,從而減小細胞受到的機械損傷及滲透性損傷。目前國內外針對微流控芯片用于低溫保護劑加載(去除)的研究中,研究者們已利用微流控裝置,實現了緩沖溶液對細胞內保護劑的連續性加載(去除),并通過改變細胞體積分數、細胞懸浮液及緩沖溶液流量、流速等參數,研究了細胞的加載(去除)方式及微流控裝置的加載(去除)效率,但其實驗材料多為肝細胞、紅細胞、淋巴細胞等小體積并能制成懸浮液的細胞[8-13]。而本文提及的類似卵母細胞這類大體積細胞,其滲透特性及在通道內的流動行為完全不同于小體積細胞,在臨床上多是單個細胞操作,因此在芯片設計上需要有單獨的溶液混合通道及細胞操作腔。目前僅有 Heo 等[14]制作了由溶液混合通道、卵母細胞操作腔、細胞進出通道等組成的微流控裝置,并將其用于研究卵母細胞低溫保護劑加載以及卵母細胞在異丙醇溶液中的滲透特性。而對于微流控裝置用于卵母細胞冷凍保護劑去除的相關研究,目前還未見報道。據 Paynter 等[15-16]的研究,卵母細胞在玻璃化保存后,細胞本身所能承受的機械應力會發生變化,對滲透壓也變得更為敏感,因此關注低溫保護劑的去除過程很有必要。
基于以上原因,本文設計制作了一種可用于卵母細胞低溫保護劑加載及去除的微流控芯片[17],對豬二次減數分裂中期(metaphase Ⅱ-stage,MⅡ-stage)(簡稱:MⅡ期)卵母細胞低溫保護劑的去除方案進行了優化研究。課題組首先比較了傳統的分步法去除與微流控連續性去除對卵母細胞存活率及體外成熟發育的影響,驗證連續性去除對卵母細胞的有效性;然后利用該裝置,對去除時總時間、去除液成分及濃度進行了優化,完善了微流控芯片用于卵母細胞低溫保護劑去除的實驗方案。本文研究結果表明,微流控連續性去除方法(以下簡稱:微流控法)去除低溫保護劑能夠減小對卵母細胞的損傷,從而可能進一步提高卵母細胞的低溫保存效果。
1 材料與方法
1.1 主要試劑
實驗中所用化學試劑除特別說明外,均購自 Sigma-Aldrich 公司,組織培養液 199(tissue culture meduium-199,TCM199)、胎牛血清(fetal bovine serum,FBS)購自 Gibco 公司,孕馬血清促性腺激素、人絨毛促性腺激素購自寧波市第三激素制品有限公司。
各試劑配比如下:
基礎液:TCM199 培養液 + 20% FBS;兩步法低溫保護劑Ⅰ:基礎液 + 7.5% 二甲基亞砜(dimethyl sulfoxide,Me2SO)+ 7.5% 乙二醇(ethylene glycol,EG);兩步法低溫保護劑Ⅱ:15% Me2SO + 15% EG + 0.5 mol/L 蔗糖;兩步法去除溶液Ⅰ:基礎液 + 0.3 mol/L 蔗糖溶液;兩步法去除溶液Ⅱ:基礎液 + 0.15 mol/L 蔗糖溶液;微流控法去除溶液分別采用:基礎液 +(0.5、1.0、2.0 mol/L)蔗糖、基礎液 +(0.5、1.0、2.0 mol/L)葡萄糖、基礎液 +(0.5、1.0、2.0 mol/L)海藻糖。
洗卵臺氏液:參照戴建軍[18]的配置方法,每次配制 500 mL,經 0.22 μm 濾器過濾后進行分裝,分裝后置于 4℃ 保存。
1.2 豬卵母細胞的采集和體外成熟培養
實驗中所用的豬卵母細胞取自上海市嘉定區某屠宰場采集的新鮮卵巢,放在 37℃ 的生理鹽水(含 500 IU 青(鏈)霉素)中,1 h 內運回實驗室,用帶有 18 G 針頭的 5 mL 注射器抽吸卵巢表面直徑 2~6 mm 卵泡的卵泡液并注入 15 mL 離心管中,37℃ 靜置 10 min,移除上清液,用少量洗卵臺氏液懸浮沉淀后,轉入直徑 10 cm 培養皿內進行卵母細胞收集。在體視顯微鏡(SMZ-168,MOTIC,日本)下撿取胞質均勻、包被 3 層或以上致密卵丘細胞的卵丘-卵母細胞復合體(cumulus oocyte complexes,COCs)用于體外成熟培養。
COCs 用洗卵臺氏液洗滌 2~3 次,再用 TCM199 培養液洗滌 2~3 次后,將細胞移入用 4 孔培養板,并置于 CO2 培養箱[(39 ± 0.5)℃、5%CO2、95% 空氣、飽和濕度](Forma Scientific,美國)中進行細胞體外成熟培養,每孔加入 500 μL 培養液(TCM199 培養液 + 10% FBS + 10% 豬卵泡液 + 10 IU/mL 孕馬血清促性腺激素 + 10 IU/mL 人絨毛膜促性腺激素),并在其上覆以滅菌礦物油,培養 42~46 h 后,得到 MⅡ期卵母細胞。實驗時,MⅡ期卵母細胞用 0.1% 透明質酸酶消化去除卵丘細胞,再用 TCM199 培養液洗滌 3~5 次,備用。
1.3 微流控芯片及微混合系統
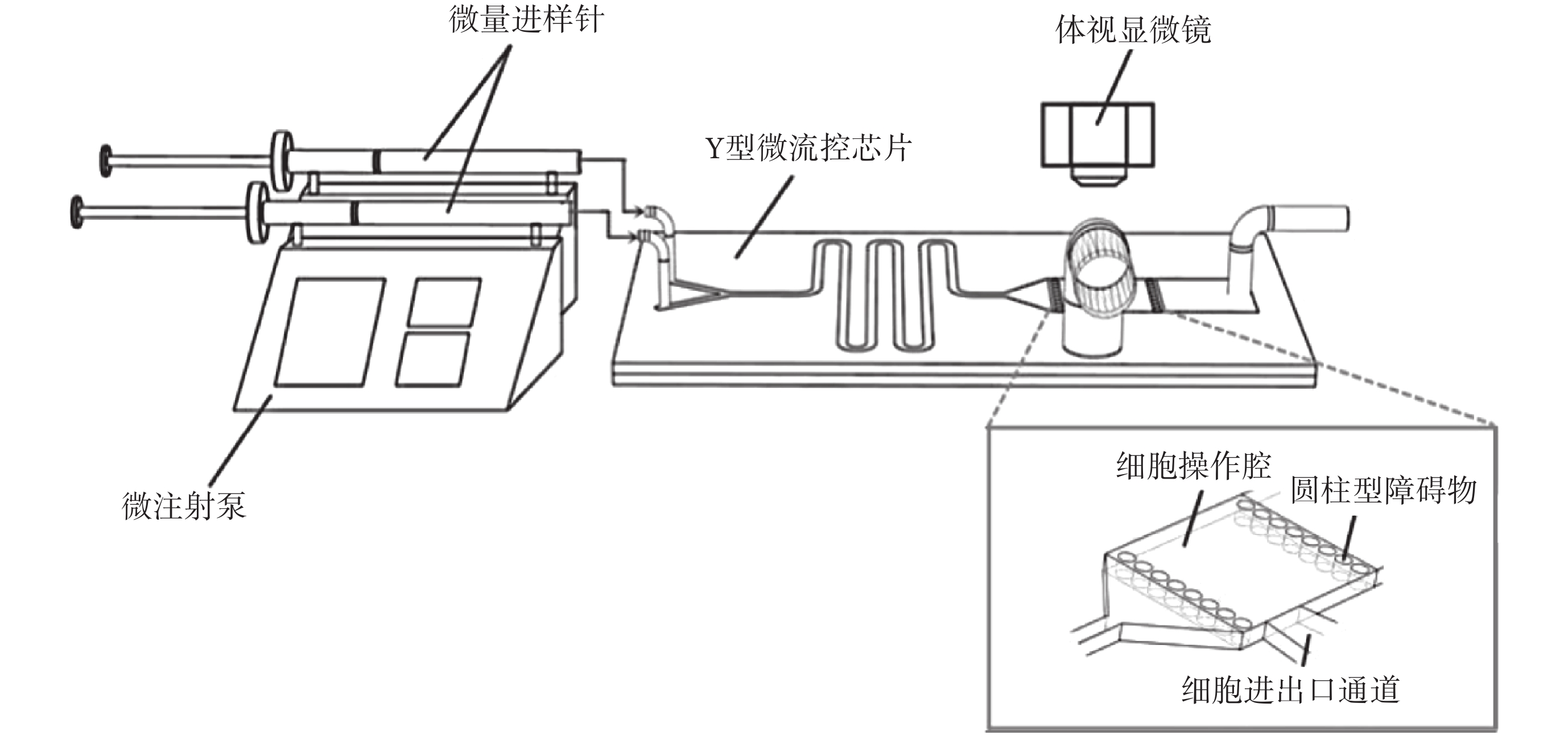
微流控芯片由 Y 型入口、蛇形混合通道及細胞操作腔組成,Y 型通道入口長為 10 mm,蛇型通道長 17 mm,整個管道總長約為 135 mm,細胞操作腔內左右各設置有一排圓柱型障礙物,圓柱型底面直徑為 100 μm,兩圓柱型間隔為 50 μm,保證細胞在低溫保護劑加載或去除時,不易被溶液沖走。微混合系統如圖 1 所示。將微流控芯片放置于體視顯微鏡下,使用兩個微注射泵(Pump 11 Pico Plus Elite,Harvard,美國)和兩個 1 mL 平頭液相微量進樣針(上海高鴿工貿有限公司,中國),分別將低溫保護劑溶液和緩沖溶液注入芯片。
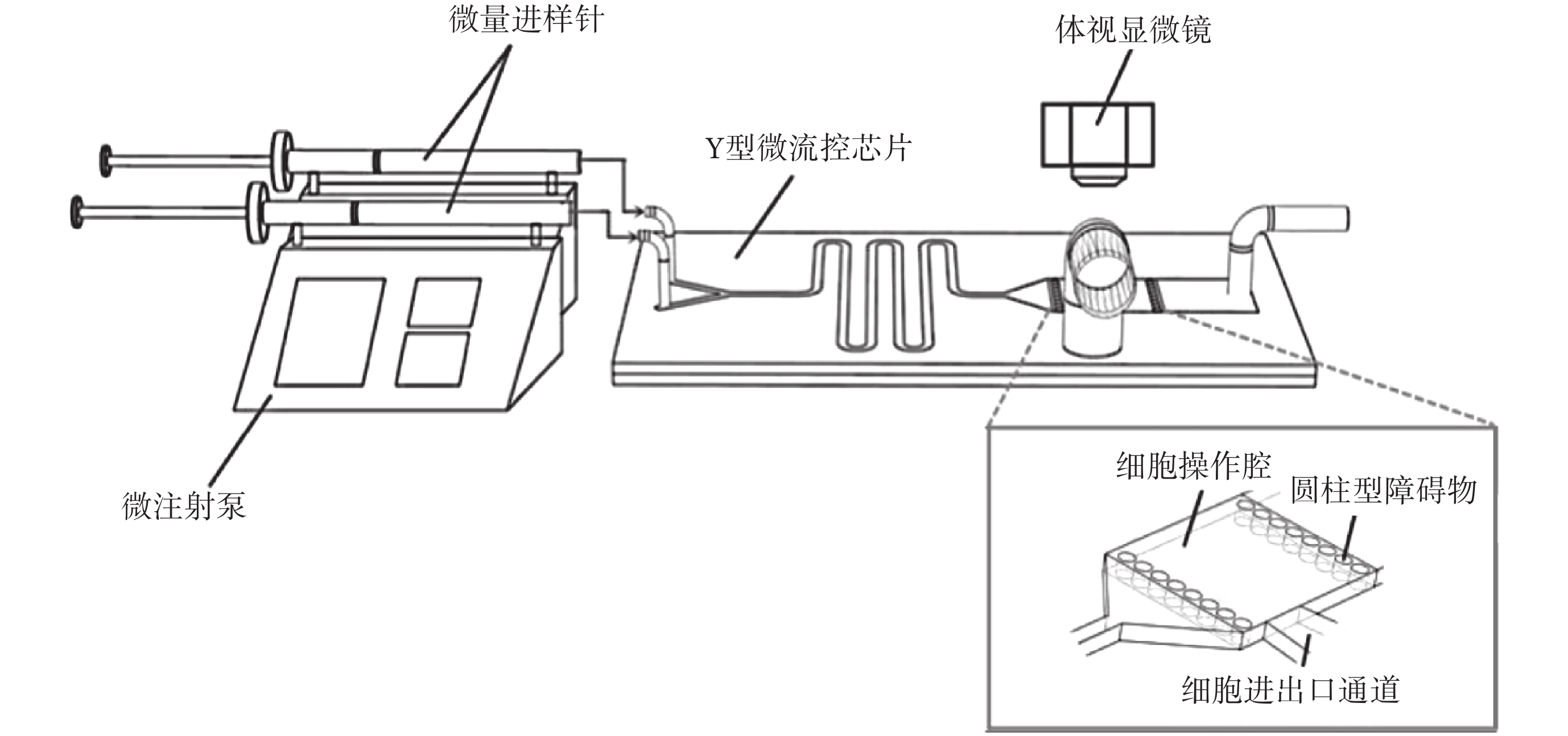 圖1
微流控芯片及微混合系統
Figure1.
Microfluidic chip and microfluidic mixing system
圖1
微流控芯片及微混合系統
Figure1.
Microfluidic chip and microfluidic mixing system
1.4 卵母細胞冷凍保護劑去除方案
1.4.1 微流控法去除時間優化
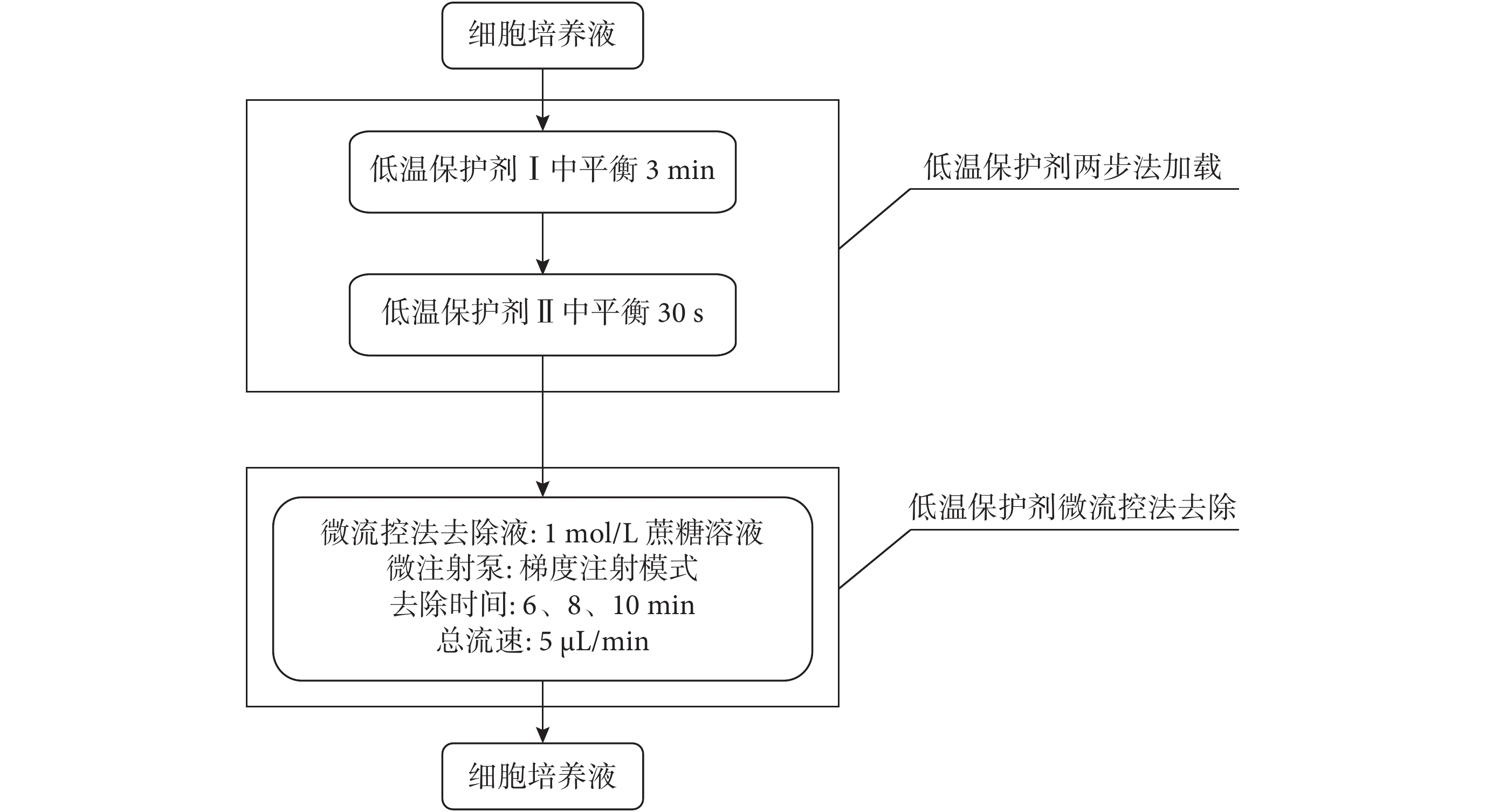
如圖 2 所示,微流控法去除時間優化時,首先進行卵母細胞低溫保護劑兩步法加載:將消化好的細胞放入低溫保護劑Ⅰ中平衡 3 min 后,迅速轉移至低溫保護劑Ⅱ中平衡 30 s,然后進行保護劑微流控法去除。實驗中,基于文獻[26]及簡化實驗因素的原因,課題組暫未考慮其他兩種因素,僅選定 1 mol/L 蔗糖溶液作為微流控法去除液,故微流控法去除保護劑時,芯片的兩個入口處分別通入 1 mol/L 蔗糖溶液和 TCM199 培養液,設置 1 mol/L 蔗糖溶液流速占總流速的百分比從 100% 線性減小至 0%,TCM199 培養液的流速占總流速的百分比從 0% 線性增加至 100%,總流速為 5 μL/min,去除總時間分別設為 6 min、8 min、10 min。
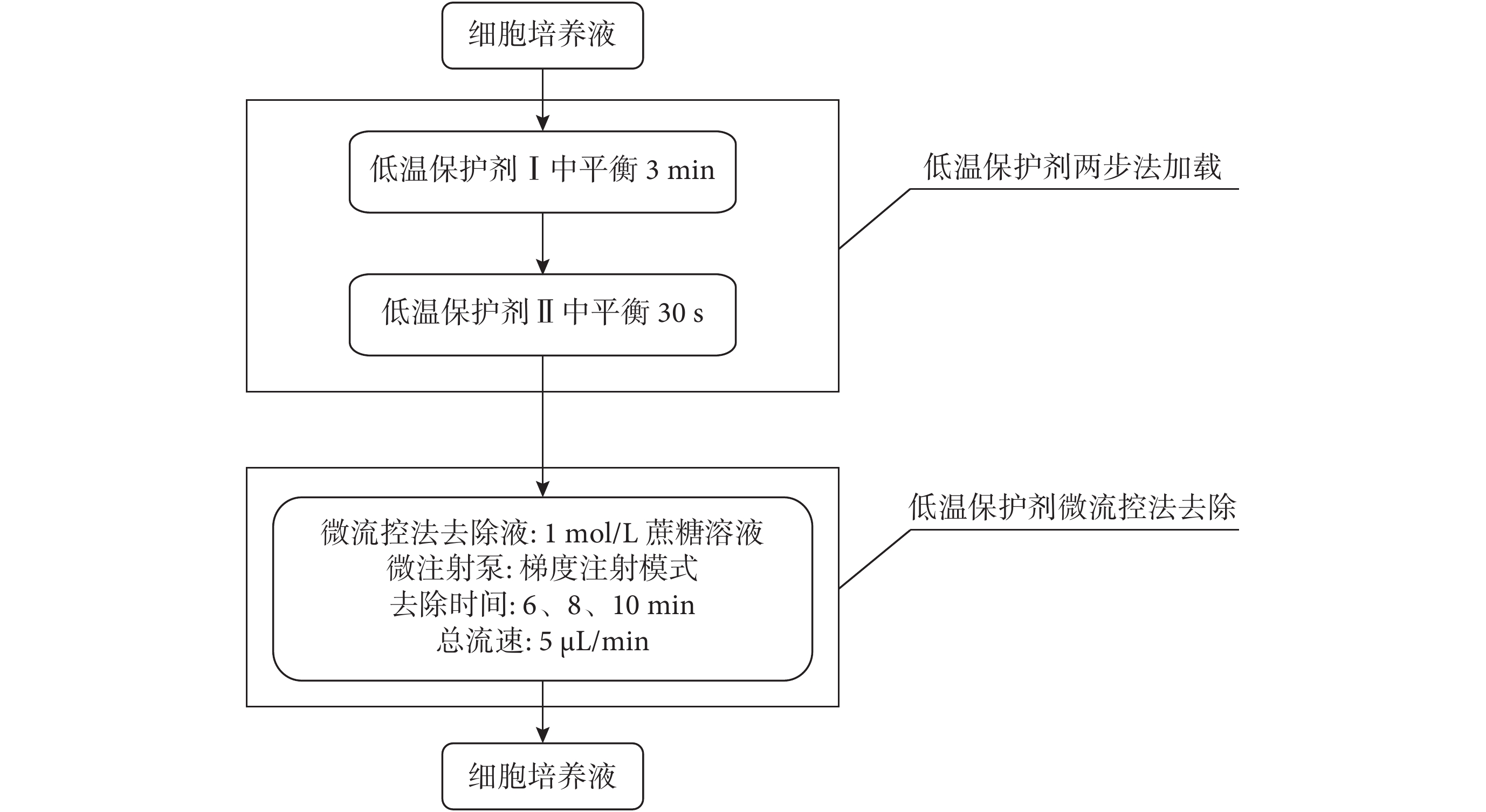 圖2
微流控法去除時間優化過程流程圖
Figure2.
Flowchart of the unloading time optimization of microfluidic removal method
圖2
微流控法去除時間優化過程流程圖
Figure2.
Flowchart of the unloading time optimization of microfluidic removal method
1.4.2 微流控法去除液成分及濃度優化
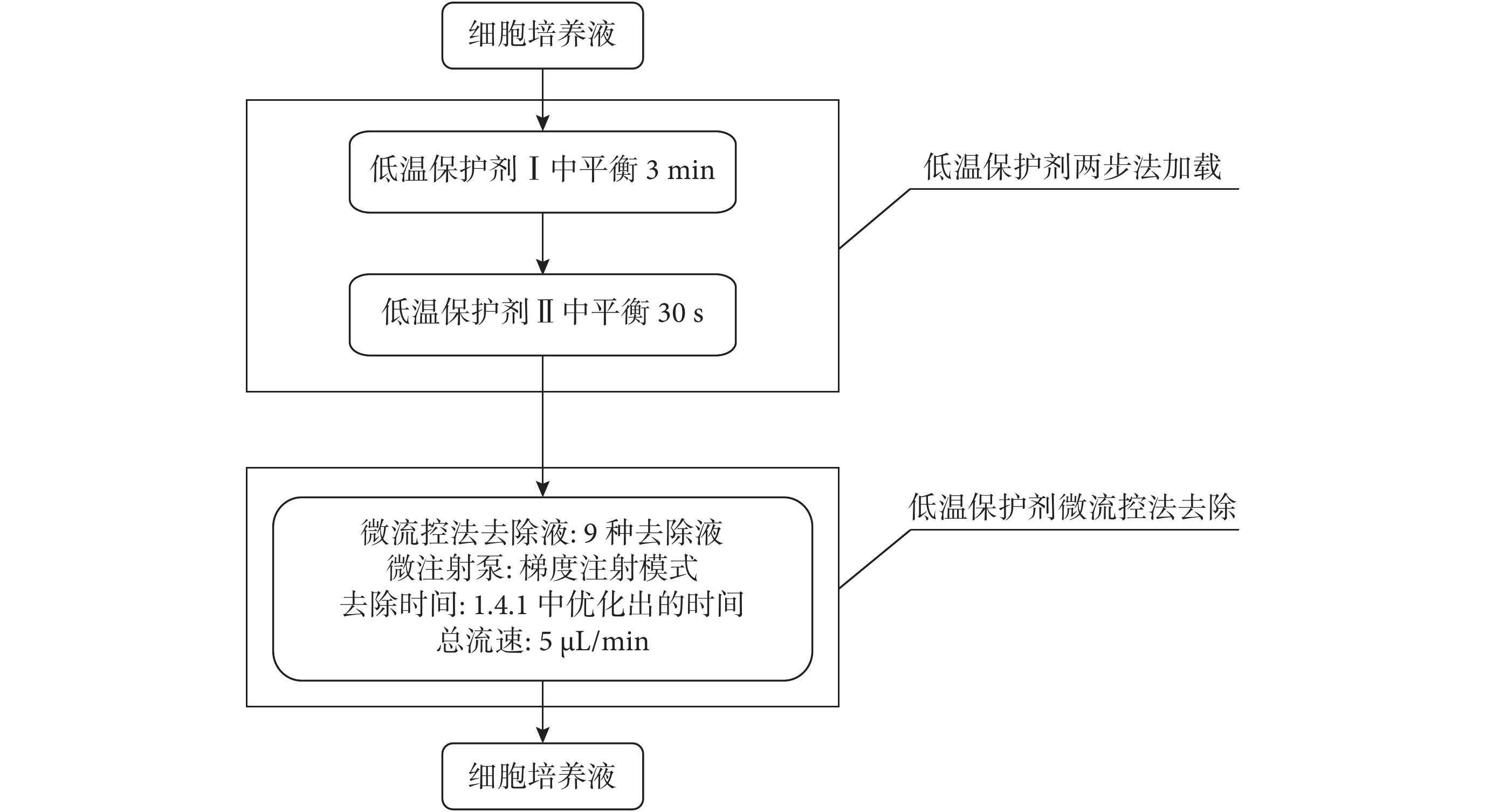
在優化微流控法去除溶液的種類和濃度時,操作過程如圖 3 所示,去除總時間選用 1.4.1 微流控法去除時間優化實驗中測定出存活率及體外發育情況最好時的去除總時間。選用的去除液組成及配比如表 1 所示。
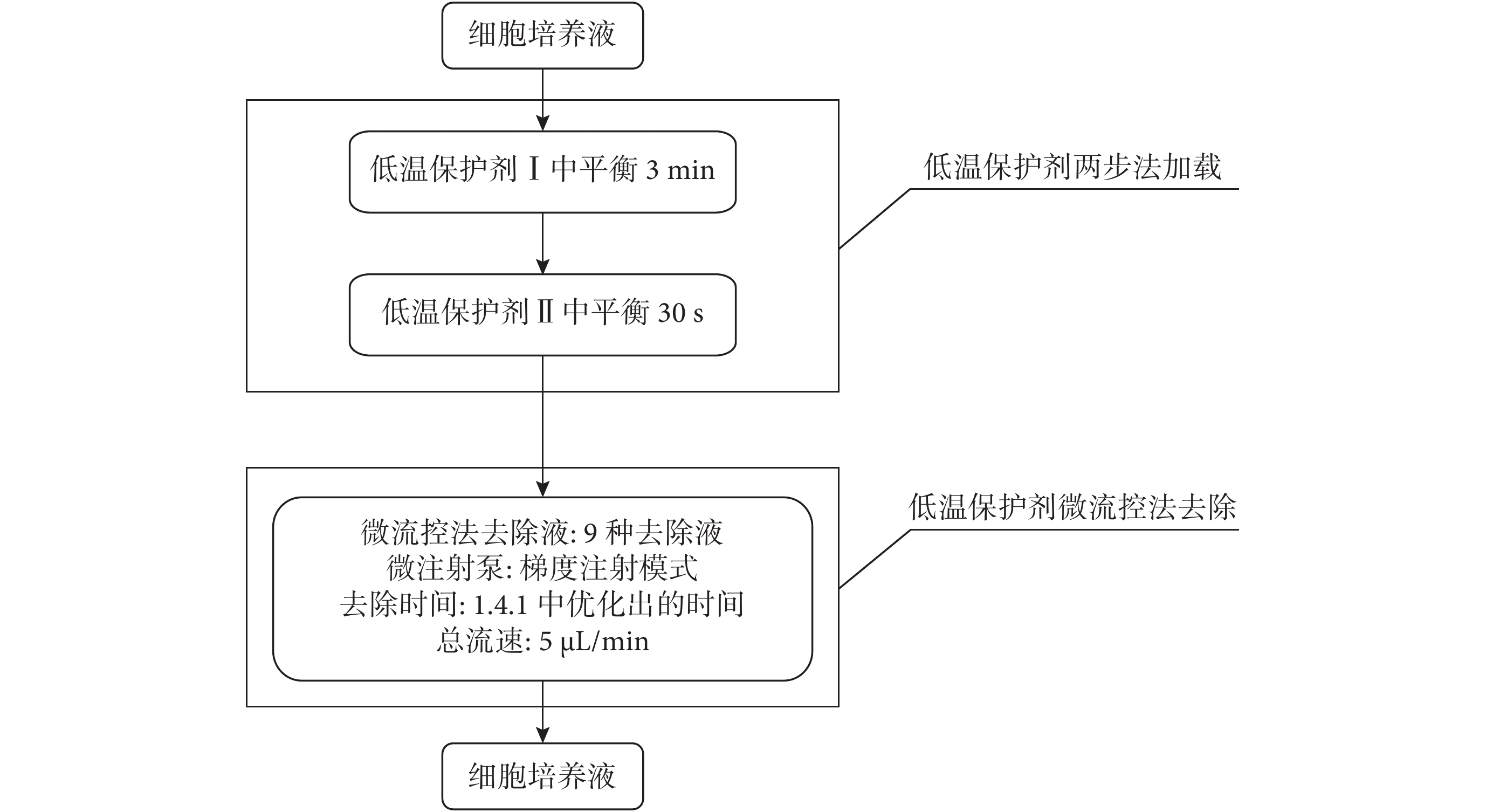 圖3
微流控法去除液成分及濃度優化過程流程圖
Figure3.
Flowchart of the composition and concentration of diluting solutions optimization of microfluidic removal method
圖3
微流控法去除液成分及濃度優化過程流程圖
Figure3.
Flowchart of the composition and concentration of diluting solutions optimization of microfluidic removal method
1.4.3 一步法、兩步法、微流控法去除
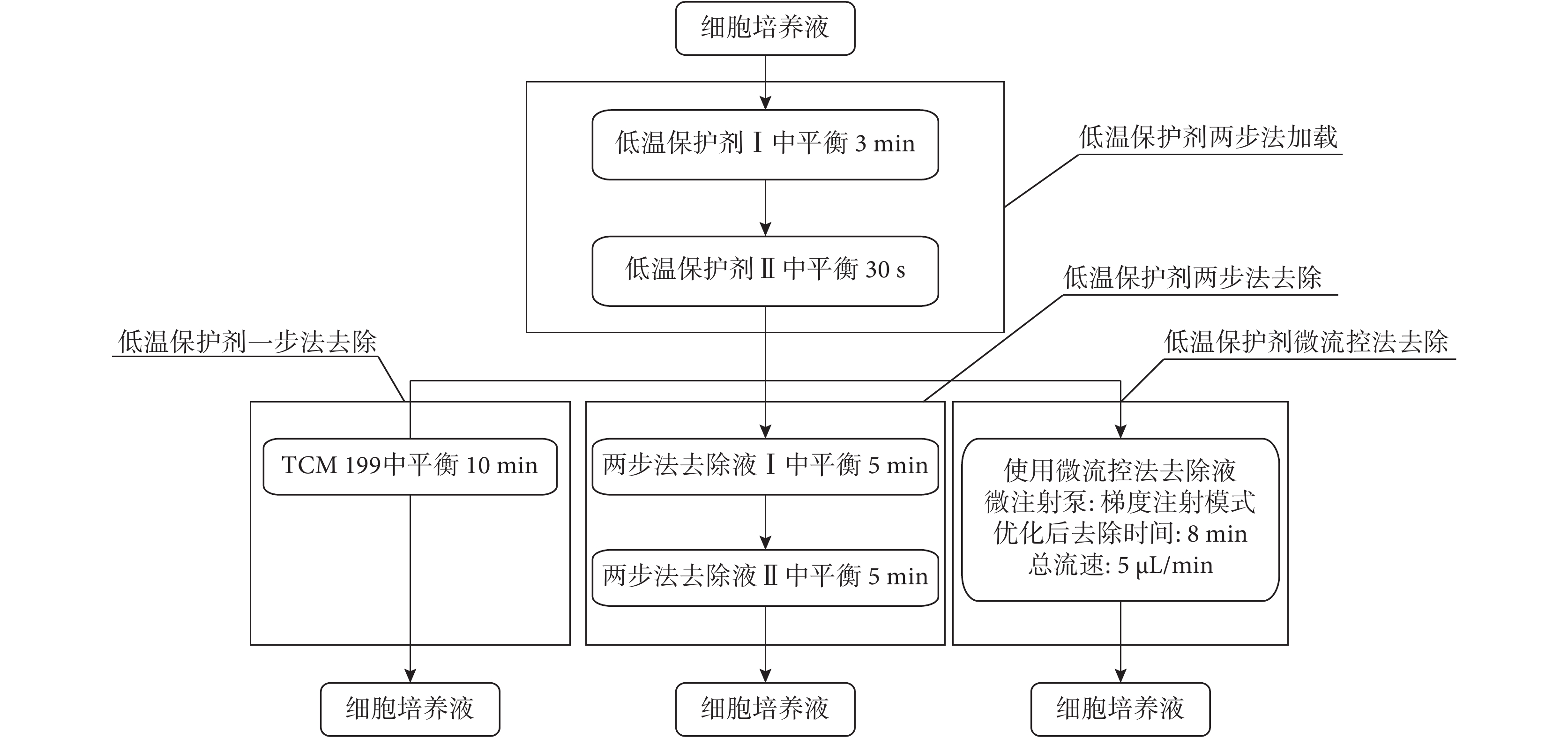
采用傳統兩步法對細胞進行低溫保護劑加載,再分別采用一步法、兩步法和微流控法進行保護劑去除,加載與去除過程如圖 4 所示。
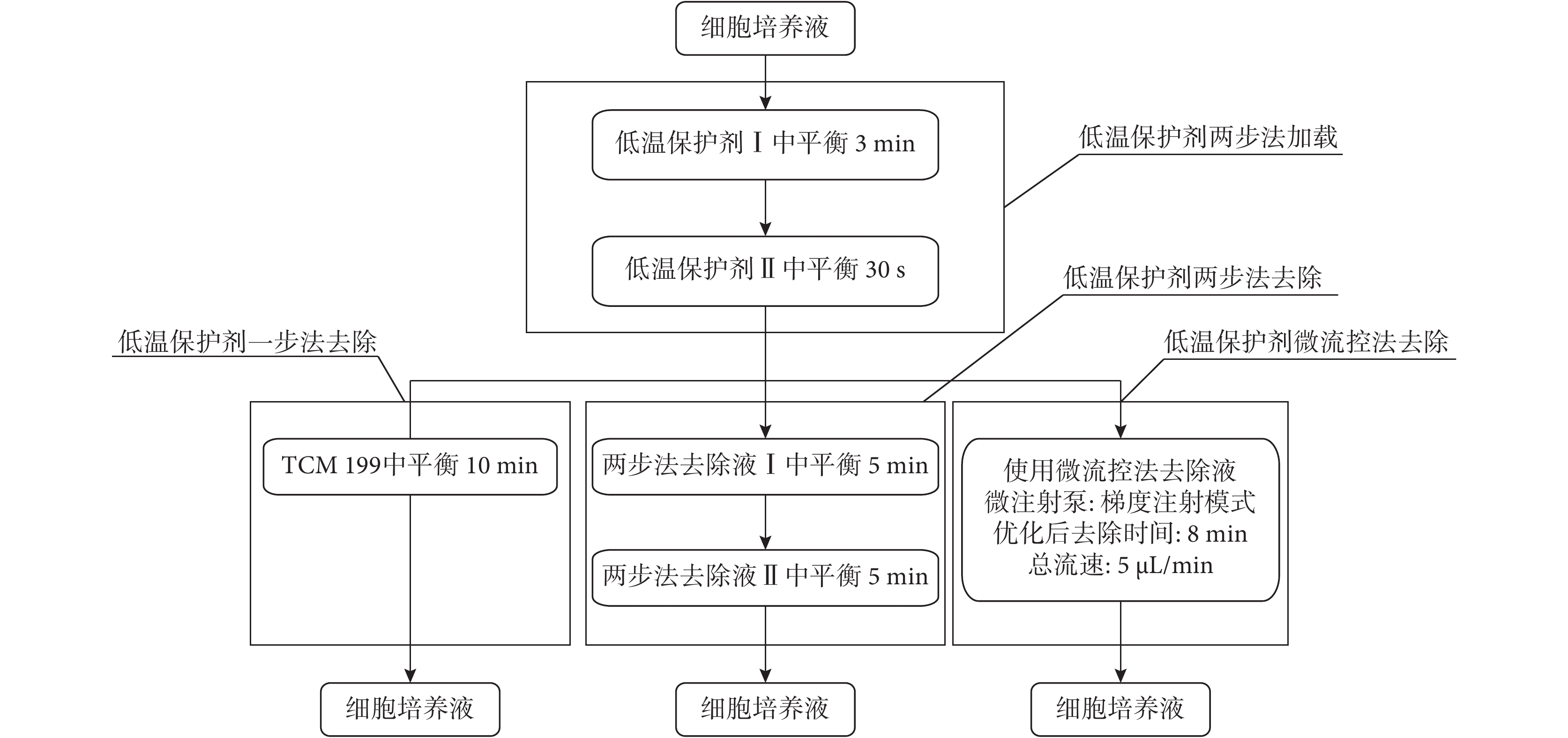 圖4
傳統方法與微流控法去除過程流程圖
Figure4.
Flowchart of traditional and microfluidic removal method
圖4
傳統方法與微流控法去除過程流程圖
Figure4.
Flowchart of traditional and microfluidic removal method
低溫保護劑兩步法加載:將消化好的細胞放入低溫保護劑Ⅰ中平衡 3 min 后,迅速轉移至低溫保護劑Ⅱ中平衡 30 s。一步法去除為:將加載后的細胞迅速移至 TCM199 培養液中,平衡 10 min。兩步法去除為:將加載后的細胞先轉移到兩步法去除液Ⅰ中,平衡 5 min 后,再轉移至去除液Ⅱ中,平衡 5 min。微流控法去除為:使用細胞口吸器將已加載了低溫保護劑的細胞移入微流控芯片中,芯片的兩個入口處分別通入 1.4.2 中優化出的微流控法去除液和 TCM199 培養液,設置微流控法去除液流速占總流速從 100% 線性減小至 0%,TCM199 培養液流速占總流速從 0 線性增加至 100%,總流速為 5 μL/min,去除總時間為 1.4.1 中優化出的去除時間。
1.5 卵母細胞保護劑去除方案效果評價
卵母細胞存活率檢測:采用二乙酸熒光素(fluorescein diacetate,FDA)染色法[19-20]檢測不同低溫保護劑加載去除方案對卵母細胞細胞膜及胞內酯酶系統完整性和活性的影響。將已去除低溫保護劑的卵母細胞放入 TCM199 培養液中洗滌 3 次,轉移至 10% FDA 染色液中,在培養箱中避光染色 5~10 min 后,再用 TCM199 培養液洗滌 3~5 次,立即拿到熒光顯微鏡(1XY71,OLYMPUS,日本)下進行觀察。胞質發熒光的卵母細胞視為有活力,不發熒光或熒光較弱的均視為死細胞。
卵母細胞體外發育能力檢測:采用電激活的方法對卵母細胞進行孤雌激活[21-23],檢測不同低溫保護劑加載去除方案對卵母細胞體外成熟發育的影響。將加載并去除低溫保護劑后的 MⅡ期卵母細胞放入電激活融合液中平衡 1~3 min,轉入鋪滿激活液的 0.5 mm 寬度的激活槽中,使用電融合儀(BTX2001,SanDiego,美國),在電場強度 1.2 kV/cm、脈沖時間 30 μs、1 次脈沖條件下對卵母細胞進行電激活處理。激活后的孤雌激活胚胎放入胚胎培養液中培養 4~5 h,再轉移至胚胎培養液中進行孤雌激活胚胎培養。激活后第 7 天觀察胚胎發育情況,統計胚胎所處的發育時。其中,卵裂后擁有 2、4、8、16 個細胞的胚胎分別為 2 細胞時期胚胎、4 細胞時期胚胎、8 細胞時期胚胎和 16 細胞時期胚胎,多于 16 個胞但還未分化出空腔的胚胎為桑椹胚時期胚胎。
1.6 數據分析
采用 SPSS Statistics 19.0 軟件中 One way ANOVA、Duncan’s 新復極差法進行分析,以 P < 0.05 作為差異是否具有統計學意義的評判標準。
2 結果與討論
2.1 微流控法不同去除時間對卵母細胞的影響
細胞在保護劑加載(去除)過程中暴露在保護劑中的時間,會增加保護劑滲透作用和化學毒性對細胞的損傷,因此,以傳統去除方法的總去除時間為依據[19],比較了微流控法不同去除時間對卵母細胞存活率和體外發育潛能的影響,結果如表 2 所示,其中對照組為不經過低溫保護劑加載及去除處理的 MⅡ期卵母細胞。
如表 2 所示,微流控法 8 min 去除方案下,細胞的存活率(95.99% ± 4.64%)與 6 min 組(73.33% ± 1.48%)和 10 min 組(76.74% ± 1.42%)相比,差異具有統計學意義(P < 0.01),與對照組卵母細胞存活率相比(98.53% ± 2.94%)差異無統計學意義。不同處理方法得到的卵母細胞電激活并培養 7 d 后,8 min 組僅有 17.08% ± 3.78% 的胚胎未能跨越 8-細胞時期,74.17% ± 1.18% 的胚胎都發育到了桑椹胚階段,與對照組(15.16% ± 4.98%;78.22% ± 1.34%)相比,差異無統計學意義;6 min 組存活率與 10 min 組相比,差異無統計學意義,但電激活后僅有 43.09% ± 2.70% 的胚胎發育到了桑椹胚時期,其桑椹胚率與 10 min 組(50.15% ± 3.94%)相比,差異具有統計學意義( P < 0.05)。這可能是因為,去除時間較短(6 min)時,相同注射模式下,細胞周圍溶液形成的濃度梯度較大,對細胞造成的滲透性損傷也較大,而去除時間較長(10 min)時,相同注射模式下,細胞周圍洗脫液形成的濃度梯度雖然較小,但細胞在洗脫液中暴露的時間過長,對細胞造成的毒性損傷抵消了濃度梯度較小帶來的優勢,不利于細胞后期的發育。
2.2 微流控法不同去除溶液對卵母細胞的影響
為了探究不同去除溶液對卵母細胞的影響,使用微流控法比較了不同濃度的蔗糖、葡萄糖、海藻糖去除液對 MⅡ期卵母細胞存活率及體外發育潛能的影響,結果如表 3 所示,其中對照組為不經過低溫保護劑加載及去除處理的 MⅡ期卵母細胞。
如表 3 所示,3 種去除液中,0.5 mol/L 組和 1 mol/L 組存活率及體外成熟發育情況均優于 2 mol/L 組。原因可能是 2 mol/L 組去除液濃度過高,使得細胞在去除過程中體積發生變化,增加了細胞需承受的機械應力,造成了細胞的滲透性損傷。雖然大部分 0.5 mol/L 組的存活率及體外發育情況與 1 mol/L 組相比,差異無統計學意義,但不同去除液處理得到的卵母細胞 0.5 mol/L 組的桑椹胚率普遍略低于 1 mol/L 組。比如 0.5 mol/L 蔗糖組與 1 mol/L 蔗糖組相比,有 7.97% ± 5.37% 的胚胎滯留在了 16-細胞階段,因此其桑椹胚率略低于 1 mol/L 蔗糖組和對照組,造成這一現象的原因可能是 0.5 mol/L 去除液能提供給細胞的滲透壓小于 1 mol/L 組,細胞受到的滲透性損傷及殘留在細胞中的低溫保護劑造成的毒性損傷,影響了卵母細胞的存活率及體外發育情況。
另外,3 種去除液中,蔗糖、葡萄糖的效果均好于海藻糖。0.5 mol/L、1 mol/L 蔗糖組和 1 mol/L 葡萄糖組的細胞存活率分別能達到 96.61% ± 3.99%、95.99% ± 4.64% 和 95.06% ± 5.89%,三者相比差異無統計學意義,且三者與對照組(98.53% ± 2.94%)相比,差異無統計學意義,但海藻糖組存活率與對照組相比差異均有統計學意義(0.5 mol/L、1/mol/L 海藻糖去除液組 vs. 對照組,P < 0.05;2 mol/L 海藻糖去除液組 vs. 對照組,P < 0.01)。不同去除液處理得到的卵母細胞電激活并培養 7 d 后,僅 1mol/L 蔗糖去除液組的桑椹胚率(74.17% ± 1.18%)與對照組(78.22% ± 1.34%)相比,差異無統計學意義。葡萄糖組中 1 mol/L 組與蔗糖 1 mol/L 組相比,滯留在 16-細胞時期的胚胎數較多(7.74% ± 0.84%),因此桑椹胚率略低于蔗糖 1 mol/L 組。海藻糖組中體外發育較好的 1 mol/L 組也和葡萄糖組類似,但細胞本身存活率就低,因此體外成熟發育情況最不理想。
糖類對細胞起到的保護作用十分復雜,已有研究表明,相比于二糖,單糖是較好的滲透緩沖液[25],但從以上 3 種不同去除溶液的實驗結果來看,1 mol/L 蔗糖去除液最有利于卵母細胞低溫保護劑去除后的存活和體外發育,這可能是因為蔗糖在細胞脫水時能通過氫鍵與大分子中極性殘基結合,因而具有穩定蛋白質與膜的作用[26];海藻糖溶液雖然在脫水環境中保護細胞蛋白質和膜的機制類似于蔗糖[27],但卻不是很好的滲透壓緩沖液;葡萄糖溶液在去除時雖然是很好的滲透壓緩沖液,但不具有類似蔗糖穩定蛋白質分子的機制,造成的蛋白質及膜損傷,直接影響了細胞孤雌激活后胚胎的發育能力。
2.3 傳統去除法與微流控法對卵母細胞的影響
為探究微流控裝置用于卵母細胞低溫保護劑去除的有效性,比較了傳統的一步法、兩步法與微流控法對豬 MⅡ期卵母細胞的存活率和體外發育潛能的影響,結果如表 4 所示,其中對照組為不經過低溫保護劑加載及去除處理的 MⅡ期卵母細胞。
如表 4 所示,使用微流控法去除低溫保護劑時,卵母細胞的存活率(95.99% ± 4.64%)明顯高于一步法(52.5% ± 2.22%)和兩步法(63.25% ± 2.96%),與對照組卵母細胞存活率(98.53% ± 2.94%)相比,差異無統計學意義。不同處理方法得到的卵母細胞電激活并培養 7 d 后,由一步法處理得到的胚胎大部分都停留在了 4-細胞時期(35.66% ± 13.21%),極少數能跨越 4-細胞時期,但不能繼續發育至桑椹胚時期;由兩步法處理得到的胚胎在體外發育停滯時期分布的較為均勻,但能發育至桑椹胚階段的胚胎(18.01% ± 7.80%)與對照組(78.22% ± 1.34%)間的差異具有統計學意義(P < 0.01);由微流控法處理得到的胚胎停留在 4-細胞時期的數量幾乎只有兩步法的一半,大部分胚胎(74.17% ± 1.18%)都能跨越 8-細胞時期,發育至桑椹胚時期,其桑椹胚率與一步法組、兩步法組桑椹胚率相比差異具有統計學意義( P < 0.01)且與對照組桑椹胚率相比,差異無統計學意義。
已有研究表明兩步法加載(去除)時,細胞體積變化比一步法小[15],微流控法可以實現細胞周圍溶液濃度的緩慢增加或減少,細胞在加載(去除)過程中體積變化較傳統方法更小,因此微流控法細胞實驗結果優于傳統方法。此外,人類及豬胚胎基因組激活發生在 4-細胞到 8-細胞階段[24],因此能否成功跨越 4-細胞、8-細胞階段,對激活后的卵母細胞很關鍵,可以間接作為考量卵母細胞前期處理方法是否得當的依據。研究結果表明,微流控法能循序漸進地改變細胞周圍的生存環境,因此能夠使得大部分細胞都跨越 8-細胞時期。
3 結論
本文利用以微流控芯片為中心搭建的微混合系統,對豬 MⅡ期卵母細胞低溫保護劑的去除方案進行了優化研究。對微流控法的去除總時間、去除液成分及濃度進行了優化實驗,并比較了傳統的分步法去除與連續性去除對卵母細胞存活率及體外成熟發育的影響。實驗結果表明,使用傳統兩步法對卵母細胞加載保護劑后,采用微流控法去除保護劑,總去除時間 8 min 時,1 mol/L 蔗糖去除液最有利于卵母細胞低溫保護劑去除后的存活和體外發育;微流控法去除卵母細胞低溫保護劑后,卵母細胞的存活率、體外發育情況,均好于傳統去除方法。以上結論驗證了連續性去除法的有效性,為微流控法用于去除卵母細胞低溫保護劑提供了依據。
引言
自從 1986 年 Chen[1]低溫保存人類卵母細胞并最終成功實現妊娠以來,卵母細胞的低溫保存成為低溫生物醫學研究的重要內容,在臨床上逐漸呈現出大量的需求。雖然這一領域已經有了一系列重要突破[2-4],但卵母細胞低溫保存后的發育能力還是不高。影響卵母細胞冷凍效果的因素有很多,特別是在低溫保護劑的添加和去除過程中,滲透壓的急劇變化和高濃度低溫保護劑的化學毒性對卵母細胞造成的損傷很大。
為了減小細胞在低溫保護劑加載/去除操作中受到的損傷,有研究者將微流控芯片技術引入低溫保存領域[5-7]。該技術能使保護劑溶液和緩沖溶液在微流體通道內通過擴散方式混合,實現沿著通道方向保護劑濃度的連續改變,相比于需要將細胞在不同濃度溶液間轉移的傳統分步加載(去除)保護劑方式,可以大幅度減小分步法中由于溶液濃度突然變化造成的細胞體積突然變化,從而減小細胞受到的機械損傷及滲透性損傷。目前國內外針對微流控芯片用于低溫保護劑加載(去除)的研究中,研究者們已利用微流控裝置,實現了緩沖溶液對細胞內保護劑的連續性加載(去除),并通過改變細胞體積分數、細胞懸浮液及緩沖溶液流量、流速等參數,研究了細胞的加載(去除)方式及微流控裝置的加載(去除)效率,但其實驗材料多為肝細胞、紅細胞、淋巴細胞等小體積并能制成懸浮液的細胞[8-13]。而本文提及的類似卵母細胞這類大體積細胞,其滲透特性及在通道內的流動行為完全不同于小體積細胞,在臨床上多是單個細胞操作,因此在芯片設計上需要有單獨的溶液混合通道及細胞操作腔。目前僅有 Heo 等[14]制作了由溶液混合通道、卵母細胞操作腔、細胞進出通道等組成的微流控裝置,并將其用于研究卵母細胞低溫保護劑加載以及卵母細胞在異丙醇溶液中的滲透特性。而對于微流控裝置用于卵母細胞冷凍保護劑去除的相關研究,目前還未見報道。據 Paynter 等[15-16]的研究,卵母細胞在玻璃化保存后,細胞本身所能承受的機械應力會發生變化,對滲透壓也變得更為敏感,因此關注低溫保護劑的去除過程很有必要。
基于以上原因,本文設計制作了一種可用于卵母細胞低溫保護劑加載及去除的微流控芯片[17],對豬二次減數分裂中期(metaphase Ⅱ-stage,MⅡ-stage)(簡稱:MⅡ期)卵母細胞低溫保護劑的去除方案進行了優化研究。課題組首先比較了傳統的分步法去除與微流控連續性去除對卵母細胞存活率及體外成熟發育的影響,驗證連續性去除對卵母細胞的有效性;然后利用該裝置,對去除時總時間、去除液成分及濃度進行了優化,完善了微流控芯片用于卵母細胞低溫保護劑去除的實驗方案。本文研究結果表明,微流控連續性去除方法(以下簡稱:微流控法)去除低溫保護劑能夠減小對卵母細胞的損傷,從而可能進一步提高卵母細胞的低溫保存效果。
1 材料與方法
1.1 主要試劑
實驗中所用化學試劑除特別說明外,均購自 Sigma-Aldrich 公司,組織培養液 199(tissue culture meduium-199,TCM199)、胎牛血清(fetal bovine serum,FBS)購自 Gibco 公司,孕馬血清促性腺激素、人絨毛促性腺激素購自寧波市第三激素制品有限公司。
各試劑配比如下:
基礎液:TCM199 培養液 + 20% FBS;兩步法低溫保護劑Ⅰ:基礎液 + 7.5% 二甲基亞砜(dimethyl sulfoxide,Me2SO)+ 7.5% 乙二醇(ethylene glycol,EG);兩步法低溫保護劑Ⅱ:15% Me2SO + 15% EG + 0.5 mol/L 蔗糖;兩步法去除溶液Ⅰ:基礎液 + 0.3 mol/L 蔗糖溶液;兩步法去除溶液Ⅱ:基礎液 + 0.15 mol/L 蔗糖溶液;微流控法去除溶液分別采用:基礎液 +(0.5、1.0、2.0 mol/L)蔗糖、基礎液 +(0.5、1.0、2.0 mol/L)葡萄糖、基礎液 +(0.5、1.0、2.0 mol/L)海藻糖。
洗卵臺氏液:參照戴建軍[18]的配置方法,每次配制 500 mL,經 0.22 μm 濾器過濾后進行分裝,分裝后置于 4℃ 保存。
1.2 豬卵母細胞的采集和體外成熟培養
實驗中所用的豬卵母細胞取自上海市嘉定區某屠宰場采集的新鮮卵巢,放在 37℃ 的生理鹽水(含 500 IU 青(鏈)霉素)中,1 h 內運回實驗室,用帶有 18 G 針頭的 5 mL 注射器抽吸卵巢表面直徑 2~6 mm 卵泡的卵泡液并注入 15 mL 離心管中,37℃ 靜置 10 min,移除上清液,用少量洗卵臺氏液懸浮沉淀后,轉入直徑 10 cm 培養皿內進行卵母細胞收集。在體視顯微鏡(SMZ-168,MOTIC,日本)下撿取胞質均勻、包被 3 層或以上致密卵丘細胞的卵丘-卵母細胞復合體(cumulus oocyte complexes,COCs)用于體外成熟培養。
COCs 用洗卵臺氏液洗滌 2~3 次,再用 TCM199 培養液洗滌 2~3 次后,將細胞移入用 4 孔培養板,并置于 CO2 培養箱[(39 ± 0.5)℃、5%CO2、95% 空氣、飽和濕度](Forma Scientific,美國)中進行細胞體外成熟培養,每孔加入 500 μL 培養液(TCM199 培養液 + 10% FBS + 10% 豬卵泡液 + 10 IU/mL 孕馬血清促性腺激素 + 10 IU/mL 人絨毛膜促性腺激素),并在其上覆以滅菌礦物油,培養 42~46 h 后,得到 MⅡ期卵母細胞。實驗時,MⅡ期卵母細胞用 0.1% 透明質酸酶消化去除卵丘細胞,再用 TCM199 培養液洗滌 3~5 次,備用。
1.3 微流控芯片及微混合系統
微流控芯片由 Y 型入口、蛇形混合通道及細胞操作腔組成,Y 型通道入口長為 10 mm,蛇型通道長 17 mm,整個管道總長約為 135 mm,細胞操作腔內左右各設置有一排圓柱型障礙物,圓柱型底面直徑為 100 μm,兩圓柱型間隔為 50 μm,保證細胞在低溫保護劑加載或去除時,不易被溶液沖走。微混合系統如圖 1 所示。將微流控芯片放置于體視顯微鏡下,使用兩個微注射泵(Pump 11 Pico Plus Elite,Harvard,美國)和兩個 1 mL 平頭液相微量進樣針(上海高鴿工貿有限公司,中國),分別將低溫保護劑溶液和緩沖溶液注入芯片。
 圖1
微流控芯片及微混合系統
Figure1.
Microfluidic chip and microfluidic mixing system
圖1
微流控芯片及微混合系統
Figure1.
Microfluidic chip and microfluidic mixing system
1.4 卵母細胞冷凍保護劑去除方案
1.4.1 微流控法去除時間優化
如圖 2 所示,微流控法去除時間優化時,首先進行卵母細胞低溫保護劑兩步法加載:將消化好的細胞放入低溫保護劑Ⅰ中平衡 3 min 后,迅速轉移至低溫保護劑Ⅱ中平衡 30 s,然后進行保護劑微流控法去除。實驗中,基于文獻[26]及簡化實驗因素的原因,課題組暫未考慮其他兩種因素,僅選定 1 mol/L 蔗糖溶液作為微流控法去除液,故微流控法去除保護劑時,芯片的兩個入口處分別通入 1 mol/L 蔗糖溶液和 TCM199 培養液,設置 1 mol/L 蔗糖溶液流速占總流速的百分比從 100% 線性減小至 0%,TCM199 培養液的流速占總流速的百分比從 0% 線性增加至 100%,總流速為 5 μL/min,去除總時間分別設為 6 min、8 min、10 min。
 圖2
微流控法去除時間優化過程流程圖
Figure2.
Flowchart of the unloading time optimization of microfluidic removal method
圖2
微流控法去除時間優化過程流程圖
Figure2.
Flowchart of the unloading time optimization of microfluidic removal method
1.4.2 微流控法去除液成分及濃度優化
在優化微流控法去除溶液的種類和濃度時,操作過程如圖 3 所示,去除總時間選用 1.4.1 微流控法去除時間優化實驗中測定出存活率及體外發育情況最好時的去除總時間。選用的去除液組成及配比如表 1 所示。
 圖3
微流控法去除液成分及濃度優化過程流程圖
Figure3.
Flowchart of the composition and concentration of diluting solutions optimization of microfluidic removal method
圖3
微流控法去除液成分及濃度優化過程流程圖
Figure3.
Flowchart of the composition and concentration of diluting solutions optimization of microfluidic removal method
1.4.3 一步法、兩步法、微流控法去除
采用傳統兩步法對細胞進行低溫保護劑加載,再分別采用一步法、兩步法和微流控法進行保護劑去除,加載與去除過程如圖 4 所示。
 圖4
傳統方法與微流控法去除過程流程圖
Figure4.
Flowchart of traditional and microfluidic removal method
圖4
傳統方法與微流控法去除過程流程圖
Figure4.
Flowchart of traditional and microfluidic removal method
低溫保護劑兩步法加載:將消化好的細胞放入低溫保護劑Ⅰ中平衡 3 min 后,迅速轉移至低溫保護劑Ⅱ中平衡 30 s。一步法去除為:將加載后的細胞迅速移至 TCM199 培養液中,平衡 10 min。兩步法去除為:將加載后的細胞先轉移到兩步法去除液Ⅰ中,平衡 5 min 后,再轉移至去除液Ⅱ中,平衡 5 min。微流控法去除為:使用細胞口吸器將已加載了低溫保護劑的細胞移入微流控芯片中,芯片的兩個入口處分別通入 1.4.2 中優化出的微流控法去除液和 TCM199 培養液,設置微流控法去除液流速占總流速從 100% 線性減小至 0%,TCM199 培養液流速占總流速從 0 線性增加至 100%,總流速為 5 μL/min,去除總時間為 1.4.1 中優化出的去除時間。
1.5 卵母細胞保護劑去除方案效果評價
卵母細胞存活率檢測:采用二乙酸熒光素(fluorescein diacetate,FDA)染色法[19-20]檢測不同低溫保護劑加載去除方案對卵母細胞細胞膜及胞內酯酶系統完整性和活性的影響。將已去除低溫保護劑的卵母細胞放入 TCM199 培養液中洗滌 3 次,轉移至 10% FDA 染色液中,在培養箱中避光染色 5~10 min 后,再用 TCM199 培養液洗滌 3~5 次,立即拿到熒光顯微鏡(1XY71,OLYMPUS,日本)下進行觀察。胞質發熒光的卵母細胞視為有活力,不發熒光或熒光較弱的均視為死細胞。
卵母細胞體外發育能力檢測:采用電激活的方法對卵母細胞進行孤雌激活[21-23],檢測不同低溫保護劑加載去除方案對卵母細胞體外成熟發育的影響。將加載并去除低溫保護劑后的 MⅡ期卵母細胞放入電激活融合液中平衡 1~3 min,轉入鋪滿激活液的 0.5 mm 寬度的激活槽中,使用電融合儀(BTX2001,SanDiego,美國),在電場強度 1.2 kV/cm、脈沖時間 30 μs、1 次脈沖條件下對卵母細胞進行電激活處理。激活后的孤雌激活胚胎放入胚胎培養液中培養 4~5 h,再轉移至胚胎培養液中進行孤雌激活胚胎培養。激活后第 7 天觀察胚胎發育情況,統計胚胎所處的發育時。其中,卵裂后擁有 2、4、8、16 個細胞的胚胎分別為 2 細胞時期胚胎、4 細胞時期胚胎、8 細胞時期胚胎和 16 細胞時期胚胎,多于 16 個胞但還未分化出空腔的胚胎為桑椹胚時期胚胎。
1.6 數據分析
采用 SPSS Statistics 19.0 軟件中 One way ANOVA、Duncan’s 新復極差法進行分析,以 P < 0.05 作為差異是否具有統計學意義的評判標準。
2 結果與討論
2.1 微流控法不同去除時間對卵母細胞的影響
細胞在保護劑加載(去除)過程中暴露在保護劑中的時間,會增加保護劑滲透作用和化學毒性對細胞的損傷,因此,以傳統去除方法的總去除時間為依據[19],比較了微流控法不同去除時間對卵母細胞存活率和體外發育潛能的影響,結果如表 2 所示,其中對照組為不經過低溫保護劑加載及去除處理的 MⅡ期卵母細胞。
如表 2 所示,微流控法 8 min 去除方案下,細胞的存活率(95.99% ± 4.64%)與 6 min 組(73.33% ± 1.48%)和 10 min 組(76.74% ± 1.42%)相比,差異具有統計學意義(P < 0.01),與對照組卵母細胞存活率相比(98.53% ± 2.94%)差異無統計學意義。不同處理方法得到的卵母細胞電激活并培養 7 d 后,8 min 組僅有 17.08% ± 3.78% 的胚胎未能跨越 8-細胞時期,74.17% ± 1.18% 的胚胎都發育到了桑椹胚階段,與對照組(15.16% ± 4.98%;78.22% ± 1.34%)相比,差異無統計學意義;6 min 組存活率與 10 min 組相比,差異無統計學意義,但電激活后僅有 43.09% ± 2.70% 的胚胎發育到了桑椹胚時期,其桑椹胚率與 10 min 組(50.15% ± 3.94%)相比,差異具有統計學意義( P < 0.05)。這可能是因為,去除時間較短(6 min)時,相同注射模式下,細胞周圍溶液形成的濃度梯度較大,對細胞造成的滲透性損傷也較大,而去除時間較長(10 min)時,相同注射模式下,細胞周圍洗脫液形成的濃度梯度雖然較小,但細胞在洗脫液中暴露的時間過長,對細胞造成的毒性損傷抵消了濃度梯度較小帶來的優勢,不利于細胞后期的發育。
2.2 微流控法不同去除溶液對卵母細胞的影響
為了探究不同去除溶液對卵母細胞的影響,使用微流控法比較了不同濃度的蔗糖、葡萄糖、海藻糖去除液對 MⅡ期卵母細胞存活率及體外發育潛能的影響,結果如表 3 所示,其中對照組為不經過低溫保護劑加載及去除處理的 MⅡ期卵母細胞。
如表 3 所示,3 種去除液中,0.5 mol/L 組和 1 mol/L 組存活率及體外成熟發育情況均優于 2 mol/L 組。原因可能是 2 mol/L 組去除液濃度過高,使得細胞在去除過程中體積發生變化,增加了細胞需承受的機械應力,造成了細胞的滲透性損傷。雖然大部分 0.5 mol/L 組的存活率及體外發育情況與 1 mol/L 組相比,差異無統計學意義,但不同去除液處理得到的卵母細胞 0.5 mol/L 組的桑椹胚率普遍略低于 1 mol/L 組。比如 0.5 mol/L 蔗糖組與 1 mol/L 蔗糖組相比,有 7.97% ± 5.37% 的胚胎滯留在了 16-細胞階段,因此其桑椹胚率略低于 1 mol/L 蔗糖組和對照組,造成這一現象的原因可能是 0.5 mol/L 去除液能提供給細胞的滲透壓小于 1 mol/L 組,細胞受到的滲透性損傷及殘留在細胞中的低溫保護劑造成的毒性損傷,影響了卵母細胞的存活率及體外發育情況。
另外,3 種去除液中,蔗糖、葡萄糖的效果均好于海藻糖。0.5 mol/L、1 mol/L 蔗糖組和 1 mol/L 葡萄糖組的細胞存活率分別能達到 96.61% ± 3.99%、95.99% ± 4.64% 和 95.06% ± 5.89%,三者相比差異無統計學意義,且三者與對照組(98.53% ± 2.94%)相比,差異無統計學意義,但海藻糖組存活率與對照組相比差異均有統計學意義(0.5 mol/L、1/mol/L 海藻糖去除液組 vs. 對照組,P < 0.05;2 mol/L 海藻糖去除液組 vs. 對照組,P < 0.01)。不同去除液處理得到的卵母細胞電激活并培養 7 d 后,僅 1mol/L 蔗糖去除液組的桑椹胚率(74.17% ± 1.18%)與對照組(78.22% ± 1.34%)相比,差異無統計學意義。葡萄糖組中 1 mol/L 組與蔗糖 1 mol/L 組相比,滯留在 16-細胞時期的胚胎數較多(7.74% ± 0.84%),因此桑椹胚率略低于蔗糖 1 mol/L 組。海藻糖組中體外發育較好的 1 mol/L 組也和葡萄糖組類似,但細胞本身存活率就低,因此體外成熟發育情況最不理想。
糖類對細胞起到的保護作用十分復雜,已有研究表明,相比于二糖,單糖是較好的滲透緩沖液[25],但從以上 3 種不同去除溶液的實驗結果來看,1 mol/L 蔗糖去除液最有利于卵母細胞低溫保護劑去除后的存活和體外發育,這可能是因為蔗糖在細胞脫水時能通過氫鍵與大分子中極性殘基結合,因而具有穩定蛋白質與膜的作用[26];海藻糖溶液雖然在脫水環境中保護細胞蛋白質和膜的機制類似于蔗糖[27],但卻不是很好的滲透壓緩沖液;葡萄糖溶液在去除時雖然是很好的滲透壓緩沖液,但不具有類似蔗糖穩定蛋白質分子的機制,造成的蛋白質及膜損傷,直接影響了細胞孤雌激活后胚胎的發育能力。
2.3 傳統去除法與微流控法對卵母細胞的影響
為探究微流控裝置用于卵母細胞低溫保護劑去除的有效性,比較了傳統的一步法、兩步法與微流控法對豬 MⅡ期卵母細胞的存活率和體外發育潛能的影響,結果如表 4 所示,其中對照組為不經過低溫保護劑加載及去除處理的 MⅡ期卵母細胞。
如表 4 所示,使用微流控法去除低溫保護劑時,卵母細胞的存活率(95.99% ± 4.64%)明顯高于一步法(52.5% ± 2.22%)和兩步法(63.25% ± 2.96%),與對照組卵母細胞存活率(98.53% ± 2.94%)相比,差異無統計學意義。不同處理方法得到的卵母細胞電激活并培養 7 d 后,由一步法處理得到的胚胎大部分都停留在了 4-細胞時期(35.66% ± 13.21%),極少數能跨越 4-細胞時期,但不能繼續發育至桑椹胚時期;由兩步法處理得到的胚胎在體外發育停滯時期分布的較為均勻,但能發育至桑椹胚階段的胚胎(18.01% ± 7.80%)與對照組(78.22% ± 1.34%)間的差異具有統計學意義(P < 0.01);由微流控法處理得到的胚胎停留在 4-細胞時期的數量幾乎只有兩步法的一半,大部分胚胎(74.17% ± 1.18%)都能跨越 8-細胞時期,發育至桑椹胚時期,其桑椹胚率與一步法組、兩步法組桑椹胚率相比差異具有統計學意義( P < 0.01)且與對照組桑椹胚率相比,差異無統計學意義。
已有研究表明兩步法加載(去除)時,細胞體積變化比一步法小[15],微流控法可以實現細胞周圍溶液濃度的緩慢增加或減少,細胞在加載(去除)過程中體積變化較傳統方法更小,因此微流控法細胞實驗結果優于傳統方法。此外,人類及豬胚胎基因組激活發生在 4-細胞到 8-細胞階段[24],因此能否成功跨越 4-細胞、8-細胞階段,對激活后的卵母細胞很關鍵,可以間接作為考量卵母細胞前期處理方法是否得當的依據。研究結果表明,微流控法能循序漸進地改變細胞周圍的生存環境,因此能夠使得大部分細胞都跨越 8-細胞時期。
3 結論
本文利用以微流控芯片為中心搭建的微混合系統,對豬 MⅡ期卵母細胞低溫保護劑的去除方案進行了優化研究。對微流控法的去除總時間、去除液成分及濃度進行了優化實驗,并比較了傳統的分步法去除與連續性去除對卵母細胞存活率及體外成熟發育的影響。實驗結果表明,使用傳統兩步法對卵母細胞加載保護劑后,采用微流控法去除保護劑,總去除時間 8 min 時,1 mol/L 蔗糖去除液最有利于卵母細胞低溫保護劑去除后的存活和體外發育;微流控法去除卵母細胞低溫保護劑后,卵母細胞的存活率、體外發育情況,均好于傳統去除方法。以上結論驗證了連續性去除法的有效性,為微流控法用于去除卵母細胞低溫保護劑提供了依據。