動脈粥樣硬化性心臟病是嚴重危害人類生命健康的心血管疾病。近年來其主要的治療手段是將血管內支架植入到病變部位,支撐血管并重建血運。然而,大量研究表明,血管內支架植入的介入操作、抗增殖藥物釋放均會對血管內皮造成極大的損傷,大大增加了支架內再狹窄和晚期血栓形成的風險。維持血管內皮的完整和正常功能可明顯降低支架植入帶來的一系列風險。研究表明,干細胞動員、歸巢、分化、增殖是血管內支架植入后血管內皮修復的主要機制,多種血管內因子、力學微環境變化等均參與此過程,進而影響植入部位的再內皮化。本文對支架植入造成血管內皮損傷的過程、損傷后的修復機制及其影響因素等進行詳細闡述,并分析總結其修復策略,為深入理解支架內再狹窄、血管內皮化延遲和晚期血栓形成的機制以及新型藥物洗脫支架和生物可降解支架的設計提供參考。
引用本文: 席亞東, 黃玉華, 杜若林, 王亞洲, 王貴學, 尹鐵英. 血管內支架植入后的內皮損傷及其修復策略. 生物醫學工程學雜志, 2018, 35(2): 307-313. doi: 10.7507/1001-5515.201612008 復制
版權信息: ?四川大學華西醫院華西期刊社《生物醫學工程學雜志》版權所有,未經授權不得轉載、改編
引言
目前,全國有心血管病患者 2.9 億,其死亡率居各種疾病之首[1]。經皮冠狀動脈介入治療(percutaneous coronary intervention,PCI)等能快速重建血運,恢復缺血心肌的血供,并以高效、微創的優勢成為目前最重要、最有效的心血管疾病診療技術,已廣泛應用于臨床治療。血管內皮細胞(vascular endothelial cells,VECs)是血管壁與血液之間的分界細胞,其不僅具有物質交換、分泌和屏障的功能,還在抗炎、抗血栓、調節血管張力等方面具有重要的生物學意義,與心血管疾病的發生、發展具有密切聯系。血管內支架植入等介入操作對血管內壁的擠壓和擦傷、支架上裝載的抗內膜增生藥物、金屬支架絲的持續刺激等都會造成內膜的損傷,進而引發血栓形成、血管平滑肌細胞(vascular smooth muscle cells,VSMCs)增殖,最終導致支架內再狹窄(in stent restenosis,ISR)和晚期血栓形成[2]。可以說,支架植入后對內皮的損傷是諸多風險發生的始動環節。因此,在血管支架植入后,如何盡快恢復內膜的完整與功能成為治療 ISR 和晚期血栓的關鍵。本文對支架植入造成內皮損傷的過程、修復機制及其影響因素進行了詳細闡述,并對其修復策略進行分析總結,為深入理解 ISR、血管內皮化延遲和晚期血栓形成的機制以及新型藥物洗脫支架和生物可降解支架的設計提供參考。
1 血管內支架植入后的 VECs 損傷及其修復機制
1.1 損傷的過程及影響因素
支架植入即刻,由于球囊擴張和支架植入引起的摩擦、張應力、壓迫等力學刺激,使血管內皮的完整性受到損壞,而暴露在血液中的中膜彈力板易黏附并激活血小板等血液成分,繼而形成血栓。同時,該過程還會激活炎癥反應,產生一系列生長因子和細胞因子,導致 VSMCs 在血管壁增殖。在這個過程中,VSMCs 發生表型轉換,分泌大量胞外基質,增加內膜厚度,從而引起 ISR[3]。此外,支架擴張不足、聚合物斷裂、金屬支架本身等也會引起炎癥反應,延遲局部再內皮化,導致一系列術后風險增加[4]。
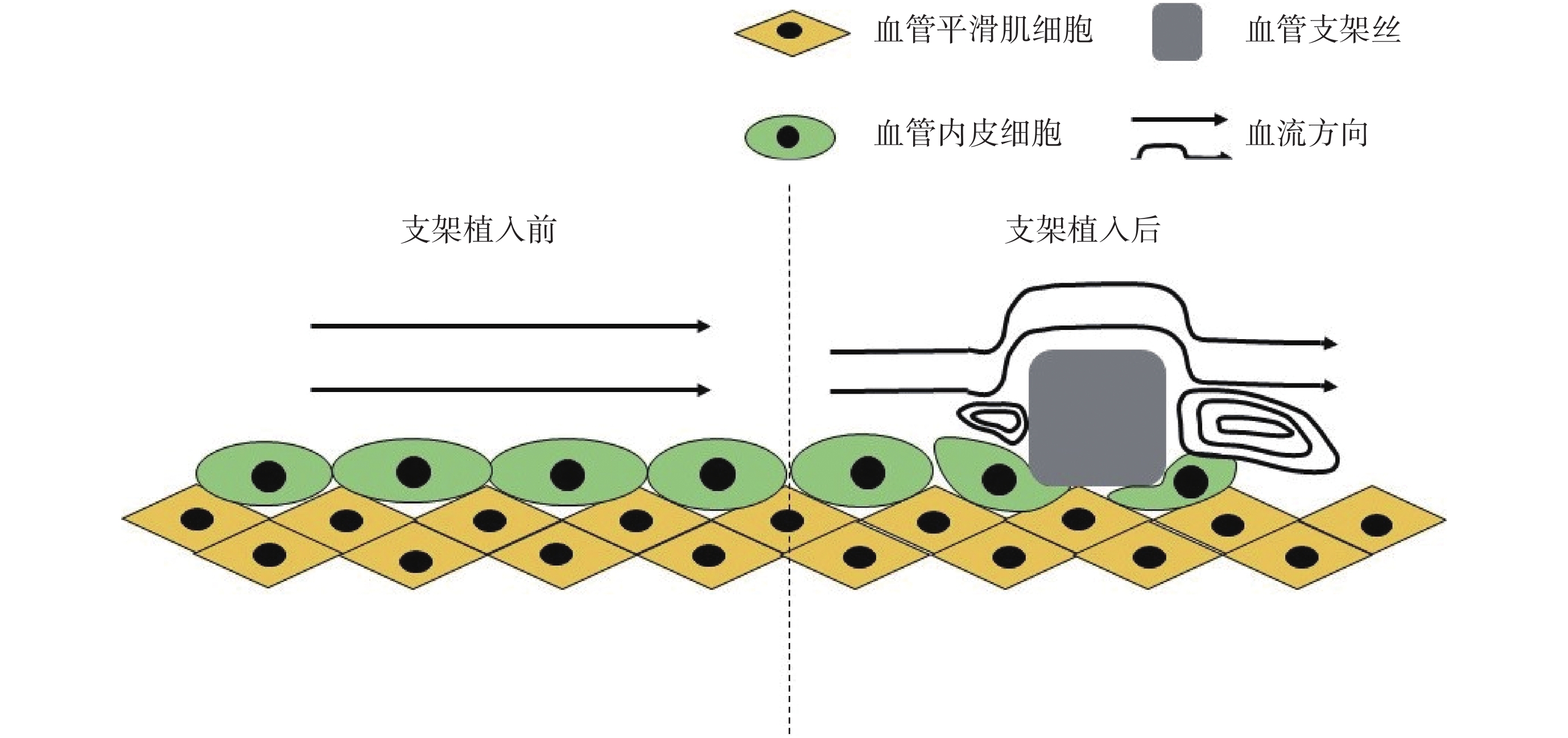
血管內支架作為異物,會極大影響植入部位的血流動力學環境,也會影響內皮損傷后的修復進程。除對血管內壁形成壓迫外,支架絲貼合血管壁后形成的凸起會深刻影響內膜表面形貌,血液流經支架植入部位會在支架絲附近形成渦流或紊流等低剪切力區域,而支架絲的厚度、間距、走向等都會通過產生局部震蕩流、渦流影響 VECs 調控基因的表達,進而影響 VECs 的結構、功能,導致內皮功能障礙,抑制支架損傷后的再內皮化[5]。由于支架植入導致的力學環境影響如圖 1 所示。
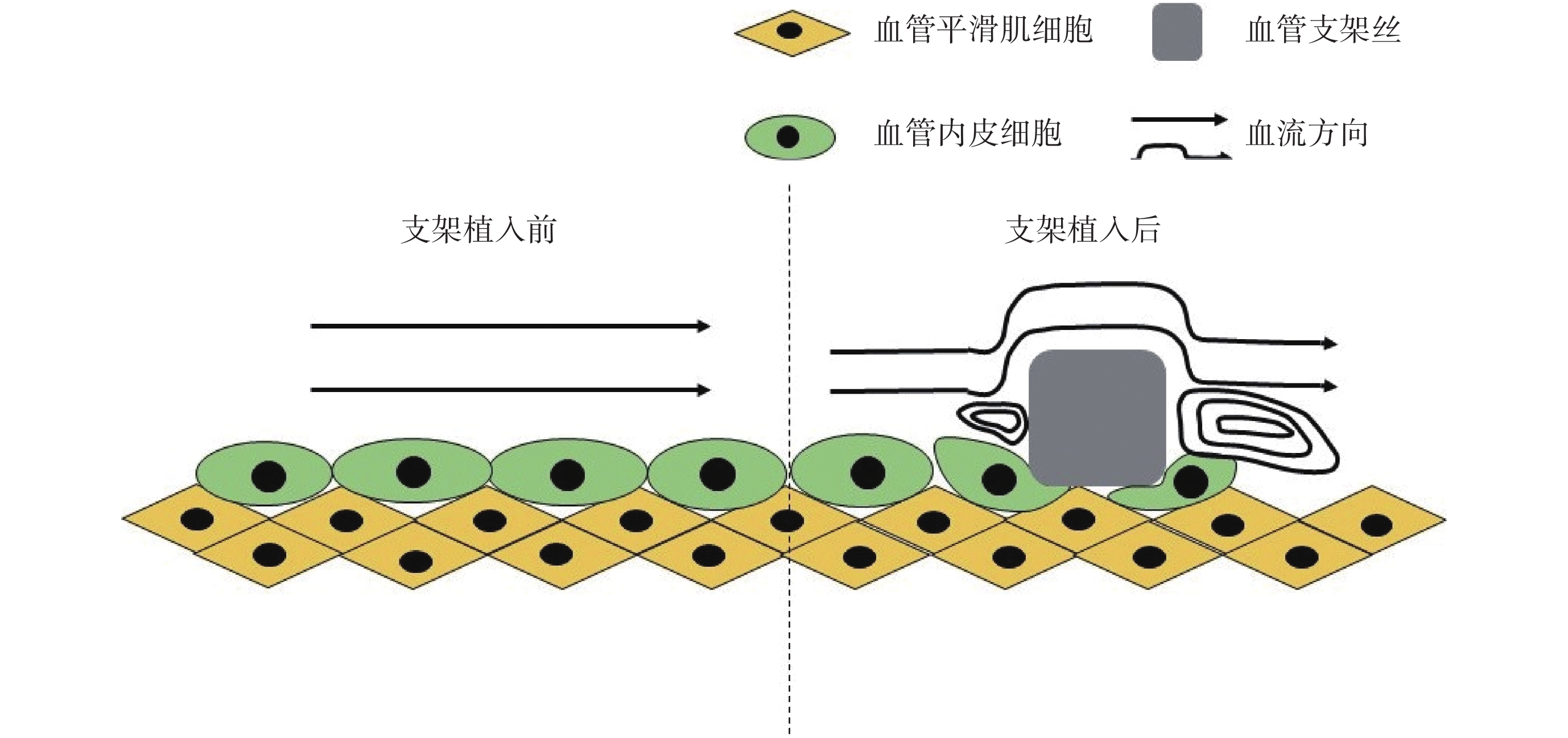 圖1
支架植入前后局部血流變化示意圖
Figure1.
Local blood flow diagram before and after stent implantation
圖1
支架植入前后局部血流變化示意圖
Figure1.
Local blood flow diagram before and after stent implantation
此外,目前廣泛應用的可在支架植入局部實現藥物控釋的藥物洗脫支架(drug eluting stents,DES)所裝載的藥物以及載藥涂層等可能會對 VECs 造成化學和炎癥損傷。DES 植入后,根據術后風險可將植入部位的病理變化分為三個階段。第一階段(植入即刻至 1 個月),藥物會大量釋放,即爆釋效應,在短時間內局部濃度過高的藥物會對血管內膜造成損傷,有產生急性和亞急性血栓的危險。第二階段是支架植入后受損血管部位內皮修復的重要階段。支架表面開始覆蓋新生組織,但延遲的或不完全的內皮化有可能會導致血栓的形成和 ISR 的發生。第三階段通常發生在植入 3 個月以后,當支架進一步嵌入在血管組織中,可能會導致晚期血栓和胞外基質沉積等引起的 ISR[6]。此外,裝載藥物的類型、劑量,涂層材料的選擇、制備工藝等均會影響到內膜增生、血栓及炎癥形成,而優良的藥物緩控釋涂層可以促進 VECs 增殖并加快支架表面再內皮化進程。其主要參數包括藥物在支架涂層中的擴散系數、溶解常數、藥物結合(吸收)率以及藥物與血管壁之間的透壁交換量等[7]。
1.2 修復的細胞來源
傳統觀點認為,血管內皮損傷后的修復主要依賴于損傷兩端鄰近的成熟 VECs 的遷移和增殖,修復程度不僅取決于損傷區域的大小,且極易受到局部非特異性抗增殖藥物的影響。研究證實,干細胞修復是 VECs 損傷修復一個非常重要的途徑[8],主要包括內皮祖細胞(endothelial progenitor cells,EPCs)、間充質干細胞(mesenchymal stem cells,MSCs)、血管壁原位干(祖)細胞(vascular wall-resident stem and progenitor cells,VW-SCs)等的參與。
1.2.1 骨髓來源干細胞
EPCs、MSCs 是來源于骨髓并參與內皮修復的主要干細胞。正常人體外周血中 EPCs 含量極低,局部血管損傷、急性心肌梗死、缺血及細胞因子等刺激會促使 EPCs 從骨髓動員進入外周血中,循環血中 EPCs 數量明顯增加,并逐漸遷移到損傷部位,修復血管損傷,促進血管新生,維持血管內皮的完整性[9]。
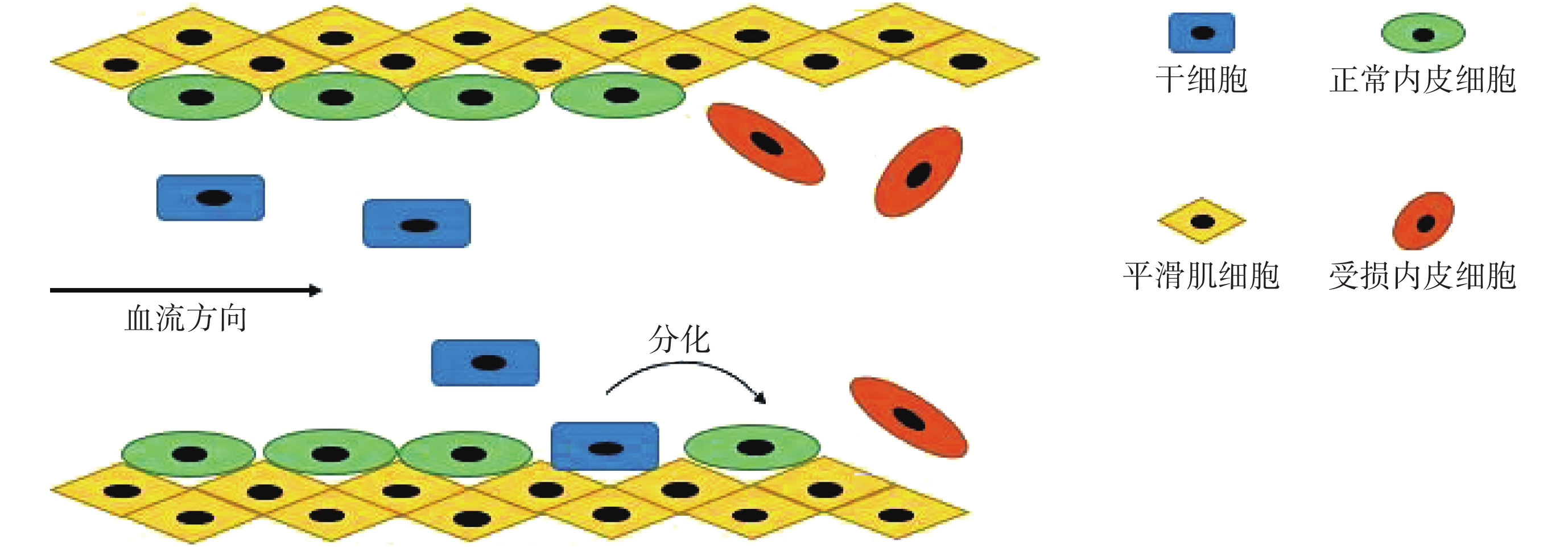
MSCs 與 EPCs 修復受損內皮的機制非常相似,如圖 2 所示。支架植入對血管內皮造成損傷后,EPCs、MSCs 在多種生物、力學等因子的刺激下從原始聚居部位啟動并轉移入血液循環,到達支架植入部位后歸巢至損傷血管局部,在一定的力學環境及生物因子的誘導下分化為 VECs,修復損傷的 VECs,同時抑制新生內膜增生。眾多動物及人體試驗結果表明,在一定的剪切力刺激下,不同類型和來源的 MSCs 均有分化成為 VECs 的潛力[10]。
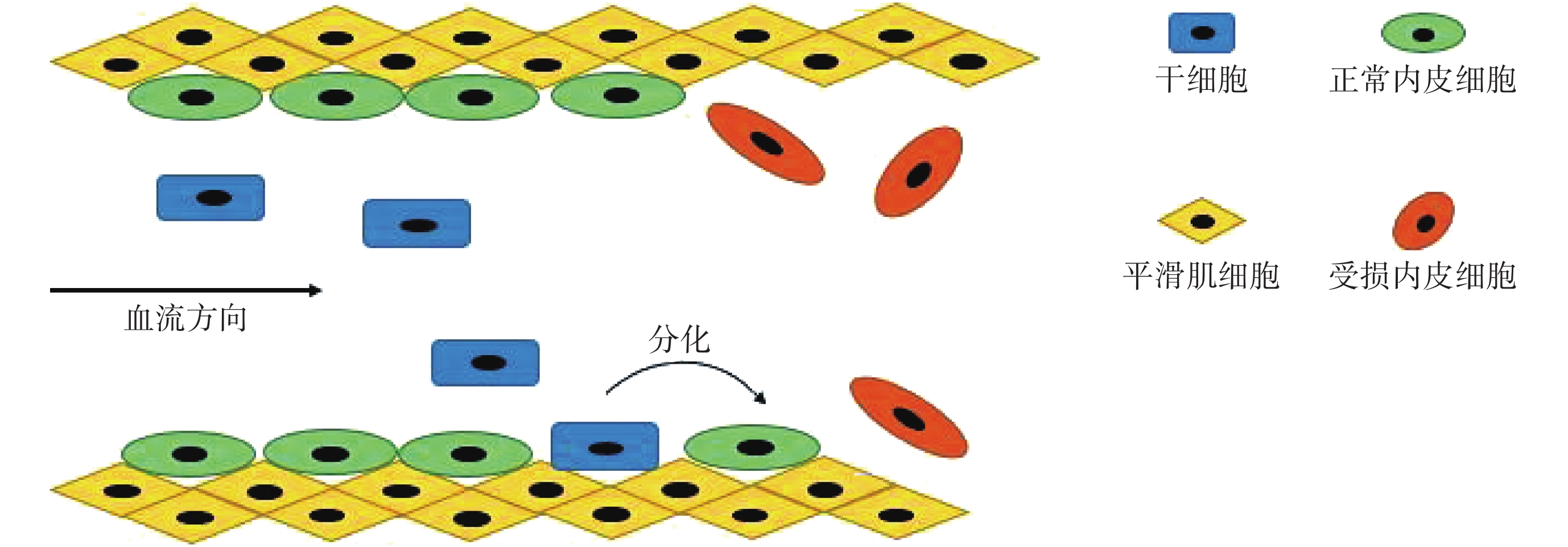 圖2
VECs 損傷后干細胞修復機制示意圖
Figure2.
Stem cells repair mechanism after endothelial injury
圖2
VECs 損傷后干細胞修復機制示意圖
Figure2.
Stem cells repair mechanism after endothelial injury
1.2.2 血管壁原位干(祖)細胞
VW-SCs 是骨髓外修復內皮的主要細胞來源。血管外膜可能通過參與細胞表型轉化、增殖、凋亡、遷移等生理活動,在血管生長、維持血管穩態、功能調節以及血管重構、鈣化和纖維化等過程中發揮重要作用。有研究顯示,VW-SCs 在特定條件下能轉移、分化為 VSMCs。Yu 等[11]對趨化因子干細胞抗原 1(stem cell antigen-1,Sca-1+)基因敲除小鼠血管內壁進行導絲損傷處理后發現,Sca-1+干細胞無法從外膜轉移至內膜以促進內膜增生。他們認為,內膜損傷后 VSMCs 可能通過趨化因子 C-C 受體 2/Ras 相關 C3 肉毒素底物 1(ras-related C3 botulinum toxin substrate 1,Rac-1)/p38 絲裂原活化蛋白激酶(p38 mitogen-activated protein kinases,p38 MAPKs)和趨化因子 C-X-C 受體 2/Rac-1/p38 MAPKs 兩條信號通路誘導 VW-SCs 由外膜轉入內膜并分化為 VSMCs,導致內膜增生。但也有研究認為,VW-SCs 也具有分化為 VECs 的能力,可能是支架植入后修復 VECs 損傷的重要細胞來源。Campagnolo 等[12]研究結果顯示,白藜蘆醇可以通過微小 RNA 21/蛋白激酶 B/β-鏈蛋白信號通路作用于 VW-SCs,并誘導諸如跨膜糖蛋白 CD31、鈣粘蛋白和內皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)等 VECs 標志物的表達,其小鼠實驗中白藜蘆醇可以減少病變的結果也印證了這一點。
1.3 修復的主要影響因子
支架植入局部因機械損傷、炎癥反應等對內膜造成損傷后,受損血管局部會產生響應機制,分泌血管內皮生長因子(vascular endothelial growth factor,VEGF)、粒細胞集落刺激因子(granulocyte colony stimulating factor,G-CSF)等重要的生物活性因子,進一步動員 EPCs、MSCs 分化為 VECs 或促進周圍 VECs 分裂增殖,修復局部 VECs 損傷,促進再內皮化。
其中,VEGF 是一種重要的 EPCs 動員的調節因子,它能特異性促進 VECs 的分裂與增殖。而成纖維細胞生長因子(fibroblast growth factor,FGF)能促進 VECs 的增殖、遷移,并且促進管腔的形成。G-CSF 則作為一種血液生長因子,可以動員更多外周血中的 EPCs,提升循環中的 EPCs 數量和功能,提高 EPCs 的增殖分化潛力,加速受損心肌和血管修復[13]。另外,還有一類生物活性因子——雌激素,其作為一類有廣泛生物活性并具有一定心血管保護作用的類固醇化合物,主要有雌二醇、雌三醇、雌酚等。支架植入對內皮造成損傷后,雌激素可以促進 EPCs 的歸巢、分化,修復受損部位,促進再內皮化,改善心肌供血,保護心血管健康[14]。
除了上述生物活性因子外,生物力學刺激也是影響干細胞分化的重要因素。研究發現高剪切力有助于 MSCs 的 VECs 標志成分如 VEGF 水平的明顯提高,而諸如 α-肌動蛋白(α-smooth muscle actin,α-SMA)、鈣結合蛋白等 VSMCs 標志表達水平則明顯降低[10]。
支架植入后造成的內皮損傷,不僅會刺激各類生物因子的表達,引起一系列促 VSMCs 的增殖反應,還會改變局部力學環境,刺激 VSMCs 的表型轉換、增殖和遷移。影響該過程的生物因子很多,而干細胞的歸巢、分化作為重要的內皮修復機制已經展開了廣泛研究。細胞、分子機制研究的積累為支架植入后 VECs 損傷的修復策略提供了相應的依據。
2 血管內支架植入后造成 VECs 損傷的修復策略
支架植入后球囊和支架的機械擠壓、涂層藥物的抗細胞增殖作用等將導致血管內皮損傷,進而導致內膜增生,最終引起 ISR 和晚期血栓的發生。因此,快速內皮化、盡快恢復受損部位的內皮功能,是解決支架植入后諸多問題的核心環節。促進支架植入后受損內皮的修復主要包括藥物治療、支架改進以及細胞治療等。
2.1 藥物治療與支架改進
2.1.1 促 VECs 修復的藥物
現在應用較多的治療內皮損傷的藥物、生物因子包括 VEGF、FGF、G-CSF、過氧化物酶體增殖物激活受體激動劑、他汀類等。
生物活性因子類藥物中以 VEGF 研究最多,其在促進內皮修復當中使用也最為廣泛。VEGF 不僅能夠促進 VECs 的分裂、增殖和功能恢復,還能夠作用于干細胞。用 VEGF 修飾的血管支架生物涂層,VECs 可以在其上附著,活力和增殖能力明顯增強,而且能夠誘導外周血中的 MSCs 向 VECs 方向分化[15],具有很好的促進內皮修復的效果。Song 等[16]首先將多巴胺(dopamine,DA)與肝素(heparin,Hep)共混交聯,在 316L 不銹鋼表面制備了 DA-Hep 涂層,而后通過浸泡的方法制備了兼有 VEGF 和跨膜糖蛋白 CD34 的新型涂層。該涂層能進一步加快內皮修復,減少支架在血液中的暴露時間,抑制急性、亞急性及血栓形成。這為促進血管再內皮化 DES 的研發提供了一個新的思路與平臺。
非生物因子類藥物以他汀類最具代表性。他汀類藥物可以增加循環 EPCs 的數量,增強其修復內皮損傷的功能[17]。在支架植入后,可以采取口服、支架載藥等方式實現他汀類藥物對受損部位內皮修復的功能。
2.1.2 支架載藥系統改進
DES 植入后的幾個小時內,藥物釋放往往會發生暴釋效應,急劇升高的局部藥物濃度會對血管內皮造成損傷,同時抑制 VECs 的生長,延遲血管受損部位再內皮化進程,導致急性血栓和亞急性血栓形成,最終導致晚期血栓和 ISR。此外,載藥聚合物的持續刺激也會引起血管內壁的炎癥,抑制內皮的修復。
針對 DES 出現的上述諸多問題,國內外研究者們開展了對支架的結構、載藥系統等設計與優化的研究,包括涂層材料優選、制備工藝優化、涂層及支架本體設計等。Saito 等[18]設計出了一種外腔梯度變化涂層。實驗結果表明,相對于傳統均勻滿載的 DES,該涂層結合西羅莫司支架植入兔子髂骨動脈 2 周后,內腔表面就已經完全被 VECs 覆蓋,且其抗血栓效果也遠優于傳統 DES。Zhu 等[19]設計了一種新穎的腔外充填生物可降解聚合物西羅莫司洗脫支架,雖然西羅莫司含量僅為傳統 DES 的 1/3,但其在保持傳統 DES 優異機械性能的同時,能較好地控制藥物釋放,維持安全和有效的局部藥物濃度,且并未出現局部或系統風險。此外,國內還設計出了一種無聚合物紫杉醇微盲孔載藥支架,對支架本體進行了凹槽設計,即在支架絲表面布有的微米級蜂窩狀小坑裝載藥物,可有效避免聚合物引發的血管壁炎癥及超敏反應,減弱了支架對內皮修復的持續干擾和抑制作用,減少了對內皮造成的損傷,降低血栓事件及 ISR 發生的風險[20]。
2.1.3 生物可降解支架
傳統不可降解金屬 DES 由于其不可降解性會帶來一系列后遺癥及風險。生物可降解支架在完成早期力學支撐后,于適當的時期開始降解,既減少了支架持續支撐所導致的內皮損傷,同時也解決了遠期支架殘留對再內皮化的阻礙。生物可降解支架的降解產物能夠完全被人體吸收或排出體外,是一種內皮友好型血管支架。常見的可降解支架主要有可降解聚合物支架和可降解金屬支架兩類。
目前,較為常用的可降解聚合物支架所采用的聚合物材料有聚乳酸(polylactic acid,PLA)、聚左旋乳酸(poly-l-lactic acid,PLLA)和聚羥基乙酸/聚乳酸共聚物等,其突出優點是生物相容性良好、降解速度可調、機械性能可控、降解產物無毒且能被吸收或排出體外[21]。
可降解金屬支架材料主要包括鎂合金和鋅合金。可降解鎂合金支架具有理想的機械支撐力、良好的生物相容性、新生內皮化迅速、血栓發生率低、易于降解(2~3 個月)等諸多優點。陳亮等[22]將新型鎂合金支架植入兔子腹主動脈后,支架于 180 d 左右完全降解,該支架能為血管重塑期管壁提供一定的支撐作用,防止晚期 ISR。而鋅合金支架作為可降解金屬支架研究新的熱點,正以其適宜的降解速度、良好的機械性能和生物相容性得到研究者的關注。Kubasek 等[23]通過配比不同鋅鎂含量篩選出一種 Zn-0.8 Mg 的鋅合金,其在具有優異的機械性能、合適的降解速率的同時,對成纖維細胞 L-929 和人骨肉瘤細胞并未顯示出細胞毒性,有望成為理想的血管植入材料。Bowen 等[24]采用鋅絲穿刺植入大鼠腹主動脈的方法進行鋅合金的體內研究。實驗結果顯示,鋅絲的植入并未產生慢性毒性,且在植入部位其能夠較好地抑制周圍 VSMCs 的活性,從而抑制內膜增生,因此在體內支架植入領域具有廣闊的應用前景。
2.2 細胞治療
細胞治療方法是指以細胞種植、細胞捕獲支架等為主要構想的在受損部位或支架表面種植干細胞、VECs,或是包被 EPCs、MSCs 等特異性捕獲抗體的方法,該方法在 VSMCs 增生之前可快速修復受損的內皮組織,促進 VECs 向損傷部位遷移,同時釋放活性因子抑制 VSMCs 過度增生和血栓的形成。
2.2.1 細胞種植支架
根據種植細胞的種類不同,可將細胞種植支架分為 VECs 種植支架和干細胞種植支架兩類。
VECs 種植支架是將支架在體外培養、包覆 VECs 后植入體內,具有活性表面的 VECs 種植支架有促再內皮化的作用。Wu 等[25]構建血管內皮生長因子 121(VEGF121)過表達慢病毒載體并轉染 VECs,將采用超聲霧化工藝噴涂明膠的 316L 不銹鋼與該轉染 VECs 旋轉共培養,得到 VECs 種植支架。該支架可以促進血管支架植入受損部位的再內皮化過程,并且能夠明顯地減少新生內膜面積,具有很大的應用潛力。
干細胞種植支架是在支架表面包覆 EPCs、MSCs 等干細胞,通過迅速促進 VECs 再生來預防 PCI 術后的并發癥。Shirota 等[26]設計了一種覆蓋于微孔薄層聚氨酯膜之上的光固化明膠涂層支架,將其放入從犬外周血中提取的 EPCs 的基質中培養,直到 EPCs 完全覆蓋支架表面,然后將支架植入人造血管組織。7 d 的培養結果發現,EPCs 不僅覆蓋于血管腔面,而且覆蓋于支架腔內側面,表明 EPCs 從支架中遷移、增殖,并在支架和鄰近血管處形成了完全內皮化的管腔。Hwang 等[27]設計出了一種納米纖維支架套管,該支架具有半透性,可以將 MSCs 包覆其內,MSCs 分泌的旁分泌因子可以增強植入局部自我修復能力。動物實驗結果顯示,該種支架沒有出現栓塞和免疫排斥反應,這無疑為干細胞種植支架提供了一個嶄新的思路。
2.2.2 細胞捕獲支架
由于外周血中的 EPCs、MSCs 等干細胞數量非常少,自然狀態下的修復十分緩慢,可自動識別并特異性“捕捉”EPCs 等干細胞的細胞捕獲支架應運而生。該類血管支架將特異性抗體包覆于支架表面,可以有效捕捉外周血中的干細胞,覆蓋在植入部位表面并迅速分化為 VECs 用于再內皮化。Wu 等[28]對跨膜糖蛋白 CD133、CD34 抗體捕獲支架進行了深入研究,實驗結果表明,無論在靜態環境還是在流動剪切力加載條件下,抗體涂層支架捕獲 EPCs 的能力均明顯高于對照。楊峰等[29]制備的雷帕霉素聯合 CD34 抗體復合支架在體外可以有效地捕捉 EPCs。在支架植入動物體內 48 h 后支架表面被完全覆蓋,表現出了較高的捕獲效率和促進 VECs 增殖的能力,具有極大的應用潛力。
3 展望
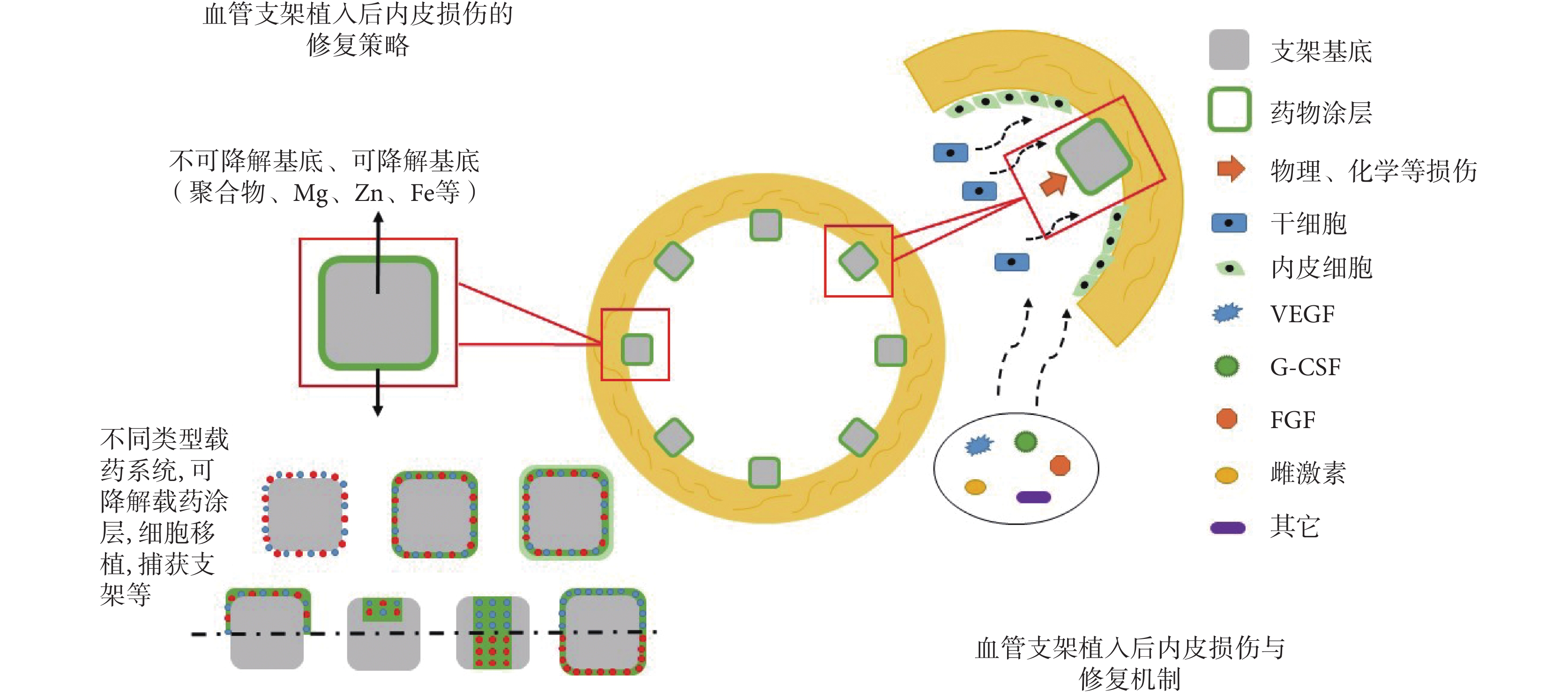
VECs 在冠狀動脈粥樣硬化性心臟病的發生發展以及心血管支架植入后的治療中發揮重要作用。血管內支架植入后再內皮化進程的延緩是導致后期一系列風險的始動環節,因此支架植入后迅速再內皮化是解決血管內支架植入后血栓形成和提高遠期通暢率的有效方法。干細胞能夠在內皮損傷后的動員、歸巢、遷移和分化,對修復內皮損傷具有重要積極的意義,是支架植入后修復的重要機制。針對當下支架植入后的問題,通過構建新型促進內皮修復的支架涂層、載藥系統、可降解支架、細胞種植支架、細胞捕獲支架等方式,可以有效促進植入初期受損部位的再內皮化過程,如圖 3 所示。其中生物可降解支架因其全降解性、內皮友好性,顯示出巨大的優勢,有望成為心血管疾病介入治療的主要手段,有廣大的發展與應用空間。
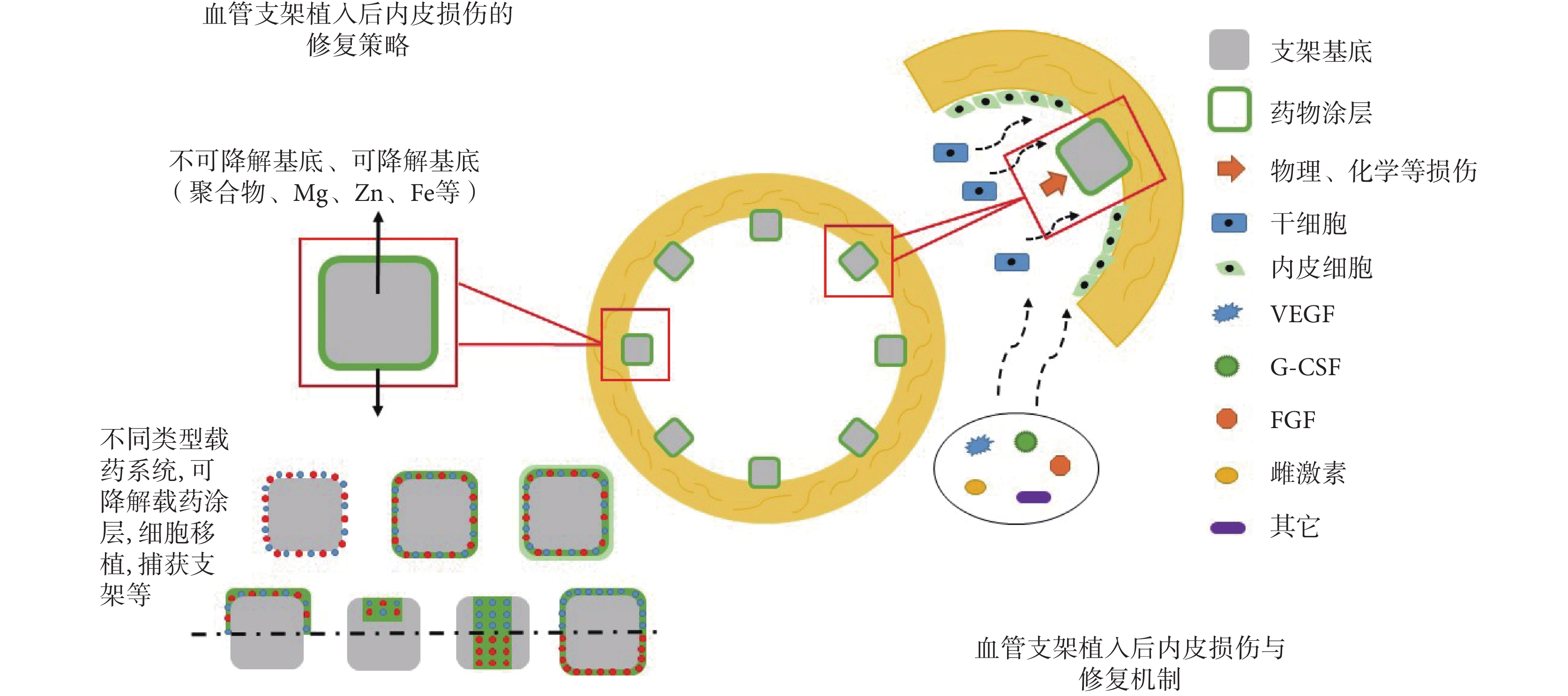 圖3
血管內支架植入后的 VECs 損傷及其修復策略
Figure3.
Mechanisms of endothelial injury and strategies of its reparation after vascular stent implantation
圖3
血管內支架植入后的 VECs 損傷及其修復策略
Figure3.
Mechanisms of endothelial injury and strategies of its reparation after vascular stent implantation
引言
目前,全國有心血管病患者 2.9 億,其死亡率居各種疾病之首[1]。經皮冠狀動脈介入治療(percutaneous coronary intervention,PCI)等能快速重建血運,恢復缺血心肌的血供,并以高效、微創的優勢成為目前最重要、最有效的心血管疾病診療技術,已廣泛應用于臨床治療。血管內皮細胞(vascular endothelial cells,VECs)是血管壁與血液之間的分界細胞,其不僅具有物質交換、分泌和屏障的功能,還在抗炎、抗血栓、調節血管張力等方面具有重要的生物學意義,與心血管疾病的發生、發展具有密切聯系。血管內支架植入等介入操作對血管內壁的擠壓和擦傷、支架上裝載的抗內膜增生藥物、金屬支架絲的持續刺激等都會造成內膜的損傷,進而引發血栓形成、血管平滑肌細胞(vascular smooth muscle cells,VSMCs)增殖,最終導致支架內再狹窄(in stent restenosis,ISR)和晚期血栓形成[2]。可以說,支架植入后對內皮的損傷是諸多風險發生的始動環節。因此,在血管支架植入后,如何盡快恢復內膜的完整與功能成為治療 ISR 和晚期血栓的關鍵。本文對支架植入造成內皮損傷的過程、修復機制及其影響因素進行了詳細闡述,并對其修復策略進行分析總結,為深入理解 ISR、血管內皮化延遲和晚期血栓形成的機制以及新型藥物洗脫支架和生物可降解支架的設計提供參考。
1 血管內支架植入后的 VECs 損傷及其修復機制
1.1 損傷的過程及影響因素
支架植入即刻,由于球囊擴張和支架植入引起的摩擦、張應力、壓迫等力學刺激,使血管內皮的完整性受到損壞,而暴露在血液中的中膜彈力板易黏附并激活血小板等血液成分,繼而形成血栓。同時,該過程還會激活炎癥反應,產生一系列生長因子和細胞因子,導致 VSMCs 在血管壁增殖。在這個過程中,VSMCs 發生表型轉換,分泌大量胞外基質,增加內膜厚度,從而引起 ISR[3]。此外,支架擴張不足、聚合物斷裂、金屬支架本身等也會引起炎癥反應,延遲局部再內皮化,導致一系列術后風險增加[4]。
血管內支架作為異物,會極大影響植入部位的血流動力學環境,也會影響內皮損傷后的修復進程。除對血管內壁形成壓迫外,支架絲貼合血管壁后形成的凸起會深刻影響內膜表面形貌,血液流經支架植入部位會在支架絲附近形成渦流或紊流等低剪切力區域,而支架絲的厚度、間距、走向等都會通過產生局部震蕩流、渦流影響 VECs 調控基因的表達,進而影響 VECs 的結構、功能,導致內皮功能障礙,抑制支架損傷后的再內皮化[5]。由于支架植入導致的力學環境影響如圖 1 所示。
 圖1
支架植入前后局部血流變化示意圖
Figure1.
Local blood flow diagram before and after stent implantation
圖1
支架植入前后局部血流變化示意圖
Figure1.
Local blood flow diagram before and after stent implantation
此外,目前廣泛應用的可在支架植入局部實現藥物控釋的藥物洗脫支架(drug eluting stents,DES)所裝載的藥物以及載藥涂層等可能會對 VECs 造成化學和炎癥損傷。DES 植入后,根據術后風險可將植入部位的病理變化分為三個階段。第一階段(植入即刻至 1 個月),藥物會大量釋放,即爆釋效應,在短時間內局部濃度過高的藥物會對血管內膜造成損傷,有產生急性和亞急性血栓的危險。第二階段是支架植入后受損血管部位內皮修復的重要階段。支架表面開始覆蓋新生組織,但延遲的或不完全的內皮化有可能會導致血栓的形成和 ISR 的發生。第三階段通常發生在植入 3 個月以后,當支架進一步嵌入在血管組織中,可能會導致晚期血栓和胞外基質沉積等引起的 ISR[6]。此外,裝載藥物的類型、劑量,涂層材料的選擇、制備工藝等均會影響到內膜增生、血栓及炎癥形成,而優良的藥物緩控釋涂層可以促進 VECs 增殖并加快支架表面再內皮化進程。其主要參數包括藥物在支架涂層中的擴散系數、溶解常數、藥物結合(吸收)率以及藥物與血管壁之間的透壁交換量等[7]。
1.2 修復的細胞來源
傳統觀點認為,血管內皮損傷后的修復主要依賴于損傷兩端鄰近的成熟 VECs 的遷移和增殖,修復程度不僅取決于損傷區域的大小,且極易受到局部非特異性抗增殖藥物的影響。研究證實,干細胞修復是 VECs 損傷修復一個非常重要的途徑[8],主要包括內皮祖細胞(endothelial progenitor cells,EPCs)、間充質干細胞(mesenchymal stem cells,MSCs)、血管壁原位干(祖)細胞(vascular wall-resident stem and progenitor cells,VW-SCs)等的參與。
1.2.1 骨髓來源干細胞
EPCs、MSCs 是來源于骨髓并參與內皮修復的主要干細胞。正常人體外周血中 EPCs 含量極低,局部血管損傷、急性心肌梗死、缺血及細胞因子等刺激會促使 EPCs 從骨髓動員進入外周血中,循環血中 EPCs 數量明顯增加,并逐漸遷移到損傷部位,修復血管損傷,促進血管新生,維持血管內皮的完整性[9]。
MSCs 與 EPCs 修復受損內皮的機制非常相似,如圖 2 所示。支架植入對血管內皮造成損傷后,EPCs、MSCs 在多種生物、力學等因子的刺激下從原始聚居部位啟動并轉移入血液循環,到達支架植入部位后歸巢至損傷血管局部,在一定的力學環境及生物因子的誘導下分化為 VECs,修復損傷的 VECs,同時抑制新生內膜增生。眾多動物及人體試驗結果表明,在一定的剪切力刺激下,不同類型和來源的 MSCs 均有分化成為 VECs 的潛力[10]。
 圖2
VECs 損傷后干細胞修復機制示意圖
Figure2.
Stem cells repair mechanism after endothelial injury
圖2
VECs 損傷后干細胞修復機制示意圖
Figure2.
Stem cells repair mechanism after endothelial injury
1.2.2 血管壁原位干(祖)細胞
VW-SCs 是骨髓外修復內皮的主要細胞來源。血管外膜可能通過參與細胞表型轉化、增殖、凋亡、遷移等生理活動,在血管生長、維持血管穩態、功能調節以及血管重構、鈣化和纖維化等過程中發揮重要作用。有研究顯示,VW-SCs 在特定條件下能轉移、分化為 VSMCs。Yu 等[11]對趨化因子干細胞抗原 1(stem cell antigen-1,Sca-1+)基因敲除小鼠血管內壁進行導絲損傷處理后發現,Sca-1+干細胞無法從外膜轉移至內膜以促進內膜增生。他們認為,內膜損傷后 VSMCs 可能通過趨化因子 C-C 受體 2/Ras 相關 C3 肉毒素底物 1(ras-related C3 botulinum toxin substrate 1,Rac-1)/p38 絲裂原活化蛋白激酶(p38 mitogen-activated protein kinases,p38 MAPKs)和趨化因子 C-X-C 受體 2/Rac-1/p38 MAPKs 兩條信號通路誘導 VW-SCs 由外膜轉入內膜并分化為 VSMCs,導致內膜增生。但也有研究認為,VW-SCs 也具有分化為 VECs 的能力,可能是支架植入后修復 VECs 損傷的重要細胞來源。Campagnolo 等[12]研究結果顯示,白藜蘆醇可以通過微小 RNA 21/蛋白激酶 B/β-鏈蛋白信號通路作用于 VW-SCs,并誘導諸如跨膜糖蛋白 CD31、鈣粘蛋白和內皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)等 VECs 標志物的表達,其小鼠實驗中白藜蘆醇可以減少病變的結果也印證了這一點。
1.3 修復的主要影響因子
支架植入局部因機械損傷、炎癥反應等對內膜造成損傷后,受損血管局部會產生響應機制,分泌血管內皮生長因子(vascular endothelial growth factor,VEGF)、粒細胞集落刺激因子(granulocyte colony stimulating factor,G-CSF)等重要的生物活性因子,進一步動員 EPCs、MSCs 分化為 VECs 或促進周圍 VECs 分裂增殖,修復局部 VECs 損傷,促進再內皮化。
其中,VEGF 是一種重要的 EPCs 動員的調節因子,它能特異性促進 VECs 的分裂與增殖。而成纖維細胞生長因子(fibroblast growth factor,FGF)能促進 VECs 的增殖、遷移,并且促進管腔的形成。G-CSF 則作為一種血液生長因子,可以動員更多外周血中的 EPCs,提升循環中的 EPCs 數量和功能,提高 EPCs 的增殖分化潛力,加速受損心肌和血管修復[13]。另外,還有一類生物活性因子——雌激素,其作為一類有廣泛生物活性并具有一定心血管保護作用的類固醇化合物,主要有雌二醇、雌三醇、雌酚等。支架植入對內皮造成損傷后,雌激素可以促進 EPCs 的歸巢、分化,修復受損部位,促進再內皮化,改善心肌供血,保護心血管健康[14]。
除了上述生物活性因子外,生物力學刺激也是影響干細胞分化的重要因素。研究發現高剪切力有助于 MSCs 的 VECs 標志成分如 VEGF 水平的明顯提高,而諸如 α-肌動蛋白(α-smooth muscle actin,α-SMA)、鈣結合蛋白等 VSMCs 標志表達水平則明顯降低[10]。
支架植入后造成的內皮損傷,不僅會刺激各類生物因子的表達,引起一系列促 VSMCs 的增殖反應,還會改變局部力學環境,刺激 VSMCs 的表型轉換、增殖和遷移。影響該過程的生物因子很多,而干細胞的歸巢、分化作為重要的內皮修復機制已經展開了廣泛研究。細胞、分子機制研究的積累為支架植入后 VECs 損傷的修復策略提供了相應的依據。
2 血管內支架植入后造成 VECs 損傷的修復策略
支架植入后球囊和支架的機械擠壓、涂層藥物的抗細胞增殖作用等將導致血管內皮損傷,進而導致內膜增生,最終引起 ISR 和晚期血栓的發生。因此,快速內皮化、盡快恢復受損部位的內皮功能,是解決支架植入后諸多問題的核心環節。促進支架植入后受損內皮的修復主要包括藥物治療、支架改進以及細胞治療等。
2.1 藥物治療與支架改進
2.1.1 促 VECs 修復的藥物
現在應用較多的治療內皮損傷的藥物、生物因子包括 VEGF、FGF、G-CSF、過氧化物酶體增殖物激活受體激動劑、他汀類等。
生物活性因子類藥物中以 VEGF 研究最多,其在促進內皮修復當中使用也最為廣泛。VEGF 不僅能夠促進 VECs 的分裂、增殖和功能恢復,還能夠作用于干細胞。用 VEGF 修飾的血管支架生物涂層,VECs 可以在其上附著,活力和增殖能力明顯增強,而且能夠誘導外周血中的 MSCs 向 VECs 方向分化[15],具有很好的促進內皮修復的效果。Song 等[16]首先將多巴胺(dopamine,DA)與肝素(heparin,Hep)共混交聯,在 316L 不銹鋼表面制備了 DA-Hep 涂層,而后通過浸泡的方法制備了兼有 VEGF 和跨膜糖蛋白 CD34 的新型涂層。該涂層能進一步加快內皮修復,減少支架在血液中的暴露時間,抑制急性、亞急性及血栓形成。這為促進血管再內皮化 DES 的研發提供了一個新的思路與平臺。
非生物因子類藥物以他汀類最具代表性。他汀類藥物可以增加循環 EPCs 的數量,增強其修復內皮損傷的功能[17]。在支架植入后,可以采取口服、支架載藥等方式實現他汀類藥物對受損部位內皮修復的功能。
2.1.2 支架載藥系統改進
DES 植入后的幾個小時內,藥物釋放往往會發生暴釋效應,急劇升高的局部藥物濃度會對血管內皮造成損傷,同時抑制 VECs 的生長,延遲血管受損部位再內皮化進程,導致急性血栓和亞急性血栓形成,最終導致晚期血栓和 ISR。此外,載藥聚合物的持續刺激也會引起血管內壁的炎癥,抑制內皮的修復。
針對 DES 出現的上述諸多問題,國內外研究者們開展了對支架的結構、載藥系統等設計與優化的研究,包括涂層材料優選、制備工藝優化、涂層及支架本體設計等。Saito 等[18]設計出了一種外腔梯度變化涂層。實驗結果表明,相對于傳統均勻滿載的 DES,該涂層結合西羅莫司支架植入兔子髂骨動脈 2 周后,內腔表面就已經完全被 VECs 覆蓋,且其抗血栓效果也遠優于傳統 DES。Zhu 等[19]設計了一種新穎的腔外充填生物可降解聚合物西羅莫司洗脫支架,雖然西羅莫司含量僅為傳統 DES 的 1/3,但其在保持傳統 DES 優異機械性能的同時,能較好地控制藥物釋放,維持安全和有效的局部藥物濃度,且并未出現局部或系統風險。此外,國內還設計出了一種無聚合物紫杉醇微盲孔載藥支架,對支架本體進行了凹槽設計,即在支架絲表面布有的微米級蜂窩狀小坑裝載藥物,可有效避免聚合物引發的血管壁炎癥及超敏反應,減弱了支架對內皮修復的持續干擾和抑制作用,減少了對內皮造成的損傷,降低血栓事件及 ISR 發生的風險[20]。
2.1.3 生物可降解支架
傳統不可降解金屬 DES 由于其不可降解性會帶來一系列后遺癥及風險。生物可降解支架在完成早期力學支撐后,于適當的時期開始降解,既減少了支架持續支撐所導致的內皮損傷,同時也解決了遠期支架殘留對再內皮化的阻礙。生物可降解支架的降解產物能夠完全被人體吸收或排出體外,是一種內皮友好型血管支架。常見的可降解支架主要有可降解聚合物支架和可降解金屬支架兩類。
目前,較為常用的可降解聚合物支架所采用的聚合物材料有聚乳酸(polylactic acid,PLA)、聚左旋乳酸(poly-l-lactic acid,PLLA)和聚羥基乙酸/聚乳酸共聚物等,其突出優點是生物相容性良好、降解速度可調、機械性能可控、降解產物無毒且能被吸收或排出體外[21]。
可降解金屬支架材料主要包括鎂合金和鋅合金。可降解鎂合金支架具有理想的機械支撐力、良好的生物相容性、新生內皮化迅速、血栓發生率低、易于降解(2~3 個月)等諸多優點。陳亮等[22]將新型鎂合金支架植入兔子腹主動脈后,支架于 180 d 左右完全降解,該支架能為血管重塑期管壁提供一定的支撐作用,防止晚期 ISR。而鋅合金支架作為可降解金屬支架研究新的熱點,正以其適宜的降解速度、良好的機械性能和生物相容性得到研究者的關注。Kubasek 等[23]通過配比不同鋅鎂含量篩選出一種 Zn-0.8 Mg 的鋅合金,其在具有優異的機械性能、合適的降解速率的同時,對成纖維細胞 L-929 和人骨肉瘤細胞并未顯示出細胞毒性,有望成為理想的血管植入材料。Bowen 等[24]采用鋅絲穿刺植入大鼠腹主動脈的方法進行鋅合金的體內研究。實驗結果顯示,鋅絲的植入并未產生慢性毒性,且在植入部位其能夠較好地抑制周圍 VSMCs 的活性,從而抑制內膜增生,因此在體內支架植入領域具有廣闊的應用前景。
2.2 細胞治療
細胞治療方法是指以細胞種植、細胞捕獲支架等為主要構想的在受損部位或支架表面種植干細胞、VECs,或是包被 EPCs、MSCs 等特異性捕獲抗體的方法,該方法在 VSMCs 增生之前可快速修復受損的內皮組織,促進 VECs 向損傷部位遷移,同時釋放活性因子抑制 VSMCs 過度增生和血栓的形成。
2.2.1 細胞種植支架
根據種植細胞的種類不同,可將細胞種植支架分為 VECs 種植支架和干細胞種植支架兩類。
VECs 種植支架是將支架在體外培養、包覆 VECs 后植入體內,具有活性表面的 VECs 種植支架有促再內皮化的作用。Wu 等[25]構建血管內皮生長因子 121(VEGF121)過表達慢病毒載體并轉染 VECs,將采用超聲霧化工藝噴涂明膠的 316L 不銹鋼與該轉染 VECs 旋轉共培養,得到 VECs 種植支架。該支架可以促進血管支架植入受損部位的再內皮化過程,并且能夠明顯地減少新生內膜面積,具有很大的應用潛力。
干細胞種植支架是在支架表面包覆 EPCs、MSCs 等干細胞,通過迅速促進 VECs 再生來預防 PCI 術后的并發癥。Shirota 等[26]設計了一種覆蓋于微孔薄層聚氨酯膜之上的光固化明膠涂層支架,將其放入從犬外周血中提取的 EPCs 的基質中培養,直到 EPCs 完全覆蓋支架表面,然后將支架植入人造血管組織。7 d 的培養結果發現,EPCs 不僅覆蓋于血管腔面,而且覆蓋于支架腔內側面,表明 EPCs 從支架中遷移、增殖,并在支架和鄰近血管處形成了完全內皮化的管腔。Hwang 等[27]設計出了一種納米纖維支架套管,該支架具有半透性,可以將 MSCs 包覆其內,MSCs 分泌的旁分泌因子可以增強植入局部自我修復能力。動物實驗結果顯示,該種支架沒有出現栓塞和免疫排斥反應,這無疑為干細胞種植支架提供了一個嶄新的思路。
2.2.2 細胞捕獲支架
由于外周血中的 EPCs、MSCs 等干細胞數量非常少,自然狀態下的修復十分緩慢,可自動識別并特異性“捕捉”EPCs 等干細胞的細胞捕獲支架應運而生。該類血管支架將特異性抗體包覆于支架表面,可以有效捕捉外周血中的干細胞,覆蓋在植入部位表面并迅速分化為 VECs 用于再內皮化。Wu 等[28]對跨膜糖蛋白 CD133、CD34 抗體捕獲支架進行了深入研究,實驗結果表明,無論在靜態環境還是在流動剪切力加載條件下,抗體涂層支架捕獲 EPCs 的能力均明顯高于對照。楊峰等[29]制備的雷帕霉素聯合 CD34 抗體復合支架在體外可以有效地捕捉 EPCs。在支架植入動物體內 48 h 后支架表面被完全覆蓋,表現出了較高的捕獲效率和促進 VECs 增殖的能力,具有極大的應用潛力。
3 展望
VECs 在冠狀動脈粥樣硬化性心臟病的發生發展以及心血管支架植入后的治療中發揮重要作用。血管內支架植入后再內皮化進程的延緩是導致后期一系列風險的始動環節,因此支架植入后迅速再內皮化是解決血管內支架植入后血栓形成和提高遠期通暢率的有效方法。干細胞能夠在內皮損傷后的動員、歸巢、遷移和分化,對修復內皮損傷具有重要積極的意義,是支架植入后修復的重要機制。針對當下支架植入后的問題,通過構建新型促進內皮修復的支架涂層、載藥系統、可降解支架、細胞種植支架、細胞捕獲支架等方式,可以有效促進植入初期受損部位的再內皮化過程,如圖 3 所示。其中生物可降解支架因其全降解性、內皮友好性,顯示出巨大的優勢,有望成為心血管疾病介入治療的主要手段,有廣大的發展與應用空間。
 圖3
血管內支架植入后的 VECs 損傷及其修復策略
Figure3.
Mechanisms of endothelial injury and strategies of its reparation after vascular stent implantation
圖3
血管內支架植入后的 VECs 損傷及其修復策略
Figure3.
Mechanisms of endothelial injury and strategies of its reparation after vascular stent implantation