本研究采用化學提取法制備大鼠子宮去細胞支架,以探究大鼠子宮細胞外基質(ECM)凝膠制備的可行性。取大鼠子宮,經 1% 十二烷基磺酸鈉(SDS)、3% 曲拉通 X-100(TritonX-100)、4% 脫氧膽酸鈉(SDC)溶液依次振搖,制得大鼠子宮去細胞支架。通過掃描電鏡、組織化學染色、免疫組化等方法檢測支架去細胞化情況。將成功制備的大鼠子宮去細胞支架經胃蛋白酶消化得 ECM 凝膠,特異性檢測 ECM 凝膠中蛋白含量,測定其流變學性能。結果表明,化學提取法能有效去除細胞,完全保留支架中 ECM 蛋白成分;本研究制得的 ECM 凝膠中含有大量 ECM 蛋白,膠凝穩定,或可為體外子宮內膜構建提供合適的支架材料。
引用本文: 許潔, 金冰慧, 趙應征. 大鼠子宮去細胞支架及其細胞外基質凝膠的制備. 生物醫學工程學雜志, 2018, 35(2): 237-243. doi: 10.7507/1001-5515.201704070 復制
版權信息: ?四川大學華西醫院華西期刊社《生物醫學工程學雜志》版權所有,未經授權不得轉載、改編
引言
子宮是女性產生月經、孕育胎兒的重要器官。子宮內膜在卵巢激素的作用下發生動態、周期性的變化,實現剝脫內膜的修復與再生。目前,臨床上常見的子宮手術操作如子宮肌瘤剔除術、人工流產術以及一些病理因素,如感染等,均可導致嚴重的子宮內膜損傷,繼而形成子宮疤痕,表現為腹痛、閉經、不孕、反復流產及胎盤黏連、早產、胎兒生長受限等一系列婦產科并發癥[1]。一些研究已經在動物模型體內實現子宮創傷的修復,但仍無法恢復子宮的生殖功能[2]。隨著組織工程技術的發展,應用人造子宮內膜組織移植作為子宮損傷的修復替代手段成為組織工程領域研究的熱點。然而,大多數體外構建的子宮內膜組織由于必須依賴于復雜的細胞源、支架材料及培養環境等,使得子宮重建仍停留在體外研究階段[3]。鑒于子宮在胚胎發育以及人類生殖研究中具有無法替代的重要作用和功能,建造組織工程化子宮去細胞支架材料成為組織工程領域的研究熱點之一。
目前,由哺乳動物組織經去細胞化制備的去細胞支架材料具有良好的生物相容性、高生物活性和低免疫原性,被廣泛用于臨床前動物研究和臨床期的組織修復與重構[4]。另一方面,去細胞支架材料經胃蛋白酶消化可制成細胞外基質(extracellular matrix,ECM)凝膠,具有流動性和可注射性,因此 ECM 凝膠能有效解決傳統生物支架材料受限于組織的固有形態和機械性能等應用難題,并為細胞的增殖與分化提供更接近于天然細胞所處的生理微環境。因此,相比于傳統的生物支架材料,ECM 凝膠具有更大的優勢,是細胞支架的一個重要組成部分與發展方向。Ghuman 等[5]以豬膀胱去細胞支架制備 ECM 凝膠材料,經微創注射植入大鼠腦中風病灶內并取得一定療效。該研究在植入病灶的支架中明顯觀察到正常神經細胞的遷移軌跡和增殖分化行為。另有研究證實,利用心肌 ECM 凝膠制備體外細胞培養的支架材料,有利于作為細胞黏附位點,為心肌細胞分化為正常組織提供良好的營養環境[6]。
在目前報道的諸多組織去細胞化技術中,針對不同組織的去細胞化方法有所不同。本實驗基于前期對不同去細胞化方案的比較,選用化學提取法進行大鼠子宮去細胞化,并進行了一系列大鼠子宮去細胞支架的質量評價,并進一步制備了子宮 ECM 凝膠,同時探究其所含生物活性成分和凝膠流變學性能,以期為子宮生物組織工程提供一種理想的支架材料。
1 材料和方法
1.1 材料
實驗動物:健康雌性 Sprague Dawley(SD)大鼠 20 只,重 260~290 g,購自溫州醫科大學實驗動物中心,無特定病原體(specific pathogen free,SPF)級環境飼養,動物生產許可證號:SYXK(浙)2015-0009。
主要試劑:十二烷基磺酸鈉(sodium dodecyl sulfate,SDS)、曲拉通 X-100(TritonX-100)、脫氧膽酸鈉(odium 3-α,12-α-dihydroxy-5-β-cholan-24-oate,SDC)購自 Sigma 公司;雙氧水(H2O2)購自索萊寶科技有限公司;青霉素-鏈霉素抗生素混合液購自 Gibco 公司;DNA 檢測試劑盒購自美國 Omega 公司;酶聯免疫吸附測定(enzyme-linked immunosorbent assays,ELISA)試劑盒購自武漢博士德公司;兔抗纖維連接蛋白(fibronectin,FN)抗體、兔抗膠原蛋白(collagen,Col)抗體、兔抗彈性蛋白(elasin,EN)抗體購自英國 Abcam 公司;4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI)染色液、愛先藍-糖原(Alcian blue-periodic acid sthiff,AB-PAS)染色試劑盒購自美國 Invitrogen 公司。
1.2 實驗方法
化學提取法制備大鼠子宮去細胞支架:取成年雌性 SD 大鼠,稱重,腹腔注射 1% 戊巴比妥鈉麻醉(劑量為:5 mL/kg)。打開腹腔,在室溫和無菌條件下,經左心室生理鹽水灌注后,將大鼠子宮組織取出,保存在 4℃ 無菌蒸餾水中,而后用化學提取法進行組織去細胞化。大鼠子宮組織首先以 1%SDS 室溫震蕩萃取 12 h,無菌蒸餾水漂洗 3 次,每次 10 min;然后以 3% TritionX-100 室溫震蕩萃取 12 h,洗滌;加入 4% SDC,室溫震蕩萃取 24 h,無菌蒸餾水漂洗 3 次,每次 10 min。搖床震蕩速度設置為 120 r/min。萃取后的大鼠子宮組織經 0.01% H2O2 沖洗后,置 4℃ 無菌磷酸緩沖鹽(phosphate buffer saline,PBS)溶液(0.01 mol/L,pH = 7.4)中保存備用。
1.3 組織形態學觀察
1.3.1 掃描電鏡觀察
大鼠子宮去細胞組織用 4% 戊二醛前固定 48 h,PBS 漂洗;1% 鋨酸后固定,PBS 漂洗;行丙酮梯度脫水,分別以 50%、70%、90%、100% 的醋酸異戊酯置換,臨界點干燥儀干燥,真空噴金鍍膜,最后將標本置于掃描電鏡(H-7500,Hitachi 集團/日本)下觀察其微觀形態。
1.3.2 組織化學染色
將大鼠子宮組織分為兩組:正常組(未加任何處理)和去細胞支架組(經去細胞化處理)。用 4% 多聚甲醛分別固定正常組和去細胞支架組的大鼠子宮組織,脫水、石蠟包埋、切片。常規石蠟切片染色處理,根據不同染色試劑盒操作過程,進行不同病理染色。蘇木精-伊紅(hematoxylin-eosin,HE)染色評價細胞是否殘留,Masson 染色檢測大鼠子宮組織中基底層膠原成分是否存在,正置熒光顯微鏡(Nikon-ECLIPSE Ti-S,北京瑞科中儀有限公司/北京)光學鏡下觀察組織結構改變。
1.3.3 免疫熒光染色
將石蠟切片經脫蠟、水化、洗滌、DAPI 熒光染色,組織切片染色結果用正置熒光顯微鏡(Nikon-ECLIPSE Ti-S,北京瑞科中儀有限公司/北京)觀察,評價是否有細胞殘留。
1.4 制備子宮 ECM 凝膠
將大鼠子宮去細胞支架剪碎,冷凍干燥 24 h,以液氮研磨成粉末狀。將支架粉末與胃蛋白酶以 10∶1 的質量比混合到 0.1 mol/L 的 HCl 溶液中,混合溶液在 37℃ 水浴消化 48 h。酶解反應完全后,用 NaOH 中和支架溶液,調節 pH 值為 7.4,以停止胃蛋白酶的消化作用,然后用 PBS 進行稀釋,即制成大鼠子宮 ECM 凝膠(簡稱:ECM 凝膠)。ECM 凝膠經凍干后于 –80℃ 中保存備用。
1.5 子宮去細胞組織蛋白含量檢測
1.5.1 免疫組化染色
取大鼠子宮去細胞支架組石蠟切片經脫蠟、水化、抗原修復處理后,分別滴加 FN、Col、EN 單克隆抗體,37℃ 恒溫箱中孵育 1 h。滴加二抗,37℃ 恒溫箱中下孵育 2 h,蘇木素染色液復染細胞核,中性樹膠封片。觀察各組樣本蛋白 FN、Col、EN 的表達及分布情況。
1.5.2 AB-PAS 染色
分別將兩組大鼠子宮組織石蠟切片經脫蠟、水化、洗滌。根據染色試劑盒步驟進行染色操作,光學顯微鏡下觀察兩組大鼠子宮組織中黏多糖蛋白(glucosamnoglycans,GAGs)的保留情況。
1.5.3 特異性 ELISA 檢測
針對不同的蛋白,現已有不同的蛋白測定試劑盒。以標準品濃度為橫坐標,光密度(optical density,OD)值為縱坐標,繪制標準曲線。將制備好的 ECM 凝膠稀釋至 ELISA 試劑盒檢測濃度范圍內,用生理鹽水梯度稀釋(比例分別為:1∶2,1∶3,1∶4,
 ,1∶l0),嚴格按試劑盒說明書操作測定 OD 值,根據標準曲線,推算出 FN、Col、EN 等蛋白濃度。各蛋白濃度檢測實驗重復 3 次。最后將各 ECM 凝膠的蛋白濃度與正常子宮組織蛋白濃度含量進行比值分析,得到 ECM 凝膠中各類蛋白的含量百分比。
,1∶l0),嚴格按試劑盒說明書操作測定 OD 值,根據標準曲線,推算出 FN、Col、EN 等蛋白濃度。各蛋白濃度檢測實驗重復 3 次。最后將各 ECM 凝膠的蛋白濃度與正常子宮組織蛋白濃度含量進行比值分析,得到 ECM 凝膠中各類蛋白的含量百分比。
1.6 ECM 凝膠流變學性能檢測
本文采用動力流變儀(Discovery HR-2,TA 儀器公司/上海)對 ECM 凝膠進行流變學性能檢測。首先,將 ECM 凝膠樣品置于 37℃ 環境下形成穩定凝膠。儀器程序設定如下:測試夾具為 25 mm 平行板,剪切頻率設定為 10 rad/s,剪切應變為 1%,溫度精確控制在±0.1℃范圍內 ,恒溫 10 min 后,測定樣品的彈性模量(G’)和黏性模量(G”)。測定結果以時間(t)與 G’ 和 G” 作曲線圖。設定 0.1~100 Hz 的剪切頻率(ω)掃描范圍,剪切應變為 1%。上樣后平衡 5 min,進行頻率掃描實驗,觀察 ECM 凝膠樣品的 G’ 和 G” 以及復合黏度(η)變化情況。進行 3 次重復性實驗,結果取其平均值。
2 結果
2.1 大鼠子宮去細胞支架及其 ECM 凝膠的制備
正常組大鼠子宮組織呈粉紅色,表面分布有毛細血管網,血管內可見殘留血液。在制備去細胞支架的過程中,子宮組織經化學試劑振搖逐漸由外至內變白,逐漸變為半透明,完全去細胞化的大鼠子宮組織為乳白色半透明狀,如圖 1 所示。
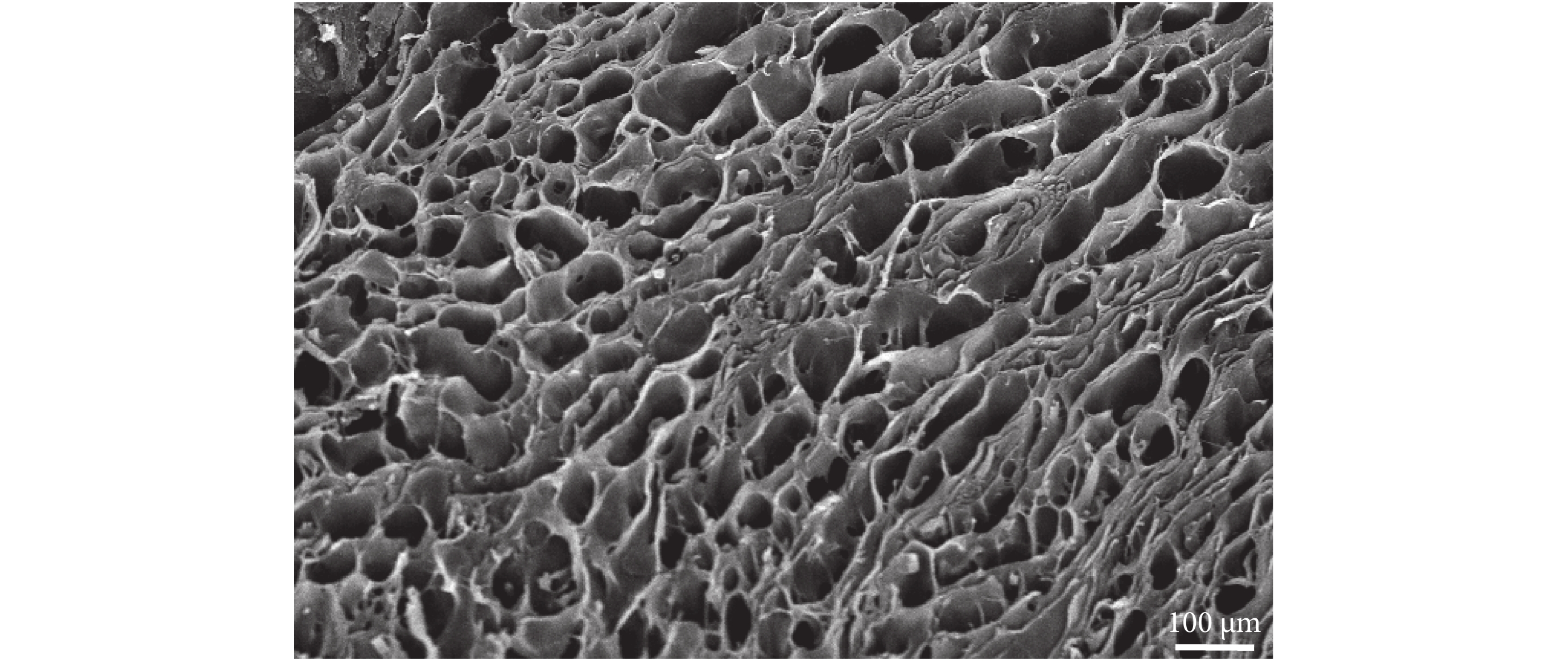
通過掃描電鏡(H-7500,Hitachi集團/日本)觀察,本文處理的大鼠子宮組織經去細胞化后保留了完好的三維支架結構,孔間連接完整,纖維層連接斷裂較少,如圖 2 所示。由大鼠子宮去細胞支架制得的 ECM 凝膠在制備過程中一直保持為乳白色,經胃蛋白酶消化后呈凝膠狀,在體溫(37℃)時穩定形成凝膠,如圖 1 所示。
 圖1
化學提取法制備大鼠子宮去細胞支架流程圖及 ECM 凝膠制備過程
Figure1.
Preparation process of rat uterine decellularized scaffold and ECM hydrogel by chemical extraction
圖1
化學提取法制備大鼠子宮去細胞支架流程圖及 ECM 凝膠制備過程
Figure1.
Preparation process of rat uterine decellularized scaffold and ECM hydrogel by chemical extraction
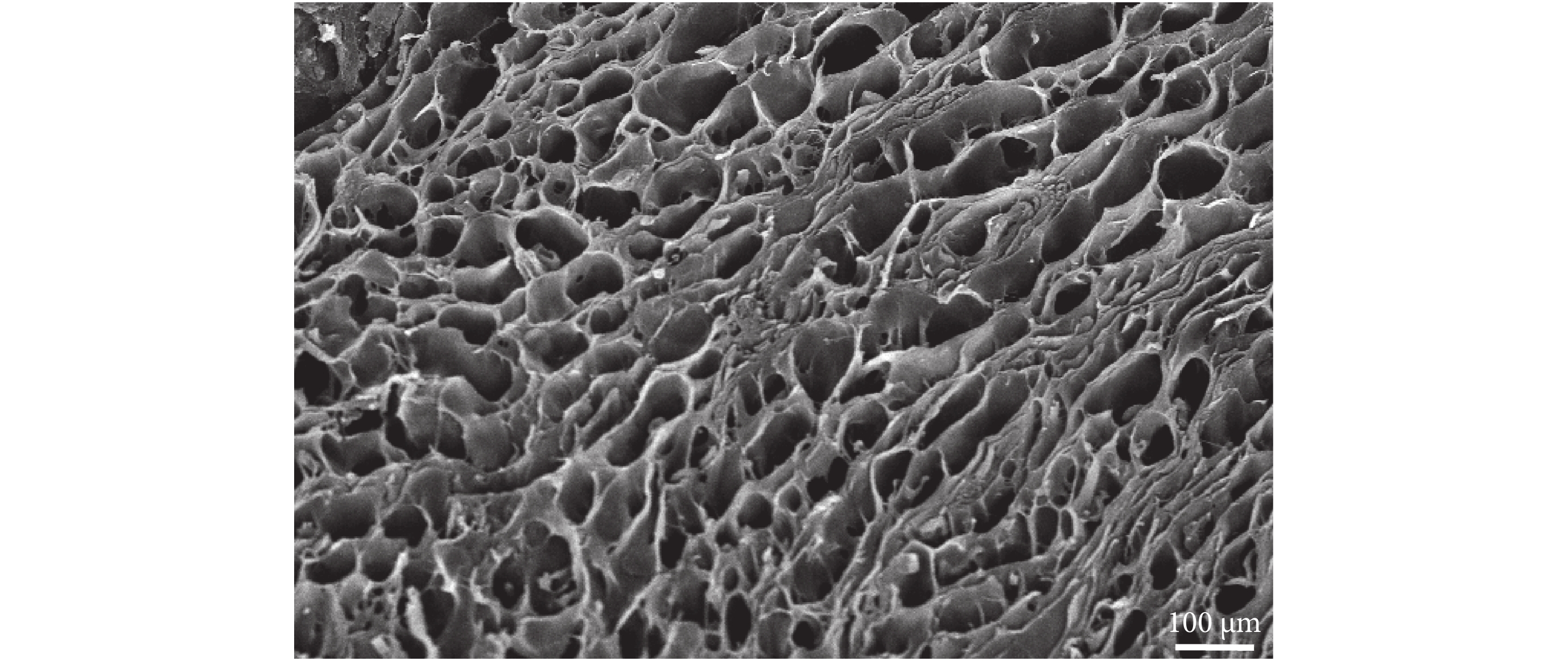 圖2
大鼠子宮去細胞支架掃描電鏡結果
Figure2.
Scanning electron microscope image of rat uterine decellularized scaffold
圖2
大鼠子宮去細胞支架掃描電鏡結果
Figure2.
Scanning electron microscope image of rat uterine decellularized scaffold
2.2 大鼠子宮去細胞支架組織學觀察
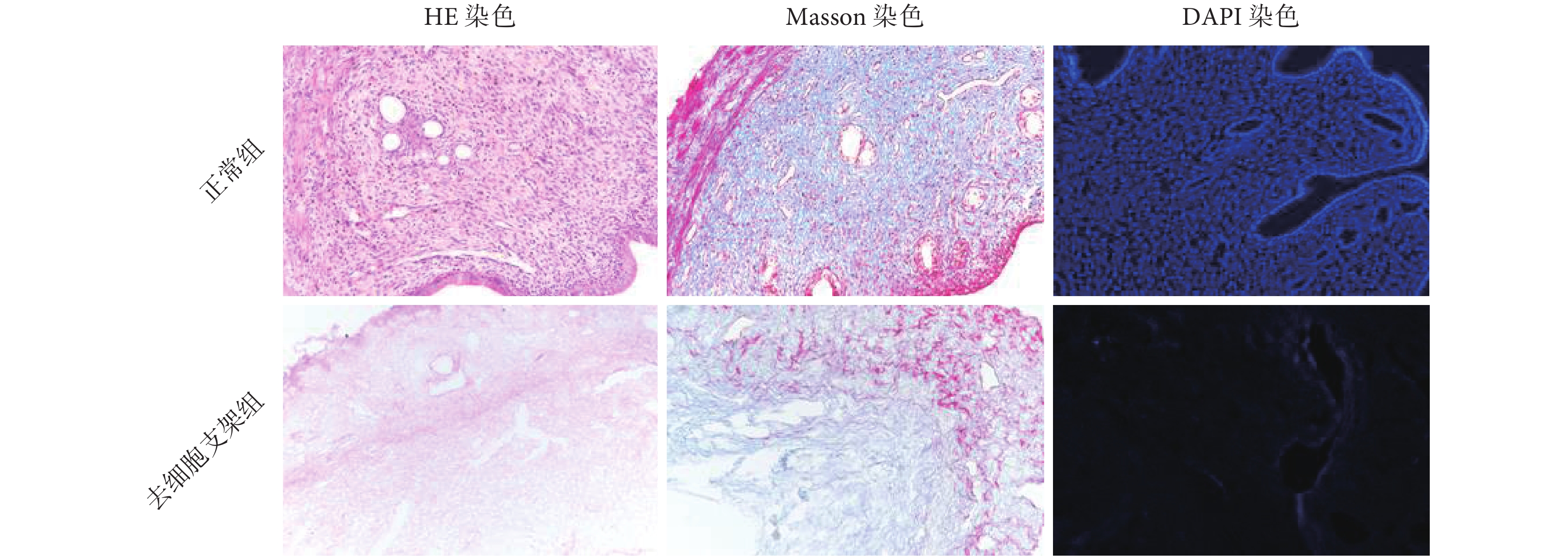
如圖 3 所示,HE 染色顯示正常組子宮組織中分布大量藍紫色的細胞核,細胞緊密排列,細胞膜及細胞核完整。去細胞支架組的子宮組織基底層去細胞化完全,肌層有較多淺粉色細胞外基質留存,整體去細胞組織未見殘留細胞及細胞核結構。同時,去細胞支架組子宮基底層腺體結構保留完整,肌層紋理網格清晰可見。正常組的子宮組織經 DAPI 熒光染色顯示藍色胞核清晰,去細胞支架組未見明顯 DAPI 與細胞核結合后發出的藍色強熒光。Masson 染色可見去細胞支架組有明顯的紅色肌纖維,藍色膠原纖維成分保留較多,細胞外膠原纖維的結構排列基本保持,細胞外基質的彈性纖維結構總體正常。
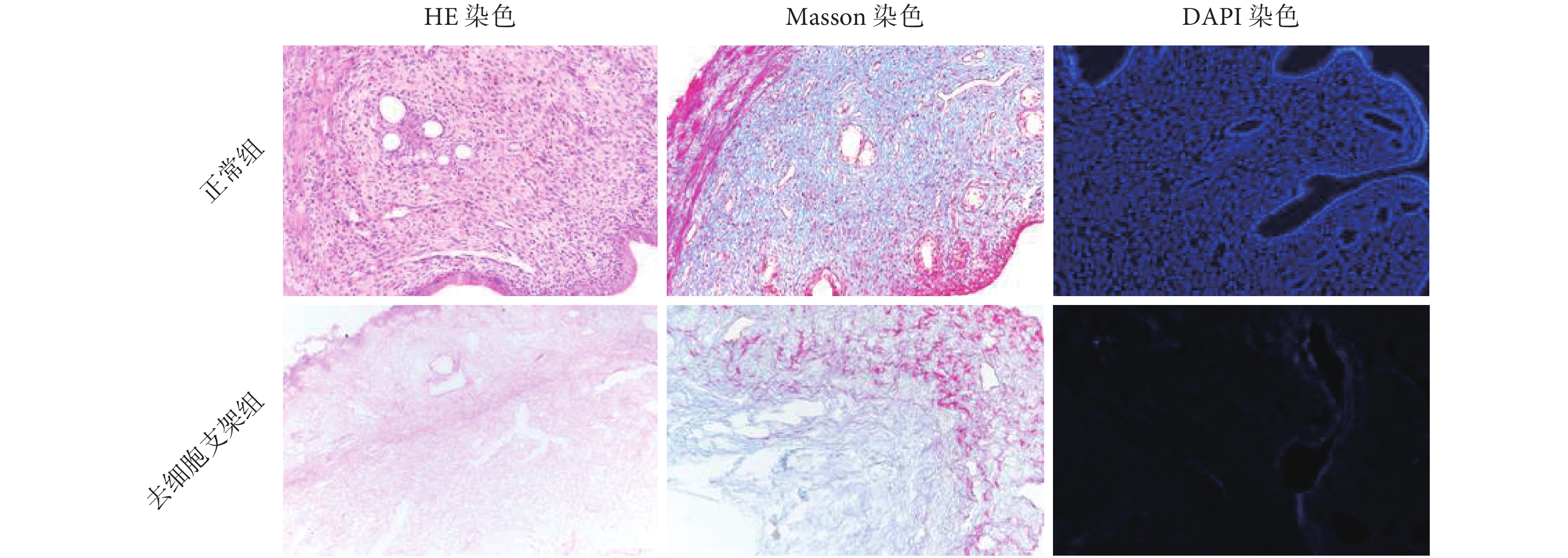 圖3
大鼠子宮組織組織學評價(200×)
Figure3.
Histological evaluation of uterus in rats (200×)
圖3
大鼠子宮組織組織學評價(200×)
Figure3.
Histological evaluation of uterus in rats (200×)
2.3 大鼠子宮去細胞支架免疫組化染色結果
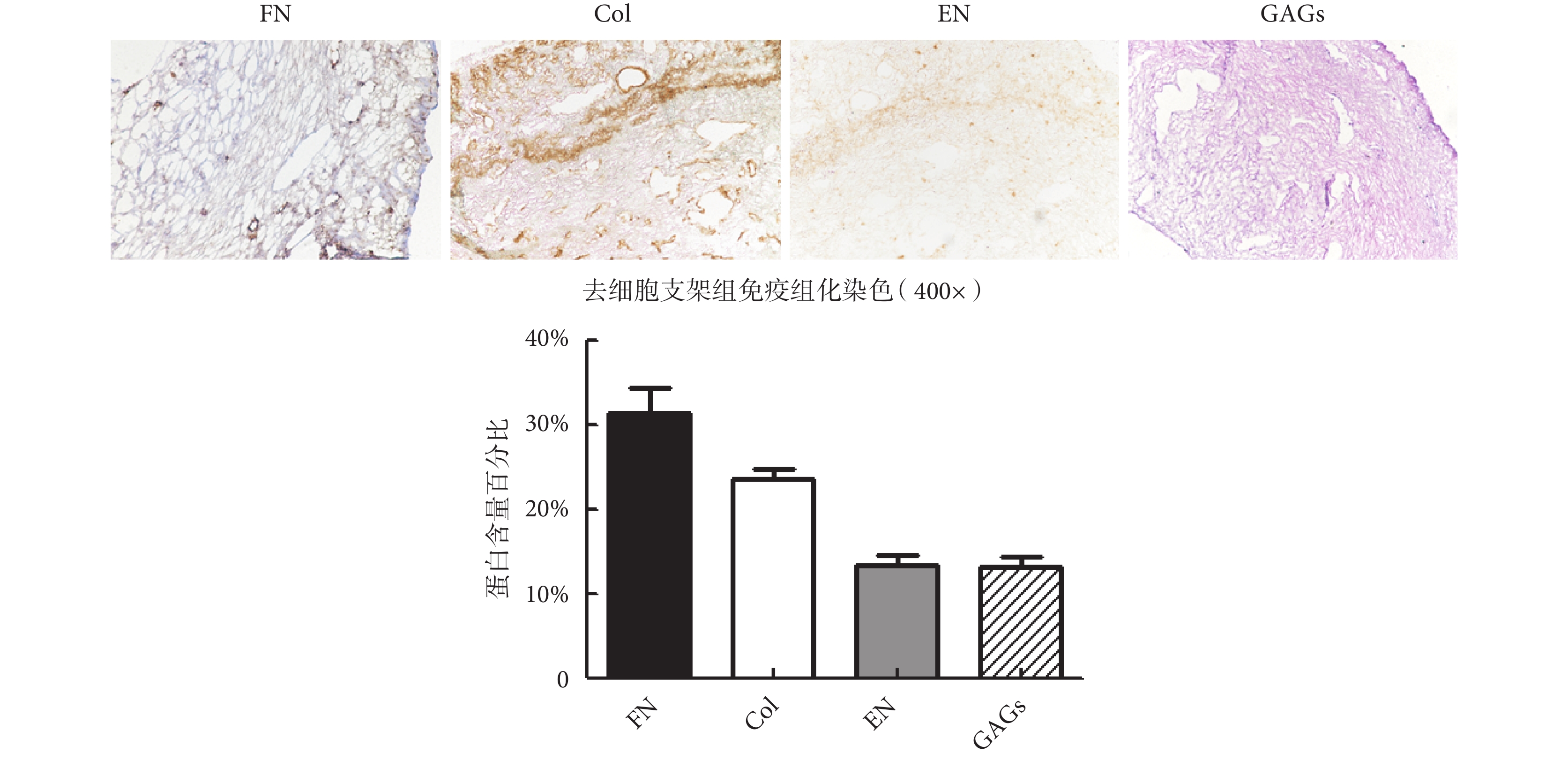
如圖 4 所示,大鼠子宮去細胞支架中仍保留有大量的 FN、Col、EN 等重要蛋白,同時還保留有一定含量的黏多糖蛋白。同時,應用蛋白特異性 ELISA 試劑盒對 ECM 凝膠中各蛋白含量進行定量檢測。研究結果表明,ECM 凝膠中各蛋白成分保留齊全,其中 FN 和 Col 成分保留最多,分別為 32% 和 26.7%。
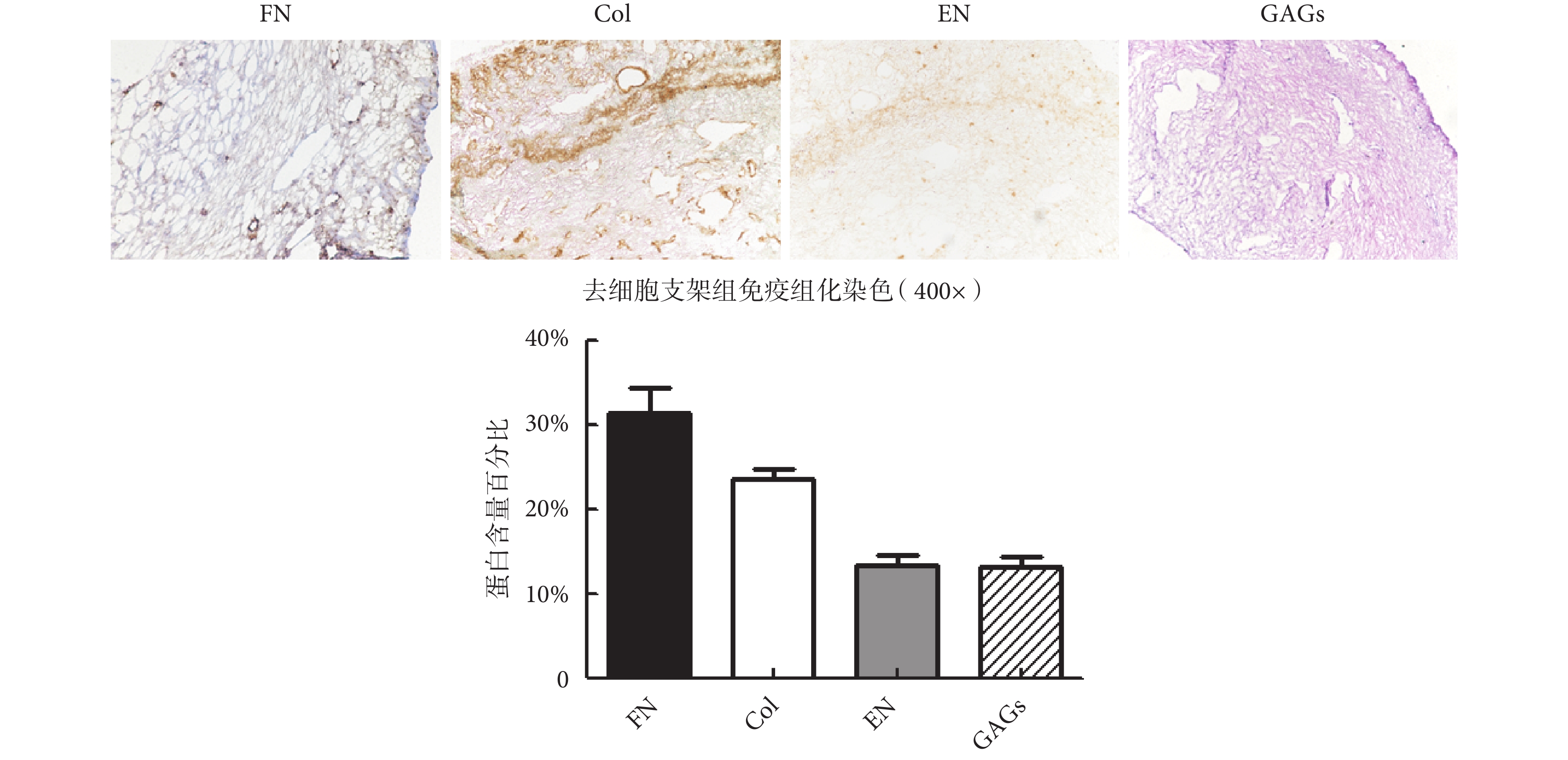 圖4
大鼠子宮去細胞支架 ECM 成分檢測
Figure4.
Detection of ECM components in rat uterine decellularized scaffold
圖4
大鼠子宮去細胞支架 ECM 成分檢測
Figure4.
Detection of ECM components in rat uterine decellularized scaffold
2.4 ECM 凝膠流變學性能檢測
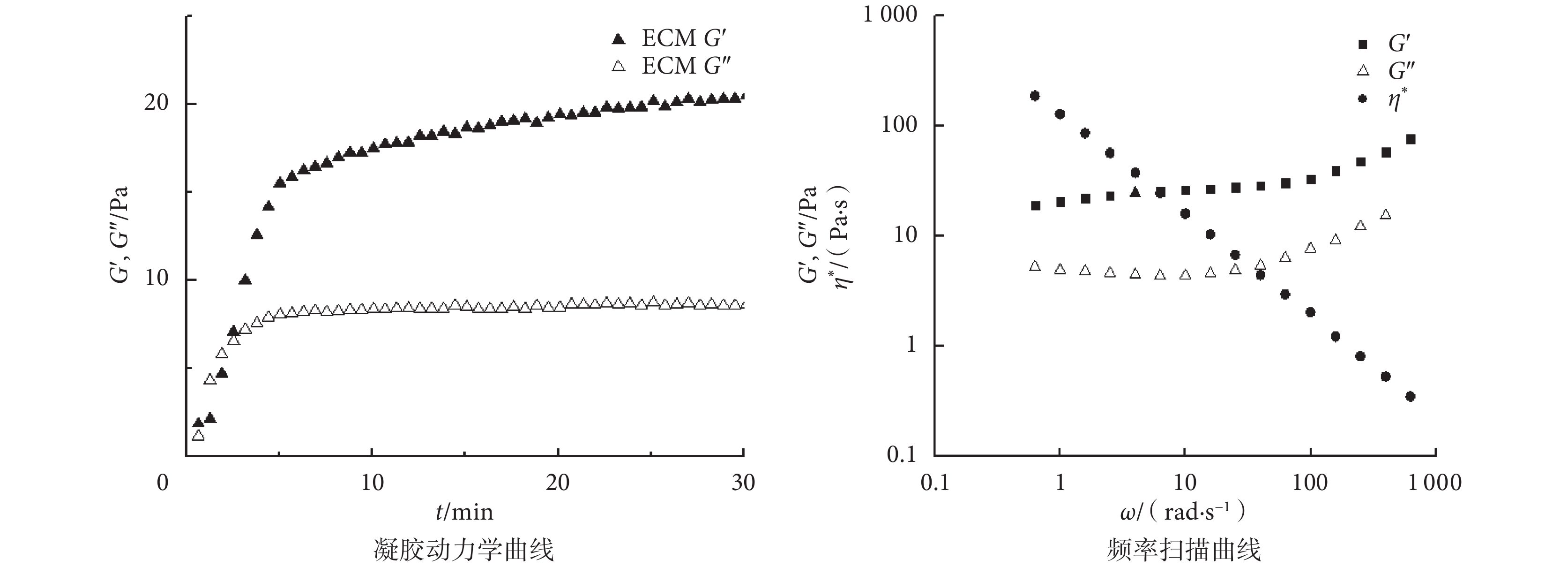
通過流變學性能檢測揭示 ECM 凝膠的凝膠化過程和機械性能。如圖 5 所示,在 37℃ 下,ECM 凝膠的 G’ 和 G” 值在 3 min 時相等,說明 ECM 溶液開始相變形成凝膠。隨后 G’ 和 G” 值繼續增加,在 10 min 時達到最大值,且在 30 min 后仍保持穩定,說明 ECM 凝膠以凝膠狀態穩定存在。ECM 凝膠最大 G’ 值大于最大 G” 值,說明 ECM 凝膠為類固體凝膠。采用振幅剪切模式觀察 ECM 凝膠的穩定性和動態黏度,如圖 5 中頻率掃描曲線所示,ECM 凝膠的 G’ 和 G” 與頻率之間無明顯相關性,即 ECM 凝膠不呈頻率依賴性,膠凝穩定。在整個頻率掃描范圍內,初始復合黏度值大,隨剪切頻率增加,凝膠結構被破壞,其復合黏度減小,表明 ECM 溶液具有假塑性流體性質。
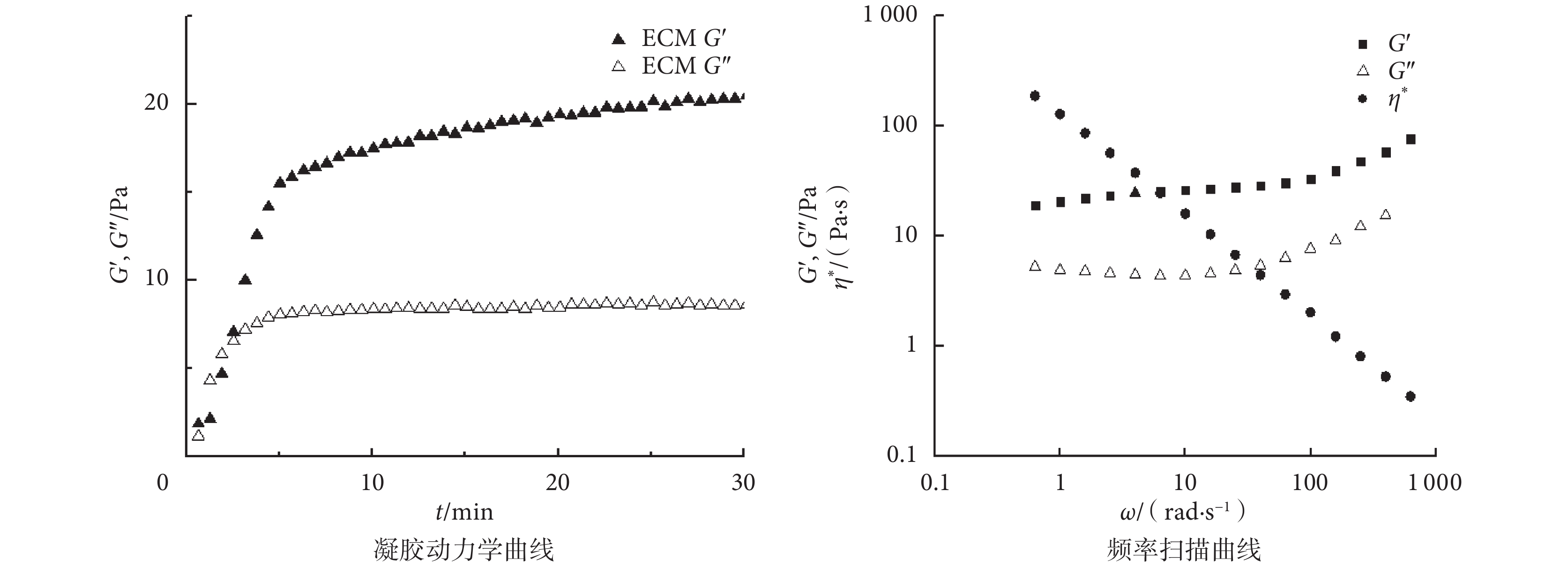 圖5
ECM 凝膠流變學性能檢測
Figure5.
Rheological characterization of ECM hydrogel
圖5
ECM 凝膠流變學性能檢測
Figure5.
Rheological characterization of ECM hydrogel
3 分析與討論
目前關于子宮組織工程學的研究內容主要包括體外子宮內膜構建和移植支架材料兩大方面。其中子宮內膜培養法的種子細胞體外培養技術已經相對成熟。雖然子宮內膜培養法能達到體外對子宮各種病理學和生理學的研究目的,也為建立胚胎植入的體外模型提供了新的思路,但它在目前的研究過程中仍存在一定的局限性,如子宮內膜構建中傳統的硬支架材料降解慢、組織強度大、無法模擬子宮生理功能以及細胞結構被支架材料破壞和內部組織出現壞死等問題。隨著干細胞發育生物學以及材料力學的發展,人們開始認識到體外構建一個類似于自然子宮組織的重要性[7]。因此,如何構建出適合體內移植和種子細胞生長所需的支架材料成為子宮組織工程研究的關鍵。
由于子宮組織經歷著動態、周期性的更新,胚胎受精過程復雜,常規的生物支架材料如聚乙交酯-丙交酯、膠原等生物材料無法分泌細胞周期中所需的激素,構建一個類似的生理營養環境,也無法模擬人體子宮的收縮和擴張等生理功能[8]。為了克服以上研究難題,本文選擇了具有良好的生物相容性、低免疫原性和生物活性的大鼠子宮去細胞支架,從根本上打破生物支架/移植材料的局限。Miyazaki 等[9]在研究中制備了大鼠子宮去細胞支架,以切除大鼠正常子宮角 1/3 段作為子宮缺損疾病模型,將大鼠子宮去細胞支架替代原有子宮組織進行部分組織移植治療。治療 90 d 后,支架移植組子宮腔道上皮化明顯,肌層再細胞化密集,有一定水平雌激素受體表達,同時生殖功能評價結果顯示大鼠懷孕率為 75%。這一體內去細胞支架同種移植的研究表明:子宮去細胞支架經在體移植,具有良好的再細胞化和功能化,使應用去細胞支架進行子宮組織再生并恢復其生理功能成為可能。然而,人體子宮組織供體匱乏,異種移植免疫原性和排斥反應不容輕視,且體內研究重復性和可操作性差[10],獲得的信息數量有限。因此,如何在體外構建人造子宮內膜是克服體內研究不足的有效途徑。基于上述研究基礎,大鼠子宮去細胞支架為體外構建子宮內膜提供了合適的生物材料來源,但由于人體子宮結構、生理特性與大鼠子宮的差異,將大鼠子宮去細胞支架選擇合適的且接近于生理狀態的重構形式是子宮內膜構建方法的另一關鍵。
近年來,有研究者采用子宮內膜上皮細胞和基質細胞在膠原/人工基底膜(Matrigel)復合支架材料上種植培養,并將子宮內膜直接置于支架材料中形成外植塊培養[8],但這種體外形成的三維生物體系與自然子宮在生理結構和組織形態方面有較大的差異,目前只能做一些簡單的生理或病理研究。ECM 凝膠因具有良好的生物相容性,展現了復雜的生物刺激性,有較好的機械性能,逐漸受到科研人員的重視。ECM 凝膠作為組織去細胞支架的延伸應用,利用 ECM 中所含各類蛋白質成分通過正常生理比例排列成空間構象,為組織器官的實質細胞提供生長發育附著點,也為組織器官結構與功能的重構提供了基礎。Ott 等[11]采用小鼠心臟組織,經去細胞化制備心臟 ECM,并重新注入新生小鼠細胞,經體外培養后心臟復跳,這一研究結果使體外器官組織再生成為可能。本實驗采用化學提取法制備子宮去細胞支架,應用 SDS、TritionX-100 破除細胞,聯合 SDC、H2O2 等化學去垢劑對去細胞支架徹底清洗[12]。其中離子型去污劑 SDS 能減輕 ECM 超微結構的破壞[13]。經 HE、Masson 等染色方法對子宮去細胞支架的組織質量進行評價,結果表明化學提取法制備的子宮去細胞支架基本無細胞與細胞核殘留,可有效避免去細胞支架在體應用的免疫排斥反應。免疫組化和 ELISA 法的結果進一步表明子宮去細胞支架較完整地保留了 ECM 的主要成分,如 FN、Col、EN、GAGs,且 ECM 凝膠中以 FN 含量最高。FN 作為高分子糖蛋白,有促進巨噬細胞的吞噬功能,促進細胞與纖維基質間連接的生理作用[14],其中最基本最重要的一項功能是促進細胞的黏連生長。而細胞與材料的相互作用是組織工程研究的主要研究領域,其中細胞與材料的黏附是基礎,細胞必須與材料發生適當的黏附,才有利于遷移、分化和增殖[15]。
ECM 凝膠的流變學性能檢測結果表明,G’ 和 G” 不呈頻率依賴性,ECM 溶液形成的凝膠穩定;ECM 凝膠化后 G’ 值大于 G”,且初始復合黏度值大,說明 ECM 凝膠為具有黏彈性的類固體凝膠。ECM 凝膠主要由生物組織制備而成,不具有傳統硬支架材料的硬度和強度,通過提供合適的可降解度和生物活性,有效避免了體外子宮內膜構建中傳統硬支架材料的應用局限。Massensini 等[16]制備豬膀胱 ECM 凝膠,發現 ECM 的膠凝性質具有濃度依賴性,這個膠凝過程可能是所有蛋白組分相互作用或受蛋白濃度影響的結果[17]。研究中 ECM 凝膠的穩定凝膠性質能有效保持子宮結構塑形,但其所形成的膠凝固態也可能在培養過程中對細胞所需的營養物質、氧氣和代謝物的擴散和分布產生影響。其中細胞生長所需的營養物質是由機體體液交換提供,細胞增殖分化、組織的形成和功能的表達高度依賴于體內微環境。如果將 ECM 凝膠作為細胞遞送或細胞嵌入介質,其產生的物質擴散和分布的變化可能會影響細胞的生理行為[18-19]。因此,ECM 凝膠影響種子細胞培養中的體外反應以及宿主組織反應的行為可作為將來臨床前研究的另一關注點。
綜上所述,化學提取法制備子宮去細胞支架的方法簡便易行,制備的大鼠子宮去細胞支架具有低免疫原性,且保留了較多 ECM 蛋白成分,為制備 ECM 凝膠提供了理想的支架來源。經大鼠子宮去細胞支架制備的 ECM 凝膠表現出良好的凝膠化性能,可滿足體外種子培養的子宮模型構建和臨床注射支架的應用;同時支架材料中所含的高濃度纖維連接蛋白也可為將來進一步制備子宮組織工程替代移植的生物學功能材料提供研究基礎。
引言
子宮是女性產生月經、孕育胎兒的重要器官。子宮內膜在卵巢激素的作用下發生動態、周期性的變化,實現剝脫內膜的修復與再生。目前,臨床上常見的子宮手術操作如子宮肌瘤剔除術、人工流產術以及一些病理因素,如感染等,均可導致嚴重的子宮內膜損傷,繼而形成子宮疤痕,表現為腹痛、閉經、不孕、反復流產及胎盤黏連、早產、胎兒生長受限等一系列婦產科并發癥[1]。一些研究已經在動物模型體內實現子宮創傷的修復,但仍無法恢復子宮的生殖功能[2]。隨著組織工程技術的發展,應用人造子宮內膜組織移植作為子宮損傷的修復替代手段成為組織工程領域研究的熱點。然而,大多數體外構建的子宮內膜組織由于必須依賴于復雜的細胞源、支架材料及培養環境等,使得子宮重建仍停留在體外研究階段[3]。鑒于子宮在胚胎發育以及人類生殖研究中具有無法替代的重要作用和功能,建造組織工程化子宮去細胞支架材料成為組織工程領域的研究熱點之一。
目前,由哺乳動物組織經去細胞化制備的去細胞支架材料具有良好的生物相容性、高生物活性和低免疫原性,被廣泛用于臨床前動物研究和臨床期的組織修復與重構[4]。另一方面,去細胞支架材料經胃蛋白酶消化可制成細胞外基質(extracellular matrix,ECM)凝膠,具有流動性和可注射性,因此 ECM 凝膠能有效解決傳統生物支架材料受限于組織的固有形態和機械性能等應用難題,并為細胞的增殖與分化提供更接近于天然細胞所處的生理微環境。因此,相比于傳統的生物支架材料,ECM 凝膠具有更大的優勢,是細胞支架的一個重要組成部分與發展方向。Ghuman 等[5]以豬膀胱去細胞支架制備 ECM 凝膠材料,經微創注射植入大鼠腦中風病灶內并取得一定療效。該研究在植入病灶的支架中明顯觀察到正常神經細胞的遷移軌跡和增殖分化行為。另有研究證實,利用心肌 ECM 凝膠制備體外細胞培養的支架材料,有利于作為細胞黏附位點,為心肌細胞分化為正常組織提供良好的營養環境[6]。
在目前報道的諸多組織去細胞化技術中,針對不同組織的去細胞化方法有所不同。本實驗基于前期對不同去細胞化方案的比較,選用化學提取法進行大鼠子宮去細胞化,并進行了一系列大鼠子宮去細胞支架的質量評價,并進一步制備了子宮 ECM 凝膠,同時探究其所含生物活性成分和凝膠流變學性能,以期為子宮生物組織工程提供一種理想的支架材料。
1 材料和方法
1.1 材料
實驗動物:健康雌性 Sprague Dawley(SD)大鼠 20 只,重 260~290 g,購自溫州醫科大學實驗動物中心,無特定病原體(specific pathogen free,SPF)級環境飼養,動物生產許可證號:SYXK(浙)2015-0009。
主要試劑:十二烷基磺酸鈉(sodium dodecyl sulfate,SDS)、曲拉通 X-100(TritonX-100)、脫氧膽酸鈉(odium 3-α,12-α-dihydroxy-5-β-cholan-24-oate,SDC)購自 Sigma 公司;雙氧水(H2O2)購自索萊寶科技有限公司;青霉素-鏈霉素抗生素混合液購自 Gibco 公司;DNA 檢測試劑盒購自美國 Omega 公司;酶聯免疫吸附測定(enzyme-linked immunosorbent assays,ELISA)試劑盒購自武漢博士德公司;兔抗纖維連接蛋白(fibronectin,FN)抗體、兔抗膠原蛋白(collagen,Col)抗體、兔抗彈性蛋白(elasin,EN)抗體購自英國 Abcam 公司;4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI)染色液、愛先藍-糖原(Alcian blue-periodic acid sthiff,AB-PAS)染色試劑盒購自美國 Invitrogen 公司。
1.2 實驗方法
化學提取法制備大鼠子宮去細胞支架:取成年雌性 SD 大鼠,稱重,腹腔注射 1% 戊巴比妥鈉麻醉(劑量為:5 mL/kg)。打開腹腔,在室溫和無菌條件下,經左心室生理鹽水灌注后,將大鼠子宮組織取出,保存在 4℃ 無菌蒸餾水中,而后用化學提取法進行組織去細胞化。大鼠子宮組織首先以 1%SDS 室溫震蕩萃取 12 h,無菌蒸餾水漂洗 3 次,每次 10 min;然后以 3% TritionX-100 室溫震蕩萃取 12 h,洗滌;加入 4% SDC,室溫震蕩萃取 24 h,無菌蒸餾水漂洗 3 次,每次 10 min。搖床震蕩速度設置為 120 r/min。萃取后的大鼠子宮組織經 0.01% H2O2 沖洗后,置 4℃ 無菌磷酸緩沖鹽(phosphate buffer saline,PBS)溶液(0.01 mol/L,pH = 7.4)中保存備用。
1.3 組織形態學觀察
1.3.1 掃描電鏡觀察
大鼠子宮去細胞組織用 4% 戊二醛前固定 48 h,PBS 漂洗;1% 鋨酸后固定,PBS 漂洗;行丙酮梯度脫水,分別以 50%、70%、90%、100% 的醋酸異戊酯置換,臨界點干燥儀干燥,真空噴金鍍膜,最后將標本置于掃描電鏡(H-7500,Hitachi 集團/日本)下觀察其微觀形態。
1.3.2 組織化學染色
將大鼠子宮組織分為兩組:正常組(未加任何處理)和去細胞支架組(經去細胞化處理)。用 4% 多聚甲醛分別固定正常組和去細胞支架組的大鼠子宮組織,脫水、石蠟包埋、切片。常規石蠟切片染色處理,根據不同染色試劑盒操作過程,進行不同病理染色。蘇木精-伊紅(hematoxylin-eosin,HE)染色評價細胞是否殘留,Masson 染色檢測大鼠子宮組織中基底層膠原成分是否存在,正置熒光顯微鏡(Nikon-ECLIPSE Ti-S,北京瑞科中儀有限公司/北京)光學鏡下觀察組織結構改變。
1.3.3 免疫熒光染色
將石蠟切片經脫蠟、水化、洗滌、DAPI 熒光染色,組織切片染色結果用正置熒光顯微鏡(Nikon-ECLIPSE Ti-S,北京瑞科中儀有限公司/北京)觀察,評價是否有細胞殘留。
1.4 制備子宮 ECM 凝膠
將大鼠子宮去細胞支架剪碎,冷凍干燥 24 h,以液氮研磨成粉末狀。將支架粉末與胃蛋白酶以 10∶1 的質量比混合到 0.1 mol/L 的 HCl 溶液中,混合溶液在 37℃ 水浴消化 48 h。酶解反應完全后,用 NaOH 中和支架溶液,調節 pH 值為 7.4,以停止胃蛋白酶的消化作用,然后用 PBS 進行稀釋,即制成大鼠子宮 ECM 凝膠(簡稱:ECM 凝膠)。ECM 凝膠經凍干后于 –80℃ 中保存備用。
1.5 子宮去細胞組織蛋白含量檢測
1.5.1 免疫組化染色
取大鼠子宮去細胞支架組石蠟切片經脫蠟、水化、抗原修復處理后,分別滴加 FN、Col、EN 單克隆抗體,37℃ 恒溫箱中孵育 1 h。滴加二抗,37℃ 恒溫箱中下孵育 2 h,蘇木素染色液復染細胞核,中性樹膠封片。觀察各組樣本蛋白 FN、Col、EN 的表達及分布情況。
1.5.2 AB-PAS 染色
分別將兩組大鼠子宮組織石蠟切片經脫蠟、水化、洗滌。根據染色試劑盒步驟進行染色操作,光學顯微鏡下觀察兩組大鼠子宮組織中黏多糖蛋白(glucosamnoglycans,GAGs)的保留情況。
1.5.3 特異性 ELISA 檢測
針對不同的蛋白,現已有不同的蛋白測定試劑盒。以標準品濃度為橫坐標,光密度(optical density,OD)值為縱坐標,繪制標準曲線。將制備好的 ECM 凝膠稀釋至 ELISA 試劑盒檢測濃度范圍內,用生理鹽水梯度稀釋(比例分別為:1∶2,1∶3,1∶4,
 ,1∶l0),嚴格按試劑盒說明書操作測定 OD 值,根據標準曲線,推算出 FN、Col、EN 等蛋白濃度。各蛋白濃度檢測實驗重復 3 次。最后將各 ECM 凝膠的蛋白濃度與正常子宮組織蛋白濃度含量進行比值分析,得到 ECM 凝膠中各類蛋白的含量百分比。
,1∶l0),嚴格按試劑盒說明書操作測定 OD 值,根據標準曲線,推算出 FN、Col、EN 等蛋白濃度。各蛋白濃度檢測實驗重復 3 次。最后將各 ECM 凝膠的蛋白濃度與正常子宮組織蛋白濃度含量進行比值分析,得到 ECM 凝膠中各類蛋白的含量百分比。
1.6 ECM 凝膠流變學性能檢測
本文采用動力流變儀(Discovery HR-2,TA 儀器公司/上海)對 ECM 凝膠進行流變學性能檢測。首先,將 ECM 凝膠樣品置于 37℃ 環境下形成穩定凝膠。儀器程序設定如下:測試夾具為 25 mm 平行板,剪切頻率設定為 10 rad/s,剪切應變為 1%,溫度精確控制在±0.1℃范圍內 ,恒溫 10 min 后,測定樣品的彈性模量(G’)和黏性模量(G”)。測定結果以時間(t)與 G’ 和 G” 作曲線圖。設定 0.1~100 Hz 的剪切頻率(ω)掃描范圍,剪切應變為 1%。上樣后平衡 5 min,進行頻率掃描實驗,觀察 ECM 凝膠樣品的 G’ 和 G” 以及復合黏度(η)變化情況。進行 3 次重復性實驗,結果取其平均值。
2 結果
2.1 大鼠子宮去細胞支架及其 ECM 凝膠的制備
正常組大鼠子宮組織呈粉紅色,表面分布有毛細血管網,血管內可見殘留血液。在制備去細胞支架的過程中,子宮組織經化學試劑振搖逐漸由外至內變白,逐漸變為半透明,完全去細胞化的大鼠子宮組織為乳白色半透明狀,如圖 1 所示。
通過掃描電鏡(H-7500,Hitachi集團/日本)觀察,本文處理的大鼠子宮組織經去細胞化后保留了完好的三維支架結構,孔間連接完整,纖維層連接斷裂較少,如圖 2 所示。由大鼠子宮去細胞支架制得的 ECM 凝膠在制備過程中一直保持為乳白色,經胃蛋白酶消化后呈凝膠狀,在體溫(37℃)時穩定形成凝膠,如圖 1 所示。
 圖1
化學提取法制備大鼠子宮去細胞支架流程圖及 ECM 凝膠制備過程
Figure1.
Preparation process of rat uterine decellularized scaffold and ECM hydrogel by chemical extraction
圖1
化學提取法制備大鼠子宮去細胞支架流程圖及 ECM 凝膠制備過程
Figure1.
Preparation process of rat uterine decellularized scaffold and ECM hydrogel by chemical extraction
 圖2
大鼠子宮去細胞支架掃描電鏡結果
Figure2.
Scanning electron microscope image of rat uterine decellularized scaffold
圖2
大鼠子宮去細胞支架掃描電鏡結果
Figure2.
Scanning electron microscope image of rat uterine decellularized scaffold
2.2 大鼠子宮去細胞支架組織學觀察
如圖 3 所示,HE 染色顯示正常組子宮組織中分布大量藍紫色的細胞核,細胞緊密排列,細胞膜及細胞核完整。去細胞支架組的子宮組織基底層去細胞化完全,肌層有較多淺粉色細胞外基質留存,整體去細胞組織未見殘留細胞及細胞核結構。同時,去細胞支架組子宮基底層腺體結構保留完整,肌層紋理網格清晰可見。正常組的子宮組織經 DAPI 熒光染色顯示藍色胞核清晰,去細胞支架組未見明顯 DAPI 與細胞核結合后發出的藍色強熒光。Masson 染色可見去細胞支架組有明顯的紅色肌纖維,藍色膠原纖維成分保留較多,細胞外膠原纖維的結構排列基本保持,細胞外基質的彈性纖維結構總體正常。
 圖3
大鼠子宮組織組織學評價(200×)
Figure3.
Histological evaluation of uterus in rats (200×)
圖3
大鼠子宮組織組織學評價(200×)
Figure3.
Histological evaluation of uterus in rats (200×)
2.3 大鼠子宮去細胞支架免疫組化染色結果
如圖 4 所示,大鼠子宮去細胞支架中仍保留有大量的 FN、Col、EN 等重要蛋白,同時還保留有一定含量的黏多糖蛋白。同時,應用蛋白特異性 ELISA 試劑盒對 ECM 凝膠中各蛋白含量進行定量檢測。研究結果表明,ECM 凝膠中各蛋白成分保留齊全,其中 FN 和 Col 成分保留最多,分別為 32% 和 26.7%。
 圖4
大鼠子宮去細胞支架 ECM 成分檢測
Figure4.
Detection of ECM components in rat uterine decellularized scaffold
圖4
大鼠子宮去細胞支架 ECM 成分檢測
Figure4.
Detection of ECM components in rat uterine decellularized scaffold
2.4 ECM 凝膠流變學性能檢測
通過流變學性能檢測揭示 ECM 凝膠的凝膠化過程和機械性能。如圖 5 所示,在 37℃ 下,ECM 凝膠的 G’ 和 G” 值在 3 min 時相等,說明 ECM 溶液開始相變形成凝膠。隨后 G’ 和 G” 值繼續增加,在 10 min 時達到最大值,且在 30 min 后仍保持穩定,說明 ECM 凝膠以凝膠狀態穩定存在。ECM 凝膠最大 G’ 值大于最大 G” 值,說明 ECM 凝膠為類固體凝膠。采用振幅剪切模式觀察 ECM 凝膠的穩定性和動態黏度,如圖 5 中頻率掃描曲線所示,ECM 凝膠的 G’ 和 G” 與頻率之間無明顯相關性,即 ECM 凝膠不呈頻率依賴性,膠凝穩定。在整個頻率掃描范圍內,初始復合黏度值大,隨剪切頻率增加,凝膠結構被破壞,其復合黏度減小,表明 ECM 溶液具有假塑性流體性質。
 圖5
ECM 凝膠流變學性能檢測
Figure5.
Rheological characterization of ECM hydrogel
圖5
ECM 凝膠流變學性能檢測
Figure5.
Rheological characterization of ECM hydrogel
3 分析與討論
目前關于子宮組織工程學的研究內容主要包括體外子宮內膜構建和移植支架材料兩大方面。其中子宮內膜培養法的種子細胞體外培養技術已經相對成熟。雖然子宮內膜培養法能達到體外對子宮各種病理學和生理學的研究目的,也為建立胚胎植入的體外模型提供了新的思路,但它在目前的研究過程中仍存在一定的局限性,如子宮內膜構建中傳統的硬支架材料降解慢、組織強度大、無法模擬子宮生理功能以及細胞結構被支架材料破壞和內部組織出現壞死等問題。隨著干細胞發育生物學以及材料力學的發展,人們開始認識到體外構建一個類似于自然子宮組織的重要性[7]。因此,如何構建出適合體內移植和種子細胞生長所需的支架材料成為子宮組織工程研究的關鍵。
由于子宮組織經歷著動態、周期性的更新,胚胎受精過程復雜,常規的生物支架材料如聚乙交酯-丙交酯、膠原等生物材料無法分泌細胞周期中所需的激素,構建一個類似的生理營養環境,也無法模擬人體子宮的收縮和擴張等生理功能[8]。為了克服以上研究難題,本文選擇了具有良好的生物相容性、低免疫原性和生物活性的大鼠子宮去細胞支架,從根本上打破生物支架/移植材料的局限。Miyazaki 等[9]在研究中制備了大鼠子宮去細胞支架,以切除大鼠正常子宮角 1/3 段作為子宮缺損疾病模型,將大鼠子宮去細胞支架替代原有子宮組織進行部分組織移植治療。治療 90 d 后,支架移植組子宮腔道上皮化明顯,肌層再細胞化密集,有一定水平雌激素受體表達,同時生殖功能評價結果顯示大鼠懷孕率為 75%。這一體內去細胞支架同種移植的研究表明:子宮去細胞支架經在體移植,具有良好的再細胞化和功能化,使應用去細胞支架進行子宮組織再生并恢復其生理功能成為可能。然而,人體子宮組織供體匱乏,異種移植免疫原性和排斥反應不容輕視,且體內研究重復性和可操作性差[10],獲得的信息數量有限。因此,如何在體外構建人造子宮內膜是克服體內研究不足的有效途徑。基于上述研究基礎,大鼠子宮去細胞支架為體外構建子宮內膜提供了合適的生物材料來源,但由于人體子宮結構、生理特性與大鼠子宮的差異,將大鼠子宮去細胞支架選擇合適的且接近于生理狀態的重構形式是子宮內膜構建方法的另一關鍵。
近年來,有研究者采用子宮內膜上皮細胞和基質細胞在膠原/人工基底膜(Matrigel)復合支架材料上種植培養,并將子宮內膜直接置于支架材料中形成外植塊培養[8],但這種體外形成的三維生物體系與自然子宮在生理結構和組織形態方面有較大的差異,目前只能做一些簡單的生理或病理研究。ECM 凝膠因具有良好的生物相容性,展現了復雜的生物刺激性,有較好的機械性能,逐漸受到科研人員的重視。ECM 凝膠作為組織去細胞支架的延伸應用,利用 ECM 中所含各類蛋白質成分通過正常生理比例排列成空間構象,為組織器官的實質細胞提供生長發育附著點,也為組織器官結構與功能的重構提供了基礎。Ott 等[11]采用小鼠心臟組織,經去細胞化制備心臟 ECM,并重新注入新生小鼠細胞,經體外培養后心臟復跳,這一研究結果使體外器官組織再生成為可能。本實驗采用化學提取法制備子宮去細胞支架,應用 SDS、TritionX-100 破除細胞,聯合 SDC、H2O2 等化學去垢劑對去細胞支架徹底清洗[12]。其中離子型去污劑 SDS 能減輕 ECM 超微結構的破壞[13]。經 HE、Masson 等染色方法對子宮去細胞支架的組織質量進行評價,結果表明化學提取法制備的子宮去細胞支架基本無細胞與細胞核殘留,可有效避免去細胞支架在體應用的免疫排斥反應。免疫組化和 ELISA 法的結果進一步表明子宮去細胞支架較完整地保留了 ECM 的主要成分,如 FN、Col、EN、GAGs,且 ECM 凝膠中以 FN 含量最高。FN 作為高分子糖蛋白,有促進巨噬細胞的吞噬功能,促進細胞與纖維基質間連接的生理作用[14],其中最基本最重要的一項功能是促進細胞的黏連生長。而細胞與材料的相互作用是組織工程研究的主要研究領域,其中細胞與材料的黏附是基礎,細胞必須與材料發生適當的黏附,才有利于遷移、分化和增殖[15]。
ECM 凝膠的流變學性能檢測結果表明,G’ 和 G” 不呈頻率依賴性,ECM 溶液形成的凝膠穩定;ECM 凝膠化后 G’ 值大于 G”,且初始復合黏度值大,說明 ECM 凝膠為具有黏彈性的類固體凝膠。ECM 凝膠主要由生物組織制備而成,不具有傳統硬支架材料的硬度和強度,通過提供合適的可降解度和生物活性,有效避免了體外子宮內膜構建中傳統硬支架材料的應用局限。Massensini 等[16]制備豬膀胱 ECM 凝膠,發現 ECM 的膠凝性質具有濃度依賴性,這個膠凝過程可能是所有蛋白組分相互作用或受蛋白濃度影響的結果[17]。研究中 ECM 凝膠的穩定凝膠性質能有效保持子宮結構塑形,但其所形成的膠凝固態也可能在培養過程中對細胞所需的營養物質、氧氣和代謝物的擴散和分布產生影響。其中細胞生長所需的營養物質是由機體體液交換提供,細胞增殖分化、組織的形成和功能的表達高度依賴于體內微環境。如果將 ECM 凝膠作為細胞遞送或細胞嵌入介質,其產生的物質擴散和分布的變化可能會影響細胞的生理行為[18-19]。因此,ECM 凝膠影響種子細胞培養中的體外反應以及宿主組織反應的行為可作為將來臨床前研究的另一關注點。
綜上所述,化學提取法制備子宮去細胞支架的方法簡便易行,制備的大鼠子宮去細胞支架具有低免疫原性,且保留了較多 ECM 蛋白成分,為制備 ECM 凝膠提供了理想的支架來源。經大鼠子宮去細胞支架制備的 ECM 凝膠表現出良好的凝膠化性能,可滿足體外種子培養的子宮模型構建和臨床注射支架的應用;同時支架材料中所含的高濃度纖維連接蛋白也可為將來進一步制備子宮組織工程替代移植的生物學功能材料提供研究基礎。