內源性成體神經干細胞的神經發生與大腦正常生理功能以及很多神經退行性疾病息息相關。神經發生受細胞外微環境和胞內信號等因素影響。近幾年,已逐步發現了一些具體的影響成體神經干細胞神經發生,包括增殖、分化、成熟、遷移以及與宿主功能整合等方面的信號通路。本文將從細胞外和細胞內兩方面總結影響神經分化的信號及其分子機制,包括相關信號通路、神經營養因子、神經遞質以及胞內轉錄因子和表觀遺傳調控等,為通過內源性神經干細胞途徑治療中樞神經系統疾病提供基礎理論支持。
引用本文: 應一博, 陳敏, 朱娟娟, 項光恒, 陳夢吉, 毛怡雯, 陳子祺, 朱思品. 內源性成體神經干細胞神經發生機制的研究進展. 生物醫學工程學雜志, 2018, 35(6): 986-992. doi: 10.7507/1001-5515.201707005 復制
版權信息: ?四川大學華西醫院華西期刊社《生物醫學工程學雜志》版權所有,未經授權不得轉載、改編
引言
神經干細胞(neural stem cells,NSCs)是指具有自我更新和增殖能力且能夠分化成神經元、星形膠質細胞和少突膠質細胞的細胞群[1]。目前已公認,成體神經干細胞(adult neural stem cells,aNSCs)主要存在于大腦側腦室外側壁的腦室下區(subventricular zone,SVZ)和海馬齒狀回(dentate gyrus,DG)的顆粒下區(subgranular zone,SGZ)[2]。神經發生是指中樞神經系統產生新神經元并整合到現存的神經環路中的過程。大量研究證明,aNSCs 的正常神經發生和學習記憶等認知功能息息相關,其缺失或異常可引發許多神經退行性疾病,如帕金森病、抑郁癥、癲癇等。同時還發現,成體大腦內很多腫瘤的形成可能與神經干細胞的調節異常有關。因此,充分了解 aNSCs 的神經發生機制對于了解神經退行性疾病等中樞神經系統疾病的病因和發掘內源性 aNSCs 的治療潛力具有重大意義。本文著重對于內源性 aNSCs 的神經發生,包括增殖、分化、成熟、遷移以及與宿主功能整合等方面的分子機制進行綜述。
1 內源性 aNSCs 的發生發展概述
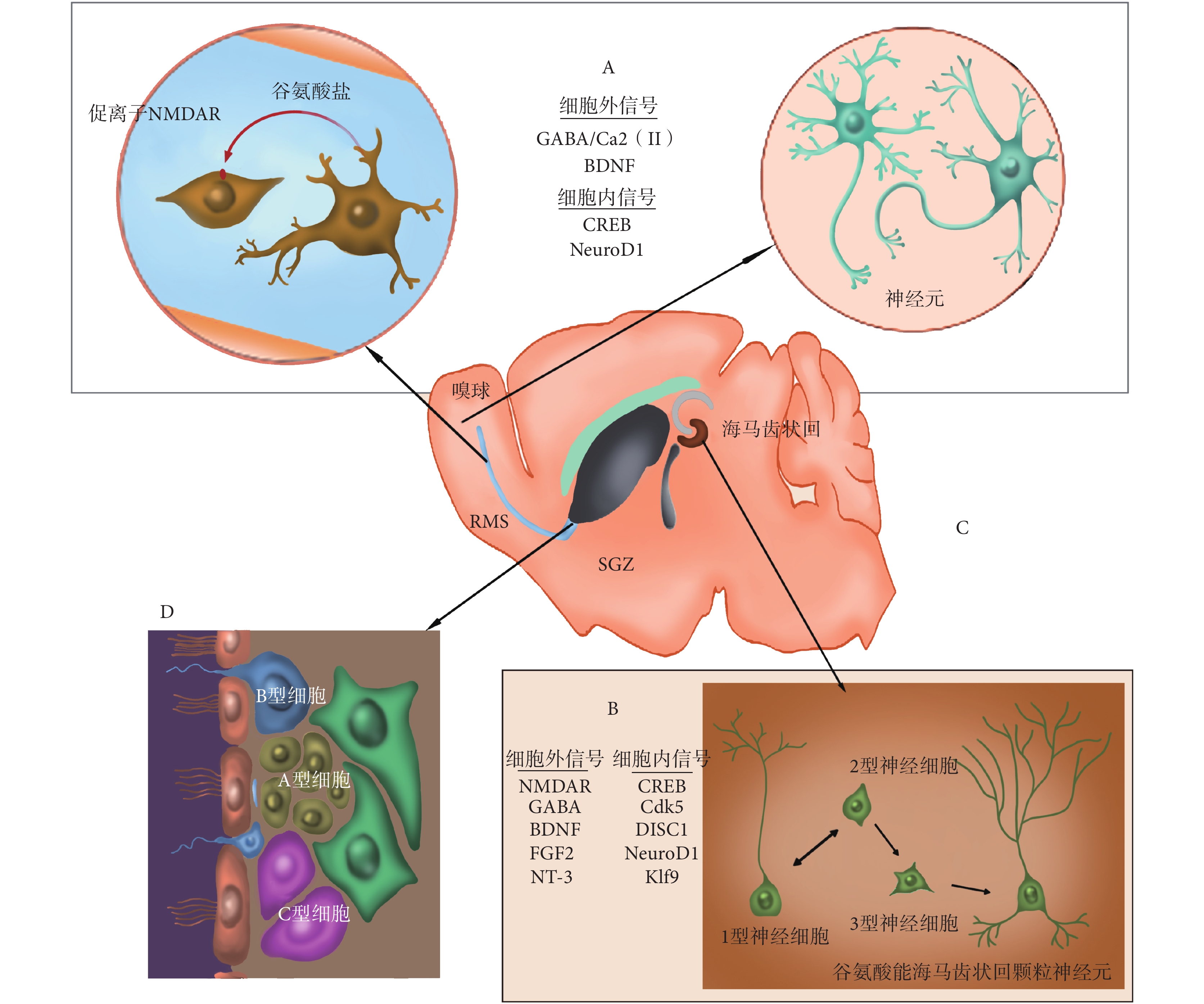
aNSCs 的神經發生最先出現在 SVZ 和 SGZ 區域。在 SVZ 區域中,神經干細胞可以根據其形態學表型分為 4 類,即 A、B、C、E 型細胞。其中膠質纖維酸性蛋白(glial fibrillary acidic protein,GFAP)陽性(GFAP+)及人類造血干跨膜糖蛋白(human hematopoietic transmembrane glycoprotein,CD133)陽性的 B 型細胞是處于靜止或增殖緩慢狀態的放射狀膠質細胞,其頂端和 E 型細胞一起構成了側腦室的外側壁,并可通過不對稱分裂產生一個 B 型細胞和一個 C 型細胞。C 型細胞即神經祖細胞,又叫做短暫擴充細胞(transit amplifying cells),表現為同源異性盒基因 2(disstal-less homeobox2,Dlx2)陽性、保守 RNA 結合蛋白 1(Mashl)陽性、表皮生長因子受體(epidermal growth factor receptor,EGFR)陽性,其增殖旺盛,可以分化成帶有早期神經元標志物多唾液酸神經細胞黏附分子(sialic acid nerve cell adhesion molecule,SA-NCAM)和雙皮質素(doublecortin)的 A 型細胞,即神經元母細胞。A 型細胞將沿著一條高度局限的遷移通道—嘴側遷移流(rostraI migratory stream,RMS)遷移到嗅球(olfactory bulb,OB),并分化成 γ-氨基丁酸(gamma-aminobutyric acid,GABA)能顆粒中間神經元、多巴胺能或者谷氨酸能球旁中間神經元,并整合到局部神經環路。嚙齒類動物每天可以產生數千個 A 型細胞,但只有少數可以存活并遷移到嗅球神經環路中[3]。
在成年小鼠大腦的海馬齒狀回的 SGZ 區域,神經干細胞可以根據其形態學表型分為 3 類,即 1、2、3 型細胞。放射狀膠質細胞(radial glia-like cells,RGLs)即 1 型細胞,表現為 GFAP+、性別決定區 Y-盒 2(sex determining region Y-box 2,Sox2)陽性(Sox2+)、巢蛋白(Nestin)陽性(Nestin+),處于靜止或休眠狀態;但其可通過不對稱分裂產生神經元限制性祖細胞,即 2 型神經細胞,表現為 GFAP—,Sox2+,Nestin+。2 型神經細胞可以分化產生神經元母細胞即 3 型細胞,3 型細胞從顆粒下層向顆粒層遷移并逐步成熟,形成谷氨酸能海馬齒狀回顆粒神經元[4]。這個變化受細胞內信號環磷腺苷效應元件結合蛋白(cAMP-response element binding protein,CREB)、細胞周期素依賴蛋白激酶 5(cyclin-dependent kinase 5,Cdk5)、精神分裂癥斷裂基因 1(schizophrenia break gene 1,DISC1)、Kruppel 樣轉錄因子 9(Kruppel-like transcription factors 9,Klf9)、小鼠同源蛋白神經元分化因子 1(neurogenic differentiation factor 1,NeuroD1)、N-甲基-D-天門冬氨酸受體(N-methyl-D-aspartate receptor,NMDAR)、GABA、腦源性神經營養因子(brain derived neurotrophic factor,BDNF)、成纖維細胞生長因子 2(fibroblast growth factor 2,FGF2)、神經營養素 3(neurotrophin-3,NT-3)等因子的影響。有研究表明,人海馬齒狀回區終身保持激活的狀態,每天可以產生幾千個新的神經元[5]。調節新生神經元功能整合以及成人腦神經發生的因素的總結如圖 1 所示。
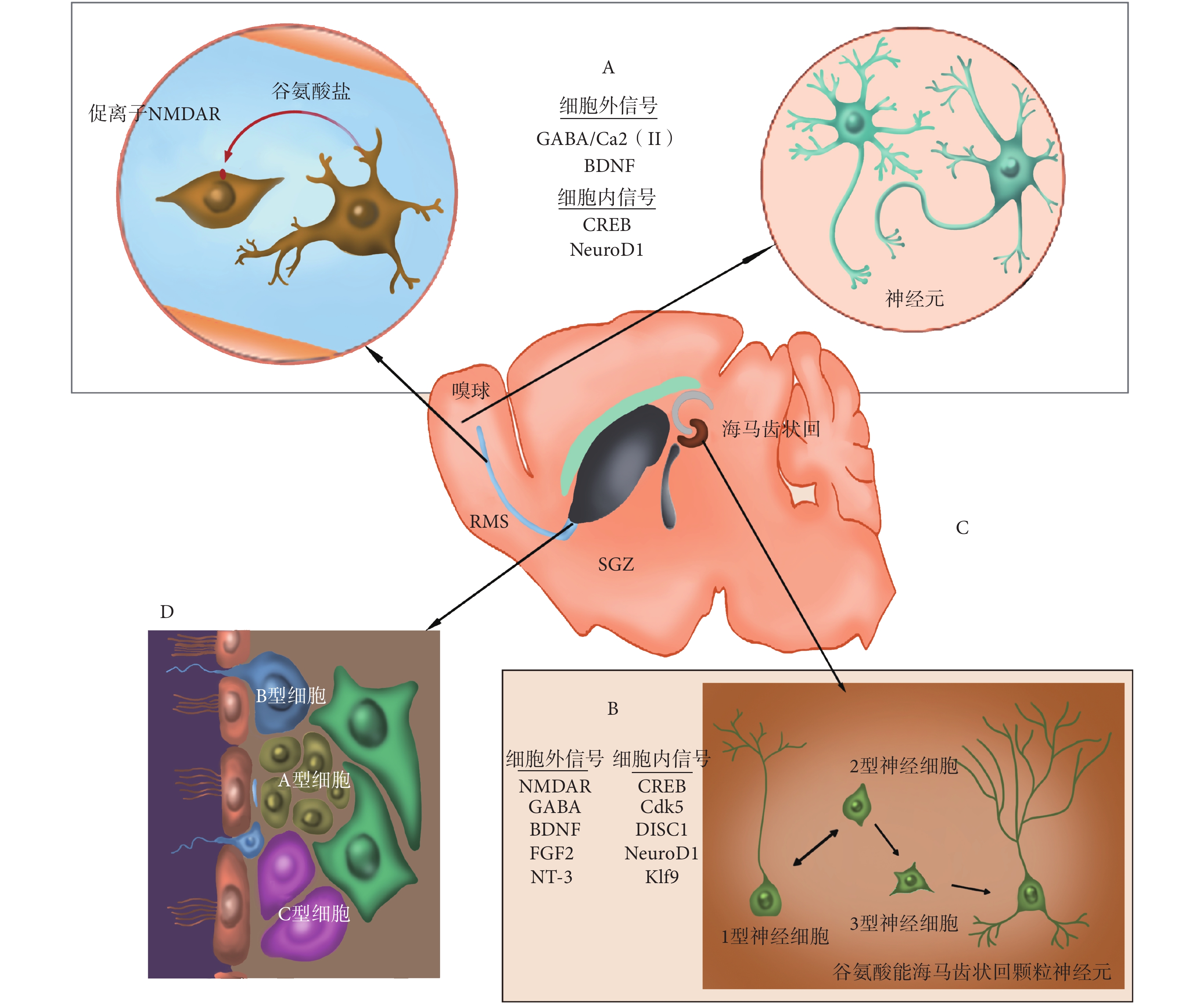 圖1
調節新生神經元功能整合、成人腦神經發生因素示意圖
Figure1.
Factors regulating the functional integration of newborn neurons and neurogenesis in the adult brain
圖1
調節新生神經元功能整合、成人腦神經發生因素示意圖
Figure1.
Factors regulating the functional integration of newborn neurons and neurogenesis in the adult brain
2 aNSCs 微環境及其作用
2.1 細胞與細胞間的相互作用和信號
成年神經發生區內細胞與細胞之間的相互作用可以通過反饋、分裂和信號等影響干細胞的維持、增殖和分化過程。在 aNSCs 微環境中,星形膠質細胞既具有感受器又具有調控器的作用,它們的突起與所有的干細胞類型有緊密的關聯。星形膠質細胞之間通過縫隙連接而發生廣泛的聯系,因此它們可能在微環境中提供快速的信號傳遞。頭蛋白(noggin),是骨形態發生蛋白(bone morphogenetic proteins,BMPs)信號通路的一種抑制劑,經 SVZ 的室管膜細胞產生后,能抑制經 BMPs 信號通路所誘導產生 SVZ 神經干細胞的膠質細胞分化,從而促進神經細胞的定向分化。在發育過程中,基質細胞衍生因子 1(stromal cell derived factor 1,SDF1)由腦脊膜分泌,其作用是維持并且吸引腦前體細胞,并與有絲分裂劑協同作用促進前體細胞增殖[6]。
2.2 細胞因子信號
細胞因子與神經干細胞的遷移、分化、增殖密切相關,不同的細胞因子在神經干細胞的誘導分化中起重要作用,但尚未有一種細胞因子能在體外將神經干細胞全部誘導分化為所需的功能細胞。細胞因子信號在神經干細胞的不同發育階段起作用,在成體神經發生區,它反映了對整個細胞分裂過程重要的調控作用。在體內注入表皮生長因子(epidermal growth factor,EGF)后,C 型細胞可抑制神經母細胞的產生和快速分裂,并促進細胞沿著血管遷移。使用遺傳學方法可以在體內選擇性殺傷 C 型細胞,顯著地減少這種應答[7]。
2.3 成體生發區的血管微環境
干細胞微環境與血管生成有著密切的聯系,血管腔由內皮細胞和周細胞組成,僅通過一層基板與腦室系統分隔開,血管生成常影響神經的生成,兩者密不可分。神經生成和血管生成是由相同的因子起調控作用的,包括 FGF2、血管內皮生長因子(vascular endothelial growth factor,VEGF)、胰島素生長因子 1(insulin-like growth factors 1,IGF1)和轉化生長因子(transforming growth factor,TGF)等。研究表明,用 X 線照射破壞內皮細胞和 SGZ 細胞的內在聯系后,將刺激神經再生環境,出現小膠質細胞的增生,甚至可誘導干細胞主要分化為膠質細胞[8]。
2.4 細胞外基質和基板
細胞外基質(extracellular matrix,ECM)由膠原蛋白、蛋白多糖、彈性蛋白等組成。在干細胞微環境中,基板類似于 ECM,可吸引細胞因子,吸附細胞,并為干細胞提供空間環境。在成年 SVZ 內特化的基板和 ECM 成分可能共同參與形成干細胞微環境[9]。但是,體外研究表明,神經干細胞受到不同種類、不同濃度的因子,及多種因子聯合應用的影響各不相同;在神經干細胞分化的不同階段,相同因子的作用也不同。例如:在 EGF 和堿性成纖維細胞生長因子(basic fibroblast growth factor,bFGF)因子存在的條件下,胚胎神經干細胞主要向神經元、少突膠質細胞和星形膠質細胞分化,然而成年的腦神經干細胞,則無論是否存在 EGF 和 bFGF 因子,都主要分化為星形膠質細胞。
3 細胞外信號對 aNSCs 發生發展的影響及其分子機制
通過誘導 aNSCs 特定基因表達技術,現已發現一些可溶膜結合細胞外因子和相應的信號通路可作為 SVZ 和 SGZ 微環境的重要組成部分,包括 Wnt 信號通路、棘猬(sonic hedgehog,Shh)信號通路、Notch 信號通路、BMPs 信號通路、神經營養因子和神經遞質,分述如下。
3.1 Wnt/β-鏈蛋白(β-catenin)信號通路
Wnt 配體通過自分泌和旁分泌路徑產生,可以結合并活化目的細胞上的跨膜受體卷曲蛋白(frizzled,FZD)和低密度脂蛋白相關蛋白 5/6(low density lipoprptein receoter related protein 5/6,LRP5/6)受體,活化的受體復合物可以招募并磷酸化細胞內亂蓬蛋白(dishevelled,DVL),磷酸化的 DVL 可以抑制糖原合成酶激酶-3(glycogen synthase kinase-3,GSK-3β)的激活,從而使 β-catenin 在胞內穩定存在并轉至核內與核內激活淋巴樣增強因子/T 細胞因子(lymphoid enhancer factor/T cell factor,LEF/TCF)結合。在缺少 Wnt 配體時,GSK-3β 激活并介導傳導蛋白(axin)、結腸腺瘤病基因蛋白(colon adenoma gene protein,APC)和 β-catenin 等形成降解復合物,導致 β-catenin 在胞內被降解,促進目的基因的轉錄,如:小鼠基質金屬蛋白酶 7(mouse matrix metalloproteinase 7,MMP7)、DNA 結合抑制劑 2(inhibitor of DNA binding,ID2)、傳導蛋白 2(axin2)、成纖維細胞生長因子 20(fibroblast growth factor 20,FGF20)等基因。
Wnt 信號通路缺陷可以導致很多中樞神經系統的疾病,包括精神分裂癥、阿爾茨海默病等。已有研究報道,Wnt 信號通路在成體大腦神經發生中起作用。例如:研究發現,Wnt 配體 3(Wnt3)在海馬齒狀回細胞和體外海馬星形膠質細胞上都有強表達,并且 Wnt 信號可以通過 β-catenin 通路調節海馬神經母細胞的擴增和神經元的分化[10]。另外,成體海馬齒狀回轉染 Wnt 雜合表達的慢病毒,可使其神經發生退化,說明在成體海馬中 Wnt 信號對神經發生具有重要意義。在成年 SVZ 中 Wnt 配體 3a(Wnt3a)和 Wnt 配體 5a(Wnt5a)過表達可以促進離體 SVZ 的成體神經祖細胞的分化。另外,通過逆轉錄病毒技術使其穩定表達 β-catenin,可以促進成體 SVZ 神經祖細胞的擴增,增加嗅球的神經發生。
3.2 Notch 信號通路
Notch 信號通路可以影響 aNSCs 的擴增、分化和凋亡等神經發生過程。Notch 受體是一個單通道的跨膜異構二聚體,與鄰近細胞的 Notch 配體相互作用而發生構象改變,釋放出 Notch 的胞內段(Notch intracellular domain,NICD),NICD 轉移至細胞核內,與轉錄抑制因子重組信號序列結合蛋白 Jκ(recombination signal sequence binding protein Jκ,RBP-Jκ)結合并募集四聚物(Groucho)/轉導蛋白樣增強子(transducin-like enhancer,TLE)等轉錄共抑制因子,阻礙發狀分裂相關增強子(hairy and enhancer of split,HES)等靶基因表達,最終影響細胞的分化、增殖和凋亡。Notch 通道的組成部分在成年哺乳動物大腦內的 SVZ 和 SGZ 都有表達。在成體大腦 SVZ 中,條件性地敲除 SVZ 中的 RBP-Jκ,可以導致所有的 B 型細胞向 C 型細胞分化,最終導致神經干細胞耗竭,使神經發生提前終止[11]。
另外,Notch 信號對成體小鼠大腦內未成熟的神經元的樹突生長有重要的作用。敲除 Notch 同源物 1(notch homolog 1,Notch1)后,導致樹突結構簡單,而過表達 Notch1 導致新生的海馬齒狀回顆粒細胞的樹突更加復雜[12]。
3.3 Shh 信號通路
Shh 是細胞外可溶性蛋白,通過調節跨膜受體蛋白和它的 G 蛋白耦合體(smoothened,Smo)組成的受體復合物來發揮在神經系統發育中重要的調節作用。
研究發現,Shh 對于成體哺乳動物大腦的神經發生具有重要作用,其信號通路的組成成分在成體海馬以及成體 SVZ 中都有很高表達。在成體海馬中,通過腺病毒轉錄使海馬齒狀回中神經祖細胞過表達 Shh,可增加其增殖能力。相反的,將 Shh 信號的抑制劑導入成體海馬時,海馬齒狀回中的顆粒細胞增殖能力下降[11]。
Shh 除了在 aNSCs 的自我更新和增殖中扮演重要角色外,還是成體哺乳動物大腦內的細胞遷移的重要調節因子。在成體 SVZ 區缺失 Shh 信號蛋白可以導致 A 型細胞不能向嗅球遷移[13]。
3.4 神經營養因子和生長因子
3.4.1 神經營養因子
神經營養因子是一些細胞外蛋白,在中樞神經系統發育中有重要作用。在哺乳動物中,已有 4 種神經營養因子被發現,分別是神經生長因子(nerve growth factor,NGF)、BDNF、NT-3 和神經營養素 4/5(neurotrophin-4/5,NT-4/5)。神經營養因子可以和絡氨酸激酶受體(tyrosine kinase receptor,Tkr)以及它們的共同受體 p75 神經營養素受體(p75 neurotrophinp recepter,75NTR)結合,形成二聚體,并使胞質端特定的絡氨酸殘基自我磷酸化,產生一系列下游效應產物,激活信號轉導。
BDNF 在神經發生中的作用被研究的較多。長期向成體海馬齒狀回中注入 BDNF 可以增加顆粒細胞的神經發生。相似的,在成體 SVZ 內,向側腦室直接注射 BDNF 可以明顯增加新生神經元的形成。
另一方面,在成體海馬中,條件性地敲除 NT-3 可以明顯損害神經干細胞的分化,但不影響其擴增。另外,NT-3 缺陷小鼠的學習和記憶有缺陷,提示 NT-3 可以調節神經元分化,而不是擴增,因為成體大腦學習和記憶的形成和神經元分化有關。在成體大鼠的側腦室直接持續灌注 NGF 對于海馬齒狀回顆粒層神經前體細胞的擴增并沒有作用,但可以增加成體海馬中的神經元的存活[14]。
3.4.2 生長因子
生長因子可以調節成體大腦內的神經發生,主要有 FGF2、IGF1 和 VEGF。這些生長因子在信號轉導中有個共同特點,就是和絡氨酸激酶受體家族結合。配體和受體結合后,使胞質內區域自身磷酸化,激活一系列下游信號通路包括 PI-3K/Akt 和 Ras/Raf/MEK/Erk 信號通路,從而調節神經發生[15]。
最近研究表明,FGF2 是成體大腦內神經發生的重要調節因子,側腦室灌注 FGF2 可以增加成體海馬新生細胞[16]。持續皮下注射或者腦室內注射 IGF1 可以促進成體海馬的神經發生。另外,現已發現 IGF1 可以促進來自 SVZ 的神經母細胞通過 RMS 向嗅球遷移。Yuan 等[17]發現 VEGF 的受體在成體海馬和 SVZ 的神經前體細胞和室管膜細胞都有表達并可以直接促進神經前體細胞有絲分裂。向成體大鼠側腦室直接灌注 VEGF 可以增加 SVZ 和 SGZ 的神經發生。
3.5 神經遞質
神經遞質是介導神經元之間信息傳遞的可擴散性小分子。研究證明,神經遞質在調節 aNSCs 的增殖、分化以及突觸整合等過程中起著重要作用[18]。這些神經遞質主要包括谷氨酸、GABA、多巴胺等。
3.5.1 谷氨酸
谷氨酸是腦內一種興奮性神經遞質,可以結合體內不同亞型的受體,如促離子 NMDAR 等。研究表明,成體 SVZ 和 SGZ 區中的神經前體細胞都有大量谷氨酸受體表達。在 SVZ 區中,神經母細胞在向嗅球遷移過程中大量表達谷氨酸受體,敲除神經母細胞的 NMDAR 可導致其在遷移中發生凋亡,提示谷氨酸可以通過 NMDAR 調節神經母細胞的存活[19]。
3.5.2 GABA
GABA 是成體腦內主要的抑制性神經遞質,GABA 受體是一種離子通道型受體,與大腦神經發生密切相關。在 SVZ 區,神經母細胞釋放 GABA 可以通過和 GABA 受體結合,減少 GFAP+的神經干細胞的增殖,并且還可以直接影響神經母細胞的遷移。在隨后的研究中,條件性地敲除 GABA 受體的 γ2-亞基,導致神經干細胞快速退出靜息狀態,促進對稱分裂的自我更新,提示 GABA-γ2 作為一種重要的機制在 aNSCs 的自我更新模式中發揮作用[20]。
3.5.3 多巴胺
多巴胺是兒茶酚胺類神經遞質,與成體大腦內調節運動及情緒的功能相關。多巴胺受體可以分為兩類,D1 類(D1 和 D5)和 D2 類(D2、D3 和 D4)。在成體 SVZ 區,抑制 C 型細胞多巴胺能受體可以明顯減少 SVZ 中神經干細胞的增殖。通過緩慢釋放左旋多巴刺激 C 型細胞上的 D2 類受體可以促進成體 SVZ 區神經干細胞的增殖。在成體海馬區,多巴胺也可以刺激神經前體細胞的增殖[21]。
4 細胞內信號對神經發生的影響及其分子機制
成年小鼠大腦內,細胞內固有的機制如轉錄因子、神經發生的遺傳調節因子都對神經發生發展的調節起關鍵作用。
4.1 轉錄因子
細胞內很多轉錄因子對 aNSCs 的神經發生起重要調節作用,包括 CREB、配對盒基因 6(paired-box gene 6,Pax6)、無剛毛鱗甲同源復合體樣 1(achaete scute complex homolog-like 1,Ascl1)、少突膠質細胞系轉錄因子 2(oligodendrocyte lineage transcription factor 2,Olig2)、Dlx2、Tailless 樣蛋白(Tailless-like,Tlx)等轉錄因子。
CREB 是對細胞的生長和發育有重要作用的轉錄因子,是很多信號通路的磷酸化反應底物。研究表明,通過 cAMP 介導的 CREB 磷酸化可以促進成體海馬中神經干細胞增殖和新生神經元的存活。另外,通過病毒逆轉錄技術使成體小鼠大腦海馬新生細胞誘導細胞自發性 CREB 敲除,可以導致新生海馬顆粒細胞的分化和成熟功能受損[22]。
Pax6 在大腦發育中所起的關鍵作用,主要是作為發生分化和增殖所需的協調和模式形成的調節劑,以確保神經發生成功進行。作為轉錄因子,Pax6 激活和(或)失活基因表達模式,以確保組織的正常發育并在中樞神經系統的信號傳導和形成中起作用。在成體 SVZ 區,Pax6 是在 RMS 中向嗅球遷移的未成熟細胞中表達,并誘導神經母細胞向多巴胺能球旁神經元分化[23]。
Ascl1 是堿性螺旋-環-螺旋(basic/helix-loop-helix,bHLH)家族的一員,可以持續調節成體神經發生中的細胞分化方向。在生理條件下,通過病毒逆轉錄技術使成體海馬神經前體細胞過表達 Ascl1,可以使其主要向少突膠質細胞分化[13,24]。在 SVZ 和嗅球中表達 Ascl1 的 C 型細胞注定成為的 GABA 能中間神經元,而神經元素 2(neurogenin 2,Neurog2)則存在于產生谷氨酸能的近側腎小球神經元的背側 SVZ 祖細胞亞群中。與這些體內分析一致,SVZ 的體外擴增 aNSCs 的所有后代在被迫表達 Neurog2 時獲得谷氨酸能識別,而僅表達 Ascl1 時生成 GABA 能神經元。類似地,Ascl1 和 Neurog2 由成熟神經祖細胞在成熟為谷氨酸能海馬齒狀回顆粒細胞的海馬神經原生態位瞬時表達[25]。有趣的是,逆轉錄病毒介導的 Ascl1 在增殖的成體海馬神經干細胞中的過度表達導致它們僅產生少突膠質譜系細胞而不是神經元,表明單個基因的表達可指導 aNSCs 在其體內生態位的命運選擇。
Dlx2 是前腦神經元分化的特異性調控因子,在成體 SVZ 神經前體細胞以及向嗅球遷移中的神經母細胞中表達。研究發現 Dlx2 過表達可以提高神經元分化能力以及神經母細胞向嗅球遷移速率[26]。
Tlx 是一個在成體大腦內高表達的孤核受體。Tlx 在 SVZ 區 B 型細胞中表達特別多,條件性敲除 Tlx 可以導致成體 SVZ 區的神經干細胞自我更新能力的完全缺失。在成體海馬中,Tlx 的小鼠 aNSCs 缺失了自我更新能力,更易向膠質細胞分化,提示 Tlx 在 aNSCs 維持自身未分化的增殖狀態過程中起重要作用[27]。孤核受體 Tlx 在 aNSCs 的維持和自我更新中發揮重要作用,推測其與組蛋白去乙酰化酶(histone deacetylase,HDACs)復合以抑制細胞周期基因 p21 和第 10 號染色體缺失的磷酸酶及張力蛋白同源的基因(phosphatase and tensin homolog deleted on chromosome ten,PTEN)。 最近發現 Tlx 可以激活 Wnt 配體 7a(Wnt7a)的表達和經典的 Wnt/β-catenin 信號通路,表明神經干細胞具有通過自分泌信號傳導環路調節其自身更新的潛力[28]。
4.2 表觀遺傳調控
表觀遺傳修飾指在基因表達模式上可遺傳的改變,但不涉及原始自身基因編碼的改變,因此雖然可以產生新的細胞表型但不改變真正的基因組序列。表觀遺傳調控機制(包括:DNA 的甲基化、組蛋白修飾)已經成為影響 aNSCs 神經發生的外界環境影響因素和基因轉錄調控之間的重要聯系。
4.2.1 DNA 甲基化
甲基化 C/G 結合蛋白 1(methylated C/G binding protein 1,MBD1)在成體大腦中都有表達,但在成體海馬中表達最為集中。MBD1 缺陷的小鼠海馬的神經發生顯著下降,空間學習能力受損。隨后的研究發現,MBD1 可以通過與神經干細胞絲裂原 FGF2 的啟動子結合從而促進神經元的分化。此外,最近發現 MBD1 可以通過降低 miR-18 的表達促進 aNSCs 的增殖[29]。
甲基 CpG 結合蛋白 2(methyl CpG binding protein 2,MeCP2)是另外一種 MBD,主要在哺乳動物中樞神經系統神經元中表達,與成體神經發生的調節有關。MeCP2缺陷(MeCP2—)的小鼠海馬齒狀回區中新生神經元成熟缺陷,并且脊柱形成也發生缺陷。在體內外實驗中發現,胚胎神經干細胞中 MeCP2 過表達可以抑制星形膠質細胞過表達和促進神經元分化。最近報道顯示,MeCP2 可以通過 miR-137 來調節神經干細胞的增殖和分化[30]。
4.2.2 組蛋白修飾
組蛋白甲基轉移酶(mixed-lineage leukaemia 1,Mll1)在成體 SVZ 表達,對很多生長發育相關的基因都有重要的調節作用。Mll1 的轉基因小鼠在神經干細胞的增殖、存活和膠質細胞分化等方面沒有異常,但在成體 SVZ 神經元分化上有嚴重缺陷[18]。
脆性 X 智力缺陷蛋白(fragile X mental retardation proteins,FMRP)的家族包括:FMRP、脆性 X 精神發育遲滯綜合征相關蛋白 1(fragile X mental retardation syndrome-related protein 1,FXR1)和脆性 X 精神發育遲滯綜合征相關蛋白 2(fragile X mental retardation syndrome-related protein 2,FXR2),它們可以直接選擇性結合 RNA 和多聚核糖體來調節 mRNAs 的轉錄。在成體海馬齒狀回的 aNSCs 中缺少功能性的 FMRP 可以導致星形膠質細胞分化而神經元分化受損,并伴隨海馬依賴的學習功能受損,提示 FMRP 在調節成體神經發生和學習功能中起重要作用[30]。
5 總結及展望
成體哺乳動物大腦神經發生的研究證明了成熟神經系統具有產生新生神經元并與之整合的能力。但是,人們對于 aNSCs 神經發生的調節機制的理解才剛起步,隨著病毒介導單細胞基因改變技術的進步和轉基因動物模型的發展,使研究單個信號分子在各個神經發生階段的作用成為可能。同時,研究人員也開始嘗試了解不同信號通路之間的復雜聯系和相互作用,例如已有研究已經證明,Wnt 和其他信號分子如 Tlx、DISC1、FMRP 和低氧誘導因子-1(hypoxia inducible factor-1,HIF-1)間的相互作用對于 aNSCs 神經發生至關重要。這些研究可以與之前發現的形態學表現和潛在的分子機制聯系起來。
雖然,現已對 aNSCs 的神經發生有了初步的了解,但還處于初級階段,還有很多問題有待進一步解決,例如 aNSCs 微環境的細胞和分子組成以及和 aNSCs 之間的確切聯系和相互作用還未完全了解;表觀遺傳上的調節成體神經發生的作用特點還處于初級階段;中樞神經系統中的少膠質細胞和其他免疫細胞在神經干細胞的增殖和分化中具有重要的微調作用,尚需進一步研究其確切作用和分子機制等。此外,生理條件下 aNSCs 正常神經發生和行為表現之間的聯系;病理條件下,神經發生缺陷產生相應疾病的特點等均值得進一步研究。總之,了解 aNSCs 神經發生的功能性作用及其分子機制可以使中樞神經系統疾病的治療更進一步。
引言
神經干細胞(neural stem cells,NSCs)是指具有自我更新和增殖能力且能夠分化成神經元、星形膠質細胞和少突膠質細胞的細胞群[1]。目前已公認,成體神經干細胞(adult neural stem cells,aNSCs)主要存在于大腦側腦室外側壁的腦室下區(subventricular zone,SVZ)和海馬齒狀回(dentate gyrus,DG)的顆粒下區(subgranular zone,SGZ)[2]。神經發生是指中樞神經系統產生新神經元并整合到現存的神經環路中的過程。大量研究證明,aNSCs 的正常神經發生和學習記憶等認知功能息息相關,其缺失或異常可引發許多神經退行性疾病,如帕金森病、抑郁癥、癲癇等。同時還發現,成體大腦內很多腫瘤的形成可能與神經干細胞的調節異常有關。因此,充分了解 aNSCs 的神經發生機制對于了解神經退行性疾病等中樞神經系統疾病的病因和發掘內源性 aNSCs 的治療潛力具有重大意義。本文著重對于內源性 aNSCs 的神經發生,包括增殖、分化、成熟、遷移以及與宿主功能整合等方面的分子機制進行綜述。
1 內源性 aNSCs 的發生發展概述
aNSCs 的神經發生最先出現在 SVZ 和 SGZ 區域。在 SVZ 區域中,神經干細胞可以根據其形態學表型分為 4 類,即 A、B、C、E 型細胞。其中膠質纖維酸性蛋白(glial fibrillary acidic protein,GFAP)陽性(GFAP+)及人類造血干跨膜糖蛋白(human hematopoietic transmembrane glycoprotein,CD133)陽性的 B 型細胞是處于靜止或增殖緩慢狀態的放射狀膠質細胞,其頂端和 E 型細胞一起構成了側腦室的外側壁,并可通過不對稱分裂產生一個 B 型細胞和一個 C 型細胞。C 型細胞即神經祖細胞,又叫做短暫擴充細胞(transit amplifying cells),表現為同源異性盒基因 2(disstal-less homeobox2,Dlx2)陽性、保守 RNA 結合蛋白 1(Mashl)陽性、表皮生長因子受體(epidermal growth factor receptor,EGFR)陽性,其增殖旺盛,可以分化成帶有早期神經元標志物多唾液酸神經細胞黏附分子(sialic acid nerve cell adhesion molecule,SA-NCAM)和雙皮質素(doublecortin)的 A 型細胞,即神經元母細胞。A 型細胞將沿著一條高度局限的遷移通道—嘴側遷移流(rostraI migratory stream,RMS)遷移到嗅球(olfactory bulb,OB),并分化成 γ-氨基丁酸(gamma-aminobutyric acid,GABA)能顆粒中間神經元、多巴胺能或者谷氨酸能球旁中間神經元,并整合到局部神經環路。嚙齒類動物每天可以產生數千個 A 型細胞,但只有少數可以存活并遷移到嗅球神經環路中[3]。
在成年小鼠大腦的海馬齒狀回的 SGZ 區域,神經干細胞可以根據其形態學表型分為 3 類,即 1、2、3 型細胞。放射狀膠質細胞(radial glia-like cells,RGLs)即 1 型細胞,表現為 GFAP+、性別決定區 Y-盒 2(sex determining region Y-box 2,Sox2)陽性(Sox2+)、巢蛋白(Nestin)陽性(Nestin+),處于靜止或休眠狀態;但其可通過不對稱分裂產生神經元限制性祖細胞,即 2 型神經細胞,表現為 GFAP—,Sox2+,Nestin+。2 型神經細胞可以分化產生神經元母細胞即 3 型細胞,3 型細胞從顆粒下層向顆粒層遷移并逐步成熟,形成谷氨酸能海馬齒狀回顆粒神經元[4]。這個變化受細胞內信號環磷腺苷效應元件結合蛋白(cAMP-response element binding protein,CREB)、細胞周期素依賴蛋白激酶 5(cyclin-dependent kinase 5,Cdk5)、精神分裂癥斷裂基因 1(schizophrenia break gene 1,DISC1)、Kruppel 樣轉錄因子 9(Kruppel-like transcription factors 9,Klf9)、小鼠同源蛋白神經元分化因子 1(neurogenic differentiation factor 1,NeuroD1)、N-甲基-D-天門冬氨酸受體(N-methyl-D-aspartate receptor,NMDAR)、GABA、腦源性神經營養因子(brain derived neurotrophic factor,BDNF)、成纖維細胞生長因子 2(fibroblast growth factor 2,FGF2)、神經營養素 3(neurotrophin-3,NT-3)等因子的影響。有研究表明,人海馬齒狀回區終身保持激活的狀態,每天可以產生幾千個新的神經元[5]。調節新生神經元功能整合以及成人腦神經發生的因素的總結如圖 1 所示。
 圖1
調節新生神經元功能整合、成人腦神經發生因素示意圖
Figure1.
Factors regulating the functional integration of newborn neurons and neurogenesis in the adult brain
圖1
調節新生神經元功能整合、成人腦神經發生因素示意圖
Figure1.
Factors regulating the functional integration of newborn neurons and neurogenesis in the adult brain
2 aNSCs 微環境及其作用
2.1 細胞與細胞間的相互作用和信號
成年神經發生區內細胞與細胞之間的相互作用可以通過反饋、分裂和信號等影響干細胞的維持、增殖和分化過程。在 aNSCs 微環境中,星形膠質細胞既具有感受器又具有調控器的作用,它們的突起與所有的干細胞類型有緊密的關聯。星形膠質細胞之間通過縫隙連接而發生廣泛的聯系,因此它們可能在微環境中提供快速的信號傳遞。頭蛋白(noggin),是骨形態發生蛋白(bone morphogenetic proteins,BMPs)信號通路的一種抑制劑,經 SVZ 的室管膜細胞產生后,能抑制經 BMPs 信號通路所誘導產生 SVZ 神經干細胞的膠質細胞分化,從而促進神經細胞的定向分化。在發育過程中,基質細胞衍生因子 1(stromal cell derived factor 1,SDF1)由腦脊膜分泌,其作用是維持并且吸引腦前體細胞,并與有絲分裂劑協同作用促進前體細胞增殖[6]。
2.2 細胞因子信號
細胞因子與神經干細胞的遷移、分化、增殖密切相關,不同的細胞因子在神經干細胞的誘導分化中起重要作用,但尚未有一種細胞因子能在體外將神經干細胞全部誘導分化為所需的功能細胞。細胞因子信號在神經干細胞的不同發育階段起作用,在成體神經發生區,它反映了對整個細胞分裂過程重要的調控作用。在體內注入表皮生長因子(epidermal growth factor,EGF)后,C 型細胞可抑制神經母細胞的產生和快速分裂,并促進細胞沿著血管遷移。使用遺傳學方法可以在體內選擇性殺傷 C 型細胞,顯著地減少這種應答[7]。
2.3 成體生發區的血管微環境
干細胞微環境與血管生成有著密切的聯系,血管腔由內皮細胞和周細胞組成,僅通過一層基板與腦室系統分隔開,血管生成常影響神經的生成,兩者密不可分。神經生成和血管生成是由相同的因子起調控作用的,包括 FGF2、血管內皮生長因子(vascular endothelial growth factor,VEGF)、胰島素生長因子 1(insulin-like growth factors 1,IGF1)和轉化生長因子(transforming growth factor,TGF)等。研究表明,用 X 線照射破壞內皮細胞和 SGZ 細胞的內在聯系后,將刺激神經再生環境,出現小膠質細胞的增生,甚至可誘導干細胞主要分化為膠質細胞[8]。
2.4 細胞外基質和基板
細胞外基質(extracellular matrix,ECM)由膠原蛋白、蛋白多糖、彈性蛋白等組成。在干細胞微環境中,基板類似于 ECM,可吸引細胞因子,吸附細胞,并為干細胞提供空間環境。在成年 SVZ 內特化的基板和 ECM 成分可能共同參與形成干細胞微環境[9]。但是,體外研究表明,神經干細胞受到不同種類、不同濃度的因子,及多種因子聯合應用的影響各不相同;在神經干細胞分化的不同階段,相同因子的作用也不同。例如:在 EGF 和堿性成纖維細胞生長因子(basic fibroblast growth factor,bFGF)因子存在的條件下,胚胎神經干細胞主要向神經元、少突膠質細胞和星形膠質細胞分化,然而成年的腦神經干細胞,則無論是否存在 EGF 和 bFGF 因子,都主要分化為星形膠質細胞。
3 細胞外信號對 aNSCs 發生發展的影響及其分子機制
通過誘導 aNSCs 特定基因表達技術,現已發現一些可溶膜結合細胞外因子和相應的信號通路可作為 SVZ 和 SGZ 微環境的重要組成部分,包括 Wnt 信號通路、棘猬(sonic hedgehog,Shh)信號通路、Notch 信號通路、BMPs 信號通路、神經營養因子和神經遞質,分述如下。
3.1 Wnt/β-鏈蛋白(β-catenin)信號通路
Wnt 配體通過自分泌和旁分泌路徑產生,可以結合并活化目的細胞上的跨膜受體卷曲蛋白(frizzled,FZD)和低密度脂蛋白相關蛋白 5/6(low density lipoprptein receoter related protein 5/6,LRP5/6)受體,活化的受體復合物可以招募并磷酸化細胞內亂蓬蛋白(dishevelled,DVL),磷酸化的 DVL 可以抑制糖原合成酶激酶-3(glycogen synthase kinase-3,GSK-3β)的激活,從而使 β-catenin 在胞內穩定存在并轉至核內與核內激活淋巴樣增強因子/T 細胞因子(lymphoid enhancer factor/T cell factor,LEF/TCF)結合。在缺少 Wnt 配體時,GSK-3β 激活并介導傳導蛋白(axin)、結腸腺瘤病基因蛋白(colon adenoma gene protein,APC)和 β-catenin 等形成降解復合物,導致 β-catenin 在胞內被降解,促進目的基因的轉錄,如:小鼠基質金屬蛋白酶 7(mouse matrix metalloproteinase 7,MMP7)、DNA 結合抑制劑 2(inhibitor of DNA binding,ID2)、傳導蛋白 2(axin2)、成纖維細胞生長因子 20(fibroblast growth factor 20,FGF20)等基因。
Wnt 信號通路缺陷可以導致很多中樞神經系統的疾病,包括精神分裂癥、阿爾茨海默病等。已有研究報道,Wnt 信號通路在成體大腦神經發生中起作用。例如:研究發現,Wnt 配體 3(Wnt3)在海馬齒狀回細胞和體外海馬星形膠質細胞上都有強表達,并且 Wnt 信號可以通過 β-catenin 通路調節海馬神經母細胞的擴增和神經元的分化[10]。另外,成體海馬齒狀回轉染 Wnt 雜合表達的慢病毒,可使其神經發生退化,說明在成體海馬中 Wnt 信號對神經發生具有重要意義。在成年 SVZ 中 Wnt 配體 3a(Wnt3a)和 Wnt 配體 5a(Wnt5a)過表達可以促進離體 SVZ 的成體神經祖細胞的分化。另外,通過逆轉錄病毒技術使其穩定表達 β-catenin,可以促進成體 SVZ 神經祖細胞的擴增,增加嗅球的神經發生。
3.2 Notch 信號通路
Notch 信號通路可以影響 aNSCs 的擴增、分化和凋亡等神經發生過程。Notch 受體是一個單通道的跨膜異構二聚體,與鄰近細胞的 Notch 配體相互作用而發生構象改變,釋放出 Notch 的胞內段(Notch intracellular domain,NICD),NICD 轉移至細胞核內,與轉錄抑制因子重組信號序列結合蛋白 Jκ(recombination signal sequence binding protein Jκ,RBP-Jκ)結合并募集四聚物(Groucho)/轉導蛋白樣增強子(transducin-like enhancer,TLE)等轉錄共抑制因子,阻礙發狀分裂相關增強子(hairy and enhancer of split,HES)等靶基因表達,最終影響細胞的分化、增殖和凋亡。Notch 通道的組成部分在成年哺乳動物大腦內的 SVZ 和 SGZ 都有表達。在成體大腦 SVZ 中,條件性地敲除 SVZ 中的 RBP-Jκ,可以導致所有的 B 型細胞向 C 型細胞分化,最終導致神經干細胞耗竭,使神經發生提前終止[11]。
另外,Notch 信號對成體小鼠大腦內未成熟的神經元的樹突生長有重要的作用。敲除 Notch 同源物 1(notch homolog 1,Notch1)后,導致樹突結構簡單,而過表達 Notch1 導致新生的海馬齒狀回顆粒細胞的樹突更加復雜[12]。
3.3 Shh 信號通路
Shh 是細胞外可溶性蛋白,通過調節跨膜受體蛋白和它的 G 蛋白耦合體(smoothened,Smo)組成的受體復合物來發揮在神經系統發育中重要的調節作用。
研究發現,Shh 對于成體哺乳動物大腦的神經發生具有重要作用,其信號通路的組成成分在成體海馬以及成體 SVZ 中都有很高表達。在成體海馬中,通過腺病毒轉錄使海馬齒狀回中神經祖細胞過表達 Shh,可增加其增殖能力。相反的,將 Shh 信號的抑制劑導入成體海馬時,海馬齒狀回中的顆粒細胞增殖能力下降[11]。
Shh 除了在 aNSCs 的自我更新和增殖中扮演重要角色外,還是成體哺乳動物大腦內的細胞遷移的重要調節因子。在成體 SVZ 區缺失 Shh 信號蛋白可以導致 A 型細胞不能向嗅球遷移[13]。
3.4 神經營養因子和生長因子
3.4.1 神經營養因子
神經營養因子是一些細胞外蛋白,在中樞神經系統發育中有重要作用。在哺乳動物中,已有 4 種神經營養因子被發現,分別是神經生長因子(nerve growth factor,NGF)、BDNF、NT-3 和神經營養素 4/5(neurotrophin-4/5,NT-4/5)。神經營養因子可以和絡氨酸激酶受體(tyrosine kinase receptor,Tkr)以及它們的共同受體 p75 神經營養素受體(p75 neurotrophinp recepter,75NTR)結合,形成二聚體,并使胞質端特定的絡氨酸殘基自我磷酸化,產生一系列下游效應產物,激活信號轉導。
BDNF 在神經發生中的作用被研究的較多。長期向成體海馬齒狀回中注入 BDNF 可以增加顆粒細胞的神經發生。相似的,在成體 SVZ 內,向側腦室直接注射 BDNF 可以明顯增加新生神經元的形成。
另一方面,在成體海馬中,條件性地敲除 NT-3 可以明顯損害神經干細胞的分化,但不影響其擴增。另外,NT-3 缺陷小鼠的學習和記憶有缺陷,提示 NT-3 可以調節神經元分化,而不是擴增,因為成體大腦學習和記憶的形成和神經元分化有關。在成體大鼠的側腦室直接持續灌注 NGF 對于海馬齒狀回顆粒層神經前體細胞的擴增并沒有作用,但可以增加成體海馬中的神經元的存活[14]。
3.4.2 生長因子
生長因子可以調節成體大腦內的神經發生,主要有 FGF2、IGF1 和 VEGF。這些生長因子在信號轉導中有個共同特點,就是和絡氨酸激酶受體家族結合。配體和受體結合后,使胞質內區域自身磷酸化,激活一系列下游信號通路包括 PI-3K/Akt 和 Ras/Raf/MEK/Erk 信號通路,從而調節神經發生[15]。
最近研究表明,FGF2 是成體大腦內神經發生的重要調節因子,側腦室灌注 FGF2 可以增加成體海馬新生細胞[16]。持續皮下注射或者腦室內注射 IGF1 可以促進成體海馬的神經發生。另外,現已發現 IGF1 可以促進來自 SVZ 的神經母細胞通過 RMS 向嗅球遷移。Yuan 等[17]發現 VEGF 的受體在成體海馬和 SVZ 的神經前體細胞和室管膜細胞都有表達并可以直接促進神經前體細胞有絲分裂。向成體大鼠側腦室直接灌注 VEGF 可以增加 SVZ 和 SGZ 的神經發生。
3.5 神經遞質
神經遞質是介導神經元之間信息傳遞的可擴散性小分子。研究證明,神經遞質在調節 aNSCs 的增殖、分化以及突觸整合等過程中起著重要作用[18]。這些神經遞質主要包括谷氨酸、GABA、多巴胺等。
3.5.1 谷氨酸
谷氨酸是腦內一種興奮性神經遞質,可以結合體內不同亞型的受體,如促離子 NMDAR 等。研究表明,成體 SVZ 和 SGZ 區中的神經前體細胞都有大量谷氨酸受體表達。在 SVZ 區中,神經母細胞在向嗅球遷移過程中大量表達谷氨酸受體,敲除神經母細胞的 NMDAR 可導致其在遷移中發生凋亡,提示谷氨酸可以通過 NMDAR 調節神經母細胞的存活[19]。
3.5.2 GABA
GABA 是成體腦內主要的抑制性神經遞質,GABA 受體是一種離子通道型受體,與大腦神經發生密切相關。在 SVZ 區,神經母細胞釋放 GABA 可以通過和 GABA 受體結合,減少 GFAP+的神經干細胞的增殖,并且還可以直接影響神經母細胞的遷移。在隨后的研究中,條件性地敲除 GABA 受體的 γ2-亞基,導致神經干細胞快速退出靜息狀態,促進對稱分裂的自我更新,提示 GABA-γ2 作為一種重要的機制在 aNSCs 的自我更新模式中發揮作用[20]。
3.5.3 多巴胺
多巴胺是兒茶酚胺類神經遞質,與成體大腦內調節運動及情緒的功能相關。多巴胺受體可以分為兩類,D1 類(D1 和 D5)和 D2 類(D2、D3 和 D4)。在成體 SVZ 區,抑制 C 型細胞多巴胺能受體可以明顯減少 SVZ 中神經干細胞的增殖。通過緩慢釋放左旋多巴刺激 C 型細胞上的 D2 類受體可以促進成體 SVZ 區神經干細胞的增殖。在成體海馬區,多巴胺也可以刺激神經前體細胞的增殖[21]。
4 細胞內信號對神經發生的影響及其分子機制
成年小鼠大腦內,細胞內固有的機制如轉錄因子、神經發生的遺傳調節因子都對神經發生發展的調節起關鍵作用。
4.1 轉錄因子
細胞內很多轉錄因子對 aNSCs 的神經發生起重要調節作用,包括 CREB、配對盒基因 6(paired-box gene 6,Pax6)、無剛毛鱗甲同源復合體樣 1(achaete scute complex homolog-like 1,Ascl1)、少突膠質細胞系轉錄因子 2(oligodendrocyte lineage transcription factor 2,Olig2)、Dlx2、Tailless 樣蛋白(Tailless-like,Tlx)等轉錄因子。
CREB 是對細胞的生長和發育有重要作用的轉錄因子,是很多信號通路的磷酸化反應底物。研究表明,通過 cAMP 介導的 CREB 磷酸化可以促進成體海馬中神經干細胞增殖和新生神經元的存活。另外,通過病毒逆轉錄技術使成體小鼠大腦海馬新生細胞誘導細胞自發性 CREB 敲除,可以導致新生海馬顆粒細胞的分化和成熟功能受損[22]。
Pax6 在大腦發育中所起的關鍵作用,主要是作為發生分化和增殖所需的協調和模式形成的調節劑,以確保神經發生成功進行。作為轉錄因子,Pax6 激活和(或)失活基因表達模式,以確保組織的正常發育并在中樞神經系統的信號傳導和形成中起作用。在成體 SVZ 區,Pax6 是在 RMS 中向嗅球遷移的未成熟細胞中表達,并誘導神經母細胞向多巴胺能球旁神經元分化[23]。
Ascl1 是堿性螺旋-環-螺旋(basic/helix-loop-helix,bHLH)家族的一員,可以持續調節成體神經發生中的細胞分化方向。在生理條件下,通過病毒逆轉錄技術使成體海馬神經前體細胞過表達 Ascl1,可以使其主要向少突膠質細胞分化[13,24]。在 SVZ 和嗅球中表達 Ascl1 的 C 型細胞注定成為的 GABA 能中間神經元,而神經元素 2(neurogenin 2,Neurog2)則存在于產生谷氨酸能的近側腎小球神經元的背側 SVZ 祖細胞亞群中。與這些體內分析一致,SVZ 的體外擴增 aNSCs 的所有后代在被迫表達 Neurog2 時獲得谷氨酸能識別,而僅表達 Ascl1 時生成 GABA 能神經元。類似地,Ascl1 和 Neurog2 由成熟神經祖細胞在成熟為谷氨酸能海馬齒狀回顆粒細胞的海馬神經原生態位瞬時表達[25]。有趣的是,逆轉錄病毒介導的 Ascl1 在增殖的成體海馬神經干細胞中的過度表達導致它們僅產生少突膠質譜系細胞而不是神經元,表明單個基因的表達可指導 aNSCs 在其體內生態位的命運選擇。
Dlx2 是前腦神經元分化的特異性調控因子,在成體 SVZ 神經前體細胞以及向嗅球遷移中的神經母細胞中表達。研究發現 Dlx2 過表達可以提高神經元分化能力以及神經母細胞向嗅球遷移速率[26]。
Tlx 是一個在成體大腦內高表達的孤核受體。Tlx 在 SVZ 區 B 型細胞中表達特別多,條件性敲除 Tlx 可以導致成體 SVZ 區的神經干細胞自我更新能力的完全缺失。在成體海馬中,Tlx 的小鼠 aNSCs 缺失了自我更新能力,更易向膠質細胞分化,提示 Tlx 在 aNSCs 維持自身未分化的增殖狀態過程中起重要作用[27]。孤核受體 Tlx 在 aNSCs 的維持和自我更新中發揮重要作用,推測其與組蛋白去乙酰化酶(histone deacetylase,HDACs)復合以抑制細胞周期基因 p21 和第 10 號染色體缺失的磷酸酶及張力蛋白同源的基因(phosphatase and tensin homolog deleted on chromosome ten,PTEN)。 最近發現 Tlx 可以激活 Wnt 配體 7a(Wnt7a)的表達和經典的 Wnt/β-catenin 信號通路,表明神經干細胞具有通過自分泌信號傳導環路調節其自身更新的潛力[28]。
4.2 表觀遺傳調控
表觀遺傳修飾指在基因表達模式上可遺傳的改變,但不涉及原始自身基因編碼的改變,因此雖然可以產生新的細胞表型但不改變真正的基因組序列。表觀遺傳調控機制(包括:DNA 的甲基化、組蛋白修飾)已經成為影響 aNSCs 神經發生的外界環境影響因素和基因轉錄調控之間的重要聯系。
4.2.1 DNA 甲基化
甲基化 C/G 結合蛋白 1(methylated C/G binding protein 1,MBD1)在成體大腦中都有表達,但在成體海馬中表達最為集中。MBD1 缺陷的小鼠海馬的神經發生顯著下降,空間學習能力受損。隨后的研究發現,MBD1 可以通過與神經干細胞絲裂原 FGF2 的啟動子結合從而促進神經元的分化。此外,最近發現 MBD1 可以通過降低 miR-18 的表達促進 aNSCs 的增殖[29]。
甲基 CpG 結合蛋白 2(methyl CpG binding protein 2,MeCP2)是另外一種 MBD,主要在哺乳動物中樞神經系統神經元中表達,與成體神經發生的調節有關。MeCP2缺陷(MeCP2—)的小鼠海馬齒狀回區中新生神經元成熟缺陷,并且脊柱形成也發生缺陷。在體內外實驗中發現,胚胎神經干細胞中 MeCP2 過表達可以抑制星形膠質細胞過表達和促進神經元分化。最近報道顯示,MeCP2 可以通過 miR-137 來調節神經干細胞的增殖和分化[30]。
4.2.2 組蛋白修飾
組蛋白甲基轉移酶(mixed-lineage leukaemia 1,Mll1)在成體 SVZ 表達,對很多生長發育相關的基因都有重要的調節作用。Mll1 的轉基因小鼠在神經干細胞的增殖、存活和膠質細胞分化等方面沒有異常,但在成體 SVZ 神經元分化上有嚴重缺陷[18]。
脆性 X 智力缺陷蛋白(fragile X mental retardation proteins,FMRP)的家族包括:FMRP、脆性 X 精神發育遲滯綜合征相關蛋白 1(fragile X mental retardation syndrome-related protein 1,FXR1)和脆性 X 精神發育遲滯綜合征相關蛋白 2(fragile X mental retardation syndrome-related protein 2,FXR2),它們可以直接選擇性結合 RNA 和多聚核糖體來調節 mRNAs 的轉錄。在成體海馬齒狀回的 aNSCs 中缺少功能性的 FMRP 可以導致星形膠質細胞分化而神經元分化受損,并伴隨海馬依賴的學習功能受損,提示 FMRP 在調節成體神經發生和學習功能中起重要作用[30]。
5 總結及展望
成體哺乳動物大腦神經發生的研究證明了成熟神經系統具有產生新生神經元并與之整合的能力。但是,人們對于 aNSCs 神經發生的調節機制的理解才剛起步,隨著病毒介導單細胞基因改變技術的進步和轉基因動物模型的發展,使研究單個信號分子在各個神經發生階段的作用成為可能。同時,研究人員也開始嘗試了解不同信號通路之間的復雜聯系和相互作用,例如已有研究已經證明,Wnt 和其他信號分子如 Tlx、DISC1、FMRP 和低氧誘導因子-1(hypoxia inducible factor-1,HIF-1)間的相互作用對于 aNSCs 神經發生至關重要。這些研究可以與之前發現的形態學表現和潛在的分子機制聯系起來。
雖然,現已對 aNSCs 的神經發生有了初步的了解,但還處于初級階段,還有很多問題有待進一步解決,例如 aNSCs 微環境的細胞和分子組成以及和 aNSCs 之間的確切聯系和相互作用還未完全了解;表觀遺傳上的調節成體神經發生的作用特點還處于初級階段;中樞神經系統中的少膠質細胞和其他免疫細胞在神經干細胞的增殖和分化中具有重要的微調作用,尚需進一步研究其確切作用和分子機制等。此外,生理條件下 aNSCs 正常神經發生和行為表現之間的聯系;病理條件下,神經發生缺陷產生相應疾病的特點等均值得進一步研究。總之,了解 aNSCs 神經發生的功能性作用及其分子機制可以使中樞神經系統疾病的治療更進一步。