研究可吸入顆粒物在肺腺泡內的沉積規律對于明確肺氣腫等常見呼吸系統疾病的誘因和發展,以及優化臨床治療和預防方案具有重要意義。本文建立了能夠模擬終末細支氣管和肺腺泡顆粒物沉積的體外實驗模型,在不同功能殘氣量模式下研究了不同粒徑的可吸入顆粒物在肺腺泡內的沉積率。結果表明,顆粒物直徑是影響顆粒物在肺腺泡沉積的重要因素,1 μm 左右的顆粒物沉積率最高。功能殘氣量增大,顆粒物沉積率顯著降低。本文研究結果為肺氣腫和塵肺等疾病的靶向吸入治療提供了數據支撐和優化途徑,建立的模型也為研究可吸入顆粒物在肺腺泡內的沉積規律提供了一種可行的體外實驗模型。
引用本文: 李蓉, 徐新喜, 喬楊, 趙秀國. 不同功能殘氣量對可吸入顆粒物在人體肺腺泡區沉積影響的實驗研究. 生物醫學工程學雜志, 2018, 35(4): 557-563. doi: 10.7507/1001-5515.201711054 復制
版權信息: ?四川大學華西醫院華西期刊社《生物醫學工程學雜志》版權所有,未經授權不得轉載、改編
引言
肺腺泡區是人體呼吸的主要功能區域,可吸入顆粒物(指空氣動力學直徑≤10 μm 的空氣懸浮顆粒物)在肺腺泡區的沉積會影響呼吸功能,易導致肺氣腫、塵肺等肺部病變,并可進一步穿透肺泡壁進入人體血液循環系統,對人體健康造成巨大損害。因此,研究可吸入顆粒物在肺腺泡區的沉積規律對于肺氣腫等疾病的成因研究、治療和預防具有重要意義[1]。由于肺腺泡區結構復雜、尺寸較小,尚無法通過計算機斷層掃描(computed tomography,CT)方式建立精確尺寸的計算機模型或實體模型,因此目前的研究多采用理論模型、簡化經驗模型或簡化實體模型進行計算機模擬分析或實驗研究。一些學者相繼建立了肺腺泡二維、三維的單級或多級計算機模型,研究了不同粒徑的顆粒物在肺腺泡內的呼吸流場分布和顆粒物沉積[2-4],發現肺泡內呼吸流場處于脈動式層流,并在呼吸轉換時形成部分渦流。Ma 等[5]建立了連續多級肺腺泡三維計算機模型,發現可動肺泡壁和多呼吸周期對研究顆粒物在肺腺泡內的精確沉積有重要影響。李振振[6]研究了終末細支氣管阻塞對肺泡顆粒物沉積的影響,發現支氣管阻塞將顯著降低顆粒物在肺泡內的沉積。
同時,一些學者對建立可吸入顆粒物肺腺泡沉積體外實驗模型進行了嘗試,以期與計算機模擬結果進行對比和驗證。Oakes 等[7]建立了單一彈性肺泡模型,在非穩態呼吸模式下采用粒子圖像測速(particle image velocimetry,PIV)觀察可吸入顆粒物在肺泡內的流場分布和沉積情況,結果表明肺泡內存在周期性變化渦旋流場,不同的呼吸模式下沉積率從 0.1% 到 10% 劇烈變化。Berg 等[8]根據健康成年人肺部解剖成型技術,建立了單簇肺腺泡平面模型,利用 PIV 進行了流場分析,發現單一呼吸周期內,顆粒物無法直接到達肺泡壁,顆粒物肺泡沉積可能是多個呼吸周期疊加的結果。Fishler 等[9]采用微流控技術,驗證了肺腺泡簇內渦流的存在。
上述實驗模型研究采用甘油等液體代替空氣作為顆粒物載體,只能通過 PIV 等方法觀察顆粒物運動,無法得出直接沉積率數值,因此亟需更符合實際情況的實驗模型或在體實驗進行驗證。然而,采用人體直接吸入顆粒物研究肺腺泡沉積對人體健康潛在風險大,成本高。本文通過建立多級肺腺泡實驗模型,研究不同功能殘氣量呼吸模式下不同粒徑顆粒物在終末細支氣管和肺腺泡區的沉積規律,為揭示顆粒物沉積與塵肺、肺氣腫等呼吸系統疾病之間的相互關系以及相關疾病預防和治療方法的創新提供實驗依據。
1 實驗模型
1.1 人體肺腺泡實驗模型
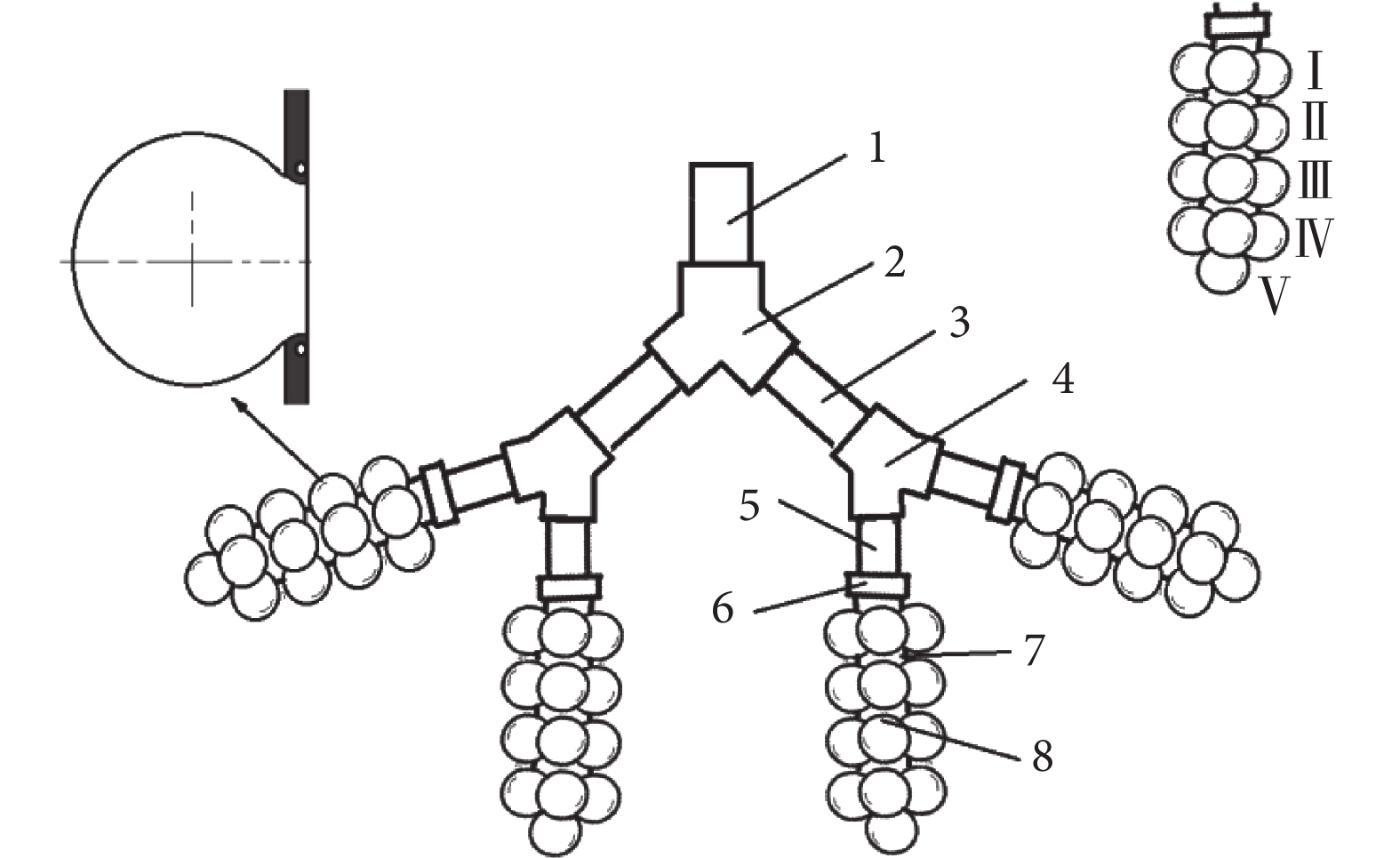
根據國際放射防護委員會(International Commission on Radiological Protection,ICRP,1994) 人體肺部的分區[10],將第 15、16 級支氣管定義為終末細支氣管,第 17 級支氣管為呼吸性細支氣管,是傳導氣道向呼吸功能區域過渡的支氣管,偶爾帶有少量肺泡,但肺泡數量仍無確切數據,因此本文設計第 17 級支氣管不帶肺泡,討論時與第 15、16 級支氣管統一進行,第 17 級以后部分定義為肺腺泡區。如圖 1 所示,本文實驗模型設計為 1 段第 15 級支氣管、2 段第 16 級支氣管、4 段第 17 級支氣管和 4 段肺腺泡區,每簇肺腺泡包括 17 個肺泡。肺腺泡毗鄰第 15~17 級支氣管和肺泡管的直徑、長度、分支角度均來自 Haefeli-Bleuer 等[11]的解剖學數據,放大 75 倍。每一級終末細支氣管中間做成可拆卸結構,沉積實驗時,可將該段拆下進行顆粒物濃度分析。
健康成年人真實肺泡平均直徑 250 μm,壁厚 δ=1.11 μm,密度250 kg/m3, 楊氏模量 E=5 kPa,泊松比υ=0.4[12],進行等效放大 75 倍后,直徑為 18.75 mm。肺泡實樣做成球形,開圓形口,帶圓環形固定圈,可將肺泡實樣固定在終末細支氣管末端。單獨測量肺泡內的沉積時可取下肺泡實樣洗脫后進行濃度分析。該模型能夠實現各種呼吸條件和不同濕度環境下肺腺泡區顆粒物運動、沉積的實驗分析,包括不同粒徑顆粒物的局部和總沉積率。
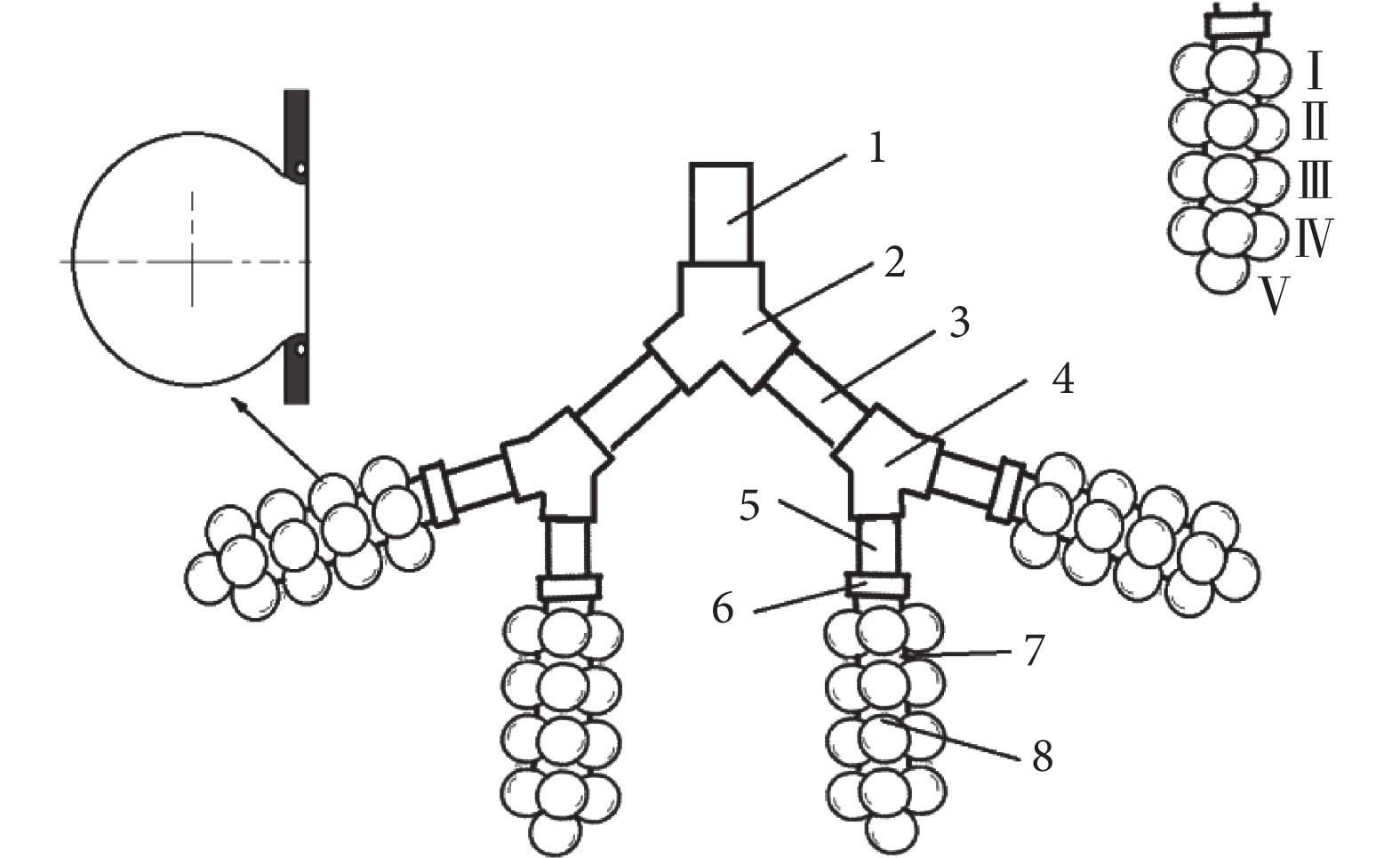 圖1
人體肺腺泡實驗模型
圖1
人體肺腺泡實驗模型
1. 第 15 級支氣管;2. 接頭;3. 第 16 級支氣管;4. 接頭;5. 第 17 級支氣管;6. 接頭;7. 肺泡管;8. 肺泡;Ⅰ. 第 1 級肺泡;Ⅱ. 第 2 級肺泡;Ⅲ. 第 3 級肺泡;Ⅳ. 第 4 級肺泡;Ⅴ. 第 5 級肺泡
Figure1. Human pulmonary acinus experimental model1. 15th level bronchus; 2. connector; 3. 16th level bronchus; 4. connector; 5. 17th level bronchus; 6. connector; 7. pulmonary alveolar duct; 8. pulmonary alveolus; Ⅰ. 1st groups of alveoli; Ⅱ. 2nd groups of alveoli; Ⅲ. 3rd groups of alveoli; Ⅳ. 4th groups of alveoli; Ⅴ. 5th groups of alveolus
1.2 可吸入顆粒物在人體肺腺泡區沉積實驗模型
如圖 2 所示,可吸入顆粒物在人體肺腺泡區沉積實驗模型通過氣溶膠發生器發生單分散聚苯乙烯微球,在模型入口用激光粒子計數器測量發生濃度,經過單向進氣閥后進入肺腺泡實驗模型,通過模擬呼吸器使透明實驗腔體的壓力變為負壓,從而使肺腺泡實驗模型的肺泡膨脹,將氣溶膠吸入肺泡,經過沉積后,模擬呼吸器使透明實驗腔體變為正壓,致使肺泡收縮,肺腺泡實驗模型內氣溶膠通過單向排氣閥排出模型。裝置工作時,通過加濕器調節模擬沉積時的環境濕度。
 圖2
可吸入顆粒物在人體肺腺泡區沉積實驗模型
圖2
可吸入顆粒物在人體肺腺泡區沉積實驗模型
1. 氣溶膠發生器;2. 激光粒子計數器;3. 單向閥;4. 加濕器;5. 單向閥;6. 濕度傳感器;7. 壓差傳感器;8. 人體肺腺泡模型;9. 氣密實驗腔體;10. 呼吸模擬器
Figure2. Experimental model of the deposition of inhalable particles in the human pulmonary acinus area1. aerosol generator; 2. laser particle counter; 3. check valve; 4. humidifier; 5. check valve; 6. humidity sensor; 7. differential pressure sensor; 8. human pulmonary acinus model; 9. airtight test chamber; 10. respiratory simulator
1.3 呼吸模式
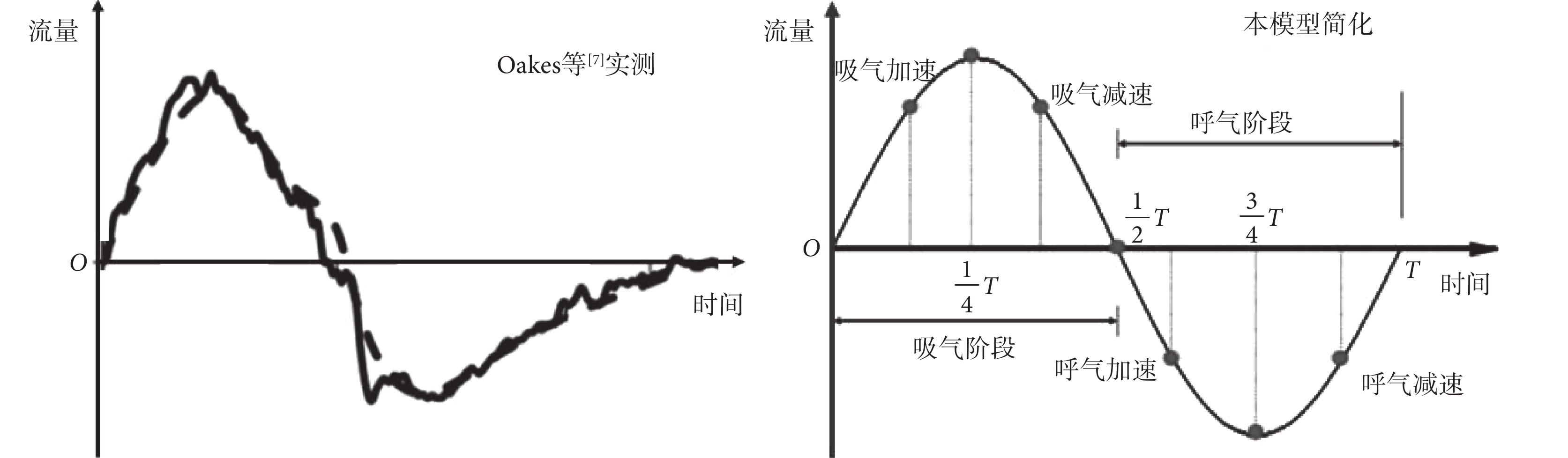
Oakes 等[7]實測了 21 歲健康男性的非穩態緩慢呼吸時的流量曲線,如圖 3 所示,近似為正弦曲線。因此本研究通過呼吸模擬器模擬呼吸模式,將呼吸狀態描述為非穩態的正弦函數,呼吸比為 1∶1,呼吸頻率可調,肺泡功能殘氣量 20%~80% 可調。設置三種呼吸模式:(A)正常呼吸模式,肺泡功能殘氣量為 30%,即肺泡最大變形率為 70%;(B)深呼吸模式,肺泡功能殘氣量為 10%,即肺泡最大變形率為 90%;(C)淺呼吸模式,肺泡功能殘氣量為 50%,即肺泡最大變形率為 50%。
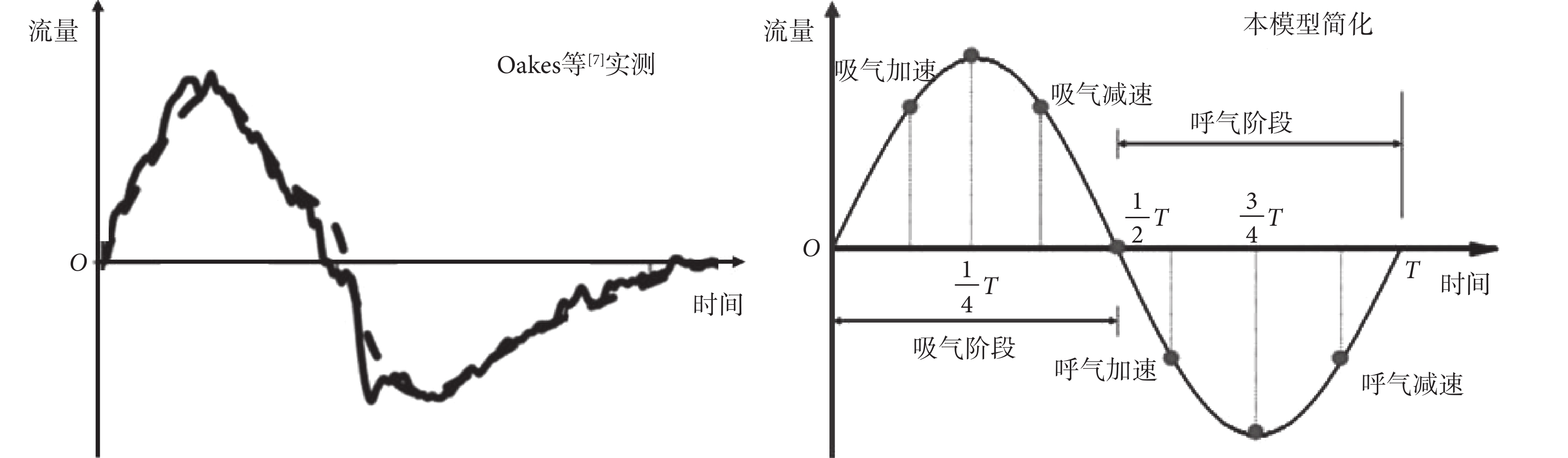 圖3
非穩態呼吸周期
Figure3.
Unsteady state respiratory cycle
圖3
非穩態呼吸周期
Figure3.
Unsteady state respiratory cycle
1.4 實驗模型流體動力學相似
實驗模型動力學相似包括模型內雷諾數 Re 和 Womersley 數
 相似。以往的研究表明,呼吸過程中,終末細支氣管和肺腺泡區的氣流為定常狀態的層流[13],其 Re < 1,
相似。以往的研究表明,呼吸過程中,終末細支氣管和肺腺泡區的氣流為定常狀態的層流[13],其 Re < 1,
 < 1。本實驗模型是該區域真實尺寸的等效放大,雷諾數計算公式為 Re = 8 EVif
/Dυ[7],E 是肺泡當前膨脹率,Vi 是肺泡總體積,f 為呼吸頻率,υ 是空氣動力黏度系數,D 為肺泡直徑。由于人體吸氣過程是空氣在呼吸道內的加濕過程,空氣到達肺泡時,濕度將增加至 100%。因此,肺腺泡內的氣流可看作高濕稀二相流,黏度計算根據王興華等[14]和丁玉龍等[15]提供的計算公式獲得,空氣動力黏度系數 υ = 132.6 × 10–5。模型呼吸周期為 T = 4 s,則三種呼吸模式下,肺泡內 Re << 1。根據 Womersley 數計算公式
< 1。本實驗模型是該區域真實尺寸的等效放大,雷諾數計算公式為 Re = 8 EVif
/Dυ[7],E 是肺泡當前膨脹率,Vi 是肺泡總體積,f 為呼吸頻率,υ 是空氣動力黏度系數,D 為肺泡直徑。由于人體吸氣過程是空氣在呼吸道內的加濕過程,空氣到達肺泡時,濕度將增加至 100%。因此,肺腺泡內的氣流可看作高濕稀二相流,黏度計算根據王興華等[14]和丁玉龍等[15]提供的計算公式獲得,空氣動力黏度系數 υ = 132.6 × 10–5。模型呼吸周期為 T = 4 s,則三種呼吸模式下,肺泡內 Re << 1。根據 Womersley 數計算公式
 [7],此時
[7],此時
 < 1。
< 1。
2 材料與方法
2.1 材料與設備
本文可吸入顆粒物采用 QDSphere 熒光聚苯乙烯微球(北京華泰昕生物醫療技術有限公司),包括 0.1、0.3、0.5、1.0、3.0、5.0 μm 六種規格。
F9631 標準粒子發生裝置(沈陽新科精密儀器設備有限公司)用于發生單分散聚苯乙烯熒光微球氣溶膠;呼吸模擬器(北京市翰文網星科技有限責任公司)用于模擬不同呼吸條件;亞都 SC-D052AE 加濕器(北京亞都環保科技有限公司)用于向實驗模型內加濕;MP100 壓差儀(法國凱茂公司)用于監測肺腺泡的壓力;TSI8386 空氣參數多功能測試儀(美國 TSI)用于監測肺腺泡內相對濕度和溫度;TSI AeroTrak9350 便攜式粒子計數器(美國 TSI)用于檢測發生至實驗模型內 0.3~5.0 μm 粒徑的可吸入顆粒物濃度;Lasairll 激光粒子計數器(美國 PMS)用于檢測發生至實驗模型內 0.1 μm 粒徑的可吸入顆粒物濃度;Attune NxT 流式細胞儀(Thermofisher)用于沉積粒子計數。
2.2 方法
2.2.1 單分散聚苯乙烯熒光微球氣溶膠發生
將單分散熒光聚苯乙烯微球原液稀釋后配成濃度 1×107~1×109 個/mL 的發生液,放入 F9631 標準粒子發生裝置發生單分散氣溶膠,發生流量為 80 L/min。在該條件下,F9631 標準粒子發生裝置可發生濃度為 1×103~3×105 個/L。
2.2.2 可吸入顆粒物肺腺泡沉積
將各級終末細支氣管、接頭及肺泡分別浸入去離子水中,放入超聲波清洗器內清洗 5 min,取出后在低溫干燥器內充分干燥,然后在超凈工作臺內裝配。裝配完畢后放入氣密實驗腔體固定,連接好管路和傳感器后,檢查裝配后實驗模型的氣密性。調節呼吸模擬器至所需的呼吸頻率流量和功能殘氣量,調節加濕器使實驗模型內相對濕度達到預定值。開啟氣溶膠發生器和粒子計數器,開始沉積實驗。每間隔 5 min 采用激光粒子計數器記錄一次氣溶膠發生濃度。
2.2.3 顆粒物沉積計數
實驗采用將沉積模型內沉積的顆粒物用洗脫液洗下,在流式細胞儀內進行計數的方式獲得顆粒物沉積數量。流式細胞儀可以區分熒光顆粒和非熒光顆粒,因此可以最大程度地減少非熒光顆粒對沉積數量的干擾。沉積實驗結束后,取下并拆分肺腺泡模型。向肺泡內加 5 mL 去離子水浸泡 1 h,漩渦振蕩器上振蕩 1 min,終末細支氣管和肺泡管放入燒杯中,加 20 mL 去離子水后漩渦振蕩器上振蕩 1 min。用移液器收集至 EP 管內。利用流式細胞儀測定顆粒物濃度,每次進樣 50 μL,進樣速度為 12.5 μL/min。
2.2.4 沉積實驗模式
主要考察 Dp = 0.1、0.3、0.5、1.0、3.0、5.0 μm 的顆粒物在人體肺腺泡實驗模型中的沉積率。呼吸周期為 T = 4 s,實驗時間 3~6 h,肺泡內空氣相對濕度 100%。
2.2.5 沉積率計算
采用式(1)進行終末細支氣管和肺泡內的沉積率計算。
 |
其中:DFi 是第 i 級終末細支氣管或肺泡的沉積率;Ni 是通過流式細胞儀計數得到的顆粒物沉積數量;Vi 是第i 級終末細支氣管和肺泡內氣溶膠通過的實際總體積,以第 15 級終末細支氣管為例,其實際總體積 V15 是本身的體積與其后終末細支氣管、肺泡管和肺泡體積之和;C1 是可吸入顆粒物氣溶膠濃度,用實驗階段所有采集數據的平均值表示;δ 是功能殘氣率。
3 結果與討論
3.1 正常呼吸模式下肺腺泡區顆粒物沉積
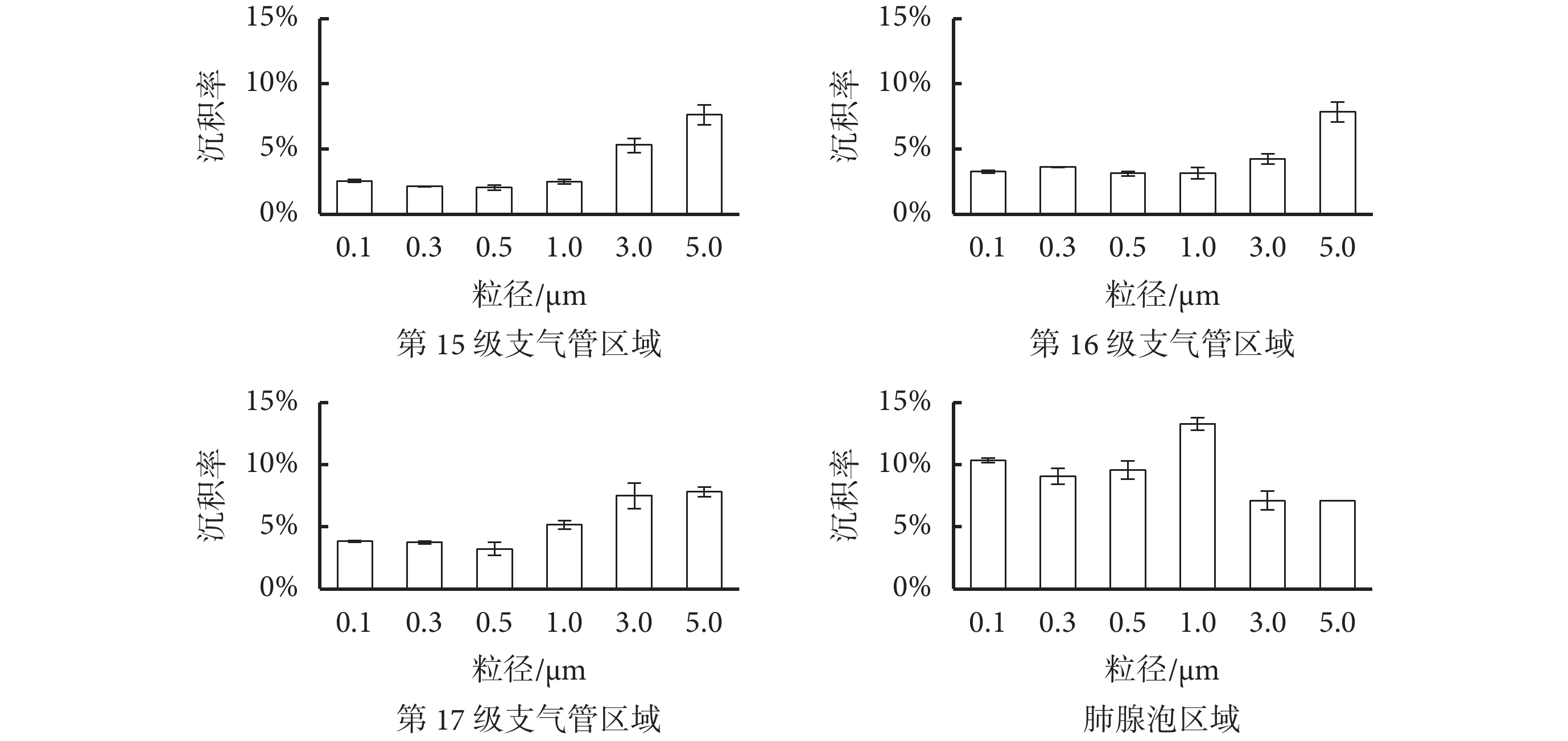
正常呼吸模式下(模型 A)肺腺泡沉積模型顆粒物沉積結果如圖 4 和圖 5 所示。圖 4 給出了顆粒物在終末細支氣管和肺腺泡區的沉積實驗結果,肺腺泡前端的第 15~17 級支氣管的 1.0 μm 以下粒徑的顆粒物沉積率并沒有明顯差別,均低于 5%,說明終末細支氣管對細微顆粒物的攔截作用有限,細微顆粒物大部分仍能直接進入肺腺泡區域。3.0~5.0 μm 顆粒物沉積率較粒徑較小的顆粒物有明顯增大,說明終末細支氣管區域和第 17 級支氣管仍對大粒徑顆粒物起主要攔截作用,使其難以到達肺腺泡區。同時,同一粒徑的顆粒物在第 15~17 級支氣管沉積率基本相同,說明終末細支氣管及呼吸性細支氣管(第 17 級)的尺寸和生理環境類似,顆粒物在終末細支氣管的流體動力學特性也類似。
如圖 4 所示,0.1~1.0 μm 的顆粒物在肺腺泡區的總沉積率明顯高于在前端支氣管的沉積率,說明肺腺泡區是細微顆粒物的主要沉積區域。粒徑 0.1 μm 顆粒物在肺腺泡區總沉積率為 10.32%,與 Oakes 等[7]模擬仿真結果(肺腺泡沉積率 8.3%)近似,也與 Chhabra 等[16]的單肺泡實驗模型 20 次呼吸循環后沉積結果(10%)一致。1.0 μm 粒徑的顆粒物在肺腺泡區沉積率(13.27%)最高。黃俊[17]對肺腺泡的計算機模擬研究表明,顆粒物在肺腺泡內的沉積隨著顆粒物的增大,呈現先增大后減小的趨勢,這與本文實驗結果一致。顆粒物沉積在肺泡壁上之前,會有一個較長時間的渦流循環,而非隨著呼氣過程流出肺泡,Chhabra 等[16]模型中顆粒物沉積率隨著呼吸循環次數的增大而增大,這些研究結果與本文實驗結果一致,即 1.0 μm 顆粒物在慣性作用和布朗運動的平衡作用下,在肺泡內懸浮時間最長,隨著時間的累積,抵達肺泡壁并沉積的概率最大。3.0~5.0 μm 的顆粒物在肺腺泡區總沉積率最低,但與第 15~17 級支氣管的沉積率沒有明顯差異,說明進入到肺腺泡的大顆粒物沉積機制與終末細支氣管一致,均是慣性沉積占主導地位。
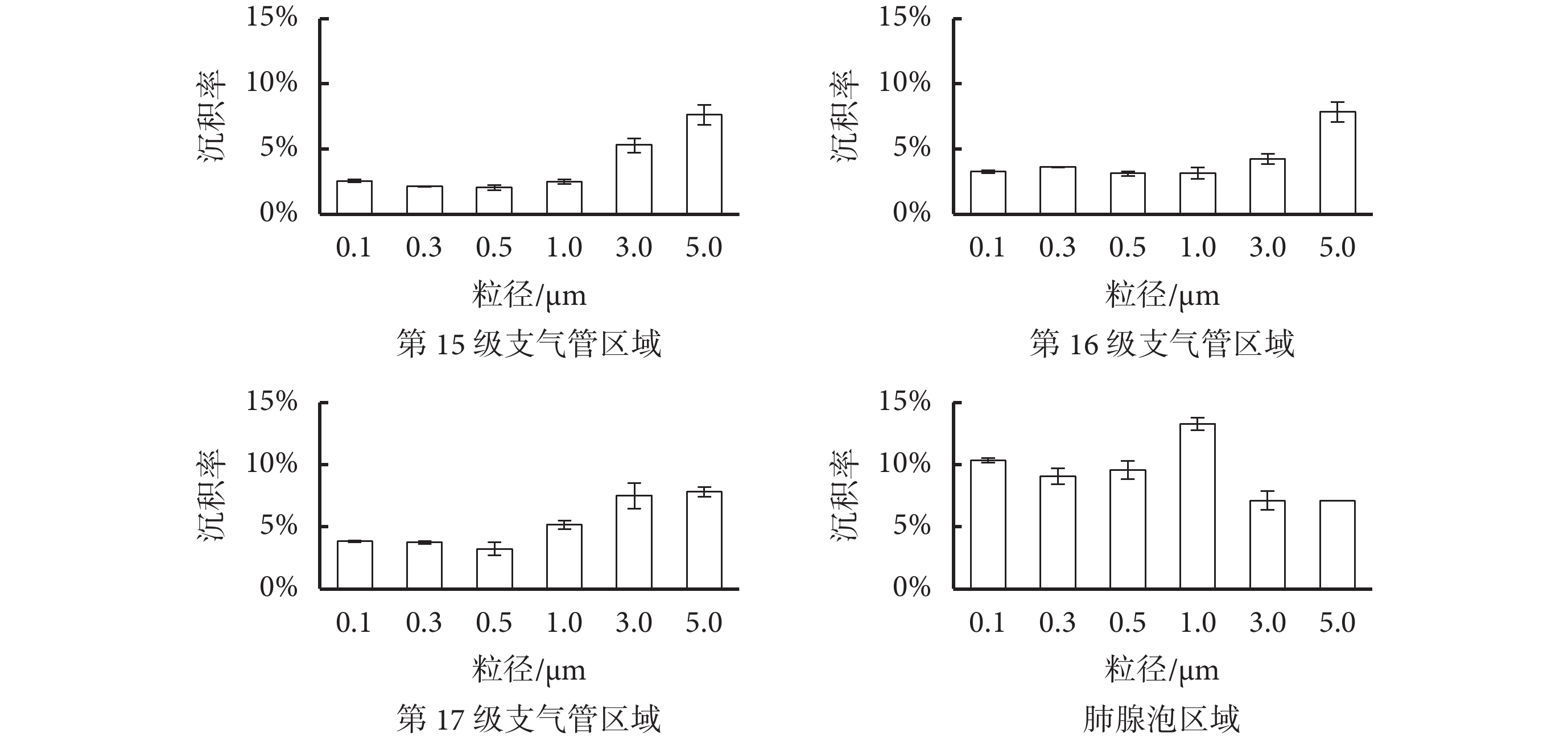 圖4
正常呼吸模式(模型 A)的顆粒物沉積結果
Figure4.
Particle deposition results of healthy alveoli (Model A)
圖4
正常呼吸模式(模型 A)的顆粒物沉積結果
Figure4.
Particle deposition results of healthy alveoli (Model A)
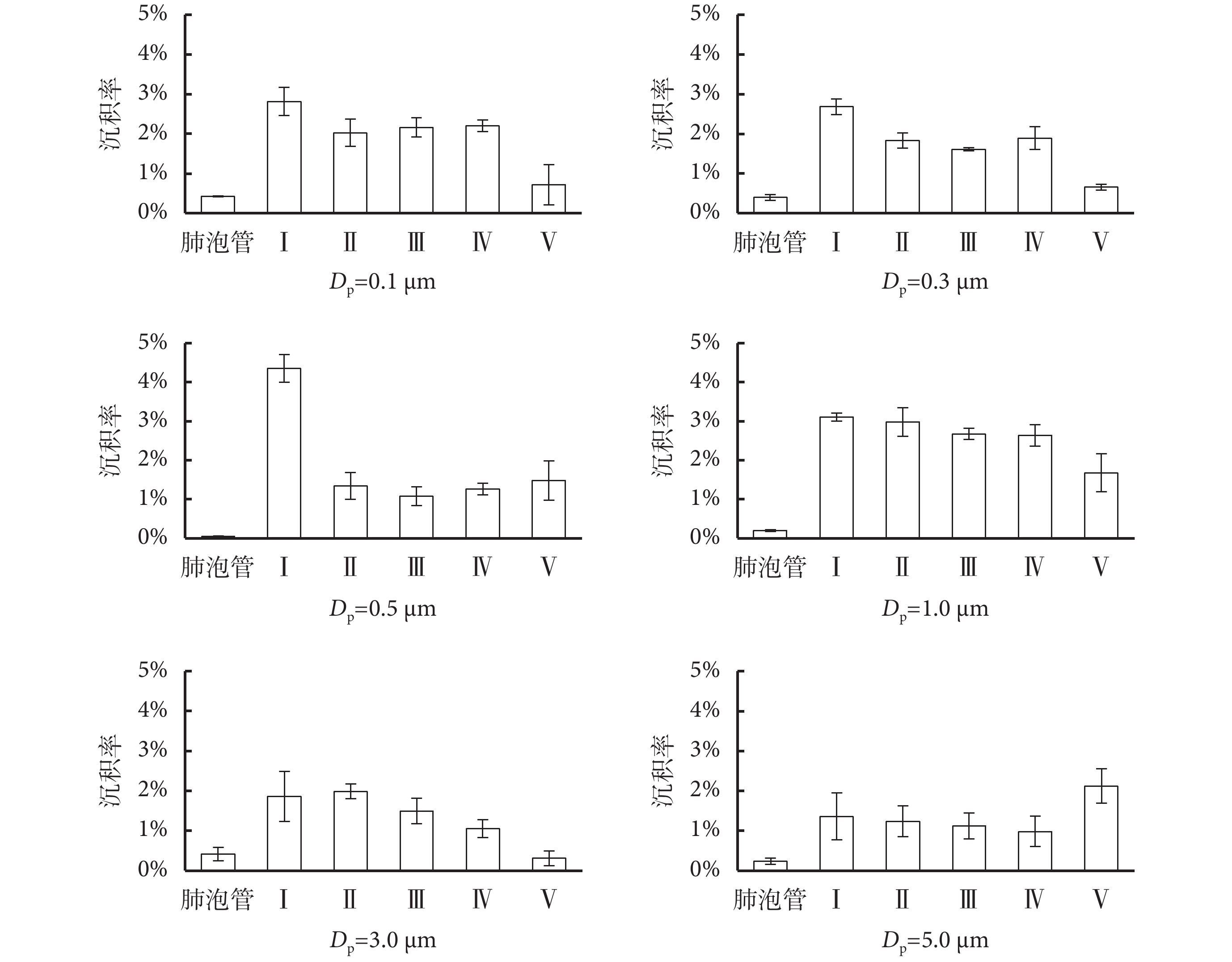
顆粒物在肺腺泡內不同區域沉積率的變化如圖 5 所示。從圖中可以看出,肺泡管沉積率比其他區域明顯降低,作為多個肺泡的共同通道,本身內表面積很小,因此與顆粒物有效接觸面積小,沉積率很小,一般低于 0.5%。Ⅰ~Ⅳ 級肺泡內的沉積率較為均勻,說明顆粒物在肺腺泡內的沉積機制一致,單簇肺腺泡可看作呼吸的基本單元,在未來的研究中可作為整體考慮[16]。但是,0.5 μm 顆粒物在第 Ⅰ 級肺腺泡沉積率明顯高于后面的肺泡。造成這一現象的原因可能是 0.5 μm 顆粒物處于擾動和擴散沉積的過渡區域,因此在第 Ⅰ 級肺泡的沉積率增大。Berg 等[8]建立的 PIV 實驗模型發現能夠到達肺腺泡末端肺泡的氣流流線很少,且流速極低。本文實驗模型中,肺腺泡末端(即第 Ⅴ 級肺泡)內的沉積率下降較明顯,說明在正常呼吸模式下,顆粒物流線很少抵達最末端的肺泡。但是,5.0 μm 顆粒物慣性最大,能夠到達肺腺泡末端,因此沉積率的增大較為明顯。
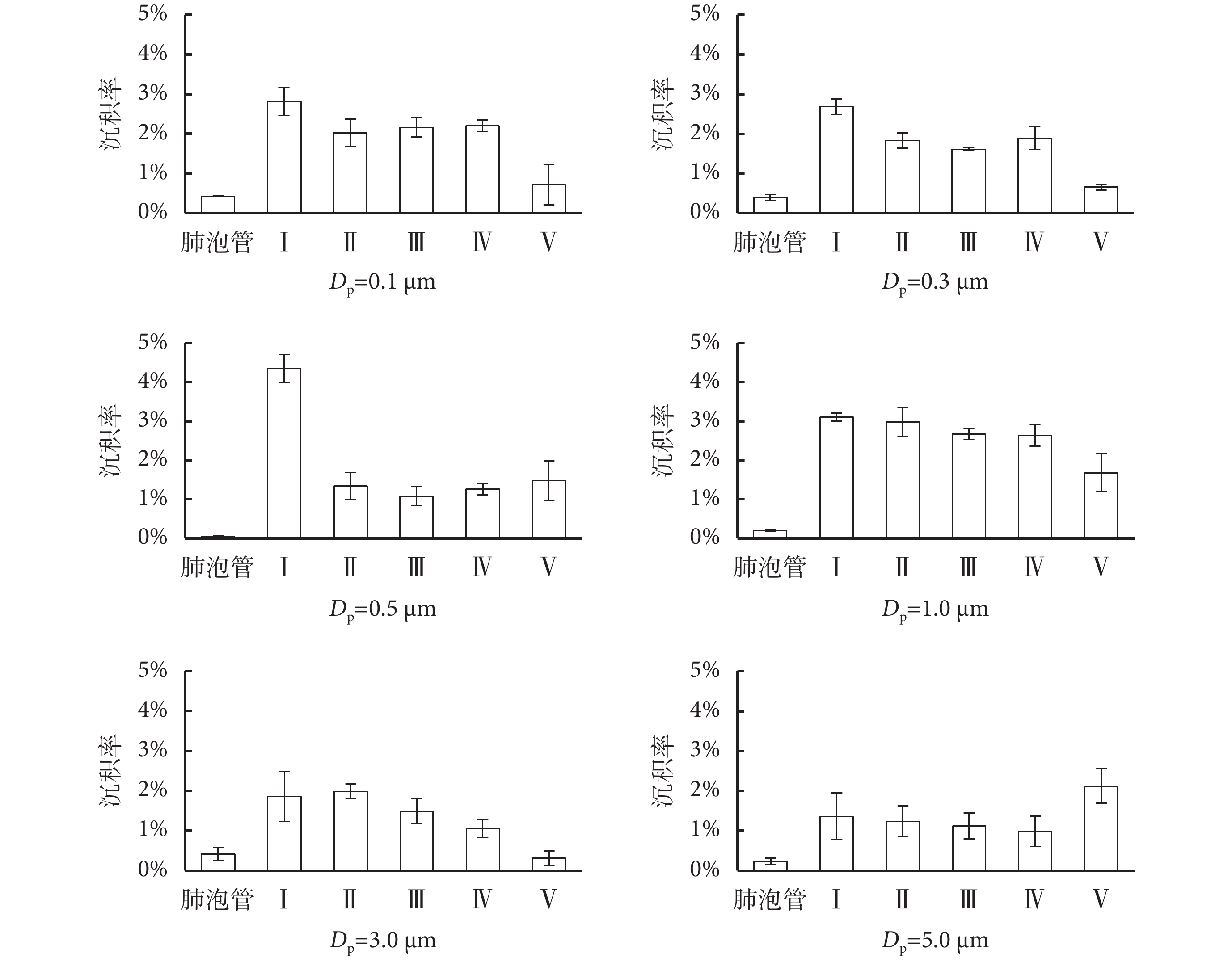 圖5
呼吸功能殘氣量為 30% 時(模型 A)的顆粒物肺泡區沉積結果
Figure5.
Particle deposition results of functional residual capacity 30% (Model A)
圖5
呼吸功能殘氣量為 30% 時(模型 A)的顆粒物肺泡區沉積結果
Figure5.
Particle deposition results of functional residual capacity 30% (Model A)
3.2 不同功能殘氣量對肺腺泡區顆粒物沉積的影響
功能殘氣量對應于呼吸殘氣量,是維持人體呼吸系統連續向人體供氧的基礎。運動、靜止、不同體力勞動下功能殘氣量均有較大差異。郭西龍[18]的模擬研究表明,功能殘氣量越低,顆粒物在人體呼吸系統的沉積率越高,且越深入肺部,沉積率增大越顯著。本文采用的實驗模型在三種不同功能殘氣量條件下的人體肺腺泡顆粒物沉積率實驗結果如圖 6 所示。不同功能殘氣量呼吸模式下,同一粒徑的顆粒物在第 15~17 級支氣管內的沉積并無明顯差異,且不同粒徑在相同支氣管內的沉積率變化趨勢也較為一致。說明在終末細支氣管和呼吸性細支氣管(第 17 級)內,功能殘氣量變化并未引起顆粒物運動速度發生質的變化,仍然處于充分發展的層流狀態。
但在肺腺泡區,不同功能殘氣量引起的顆粒物沉積率變化較為明顯。功能殘氣量越小,顆粒物在肺腺泡內沉積率越大。這是由于功能殘氣量越小,每次呼吸轉換時形成的渦流規模就越大。如前所述,對于較小粒徑的顆粒物在肺腺泡主要由擴散作用沉積,渦流有助于加速擴散,因此顆粒物沉積率就相應增大。特別對于直徑 1.0 μm 的顆粒物,功能殘氣量 10% 時沉積率達 17%,比功能殘氣量 50%(沉積率 7%)時增大了 1 倍。
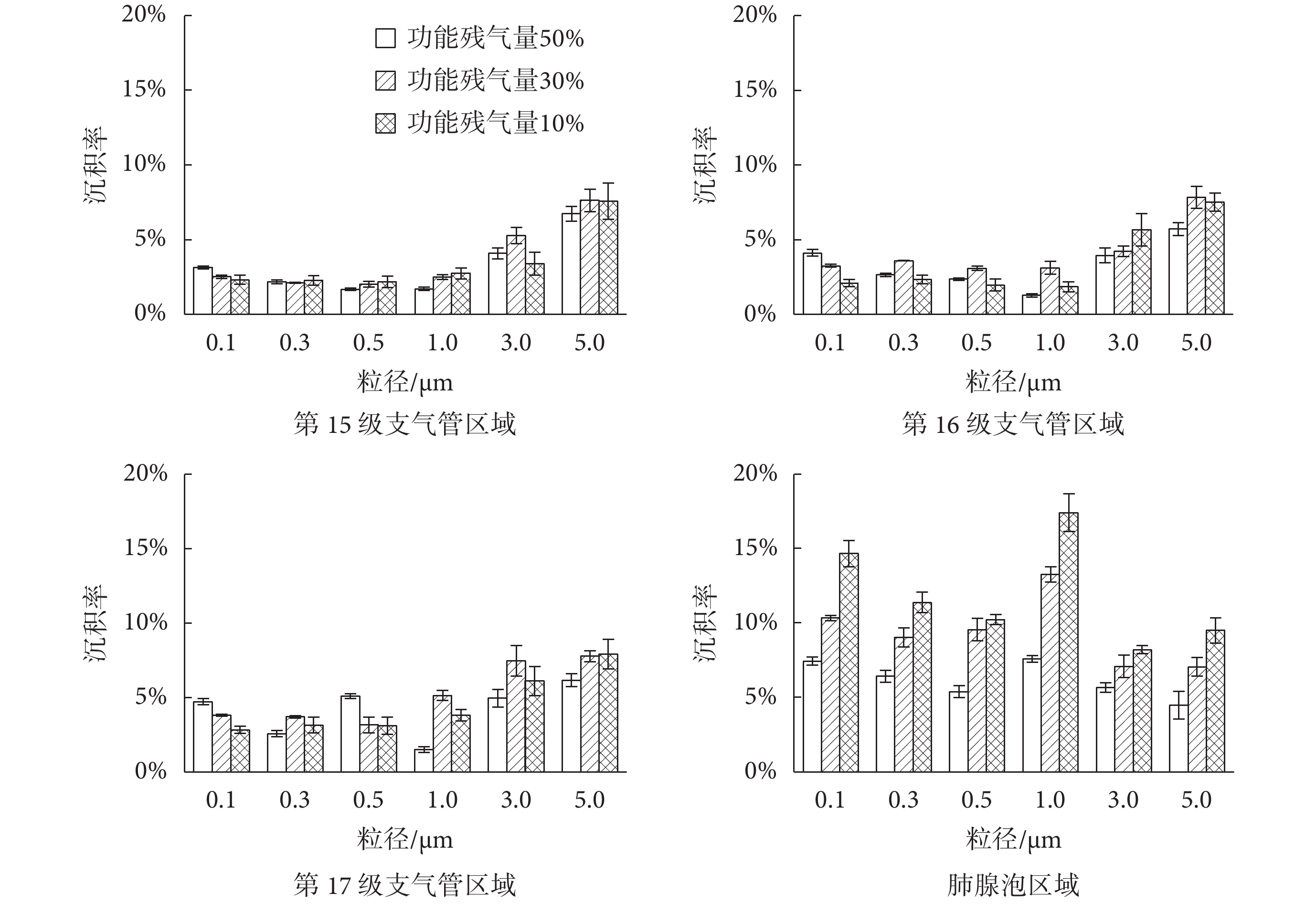 圖6
不同呼吸模式下顆粒物在模型不同區域沉積結果
Figure6.
Particle deposition results in different regions of pulmonary acinus under different respiratory modes
圖6
不同呼吸模式下顆粒物在模型不同區域沉積結果
Figure6.
Particle deposition results in different regions of pulmonary acinus under different respiratory modes
慢性阻塞性肺氣腫、肺萎縮是目前常見的呼吸系統疾病。以塵肺為例,當前的藥物治療主要起到緩解癥狀的作用,不能有效清除肺部粉塵;肺灌洗技術可以有效清除肺部粉塵,但是存在成本高、患者痛苦以及并發癥多等諸多問題[19]。然而目前可吸入顆粒物肺內沉積的研究結果表明,可溶性藥物的霧化吸入有望為慢性阻塞性肺氣腫等疾病提供靶向性更強的有效治療方法。本文實驗模型研究結果可為肺部不同病變區域的藥物霧化治療提供依據。由于鼻咽區及第 1~14 級支氣管對大顆粒物的攔截效率很高,很難進入終末細支氣管和肺腺泡區,因此若是肺腺泡區發生了病變,霧化吸入藥物顆粒直徑應小于 3 μm,以 1 μm 左右為佳,且功能殘氣量盡可能小,才能使之更有效地進入肺腺泡區。如果支氣管區域發生病變,如支氣管阻塞等,藥物顆粒物應大于 1 μm,才能有效避免藥物向肺腺泡區沉積,在提高藥物靶向作用的同時,可降低藥物進入血液循環的風險。
4 結論
顆粒物在肺腺泡內沉積規律的研究多集中在計算機建模分析,分析結果目前尚無法通過在體實驗直接驗證。近年來有學者建立了單一肺泡或單簇肺泡的實驗模型,采用 PIV 等技術分析了肺泡內流場分布和顆粒物沉積的規律。本文通過建立多簇肺腺泡離體實驗模型,分析了不同粒徑顆粒物在不同功能殘氣量條件下在終末細支氣管和肺腺泡區的沉積率變化規律。實驗結果表明,顆粒物在肺腺泡內的沉積率與以往計算機模擬結果較為一致,1 μm 直徑的顆粒物沉積率最高。功能殘氣量對顆粒物的沉積有顯著的影響,功能殘氣量越低,顆粒物在肺腺泡區沉積率越高。本文實驗結果進一步驗證了以往肺腺泡內顆粒物沉積的理論分析和計算機模擬仿真結果,其重要意義在于,通過建立離體實驗模型可為顆粒物在人體各種病變、呼吸模式下肺腺泡內沉積規律的研究提供了直接的實驗方法,也可為肺氣腫等疾病的藥物霧化吸入治療方式的優化提供必要手段。
引言
肺腺泡區是人體呼吸的主要功能區域,可吸入顆粒物(指空氣動力學直徑≤10 μm 的空氣懸浮顆粒物)在肺腺泡區的沉積會影響呼吸功能,易導致肺氣腫、塵肺等肺部病變,并可進一步穿透肺泡壁進入人體血液循環系統,對人體健康造成巨大損害。因此,研究可吸入顆粒物在肺腺泡區的沉積規律對于肺氣腫等疾病的成因研究、治療和預防具有重要意義[1]。由于肺腺泡區結構復雜、尺寸較小,尚無法通過計算機斷層掃描(computed tomography,CT)方式建立精確尺寸的計算機模型或實體模型,因此目前的研究多采用理論模型、簡化經驗模型或簡化實體模型進行計算機模擬分析或實驗研究。一些學者相繼建立了肺腺泡二維、三維的單級或多級計算機模型,研究了不同粒徑的顆粒物在肺腺泡內的呼吸流場分布和顆粒物沉積[2-4],發現肺泡內呼吸流場處于脈動式層流,并在呼吸轉換時形成部分渦流。Ma 等[5]建立了連續多級肺腺泡三維計算機模型,發現可動肺泡壁和多呼吸周期對研究顆粒物在肺腺泡內的精確沉積有重要影響。李振振[6]研究了終末細支氣管阻塞對肺泡顆粒物沉積的影響,發現支氣管阻塞將顯著降低顆粒物在肺泡內的沉積。
同時,一些學者對建立可吸入顆粒物肺腺泡沉積體外實驗模型進行了嘗試,以期與計算機模擬結果進行對比和驗證。Oakes 等[7]建立了單一彈性肺泡模型,在非穩態呼吸模式下采用粒子圖像測速(particle image velocimetry,PIV)觀察可吸入顆粒物在肺泡內的流場分布和沉積情況,結果表明肺泡內存在周期性變化渦旋流場,不同的呼吸模式下沉積率從 0.1% 到 10% 劇烈變化。Berg 等[8]根據健康成年人肺部解剖成型技術,建立了單簇肺腺泡平面模型,利用 PIV 進行了流場分析,發現單一呼吸周期內,顆粒物無法直接到達肺泡壁,顆粒物肺泡沉積可能是多個呼吸周期疊加的結果。Fishler 等[9]采用微流控技術,驗證了肺腺泡簇內渦流的存在。
上述實驗模型研究采用甘油等液體代替空氣作為顆粒物載體,只能通過 PIV 等方法觀察顆粒物運動,無法得出直接沉積率數值,因此亟需更符合實際情況的實驗模型或在體實驗進行驗證。然而,采用人體直接吸入顆粒物研究肺腺泡沉積對人體健康潛在風險大,成本高。本文通過建立多級肺腺泡實驗模型,研究不同功能殘氣量呼吸模式下不同粒徑顆粒物在終末細支氣管和肺腺泡區的沉積規律,為揭示顆粒物沉積與塵肺、肺氣腫等呼吸系統疾病之間的相互關系以及相關疾病預防和治療方法的創新提供實驗依據。
1 實驗模型
1.1 人體肺腺泡實驗模型
根據國際放射防護委員會(International Commission on Radiological Protection,ICRP,1994) 人體肺部的分區[10],將第 15、16 級支氣管定義為終末細支氣管,第 17 級支氣管為呼吸性細支氣管,是傳導氣道向呼吸功能區域過渡的支氣管,偶爾帶有少量肺泡,但肺泡數量仍無確切數據,因此本文設計第 17 級支氣管不帶肺泡,討論時與第 15、16 級支氣管統一進行,第 17 級以后部分定義為肺腺泡區。如圖 1 所示,本文實驗模型設計為 1 段第 15 級支氣管、2 段第 16 級支氣管、4 段第 17 級支氣管和 4 段肺腺泡區,每簇肺腺泡包括 17 個肺泡。肺腺泡毗鄰第 15~17 級支氣管和肺泡管的直徑、長度、分支角度均來自 Haefeli-Bleuer 等[11]的解剖學數據,放大 75 倍。每一級終末細支氣管中間做成可拆卸結構,沉積實驗時,可將該段拆下進行顆粒物濃度分析。
健康成年人真實肺泡平均直徑 250 μm,壁厚 δ=1.11 μm,密度250 kg/m3, 楊氏模量 E=5 kPa,泊松比υ=0.4[12],進行等效放大 75 倍后,直徑為 18.75 mm。肺泡實樣做成球形,開圓形口,帶圓環形固定圈,可將肺泡實樣固定在終末細支氣管末端。單獨測量肺泡內的沉積時可取下肺泡實樣洗脫后進行濃度分析。該模型能夠實現各種呼吸條件和不同濕度環境下肺腺泡區顆粒物運動、沉積的實驗分析,包括不同粒徑顆粒物的局部和總沉積率。
 圖1
人體肺腺泡實驗模型
圖1
人體肺腺泡實驗模型
1. 第 15 級支氣管;2. 接頭;3. 第 16 級支氣管;4. 接頭;5. 第 17 級支氣管;6. 接頭;7. 肺泡管;8. 肺泡;Ⅰ. 第 1 級肺泡;Ⅱ. 第 2 級肺泡;Ⅲ. 第 3 級肺泡;Ⅳ. 第 4 級肺泡;Ⅴ. 第 5 級肺泡
Figure1. Human pulmonary acinus experimental model1. 15th level bronchus; 2. connector; 3. 16th level bronchus; 4. connector; 5. 17th level bronchus; 6. connector; 7. pulmonary alveolar duct; 8. pulmonary alveolus; Ⅰ. 1st groups of alveoli; Ⅱ. 2nd groups of alveoli; Ⅲ. 3rd groups of alveoli; Ⅳ. 4th groups of alveoli; Ⅴ. 5th groups of alveolus
1.2 可吸入顆粒物在人體肺腺泡區沉積實驗模型
如圖 2 所示,可吸入顆粒物在人體肺腺泡區沉積實驗模型通過氣溶膠發生器發生單分散聚苯乙烯微球,在模型入口用激光粒子計數器測量發生濃度,經過單向進氣閥后進入肺腺泡實驗模型,通過模擬呼吸器使透明實驗腔體的壓力變為負壓,從而使肺腺泡實驗模型的肺泡膨脹,將氣溶膠吸入肺泡,經過沉積后,模擬呼吸器使透明實驗腔體變為正壓,致使肺泡收縮,肺腺泡實驗模型內氣溶膠通過單向排氣閥排出模型。裝置工作時,通過加濕器調節模擬沉積時的環境濕度。
 圖2
可吸入顆粒物在人體肺腺泡區沉積實驗模型
圖2
可吸入顆粒物在人體肺腺泡區沉積實驗模型
1. 氣溶膠發生器;2. 激光粒子計數器;3. 單向閥;4. 加濕器;5. 單向閥;6. 濕度傳感器;7. 壓差傳感器;8. 人體肺腺泡模型;9. 氣密實驗腔體;10. 呼吸模擬器
Figure2. Experimental model of the deposition of inhalable particles in the human pulmonary acinus area1. aerosol generator; 2. laser particle counter; 3. check valve; 4. humidifier; 5. check valve; 6. humidity sensor; 7. differential pressure sensor; 8. human pulmonary acinus model; 9. airtight test chamber; 10. respiratory simulator
1.3 呼吸模式
Oakes 等[7]實測了 21 歲健康男性的非穩態緩慢呼吸時的流量曲線,如圖 3 所示,近似為正弦曲線。因此本研究通過呼吸模擬器模擬呼吸模式,將呼吸狀態描述為非穩態的正弦函數,呼吸比為 1∶1,呼吸頻率可調,肺泡功能殘氣量 20%~80% 可調。設置三種呼吸模式:(A)正常呼吸模式,肺泡功能殘氣量為 30%,即肺泡最大變形率為 70%;(B)深呼吸模式,肺泡功能殘氣量為 10%,即肺泡最大變形率為 90%;(C)淺呼吸模式,肺泡功能殘氣量為 50%,即肺泡最大變形率為 50%。
 圖3
非穩態呼吸周期
Figure3.
Unsteady state respiratory cycle
圖3
非穩態呼吸周期
Figure3.
Unsteady state respiratory cycle
1.4 實驗模型流體動力學相似
實驗模型動力學相似包括模型內雷諾數 Re 和 Womersley 數
 相似。以往的研究表明,呼吸過程中,終末細支氣管和肺腺泡區的氣流為定常狀態的層流[13],其 Re < 1,
相似。以往的研究表明,呼吸過程中,終末細支氣管和肺腺泡區的氣流為定常狀態的層流[13],其 Re < 1,
 < 1。本實驗模型是該區域真實尺寸的等效放大,雷諾數計算公式為 Re = 8 EVif
/Dυ[7],E 是肺泡當前膨脹率,Vi 是肺泡總體積,f 為呼吸頻率,υ 是空氣動力黏度系數,D 為肺泡直徑。由于人體吸氣過程是空氣在呼吸道內的加濕過程,空氣到達肺泡時,濕度將增加至 100%。因此,肺腺泡內的氣流可看作高濕稀二相流,黏度計算根據王興華等[14]和丁玉龍等[15]提供的計算公式獲得,空氣動力黏度系數 υ = 132.6 × 10–5。模型呼吸周期為 T = 4 s,則三種呼吸模式下,肺泡內 Re << 1。根據 Womersley 數計算公式
< 1。本實驗模型是該區域真實尺寸的等效放大,雷諾數計算公式為 Re = 8 EVif
/Dυ[7],E 是肺泡當前膨脹率,Vi 是肺泡總體積,f 為呼吸頻率,υ 是空氣動力黏度系數,D 為肺泡直徑。由于人體吸氣過程是空氣在呼吸道內的加濕過程,空氣到達肺泡時,濕度將增加至 100%。因此,肺腺泡內的氣流可看作高濕稀二相流,黏度計算根據王興華等[14]和丁玉龍等[15]提供的計算公式獲得,空氣動力黏度系數 υ = 132.6 × 10–5。模型呼吸周期為 T = 4 s,則三種呼吸模式下,肺泡內 Re << 1。根據 Womersley 數計算公式
 [7],此時
[7],此時
 < 1。
< 1。
2 材料與方法
2.1 材料與設備
本文可吸入顆粒物采用 QDSphere 熒光聚苯乙烯微球(北京華泰昕生物醫療技術有限公司),包括 0.1、0.3、0.5、1.0、3.0、5.0 μm 六種規格。
F9631 標準粒子發生裝置(沈陽新科精密儀器設備有限公司)用于發生單分散聚苯乙烯熒光微球氣溶膠;呼吸模擬器(北京市翰文網星科技有限責任公司)用于模擬不同呼吸條件;亞都 SC-D052AE 加濕器(北京亞都環保科技有限公司)用于向實驗模型內加濕;MP100 壓差儀(法國凱茂公司)用于監測肺腺泡的壓力;TSI8386 空氣參數多功能測試儀(美國 TSI)用于監測肺腺泡內相對濕度和溫度;TSI AeroTrak9350 便攜式粒子計數器(美國 TSI)用于檢測發生至實驗模型內 0.3~5.0 μm 粒徑的可吸入顆粒物濃度;Lasairll 激光粒子計數器(美國 PMS)用于檢測發生至實驗模型內 0.1 μm 粒徑的可吸入顆粒物濃度;Attune NxT 流式細胞儀(Thermofisher)用于沉積粒子計數。
2.2 方法
2.2.1 單分散聚苯乙烯熒光微球氣溶膠發生
將單分散熒光聚苯乙烯微球原液稀釋后配成濃度 1×107~1×109 個/mL 的發生液,放入 F9631 標準粒子發生裝置發生單分散氣溶膠,發生流量為 80 L/min。在該條件下,F9631 標準粒子發生裝置可發生濃度為 1×103~3×105 個/L。
2.2.2 可吸入顆粒物肺腺泡沉積
將各級終末細支氣管、接頭及肺泡分別浸入去離子水中,放入超聲波清洗器內清洗 5 min,取出后在低溫干燥器內充分干燥,然后在超凈工作臺內裝配。裝配完畢后放入氣密實驗腔體固定,連接好管路和傳感器后,檢查裝配后實驗模型的氣密性。調節呼吸模擬器至所需的呼吸頻率流量和功能殘氣量,調節加濕器使實驗模型內相對濕度達到預定值。開啟氣溶膠發生器和粒子計數器,開始沉積實驗。每間隔 5 min 采用激光粒子計數器記錄一次氣溶膠發生濃度。
2.2.3 顆粒物沉積計數
實驗采用將沉積模型內沉積的顆粒物用洗脫液洗下,在流式細胞儀內進行計數的方式獲得顆粒物沉積數量。流式細胞儀可以區分熒光顆粒和非熒光顆粒,因此可以最大程度地減少非熒光顆粒對沉積數量的干擾。沉積實驗結束后,取下并拆分肺腺泡模型。向肺泡內加 5 mL 去離子水浸泡 1 h,漩渦振蕩器上振蕩 1 min,終末細支氣管和肺泡管放入燒杯中,加 20 mL 去離子水后漩渦振蕩器上振蕩 1 min。用移液器收集至 EP 管內。利用流式細胞儀測定顆粒物濃度,每次進樣 50 μL,進樣速度為 12.5 μL/min。
2.2.4 沉積實驗模式
主要考察 Dp = 0.1、0.3、0.5、1.0、3.0、5.0 μm 的顆粒物在人體肺腺泡實驗模型中的沉積率。呼吸周期為 T = 4 s,實驗時間 3~6 h,肺泡內空氣相對濕度 100%。
2.2.5 沉積率計算
采用式(1)進行終末細支氣管和肺泡內的沉積率計算。
 |
其中:DFi 是第 i 級終末細支氣管或肺泡的沉積率;Ni 是通過流式細胞儀計數得到的顆粒物沉積數量;Vi 是第i 級終末細支氣管和肺泡內氣溶膠通過的實際總體積,以第 15 級終末細支氣管為例,其實際總體積 V15 是本身的體積與其后終末細支氣管、肺泡管和肺泡體積之和;C1 是可吸入顆粒物氣溶膠濃度,用實驗階段所有采集數據的平均值表示;δ 是功能殘氣率。
3 結果與討論
3.1 正常呼吸模式下肺腺泡區顆粒物沉積
正常呼吸模式下(模型 A)肺腺泡沉積模型顆粒物沉積結果如圖 4 和圖 5 所示。圖 4 給出了顆粒物在終末細支氣管和肺腺泡區的沉積實驗結果,肺腺泡前端的第 15~17 級支氣管的 1.0 μm 以下粒徑的顆粒物沉積率并沒有明顯差別,均低于 5%,說明終末細支氣管對細微顆粒物的攔截作用有限,細微顆粒物大部分仍能直接進入肺腺泡區域。3.0~5.0 μm 顆粒物沉積率較粒徑較小的顆粒物有明顯增大,說明終末細支氣管區域和第 17 級支氣管仍對大粒徑顆粒物起主要攔截作用,使其難以到達肺腺泡區。同時,同一粒徑的顆粒物在第 15~17 級支氣管沉積率基本相同,說明終末細支氣管及呼吸性細支氣管(第 17 級)的尺寸和生理環境類似,顆粒物在終末細支氣管的流體動力學特性也類似。
如圖 4 所示,0.1~1.0 μm 的顆粒物在肺腺泡區的總沉積率明顯高于在前端支氣管的沉積率,說明肺腺泡區是細微顆粒物的主要沉積區域。粒徑 0.1 μm 顆粒物在肺腺泡區總沉積率為 10.32%,與 Oakes 等[7]模擬仿真結果(肺腺泡沉積率 8.3%)近似,也與 Chhabra 等[16]的單肺泡實驗模型 20 次呼吸循環后沉積結果(10%)一致。1.0 μm 粒徑的顆粒物在肺腺泡區沉積率(13.27%)最高。黃俊[17]對肺腺泡的計算機模擬研究表明,顆粒物在肺腺泡內的沉積隨著顆粒物的增大,呈現先增大后減小的趨勢,這與本文實驗結果一致。顆粒物沉積在肺泡壁上之前,會有一個較長時間的渦流循環,而非隨著呼氣過程流出肺泡,Chhabra 等[16]模型中顆粒物沉積率隨著呼吸循環次數的增大而增大,這些研究結果與本文實驗結果一致,即 1.0 μm 顆粒物在慣性作用和布朗運動的平衡作用下,在肺泡內懸浮時間最長,隨著時間的累積,抵達肺泡壁并沉積的概率最大。3.0~5.0 μm 的顆粒物在肺腺泡區總沉積率最低,但與第 15~17 級支氣管的沉積率沒有明顯差異,說明進入到肺腺泡的大顆粒物沉積機制與終末細支氣管一致,均是慣性沉積占主導地位。
 圖4
正常呼吸模式(模型 A)的顆粒物沉積結果
Figure4.
Particle deposition results of healthy alveoli (Model A)
圖4
正常呼吸模式(模型 A)的顆粒物沉積結果
Figure4.
Particle deposition results of healthy alveoli (Model A)
顆粒物在肺腺泡內不同區域沉積率的變化如圖 5 所示。從圖中可以看出,肺泡管沉積率比其他區域明顯降低,作為多個肺泡的共同通道,本身內表面積很小,因此與顆粒物有效接觸面積小,沉積率很小,一般低于 0.5%。Ⅰ~Ⅳ 級肺泡內的沉積率較為均勻,說明顆粒物在肺腺泡內的沉積機制一致,單簇肺腺泡可看作呼吸的基本單元,在未來的研究中可作為整體考慮[16]。但是,0.5 μm 顆粒物在第 Ⅰ 級肺腺泡沉積率明顯高于后面的肺泡。造成這一現象的原因可能是 0.5 μm 顆粒物處于擾動和擴散沉積的過渡區域,因此在第 Ⅰ 級肺泡的沉積率增大。Berg 等[8]建立的 PIV 實驗模型發現能夠到達肺腺泡末端肺泡的氣流流線很少,且流速極低。本文實驗模型中,肺腺泡末端(即第 Ⅴ 級肺泡)內的沉積率下降較明顯,說明在正常呼吸模式下,顆粒物流線很少抵達最末端的肺泡。但是,5.0 μm 顆粒物慣性最大,能夠到達肺腺泡末端,因此沉積率的增大較為明顯。
 圖5
呼吸功能殘氣量為 30% 時(模型 A)的顆粒物肺泡區沉積結果
Figure5.
Particle deposition results of functional residual capacity 30% (Model A)
圖5
呼吸功能殘氣量為 30% 時(模型 A)的顆粒物肺泡區沉積結果
Figure5.
Particle deposition results of functional residual capacity 30% (Model A)
3.2 不同功能殘氣量對肺腺泡區顆粒物沉積的影響
功能殘氣量對應于呼吸殘氣量,是維持人體呼吸系統連續向人體供氧的基礎。運動、靜止、不同體力勞動下功能殘氣量均有較大差異。郭西龍[18]的模擬研究表明,功能殘氣量越低,顆粒物在人體呼吸系統的沉積率越高,且越深入肺部,沉積率增大越顯著。本文采用的實驗模型在三種不同功能殘氣量條件下的人體肺腺泡顆粒物沉積率實驗結果如圖 6 所示。不同功能殘氣量呼吸模式下,同一粒徑的顆粒物在第 15~17 級支氣管內的沉積并無明顯差異,且不同粒徑在相同支氣管內的沉積率變化趨勢也較為一致。說明在終末細支氣管和呼吸性細支氣管(第 17 級)內,功能殘氣量變化并未引起顆粒物運動速度發生質的變化,仍然處于充分發展的層流狀態。
但在肺腺泡區,不同功能殘氣量引起的顆粒物沉積率變化較為明顯。功能殘氣量越小,顆粒物在肺腺泡內沉積率越大。這是由于功能殘氣量越小,每次呼吸轉換時形成的渦流規模就越大。如前所述,對于較小粒徑的顆粒物在肺腺泡主要由擴散作用沉積,渦流有助于加速擴散,因此顆粒物沉積率就相應增大。特別對于直徑 1.0 μm 的顆粒物,功能殘氣量 10% 時沉積率達 17%,比功能殘氣量 50%(沉積率 7%)時增大了 1 倍。
 圖6
不同呼吸模式下顆粒物在模型不同區域沉積結果
Figure6.
Particle deposition results in different regions of pulmonary acinus under different respiratory modes
圖6
不同呼吸模式下顆粒物在模型不同區域沉積結果
Figure6.
Particle deposition results in different regions of pulmonary acinus under different respiratory modes
慢性阻塞性肺氣腫、肺萎縮是目前常見的呼吸系統疾病。以塵肺為例,當前的藥物治療主要起到緩解癥狀的作用,不能有效清除肺部粉塵;肺灌洗技術可以有效清除肺部粉塵,但是存在成本高、患者痛苦以及并發癥多等諸多問題[19]。然而目前可吸入顆粒物肺內沉積的研究結果表明,可溶性藥物的霧化吸入有望為慢性阻塞性肺氣腫等疾病提供靶向性更強的有效治療方法。本文實驗模型研究結果可為肺部不同病變區域的藥物霧化治療提供依據。由于鼻咽區及第 1~14 級支氣管對大顆粒物的攔截效率很高,很難進入終末細支氣管和肺腺泡區,因此若是肺腺泡區發生了病變,霧化吸入藥物顆粒直徑應小于 3 μm,以 1 μm 左右為佳,且功能殘氣量盡可能小,才能使之更有效地進入肺腺泡區。如果支氣管區域發生病變,如支氣管阻塞等,藥物顆粒物應大于 1 μm,才能有效避免藥物向肺腺泡區沉積,在提高藥物靶向作用的同時,可降低藥物進入血液循環的風險。
4 結論
顆粒物在肺腺泡內沉積規律的研究多集中在計算機建模分析,分析結果目前尚無法通過在體實驗直接驗證。近年來有學者建立了單一肺泡或單簇肺泡的實驗模型,采用 PIV 等技術分析了肺泡內流場分布和顆粒物沉積的規律。本文通過建立多簇肺腺泡離體實驗模型,分析了不同粒徑顆粒物在不同功能殘氣量條件下在終末細支氣管和肺腺泡區的沉積率變化規律。實驗結果表明,顆粒物在肺腺泡內的沉積率與以往計算機模擬結果較為一致,1 μm 直徑的顆粒物沉積率最高。功能殘氣量對顆粒物的沉積有顯著的影響,功能殘氣量越低,顆粒物在肺腺泡區沉積率越高。本文實驗結果進一步驗證了以往肺腺泡內顆粒物沉積的理論分析和計算機模擬仿真結果,其重要意義在于,通過建立離體實驗模型可為顆粒物在人體各種病變、呼吸模式下肺腺泡內沉積規律的研究提供了直接的實驗方法,也可為肺氣腫等疾病的藥物霧化吸入治療方式的優化提供必要手段。