骨軟骨損傷是臨床上常見的關節疾病。由于骨軟骨界面的復雜性和軟骨自我修復能力匱乏等因素,針對骨軟骨損傷的臨床治療局限性較大。組織工程的提出,為骨軟骨損傷同步修復提供了新的治療方式。本文就骨軟骨組織工程的三個方面進行綜述介紹,它們分別是:種子細胞來源以及培養方式、生長因子的調控以及協同作用、細胞支架的組成類型,文中著重探討骨軟骨修復支架的現狀和研究進展,最終期待通過本文綜述,可為骨軟骨組織工程的進一步發展提供參考。
引用本文: 蘭偉偉, 陳維毅, 黃棣. 骨軟骨組織工程研究進展. 生物醫學工程學雜志, 2019, 36(3): 504-510. doi: 10.7507/1001-5515.201810001 復制
版權信息: ?四川大學華西醫院華西期刊社《生物醫學工程學雜志》版權所有,未經授權不得轉載、改編
引言
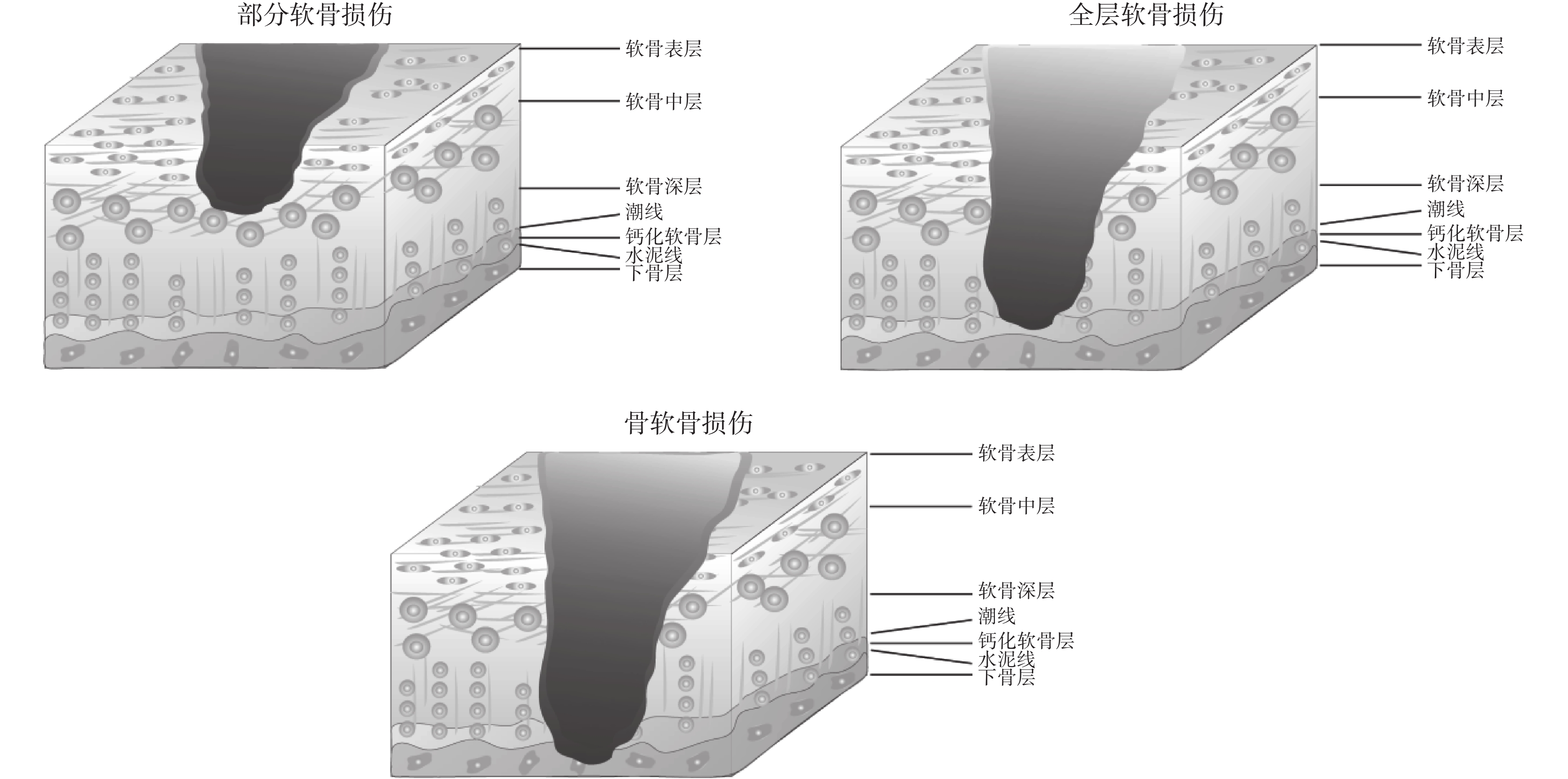
關節軟骨在關節的運動中發揮著重要的作用。由機體老化所帶來關節軟骨退化以及不健康的運動方式和創傷所帶來的骨軟骨受損等相關疾病已經嚴重威脅患者的健康,但由于關節軟骨內部缺少神經和血管,且內部軟骨細胞數目較少,因而關節軟骨幾乎不具有自我損傷修復的能力[1]。常見的關節損傷按照其受損程度可以分為:部分軟骨損傷、全層軟骨損傷、骨軟骨損傷[2],如圖 1 所示。目前針對關節損傷的治療,臨床多以手術治療為主,包括有:關節鏡清創術、微骨折術、自體移植術與異體移植術等[1-4],如表 1 所示,這些手術均具有一定的局限性。
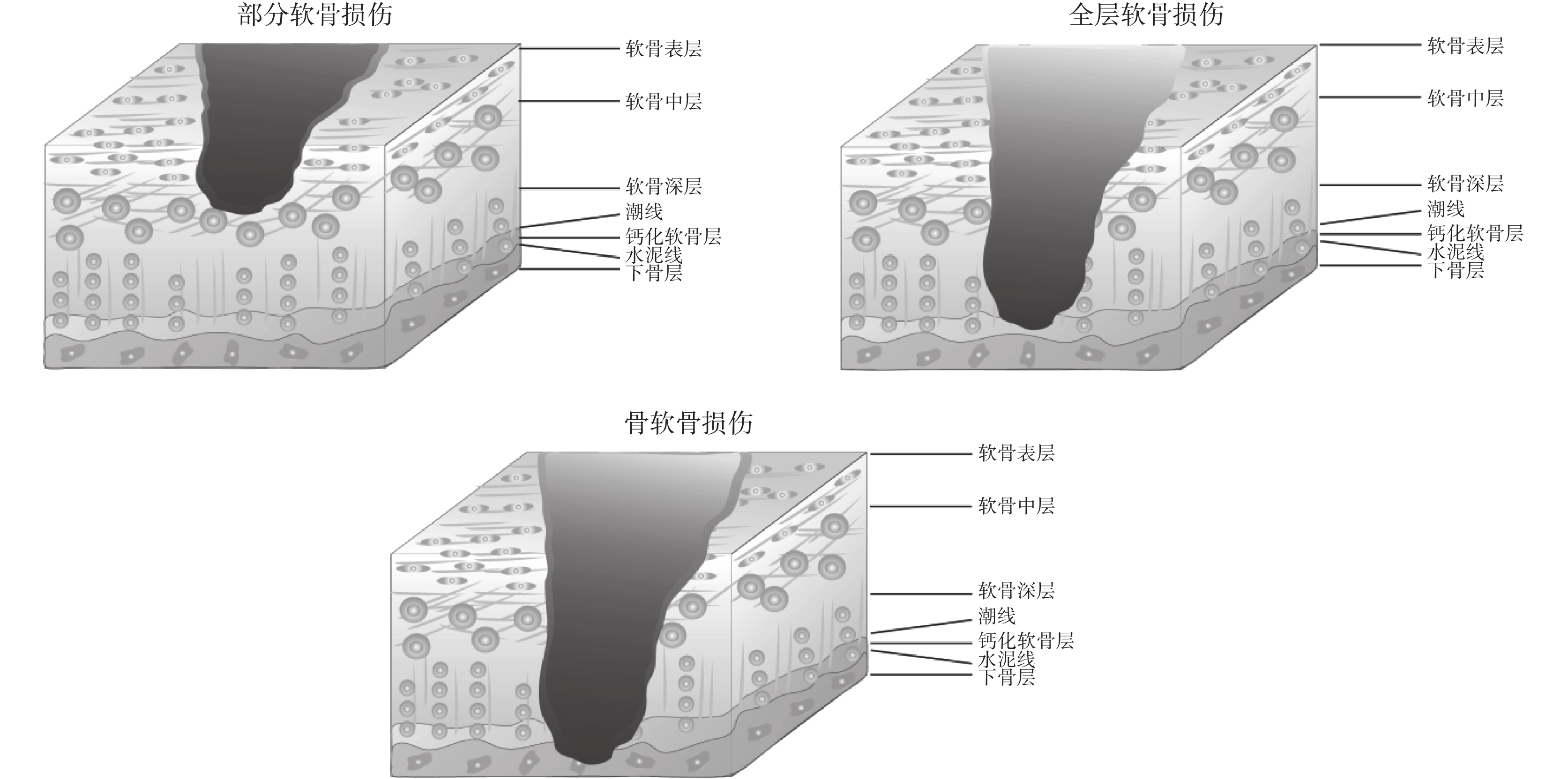 圖1
關節軟骨損傷類型
Figure1.
Types of articular cartilage injury
圖1
關節軟骨損傷類型
Figure1.
Types of articular cartilage injury
近年來,組織工程的發展與進步為骨軟骨損傷修復帶來了新的希望。組織工程主要包括三個方面:種子細胞、生長因子和細胞支架[5],其中細胞支架作為細胞生存的載體,不僅需要提供適合細胞生長、增殖和分化的環境,在移植后還需不斷適應生理環境變化,滿足體內生長需求。
相關研究表明,軟骨損傷和修復均受到軟骨下骨的影響,軟骨下骨為軟骨修復提供固定支撐和營養輸送等作用[6-9]。骨軟骨界面構造精細且復雜,兩者在解剖結構上相互連接,在生物學功能上彼此影響。骨軟骨界面整體呈現連續性,但不同的位置卻具有不同結構、力學特性以及生物學特征等,軟骨和骨中任一組織的變化都會對彼此產生影響[8-9]。作為體內植入體的細胞支架應該在設計上考慮到這種復雜性,以期更好地模擬在體結構。現就骨軟骨組織工程三個方面:種子細胞、生長因子和細胞支架進行綜述,著重介紹骨軟骨修復支架的現狀和研究進展,以期為骨軟骨組織工程的進一步發展提供參考。
1 種子細胞
組織工程選用的種子細胞應滿足相關要求,例如:來源廣泛、取材方便;細胞活性和增殖能力強;能夠與支架良好融合以及免疫原性較低等。目前骨軟骨修復所采用的種子細胞有:自體細胞、同種異體細胞和異種細胞等。自體細胞來源于患者自身,不具備免疫原性,但由于存在取材不便、易引起取材部位的不適和創傷等潛在風險限制了其應用。相較于自體細胞,同種異體和異種細胞的取材來源更為廣泛,但是具有一定的免疫風險性[10]。其中,軟骨細胞、成骨細胞、骨髓間充質干細胞、脂肪間充質干細胞和胚胎干細胞等是骨軟骨組織工程修復中常選用的種子細胞。
骨軟骨受損涉及多種組織和細胞,細胞共培養技術的提出為骨軟骨修復提供了一種新的思路。Radhakrishnan 等[11]制備了雙相骨軟骨支架,將小鼠軟骨細胞和成骨細胞植入該支架,結果表明軟骨細胞和成骨細胞分別在對應的支架層中具有良好的分布,且在雙相支架的過渡面實現了軟骨細胞和成骨細胞共存。研究證實了該培養體系具有較好的軟骨細胞分化能力,同時能夠降低軟骨細胞的凋亡[12-13]。
相對于體內含量較少、分化成熟的軟骨細胞來說,干細胞具有多向分化和較長時間自我更新的能力,因而在骨軟骨組織工程領域應用廣泛。其中,骨髓間充質干細胞、脂肪間充質干細胞、滑膜間充質干細胞和胚胎干細胞均為重點研究的種子細胞[14-15]。Sartori 等[16]制備了 I 型膠原/鎂—羥基磷灰石/I 型膠原的雙相骨軟骨一體修復支架。結果表明,在 I 型膠原水凝膠層,人類間充質干細胞實現了向軟骨細胞分化;而在下層礦化層則向成骨細胞分化。他們進一步將此載有干細胞的復合支架植入小鼠體內,也得到了與體外實驗一致的結果,同時支架與組織能夠較好地融合,表明該復合支架具有一定的骨軟骨修復實用性。
總之,種子細胞的選取在骨軟骨修復中起著至關重要的影響。現有技術中,以骨軟骨細胞作為種子細胞具有取材不便、含量較少的缺點;而以干細胞作為種子細胞,則存在體外誘導分化、增殖價格昂貴且效率較低的缺陷;而細胞共培養技術則具有成本較低、效率較高的優勢,因此也有很多相關實驗采用多種細胞共培養的方式,包括有:成骨細胞和軟骨細胞共培養體系、成骨細胞與干細胞共培養體系以及軟骨細胞與干細胞共培養體系等[12-13, 17-18]。相關實驗證實,共培養體系能夠解決種子細胞來源單一的問題,但是由于共培養體系中細胞種植比例以及生長因子的添加均會對研究結果產生各種的影響,仍需要進一步的深入研究。
2 生長因子
生長因子在骨軟骨修復中發揮著重要的作用,如骨形態蛋白、堿性成纖維細胞生長因子、轉化生長因子、血管內皮生長因子、胰島素生長因子、血小板衍生生長因子等均對成骨細胞、軟骨細胞和干細胞的生長和增殖等相關生物學行為具有一定的調控作用[19-20]。例如:轉化生長因子能夠誘導骨髓間充質干細胞向軟骨細胞分化,但相關實驗證實,只使用轉化生長因子并不能夠誘導形成與在體相仿的軟骨組織,反而會誘導纖維化軟骨的形成[19]。骨形態蛋白能夠促進骨生成[21],但是目前尚不明確其合理使用的劑量范圍以及半衰期等。同時,相關研究也報道,骨形態蛋白可能會導致異位成骨以及相關炎癥反應等,以上因素在一定程度上限制了生長因子的使用[22-23]。
為提高生長因子的使用效率,研究者們通常會考慮將其與其它材料復合,制成載生長因子復合材料。Yao 等[24]利用電泳沉積技術制備了載有骨形態蛋白的石墨烯、聚乳酸—羥基乙酸復合支架。實驗結果表明,該載骨形態蛋白復合支架經石墨烯修飾后,復合支架的力學性能明顯改善,拉伸強度由原來的(47.2 ± 8)kPa 提升至(126.1 ± 6)kPa;體外釋放結果表明,骨形態蛋白可穩定釋放,同時釋放濃度可通過電壓調控,隨著電壓升高,復合支架釋放能力有所提升;細胞實驗表明,該復合支架能夠誘導人骨髓間充質干細胞向成骨細胞分化。
Han 等[25]制備了骨軟骨修復支架,在軟骨層中添加轉化生長因子,其濃度從上至下呈遞減趨勢,在下骨層中添加骨形態蛋白因子,其濃度從上至下呈遞增趨勢。體外細胞實驗證實,該支架成功誘導骨髓間充質干細胞在軟骨層中向軟骨細胞分化,在下骨層中向成骨細胞分化。動物實驗也證實支架能夠較好地與周圍組織融合,光鏡下可見新生軟骨和骨的生成,證實這種復合支架具有良好的骨軟骨修復能力。
上述生長因子對骨軟骨缺損修復均具有一定的影響,特定條件下能促進骨軟骨損傷修復,但生長因子作為一種外源性添加劑,其自身具有多向調控性,這種調控性與其來源、純度、劑量大小以及種子細胞的種類、分化狀態、培養條件及有無其它生長因子等多種因素有關。目前相關實驗多采用單一生長因子用于骨軟骨修復,實際生理環境是多種生長因子協同調控,此外當前對于生長因子以體外研究居多,缺少在體實驗數據等,以上問題均需通過相關實驗以確定使生長因子發揮最佳效應的各項條件。
3 細胞支架
理想的細胞支架應具有良好的細胞相容性、合適的降解速率且其降解產物無細胞毒性、適宜的孔隙率和孔徑結構、良好的力學性能和三維網絡結構以及能夠促進細胞生長等優勢,并可作為藥物和生長因子的載體[7]。
隨著生物材料的不斷發展,各種能夠更好地滿足骨軟骨修復的新型材料不斷涌現。依照來源的不同,可以分為天然材料和人工合成材料。常用天然材料有:膠原、殼聚糖、絲素蛋白、海藻酸鹽、透明質酸、硫酸軟骨素、羥基磷灰石、β—磷酸鈣等。天然材料具有良好的生物相容性、低免疫原性、較好的細胞結合能力和生物降解性等,因而受到更多關注,但是天然材料較弱的力學性能限制了其在臨床上的應用。
為了較好地模擬骨軟骨在體組成和內在結構特點,Levingstone 等[4]利用迭代分層冷凍干燥技術制備了三層一體化骨軟骨修復支架,軟骨層采用Ⅰ、Ⅱ型膠原和透明質酸;中間過渡層采用Ⅰ、Ⅱ型膠原和羥基磷灰石;軟骨下骨層采用Ⅰ型膠原和羥基磷灰石。實驗結果表明,該支架具有較好的孔隙率,且支架孔徑整體呈現上大下小,相互貫通,能夠較好地模擬在體環境。細胞實驗進一步證實,該研究中采用的細胞貫穿生長于整個支架,且實現了細胞增殖,結果證實了該支架能夠較好地滿足骨軟骨一體化修復。然而,該支架的壓縮模量遠低于正常人體實際情況,具體對比參數為:支架軟骨層為 0.3 kPa、中間層為 0.35 kPa、軟骨下骨層約為 0.95 kPa;正常人體的軟骨淺層、軟骨深層、鈣化軟骨層和軟骨下骨的壓縮模量分別約為 0.079 MPa、2.1 MPa、320 MPa 和 5.7 GPa[9],提示該支架的力學性能仍需要進一步加強。
常用于骨軟骨修復的人工合成高分子材料包括有:聚乳酸—羥基乙酸、聚乙烯醇、聚乳酸、聚醚醚酮、聚己內酯、聚乙二醇等。人工合成高分子材料能夠人為調控材料聚合度,從而控制其力學性能、內在結構等,進而可更好地滿足骨軟骨修復的實際需求。但是高分子材料大多具有細胞毒性或者其降解產物具有細胞毒性、酸堿性等,以上因素在一定程度上限制了其應用。Du 等[26]利用選擇性激光燒結技術制備了具有分層結構的聚己內酯、羥基磷灰石骨軟骨一體修復支架。該支架的整體壓縮模量為 8.7 MPa,能夠較好地滿足骨軟骨修復力學要求,細胞實驗和體內實驗證實該支架具備一定的骨軟骨修復應用價值。
作為常見的高分子修復材料之一,聚己內酯具有優異的生物相容性、降解產物不具有細胞毒性以及易加工成形等優點,但是也存在熔點較低、降解速率較慢等問題。為解決單一材料性能的相關弊端,可采用兩種或多種材料進行復合,依據其性能互補的特點進行新型復合材料的研究和相關性能探索,以研發更加理想的骨軟骨修復材料。
從支架的整體結構和性能進行分類,可以將骨軟骨修復支架大致分為三大類:單相支架、雙相支架和多相支架。其中的“相”代表其結構、成分、力學性能等,現就這三種支架分別進行相關的綜述。
3.1 單相支架
單相支架是用一種或多種材料制備而成,是具有相同結構、成分、力學屬性的支架,并最早用于骨軟骨修復。單相支架由于整體結構和成分的統一性,通常并不滿足骨軟骨一體修復的需求,僅單獨用于軟骨修復或骨修復。
羥基磷灰石作為骨中無機成分的重要組成部分,具有較好的生物活性、骨誘導性和生物相容性,是較早用于骨修復的醫用材料之一。但純羥基磷灰石支架力學性能較脆、分散性差、生物降解能力相比 β—磷酸鈣較弱,很難滿足骨修復要求。因而大量研究著重于對其晶體進行改性或者添加相關聚合物使其具有較好的分散能力,同時增強其力學穩定性。實驗研究中多用羥基磷灰石與 β—磷酸鈣復合形成雙相磷酸鈣來滿足骨修復的需求[3, 27]。
Effendi 等[28]研究了制備的純羥基磷灰石經明膠和殼聚糖修飾的羥基磷灰石骨修復單相支架的相關性能,結果表明純羥基磷灰石支架具有較高的孔隙率以及相互貫通的孔徑結構,但其力學性能較差;經殼聚糖和明膠修飾后,支架力學性能具有一定的提升。
膠原是骨、軟骨組織主要的有機組分,軟骨中Ⅱ型膠原和骨中Ⅰ型膠原含量豐富。實驗證實,軟骨細胞和成骨細胞在膠原支架上具有較好的細胞相容性以及增殖能力,膠原的存在還能夠誘導干細胞向成骨細胞或軟骨細胞分化,此外膠原在組織修復過程中也起著重要的作用[29-30]。但是,純膠原支架力學性能較差且降解速度較快,不具備支架修復的穩定性,有研究證實可通過添加羥基磷灰石在一定程度上改善膠原支架的穩定性[31]。
Lin 等[32]采用低溫三維打印技術制備了具有不同結構的膠原、羥基磷灰石復合單相骨修復支架。結果表明,相較于對照組,采用低溫三維打印技術所制備的支架能更好地促進骨髓間充質干細胞的增殖能力,同時促進其向成骨細胞分化;在體實驗也證實,實驗組能夠更好地促進新生骨的形成。
綜上表明,單相支架可為成骨、軟骨細胞的生長提供良好的條件,且能夠誘導干細胞定向分化為軟骨或成骨細胞,但是骨軟骨損傷體系中涉及到不同結構、不同組織,軟骨細胞和成骨細胞增殖所需要的生長環境不同,單相支架往往不能同時提供成骨細胞與軟骨細胞生長所需的環境,在一定程度上降低了其在治療關節骨軟骨缺損時的效果。
3.2 雙相支架
雙相支架是用一種或多種材料制備而成,具有兩相分層結構,且通常各分層在成分、內在結構以及力學屬性等方面均有差異。相較于單相支架,雙相支架能夠同時滿足軟骨和軟骨下骨的植入和修復要求。雙相支架既可以植入成骨、軟骨兩種細胞,也可以植入同種干細胞,以構建骨軟骨修復共同體。
Seong 等[33]利用定向冷凍干燥法,制備了具有定向對齊孔徑結構的膠原和雙相磷酸鈣復合支架。實驗結果表明,具有定向對齊結構的雙相支架其壓縮強度和拉伸強度均優于隨機結構對照組,同時定向對齊支架的力學性能隨著孔徑的縮小而提升。值得注意的是,雙相磷酸鈣的加入提升了復合支架的壓縮力學性能,但是其拉伸性能卻小于純膠原對照組。細胞實驗證實,定向對齊結構的雙向支架中細胞增殖較快、遷移能力較強且細胞鋪展較好;在體動物實驗證實,與隨機結構對照組比較,實驗組具有較好的骨軟骨修復能力,其中孔徑在 270 μm 時修復效果最好。以上實驗證實,骨軟骨修復支架的孔徑大小以及結構分布均會對其修復效果產生影響。
Yao 等[15]通過在聚乙烯醇中加入改性 β—磷酸鈣制備骨軟骨修復雙相支架。力學性能測試結果表明,隨著 β—磷酸鈣濃度的增加,支架整體力學性能得到了改善;支架的內部結構也能夠較好地模擬在體骨軟骨結構特點。細胞實驗證實,上層支架能夠較好地促進軟骨細胞的黏附、增殖,下層支架能夠較好地誘導滑膜間充質干細胞向成骨細胞的分化。整體實驗證實該種雙相支架具有一定的骨軟骨修復潛在可能性。
Ruan 等[34]制備了殼聚糖、絲素蛋白、羥基磷灰石雙相復合支架,支架相關性能分析表明,支架的孔隙率達到 90%、吸水性高達 822%,能夠較好地滿足骨軟骨支架結構特點,將骨髓間充質干細胞植入支架,相關結果表明干細胞能夠定向分化為軟骨和成骨細胞,在體動物實驗也證實該種支架具有良好的骨軟骨修復效果。
綜上所述,雙相支架能夠較好地滿足骨軟骨修復需求,但一些弊端也不容忽視,如骨軟骨界面結合力較差、力學穩定性較弱、骨軟骨界面缺失等。大量研究對于潮線以及鈣化軟骨層的生理作用進行了闡述[9, 35]。雙相支架中往往忽視了潮線以及鈣化軟骨層制備,而鈣化軟骨層以及潮線是連接軟骨和軟骨下骨的重要界面結構。潮線以及鈣化軟骨層的缺失可能會引起支架生物力學分布不均衡以及組織液循環障礙,不利于骨軟骨缺損的修復,因此如果采用三相或者多相支架作為骨軟骨修復支架,或許可以更好地模擬在體骨軟骨界面。
3.3 多相支架
為了更好地模擬在體環境的結構特點,骨軟骨一體化修復支架更加傾向于三相以及多相支架的設計。三相以及多相支架通常采用多種材料制備而成,具有三相及以上分層結構,或者支架結構呈整體連續變化,且通常各分層在成分、內在結構以及力學屬性等方面均有差異。
為了解決支架界面黏合問題,Su 等[36]通過定向電泳的方式制備了一體化聚乙烯醇、羥基磷灰石支架。實驗表明,羥基磷灰石分散良好,支架的力學性能隨著羥基磷灰石的濃度增加有所提升,支架結構呈連續變化,具有整體性,并不存在明顯的分層結構。
多相支架的制備和復合方式包括有:迭代冷凍法[3, 37]、力學擠壓法[8]、三維打印[32, 38-39]以及上述的電泳法等。骨軟骨修復過程不僅僅與支架的相關結構性能相關,同時也與支架的化學成分以及藥物釋放相關。Algul 等[7]利用海藻酸鹽、殼聚糖、β—磷酸鈣制備了三層結構的骨軟骨修復支架,利用溶劑吸附方式將地塞米松鈉磷酸吸附于支架表面,動物實驗結果表明,該種支架能夠有效地控制藥物的釋放速率,同時有效地促進骨軟骨再生。
現階段大量骨軟骨修復實驗均處于體外細胞實驗以及動物體內實驗階段,臨床實驗樣本量較少。Perdisa 等[40-41]利用Ⅰ型膠原和羥基磷灰石制備了三相復合支架,上層支架為 100% 的Ⅰ型膠原;中間支架為 40% 的羥基磷灰石和 60% 的Ⅰ型膠原;下層支架為 70% 的羥基磷灰石和 30% 的Ⅰ型膠原。其臨床實驗證實,該支架具有良好的骨軟骨修復能力。該實驗或可為人在體骨軟骨修復做出一定的參考。
三相或多相骨軟骨修復支架能夠較好地模擬正常組織結構分布,更符合組織工程骨軟骨復合支架的要求。需要值得關注的是,支架相鄰界面的結合強度有待加強,同時對于潮線以及鈣化軟骨層的設計模擬尚不成熟。
4 總結和展望
近年來,針對骨軟骨受損作為臨床廣泛可見且較為嚴重的關節疾病這一事實,骨軟骨的有效修復和再生一直受到組織工程領域的密切關注。本文系統地闡述了當前骨軟骨缺損的治療方式以及面臨的問題,同時著重從組織工程的角度來敘述了骨軟骨修復的研究進展以及存在的問題。隨著對于骨軟骨結構認識的不斷深入,組織工程領域已經能夠較好地從種子細胞、生長因子以及支架三個方面模擬體內的生理狀態以制備骨軟骨支架。但是,由于正常人體骨軟骨解剖界面、組分含量的復雜性,目前組織工程尚不能做到成分以及結構的雙重仿生。
隨著材料與技術的不斷發展,新的制備技術如:三維打印技術、靜電紡絲技術等,可結合新的支架材料,多學科、多領域合作,綜合利用材料學、生物力學、生理學等相關專業知識跨專業相結合,未來終將解決骨軟骨缺損這一臨床科學難題。
引言
關節軟骨在關節的運動中發揮著重要的作用。由機體老化所帶來關節軟骨退化以及不健康的運動方式和創傷所帶來的骨軟骨受損等相關疾病已經嚴重威脅患者的健康,但由于關節軟骨內部缺少神經和血管,且內部軟骨細胞數目較少,因而關節軟骨幾乎不具有自我損傷修復的能力[1]。常見的關節損傷按照其受損程度可以分為:部分軟骨損傷、全層軟骨損傷、骨軟骨損傷[2],如圖 1 所示。目前針對關節損傷的治療,臨床多以手術治療為主,包括有:關節鏡清創術、微骨折術、自體移植術與異體移植術等[1-4],如表 1 所示,這些手術均具有一定的局限性。
 圖1
關節軟骨損傷類型
Figure1.
Types of articular cartilage injury
圖1
關節軟骨損傷類型
Figure1.
Types of articular cartilage injury
近年來,組織工程的發展與進步為骨軟骨損傷修復帶來了新的希望。組織工程主要包括三個方面:種子細胞、生長因子和細胞支架[5],其中細胞支架作為細胞生存的載體,不僅需要提供適合細胞生長、增殖和分化的環境,在移植后還需不斷適應生理環境變化,滿足體內生長需求。
相關研究表明,軟骨損傷和修復均受到軟骨下骨的影響,軟骨下骨為軟骨修復提供固定支撐和營養輸送等作用[6-9]。骨軟骨界面構造精細且復雜,兩者在解剖結構上相互連接,在生物學功能上彼此影響。骨軟骨界面整體呈現連續性,但不同的位置卻具有不同結構、力學特性以及生物學特征等,軟骨和骨中任一組織的變化都會對彼此產生影響[8-9]。作為體內植入體的細胞支架應該在設計上考慮到這種復雜性,以期更好地模擬在體結構。現就骨軟骨組織工程三個方面:種子細胞、生長因子和細胞支架進行綜述,著重介紹骨軟骨修復支架的現狀和研究進展,以期為骨軟骨組織工程的進一步發展提供參考。
1 種子細胞
組織工程選用的種子細胞應滿足相關要求,例如:來源廣泛、取材方便;細胞活性和增殖能力強;能夠與支架良好融合以及免疫原性較低等。目前骨軟骨修復所采用的種子細胞有:自體細胞、同種異體細胞和異種細胞等。自體細胞來源于患者自身,不具備免疫原性,但由于存在取材不便、易引起取材部位的不適和創傷等潛在風險限制了其應用。相較于自體細胞,同種異體和異種細胞的取材來源更為廣泛,但是具有一定的免疫風險性[10]。其中,軟骨細胞、成骨細胞、骨髓間充質干細胞、脂肪間充質干細胞和胚胎干細胞等是骨軟骨組織工程修復中常選用的種子細胞。
骨軟骨受損涉及多種組織和細胞,細胞共培養技術的提出為骨軟骨修復提供了一種新的思路。Radhakrishnan 等[11]制備了雙相骨軟骨支架,將小鼠軟骨細胞和成骨細胞植入該支架,結果表明軟骨細胞和成骨細胞分別在對應的支架層中具有良好的分布,且在雙相支架的過渡面實現了軟骨細胞和成骨細胞共存。研究證實了該培養體系具有較好的軟骨細胞分化能力,同時能夠降低軟骨細胞的凋亡[12-13]。
相對于體內含量較少、分化成熟的軟骨細胞來說,干細胞具有多向分化和較長時間自我更新的能力,因而在骨軟骨組織工程領域應用廣泛。其中,骨髓間充質干細胞、脂肪間充質干細胞、滑膜間充質干細胞和胚胎干細胞均為重點研究的種子細胞[14-15]。Sartori 等[16]制備了 I 型膠原/鎂—羥基磷灰石/I 型膠原的雙相骨軟骨一體修復支架。結果表明,在 I 型膠原水凝膠層,人類間充質干細胞實現了向軟骨細胞分化;而在下層礦化層則向成骨細胞分化。他們進一步將此載有干細胞的復合支架植入小鼠體內,也得到了與體外實驗一致的結果,同時支架與組織能夠較好地融合,表明該復合支架具有一定的骨軟骨修復實用性。
總之,種子細胞的選取在骨軟骨修復中起著至關重要的影響。現有技術中,以骨軟骨細胞作為種子細胞具有取材不便、含量較少的缺點;而以干細胞作為種子細胞,則存在體外誘導分化、增殖價格昂貴且效率較低的缺陷;而細胞共培養技術則具有成本較低、效率較高的優勢,因此也有很多相關實驗采用多種細胞共培養的方式,包括有:成骨細胞和軟骨細胞共培養體系、成骨細胞與干細胞共培養體系以及軟骨細胞與干細胞共培養體系等[12-13, 17-18]。相關實驗證實,共培養體系能夠解決種子細胞來源單一的問題,但是由于共培養體系中細胞種植比例以及生長因子的添加均會對研究結果產生各種的影響,仍需要進一步的深入研究。
2 生長因子
生長因子在骨軟骨修復中發揮著重要的作用,如骨形態蛋白、堿性成纖維細胞生長因子、轉化生長因子、血管內皮生長因子、胰島素生長因子、血小板衍生生長因子等均對成骨細胞、軟骨細胞和干細胞的生長和增殖等相關生物學行為具有一定的調控作用[19-20]。例如:轉化生長因子能夠誘導骨髓間充質干細胞向軟骨細胞分化,但相關實驗證實,只使用轉化生長因子并不能夠誘導形成與在體相仿的軟骨組織,反而會誘導纖維化軟骨的形成[19]。骨形態蛋白能夠促進骨生成[21],但是目前尚不明確其合理使用的劑量范圍以及半衰期等。同時,相關研究也報道,骨形態蛋白可能會導致異位成骨以及相關炎癥反應等,以上因素在一定程度上限制了生長因子的使用[22-23]。
為提高生長因子的使用效率,研究者們通常會考慮將其與其它材料復合,制成載生長因子復合材料。Yao 等[24]利用電泳沉積技術制備了載有骨形態蛋白的石墨烯、聚乳酸—羥基乙酸復合支架。實驗結果表明,該載骨形態蛋白復合支架經石墨烯修飾后,復合支架的力學性能明顯改善,拉伸強度由原來的(47.2 ± 8)kPa 提升至(126.1 ± 6)kPa;體外釋放結果表明,骨形態蛋白可穩定釋放,同時釋放濃度可通過電壓調控,隨著電壓升高,復合支架釋放能力有所提升;細胞實驗表明,該復合支架能夠誘導人骨髓間充質干細胞向成骨細胞分化。
Han 等[25]制備了骨軟骨修復支架,在軟骨層中添加轉化生長因子,其濃度從上至下呈遞減趨勢,在下骨層中添加骨形態蛋白因子,其濃度從上至下呈遞增趨勢。體外細胞實驗證實,該支架成功誘導骨髓間充質干細胞在軟骨層中向軟骨細胞分化,在下骨層中向成骨細胞分化。動物實驗也證實支架能夠較好地與周圍組織融合,光鏡下可見新生軟骨和骨的生成,證實這種復合支架具有良好的骨軟骨修復能力。
上述生長因子對骨軟骨缺損修復均具有一定的影響,特定條件下能促進骨軟骨損傷修復,但生長因子作為一種外源性添加劑,其自身具有多向調控性,這種調控性與其來源、純度、劑量大小以及種子細胞的種類、分化狀態、培養條件及有無其它生長因子等多種因素有關。目前相關實驗多采用單一生長因子用于骨軟骨修復,實際生理環境是多種生長因子協同調控,此外當前對于生長因子以體外研究居多,缺少在體實驗數據等,以上問題均需通過相關實驗以確定使生長因子發揮最佳效應的各項條件。
3 細胞支架
理想的細胞支架應具有良好的細胞相容性、合適的降解速率且其降解產物無細胞毒性、適宜的孔隙率和孔徑結構、良好的力學性能和三維網絡結構以及能夠促進細胞生長等優勢,并可作為藥物和生長因子的載體[7]。
隨著生物材料的不斷發展,各種能夠更好地滿足骨軟骨修復的新型材料不斷涌現。依照來源的不同,可以分為天然材料和人工合成材料。常用天然材料有:膠原、殼聚糖、絲素蛋白、海藻酸鹽、透明質酸、硫酸軟骨素、羥基磷灰石、β—磷酸鈣等。天然材料具有良好的生物相容性、低免疫原性、較好的細胞結合能力和生物降解性等,因而受到更多關注,但是天然材料較弱的力學性能限制了其在臨床上的應用。
為了較好地模擬骨軟骨在體組成和內在結構特點,Levingstone 等[4]利用迭代分層冷凍干燥技術制備了三層一體化骨軟骨修復支架,軟骨層采用Ⅰ、Ⅱ型膠原和透明質酸;中間過渡層采用Ⅰ、Ⅱ型膠原和羥基磷灰石;軟骨下骨層采用Ⅰ型膠原和羥基磷灰石。實驗結果表明,該支架具有較好的孔隙率,且支架孔徑整體呈現上大下小,相互貫通,能夠較好地模擬在體環境。細胞實驗進一步證實,該研究中采用的細胞貫穿生長于整個支架,且實現了細胞增殖,結果證實了該支架能夠較好地滿足骨軟骨一體化修復。然而,該支架的壓縮模量遠低于正常人體實際情況,具體對比參數為:支架軟骨層為 0.3 kPa、中間層為 0.35 kPa、軟骨下骨層約為 0.95 kPa;正常人體的軟骨淺層、軟骨深層、鈣化軟骨層和軟骨下骨的壓縮模量分別約為 0.079 MPa、2.1 MPa、320 MPa 和 5.7 GPa[9],提示該支架的力學性能仍需要進一步加強。
常用于骨軟骨修復的人工合成高分子材料包括有:聚乳酸—羥基乙酸、聚乙烯醇、聚乳酸、聚醚醚酮、聚己內酯、聚乙二醇等。人工合成高分子材料能夠人為調控材料聚合度,從而控制其力學性能、內在結構等,進而可更好地滿足骨軟骨修復的實際需求。但是高分子材料大多具有細胞毒性或者其降解產物具有細胞毒性、酸堿性等,以上因素在一定程度上限制了其應用。Du 等[26]利用選擇性激光燒結技術制備了具有分層結構的聚己內酯、羥基磷灰石骨軟骨一體修復支架。該支架的整體壓縮模量為 8.7 MPa,能夠較好地滿足骨軟骨修復力學要求,細胞實驗和體內實驗證實該支架具備一定的骨軟骨修復應用價值。
作為常見的高分子修復材料之一,聚己內酯具有優異的生物相容性、降解產物不具有細胞毒性以及易加工成形等優點,但是也存在熔點較低、降解速率較慢等問題。為解決單一材料性能的相關弊端,可采用兩種或多種材料進行復合,依據其性能互補的特點進行新型復合材料的研究和相關性能探索,以研發更加理想的骨軟骨修復材料。
從支架的整體結構和性能進行分類,可以將骨軟骨修復支架大致分為三大類:單相支架、雙相支架和多相支架。其中的“相”代表其結構、成分、力學性能等,現就這三種支架分別進行相關的綜述。
3.1 單相支架
單相支架是用一種或多種材料制備而成,是具有相同結構、成分、力學屬性的支架,并最早用于骨軟骨修復。單相支架由于整體結構和成分的統一性,通常并不滿足骨軟骨一體修復的需求,僅單獨用于軟骨修復或骨修復。
羥基磷灰石作為骨中無機成分的重要組成部分,具有較好的生物活性、骨誘導性和生物相容性,是較早用于骨修復的醫用材料之一。但純羥基磷灰石支架力學性能較脆、分散性差、生物降解能力相比 β—磷酸鈣較弱,很難滿足骨修復要求。因而大量研究著重于對其晶體進行改性或者添加相關聚合物使其具有較好的分散能力,同時增強其力學穩定性。實驗研究中多用羥基磷灰石與 β—磷酸鈣復合形成雙相磷酸鈣來滿足骨修復的需求[3, 27]。
Effendi 等[28]研究了制備的純羥基磷灰石經明膠和殼聚糖修飾的羥基磷灰石骨修復單相支架的相關性能,結果表明純羥基磷灰石支架具有較高的孔隙率以及相互貫通的孔徑結構,但其力學性能較差;經殼聚糖和明膠修飾后,支架力學性能具有一定的提升。
膠原是骨、軟骨組織主要的有機組分,軟骨中Ⅱ型膠原和骨中Ⅰ型膠原含量豐富。實驗證實,軟骨細胞和成骨細胞在膠原支架上具有較好的細胞相容性以及增殖能力,膠原的存在還能夠誘導干細胞向成骨細胞或軟骨細胞分化,此外膠原在組織修復過程中也起著重要的作用[29-30]。但是,純膠原支架力學性能較差且降解速度較快,不具備支架修復的穩定性,有研究證實可通過添加羥基磷灰石在一定程度上改善膠原支架的穩定性[31]。
Lin 等[32]采用低溫三維打印技術制備了具有不同結構的膠原、羥基磷灰石復合單相骨修復支架。結果表明,相較于對照組,采用低溫三維打印技術所制備的支架能更好地促進骨髓間充質干細胞的增殖能力,同時促進其向成骨細胞分化;在體實驗也證實,實驗組能夠更好地促進新生骨的形成。
綜上表明,單相支架可為成骨、軟骨細胞的生長提供良好的條件,且能夠誘導干細胞定向分化為軟骨或成骨細胞,但是骨軟骨損傷體系中涉及到不同結構、不同組織,軟骨細胞和成骨細胞增殖所需要的生長環境不同,單相支架往往不能同時提供成骨細胞與軟骨細胞生長所需的環境,在一定程度上降低了其在治療關節骨軟骨缺損時的效果。
3.2 雙相支架
雙相支架是用一種或多種材料制備而成,具有兩相分層結構,且通常各分層在成分、內在結構以及力學屬性等方面均有差異。相較于單相支架,雙相支架能夠同時滿足軟骨和軟骨下骨的植入和修復要求。雙相支架既可以植入成骨、軟骨兩種細胞,也可以植入同種干細胞,以構建骨軟骨修復共同體。
Seong 等[33]利用定向冷凍干燥法,制備了具有定向對齊孔徑結構的膠原和雙相磷酸鈣復合支架。實驗結果表明,具有定向對齊結構的雙相支架其壓縮強度和拉伸強度均優于隨機結構對照組,同時定向對齊支架的力學性能隨著孔徑的縮小而提升。值得注意的是,雙相磷酸鈣的加入提升了復合支架的壓縮力學性能,但是其拉伸性能卻小于純膠原對照組。細胞實驗證實,定向對齊結構的雙向支架中細胞增殖較快、遷移能力較強且細胞鋪展較好;在體動物實驗證實,與隨機結構對照組比較,實驗組具有較好的骨軟骨修復能力,其中孔徑在 270 μm 時修復效果最好。以上實驗證實,骨軟骨修復支架的孔徑大小以及結構分布均會對其修復效果產生影響。
Yao 等[15]通過在聚乙烯醇中加入改性 β—磷酸鈣制備骨軟骨修復雙相支架。力學性能測試結果表明,隨著 β—磷酸鈣濃度的增加,支架整體力學性能得到了改善;支架的內部結構也能夠較好地模擬在體骨軟骨結構特點。細胞實驗證實,上層支架能夠較好地促進軟骨細胞的黏附、增殖,下層支架能夠較好地誘導滑膜間充質干細胞向成骨細胞的分化。整體實驗證實該種雙相支架具有一定的骨軟骨修復潛在可能性。
Ruan 等[34]制備了殼聚糖、絲素蛋白、羥基磷灰石雙相復合支架,支架相關性能分析表明,支架的孔隙率達到 90%、吸水性高達 822%,能夠較好地滿足骨軟骨支架結構特點,將骨髓間充質干細胞植入支架,相關結果表明干細胞能夠定向分化為軟骨和成骨細胞,在體動物實驗也證實該種支架具有良好的骨軟骨修復效果。
綜上所述,雙相支架能夠較好地滿足骨軟骨修復需求,但一些弊端也不容忽視,如骨軟骨界面結合力較差、力學穩定性較弱、骨軟骨界面缺失等。大量研究對于潮線以及鈣化軟骨層的生理作用進行了闡述[9, 35]。雙相支架中往往忽視了潮線以及鈣化軟骨層制備,而鈣化軟骨層以及潮線是連接軟骨和軟骨下骨的重要界面結構。潮線以及鈣化軟骨層的缺失可能會引起支架生物力學分布不均衡以及組織液循環障礙,不利于骨軟骨缺損的修復,因此如果采用三相或者多相支架作為骨軟骨修復支架,或許可以更好地模擬在體骨軟骨界面。
3.3 多相支架
為了更好地模擬在體環境的結構特點,骨軟骨一體化修復支架更加傾向于三相以及多相支架的設計。三相以及多相支架通常采用多種材料制備而成,具有三相及以上分層結構,或者支架結構呈整體連續變化,且通常各分層在成分、內在結構以及力學屬性等方面均有差異。
為了解決支架界面黏合問題,Su 等[36]通過定向電泳的方式制備了一體化聚乙烯醇、羥基磷灰石支架。實驗表明,羥基磷灰石分散良好,支架的力學性能隨著羥基磷灰石的濃度增加有所提升,支架結構呈連續變化,具有整體性,并不存在明顯的分層結構。
多相支架的制備和復合方式包括有:迭代冷凍法[3, 37]、力學擠壓法[8]、三維打印[32, 38-39]以及上述的電泳法等。骨軟骨修復過程不僅僅與支架的相關結構性能相關,同時也與支架的化學成分以及藥物釋放相關。Algul 等[7]利用海藻酸鹽、殼聚糖、β—磷酸鈣制備了三層結構的骨軟骨修復支架,利用溶劑吸附方式將地塞米松鈉磷酸吸附于支架表面,動物實驗結果表明,該種支架能夠有效地控制藥物的釋放速率,同時有效地促進骨軟骨再生。
現階段大量骨軟骨修復實驗均處于體外細胞實驗以及動物體內實驗階段,臨床實驗樣本量較少。Perdisa 等[40-41]利用Ⅰ型膠原和羥基磷灰石制備了三相復合支架,上層支架為 100% 的Ⅰ型膠原;中間支架為 40% 的羥基磷灰石和 60% 的Ⅰ型膠原;下層支架為 70% 的羥基磷灰石和 30% 的Ⅰ型膠原。其臨床實驗證實,該支架具有良好的骨軟骨修復能力。該實驗或可為人在體骨軟骨修復做出一定的參考。
三相或多相骨軟骨修復支架能夠較好地模擬正常組織結構分布,更符合組織工程骨軟骨復合支架的要求。需要值得關注的是,支架相鄰界面的結合強度有待加強,同時對于潮線以及鈣化軟骨層的設計模擬尚不成熟。
4 總結和展望
近年來,針對骨軟骨受損作為臨床廣泛可見且較為嚴重的關節疾病這一事實,骨軟骨的有效修復和再生一直受到組織工程領域的密切關注。本文系統地闡述了當前骨軟骨缺損的治療方式以及面臨的問題,同時著重從組織工程的角度來敘述了骨軟骨修復的研究進展以及存在的問題。隨著對于骨軟骨結構認識的不斷深入,組織工程領域已經能夠較好地從種子細胞、生長因子以及支架三個方面模擬體內的生理狀態以制備骨軟骨支架。但是,由于正常人體骨軟骨解剖界面、組分含量的復雜性,目前組織工程尚不能做到成分以及結構的雙重仿生。
隨著材料與技術的不斷發展,新的制備技術如:三維打印技術、靜電紡絲技術等,可結合新的支架材料,多學科、多領域合作,綜合利用材料學、生物力學、生理學等相關專業知識跨專業相結合,未來終將解決骨軟骨缺損這一臨床科學難題。