為了驗證采用超聲 Nakagami 統計參量成像對微波熱消融治療過程進行監控成像的可行性,本文提出并研究了采用超聲 Nakagami 統計參量成像對活體豬肝臟和腎臟的微波熱消融過程進行監控成像的方法。本文對 5 頭實驗豬進行微波熱消融治療,治療中同步采集超聲射頻(RF)數據,實驗后計算了熱凝固區域超聲 Nakagami 統計參量的動態變化,同步構建超聲 B 模式圖像和 Nakagami 統計參量圖像,并計算熱凝固區域和周邊正常組織之間的對比噪聲比值(CNR)。微波熱消融后,超聲 Nakagami 統計參量圖像中出現高亮強回聲區域,并隨著治療時間的增加而逐步增大。經計算,肝、腎的超聲 Nakagami 統計參量平均值分別從治療前的 0.78、0.79 增大到 0.91、0.92;肝、腎的超聲 Nakagami 統計參量圖像的 CNR 平均值從 0.49、0.51 增加到 1.13、0.85,均高于相應超聲 B 模式圖像的 CNR 值。本研究表明,使用超聲 Nakagami 統計參量成像在微波熱消融治療中進行監控具有一定的可行性。
引用本文: 吳珊, 尚少強, 王雪維, 萬明習, 張思遠. 基于 Nakagami 統計參量的活體微波熱消融超聲監控成像研究. 生物醫學工程學雜志, 2019, 36(3): 371-378. doi: 10.7507/1001-5515.201810031 復制
版權信息: ?四川大學華西醫院華西期刊社《生物醫學工程學雜志》版權所有,未經授權不得轉載、改編
引言
微波熱消融(microwave ablation,MWA)是一種微創的局部腫瘤熱消融技術,其采用高頻電磁波作為熱源,電磁波輻射作用于腫瘤組織,引起水分子振動和旋轉導致組織加熱升溫,致使熱致蛋白變性引起細胞死亡[1]。微波熱消融治療具有治療時間短、受組織碳化影響小、治療效率高、凝固壞死體積大、瘤內溫度高等優點,目前已廣泛用于肝、腎、肺、乳腺、腎上腺、骨、子宮腺肌癥、子宮肌瘤等的治療[2]。現代醫學影像技術已在微波熱消融治療的術前科學規劃、治療過程中的實時監控及治療后的療效評估中發揮了至關重要的作用。
近年來,隨著超聲成像以及磁共振成像等現代成像技術的發展,臨床微波熱消融技術在腫瘤治療方面的應用范圍變得更加廣闊[1, 3]。其中,磁共振成像技術可利用質子共振頻率或弛豫時間 T1 的溫度靈敏度來監測微波熱消融治療期間的溫度分布,同時由于磁共振成像技術具有定量的溫度信息、較好的時間和空間準確度和分辨率,在微波熱消融的術前評估方面有較為廣泛的應用[3-4]。而超聲成像具有較好的實時性、兼容性,且兼具設備便攜和成本低廉等優勢,近年來在醫學影像引導監控熱消融治療領域受到廣泛青睞。由于微波熱消融會引起組織力學特性發生改變,因此可以使用超聲彈性成像和應變成像對微波熱消融區域進行識別與監控成像[5]。在微波熱消融中,組織熱凝固區域的聲速改變和熱膨脹會導致超聲回波改變,則可利用超聲回波信號時域或頻域特征改變來進行溫度估計[6]。此外,還有學者研究利用微波熱消融過程中超聲參量的變化,如衰減、背向散射、散射子平均間距以及散射回波解相關等特性,對微波熱消融過程進行監控成像[6-9]。目前臨床微波熱消融治療中通常采用超聲 B 模式圖像中出現的高回聲區域對治療過程進行識別監控[10]。通常認為該高回聲區域與熱消融治療中的空化或汽化微泡活動有關,而這些微泡和實際熱消融區域有時并不完全對應,且在熱消融治療結束后微泡會逐漸消散,因此超聲 B 模式圖像不能準確檢測到熱凝固區域[10]。
醫學影像的引導監控是高效、安全的微波熱消融治療的基礎與保障。本課題組之前的研究工作已證實,超聲 Nakagami 統計參量成像可對高強度聚焦超聲熱消融進行監控成像,并能有效提高監控圖像中熱消融區域的對比度[11];后續工作進一步表明,超聲 Nakagami 統計參量成像有望評估離體豬肝微波熱消融中的組織熱凝固區域[12]。由于超聲 Nakagami 統計參量可以區分生物組織中不同散射子濃度,可在生物組織測量中用來對散射子進行分類[13],因此本文提出并研究采用超聲 Nakagami 統計參量成像對活體豬肝和腎的微波熱消融過程進行監控成像的可行性。本文使用臨床微波腫瘤熱消融系統在活體豬肝臟和腎臟中產生熱凝固,并利用超聲成像線陣探頭獲取熱凝固區域超聲背向散射回波射頻數據,估計組織熱消融區域的超聲 Nakagami 統計參量,并同步構建超聲 B 模式圖像和 Nakagami 統計參量圖像。然后計算熱凝固區域和周邊正常組織區域之間的對比噪聲比值(contrast-to-noise ratio,CNR),用來量化分析超聲 Nakagami 統計參量圖像和超聲 B 模式圖像在微波熱消融監控中的對比度。
本文提出了一種新的超聲監控成像方式,與傳統超聲 B 模式成像監控相比,這種新方式可能在微波熱消融過程中對圖像中損傷部分的突顯能力更為優異,同時通過在活體實驗中進行驗證,期許該方法或可對現有的微波熱消融等熱消融治療提供一種新的監控思路。
1 方法
1.1 活體豬微波熱消融
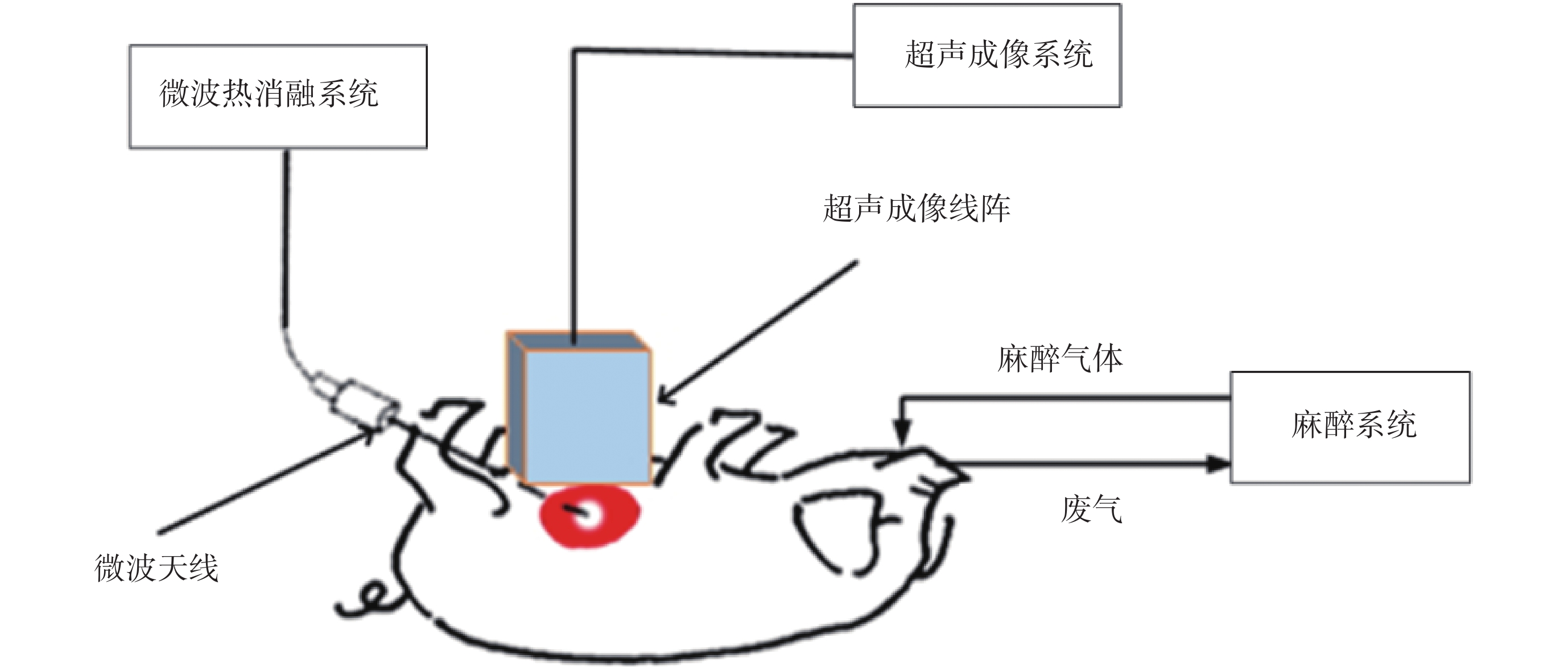
使用臨床腫瘤微波熱消融系統(MH-1Y,中國北京 M & Y 電子有限公司,中國)對 5 頭活體豬(20~25 kg)分別進行肝臟和腎臟的微波熱消融實驗,設置微波系統電功率為 30~70 W,消融時間 5 min,實驗系統如圖 1 所示。微波熱消融實驗在 5 頭實驗豬的肝臟和腎臟上均各進行了 10 組實驗。實驗前,用超聲 B 模式圖像檢查目標組織,以避免在微波熱消融區存在較大血管,防止影響微波能量傳遞和隨后的超聲成像。治療完成后,開大麻醉氣體流量處死動物并分離肝臟和腎臟,依照超聲數據采集平面切片,拍攝熱損傷中心的照片。本研究得到西安交通大學生命科學與技術學院生物醫學科研倫理委員會批準。
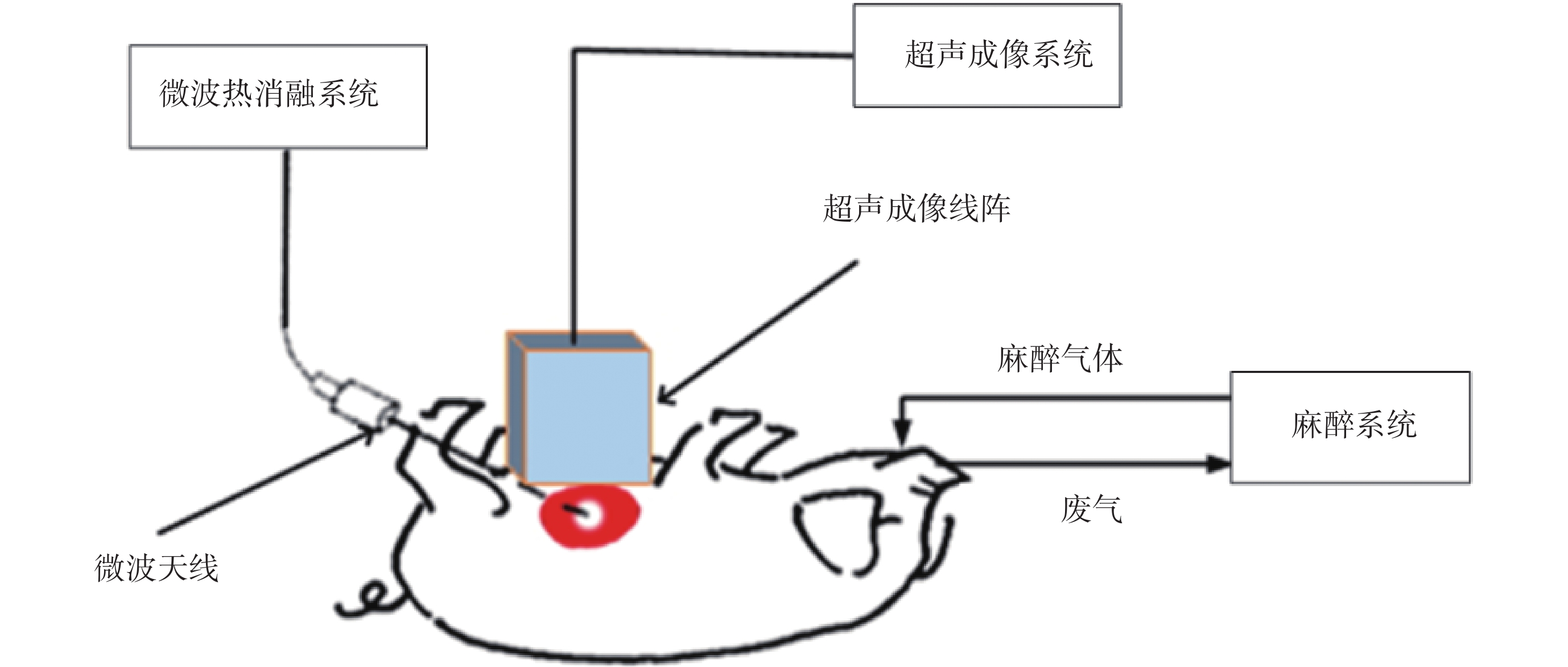 圖1
實驗系統示意圖
Figure1.
Schematic of the experimental apparatus.
圖1
實驗系統示意圖
Figure1.
Schematic of the experimental apparatus.
1.2 超聲散射回波射頻數據采集
在對活體豬進行微波熱消融的治療過程中,使用超聲成像系統(DP9900,邁瑞生物醫療電子股份有限公司,中國)線陣探頭,工作頻率 5 MHz,帶寬 60%,采集熱凝固區域和周邊正常組織的二維射頻(radiofrequency,RF)數據,通過小型計算機接口(small computer system interface,SCSI)將超聲成像系統與計算機的外圍組件(7300A,中國臺灣凌華科技公司,中國臺灣)連接,將 RF 數據以 14 位分辨率、25 MS/s 的速度數字化并保存。治療過程中,超聲成像系統設置為每 20 s 采集一次 RF 數據。
1.3 超聲 Nakagami 統計參量成像
Nakagami 分布模型與超聲背向散射回波信號的概率密度分布有高度的一致性,并且 Nakagami 模型的參數會隨著背向散射回波信號統計特性的變化而改變,因此 Nakagami 模型在超聲信號組織定征中得到了越來越多的應用。
Nakagami 統計參量決定了超聲回波包絡統計分布的形狀參數[13],在 Nakagami 分布模型中,超聲背向散射回波包絡 R 的概率密度函數 f(r)如式(1)和式(2)所示:
 |
 |
其中,Γ(·)表示伽馬函數,U(·)表示單位階躍函數,Ω 表示尺度參數。R 表示背向散射包絡,m 即表示 Nakagami 統計參量。
Nakagami 統計參量(用符號 m 表示),可由如式(3)、(4)所示方程組計算得到。
 |
 |
其中, 表示雙伽馬函數,其中通過商用數學軟件 MATLAB(MathWorks Inc.,美國)的函數 psi(k,x)較易得到函數
表示雙伽馬函數,其中通過商用數學軟件 MATLAB(MathWorks Inc.,美國)的函數 psi(k,x)較易得到函數 ,此函數中的 k 為導數階數。Γ(·)表示伽馬函數,R 表示背向散射包絡,x 表示回波信號。
,此函數中的 k 為導數階數。Γ(·)表示伽馬函數,R 表示背向散射包絡,x 表示回波信號。
Greenwood 等[14]通過最大似然法估算出了最恰當的基于 Nakagami 分布的 Nakagami 統計參量(用 m 表示),如式(5)所示:
 |
其中,y 表示回波信號。
超聲背向散射包絡的統計分布與散射子濃度有關,因此可用超聲 Nakagami 統計參量確定組織中散射子濃度[13]。通過計算 Nakagami 統計參量可以得到超聲 Nakagami 統計參量圖像[15],而為了計算 Nakagami 統計參量,可使用 Nakagami 統計參量估計的最佳尺寸滑動窗(即,窗寬約為 3 倍入射超聲波脈沖長度的滑動窗口)遍歷采集到的 RF 數據,并產生背向散射回波包絡[16]。成像圖像的縱坐標表示深度,橫坐標表示橫向位置。盡管使用了帶通濾波器和希爾伯特變換來處理射頻數據,超聲 Nakagami 統計參量圖像仍然有很多可能影響圖像質量的系統噪聲,因此本文采用了近鄰成分分析算法(neighborhood components analysis,NCA)作為去噪算法來減少系統噪聲[15, 17]。本文使用的 NCA 算法中,選用相關性低于 80% 的原始射頻數據掃描線幅度作為圖像數據最小值,代替理想直流噪聲信號以達到去噪的目的[17]。最后對超聲 Nakagami 統計參量進行彩色編碼并疊加到對應的超聲 B 模式圖像上,得到超聲 Nakagami 統計參量圖像[9]。
1.4 CNR 的計算
本文使用微波熱消融區域和周邊正常組織之間的 CNR 來量化分析超聲 Nakagami 統計參量圖像和超聲 B 模式圖像在微波熱消融監控中的對比度。該方法已在射頻熱消融超聲監控成像評價中被研究并采用[18]。CNR(以符號 CNR 表示)的計算公式如式(6)所示:
 |
其中,M 和 S 分別表示均值和標準差,是微波熱消融后,在同一深度的熱消融區域(T)和周邊正常組織區域(N)分別選取一個相應目標感興趣區域(region of interest,ROI)的像素值的均值和標準差。
2 結果
2.1 微波熱消融治療后的超聲 B 模式和 Nakagami 統計參量成像
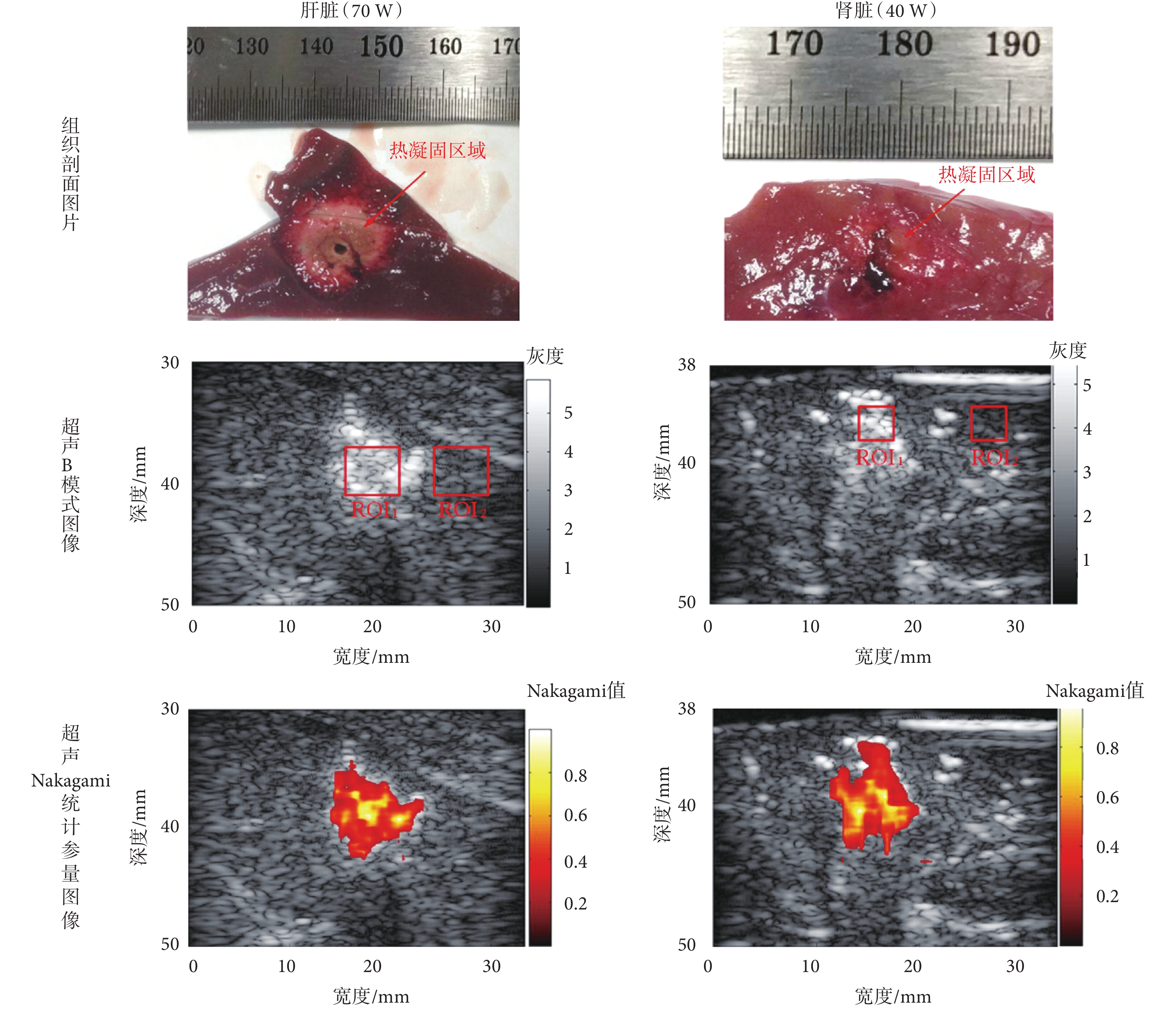
在對實驗豬執行微波熱消融操作結束后,使用 RF 數據同步構建熱凝固區域的超聲 B 模式圖像和 Nakagami 統計參量圖像。每次實驗結束后,沿超聲檢測與成像換能器采集切面剖開樣品,并對切面拍照以獲取光學圖像。微波熱消融實驗后活體豬的肝臟和腎臟的超聲 B 模式圖像和 Nakagami 統計參量圖像及對應的組織剖面照片如圖 2 所示。
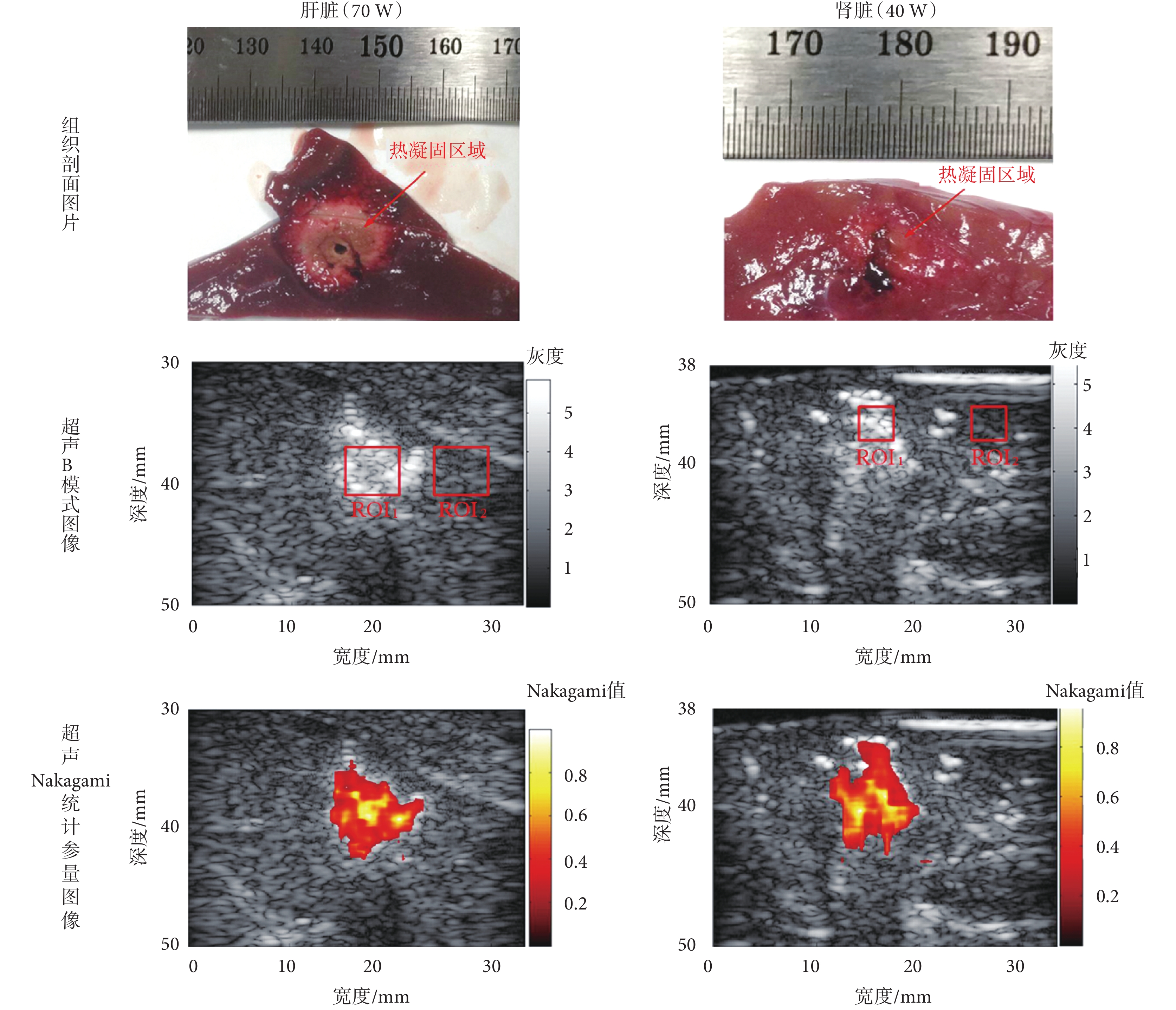 圖2
微波熱消融后的熱凝固區域
Figure2.
Thermal lesions after microwave ablation
圖2
微波熱消融后的熱凝固區域
Figure2.
Thermal lesions after microwave ablation
如圖 2 所示為本文一組活體豬的肝臟、腎臟微波熱消融實驗的結果,從上至下依次為組織剖面圖片、超聲 B 模式圖像和超聲 Nakagami 統計參量圖像。本組肝臟微波熱消融實驗的消融功率為 70 W,腎臟微波熱消融實驗的消融功率為 40 W,這是由于活體豬實驗中腎臟位置不易暴露且腎臟較小,故而本文所述活體豬實驗的腎臟微波熱消融功率均選擇為較小功率。圖 2 中的 ROI 用于提取數據計算 Nakagami 統計參量的值并進行后續的統計學分析,ROI 在肝臟微波熱消融實驗中尺寸設置為 5 × 5 mm,而在腎臟微波熱消融實驗中設置為 3 × 3 mm,且 ROI1 表示在熱凝固區域內選取的 ROI,ROI2 表示在周圍正常組織選取的 ROI。
從圖 2 中的組織剖面圖片可以看到,不論是肝臟還是腎臟,在微波熱消融治療后,由于蛋白質受熱變性等緣故,均以微波針為中心形成了一個變色區域,此變色區域即為熱凝固區域。且消融功率設置為 70 W 時,隨著熱能量的沉積增大,消融區域中心顏色較暗,肝臟組織有出現碳化的趨勢;而消融功率設置為 40 W 時,組織剖面圖片中卻沒有顯示碳化趨勢。在臨床微波熱消融治療中,超聲 B 模式圖像中可觀察到的隨著功率增加而變大的高亮區域即為熱凝固區域,此高亮區域主要是由于微波熱消融中產生的熱凝固和汽化微泡所引起的[10]。圖 2 中的超聲 Nakagami 統計參量圖像是由超聲 B 模式圖像疊加彩色編碼后的 Nakagami 值得到的,基于超聲 Nakagami 統計參量圖像可以看出,微波消融后損傷處以彩色的形式顯示出來,背景組織則為灰度圖像。與傳統的超聲 B 模式圖像相比,基于 Nakagami 統計參量的彩色編碼疊加圖像不僅對損傷邊界信息的判定更加明顯、清晰,并且在使圖像中損傷部分突顯出來的同時可以確定損傷區域的位置信息。觀察圖像可知,超聲 Nakagami 統計參量圖像可以有效地抑制超聲 B 模式圖像上由于上部強回聲區域引起的聲遮擋效應,更好地顯示熱凝固區域。
2.2 微波熱消融過程中的動態監控
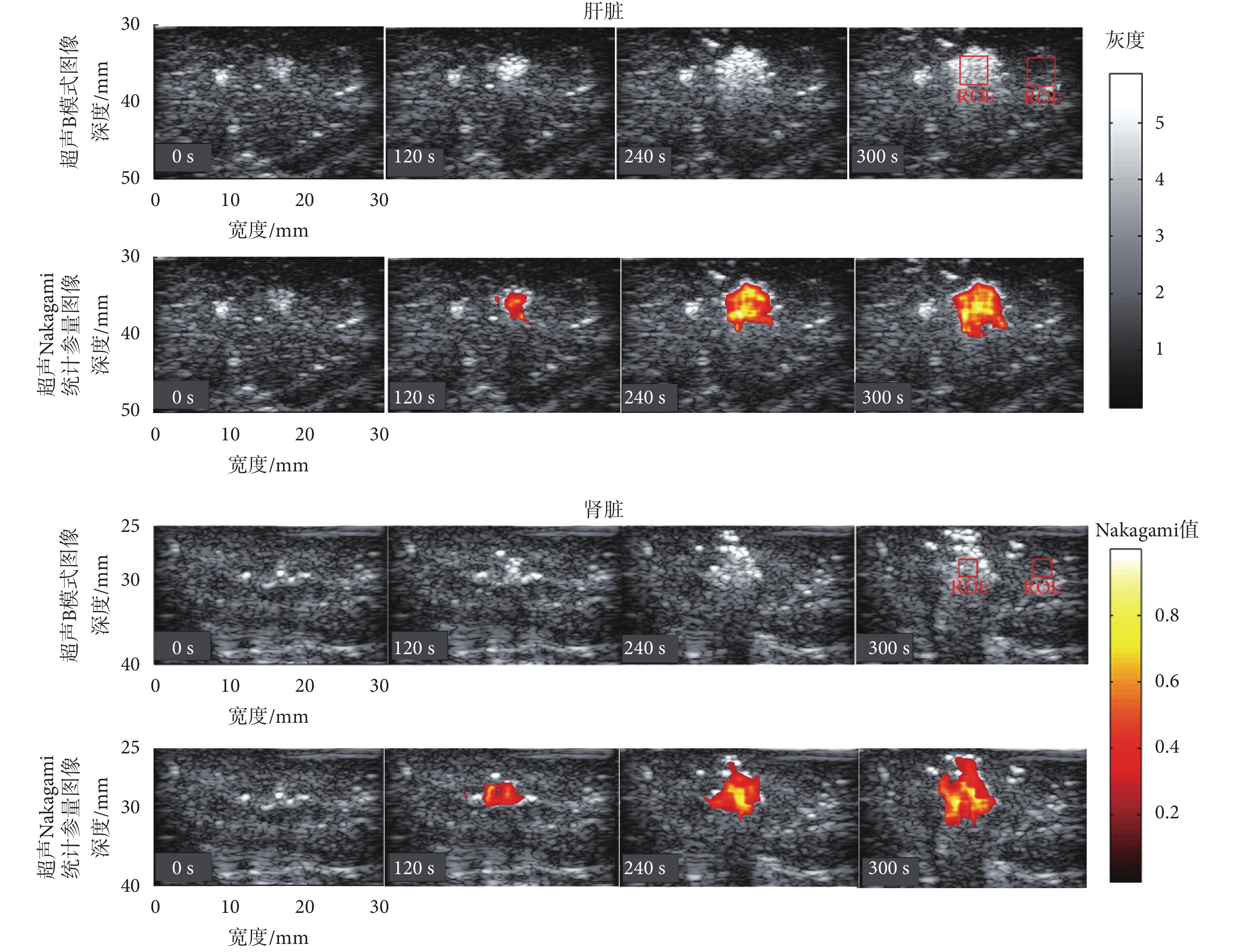
為了反映微波熱消融實驗時活體豬肝、腎的動態變化,在實驗過程中活體豬肝臟和腎臟的超聲 B 模式圖像和 Nakagami 統計參量圖像動態監控如圖 3 所示。其中,肝臟和腎臟的微波熱消融功率均為 40 W。圖中所示 ROI 與之前相同,在肝臟微波熱消融實驗中設置為 5 × 5 mm 的尺寸,而在腎臟微波熱消融實驗中設置為 3 × 3 mm,且 ROI1 和 ROI2 分別表示在熱凝固區域內以及周圍正常組織選取的 ROI。在圖 3 中,觀察微波熱消融過程中超聲 B 模式圖像的動態變化可知,未消融前(0 s),可以看到組織中心處有較亮區域,是由于輻射器尖端產生的強反射。當消融持續一定時間之后(120 s),超聲 B 模式圖像的高回聲區域增大,但是高亮區域與周圍正常組織的邊界模糊,不易判斷損傷的邊界,這主要是由于強散射信號的汽化微泡所導致的。因此,使用常規超聲 B 模式圖像監控微波熱消融過程具有一定的困難。而超聲 Nakagmai 統計參量圖像反映的是回波包絡的統計分布特性,與背向散射統計特性的形狀有關,受散射子系數影響較小[15, 19]。因此超聲 Nakagmai 統計參量圖像受強散射信號的汽化微泡的影響較小,可以較好地描述熱凝固的形成過程。與超聲 B 模式圖像不同,在微波熱消融過程中,超聲 Nakagami 統計參量圖像中的明亮高回聲區域隨著熱消融時間的增加而逐步增大,且邊界、位置均較為清晰。
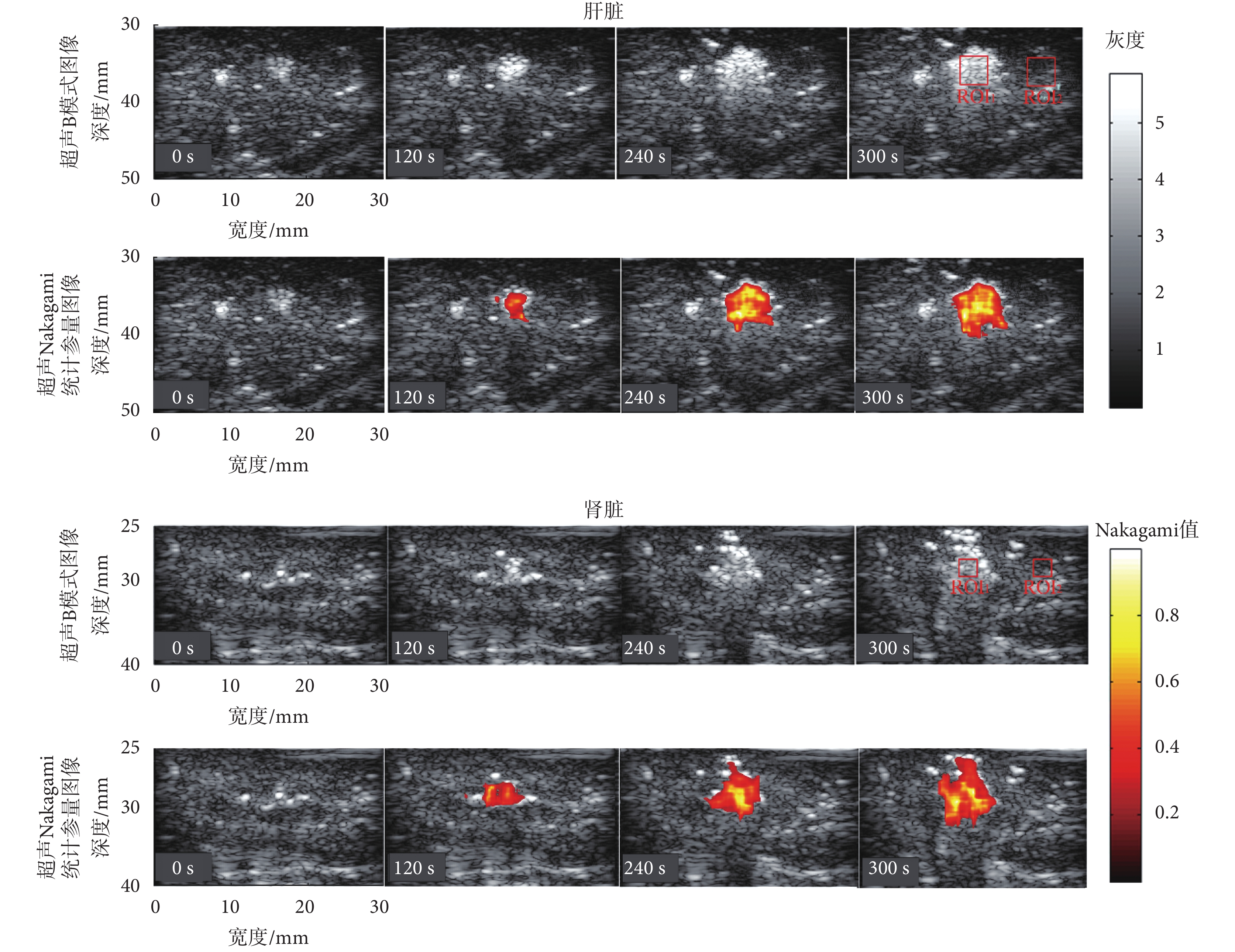 圖3
微波熱消融過程中的動態監控圖像
Figure3.
Temporal evolution of thermal lesion before and during microwave ablation treatment
圖3
微波熱消融過程中的動態監控圖像
Figure3.
Temporal evolution of thermal lesion before and during microwave ablation treatment
2.3 Nakagami 統計參量及 CNR 動態變化
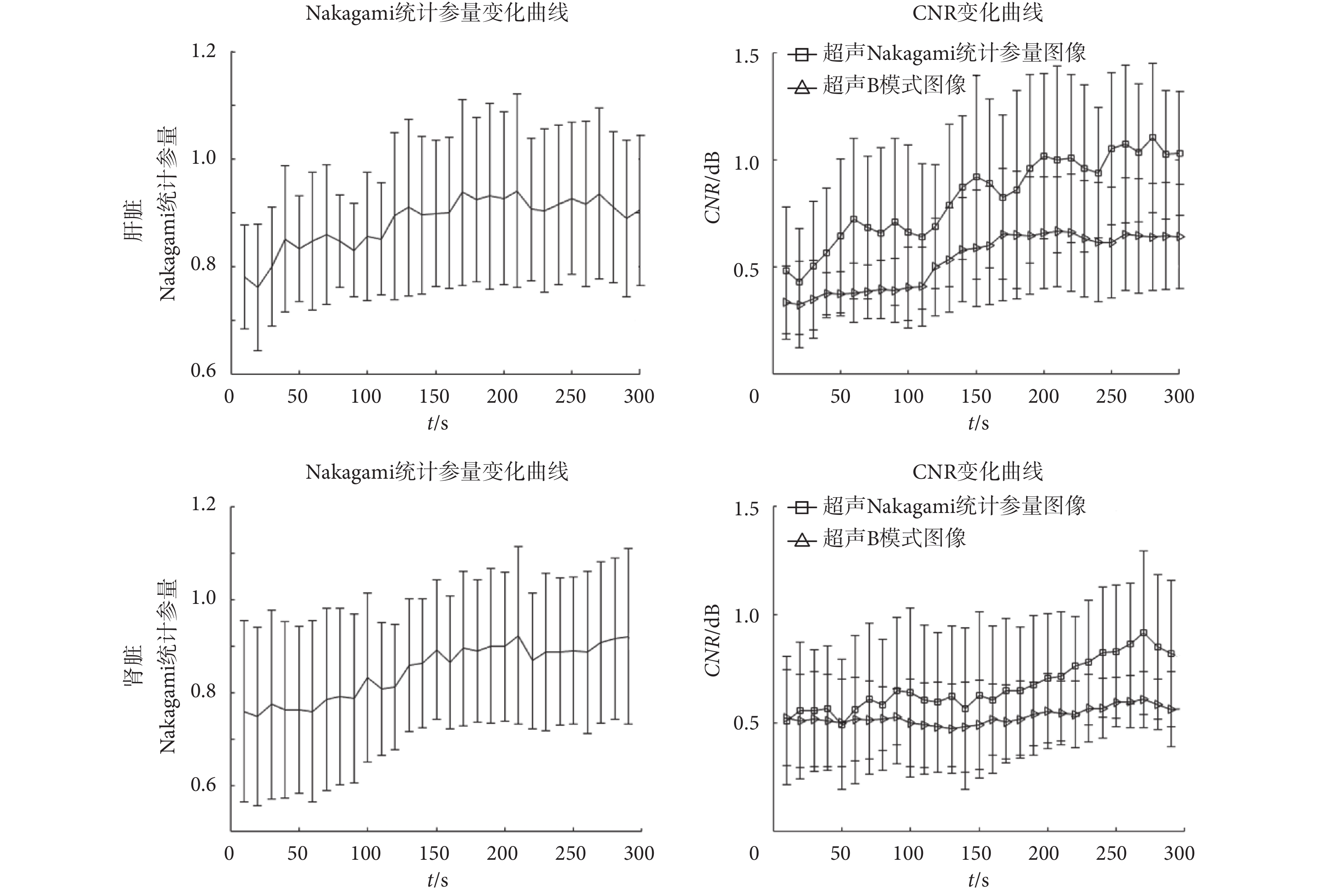
為了分析微波熱消融過程中熱凝固區域和周圍正常組織的 Nakagami 統計參量幅值以及 CNR 的動態變化,特在熱凝固區域和周圍正常組織分別選取了 ROI1 和 ROI2,提取 ROI 區域的 Nakagami 統計參量(以 m 表示)幅值并使用前述公式計算 CNR,得到的結果如圖 4 所示。圖 4 中所示值均為每組 10 個測量值的平均值和標準差。從圖 4 中可看到,豬肝、腎正常組織中的 Nakagami 統計參量的平均值分別約為 0.78 和 0.79,而經過微波熱消融形成熱凝固后,其值分別增加到了 0.91 和 0.92。從圖 4 中 Nakagami 統計參量隨著時間的動態變化可以看到,隨著治療時間的增加,Nakagami 統計參量逐漸增大,很好地表現了熱凝固區域散射子的變化。且統計學結果表明,微波熱消融后的超聲 Nakagami 統計參量圖像能明顯分辨出熱凝固區域。微波熱消融治療前常規超聲 B 模式圖像和超聲 Nakagami 統計參量圖像的 CNR 值差異沒有統計學意義,治療后,常規超聲 B 模式圖像和超聲 Nakagami 統計參量圖像的 CNR 值的差異具有統計學意義(P < 0.05)。
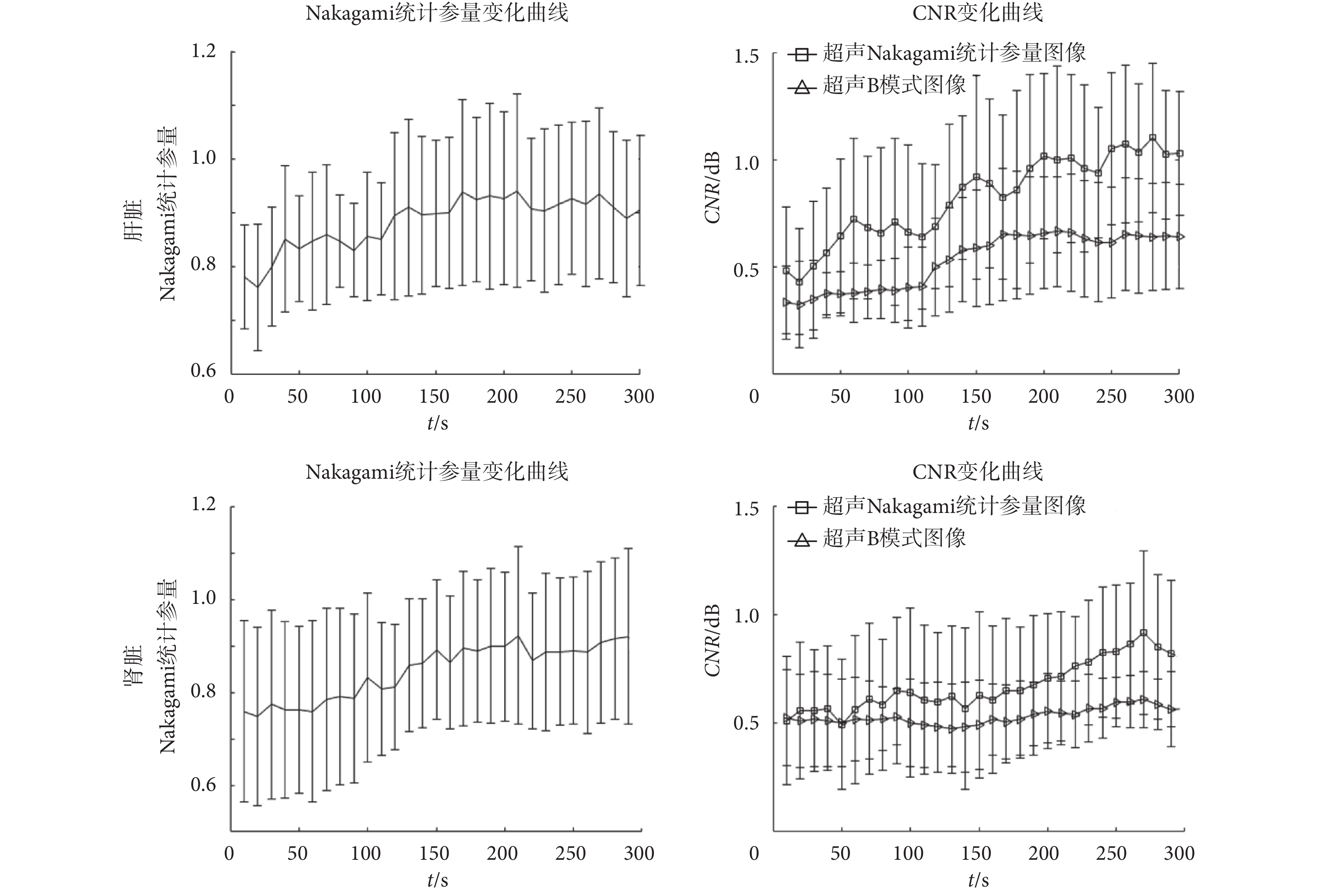 圖4
微波熱消融治療中 Nakagami 統計參量及 CNR 的動態變化
Figure4.
Statistical results of the dynamic changes of Nakagami parameter and CNR during microwave ablation exposure
圖4
微波熱消融治療中 Nakagami 統計參量及 CNR 的動態變化
Figure4.
Statistical results of the dynamic changes of Nakagami parameter and CNR during microwave ablation exposure
從圖 4 中 CNR 值隨著時間的動態變化可以看到,隨著治療時間的增加,不論是超聲 Nakagami 統計參量圖像還是超聲 B 模式圖像的 CNR 值均逐漸增大,但超聲 Nakagami 統計參量圖像的 CNR 值增加十分明顯,超聲 B 模式圖像的 CNR 值的變化卻沒有那么明顯。在微波熱消融過程中,由活體豬肝臟超聲 Nakagami 統計參量圖像中計算得的 CNR 平均值從 0.49 增加到 1.13,而腎臟對應的 CNR 平均值則從 0.51 增加到 0.85,均高于對應的超聲 B 模式圖像計算得到的 CNR 值。一般而言,CNR 值表示信號有用功率與噪聲之比,在本文中表現為 ROI 區域信號平均值與方差之比。CNR 可以表現對有用信號的突顯程度,即在本文中表現為對熱凝固區域的突顯能力。從圖 4 中可以看到,超聲 Nakagami 統計參量圖像的 CNR 值高于超聲 B 模式圖像的 CNR 值,說明超聲 Nakagami 統計參量圖像較常規超聲 B 模式圖像更能突顯出熱凝固區域。
圖 4 中可以看到 Nakagami 統計參量和 CNR 均有一定的方差,此方差可能來源于熱凝固區域內的組織異質性和微泡活動。即使實驗前通過超聲 B 模式圖像檢查組織以避免在存在大血管等組織的區域進行熱消融,但一些小血管和筋膜仍舊無法避免;而且在微波熱消融過程中也會產生汽化微泡。組織的非均勻性和微泡活動可能是引起超聲回波信號在熱凝固區域存在方差的主要原因,進而又影響了后續超聲 Nakagami 統計參量和 CNR 值的估計。
3 討論
本文通過對活體豬進行實驗驗證的方式,探討了采用超聲 Nakagami 統計參量成像對微波熱消融治療過程進行監控成像的可行性。
通常,超聲 B 模式圖像中的高亮區域的亮度會隨著回波振幅幅度的增加而增加,而這種增加與散射子濃度和散射系數相關。所以,當進行微波熱消融治療時,由于高溫會產生氣泡,將極大地影響超聲散射系數,導致超聲 B 模式圖像不能清晰地看到損傷的邊界。而根據 Tsui 等[15]和 Zhang 等[19]的研究可知,超聲 Nakagami 統計參量圖像的亮度僅取決于散射子濃度,散射子濃度卻基本不受氣泡等因素的影響。Nakagami 統計參量是 Nakagami 分布的形狀參數,它決定了超聲背向散射包絡的統計分布。超聲背向散射包絡統計分布的形狀僅隨散射子濃度的變化而變化,與回波幅值無關。因此,在散射系數變化的情況下,Nakagami 統計參量的這種特性能夠提供相對穩定的參量值,能夠較為清晰地表現出實際的熱凝固區域。
本文研究中還發現,超聲 Nakagami 統計參量圖像在熱凝固區域邊界處存在亞溶解效應。目前已有學者研究發現,采用高頻超聲成像可以有效改善超聲 Nakagami 統計參量圖像的亞溶解效應[19],由于此部分內容不是本文重點,故而在此不再贅述。
已有研究通過組織病理學檢查以及光鏡和電鏡觀察表明,組織熱損傷的特點是結構破壞、熱凝固[20]。由于熱凝固,細胞膜和細胞核膜被破壞,細胞質和細胞核流出成為超聲散射子,從而損傷區超聲散射子濃度增加。根據本文結果,微波熱消融后組織熱凝固區域的 Nakagami 統計參量明顯增大,因此今后有望使用超聲 Nakagami 統計參量評估微波熱消融形成的熱凝固區域。
經過本文的研究可以看到,微波熱消融治療后,組織熱凝固區域的 Nakagami 統計參量明顯增大,且其 CNR 平均值遠高于從超聲 B 模式圖像中計算得到的 CNR 值,這表明超聲 Nakagami 統計參量成像在微波熱消融治療中進行監控得到的圖像的對比度更高。本文通過活體豬微波熱消融研究證實,超聲 Nakagami 統計參量評估微波熱凝固區域是切實可行的,超聲 Nakagami 統計參量成像有望成為微波熱消融治療中可供選擇的新的監控成像方式。
引言
微波熱消融(microwave ablation,MWA)是一種微創的局部腫瘤熱消融技術,其采用高頻電磁波作為熱源,電磁波輻射作用于腫瘤組織,引起水分子振動和旋轉導致組織加熱升溫,致使熱致蛋白變性引起細胞死亡[1]。微波熱消融治療具有治療時間短、受組織碳化影響小、治療效率高、凝固壞死體積大、瘤內溫度高等優點,目前已廣泛用于肝、腎、肺、乳腺、腎上腺、骨、子宮腺肌癥、子宮肌瘤等的治療[2]。現代醫學影像技術已在微波熱消融治療的術前科學規劃、治療過程中的實時監控及治療后的療效評估中發揮了至關重要的作用。
近年來,隨著超聲成像以及磁共振成像等現代成像技術的發展,臨床微波熱消融技術在腫瘤治療方面的應用范圍變得更加廣闊[1, 3]。其中,磁共振成像技術可利用質子共振頻率或弛豫時間 T1 的溫度靈敏度來監測微波熱消融治療期間的溫度分布,同時由于磁共振成像技術具有定量的溫度信息、較好的時間和空間準確度和分辨率,在微波熱消融的術前評估方面有較為廣泛的應用[3-4]。而超聲成像具有較好的實時性、兼容性,且兼具設備便攜和成本低廉等優勢,近年來在醫學影像引導監控熱消融治療領域受到廣泛青睞。由于微波熱消融會引起組織力學特性發生改變,因此可以使用超聲彈性成像和應變成像對微波熱消融區域進行識別與監控成像[5]。在微波熱消融中,組織熱凝固區域的聲速改變和熱膨脹會導致超聲回波改變,則可利用超聲回波信號時域或頻域特征改變來進行溫度估計[6]。此外,還有學者研究利用微波熱消融過程中超聲參量的變化,如衰減、背向散射、散射子平均間距以及散射回波解相關等特性,對微波熱消融過程進行監控成像[6-9]。目前臨床微波熱消融治療中通常采用超聲 B 模式圖像中出現的高回聲區域對治療過程進行識別監控[10]。通常認為該高回聲區域與熱消融治療中的空化或汽化微泡活動有關,而這些微泡和實際熱消融區域有時并不完全對應,且在熱消融治療結束后微泡會逐漸消散,因此超聲 B 模式圖像不能準確檢測到熱凝固區域[10]。
醫學影像的引導監控是高效、安全的微波熱消融治療的基礎與保障。本課題組之前的研究工作已證實,超聲 Nakagami 統計參量成像可對高強度聚焦超聲熱消融進行監控成像,并能有效提高監控圖像中熱消融區域的對比度[11];后續工作進一步表明,超聲 Nakagami 統計參量成像有望評估離體豬肝微波熱消融中的組織熱凝固區域[12]。由于超聲 Nakagami 統計參量可以區分生物組織中不同散射子濃度,可在生物組織測量中用來對散射子進行分類[13],因此本文提出并研究采用超聲 Nakagami 統計參量成像對活體豬肝和腎的微波熱消融過程進行監控成像的可行性。本文使用臨床微波腫瘤熱消融系統在活體豬肝臟和腎臟中產生熱凝固,并利用超聲成像線陣探頭獲取熱凝固區域超聲背向散射回波射頻數據,估計組織熱消融區域的超聲 Nakagami 統計參量,并同步構建超聲 B 模式圖像和 Nakagami 統計參量圖像。然后計算熱凝固區域和周邊正常組織區域之間的對比噪聲比值(contrast-to-noise ratio,CNR),用來量化分析超聲 Nakagami 統計參量圖像和超聲 B 模式圖像在微波熱消融監控中的對比度。
本文提出了一種新的超聲監控成像方式,與傳統超聲 B 模式成像監控相比,這種新方式可能在微波熱消融過程中對圖像中損傷部分的突顯能力更為優異,同時通過在活體實驗中進行驗證,期許該方法或可對現有的微波熱消融等熱消融治療提供一種新的監控思路。
1 方法
1.1 活體豬微波熱消融
使用臨床腫瘤微波熱消融系統(MH-1Y,中國北京 M & Y 電子有限公司,中國)對 5 頭活體豬(20~25 kg)分別進行肝臟和腎臟的微波熱消融實驗,設置微波系統電功率為 30~70 W,消融時間 5 min,實驗系統如圖 1 所示。微波熱消融實驗在 5 頭實驗豬的肝臟和腎臟上均各進行了 10 組實驗。實驗前,用超聲 B 模式圖像檢查目標組織,以避免在微波熱消融區存在較大血管,防止影響微波能量傳遞和隨后的超聲成像。治療完成后,開大麻醉氣體流量處死動物并分離肝臟和腎臟,依照超聲數據采集平面切片,拍攝熱損傷中心的照片。本研究得到西安交通大學生命科學與技術學院生物醫學科研倫理委員會批準。
 圖1
實驗系統示意圖
Figure1.
Schematic of the experimental apparatus.
圖1
實驗系統示意圖
Figure1.
Schematic of the experimental apparatus.
1.2 超聲散射回波射頻數據采集
在對活體豬進行微波熱消融的治療過程中,使用超聲成像系統(DP9900,邁瑞生物醫療電子股份有限公司,中國)線陣探頭,工作頻率 5 MHz,帶寬 60%,采集熱凝固區域和周邊正常組織的二維射頻(radiofrequency,RF)數據,通過小型計算機接口(small computer system interface,SCSI)將超聲成像系統與計算機的外圍組件(7300A,中國臺灣凌華科技公司,中國臺灣)連接,將 RF 數據以 14 位分辨率、25 MS/s 的速度數字化并保存。治療過程中,超聲成像系統設置為每 20 s 采集一次 RF 數據。
1.3 超聲 Nakagami 統計參量成像
Nakagami 分布模型與超聲背向散射回波信號的概率密度分布有高度的一致性,并且 Nakagami 模型的參數會隨著背向散射回波信號統計特性的變化而改變,因此 Nakagami 模型在超聲信號組織定征中得到了越來越多的應用。
Nakagami 統計參量決定了超聲回波包絡統計分布的形狀參數[13],在 Nakagami 分布模型中,超聲背向散射回波包絡 R 的概率密度函數 f(r)如式(1)和式(2)所示:
 |
 |
其中,Γ(·)表示伽馬函數,U(·)表示單位階躍函數,Ω 表示尺度參數。R 表示背向散射包絡,m 即表示 Nakagami 統計參量。
Nakagami 統計參量(用符號 m 表示),可由如式(3)、(4)所示方程組計算得到。
 |
 |
其中, 表示雙伽馬函數,其中通過商用數學軟件 MATLAB(MathWorks Inc.,美國)的函數 psi(k,x)較易得到函數
表示雙伽馬函數,其中通過商用數學軟件 MATLAB(MathWorks Inc.,美國)的函數 psi(k,x)較易得到函數 ,此函數中的 k 為導數階數。Γ(·)表示伽馬函數,R 表示背向散射包絡,x 表示回波信號。
,此函數中的 k 為導數階數。Γ(·)表示伽馬函數,R 表示背向散射包絡,x 表示回波信號。
Greenwood 等[14]通過最大似然法估算出了最恰當的基于 Nakagami 分布的 Nakagami 統計參量(用 m 表示),如式(5)所示:
 |
其中,y 表示回波信號。
超聲背向散射包絡的統計分布與散射子濃度有關,因此可用超聲 Nakagami 統計參量確定組織中散射子濃度[13]。通過計算 Nakagami 統計參量可以得到超聲 Nakagami 統計參量圖像[15],而為了計算 Nakagami 統計參量,可使用 Nakagami 統計參量估計的最佳尺寸滑動窗(即,窗寬約為 3 倍入射超聲波脈沖長度的滑動窗口)遍歷采集到的 RF 數據,并產生背向散射回波包絡[16]。成像圖像的縱坐標表示深度,橫坐標表示橫向位置。盡管使用了帶通濾波器和希爾伯特變換來處理射頻數據,超聲 Nakagami 統計參量圖像仍然有很多可能影響圖像質量的系統噪聲,因此本文采用了近鄰成分分析算法(neighborhood components analysis,NCA)作為去噪算法來減少系統噪聲[15, 17]。本文使用的 NCA 算法中,選用相關性低于 80% 的原始射頻數據掃描線幅度作為圖像數據最小值,代替理想直流噪聲信號以達到去噪的目的[17]。最后對超聲 Nakagami 統計參量進行彩色編碼并疊加到對應的超聲 B 模式圖像上,得到超聲 Nakagami 統計參量圖像[9]。
1.4 CNR 的計算
本文使用微波熱消融區域和周邊正常組織之間的 CNR 來量化分析超聲 Nakagami 統計參量圖像和超聲 B 模式圖像在微波熱消融監控中的對比度。該方法已在射頻熱消融超聲監控成像評價中被研究并采用[18]。CNR(以符號 CNR 表示)的計算公式如式(6)所示:
 |
其中,M 和 S 分別表示均值和標準差,是微波熱消融后,在同一深度的熱消融區域(T)和周邊正常組織區域(N)分別選取一個相應目標感興趣區域(region of interest,ROI)的像素值的均值和標準差。
2 結果
2.1 微波熱消融治療后的超聲 B 模式和 Nakagami 統計參量成像
在對實驗豬執行微波熱消融操作結束后,使用 RF 數據同步構建熱凝固區域的超聲 B 模式圖像和 Nakagami 統計參量圖像。每次實驗結束后,沿超聲檢測與成像換能器采集切面剖開樣品,并對切面拍照以獲取光學圖像。微波熱消融實驗后活體豬的肝臟和腎臟的超聲 B 模式圖像和 Nakagami 統計參量圖像及對應的組織剖面照片如圖 2 所示。
 圖2
微波熱消融后的熱凝固區域
Figure2.
Thermal lesions after microwave ablation
圖2
微波熱消融后的熱凝固區域
Figure2.
Thermal lesions after microwave ablation
如圖 2 所示為本文一組活體豬的肝臟、腎臟微波熱消融實驗的結果,從上至下依次為組織剖面圖片、超聲 B 模式圖像和超聲 Nakagami 統計參量圖像。本組肝臟微波熱消融實驗的消融功率為 70 W,腎臟微波熱消融實驗的消融功率為 40 W,這是由于活體豬實驗中腎臟位置不易暴露且腎臟較小,故而本文所述活體豬實驗的腎臟微波熱消融功率均選擇為較小功率。圖 2 中的 ROI 用于提取數據計算 Nakagami 統計參量的值并進行后續的統計學分析,ROI 在肝臟微波熱消融實驗中尺寸設置為 5 × 5 mm,而在腎臟微波熱消融實驗中設置為 3 × 3 mm,且 ROI1 表示在熱凝固區域內選取的 ROI,ROI2 表示在周圍正常組織選取的 ROI。
從圖 2 中的組織剖面圖片可以看到,不論是肝臟還是腎臟,在微波熱消融治療后,由于蛋白質受熱變性等緣故,均以微波針為中心形成了一個變色區域,此變色區域即為熱凝固區域。且消融功率設置為 70 W 時,隨著熱能量的沉積增大,消融區域中心顏色較暗,肝臟組織有出現碳化的趨勢;而消融功率設置為 40 W 時,組織剖面圖片中卻沒有顯示碳化趨勢。在臨床微波熱消融治療中,超聲 B 模式圖像中可觀察到的隨著功率增加而變大的高亮區域即為熱凝固區域,此高亮區域主要是由于微波熱消融中產生的熱凝固和汽化微泡所引起的[10]。圖 2 中的超聲 Nakagami 統計參量圖像是由超聲 B 模式圖像疊加彩色編碼后的 Nakagami 值得到的,基于超聲 Nakagami 統計參量圖像可以看出,微波消融后損傷處以彩色的形式顯示出來,背景組織則為灰度圖像。與傳統的超聲 B 模式圖像相比,基于 Nakagami 統計參量的彩色編碼疊加圖像不僅對損傷邊界信息的判定更加明顯、清晰,并且在使圖像中損傷部分突顯出來的同時可以確定損傷區域的位置信息。觀察圖像可知,超聲 Nakagami 統計參量圖像可以有效地抑制超聲 B 模式圖像上由于上部強回聲區域引起的聲遮擋效應,更好地顯示熱凝固區域。
2.2 微波熱消融過程中的動態監控
為了反映微波熱消融實驗時活體豬肝、腎的動態變化,在實驗過程中活體豬肝臟和腎臟的超聲 B 模式圖像和 Nakagami 統計參量圖像動態監控如圖 3 所示。其中,肝臟和腎臟的微波熱消融功率均為 40 W。圖中所示 ROI 與之前相同,在肝臟微波熱消融實驗中設置為 5 × 5 mm 的尺寸,而在腎臟微波熱消融實驗中設置為 3 × 3 mm,且 ROI1 和 ROI2 分別表示在熱凝固區域內以及周圍正常組織選取的 ROI。在圖 3 中,觀察微波熱消融過程中超聲 B 模式圖像的動態變化可知,未消融前(0 s),可以看到組織中心處有較亮區域,是由于輻射器尖端產生的強反射。當消融持續一定時間之后(120 s),超聲 B 模式圖像的高回聲區域增大,但是高亮區域與周圍正常組織的邊界模糊,不易判斷損傷的邊界,這主要是由于強散射信號的汽化微泡所導致的。因此,使用常規超聲 B 模式圖像監控微波熱消融過程具有一定的困難。而超聲 Nakagmai 統計參量圖像反映的是回波包絡的統計分布特性,與背向散射統計特性的形狀有關,受散射子系數影響較小[15, 19]。因此超聲 Nakagmai 統計參量圖像受強散射信號的汽化微泡的影響較小,可以較好地描述熱凝固的形成過程。與超聲 B 模式圖像不同,在微波熱消融過程中,超聲 Nakagami 統計參量圖像中的明亮高回聲區域隨著熱消融時間的增加而逐步增大,且邊界、位置均較為清晰。
 圖3
微波熱消融過程中的動態監控圖像
Figure3.
Temporal evolution of thermal lesion before and during microwave ablation treatment
圖3
微波熱消融過程中的動態監控圖像
Figure3.
Temporal evolution of thermal lesion before and during microwave ablation treatment
2.3 Nakagami 統計參量及 CNR 動態變化
為了分析微波熱消融過程中熱凝固區域和周圍正常組織的 Nakagami 統計參量幅值以及 CNR 的動態變化,特在熱凝固區域和周圍正常組織分別選取了 ROI1 和 ROI2,提取 ROI 區域的 Nakagami 統計參量(以 m 表示)幅值并使用前述公式計算 CNR,得到的結果如圖 4 所示。圖 4 中所示值均為每組 10 個測量值的平均值和標準差。從圖 4 中可看到,豬肝、腎正常組織中的 Nakagami 統計參量的平均值分別約為 0.78 和 0.79,而經過微波熱消融形成熱凝固后,其值分別增加到了 0.91 和 0.92。從圖 4 中 Nakagami 統計參量隨著時間的動態變化可以看到,隨著治療時間的增加,Nakagami 統計參量逐漸增大,很好地表現了熱凝固區域散射子的變化。且統計學結果表明,微波熱消融后的超聲 Nakagami 統計參量圖像能明顯分辨出熱凝固區域。微波熱消融治療前常規超聲 B 模式圖像和超聲 Nakagami 統計參量圖像的 CNR 值差異沒有統計學意義,治療后,常規超聲 B 模式圖像和超聲 Nakagami 統計參量圖像的 CNR 值的差異具有統計學意義(P < 0.05)。
 圖4
微波熱消融治療中 Nakagami 統計參量及 CNR 的動態變化
Figure4.
Statistical results of the dynamic changes of Nakagami parameter and CNR during microwave ablation exposure
圖4
微波熱消融治療中 Nakagami 統計參量及 CNR 的動態變化
Figure4.
Statistical results of the dynamic changes of Nakagami parameter and CNR during microwave ablation exposure
從圖 4 中 CNR 值隨著時間的動態變化可以看到,隨著治療時間的增加,不論是超聲 Nakagami 統計參量圖像還是超聲 B 模式圖像的 CNR 值均逐漸增大,但超聲 Nakagami 統計參量圖像的 CNR 值增加十分明顯,超聲 B 模式圖像的 CNR 值的變化卻沒有那么明顯。在微波熱消融過程中,由活體豬肝臟超聲 Nakagami 統計參量圖像中計算得的 CNR 平均值從 0.49 增加到 1.13,而腎臟對應的 CNR 平均值則從 0.51 增加到 0.85,均高于對應的超聲 B 模式圖像計算得到的 CNR 值。一般而言,CNR 值表示信號有用功率與噪聲之比,在本文中表現為 ROI 區域信號平均值與方差之比。CNR 可以表現對有用信號的突顯程度,即在本文中表現為對熱凝固區域的突顯能力。從圖 4 中可以看到,超聲 Nakagami 統計參量圖像的 CNR 值高于超聲 B 模式圖像的 CNR 值,說明超聲 Nakagami 統計參量圖像較常規超聲 B 模式圖像更能突顯出熱凝固區域。
圖 4 中可以看到 Nakagami 統計參量和 CNR 均有一定的方差,此方差可能來源于熱凝固區域內的組織異質性和微泡活動。即使實驗前通過超聲 B 模式圖像檢查組織以避免在存在大血管等組織的區域進行熱消融,但一些小血管和筋膜仍舊無法避免;而且在微波熱消融過程中也會產生汽化微泡。組織的非均勻性和微泡活動可能是引起超聲回波信號在熱凝固區域存在方差的主要原因,進而又影響了后續超聲 Nakagami 統計參量和 CNR 值的估計。
3 討論
本文通過對活體豬進行實驗驗證的方式,探討了采用超聲 Nakagami 統計參量成像對微波熱消融治療過程進行監控成像的可行性。
通常,超聲 B 模式圖像中的高亮區域的亮度會隨著回波振幅幅度的增加而增加,而這種增加與散射子濃度和散射系數相關。所以,當進行微波熱消融治療時,由于高溫會產生氣泡,將極大地影響超聲散射系數,導致超聲 B 模式圖像不能清晰地看到損傷的邊界。而根據 Tsui 等[15]和 Zhang 等[19]的研究可知,超聲 Nakagami 統計參量圖像的亮度僅取決于散射子濃度,散射子濃度卻基本不受氣泡等因素的影響。Nakagami 統計參量是 Nakagami 分布的形狀參數,它決定了超聲背向散射包絡的統計分布。超聲背向散射包絡統計分布的形狀僅隨散射子濃度的變化而變化,與回波幅值無關。因此,在散射系數變化的情況下,Nakagami 統計參量的這種特性能夠提供相對穩定的參量值,能夠較為清晰地表現出實際的熱凝固區域。
本文研究中還發現,超聲 Nakagami 統計參量圖像在熱凝固區域邊界處存在亞溶解效應。目前已有學者研究發現,采用高頻超聲成像可以有效改善超聲 Nakagami 統計參量圖像的亞溶解效應[19],由于此部分內容不是本文重點,故而在此不再贅述。
已有研究通過組織病理學檢查以及光鏡和電鏡觀察表明,組織熱損傷的特點是結構破壞、熱凝固[20]。由于熱凝固,細胞膜和細胞核膜被破壞,細胞質和細胞核流出成為超聲散射子,從而損傷區超聲散射子濃度增加。根據本文結果,微波熱消融后組織熱凝固區域的 Nakagami 統計參量明顯增大,因此今后有望使用超聲 Nakagami 統計參量評估微波熱消融形成的熱凝固區域。
經過本文的研究可以看到,微波熱消融治療后,組織熱凝固區域的 Nakagami 統計參量明顯增大,且其 CNR 平均值遠高于從超聲 B 模式圖像中計算得到的 CNR 值,這表明超聲 Nakagami 統計參量成像在微波熱消融治療中進行監控得到的圖像的對比度更高。本文通過活體豬微波熱消融研究證實,超聲 Nakagami 統計參量評估微波熱凝固區域是切實可行的,超聲 Nakagami 統計參量成像有望成為微波熱消融治療中可供選擇的新的監控成像方式。