阿爾茨海默病(AD)是一種慢性中樞神經退行性疾病。AD 的主要病理特征為淀粉樣蛋白 β 低聚物(AβOs)在胞外沉積形成老年斑,以及 tau 蛋白過度磷酸化在胞內積聚形成神經纖維纏結。本文提出了一種基于神經網絡傳感芯片的 AD 體外病理模型及其實時動態分析方法,在微電極陣列芯片上培養海馬神經元并形成網絡,使用 AβOs 誘導海馬神經元構造 AD 體外模型,同時記錄到錐體神經元和中間神經元兩種放電模式,利用空間發放圖譜和通道間的互相關系數驗證了病理模型中神經元網絡間信息連接的退化。該生物傳感器能夠從電信號上反應 AβOs 對神經網絡的毒性反應以及神經元網絡之間的信號傳遞功能,有望成為體外 AD 病理網絡模型研究的一種新手段。
引用本文: 高凡, 高克強, 賀川江, 劉夢雪, 胡燕婕, 應可凈, 萬浩, 王平. 基于神經網絡芯片的阿爾茨海默病體外病理模型及其實時動態分析. 生物醫學工程學雜志, 2019, 36(6): 893-901. doi: 10.7507/1001-5515.201902014 復制
版權信息: ?四川大學華西醫院華西期刊社《生物醫學工程學雜志》版權所有,未經授權不得轉載、改編
引言
阿爾茨海默病(Alzheimer’s disease,AD)是一種慢性中樞神經退行性疾病,其主要臨床癥狀為短期記憶障礙和認知障礙等。隨著當今社會人口老齡化程度日益嚴峻,AD 的高發病率和高致殘率已成為影響人類健康的一個重要問題,而目前對 AD 的診斷和治療手段仍十分有限。AD 的主要病理特征為淀粉樣蛋白 β 低聚物(amyloid-β oligomers,AβOs)胞外沉積形成老年斑,以及 tau 蛋白過度磷酸化胞內積聚形成神經纖維纏結[1]。淀粉樣蛋白由 39~43 個氨基酸組成,這些氨基酸由淀粉樣前體蛋白生成[2]。AβOs 是淀粉樣蛋白聚集物的主要形式,突觸功能障礙和認知功能減退都與 AβOs 對突觸的毒性作用密切相關[3]。AβOs 打開了突觸上的電壓門控鈣通道,促進鈣離子大量內流,最終導致軸突運輸(如腦源性神經營養因子等物質)的功能受到損傷[4]。N-甲基-D-天冬氨酸(N-methyl-D-aspartic acid,NMDA)受體是興奮性突觸后膜上離子型谷氨酸受體的主要類型[5],AβOs 可與神經元表面含有 NMDA 受體的蛋白相結合并影響下游通路,從而誘導突觸毒性效應[6]。近年來,一些研究者通過 AβOs 誘導神經元或器官型腦片建立了 AD 體外病理模型[7-8],用于研究突觸可塑性和藥物機制等,為后續研究提供了基礎和思路。
除了淀粉樣蛋白對神經元造成損傷外,過度磷酸化的 tau 蛋白也發揮著毒性作用。tau 蛋白是一種結合神經元軸突微管的相關蛋白,能穩定微管并進行不同類型的翻譯后修飾,如磷酸化、糖基化、乙酰化、泛素化等。異常的超磷酸化可誘導 tau 蛋白構象變化和聚集,從而形成神經纖維纏結[9]。在 AD 模型的神經元網絡中,高度磷酸化的 tau 蛋白(phosphorylated tau,p-tau)從微管中分離,導致細胞骨架的穩定性下降[10-11]。此外,病理性的 tau 蛋白可通過其 N 末端序列與突觸小泡結合,最終導致突觸前功能中斷[12]。
膜片鉗和功能性光學成像等技術常被應用于研究離子通道和神經電活動。膜片鉗是電生理記錄的金標準,具有很高的靈敏度和特異性,但其通道數量有限,實驗要求高,難以揭示神經元網絡特征[13-15]。鈣離子成像可以描述多個單細胞的活動映射,但通常受到一些限制,如時間分辨率低、無法長時間連續在線記錄等[16]。微電極陣列(microelectrode array,MEA)能夠記錄大量跨膜離子傳輸所產生的細胞外膜動作電位,已成為研究神經元網絡電生理的新平臺[17-19],并具有多通道、時間分辨率高、可長期記錄和同步刺激等優點[20]。如 Amin 等[21]使用一種互補金屬氧化物半導體多電極陣列來檢測經 AβOs 誘導后神經網絡的早期活動變化和神經毒性影響。然而,他們并沒有研究 AβOs 對兩類神經元的不同影響,以及通道間的網絡通信與時間關聯性。為了克服這些局限性,一種基于神經網絡傳感芯片的 AD 體外病理模型及其實時動態分析方法被提出,通過設計制作 MEA 芯片,在修飾芯片表面后培養海馬神經元并形成網絡,使用 AβOs 誘導建立 AD 體外模型。基于該芯片,本文期望達到能夠多位點、長時間、實時動態地測量神經元電活動和網絡通信的目的,進一步利用空間發放圖譜和通道間互相關性評估神經元網絡的信號傳遞功能,為今后體外 AD 病理網絡模型研究提供一種新的手段。
1 材料與方法
1.1 材料與設備
本文所用材料包括:淀粉樣蛋白(Thermo Fisher 公司,美國);胰酶(Thermo Fisher 公司,美國);杜氏改良培養基(dulbecco’s modified eagle medium,DMEM)(Thermo Fisher 公司,美國);神經基礎培養基(Thermo Fisher 公司,美國);無血清培養基 B27(Thermo Fisher 公司,美國);谷氨酰胺(Thermo Fisher 公司,美國);青霉素—鏈霉素(Thermo Fisher 公司,美國);阿糖胞苷(Sigma 公司,美國);六氟-2-丙醇(Sigma 公司,美國);胰蛋白酶(Sigma 公司,美國);多聚賴氨酸(Sigma 公司,美國);層粘連蛋白(Sigma 公司,美國);多聚甲醛(國藥集團化學試劑有限公司,中國);聚乙二醇辛基苯基醚 Triton X-100(上海阿拉丁生化科技股份有限公司,中國);牛血清白蛋白(albumin from bovine serum,BSA)(國藥集團化學試劑有限公司,中國);山羊血清(武漢博士德生物工程有限公司,中國);微管相關蛋白 2(microtubule-associated proteins 2,MAP2)一抗(Proteintech Group,美國);p-tau 蛋白一抗(Cell Signaling Technology,美國);Alexa Fluor 二抗(Beyotime Biotechnology,中國)。
本文所用設備包括:二氧化碳培養箱(Heracell 150i,Thermo Fisher 公司,美國);離心機(SpeedVac,Thermo Fisher 公司,美國);激光共聚焦熒光顯微鏡(AiR,Nikon 公司,日本);MEA 記錄系統(Classic MEA-System,Multi Channel Systems 公司,德國)。
1.2 MEA芯片與記錄系統
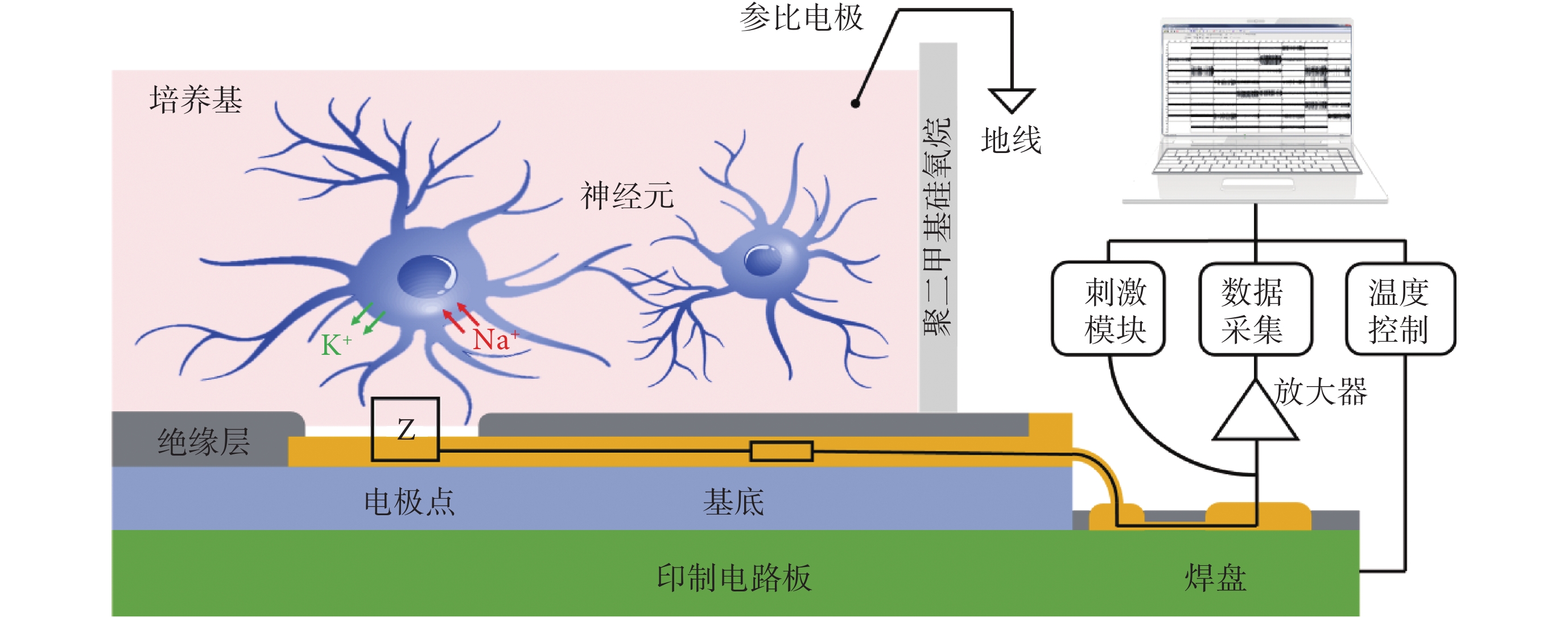
MEA 芯片由多通道組成,用于大數據采集并記錄來自神經元網絡的電活動信號。MEA 系統模式示意圖如圖1 所示,神經元生長在芯片表面后,自發或興奮性刺激產生胞內外 K+、Na+離子的大量交換,產生動作電位并改變胞外膜電位。圖1 中 Z 為電極—電解液界面雙電層阻抗,此處電壓接近細胞膜附近的電壓,細胞膜電位變化直接影響該點電壓。信號由電極點記錄后傳輸至放大器,再經數據采集卡轉換后傳輸至個人計算機(personal computer,PC)進行顯示和分析。系統包含溫度控制模塊和刺激模塊,對 MEA 芯片控溫在 37℃,并可編寫不同幅值、頻率的刺激序列施加在任一電極點上,并同步記錄所有通道的刺激后響應。
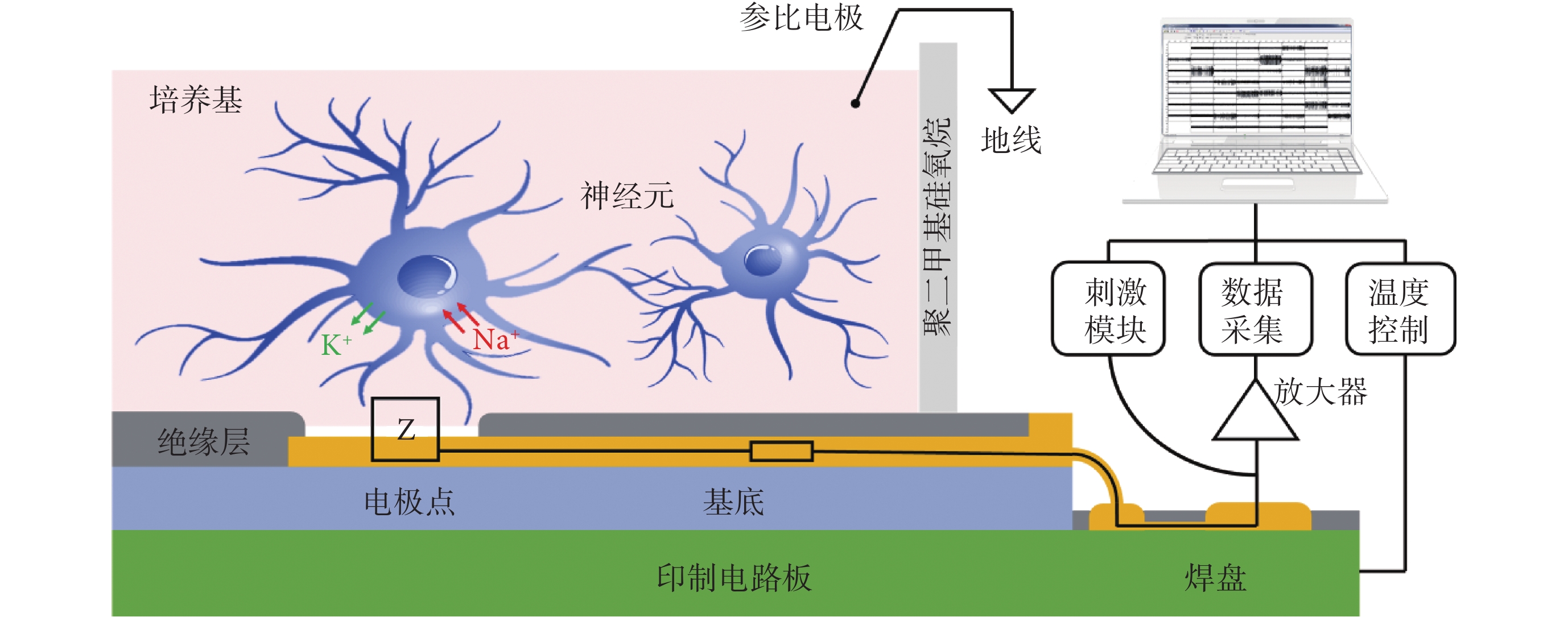 圖1
MEA 檢測系統原理圖
Figure1.
The schematic diagram of the MEA detection system
圖1
MEA 檢測系統原理圖
Figure1.
The schematic diagram of the MEA detection system
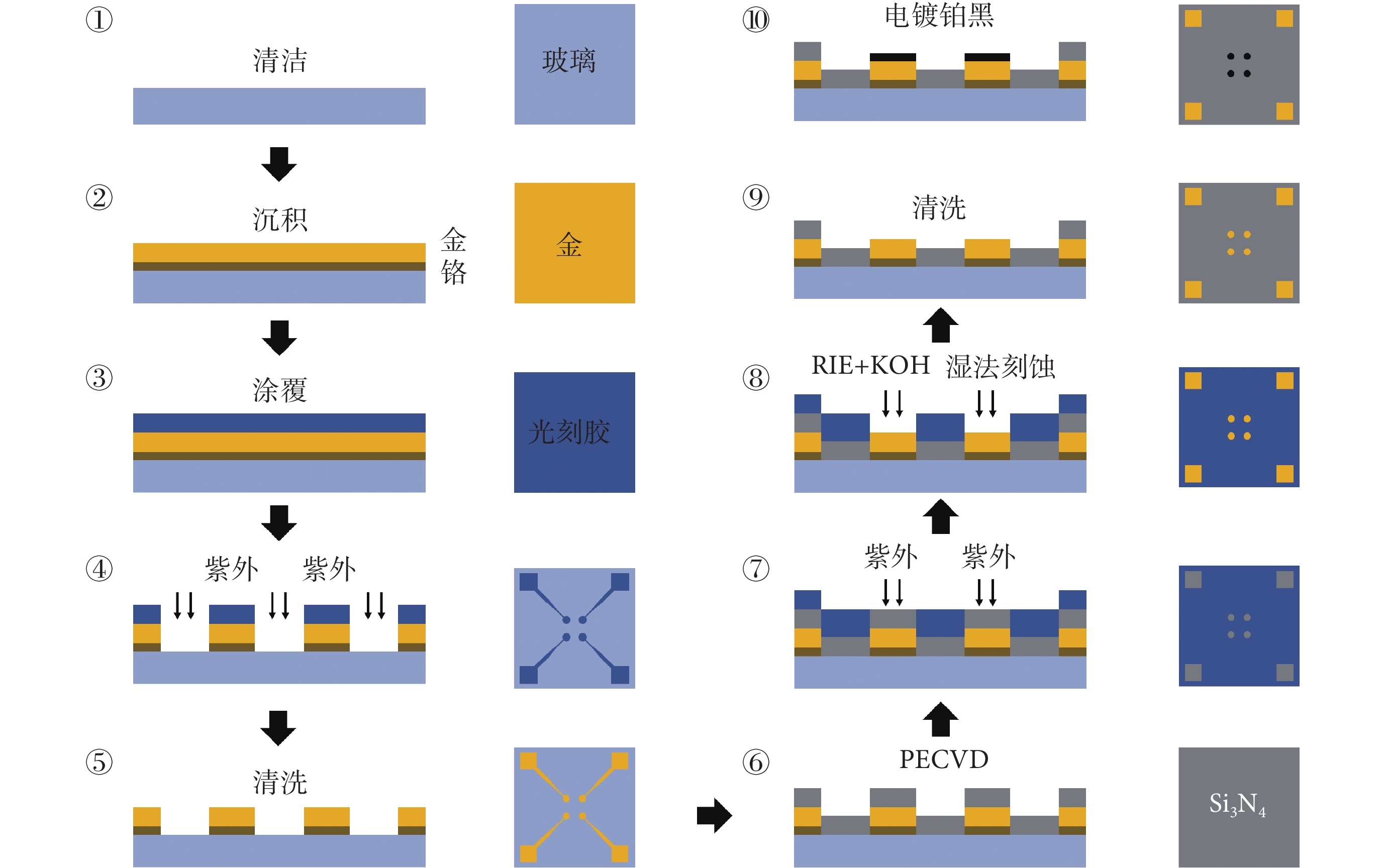
MEA 芯片采用微機電系統工藝制作,加工流程如圖2 所示,具體步驟為:① 選取四英寸硅片(厚約 450 μm),將一層 30 nm 鉻層和一層 300 nm 金層分別沉積到玻璃基底上,作為黏附層和電極層;②~⑤ 使用光蝕刻技術蝕刻出電極位點和引線的布局;⑥ 使用等離子増強型化學氣相沉積(plasma-enhanced chemical vapor deposition,PECVD)在芯片表面沉積一層 1 μm 的 Si3N4 作為純化層;⑦~⑨ 使用反應離子刻蝕技術(reaction ion etching,RIE)暴露出電極和焊盤對應處的 Si3N4,之后使用 KOH 溶液將 Si3N4 刻蝕掉,露出電極位點和焊盤并清洗光刻膠;⑩ 使用計時安培法在 MEA 電極表面電鍍鉑黑,完成 MEA 芯片加工。該 MEA 芯片共有 60 個工作電極,成 8×8 方形陣列排布,單個電極直徑為 30 μm,電極間距為 200 μm,對每個電極點按從上到下、從左到右的順序進行編號(1~60),以便于數據分析與結果展示。電鍍鉑黑后,電極點比表面積增加,電極阻抗降低,以提高信噪比。使用金線將芯片上的焊盤和印制電路板(printed circuit board,PCB)上的接口連接,使用生物相容性良好的聚二甲基硅氧烷(polydimethylsiloxane,PDMS)制作直徑 1.5 cm、高度 1 cm 的腔室固定在芯片上,用于細胞培養。為評估電極表面特性,本文采用電化學交流阻抗譜驗證 MEA 電極電鍍鉑黑之后的效果。選擇 MEA 芯片上的任一通道為工作電極,外置銀—氯化銀電極為參比電極,在培養腔中加入 pH 值 7.4 的磷酸緩沖鹽(phosphate buffer saline, PBS)溶液,外加振幅為 5 mV 的正弦激勵,評估 MEA 電極點阻抗譜變化。結果顯示,裸金電極的阻抗幅值高達 5~10 kΩ;電鍍鉑黑后,阻抗幅值降至 1 kΩ 以下。當使用 MEA 芯片記錄電生理信號時,裸金電極基線幅度達上百微伏,且極易受外界干擾,而電鍍鉑黑后,基線幅值減小至 40 μV 以內且基線平穩。
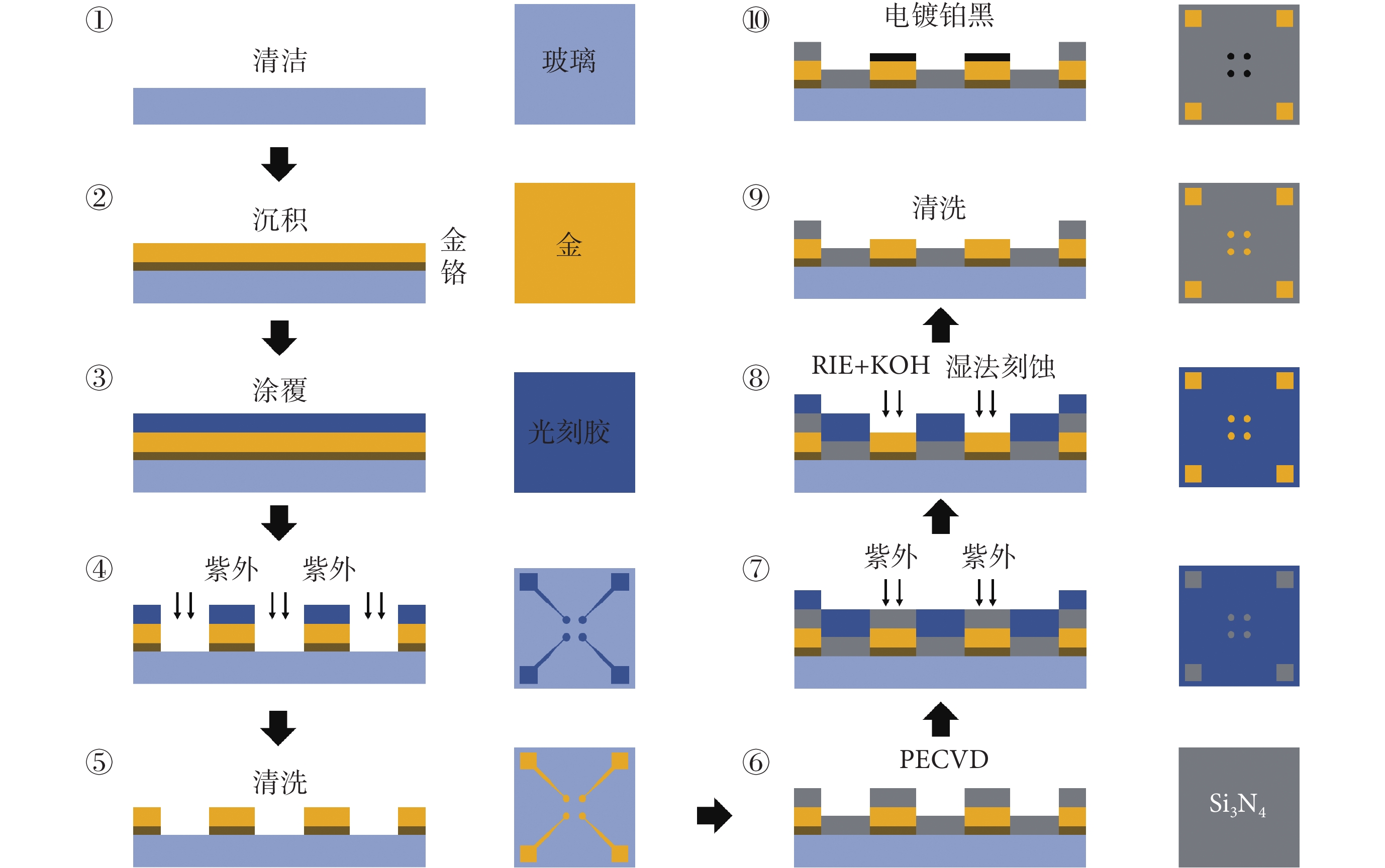 圖2
MEA 芯片加工流程
Figure2.
The general process for MEA chip fabrication
圖2
MEA 芯片加工流程
Figure2.
The general process for MEA chip fabrication
1.3 AβOs的制備
打開裝有冷凍淀粉樣蛋白的肽瓶,在室溫下平衡 30 min。將淀粉樣蛋白重新懸浮在低溫的六氟-2-丙醇中,振蕩幾秒后迅速將該混合溶液等分為三個聚丙烯小瓶。在室溫下孵育 2 h,以使淀粉樣蛋白單體化。在室溫下使用離心機(800 g)濃縮溶液,直到在小瓶底部觀察到清晰的肽膜。此后,通過二甲基亞砜溶液使肽膜重新懸浮以獲得 5 mmol/L 濃度的母液,并將小瓶密封并在 ? 20℃ 下儲存。實驗前,使用 100 μL 的 0.01 mol/L 的 PBS 稀釋母液,振蕩 30 s 后在 4℃ 環境下孵育 12 h。當誘導細胞時,將溶液加入神經元培養基中,并確保最終濃度為 500 nmol/L。
1.4 海馬神經元培養
所有涉及動物的實驗均按照浙江大學動物實驗委員會的倫理準則進行,且已通過動物倫理審查委員會的審查。妊娠 SD 大鼠來自浙江省醫學科學院。為了提高 MEA 芯片的生物相容性,使用多聚賴氨酸和層粘連蛋白混合溶液在 4℃ 下包被芯片表面 12 h。取胎鼠的海馬組織,在 37℃ 下輕輕切碎組織并用 0.25 % 胰蛋白酶消化 15 min。分離出的原代海馬神經元細胞,在 MEA 芯片表面以 5×105個/孔的密度接種,培養液為含 10 % 馬血清的 DMEM。同時,在 24 孔板上以 1×104個/cm2的密度接種,用于后期進行免疫熒光成像。芯片和 24 孔板均在 37℃ 含 5% 二氧化碳的培養箱中保存。接種 4 h 后,用神經基礎培養基(含有 2 % B27、1 % 谷氨酰胺和 0.4 % 青霉素—鏈霉素)代替接種培養基。在培養 3 d 后,加入終濃度為 2.5 μm 的阿糖胞苷,每隔 2~3 d 進行半量換液。在培養的第 13 d 使用 AβOs 誘導神經元,并使用 MEA 記錄神經元網絡的電生理變化。誘導 12 h 后,對 24 孔板中的細胞進行免疫熒光染色。
1.5 免疫熒光染色
24 孔板中的細胞在室溫下使用 4 % 多聚甲醛固定 30 min 后,使用 PBS 洗滌 3 次。使用 0.15 % Triton X-100 滲透 15 min,并在 37℃ 下用 1 % BSA 封閉液培養 30 min。然后在 4℃ 下使用 MAP2 和 p-tau 蛋白的一級抗體孵育 12 h,接著在室溫下使用 Alexa Fluor 二級抗體孵育 2 h,最后使用 4', 6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)染色法對細胞核染色并貼于玻片上。用 1 % Triton X-100、5 % 山羊血清和 1 % BSA 溶液稀釋 MAP2 蛋白和 p-tau 蛋白一抗,稀釋率分別為 1∶250 和 1∶200。使用 PBS 稀釋 Alexa Fluor 二抗,稀釋率為 1∶500。利用激光共聚焦熒光顯微鏡對熒光圖像進行了采集。
1.6 軟件與數據分析
本文使用 MEA 記錄軟件 MC_Rack(Multi Channel Systems 公司, 德國)記錄和顯示 MEA 數據。使用 MEA 數據處理軟件 Offline Sorter V4(Plexon 公司, 美國)和 NeuroExplorer 5(Plexon 公司, 美國)將原始信號經 Bessel 4 階高通濾波器(截止頻率:250 Hz)濾波后,選取信噪比大于 3 的通道作為有效信號通道,計算各有效信號通道的正負峰間隔、發放率和峰峰值,對自發動作電位波形進行分類。本研究中的所有數據均以均值±標準差表示。使用 t 檢驗評估組間差異的統計學意義,P < 0.05 表示差異具有統計學意義。
2 結果與分析
2.1 海馬神經元網絡生長與免疫熒光成像
MEA 芯片及海馬神經元網絡在芯片表面和電極點上的生長狀況如圖3 所示。顯微鏡下可觀察到電極點陣列的排布,海馬神經元培養 14 d 后,可觀察到胞體、軸突和樹突生長在單個電極點表面,且海馬神經元已相互連接形成網絡,覆蓋在 MEA 芯片表面,表明 MEA 芯片表面具有良好的生物相容性,可在電極上檢測到有效信號并分析神經元網絡通信狀態。
 圖3
MEA 芯片及海馬神經元網絡生長狀況
Figure3.
Physical map of MEA chip and growth state of hippocampal neuron network
圖3
MEA 芯片及海馬神經元網絡生長狀況
Figure3.
Physical map of MEA chip and growth state of hippocampal neuron network
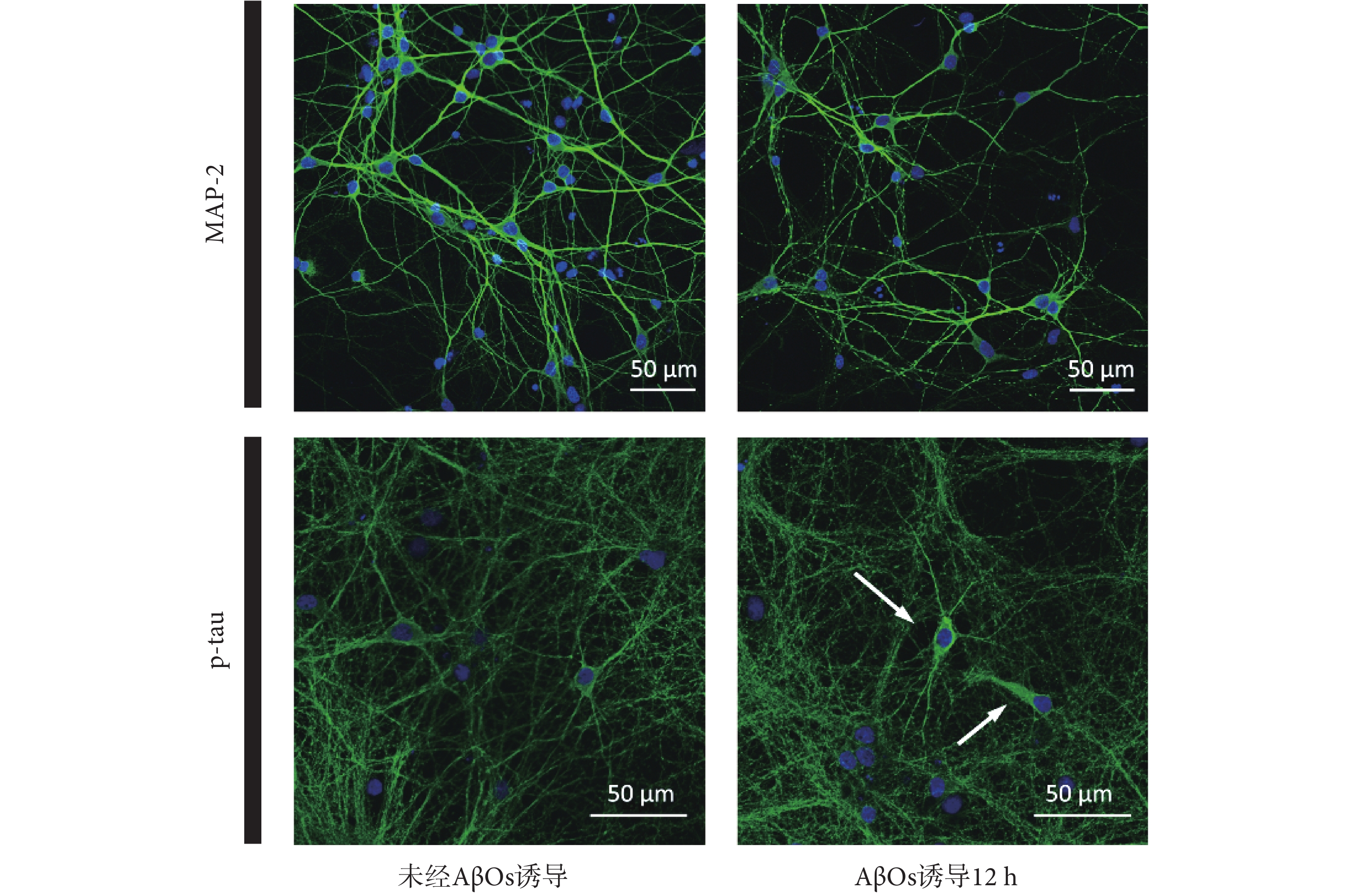
為了驗證 AβOs 對神經元網絡的影響,在體外培養 13 d 后,本文通過對樹突的 MAP2 和 p-tau 蛋白進行標記來觀察細胞形態和結構的變化,海馬神經元免疫熒光成像分析如圖4 所示。由 MAP2 的免疫熒光染色顯示,經 AβOs 誘導 12 h 后,神經元細胞出現了軸突變性和樹突受損,原本光滑連續的樹突斷裂為片段或斑點。此外,由 p-tau 蛋白的免疫熒光染色顯示,AβOs 誘導 12 h 后,部分神經元細胞的 p-tau 蛋白含量顯著增加(白色箭頭),這證實了部分 tau 蛋白發生過度磷酸化并聚集,這與 AD 退化神經元中觀察到的現象相似。
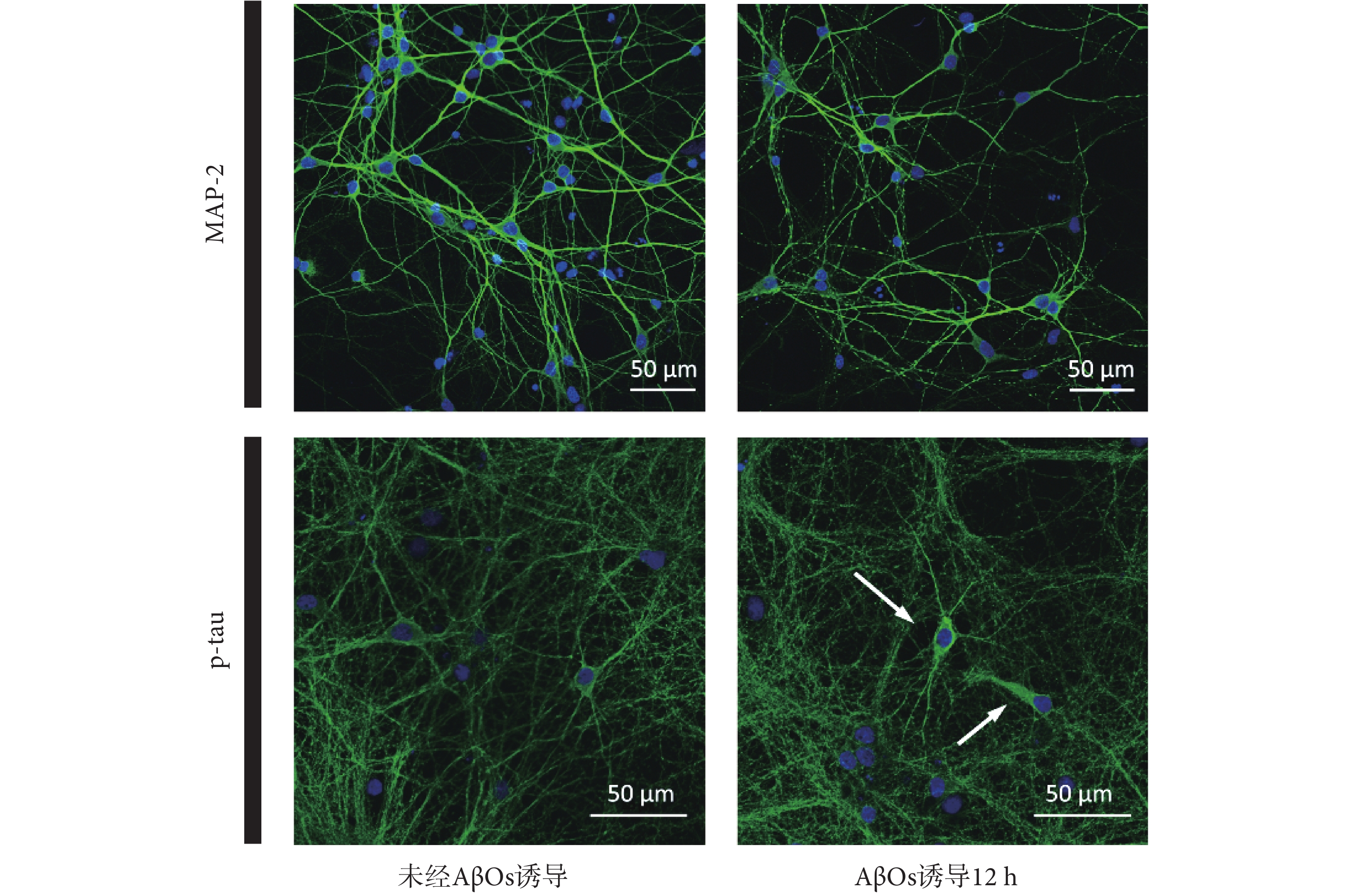 圖4
海馬神經元免疫熒光成像分析
Figure4.
Immunofluorescence image analysis of hippocampal neuron
圖4
海馬神經元免疫熒光成像分析
Figure4.
Immunofluorescence image analysis of hippocampal neuron
2.2 海馬神經元發放模式
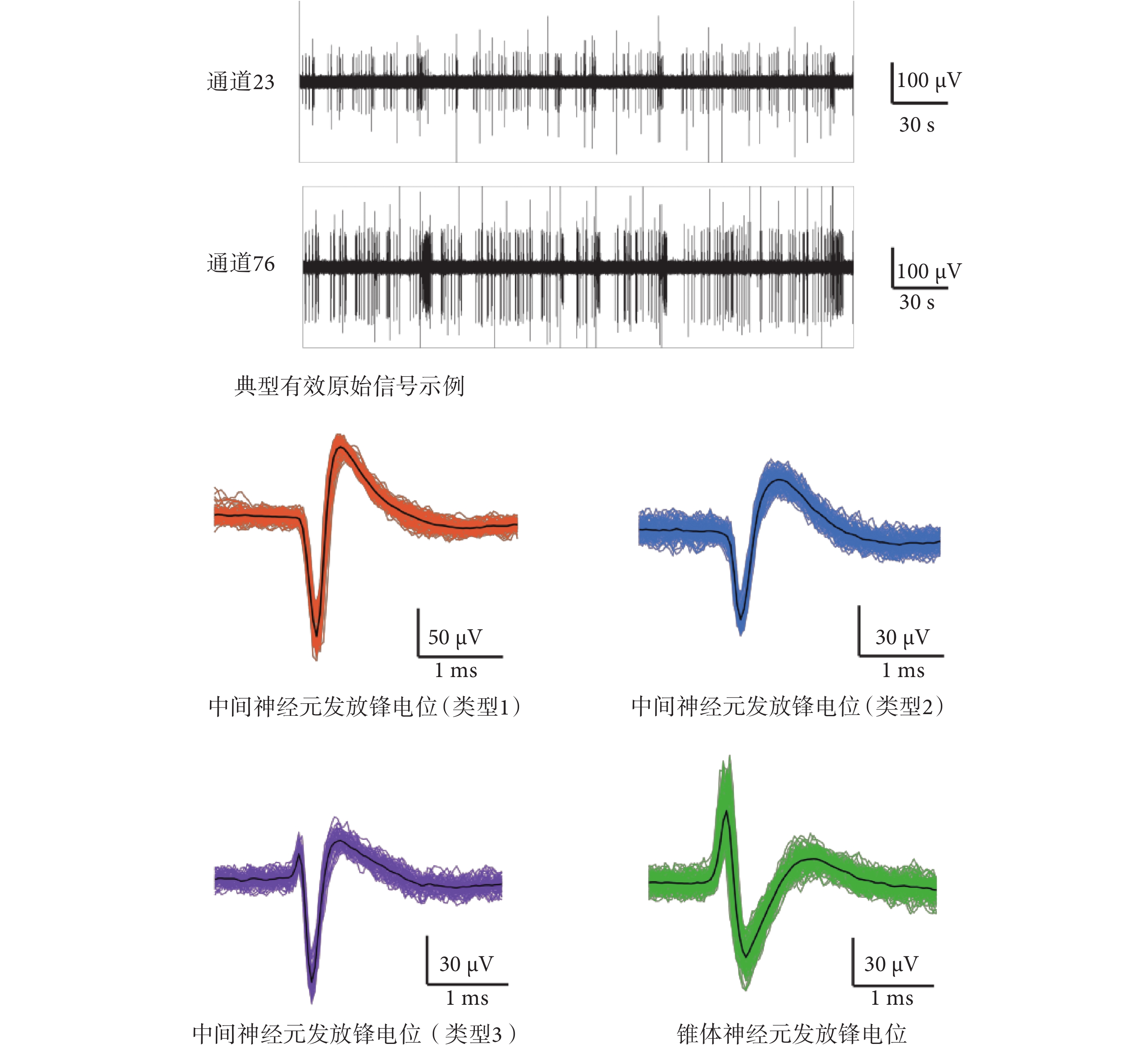
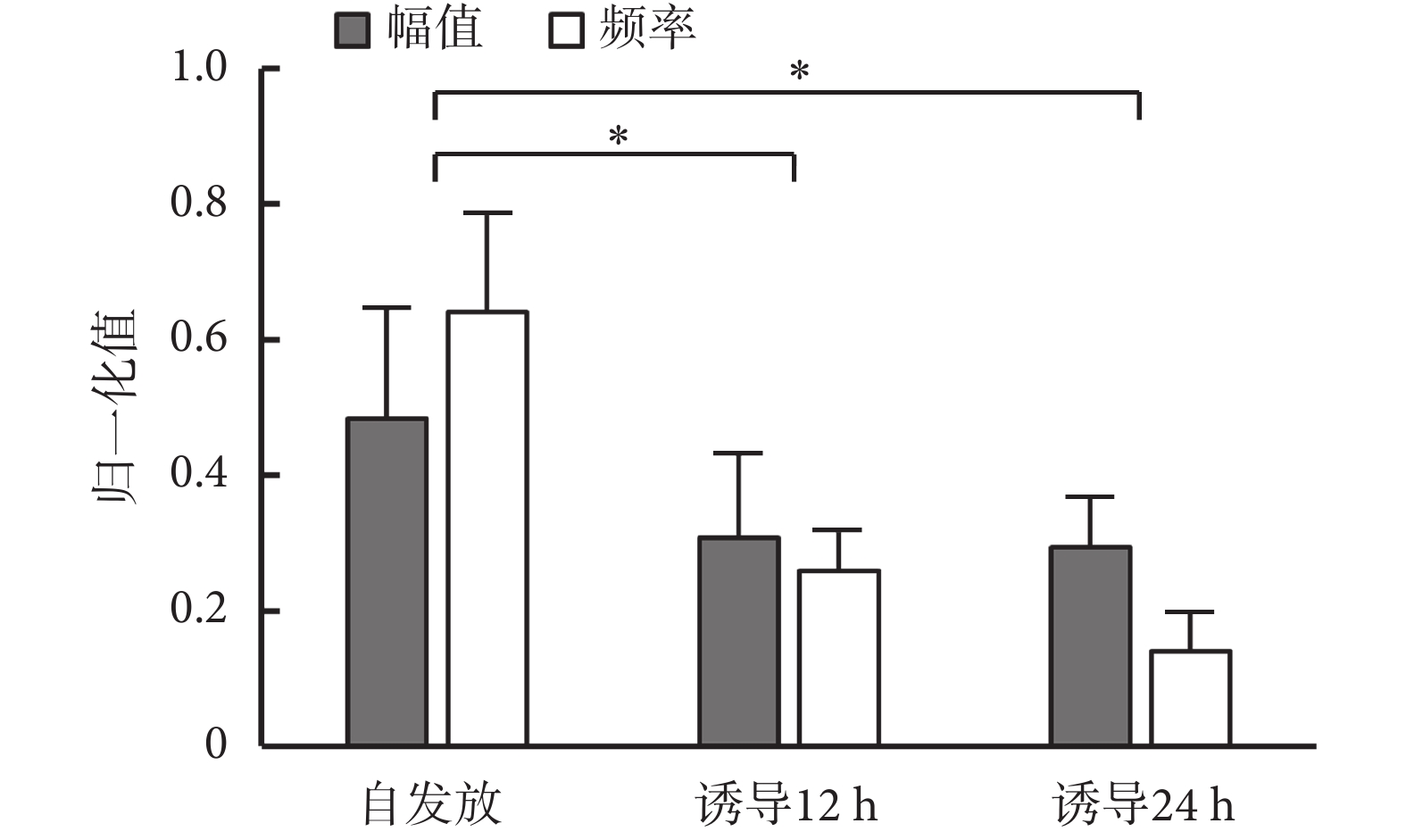
當海馬神經元網絡在 MEA 芯片上生長達 13 d 時,記錄海馬神經元自發放電狀態下的胞外信號并進行特征提取與分類。選取信噪比較高的通道 23 和通道 76 為示例,記錄到典型有效原始信號如圖5 所示,垂直比例尺代表幅值,水平比例尺代表時間。由圖可知,信號基線小于 20 μV,鋒電位幅度大于 100 μV,信噪比大于 5,說明 MEA 芯片能有效記錄神經元的胞外電位信號。選擇三倍 sigma 作為閾值檢測每個通道的峰值,提取波形、正負峰間期、峰峰值、發放率等特征參數,分類得到 4 種鋒電位。由于中間神經元間正負峰間期一般小于 500 μs,而錐體神經元的正負峰間期均大于 700 μs[22],因此 3 種鋒電位來源于中間神經元的放電,另一種鋒電位由錐體神經元放電產生。提取出的不同神經元發放的鋒電位波形如圖5 所示。生長在電極點上的神經元胞體或軸突、樹突位置與數量不同,故在同一電極點上可能記錄到同一種神經元的不同發放波形。由 AβOs 誘導后,樹突棘的數量逐漸減少,突觸蛋白丟失增多,神經遞質受體表面表達受損,同時伴隨著興奮性突觸后電流的減少和突觸可塑性的降低。如圖6 所示顯示了經 AβOs 誘導 12 h 與 24 h 后,不同神經元發放鋒電位歸一化后的幅值和頻率的變化。結果顯示,幅值和頻率均明顯降低,其中誘導 12 h 和 24 h 的發放幅值和頻率相較于自發放其差異均有統計學意義(P < 0.05);且誘導 24 h 的發放頻率相較于 12 h,其差異也具有統計學意義(P < 0.05)。
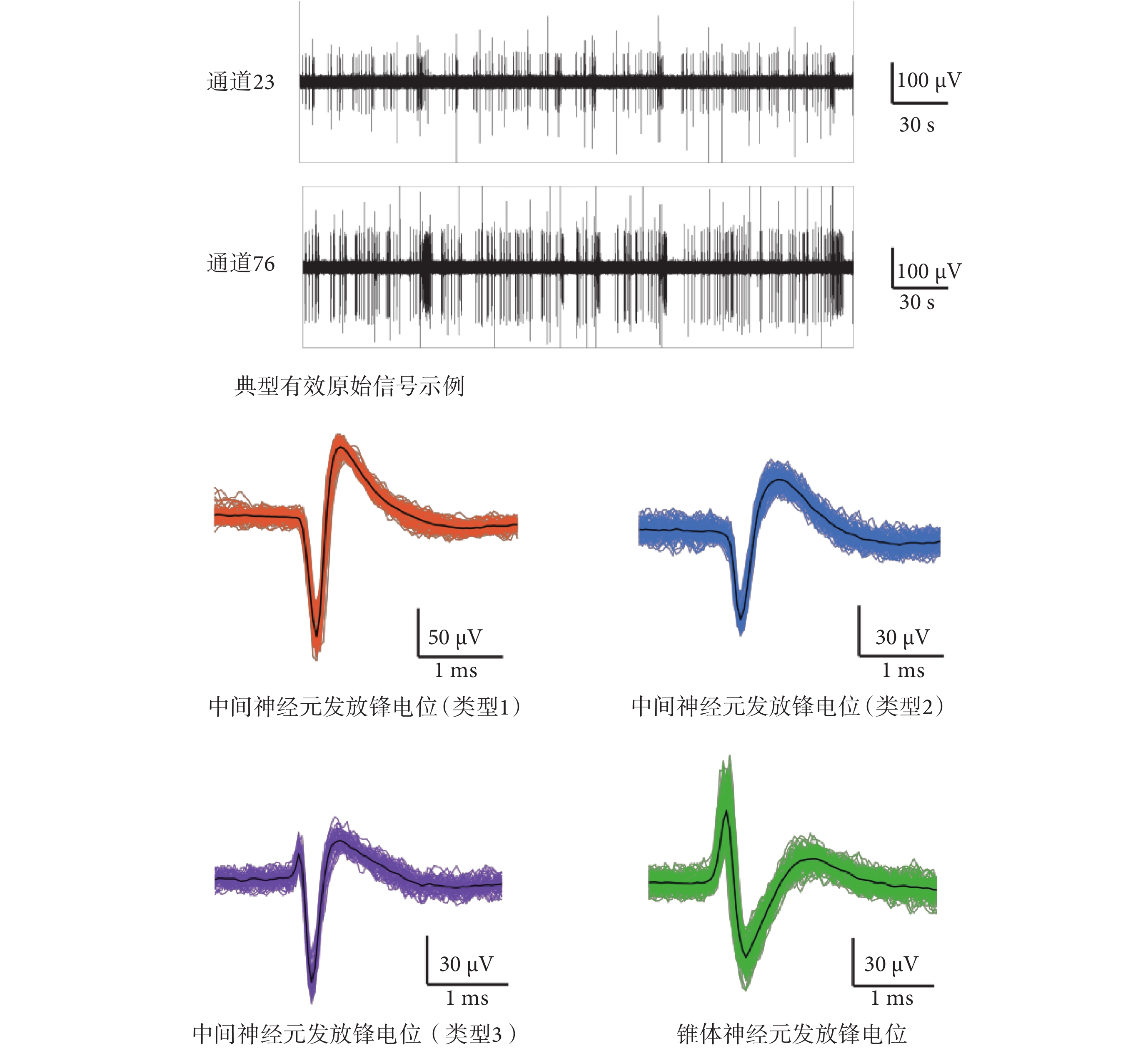 圖5
海馬神經元發放有效信號與鋒電位分類
Figure5.
Effective signals of hippocampal neurons firing and spike classification
圖5
海馬神經元發放有效信號與鋒電位分類
Figure5.
Effective signals of hippocampal neurons firing and spike classification
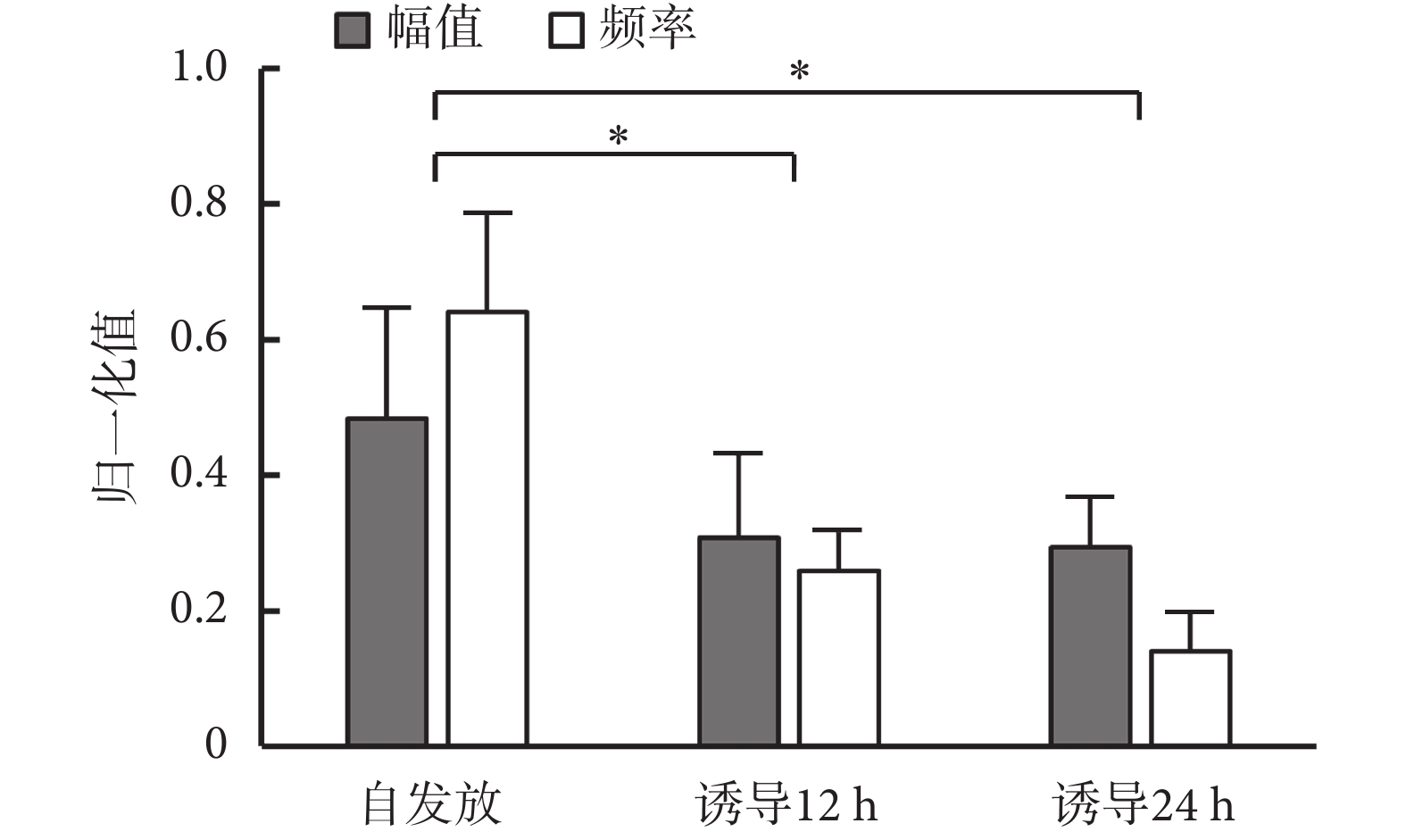 圖6
AβOs誘導前后發放幅值與頻率變化統計圖(n = 9,n 表 示有效信號通道數)*P < 0.05
Figure6.
Statistical chart of amplitude and frequency changing before and after treatment with AβOs (n = 9, n indicates the number of channels with effective signals) *P < 0.05
圖6
AβOs誘導前后發放幅值與頻率變化統計圖(n = 9,n 表 示有效信號通道數)*P < 0.05
Figure6.
Statistical chart of amplitude and frequency changing before and after treatment with AβOs (n = 9, n indicates the number of channels with effective signals) *P < 0.05
2.3 海馬神經元網絡發放圖譜
利用 MEA 空間多位點同時記錄的特性,繪制海馬神經元網絡發放圖譜,觀察誘導前后的變化,以檢測神經退行性變、網絡連接和通信中斷等 AD 模型的主要病理改變。MEA 芯片同時記錄到的神經元網絡多位點電信號如圖7 所示。自發放電狀態中,60 個通道中 34 個通道記錄到基線信號,26 個通道記錄海馬神經元網絡的有效放電信號。其中,23 個通道記錄到中間神經元的發放鋒電位(橙色、藍色、紫色),6 個通道記錄的鋒電位來源于錐體神經元(綠色),且有 7 個通道同時記錄到兩類鋒電位發放,1 個通道同時記錄到三類鋒電位發放,神經元網絡生長狀態良好,且 MEA 陣列可有效記錄到神經元網絡中多位點的發放信號。
 圖7
空間多位點海馬神經元網絡發放圖譜
Figure7.
Spatial multi-site hippocampal neuronal network firing map
圖7
空間多位點海馬神經元網絡發放圖譜
Figure7.
Spatial multi-site hippocampal neuronal network firing map
AβOs 誘導海馬神經元網絡 12 h 后,有效信號通道數下降為 12,剩余有效信號通道的鋒電位發放幅值和頻率均減少。誘導 24 h 后,僅剩 6 個通道含有有效信號,且發放頻率幅值明顯降低。此外,12 h 后,錐體神經元發放通道僅存 3 個,24 h 后錐體神經元放電完全消失,僅剩下中間神經元發放。這是由于錐體神經元是 AD 發病機制和認知功能障礙的核心[23],神經纖維纏結的形成和淀粉樣前體蛋白代謝失調和退化多發于錐體神經元,使得錐體神經元的電生理活性受到更嚴重的影響。
2.4 神經元網絡關聯性分析
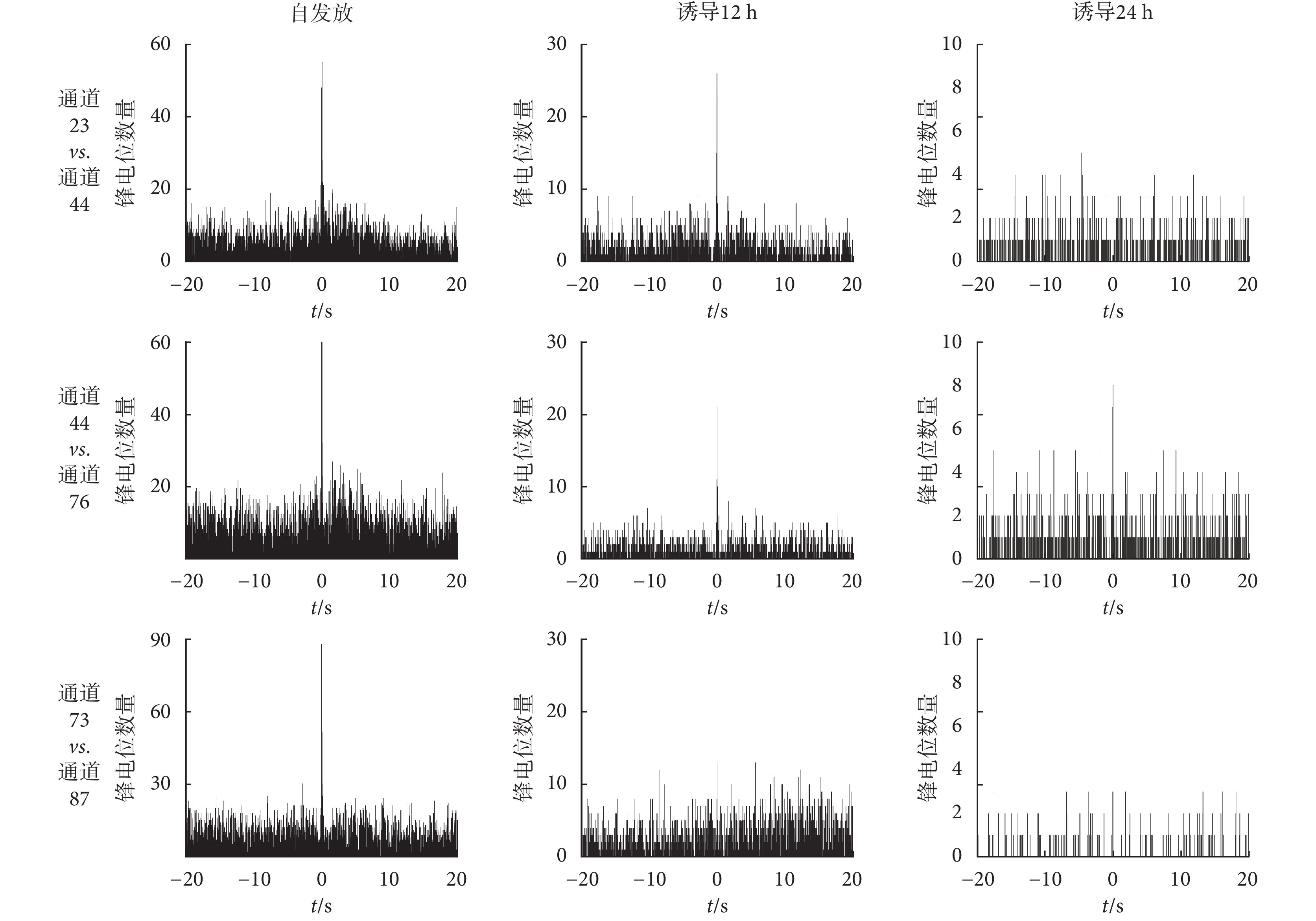
基于 MEA 的神經元網絡芯片還可挖掘各點信號之間的關系和特點,并能考察細胞與細胞信息之間的同步性和平行關系。3 組相近通道神經元發放的互相關分析如圖8 所示,橫軸為鋒電位間隔時間,縱軸為鋒電位數量,該圖反應了兩個通道神經元發放之間時間的關聯性。如果互相關直方圖平坦無規律,則兩個放電序列視為各自獨立的過程;如果互相關函數在 0 時刻出現峰值,則兩個神經元有出現同步放電的趨勢,兩者存在共同輸入或突觸連接,其他形狀則為相互促進或者抑制關系等。
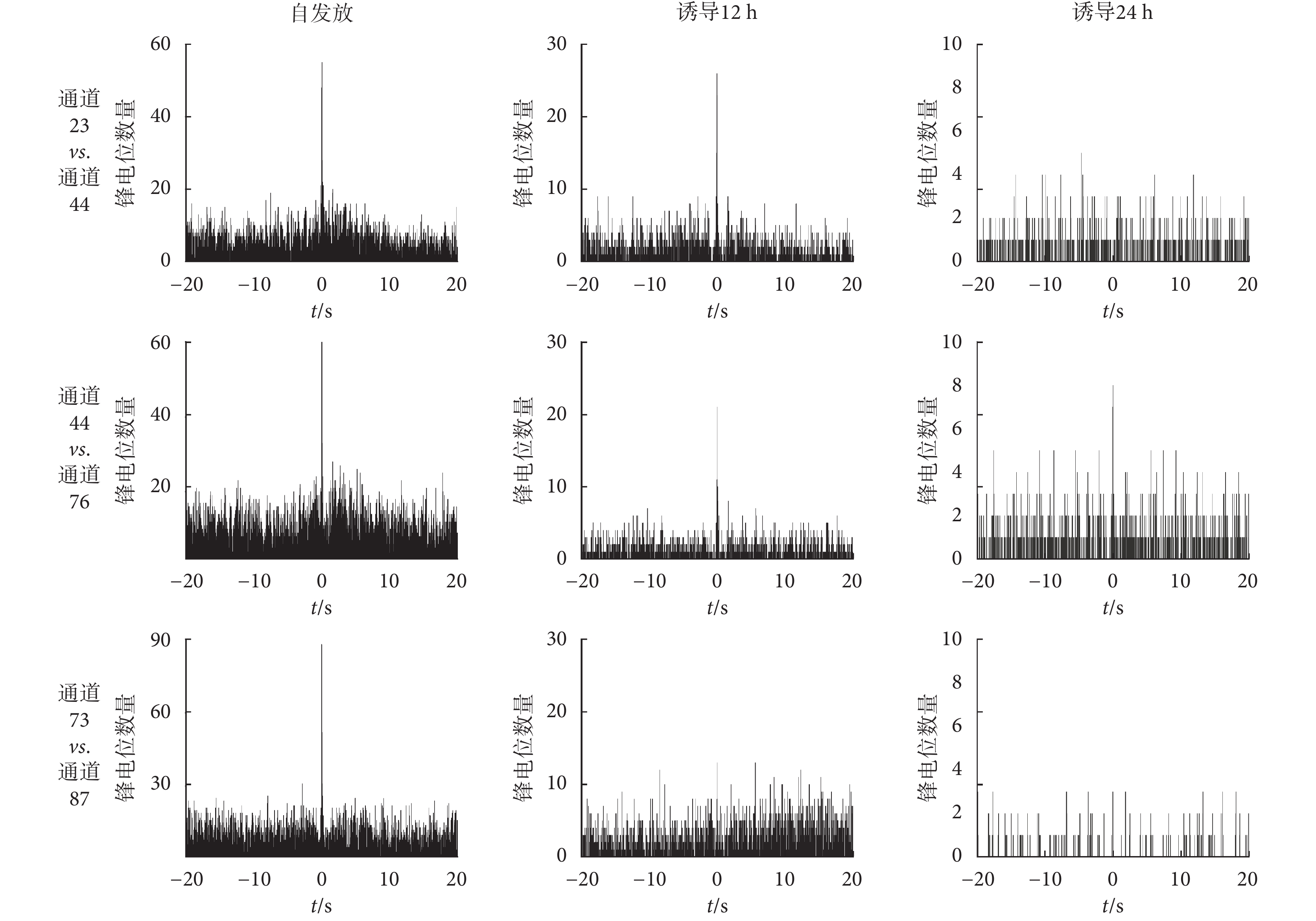 圖8
海馬神經元網絡通道間互相關性分析
Figure8.
Cross-correlation analysis of hippocampal neuronal network between different channels
圖8
海馬神經元網絡通道間互相關性分析
Figure8.
Cross-correlation analysis of hippocampal neuronal network between different channels
由自然發放狀態下各組通道之間自相關分析可知,通道 23 vs. 通道 44、通道 44 vs. 通道 76 記錄到的神經元發放同步但不存在明顯不應期,說明兩個電極點可能記錄到不同神經元的同步發放,而通道 73 vs. 通道 87 記錄到的神經元發放同步且存在不應期,說明兩個電極點記錄到同一個神經元的發放。
AβOs 誘導 12 h 后,通道 23 vs. 通道 44、通道 44 vs. 通道 76 仍有同步發放,但相關性明顯減弱,通道 73 vs. 通道 87 相關性消失。誘導 24 h 后,除了通道 44 vs. 通道 76 仍有微弱的同步發放,其余兩組通道之間均無相關性。AβOs 誘導后導致突觸可塑性降低乃至突觸丟失,使突觸的信息傳輸、加工,神經遞質的儲存、釋放、再攝取,以及遞質、受體、功能蛋白間相互作用的喪失,最終導致海馬神經元網絡之間的通信中斷、信號與營養因子的傳遞受阻。
3 結語
本文提出了一種基于神經網絡傳感芯片的 AD 體外病理模型及其實時動態分析方法,在 MEA 芯片上培養海馬神經元并形成網絡,使用 AβOs 誘導 AD 體外模型,同時測量神經元網絡的退行性生物電活動變化,實驗結果顯示該方法具有高通量、長時間、實時動態監測等優點。通過對鋒電位信號的分析,提取出正負尖峰間隔、發放率、峰峰值等多個特征參數,并對鋒電位進行了分類。記錄了 AβOs 誘導后,中間神經元和錐體神經元在 24 h 內的發放模式,12 h 后發放幅值與頻率逐漸減弱,24 h 后錐體神經元放電消失。AβOs 誘導可導致漸進性神經元網絡功能障礙,通過空間多位點發放圖譜和通道間的互相關性分析,評估神經元網絡連通性的退化。本文實驗結果證明該方法能夠檢測到 AβOs 的神經毒性作用,并分析驗證了神經元網絡通信功能的受損,今后或可成為一種高效實用的研究體外 AD 病理網絡模型的新型技術。
利益沖突聲明:本文全體作者均聲明不存在利益沖突。
引言
阿爾茨海默病(Alzheimer’s disease,AD)是一種慢性中樞神經退行性疾病,其主要臨床癥狀為短期記憶障礙和認知障礙等。隨著當今社會人口老齡化程度日益嚴峻,AD 的高發病率和高致殘率已成為影響人類健康的一個重要問題,而目前對 AD 的診斷和治療手段仍十分有限。AD 的主要病理特征為淀粉樣蛋白 β 低聚物(amyloid-β oligomers,AβOs)胞外沉積形成老年斑,以及 tau 蛋白過度磷酸化胞內積聚形成神經纖維纏結[1]。淀粉樣蛋白由 39~43 個氨基酸組成,這些氨基酸由淀粉樣前體蛋白生成[2]。AβOs 是淀粉樣蛋白聚集物的主要形式,突觸功能障礙和認知功能減退都與 AβOs 對突觸的毒性作用密切相關[3]。AβOs 打開了突觸上的電壓門控鈣通道,促進鈣離子大量內流,最終導致軸突運輸(如腦源性神經營養因子等物質)的功能受到損傷[4]。N-甲基-D-天冬氨酸(N-methyl-D-aspartic acid,NMDA)受體是興奮性突觸后膜上離子型谷氨酸受體的主要類型[5],AβOs 可與神經元表面含有 NMDA 受體的蛋白相結合并影響下游通路,從而誘導突觸毒性效應[6]。近年來,一些研究者通過 AβOs 誘導神經元或器官型腦片建立了 AD 體外病理模型[7-8],用于研究突觸可塑性和藥物機制等,為后續研究提供了基礎和思路。
除了淀粉樣蛋白對神經元造成損傷外,過度磷酸化的 tau 蛋白也發揮著毒性作用。tau 蛋白是一種結合神經元軸突微管的相關蛋白,能穩定微管并進行不同類型的翻譯后修飾,如磷酸化、糖基化、乙酰化、泛素化等。異常的超磷酸化可誘導 tau 蛋白構象變化和聚集,從而形成神經纖維纏結[9]。在 AD 模型的神經元網絡中,高度磷酸化的 tau 蛋白(phosphorylated tau,p-tau)從微管中分離,導致細胞骨架的穩定性下降[10-11]。此外,病理性的 tau 蛋白可通過其 N 末端序列與突觸小泡結合,最終導致突觸前功能中斷[12]。
膜片鉗和功能性光學成像等技術常被應用于研究離子通道和神經電活動。膜片鉗是電生理記錄的金標準,具有很高的靈敏度和特異性,但其通道數量有限,實驗要求高,難以揭示神經元網絡特征[13-15]。鈣離子成像可以描述多個單細胞的活動映射,但通常受到一些限制,如時間分辨率低、無法長時間連續在線記錄等[16]。微電極陣列(microelectrode array,MEA)能夠記錄大量跨膜離子傳輸所產生的細胞外膜動作電位,已成為研究神經元網絡電生理的新平臺[17-19],并具有多通道、時間分辨率高、可長期記錄和同步刺激等優點[20]。如 Amin 等[21]使用一種互補金屬氧化物半導體多電極陣列來檢測經 AβOs 誘導后神經網絡的早期活動變化和神經毒性影響。然而,他們并沒有研究 AβOs 對兩類神經元的不同影響,以及通道間的網絡通信與時間關聯性。為了克服這些局限性,一種基于神經網絡傳感芯片的 AD 體外病理模型及其實時動態分析方法被提出,通過設計制作 MEA 芯片,在修飾芯片表面后培養海馬神經元并形成網絡,使用 AβOs 誘導建立 AD 體外模型。基于該芯片,本文期望達到能夠多位點、長時間、實時動態地測量神經元電活動和網絡通信的目的,進一步利用空間發放圖譜和通道間互相關性評估神經元網絡的信號傳遞功能,為今后體外 AD 病理網絡模型研究提供一種新的手段。
1 材料與方法
1.1 材料與設備
本文所用材料包括:淀粉樣蛋白(Thermo Fisher 公司,美國);胰酶(Thermo Fisher 公司,美國);杜氏改良培養基(dulbecco’s modified eagle medium,DMEM)(Thermo Fisher 公司,美國);神經基礎培養基(Thermo Fisher 公司,美國);無血清培養基 B27(Thermo Fisher 公司,美國);谷氨酰胺(Thermo Fisher 公司,美國);青霉素—鏈霉素(Thermo Fisher 公司,美國);阿糖胞苷(Sigma 公司,美國);六氟-2-丙醇(Sigma 公司,美國);胰蛋白酶(Sigma 公司,美國);多聚賴氨酸(Sigma 公司,美國);層粘連蛋白(Sigma 公司,美國);多聚甲醛(國藥集團化學試劑有限公司,中國);聚乙二醇辛基苯基醚 Triton X-100(上海阿拉丁生化科技股份有限公司,中國);牛血清白蛋白(albumin from bovine serum,BSA)(國藥集團化學試劑有限公司,中國);山羊血清(武漢博士德生物工程有限公司,中國);微管相關蛋白 2(microtubule-associated proteins 2,MAP2)一抗(Proteintech Group,美國);p-tau 蛋白一抗(Cell Signaling Technology,美國);Alexa Fluor 二抗(Beyotime Biotechnology,中國)。
本文所用設備包括:二氧化碳培養箱(Heracell 150i,Thermo Fisher 公司,美國);離心機(SpeedVac,Thermo Fisher 公司,美國);激光共聚焦熒光顯微鏡(AiR,Nikon 公司,日本);MEA 記錄系統(Classic MEA-System,Multi Channel Systems 公司,德國)。
1.2 MEA芯片與記錄系統
MEA 芯片由多通道組成,用于大數據采集并記錄來自神經元網絡的電活動信號。MEA 系統模式示意圖如圖1 所示,神經元生長在芯片表面后,自發或興奮性刺激產生胞內外 K+、Na+離子的大量交換,產生動作電位并改變胞外膜電位。圖1 中 Z 為電極—電解液界面雙電層阻抗,此處電壓接近細胞膜附近的電壓,細胞膜電位變化直接影響該點電壓。信號由電極點記錄后傳輸至放大器,再經數據采集卡轉換后傳輸至個人計算機(personal computer,PC)進行顯示和分析。系統包含溫度控制模塊和刺激模塊,對 MEA 芯片控溫在 37℃,并可編寫不同幅值、頻率的刺激序列施加在任一電極點上,并同步記錄所有通道的刺激后響應。
 圖1
MEA 檢測系統原理圖
Figure1.
The schematic diagram of the MEA detection system
圖1
MEA 檢測系統原理圖
Figure1.
The schematic diagram of the MEA detection system
MEA 芯片采用微機電系統工藝制作,加工流程如圖2 所示,具體步驟為:① 選取四英寸硅片(厚約 450 μm),將一層 30 nm 鉻層和一層 300 nm 金層分別沉積到玻璃基底上,作為黏附層和電極層;②~⑤ 使用光蝕刻技術蝕刻出電極位點和引線的布局;⑥ 使用等離子増強型化學氣相沉積(plasma-enhanced chemical vapor deposition,PECVD)在芯片表面沉積一層 1 μm 的 Si3N4 作為純化層;⑦~⑨ 使用反應離子刻蝕技術(reaction ion etching,RIE)暴露出電極和焊盤對應處的 Si3N4,之后使用 KOH 溶液將 Si3N4 刻蝕掉,露出電極位點和焊盤并清洗光刻膠;⑩ 使用計時安培法在 MEA 電極表面電鍍鉑黑,完成 MEA 芯片加工。該 MEA 芯片共有 60 個工作電極,成 8×8 方形陣列排布,單個電極直徑為 30 μm,電極間距為 200 μm,對每個電極點按從上到下、從左到右的順序進行編號(1~60),以便于數據分析與結果展示。電鍍鉑黑后,電極點比表面積增加,電極阻抗降低,以提高信噪比。使用金線將芯片上的焊盤和印制電路板(printed circuit board,PCB)上的接口連接,使用生物相容性良好的聚二甲基硅氧烷(polydimethylsiloxane,PDMS)制作直徑 1.5 cm、高度 1 cm 的腔室固定在芯片上,用于細胞培養。為評估電極表面特性,本文采用電化學交流阻抗譜驗證 MEA 電極電鍍鉑黑之后的效果。選擇 MEA 芯片上的任一通道為工作電極,外置銀—氯化銀電極為參比電極,在培養腔中加入 pH 值 7.4 的磷酸緩沖鹽(phosphate buffer saline, PBS)溶液,外加振幅為 5 mV 的正弦激勵,評估 MEA 電極點阻抗譜變化。結果顯示,裸金電極的阻抗幅值高達 5~10 kΩ;電鍍鉑黑后,阻抗幅值降至 1 kΩ 以下。當使用 MEA 芯片記錄電生理信號時,裸金電極基線幅度達上百微伏,且極易受外界干擾,而電鍍鉑黑后,基線幅值減小至 40 μV 以內且基線平穩。
 圖2
MEA 芯片加工流程
Figure2.
The general process for MEA chip fabrication
圖2
MEA 芯片加工流程
Figure2.
The general process for MEA chip fabrication
1.3 AβOs的制備
打開裝有冷凍淀粉樣蛋白的肽瓶,在室溫下平衡 30 min。將淀粉樣蛋白重新懸浮在低溫的六氟-2-丙醇中,振蕩幾秒后迅速將該混合溶液等分為三個聚丙烯小瓶。在室溫下孵育 2 h,以使淀粉樣蛋白單體化。在室溫下使用離心機(800 g)濃縮溶液,直到在小瓶底部觀察到清晰的肽膜。此后,通過二甲基亞砜溶液使肽膜重新懸浮以獲得 5 mmol/L 濃度的母液,并將小瓶密封并在 ? 20℃ 下儲存。實驗前,使用 100 μL 的 0.01 mol/L 的 PBS 稀釋母液,振蕩 30 s 后在 4℃ 環境下孵育 12 h。當誘導細胞時,將溶液加入神經元培養基中,并確保最終濃度為 500 nmol/L。
1.4 海馬神經元培養
所有涉及動物的實驗均按照浙江大學動物實驗委員會的倫理準則進行,且已通過動物倫理審查委員會的審查。妊娠 SD 大鼠來自浙江省醫學科學院。為了提高 MEA 芯片的生物相容性,使用多聚賴氨酸和層粘連蛋白混合溶液在 4℃ 下包被芯片表面 12 h。取胎鼠的海馬組織,在 37℃ 下輕輕切碎組織并用 0.25 % 胰蛋白酶消化 15 min。分離出的原代海馬神經元細胞,在 MEA 芯片表面以 5×105個/孔的密度接種,培養液為含 10 % 馬血清的 DMEM。同時,在 24 孔板上以 1×104個/cm2的密度接種,用于后期進行免疫熒光成像。芯片和 24 孔板均在 37℃ 含 5% 二氧化碳的培養箱中保存。接種 4 h 后,用神經基礎培養基(含有 2 % B27、1 % 谷氨酰胺和 0.4 % 青霉素—鏈霉素)代替接種培養基。在培養 3 d 后,加入終濃度為 2.5 μm 的阿糖胞苷,每隔 2~3 d 進行半量換液。在培養的第 13 d 使用 AβOs 誘導神經元,并使用 MEA 記錄神經元網絡的電生理變化。誘導 12 h 后,對 24 孔板中的細胞進行免疫熒光染色。
1.5 免疫熒光染色
24 孔板中的細胞在室溫下使用 4 % 多聚甲醛固定 30 min 后,使用 PBS 洗滌 3 次。使用 0.15 % Triton X-100 滲透 15 min,并在 37℃ 下用 1 % BSA 封閉液培養 30 min。然后在 4℃ 下使用 MAP2 和 p-tau 蛋白的一級抗體孵育 12 h,接著在室溫下使用 Alexa Fluor 二級抗體孵育 2 h,最后使用 4', 6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)染色法對細胞核染色并貼于玻片上。用 1 % Triton X-100、5 % 山羊血清和 1 % BSA 溶液稀釋 MAP2 蛋白和 p-tau 蛋白一抗,稀釋率分別為 1∶250 和 1∶200。使用 PBS 稀釋 Alexa Fluor 二抗,稀釋率為 1∶500。利用激光共聚焦熒光顯微鏡對熒光圖像進行了采集。
1.6 軟件與數據分析
本文使用 MEA 記錄軟件 MC_Rack(Multi Channel Systems 公司, 德國)記錄和顯示 MEA 數據。使用 MEA 數據處理軟件 Offline Sorter V4(Plexon 公司, 美國)和 NeuroExplorer 5(Plexon 公司, 美國)將原始信號經 Bessel 4 階高通濾波器(截止頻率:250 Hz)濾波后,選取信噪比大于 3 的通道作為有效信號通道,計算各有效信號通道的正負峰間隔、發放率和峰峰值,對自發動作電位波形進行分類。本研究中的所有數據均以均值±標準差表示。使用 t 檢驗評估組間差異的統計學意義,P < 0.05 表示差異具有統計學意義。
2 結果與分析
2.1 海馬神經元網絡生長與免疫熒光成像
MEA 芯片及海馬神經元網絡在芯片表面和電極點上的生長狀況如圖3 所示。顯微鏡下可觀察到電極點陣列的排布,海馬神經元培養 14 d 后,可觀察到胞體、軸突和樹突生長在單個電極點表面,且海馬神經元已相互連接形成網絡,覆蓋在 MEA 芯片表面,表明 MEA 芯片表面具有良好的生物相容性,可在電極上檢測到有效信號并分析神經元網絡通信狀態。
 圖3
MEA 芯片及海馬神經元網絡生長狀況
Figure3.
Physical map of MEA chip and growth state of hippocampal neuron network
圖3
MEA 芯片及海馬神經元網絡生長狀況
Figure3.
Physical map of MEA chip and growth state of hippocampal neuron network
為了驗證 AβOs 對神經元網絡的影響,在體外培養 13 d 后,本文通過對樹突的 MAP2 和 p-tau 蛋白進行標記來觀察細胞形態和結構的變化,海馬神經元免疫熒光成像分析如圖4 所示。由 MAP2 的免疫熒光染色顯示,經 AβOs 誘導 12 h 后,神經元細胞出現了軸突變性和樹突受損,原本光滑連續的樹突斷裂為片段或斑點。此外,由 p-tau 蛋白的免疫熒光染色顯示,AβOs 誘導 12 h 后,部分神經元細胞的 p-tau 蛋白含量顯著增加(白色箭頭),這證實了部分 tau 蛋白發生過度磷酸化并聚集,這與 AD 退化神經元中觀察到的現象相似。
 圖4
海馬神經元免疫熒光成像分析
Figure4.
Immunofluorescence image analysis of hippocampal neuron
圖4
海馬神經元免疫熒光成像分析
Figure4.
Immunofluorescence image analysis of hippocampal neuron
2.2 海馬神經元發放模式
當海馬神經元網絡在 MEA 芯片上生長達 13 d 時,記錄海馬神經元自發放電狀態下的胞外信號并進行特征提取與分類。選取信噪比較高的通道 23 和通道 76 為示例,記錄到典型有效原始信號如圖5 所示,垂直比例尺代表幅值,水平比例尺代表時間。由圖可知,信號基線小于 20 μV,鋒電位幅度大于 100 μV,信噪比大于 5,說明 MEA 芯片能有效記錄神經元的胞外電位信號。選擇三倍 sigma 作為閾值檢測每個通道的峰值,提取波形、正負峰間期、峰峰值、發放率等特征參數,分類得到 4 種鋒電位。由于中間神經元間正負峰間期一般小于 500 μs,而錐體神經元的正負峰間期均大于 700 μs[22],因此 3 種鋒電位來源于中間神經元的放電,另一種鋒電位由錐體神經元放電產生。提取出的不同神經元發放的鋒電位波形如圖5 所示。生長在電極點上的神經元胞體或軸突、樹突位置與數量不同,故在同一電極點上可能記錄到同一種神經元的不同發放波形。由 AβOs 誘導后,樹突棘的數量逐漸減少,突觸蛋白丟失增多,神經遞質受體表面表達受損,同時伴隨著興奮性突觸后電流的減少和突觸可塑性的降低。如圖6 所示顯示了經 AβOs 誘導 12 h 與 24 h 后,不同神經元發放鋒電位歸一化后的幅值和頻率的變化。結果顯示,幅值和頻率均明顯降低,其中誘導 12 h 和 24 h 的發放幅值和頻率相較于自發放其差異均有統計學意義(P < 0.05);且誘導 24 h 的發放頻率相較于 12 h,其差異也具有統計學意義(P < 0.05)。
 圖5
海馬神經元發放有效信號與鋒電位分類
Figure5.
Effective signals of hippocampal neurons firing and spike classification
圖5
海馬神經元發放有效信號與鋒電位分類
Figure5.
Effective signals of hippocampal neurons firing and spike classification
 圖6
AβOs誘導前后發放幅值與頻率變化統計圖(n = 9,n 表 示有效信號通道數)*P < 0.05
Figure6.
Statistical chart of amplitude and frequency changing before and after treatment with AβOs (n = 9, n indicates the number of channels with effective signals) *P < 0.05
圖6
AβOs誘導前后發放幅值與頻率變化統計圖(n = 9,n 表 示有效信號通道數)*P < 0.05
Figure6.
Statistical chart of amplitude and frequency changing before and after treatment with AβOs (n = 9, n indicates the number of channels with effective signals) *P < 0.05
2.3 海馬神經元網絡發放圖譜
利用 MEA 空間多位點同時記錄的特性,繪制海馬神經元網絡發放圖譜,觀察誘導前后的變化,以檢測神經退行性變、網絡連接和通信中斷等 AD 模型的主要病理改變。MEA 芯片同時記錄到的神經元網絡多位點電信號如圖7 所示。自發放電狀態中,60 個通道中 34 個通道記錄到基線信號,26 個通道記錄海馬神經元網絡的有效放電信號。其中,23 個通道記錄到中間神經元的發放鋒電位(橙色、藍色、紫色),6 個通道記錄的鋒電位來源于錐體神經元(綠色),且有 7 個通道同時記錄到兩類鋒電位發放,1 個通道同時記錄到三類鋒電位發放,神經元網絡生長狀態良好,且 MEA 陣列可有效記錄到神經元網絡中多位點的發放信號。
 圖7
空間多位點海馬神經元網絡發放圖譜
Figure7.
Spatial multi-site hippocampal neuronal network firing map
圖7
空間多位點海馬神經元網絡發放圖譜
Figure7.
Spatial multi-site hippocampal neuronal network firing map
AβOs 誘導海馬神經元網絡 12 h 后,有效信號通道數下降為 12,剩余有效信號通道的鋒電位發放幅值和頻率均減少。誘導 24 h 后,僅剩 6 個通道含有有效信號,且發放頻率幅值明顯降低。此外,12 h 后,錐體神經元發放通道僅存 3 個,24 h 后錐體神經元放電完全消失,僅剩下中間神經元發放。這是由于錐體神經元是 AD 發病機制和認知功能障礙的核心[23],神經纖維纏結的形成和淀粉樣前體蛋白代謝失調和退化多發于錐體神經元,使得錐體神經元的電生理活性受到更嚴重的影響。
2.4 神經元網絡關聯性分析
基于 MEA 的神經元網絡芯片還可挖掘各點信號之間的關系和特點,并能考察細胞與細胞信息之間的同步性和平行關系。3 組相近通道神經元發放的互相關分析如圖8 所示,橫軸為鋒電位間隔時間,縱軸為鋒電位數量,該圖反應了兩個通道神經元發放之間時間的關聯性。如果互相關直方圖平坦無規律,則兩個放電序列視為各自獨立的過程;如果互相關函數在 0 時刻出現峰值,則兩個神經元有出現同步放電的趨勢,兩者存在共同輸入或突觸連接,其他形狀則為相互促進或者抑制關系等。
 圖8
海馬神經元網絡通道間互相關性分析
Figure8.
Cross-correlation analysis of hippocampal neuronal network between different channels
圖8
海馬神經元網絡通道間互相關性分析
Figure8.
Cross-correlation analysis of hippocampal neuronal network between different channels
由自然發放狀態下各組通道之間自相關分析可知,通道 23 vs. 通道 44、通道 44 vs. 通道 76 記錄到的神經元發放同步但不存在明顯不應期,說明兩個電極點可能記錄到不同神經元的同步發放,而通道 73 vs. 通道 87 記錄到的神經元發放同步且存在不應期,說明兩個電極點記錄到同一個神經元的發放。
AβOs 誘導 12 h 后,通道 23 vs. 通道 44、通道 44 vs. 通道 76 仍有同步發放,但相關性明顯減弱,通道 73 vs. 通道 87 相關性消失。誘導 24 h 后,除了通道 44 vs. 通道 76 仍有微弱的同步發放,其余兩組通道之間均無相關性。AβOs 誘導后導致突觸可塑性降低乃至突觸丟失,使突觸的信息傳輸、加工,神經遞質的儲存、釋放、再攝取,以及遞質、受體、功能蛋白間相互作用的喪失,最終導致海馬神經元網絡之間的通信中斷、信號與營養因子的傳遞受阻。
3 結語
本文提出了一種基于神經網絡傳感芯片的 AD 體外病理模型及其實時動態分析方法,在 MEA 芯片上培養海馬神經元并形成網絡,使用 AβOs 誘導 AD 體外模型,同時測量神經元網絡的退行性生物電活動變化,實驗結果顯示該方法具有高通量、長時間、實時動態監測等優點。通過對鋒電位信號的分析,提取出正負尖峰間隔、發放率、峰峰值等多個特征參數,并對鋒電位進行了分類。記錄了 AβOs 誘導后,中間神經元和錐體神經元在 24 h 內的發放模式,12 h 后發放幅值與頻率逐漸減弱,24 h 后錐體神經元放電消失。AβOs 誘導可導致漸進性神經元網絡功能障礙,通過空間多位點發放圖譜和通道間的互相關性分析,評估神經元網絡連通性的退化。本文實驗結果證明該方法能夠檢測到 AβOs 的神經毒性作用,并分析驗證了神經元網絡通信功能的受損,今后或可成為一種高效實用的研究體外 AD 病理網絡模型的新型技術。
利益沖突聲明:本文全體作者均聲明不存在利益沖突。