軟骨細胞作為一種力學效應細胞,在體內多軸載荷的刺激下,能夠產生多種物理化學信號,從而影響自身的生長、發育和凋亡。為此,模擬體內力學環境成為體外培養軟骨細胞的一大研究熱點。雖然大量報道已充分證明不同機械刺激能夠調控軟骨細胞代謝,但對其加載方案尚未達成一致。本篇綜述將從不同機械形式出發,探討不同機械刺激調控軟骨細胞代謝的差異性,從而尋找促進軟骨細胞生長增殖的優勢方案,以制定更為穩定、有效和可靠的實驗策略。
引用本文: 楊光露, 郭楊, 涂鵬程, 吳承杰, 潘婭嵐, 馬勇. 不同機械刺激調控軟骨細胞代謝的研究進展. 生物醫學工程學雜志, 2020, 37(6): 1101-1108. doi: 10.7507/1001-5515.202001044 復制
版權信息: ?四川大學華西醫院華西期刊社《生物醫學工程學雜志》版權所有,未經授權不得轉載、改編
引言
關節軟骨(articular cartilage,AC)內在修復能力有限,因此一旦損傷就難以恢復。雖然臨床用于治療關節軟骨損傷的方法有很多,包括軟骨下骨鉆孔術、全關節置換術以及微骨折術等多種方式,但仍存在諸多缺點。近年來,隨著軟骨組織工程(cartilage tissue engineering,CTE)的發展,自體軟骨移植術得到了廣泛應用,但體外培養的軟骨細胞(chondrocyte,CC),其生物力學特性與天然軟骨存在較大差異。天然軟骨在關節運動過程中會與關節腔內的液體產生多種機械刺激,這些機械刺激可以通過細胞外基質(extracellular matrix,ECM)周圍的機械傳感器傳遞機械信號,從而直接或間接調控 CC 的活性和行為[1]。
由于體內機械環境的復雜性和 CC 對機械刺激的高度敏感性,如何模擬體內的機械環境使之達到對 CC 代謝的積極效應,成為目前體外培養 CC 的一大難點[2]。因此,為了進一步研究機械刺激對 CC 代謝的影響,本綜述將從不同機械形式出發,闡述牽張力、靜水壓力、流體剪切力、壓縮力、低強度脈沖超聲、微重力、電磁場對 CC 分化代謝的作用,從而尋求并優化培養組織工程 CC 的潛在策略。
1 主要機械刺激
1.1 牽張力
牽張力(tensile strain,TS)是體內最為常見的內力,是近年來研究的熱點[3]。有報道表明低強度(0~1%)應變、1 Hz 的 TS 能夠促進骨髓間充質干細胞(bone mesenchymal stem cells,BMSCs)向 CC 分化,且軟骨形成標志物的表達隨時間的延長而上調[4]。也有研究發現加載中強度(2%~10%)應變、0.16~0.5 Hz 的 TS 可以促進 CC 合成[5-7]。一些學者認為這可能是通過激活單磷酸腺苷激活的蛋白激酶(adenosine monophosphate-activated protein kinase,AMPK)和抑制核因子 κB(nuclear factor kappa-B,NF-κB)-p65 的核轉運來減輕軟骨損傷[8]。但 Zhong 等[9]對兔 CC 進行 10% 應變的 TS 后,卻發現 CC 表型被破壞,這可能與 TS 激活粘附斑激酶(focal adhesion kinase,FAK)-絲裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)信號,從而上調炎癥因子的表達有關[10]。Liu 等[7]表明在中度 TS 加載下,淺層 CC 更能維持細胞表型,延緩細胞衰老。而高強度(> 10%)應變、0.5 Hz 的 TS 常常會抑制 CC 表型的形成,引起基質的降解[6, 11-12]。但 Lohberger 等[13]發現交替加載低、高強度的 TS 反而能夠顯著減少基質的降解,從而降低對 CC 表型的破壞。如何聯合加載低、中、高強度的 TS 使之促進 CC 增殖還需要廣大研究者的不斷探索。關于 TS 對體外 CC 代謝的影響詳見表 1。
1.2 靜水壓力
靜水壓力(hydrostatic pressure,HP)是作用于 CC 的主要力學刺激之一。低 HP(0~10 MPa)能夠通過整聯蛋白-FAK-細胞外調節蛋白激酶(extracellular regulated protein kinases,ERK)/磷脂酰肌醇-3 激酶(phosphatidylinositol 3-kinase,PI3K)途徑增強 CC 活性并減少其凋亡[14]。姚旺祥等[15]認為它還可以減少 MAPK 信號通路蛋白的表達來保護 ECM 的合成。研究表明高 HP(> 10 MPa)會顯著增加應激及凋亡相關基因的表達,特別是加載 4 h 后,不利于維持細胞表型和基質的合成[16]。
單獨施加 HP,比微重力(microgravity,MG)和流體剪切力(fluid shear stress,FSS)更能促進 ECM 的形成,甚至比 HP 和偏應力的聯合使用更能促進 CC 表型形成,但三者皆有軟骨保護作用,可以通過下調 COL10 的表達來抑制細胞肥大,減少細胞凋亡[17-19]。部分研究表明短時間(1~4 h/d)內加載的低 HP 對促進 CC 形成或抑制 CC 肥大來說可能是優勢參數[17-18, 20]。另外,Ogura 等[21]發現重復間歇加載 HP 對 CC 的合成代謝和活性的影響可能更大。如果在短時間內進行重復間歇加載是否會對 CC 更有利目前尚無研究,未來可進一步探索。關于 HP 對體外 CC 代謝作用的影響詳見表 2。
1.3 流體剪切力
當關節處于運動狀態時,被擠壓的滑液對 CC 表面會產生 FSS。研究表明低強度(< 10 dyn/cm2)FSS 能夠抑制白介素-1β(interleukin-1β,IL-1β)激活的 NF-κB,保護軟骨運動[22]。但 Zhang 等[23]發現對正常 CC 加載低強度 FSS,會引起 CC 的終末分化和纖維化,說明 FSS 對正常 CC 沒有治療作用。Su 等[24]在研究 FSS 對抵抗素誘導的環氧化酶(cyclooxygenase,COX)-2 的作用時發現,在抵抗素誘導前后加載 FSS,COX2 的表達呈相反趨勢,說明 FSS 對 CC 代謝的影響是多方向的。有報道認為中強度(> 12 dyn/cm2)FSS 會促進基質降解,抑制 CC 表型合成[23]。Adeniran-Catlett 等[25]卻表示中強度 FSS 的施加并不會抑制 BMSCs 向 CC 分化的能力。
Kuang 等[26]表明高強度(> 20 dyn/cm2)FSS 會導致 CC 退化,促進破骨細胞性骨吸收。有學者在 BMSCs 上也發現了類似的結論,認為高強度 FSS 會抑制軟骨表型的形成,引起 CC 退化[27]。另外,CS 和 FSS 在一定參數下聯合加載能夠增強 CC 表型,刺激 ECM 產生[27-28]。DiFederico 等[29]驗證了上述觀點,還發現雙軸刺激更能提高 CC 的生物合成活性。研究表明旋轉引起的 FSS 比平移引起的更能促進基質的合成[30]。接下來我們可以研究多軸加載或不同形式引起的 FSS 對 CC 活性的具體作用機制。關于 FSS 對 CC 代謝的影響詳見表 3。
1.4 壓縮力
當關節移動時,關節面的相互觸碰擠壓導致軟骨關節面上下受力形成壓縮力(compression stress,CS)。研究表明中度動態 CS(30~40 psi)能夠促進 ECM 合成,超過 40 psi 的靜態 CS 則表現為 ECM 降解,甚至出現炎癥跡象的骨關節炎(osteoarthritis,OA)樣 CC,這表明低于 40 psi 的動態 CS 對培養 CC 更有利[31]。Diao[32]也表示動態 CS 能夠刺激性別決定基因盒 9(sex-determining region Y box 9,SOX9)和下調基質金屬蛋白酶(matrix metalloproteinase,MMP)13 的表達來抑制分解代謝。
一些學者認為在低應變(< 20%)下,CS 能夠促進未分化細胞向 CC 分化[33-34]。而在高應變(> 20%)下,CS 會引起細胞肥大和纖維化,促進炎癥的產生[35]。但 Scholtes 等[36]發現間歇加載和轉化生長因子-β1(transforming growth factor-β,TGF-β1)似乎能夠緩解高應變 CS 對 CC 表型的破壞,甚至能夠通過 MAPK、Wnt 和 Notch 信號通路的相關因子上調 SOX9 的表達。還有研究發現短時間的加載培養(1~4 h/d)比長時間(> 12 h/d)更能促進 ECM 的合成[37]。
Iseki 等[38]認為動態 CS 比 FSS 更能促進微骨折中新組織軟骨的生成和成熟。Scholtes 等[36]在基因調控上也發現了類似的趨勢,動態 CS 能夠顯著提高 SOX9 和骨形態發生蛋白(bone morphogenetic protein,BMP)的基因表達,對早期軟骨的形成具有重要意義。未來可以進一步探索動態 CS 對 CC 去分化的機制研究。關于 CS 對體外 CC 代謝的影響詳見表 4。
2 其他機械刺激
2.1 低強度脈沖超聲
低強度脈沖超聲(low intensity pulsed ultrasound,LIPUS)能夠產生機械振動作用,促進細胞生長。大量研究已經證明 LIPUS 具有治療軟骨損傷的潛力,能夠緩解軟骨變形,促進骨折愈合[39-44]。Ito 等[45]表明高于 200 mW/cm2的 LIPUS 可導致細胞死亡,低于 120 mW/cm2的 LIPUS 可以促進軟骨細胞存活。其中,強度小于 100 mW/cm2、振蕩頻率 1.5 MHz ± 10%、脈沖頻率 1 kHz、20 min/d 的 LIPUS 已得到廣泛的研究和應用[46-50]。Uddin 等[46]發現無論有沒有 IL-1β 的刺激,LIPUS 都能維持軟骨表型甚至提高 ECM 的合成,LIPUS 本身是否對細胞骨架或軟骨再生有一定的積極作用還需要進一步的研究。
LIPUS 可以使鈣離子通過瞬時感受器電位離子通道香草素受體亞家族(transient receptor potential vanilloid,TRPV)4 內流并激活 MAPK 信號通路,促進結締組織生長因子(CCN family protein 2/connective tissue growth factor,CCN2/CTGF)的產生,從而促進軟骨再生[47],抑制 IL-1β 誘導的 NF-κB-p65 磷酸化來緩解基質的降解[46],或刺激蛋白激酶 B(protein kinase B,Akt)磷酸化激活 PI3K/Akt 轉導通路來促進 ECM 的合成[48],這些信號通路都為 OA 的治療提供了新的思路,將來的研究中還需要廣大學者的探索和發現。
2.2 微重力
MG 會嚴重影響軟骨的完整性,所以失重對 CC 的影響不可忽略[51]。由于飛行試驗的昂貴和有限性,國內外對體內 MG 的相關研究較少。目前較為認可的地面模擬 MG 的生物反應器有隨機定位機(random positioning machine,RPM)、旋轉細胞培養系統(rotary cell culture system,RCCS)和旋轉壁式生物反應器(rotating wall vessel,RWV)等。我們發現在模擬 MG 過程中,不同轉速、角度、持續時間對細胞產生的力學大小及影響在很大程度上尚不明確。
研究表明在 MG 下,CC 聚集成團且呈懸浮狀態時,比貼壁狀態更有利于維持軟骨表型[52]。Mellor 等[18]發現 MG 能夠抑制 ASCs 向 CC 分化,且與 Wnt 信號通路密切相關。但在加入誘導因子或細胞基質衍生物后促進了 BMSCs 向 CC 分化,這表明 MG 環境可能不利于細胞分化,需要在外源性因子的干預下才有促分化能力[53-54]。有報道稱通過 30 d 的 MG,CC 表現出聚集蛋白多糖(aggrecan,ACAN)的減少,但膠原纖維仍保持完整,這說明 30 d 內的軟骨退變是可能逆轉的[55],但對更長時間的 MG 培養及相關機制并無進一步的研究,廣大學者將來可以做深入的探索。
2.3 電磁場
電磁場(electromagnetic field,EMF)是一種在較高頻率下能夠刺激生物組織中生物電流的電磁能[56]。目前大多數 EMF 對軟骨細胞的研究采用每天 30 min 至 8 h 的加載時間,0.4~5 mT 場強,頻率小于 100 Hz[56-57]。
Anbarasan 等[57]對超低場強(0.65~1.95 μT)EMF 進行研究,發現 CC 活性與場強呈正相關。Parate 等[58]對低場強(0~5 mT)EMF 做了更細致的研究,發現 2 mT、10 min 是間充質干細胞(mesenchymal stem cells,MSCs)向 CC 分化的優勢參數,而長期反復加載反而不利于 CC 形成,這可能與 EMF 在 CC 形成的早期和晚期激活了不同的鈣離子內流途徑[如瞬時受體電位離子通道(transient receptor potential ion channels,TRPs)]有關。Escobar 等[59]對 2 mT EMF 進行了不同時間的加載,發現加載 3 h 可以促進 CC 增殖,5 h 可以促進糖胺聚糖(glycosaminoglycan,GAG)合成。以上研究表明 2 mT 場強是 CC 的優勢參數,接下來研究人員可以就更長的加載時間探索 EMF 對 CC 代謝的影響。
有學者表明 EMF 刺激對退化或不理想的 CC 更加有效,這說明 EMF 效應不僅與 EMF 有關,還與細胞質量有關[60]。Zhou 等[61]對 OA 鼠模型進行 EMF 后發現,EMF 對 CC 的有效作用可能是通過調節 MMP13 和部分通過抑制 MAPK 信號途徑來介導的。將來學者可以就這一效應的臨床相關性進行下一步的研究。
3 總結與展望
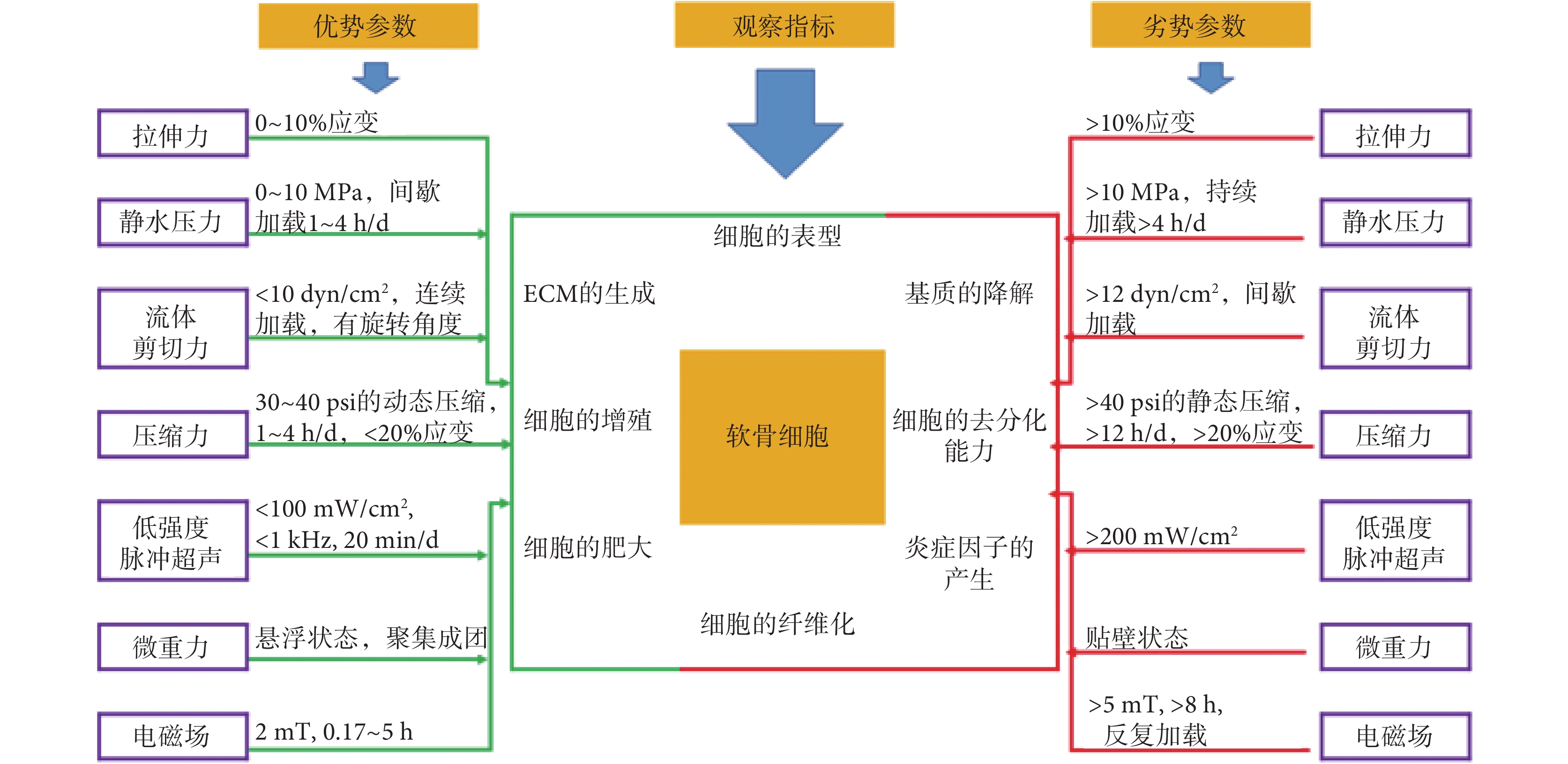
綜上所述,機械刺激對軟骨細胞內穩定的發展和維持起到舉足輕重的作用,尤其在調控軟骨細胞代謝的過程中(見圖 1)。構建一個功能性軟骨模型首先應滿足細胞代謝的要求,其次在模擬關節運動時,對軟骨施加合適的機械刺激,實現其功能構建。在體外研究中,總結與軟骨發育、分化和代謝相關的力學物理參數,有助于開發更為精準的軟骨替代策略,同樣也有助于最大限度地誘導軟骨形成,促進 CC 的增殖以加快修復軟骨損傷。
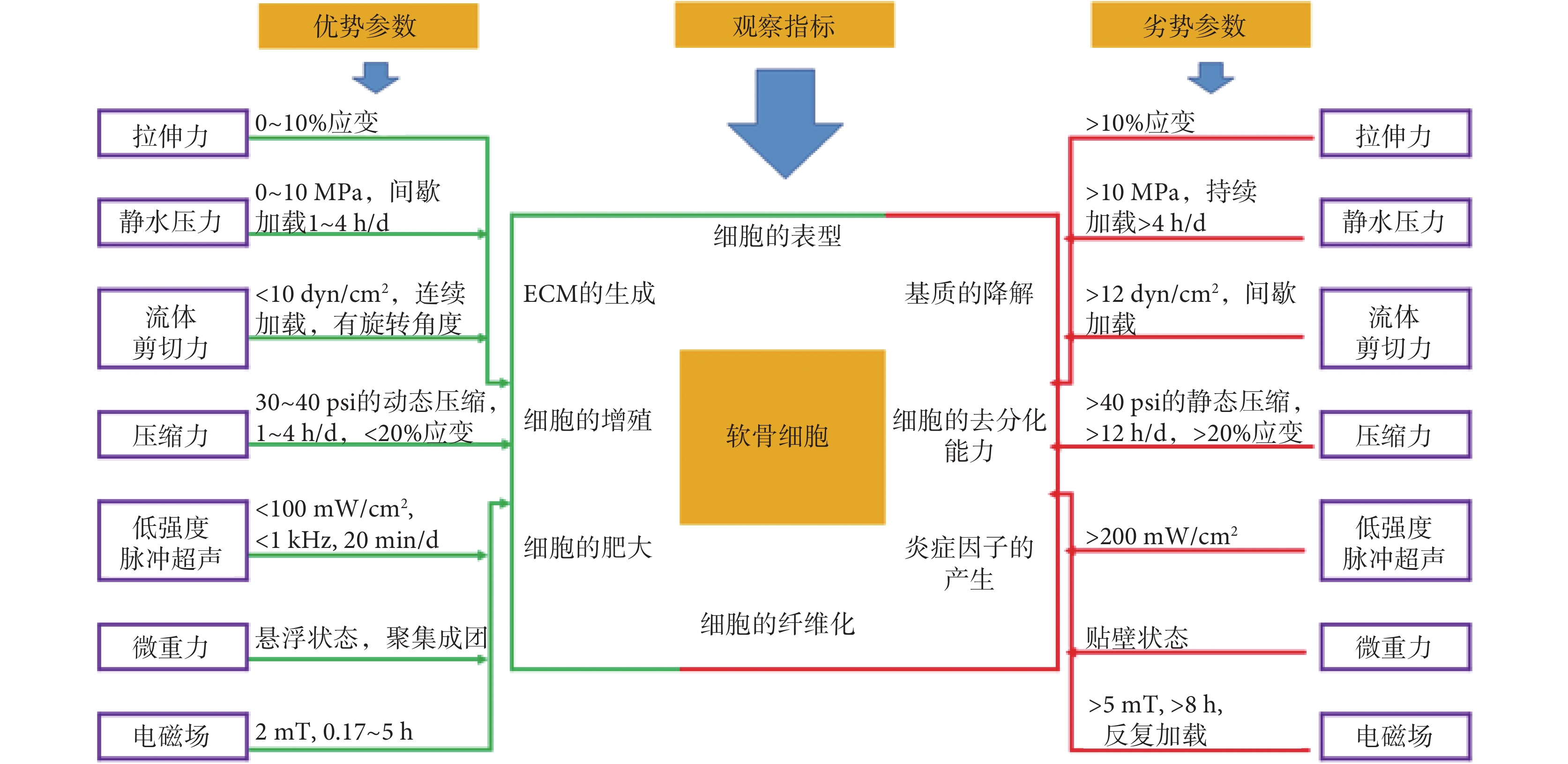 圖1
機械刺激調控軟骨細胞代謝的加載參數
Figure1.
Loading parameters of mechanical stimulation for regulating chondrocyte metabolism
圖1
機械刺激調控軟骨細胞代謝的加載參數
Figure1.
Loading parameters of mechanical stimulation for regulating chondrocyte metabolism
然而,由于體外實驗的局限性,仍有一些問題尚待解決:(1)雖然大量文獻已經表明適當的機械刺激可改善 CC 表型或促進 CC 增殖,但仍無法完全模擬體內 CC 的力學環境。(2)由機械刺激引起的 CC 相關基因及蛋白表達的改變,其機制尚不完全明了。(3)軟骨細胞所處的生化微環境也是一個重要而復雜的影響因素,應當充分考慮機械和生化因素的協同作用。
利益沖突聲明:本文全體作者均聲明不存在利益沖突。
引言
關節軟骨(articular cartilage,AC)內在修復能力有限,因此一旦損傷就難以恢復。雖然臨床用于治療關節軟骨損傷的方法有很多,包括軟骨下骨鉆孔術、全關節置換術以及微骨折術等多種方式,但仍存在諸多缺點。近年來,隨著軟骨組織工程(cartilage tissue engineering,CTE)的發展,自體軟骨移植術得到了廣泛應用,但體外培養的軟骨細胞(chondrocyte,CC),其生物力學特性與天然軟骨存在較大差異。天然軟骨在關節運動過程中會與關節腔內的液體產生多種機械刺激,這些機械刺激可以通過細胞外基質(extracellular matrix,ECM)周圍的機械傳感器傳遞機械信號,從而直接或間接調控 CC 的活性和行為[1]。
由于體內機械環境的復雜性和 CC 對機械刺激的高度敏感性,如何模擬體內的機械環境使之達到對 CC 代謝的積極效應,成為目前體外培養 CC 的一大難點[2]。因此,為了進一步研究機械刺激對 CC 代謝的影響,本綜述將從不同機械形式出發,闡述牽張力、靜水壓力、流體剪切力、壓縮力、低強度脈沖超聲、微重力、電磁場對 CC 分化代謝的作用,從而尋求并優化培養組織工程 CC 的潛在策略。
1 主要機械刺激
1.1 牽張力
牽張力(tensile strain,TS)是體內最為常見的內力,是近年來研究的熱點[3]。有報道表明低強度(0~1%)應變、1 Hz 的 TS 能夠促進骨髓間充質干細胞(bone mesenchymal stem cells,BMSCs)向 CC 分化,且軟骨形成標志物的表達隨時間的延長而上調[4]。也有研究發現加載中強度(2%~10%)應變、0.16~0.5 Hz 的 TS 可以促進 CC 合成[5-7]。一些學者認為這可能是通過激活單磷酸腺苷激活的蛋白激酶(adenosine monophosphate-activated protein kinase,AMPK)和抑制核因子 κB(nuclear factor kappa-B,NF-κB)-p65 的核轉運來減輕軟骨損傷[8]。但 Zhong 等[9]對兔 CC 進行 10% 應變的 TS 后,卻發現 CC 表型被破壞,這可能與 TS 激活粘附斑激酶(focal adhesion kinase,FAK)-絲裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)信號,從而上調炎癥因子的表達有關[10]。Liu 等[7]表明在中度 TS 加載下,淺層 CC 更能維持細胞表型,延緩細胞衰老。而高強度(> 10%)應變、0.5 Hz 的 TS 常常會抑制 CC 表型的形成,引起基質的降解[6, 11-12]。但 Lohberger 等[13]發現交替加載低、高強度的 TS 反而能夠顯著減少基質的降解,從而降低對 CC 表型的破壞。如何聯合加載低、中、高強度的 TS 使之促進 CC 增殖還需要廣大研究者的不斷探索。關于 TS 對體外 CC 代謝的影響詳見表 1。
1.2 靜水壓力
靜水壓力(hydrostatic pressure,HP)是作用于 CC 的主要力學刺激之一。低 HP(0~10 MPa)能夠通過整聯蛋白-FAK-細胞外調節蛋白激酶(extracellular regulated protein kinases,ERK)/磷脂酰肌醇-3 激酶(phosphatidylinositol 3-kinase,PI3K)途徑增強 CC 活性并減少其凋亡[14]。姚旺祥等[15]認為它還可以減少 MAPK 信號通路蛋白的表達來保護 ECM 的合成。研究表明高 HP(> 10 MPa)會顯著增加應激及凋亡相關基因的表達,特別是加載 4 h 后,不利于維持細胞表型和基質的合成[16]。
單獨施加 HP,比微重力(microgravity,MG)和流體剪切力(fluid shear stress,FSS)更能促進 ECM 的形成,甚至比 HP 和偏應力的聯合使用更能促進 CC 表型形成,但三者皆有軟骨保護作用,可以通過下調 COL10 的表達來抑制細胞肥大,減少細胞凋亡[17-19]。部分研究表明短時間(1~4 h/d)內加載的低 HP 對促進 CC 形成或抑制 CC 肥大來說可能是優勢參數[17-18, 20]。另外,Ogura 等[21]發現重復間歇加載 HP 對 CC 的合成代謝和活性的影響可能更大。如果在短時間內進行重復間歇加載是否會對 CC 更有利目前尚無研究,未來可進一步探索。關于 HP 對體外 CC 代謝作用的影響詳見表 2。
1.3 流體剪切力
當關節處于運動狀態時,被擠壓的滑液對 CC 表面會產生 FSS。研究表明低強度(< 10 dyn/cm2)FSS 能夠抑制白介素-1β(interleukin-1β,IL-1β)激活的 NF-κB,保護軟骨運動[22]。但 Zhang 等[23]發現對正常 CC 加載低強度 FSS,會引起 CC 的終末分化和纖維化,說明 FSS 對正常 CC 沒有治療作用。Su 等[24]在研究 FSS 對抵抗素誘導的環氧化酶(cyclooxygenase,COX)-2 的作用時發現,在抵抗素誘導前后加載 FSS,COX2 的表達呈相反趨勢,說明 FSS 對 CC 代謝的影響是多方向的。有報道認為中強度(> 12 dyn/cm2)FSS 會促進基質降解,抑制 CC 表型合成[23]。Adeniran-Catlett 等[25]卻表示中強度 FSS 的施加并不會抑制 BMSCs 向 CC 分化的能力。
Kuang 等[26]表明高強度(> 20 dyn/cm2)FSS 會導致 CC 退化,促進破骨細胞性骨吸收。有學者在 BMSCs 上也發現了類似的結論,認為高強度 FSS 會抑制軟骨表型的形成,引起 CC 退化[27]。另外,CS 和 FSS 在一定參數下聯合加載能夠增強 CC 表型,刺激 ECM 產生[27-28]。DiFederico 等[29]驗證了上述觀點,還發現雙軸刺激更能提高 CC 的生物合成活性。研究表明旋轉引起的 FSS 比平移引起的更能促進基質的合成[30]。接下來我們可以研究多軸加載或不同形式引起的 FSS 對 CC 活性的具體作用機制。關于 FSS 對 CC 代謝的影響詳見表 3。
1.4 壓縮力
當關節移動時,關節面的相互觸碰擠壓導致軟骨關節面上下受力形成壓縮力(compression stress,CS)。研究表明中度動態 CS(30~40 psi)能夠促進 ECM 合成,超過 40 psi 的靜態 CS 則表現為 ECM 降解,甚至出現炎癥跡象的骨關節炎(osteoarthritis,OA)樣 CC,這表明低于 40 psi 的動態 CS 對培養 CC 更有利[31]。Diao[32]也表示動態 CS 能夠刺激性別決定基因盒 9(sex-determining region Y box 9,SOX9)和下調基質金屬蛋白酶(matrix metalloproteinase,MMP)13 的表達來抑制分解代謝。
一些學者認為在低應變(< 20%)下,CS 能夠促進未分化細胞向 CC 分化[33-34]。而在高應變(> 20%)下,CS 會引起細胞肥大和纖維化,促進炎癥的產生[35]。但 Scholtes 等[36]發現間歇加載和轉化生長因子-β1(transforming growth factor-β,TGF-β1)似乎能夠緩解高應變 CS 對 CC 表型的破壞,甚至能夠通過 MAPK、Wnt 和 Notch 信號通路的相關因子上調 SOX9 的表達。還有研究發現短時間的加載培養(1~4 h/d)比長時間(> 12 h/d)更能促進 ECM 的合成[37]。
Iseki 等[38]認為動態 CS 比 FSS 更能促進微骨折中新組織軟骨的生成和成熟。Scholtes 等[36]在基因調控上也發現了類似的趨勢,動態 CS 能夠顯著提高 SOX9 和骨形態發生蛋白(bone morphogenetic protein,BMP)的基因表達,對早期軟骨的形成具有重要意義。未來可以進一步探索動態 CS 對 CC 去分化的機制研究。關于 CS 對體外 CC 代謝的影響詳見表 4。
2 其他機械刺激
2.1 低強度脈沖超聲
低強度脈沖超聲(low intensity pulsed ultrasound,LIPUS)能夠產生機械振動作用,促進細胞生長。大量研究已經證明 LIPUS 具有治療軟骨損傷的潛力,能夠緩解軟骨變形,促進骨折愈合[39-44]。Ito 等[45]表明高于 200 mW/cm2的 LIPUS 可導致細胞死亡,低于 120 mW/cm2的 LIPUS 可以促進軟骨細胞存活。其中,強度小于 100 mW/cm2、振蕩頻率 1.5 MHz ± 10%、脈沖頻率 1 kHz、20 min/d 的 LIPUS 已得到廣泛的研究和應用[46-50]。Uddin 等[46]發現無論有沒有 IL-1β 的刺激,LIPUS 都能維持軟骨表型甚至提高 ECM 的合成,LIPUS 本身是否對細胞骨架或軟骨再生有一定的積極作用還需要進一步的研究。
LIPUS 可以使鈣離子通過瞬時感受器電位離子通道香草素受體亞家族(transient receptor potential vanilloid,TRPV)4 內流并激活 MAPK 信號通路,促進結締組織生長因子(CCN family protein 2/connective tissue growth factor,CCN2/CTGF)的產生,從而促進軟骨再生[47],抑制 IL-1β 誘導的 NF-κB-p65 磷酸化來緩解基質的降解[46],或刺激蛋白激酶 B(protein kinase B,Akt)磷酸化激活 PI3K/Akt 轉導通路來促進 ECM 的合成[48],這些信號通路都為 OA 的治療提供了新的思路,將來的研究中還需要廣大學者的探索和發現。
2.2 微重力
MG 會嚴重影響軟骨的完整性,所以失重對 CC 的影響不可忽略[51]。由于飛行試驗的昂貴和有限性,國內外對體內 MG 的相關研究較少。目前較為認可的地面模擬 MG 的生物反應器有隨機定位機(random positioning machine,RPM)、旋轉細胞培養系統(rotary cell culture system,RCCS)和旋轉壁式生物反應器(rotating wall vessel,RWV)等。我們發現在模擬 MG 過程中,不同轉速、角度、持續時間對細胞產生的力學大小及影響在很大程度上尚不明確。
研究表明在 MG 下,CC 聚集成團且呈懸浮狀態時,比貼壁狀態更有利于維持軟骨表型[52]。Mellor 等[18]發現 MG 能夠抑制 ASCs 向 CC 分化,且與 Wnt 信號通路密切相關。但在加入誘導因子或細胞基質衍生物后促進了 BMSCs 向 CC 分化,這表明 MG 環境可能不利于細胞分化,需要在外源性因子的干預下才有促分化能力[53-54]。有報道稱通過 30 d 的 MG,CC 表現出聚集蛋白多糖(aggrecan,ACAN)的減少,但膠原纖維仍保持完整,這說明 30 d 內的軟骨退變是可能逆轉的[55],但對更長時間的 MG 培養及相關機制并無進一步的研究,廣大學者將來可以做深入的探索。
2.3 電磁場
電磁場(electromagnetic field,EMF)是一種在較高頻率下能夠刺激生物組織中生物電流的電磁能[56]。目前大多數 EMF 對軟骨細胞的研究采用每天 30 min 至 8 h 的加載時間,0.4~5 mT 場強,頻率小于 100 Hz[56-57]。
Anbarasan 等[57]對超低場強(0.65~1.95 μT)EMF 進行研究,發現 CC 活性與場強呈正相關。Parate 等[58]對低場強(0~5 mT)EMF 做了更細致的研究,發現 2 mT、10 min 是間充質干細胞(mesenchymal stem cells,MSCs)向 CC 分化的優勢參數,而長期反復加載反而不利于 CC 形成,這可能與 EMF 在 CC 形成的早期和晚期激活了不同的鈣離子內流途徑[如瞬時受體電位離子通道(transient receptor potential ion channels,TRPs)]有關。Escobar 等[59]對 2 mT EMF 進行了不同時間的加載,發現加載 3 h 可以促進 CC 增殖,5 h 可以促進糖胺聚糖(glycosaminoglycan,GAG)合成。以上研究表明 2 mT 場強是 CC 的優勢參數,接下來研究人員可以就更長的加載時間探索 EMF 對 CC 代謝的影響。
有學者表明 EMF 刺激對退化或不理想的 CC 更加有效,這說明 EMF 效應不僅與 EMF 有關,還與細胞質量有關[60]。Zhou 等[61]對 OA 鼠模型進行 EMF 后發現,EMF 對 CC 的有效作用可能是通過調節 MMP13 和部分通過抑制 MAPK 信號途徑來介導的。將來學者可以就這一效應的臨床相關性進行下一步的研究。
3 總結與展望
綜上所述,機械刺激對軟骨細胞內穩定的發展和維持起到舉足輕重的作用,尤其在調控軟骨細胞代謝的過程中(見圖 1)。構建一個功能性軟骨模型首先應滿足細胞代謝的要求,其次在模擬關節運動時,對軟骨施加合適的機械刺激,實現其功能構建。在體外研究中,總結與軟骨發育、分化和代謝相關的力學物理參數,有助于開發更為精準的軟骨替代策略,同樣也有助于最大限度地誘導軟骨形成,促進 CC 的增殖以加快修復軟骨損傷。
 圖1
機械刺激調控軟骨細胞代謝的加載參數
Figure1.
Loading parameters of mechanical stimulation for regulating chondrocyte metabolism
圖1
機械刺激調控軟骨細胞代謝的加載參數
Figure1.
Loading parameters of mechanical stimulation for regulating chondrocyte metabolism
然而,由于體外實驗的局限性,仍有一些問題尚待解決:(1)雖然大量文獻已經表明適當的機械刺激可改善 CC 表型或促進 CC 增殖,但仍無法完全模擬體內 CC 的力學環境。(2)由機械刺激引起的 CC 相關基因及蛋白表達的改變,其機制尚不完全明了。(3)軟骨細胞所處的生化微環境也是一個重要而復雜的影響因素,應當充分考慮機械和生化因素的協同作用。
利益沖突聲明:本文全體作者均聲明不存在利益沖突。