鈣聯蛋白(Calnexin)是內質網上的凝集素樣分子伴侶蛋白,也是線粒體結合內質網膜上的重要蛋白,在心臟疾病中發揮著重要作用,但其在心肌成纖維細胞活化中的作用和機制并未闡明。本研究通過小鼠胸主動脈縮窄(TAC)模型來觀察體內心肌纖維化情況,并利用心臟超聲,蘇木精-伊紅、Masson 和天狼星紅染色,以及心臟纖維化標志物表達水平,鑒定模型是否成功。體外實驗利用轉化生長因子 TGFβ1 刺激建立心肌成纖維細胞活化模型,通過定量 PCR、Western blot、EdU 滲入法及劃痕實驗等方法檢測其活化、細胞增殖、遷移的變化。利用腺病毒過表達和沉默 Calnexin,來觀察 Calnexin 在體外心肌成纖維細胞活化中的作用。結果顯示,Calnexin 在 TAC 模型和體外心肌成纖維細胞活化過程中均表達降低。過表達 Calnexin 能緩解心肌成纖維細胞活化;相反,沉默 Calnexin 導致其活化加重。進一步探究發現,內質網應激在心肌成纖維細胞活化過程中被激活,過表達 Calnexin 后內質網應激緩解,相反,敲低 Calnexin 后內質網應激加重,與活化表型變化一致。結果表明,過表達 Calnexin 可能通過緩解內質網應激從而減輕心肌成纖維細胞的活化程度。
引用本文: 田格爾, 趙明月, 周駿騰, 權月, 吳文超, 劉小菁. 鈣聯蛋白在心肌成纖維細胞活化過程中的作用研究. 生物醫學工程學雜志, 2020, 37(3): 450-459. doi: 10.7507/1001-5515.202001052 復制
版權信息: ?四川大學華西醫院華西期刊社《生物醫學工程學雜志》版權所有,未經授權不得轉載、改編
引言
心肌成纖維細胞占心臟組織非心肌細胞的 90%以上,在正常和病理性心臟功能中起重要作用[1-2]。心肌成纖維細胞的活化是許多心臟疾病[3](如心肌梗死[4]、心肌肥厚和心力衰竭[5]等)的病理特征之一。心肌成纖維細胞活化后,其細胞過度增殖,并分泌大量的細胞外基質(extracellular matrix,ECM,包括Ⅰ型及Ⅲ型膠原等)在心肌中逐漸沉積,形成心肌纖維化。纖維化心肌組織由于 ECM 沉積,其質地較硬,順應性較差,造成心力衰竭的發生發展[6-7]。近年來,在心肌肥厚和纖維化過程中,成纖維細胞的作用受到很多關注,但其如何發揮作用仍有待進一步闡明。
內質網在很多細胞過程中起著關鍵的作用[8-11]。多種細胞應激,如氧化還原失衡、Ca2+穩態擾動或蛋白質折疊缺陷等,可能導致未折疊或錯誤折疊的蛋白質積聚在內質網腔中,這被稱為內質網應激(endoplasmic reticulum stress,ER stress)[12-13]。內質網發生應激時,未折疊或錯誤折疊的蛋白質的積累會觸發激活三個內質網膜上的感受器,即蛋白激酶 RNA 樣內質網激酶(protein kinase RNA-like ER kinase,PERK)、內質網核信號轉導蛋白 1α(inositol-requiring protein 1α,IRE1α)以及激活轉錄因子 6(activating transcription factor 6,ATF6)[14]。研究報道,ER stress 與心臟纖維化密切相關[15-17],但其在心臟成纖維細胞活化中的作用尚未得到充分研究。
鈣聯蛋白(Calnexin)是內質網上的凝集素樣分子伴侶蛋白,也是線粒體結合內質網膜(mitochondria-associated ER membranses,MAMs)上的重要蛋白[18-19]。Calnexin 作為 MAM 上的分子伴侶,與鈣網蛋白共同調節 Ca2+的穩態,并且調節線粒體和內質網間 Ca2+的“交流”[20]。由于其含量豐富,Calnexin 常被用作內質網標志物[21]。此外,棕櫚酰化的 Calnexin 能在 MAM 上富集[22],磷酸化的 Calnexin 則可調節心肌細胞中的 Ca2+信號傳導[23]。然而,尚未確定 ER stress 相關通路是否介導了 Calnexin 在心肌成纖維細胞活化中的功能。
因此,本研究旨在確定:① 在心臟成纖維細胞活化中 Calnexin 的表達如何改變;② 確定 Calnexin 的敲低或過表達在心肌成纖維細胞活化過程中的作用;③ ER stress 通路是否為轉化生長因子 β1(transforming growth factor β1,TGFβ1)誘導心肌成纖維細胞活化中 Calnexin 的下游效應子。
1 材料和方法
1.1 實驗動物
本實驗所用動物:6~8 周雄性 C57BL/6 小鼠購自北京維通利華實驗動物科技有限公司(動物批號:1100111911041263),飼養于華西第二醫院 SPF 級動物實驗中心。本實驗經四川大學華西醫院動物倫理委員會批準通過(倫理備案號:2018162A)。
1.2 實驗材料和試劑
TGFβ1 購自北京神州義翹科技有限公司,高糖 DMEM 培養基購自以色列 BI 公司,定量 PCR 引物、Lipofectamine 3000 和 TRIzol 購自美國 Invitrogen 公司,胎牛血清(fetal bovine serum,FBS)購自美國 Hyclone 公司,SYBR? Green PCR Master Mix 和增強化學發光試劑 ECL 購自美國 Bio-Rad 公司,逆轉錄試劑盒(Rever Tra Ace 組合型)購自日本 Toyobo 公司,EdU 細胞增殖檢測試劑盒(Apollo 567)購自廣州銳博生物科技有限公司,放射免疫沉淀法(radioimmunoprecipitation assay,RIPA)裂解液和 BCA 蛋白定量試劑盒購自北京碧云天公司,PVDF 膜購于美國 Millipore 公司。小鼠單克隆抗 β-actin 抗體購于美國 Santa-Cruz 公司,山羊抗小鼠、抗兔 IgG 購于北京中杉金橋公司,鼠單克隆抗 α-SMA、鼠單克隆抗 Collagen Ⅰ、兔多克隆抗 CTGF 及兔單克隆抗 Calnexin 抗體購于美國 Abcam 公司,兔單克隆抗 BIP、兔多克隆抗 ATF4、兔單克隆抗 c-ATF6 抗體、兔單克隆抗 p-IRE1α 抗體由美國 CST 公司提供。
1.3 實驗方法
1.3.1 小鼠胸主動脈縮窄模型建立[24 ]
胸主動脈縮窄(transverse aortic constriction,TAC)模型是一種廣泛使用的壓力超負荷引起心肌肥厚/纖維化的實驗模型。30 只小鼠隨機分為假手術組(Sham)和 TAC 手術組,用異氟烷誘導麻醉后(誘導濃度 2.5%,維持濃度 1.0%),使用 PE90 管進行小鼠氣管插管,并仰臥放置在加熱墊上維持機械通氣。沿胸骨柄剪開,暴露小鼠胸腔后,用 5-0 真絲縫合線綁在 27 號鈍針針頭上,將主動脈弓進行收窄后,移出針頭,分層縫合胸腔。對假手術組進行除了結扎縫線之外的其余手術操作。手術后四周,對小鼠進行超聲心動圖檢查后采集小鼠心臟組織,取部分組織浸泡在 4% 多聚甲醛中用于病理切片,其余組織放在?80℃ 保存待用。
1.3.2 超聲心動圖檢測
應用飛依諾便攜式彩超機(VINNO 6 LAB)進行小鼠超聲心動圖檢測,以評估 TAC 術后四周小鼠心臟重塑情況。操作者在對手術分組不知情的情況下,用異氟烷誘導麻醉小鼠,并仰臥放置熱墊上。在左心室的短軸上,采集圖像以計算收縮期和舒張期的內壁厚度。在 M 型圖像上,獲得左心室心腔尺寸和壁厚。左心室收縮功能通過計算射血分數(ejection fraction,EF)和縮短分數(fractional shortening,FS)進行評估。
1.3.3 組織學檢測
將 4% 多聚甲醛中固定的心臟組織用石蠟包埋,并橫向切成 4~5 μm 厚度的切片,用于蘇木精-伊紅(hematoxylin-eosin staining,HE)染色、Masson 染色以及天狼星紅染色。使用明場顯微鏡拍攝組織切片染色圖像,并評估心臟纖維化程度。
1.3.4 大鼠乳鼠心肌成纖維原代細胞培養及藥物處理
根據實驗室建立的原代細胞分離方法[25],選擇出生 0~3 天的 SD 大鼠乳鼠心臟,洗凈剪碎后,利用二型膠原酶(0.05%)(Gibco)和胰蛋白酶(0.05%)進行消化。組織塊消化干凈后,將細胞離心后重新種板,貼壁 45~60 min,使成纖維細胞貼壁附著于細胞培養瓶/板上。吸出培養上清液,加入新鮮完全培養基(DMEM 高糖,10% 胎牛血清),放置于 37℃、5% CO2 培養箱繼續培養。當細胞密度達到 90% 左右時,對細胞進行傳代,細胞貼壁后用于后續實驗。細胞達到 60%~70% 融合度時,用無血清培養基饑餓處理 4 h 后,更換完全培養基,并加入 TGFβ1(10 ng/mL)處理 24 h[25]。
1.3.5 腺病毒轉導
重組 Calnexin 腺病毒和 sh-Calnexin 腺病毒均由漢恒生物技術有限公司(上海)設計和生產。六孔板每孔接種 2 × 105個細胞,待細胞貼壁后加入病毒濃縮液(MOI50),培養 24 h 后更換新鮮完全培養基,用于后續實驗檢測。用 GFP 腺病毒感染的細胞作為對照。
1.3.6 細胞免疫熒光染色
將成纖維細胞鋪在 48 孔板中,當細胞達到 40%~50% 融合度時,加入 TGFβ1,處理 24 h 后固定封閉細胞,然后加入一抗(α-SMA,1∶200)4℃ 孵育過夜,用 PBS 洗凈多余一抗,室溫避光孵育偶聯熒光劑的相應二抗 2 h。PBS 清洗細胞數次后,用稀釋的 DAPI 孵育 10 min,使用倒置熒光顯微鏡采集圖像,并使用 Image J 軟件進行半定量分析。
1.3.7 熒光定量 PCR 法檢測基因表達變化
按本實驗室建立的 RNA 提取方法[25],采用 TRIzol 試劑提取細胞的總 RNA,逆轉錄為 cDNA 后在 CFX96TM(Bio-Rad)熒光定量 PCR 儀上采用 SYBR? Green PCR Master Mix 進行熒光定量檢測。檢測基因的引物序列見表 1。
1.3.8 Western blot 檢測蛋白表達
成纖維細胞處理后,用 RIPA 裂解液提取細胞總蛋白,根據 BCA 法測定蛋白濃度,并上樣,經過 SDS-PAGE 凝膠電泳后,采用濕轉法將蛋白轉至 PVDF 膜上,5% 脫脂奶粉封閉后,搖床孵育一抗(BIP,1∶1 000;ATF4,1∶1 000;P-IRE1α(S724),1∶1 000;Calnexin,1∶1 000;c-ATF6,1∶1 000;TGF-β,1∶1 000;CTGF,1∶1 000;α-SMA,1∶1 000;β-actin,1∶2 000)過夜。用 TBST 數次洗膜后,室溫孵育相應二抗(1∶2 000)2 h,用 ECL 顯影曝光。β-actin 作為內參,采用 Image J 軟件進行灰度值半定量分析。
1.3.9 EdU 滲入法檢測細胞增殖
EdU 在細胞周期中可插入到正在復制的 DNA 鏈中,與 Apollo?熒光染料反應,從而檢測細胞的增殖活性[26]。其大體步驟如下:成纖維細胞處理完畢后,經過 EdU 孵育、4% 多聚甲醛固定、Apollo?染色反應液及 Hoechst 33342 反應液孵育后,在熒光顯微鏡下觀察、拍照。本實驗中每孔細胞隨機選 5 個視野,每組 3 個復孔,采用 Image J 軟件計算處于 S 期的細胞百分比。
1.3.10 劃痕實驗測定細胞遷移
成纖維細胞種板培養 24 h,加入 1 μg/mL 的絲裂霉素處理 1 h 后,用無菌 200 μL 移液槍頭劃痕并于倒置顯微鏡下拍照。按照細胞分組予以相應處理后,在低血清條件下繼續培養 24 h,再次在倒置顯微鏡下觀察拍照,每孔取 8 個視野,每組 3 個復孔。用 Image J 軟件測量劃痕面積。
1.3.11 數據分析
實驗數據采用 SPSS22.0 軟件進行統計分析,以均數 ± 標準誤(means ± SEM)表示試驗結果,采用獨立樣本 t 檢驗進行兩組間比較,單因素方差分析(One-way ANOVA)進行多組間比較,P < 0.05 認為差異有統計學意義。
2 結果
2.1 Calnexin 在纖維化心臟組織中表達降低
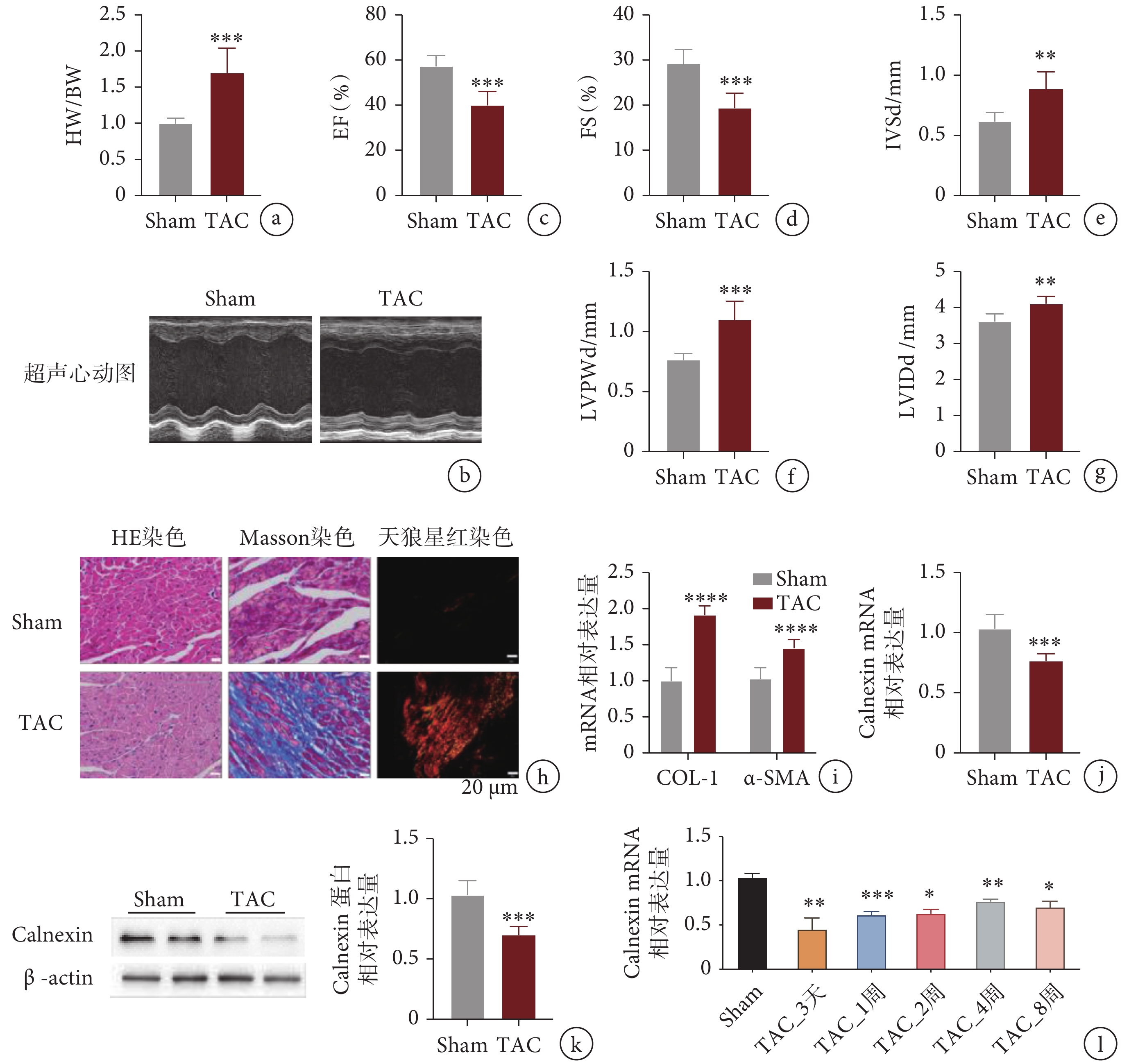
小鼠在 TAC 術后 4 周進行超聲心動圖檢測,并測量小鼠心臟體重比(HW/BW),如圖 1a-g所示,與 Sham 組相比,TAC 小鼠的 HW/BW、左心室舒張末期后壁厚度(left ventricular end-diastolic posterior wall thickness,LVPWd)、室間隔厚度(interventricular septal thickness in diastole,IVSd)和舒張末期的左心室內徑(left ventricular internal diameter in diastole,LVIDd)增加,左心室射血分數和縮短分數降低。觀察心臟組織 Masson 染色發現,TAC 組切片中纖維化面積(藍色)與 Sham 組相比明顯增多,天狼星紅染色中 TAC 組Ⅰ型膠原(紅色)和Ⅲ型膠原(綠色)比 Sham 組明顯增多(見圖 1h)。通過 qPCR 檢測了心肌纖維化指標,如圖 1i所示,TAC 組心肌組織中 COL-1 和 α-SMA 的 mRNA 表達相較于 Sham 組顯著增加。我們用 qPCR 和 Western blot 檢測到 TAC 組中 Calnexin 的 mRNA 和蛋白表達水平與 Sham 組相比均顯著下降(見圖 1j、k)。同時,用 qPCR 的方法檢測實驗室收集的 TAC 術后時間梯度樣本,發現 Calnexin 的表達在術后各個時間點相較于 Sham 組均明顯降低(見圖 1l)。
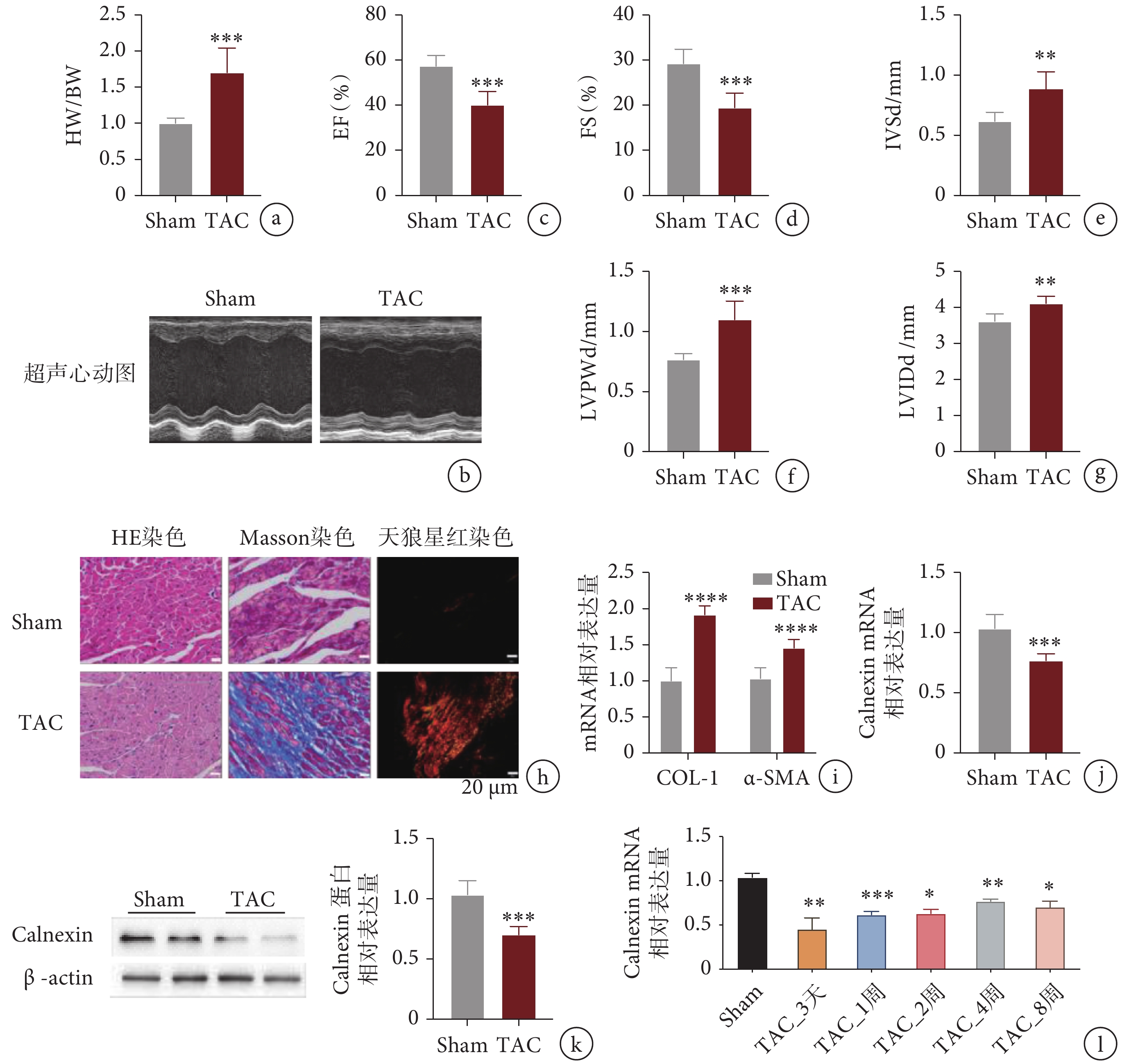 圖1
Calnexin 在小鼠 TAC 模型中的表達降低
圖1
Calnexin 在小鼠 TAC 模型中的表達降低
a.心臟重量與體重比值;b.小鼠 TAC 術后超聲心動圖檢測圖像;c-g. 超聲心動圖檢測心功能指標;h. 心臟組織病理切片;i. 纖維化指標 mRNA 相對表達量;j. Calnexin 的 mRNA 相對表達量;k. Calnexin 的蛋白相對表達量;l. Calnexin 在 TAC 術后不同時間的 mRNA 相對表達量。
a. heart weight/body weight; b. representative images of an echocardiographic assessment of mice after TAC; c-g. the cardiac function indicators by echocardiogram; h. the stained sections of hearts; i. the mRNA levels of COL-1 and α-SMA; j. the mRNA level of calnexin; k. the protein level of calnexin; l. the mRNA levels of calnexin with time gradient.
2.2 Calnexin 在活化的心肌成纖維細胞中表達降低
培養的心肌成纖維細胞受到 TGFβ1 刺激后,其增殖能力和遷移能力顯著增強。與對照組相比,TGFβ1 刺激組滲入 EdU 的細胞數量顯著增多(見圖 2a)。劃痕實驗結果顯示,與對照組相比,TGFβ1 刺激組劃痕愈合面積增加了約 50%(見圖 2b)。通過免疫熒光染色進一步驗證不同處理組 α-SMA 的表達變化,圖 2c顯示,TGFβ1 刺激后,α-SMA 熒光強度顯著增加。為了進一步證實心肌成纖維細胞的活化,我們用 qPCR 檢測到纖維化相關標志物 COl-1、CTGF、α-SMA、TGF-β 的 mRNA 水平,與 Control 組相比均顯著升高(見圖 2d)。以上數據表明,TGFβ1 能夠有效誘導心肌成纖維細胞發生活化,并且在活化過程中,Calnexin 蛋白表達顯著下降(見圖 2e)。
 圖2
Calnexin 在心肌成纖維細胞活化過程中的表達降低
圖2
Calnexin 在心肌成纖維細胞活化過程中的表達降低
a. EdU 滲入法檢測心肌成纖維細胞的增殖能力;b. 劃痕實驗檢測心肌成纖維細胞的遷移能力;c. 原代心肌成纖維細胞熒光染色;d. 心肌成纖維細胞活化標志物 mRNA 的相對表達量;e. Calnexin 的蛋白相對表達量。
a. the proliferation rate of cells by EdU staining; b. the migration capability of cardiac fibroblasts by wound healing assay; c. immuno?uorescence staining of α-SMA in cardiac fibroblasts; d. the mRNA levels of fibrotic markers; e. the protein level of calnexin.
2.3 過表達 Calnexin 緩解 TGFβ1 誘導的心肌成纖維細胞活化
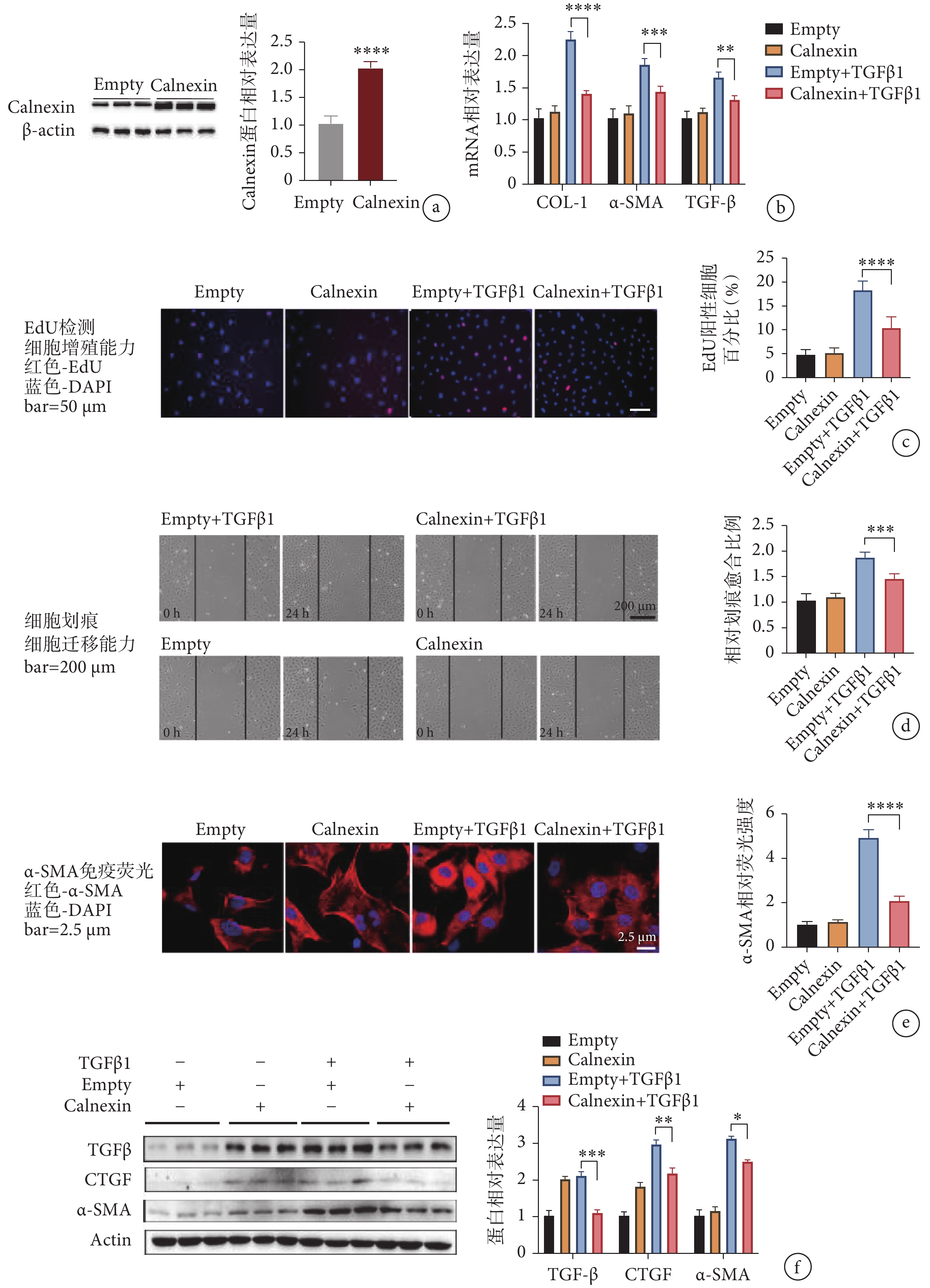
為了進一步研究 Calnexin 在心肌成纖維細胞活化中的作用,我們利用編碼 Calnexin 序列的腺病毒轉導心肌成纖維細胞,結果顯示與空載病毒組相比,過表達 Calnexin 組的蛋白表達上調至近 2 倍(見圖 3a)。隨后我們檢測了活化表型轉換的相關基因,結果顯示 Calnexin+TGFβ1 組中 COL-1、α-SMA 和 TGF-β 的 mRNA 表達水平顯著下降(見圖 3b),初步說明過表達 Calnexin 能夠緩解心肌成纖維細胞向活化表型轉換。
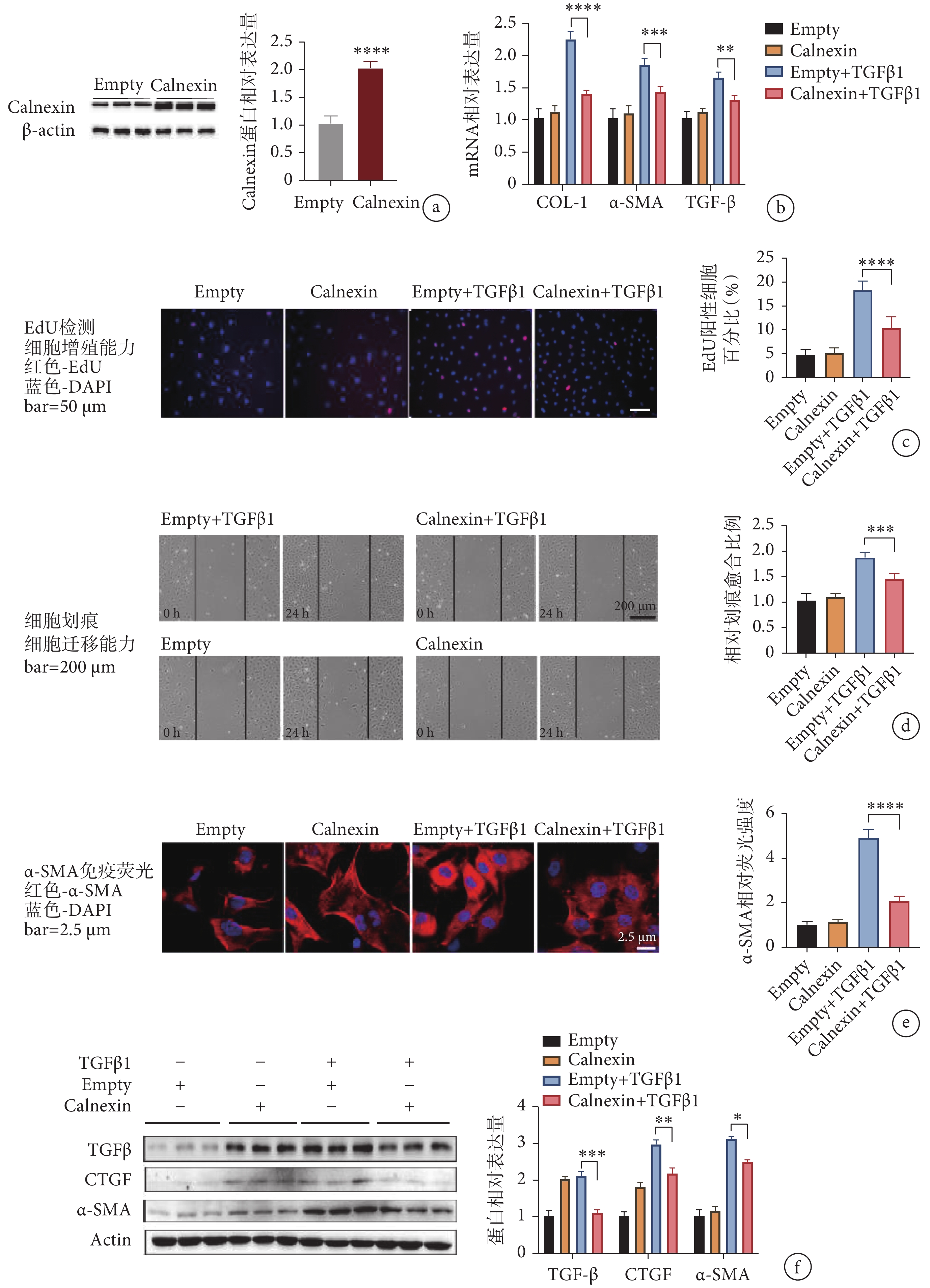 圖3
過表達 Calnexin 緩解 TGFβ1 誘導的心肌成纖維細胞活化
圖3
過表達 Calnexin 緩解 TGFβ1 誘導的心肌成纖維細胞活化
a. 腺病毒轉導效率檢測;b. 過表達 Calnexin 后心肌成纖維細胞活化指標 mRNA 水平變化;c. EdU 滲入法檢測心肌成纖維細胞的增殖能力;d. 劃痕實驗檢測心肌成纖維細胞的遷移能力;e. 心肌成纖維細胞熒光染色;f. 心肌成纖維細胞活化標志物 mRNA 的相對表達量。
a. the transduction effect of adenovirus; b. the mRNA levels of fibrosis markers; c. the proliferation rate of cells by EdU staining; d. the migration capability of cardiac fibroblasts by wound healing assay; e. immuno?uorescence staining of α-SMA in cardiac fibroblasts; f. the mRNA levels of CTGF, α-SMA and TGF-β.
EdU 檢測結果顯示,Calnexin+TGF-β1 組中陽性細胞比例相較 Empty+TGF-β1 組明顯減少(見圖 3c)。劃痕實驗結果顯示,與 Empty+TGF-β1 組相比,Calnexin+TGF-β1 組細胞遷移的能力降低了 30%(見圖 3d)。
由于 Calnexin 過表達,由 TGFβ1 引起的 α-SMA 的相對熒光強度顯著減弱(見圖 3e)。與 Empty+TGFβ1 組相比,Calnexin+TGFβ1 組的纖維化標志物 TGF-β、α-SMA 和 CTGF 的蛋白表達水平明顯下調(見圖 3f)。這些結果表明,過表達 Calnexin 可以緩解 TGFβ1 誘導的心肌成纖維細胞活化。
2.4 敲低 Calnexin 加重 TGFβ1 誘導的心肌成纖維細胞活化
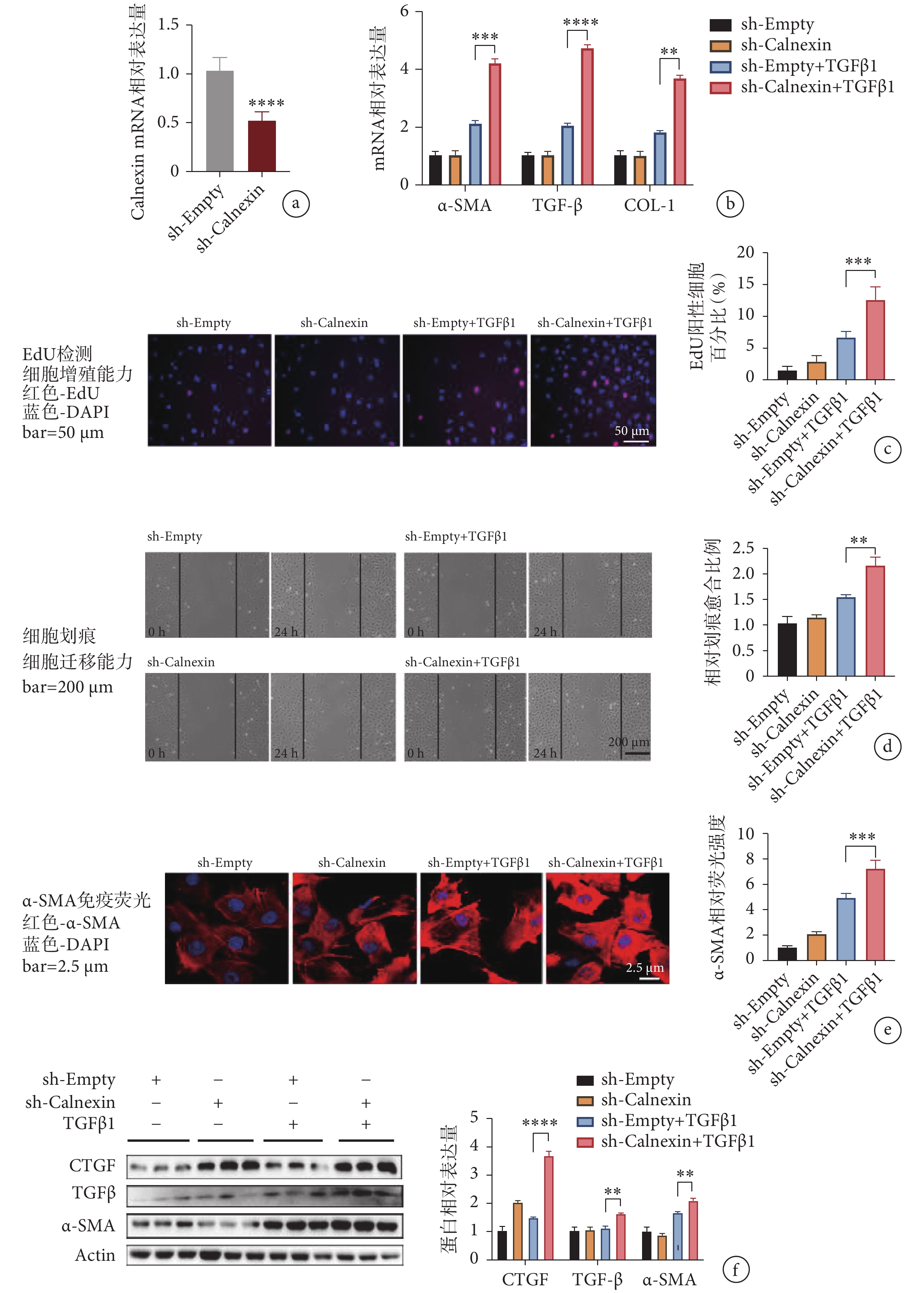
為了雙向驗證 Calnexin 在 TGFβ1 誘導的心肌成纖維細胞活化中的作用,我們利用短發夾腺病毒轉導心肌成纖維細胞,靶向沉默 Calnexin 的表達。用攜帶 GFP 的腺病毒感染的心肌成纖維細胞作為對照,驗證腺病毒的轉導效果(在我們的實驗中達 90% 以上)。與對照組相比,轉導沉默 Calnexin 腺病毒的心肌成纖維細胞中,Calnexin 的蛋白表達水平明顯下降(見圖 4a),且 α-SMA、TGF-β 和 COL-1 在 mRNA 水平上顯著上調(見圖 4b),因此,Calnexin 的下調使心肌成纖維細胞轉變為活化程度更高的表型。EdU 實驗中,敲低 Calnexin 組中陽性細胞數量較 sh-Empty+TGFβ1 組增加了 1 倍(見圖 4c),提示 Calnexin 表達水平低的心肌成纖維細胞有更強的增殖能力。劃痕實驗中,與 sh-Empty+TGFβ1 組相比,sh-Calnexin +TGFβ1 組細胞遷移能力顯著提升(見圖 4d)。由于 Calnexin 敲低,由 TGFβ1 引起的 α-SMA 的相對熒光強度明顯增強(見圖 4e)。與 sh-Empty+TGFβ1 組相比,sh-Calnexin+TGFβ1 組的纖維化標志物 TGF-β、α-SMA 和 CTGF 的蛋白表達水平均顯著上升(見圖 4f)。以上結果表明,敲低 Calnexin 能夠加重 TGFβ1 誘導的心肌成纖維細胞活化。
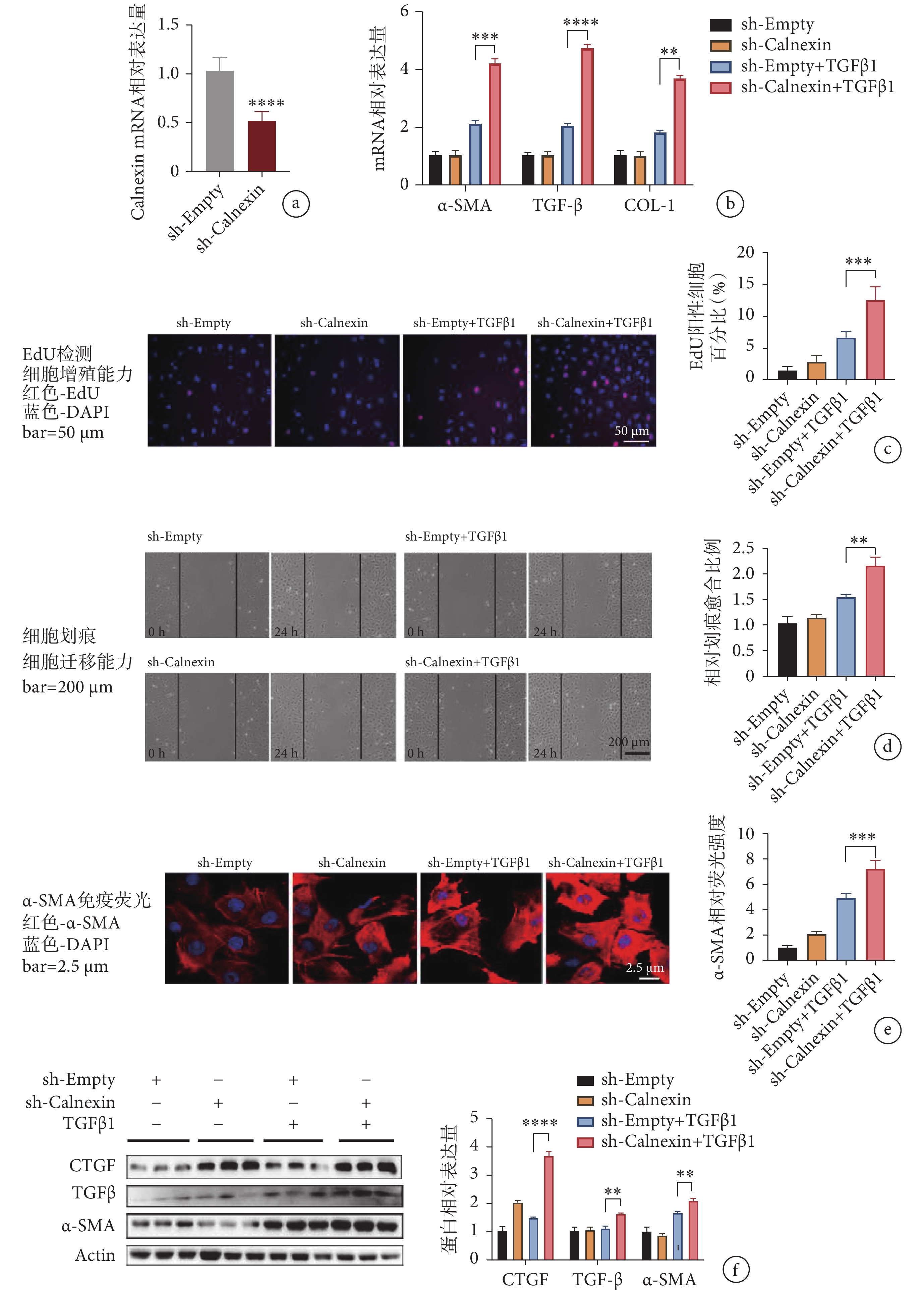 圖4
敲低 Calnexin 加重 TGFβ1 誘導的心肌成纖維細胞活化
圖4
敲低 Calnexin 加重 TGFβ1 誘導的心肌成纖維細胞活化
a. 腺病毒轉導效率檢測;b. 沉默 Calnexin 后心肌成纖維細胞活化指標 mRNA 水平變化;c. EdU 滲入法檢測心肌成纖維細胞的增殖能力;d. 劃痕實驗檢測心肌成纖維細胞的遷移能力;e. 心肌成纖維細胞熒光染色;f. 心肌成纖維細胞活化標志物蛋白相對表達量。
a. the transduction effect of adenovirus; b. the mRNA levels of fibrosis markers; c. the proliferation rate of cells by EdU staining; d. the migration capability of cardiac fibroblasts by wound healing assay; e. immuno?uorescence staining of α-SMA in cardiac fibroblasts; f. the protein levels of CTGF, α-SMA and TGF-β.
2.5 Calnexin 影響 ER stress 來調節 TGFβ1 誘導的心肌成纖維細胞活化
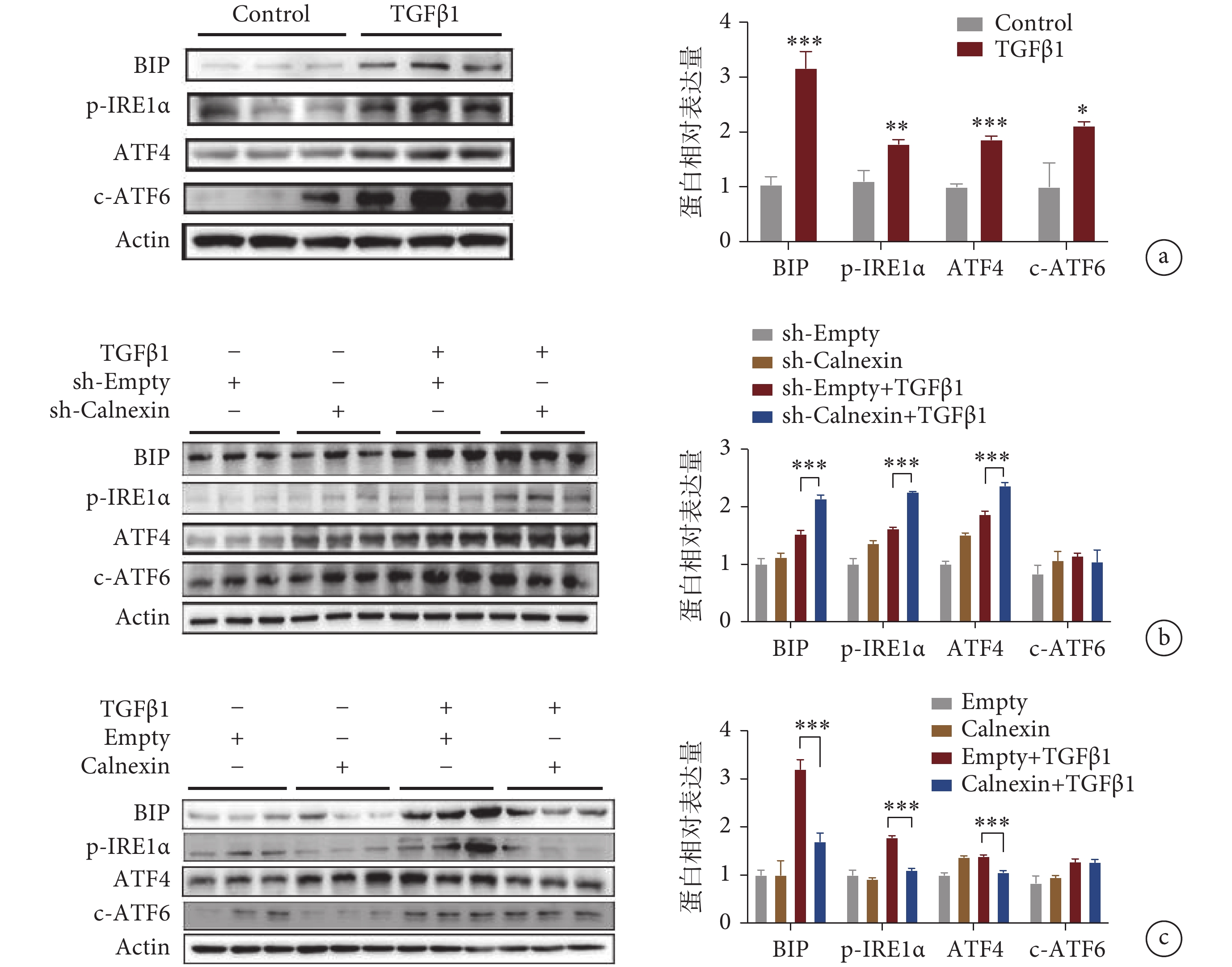
為了進一步探索 Calnexin 是否通過 ER stress 途徑介導心肌成纖維細胞的活化,我們檢測了 ER stress 相關信號通路中的蛋白改變。結果顯示,在 TGFβ1 刺激組中,p-IRE1α、ATF4 和 c-ATF6 以及 BIP 蛋白表達水平明顯增加(見圖 5a)。接著我們評估了 Calnexin 在 ER stress 中的作用。實驗結果顯示,敲低 Calnexin 后,進一步促進了 TGFβ1 誘導的 ER stress 的激活,與 sh-Empty 組相比,sh-Calnexin 組的 p-IRE1α、ATF4 和 BIP 蛋白表達水平明顯升高,但 c-ATF6 的蛋白水平沒有明顯改變(見圖 5b)。本研究顯示,過表達 Calnexin 能夠緩解 TGFβ1 誘導的 ER stress 的激活,與 Empty + TGFβ1 組相比,Calnexin + TGFβ1 組中的 BIP、p-IRE1α 和 ATF4 的蛋白表達水平顯著下降,但 c-ATF6 的蛋白表達水平并沒有明顯下降(見圖 5c)。
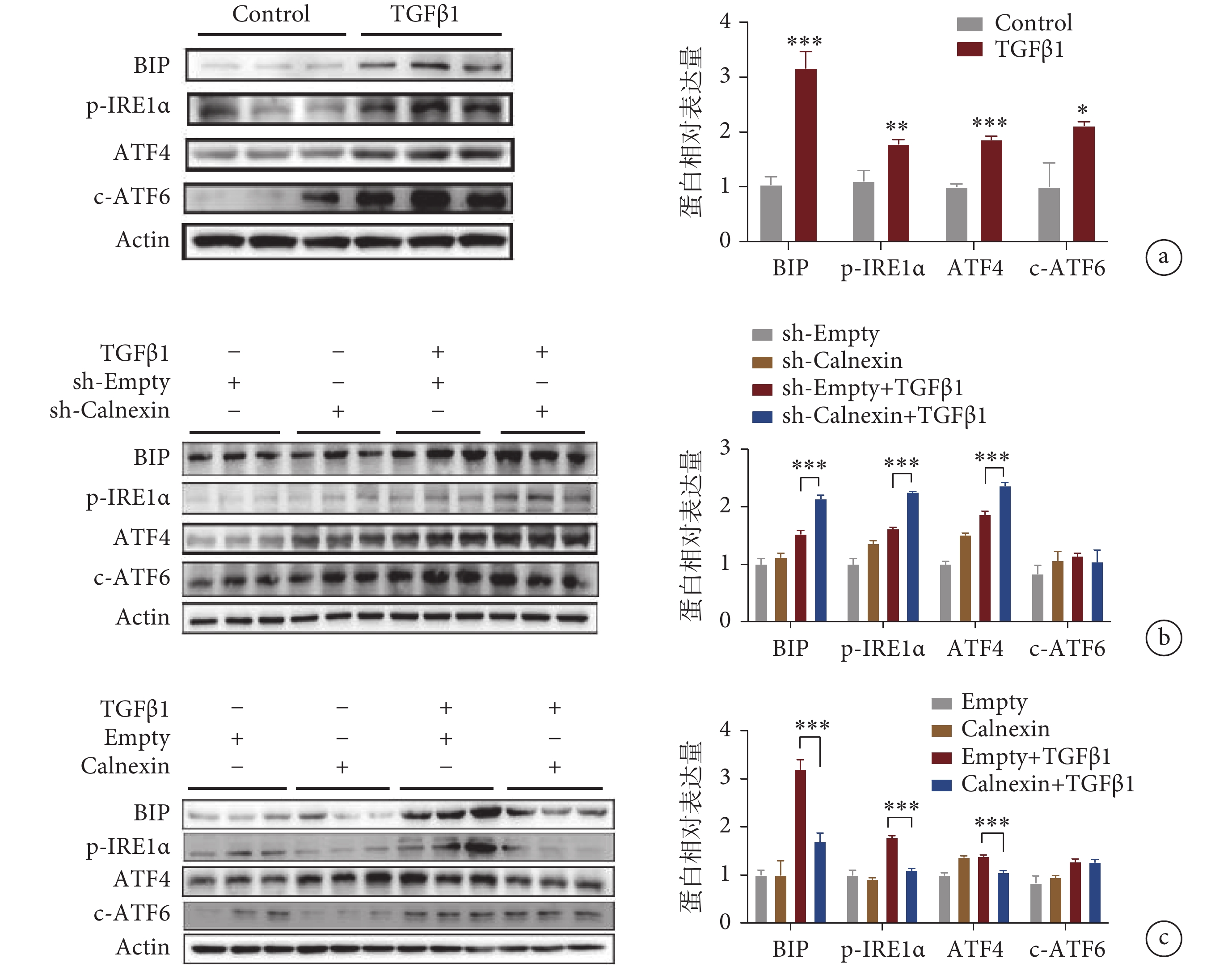 圖5
Calnexin 影響 ER stress 來調節 TGFβ1 誘導的心肌成纖維細胞活化
圖5
Calnexin 影響 ER stress 來調節 TGFβ1 誘導的心肌成纖維細胞活化
a. TGFβ1 誘導的心肌成纖維細胞活化激活 ER stress;b. 病毒敲低 Calnexin 后,心肌成纖維細胞中 ER stress 通路蛋白的表達水平;c. 病毒過表達 Calnexin 后,心肌成纖維細胞中 ER stress 通路蛋白的表達水平。*
a. the protein expression of BIP, p-IRE1α, ATF4, and c-ATF6 with TGFβ1 treatment in cardiac fibroblasts; b. the protein levels of BIP, p-IRE1α, ATF4, and c-ATF6 with sh-adenovirus transduction in cardiac fibroblasts; c. the protein levels of BIP, P-IRE1α, ATF4, and c-ATF6 with overexpression-adenovirus transfection in cardiac fibroblasts. *
以上結果表明,Calnexin 在 TGFβ1 誘導的心肌成纖維細胞活化中,可能通過影響 ER stress 水平而調節其活化狀態。
3 討論
近年來,活化的心肌成纖維細胞在介導多種心臟疾病發生發展過程中的作用受到廣泛關注[27]。各種疾病致心肌損傷或應激時,在多種因子調節下,各種來源的成纖維細胞遷移至受損區域,增殖并向肌成纖維細胞的表型轉化。活化的心肌成纖維細胞持續增殖并分泌大量膠原,持續合成細胞外基質,從而使心肌纖維化持續進展。因此,本研究探索了 Calnexin 及 ER stress 在心肌成纖維細胞活化中的作用。在本研究中我們發現,TAC 手術建立的壓力超負荷誘導的心肌肥厚/纖維化模型和 TGFβ1 刺激誘導的心肌成纖維細胞的活化模型中,Calnexin 在基因和蛋白水平的表達均呈現下降。在體外模型中,過表達 Calnexin 能夠緩解心肌成纖維細胞活化,而沉默 Calnexin 能加重其活化,提示 Calnexin 在心肌成纖維細胞活化過程中起到保護性作用,其具體機制至少可能是由于 Calnexin 影響了 ER stress 中 p-IRE1α 和 ATF4 這兩條通路,從而調節了心肌成纖維細胞的活化。
研究顯示,在心肌肥厚相關疾病發展過程中,Calnexin 的蛋白表達呈現下調趨勢,由于 Calnexin 在蛋白折疊過程中發揮著重要作用,Calnexin 含量不足可能導致錯誤折疊蛋白的積累,引起 ER stress,從而造成心肌肥厚的發展[28]。通過對 TAC 時間梯度小鼠模型的研究,我們發現在 TAC 手術組小鼠心肌組織中,Calnexin 基因表達始終低于 Sham 組小鼠的基因表達。這可能是 TAC 術后 ER stress 迅速被激活,繼而隨著時間延長有一定緩解,最后形成新的內質網穩態的潛在原因。這一結果提示,Calnexin 的有效表達在心肌組織維持正常狀態的過程中發揮著積極作用[29]。
TGFβ1 可以誘導心肌成纖維細胞活化并促進其 ECM 分泌[30-31]。我們的研究發現,心肌成纖維細胞在受到 TGFβ1 刺激后,Calnexin 通過介導 ER stress 通路中 IRE1/Xbp1 和 PERK/ATF4 分支引起其活化。研究表明,給予 TGFβ1 刺激之后,α-SMA 陽性的細胞均存在 TGF-β 受體蛋白 1/2 的表達增加[32]。我們發現,TGFβ1 可以負向調控 Calnexin,而另一方面 Calnexin 同樣能夠負向調控 TGF-β 的表達,這提示心肌成纖維細胞活化過程中,TGF-β 受體 1/2 可能和 Calnexin 之間存在相互作用,但這種相互作用的確切機制還有待進一步探討。
4 結論
綜上所述,我們的研究結果表明,心肌肥厚過程中,Calnexin 參與了心肌成纖維細胞的活化。抑制 Calnexin 表達能加重 TGFβ1 誘導的 ER stress,并進一步促進心肌成纖維細胞的活化;而過表達 Calnexin 可緩解 TGFβ1 誘導的 ER stress,同時緩解心肌成纖維細胞的活化。結果提示,Calnexin 通過 ER stress 來調節心肌成纖維細胞活化,這可能成為治療心臟疾病的新的靶點。
利益沖突聲明:本文全體作者均聲明不存在利益沖突。
引言
心肌成纖維細胞占心臟組織非心肌細胞的 90%以上,在正常和病理性心臟功能中起重要作用[1-2]。心肌成纖維細胞的活化是許多心臟疾病[3](如心肌梗死[4]、心肌肥厚和心力衰竭[5]等)的病理特征之一。心肌成纖維細胞活化后,其細胞過度增殖,并分泌大量的細胞外基質(extracellular matrix,ECM,包括Ⅰ型及Ⅲ型膠原等)在心肌中逐漸沉積,形成心肌纖維化。纖維化心肌組織由于 ECM 沉積,其質地較硬,順應性較差,造成心力衰竭的發生發展[6-7]。近年來,在心肌肥厚和纖維化過程中,成纖維細胞的作用受到很多關注,但其如何發揮作用仍有待進一步闡明。
內質網在很多細胞過程中起著關鍵的作用[8-11]。多種細胞應激,如氧化還原失衡、Ca2+穩態擾動或蛋白質折疊缺陷等,可能導致未折疊或錯誤折疊的蛋白質積聚在內質網腔中,這被稱為內質網應激(endoplasmic reticulum stress,ER stress)[12-13]。內質網發生應激時,未折疊或錯誤折疊的蛋白質的積累會觸發激活三個內質網膜上的感受器,即蛋白激酶 RNA 樣內質網激酶(protein kinase RNA-like ER kinase,PERK)、內質網核信號轉導蛋白 1α(inositol-requiring protein 1α,IRE1α)以及激活轉錄因子 6(activating transcription factor 6,ATF6)[14]。研究報道,ER stress 與心臟纖維化密切相關[15-17],但其在心臟成纖維細胞活化中的作用尚未得到充分研究。
鈣聯蛋白(Calnexin)是內質網上的凝集素樣分子伴侶蛋白,也是線粒體結合內質網膜(mitochondria-associated ER membranses,MAMs)上的重要蛋白[18-19]。Calnexin 作為 MAM 上的分子伴侶,與鈣網蛋白共同調節 Ca2+的穩態,并且調節線粒體和內質網間 Ca2+的“交流”[20]。由于其含量豐富,Calnexin 常被用作內質網標志物[21]。此外,棕櫚酰化的 Calnexin 能在 MAM 上富集[22],磷酸化的 Calnexin 則可調節心肌細胞中的 Ca2+信號傳導[23]。然而,尚未確定 ER stress 相關通路是否介導了 Calnexin 在心肌成纖維細胞活化中的功能。
因此,本研究旨在確定:① 在心臟成纖維細胞活化中 Calnexin 的表達如何改變;② 確定 Calnexin 的敲低或過表達在心肌成纖維細胞活化過程中的作用;③ ER stress 通路是否為轉化生長因子 β1(transforming growth factor β1,TGFβ1)誘導心肌成纖維細胞活化中 Calnexin 的下游效應子。
1 材料和方法
1.1 實驗動物
本實驗所用動物:6~8 周雄性 C57BL/6 小鼠購自北京維通利華實驗動物科技有限公司(動物批號:1100111911041263),飼養于華西第二醫院 SPF 級動物實驗中心。本實驗經四川大學華西醫院動物倫理委員會批準通過(倫理備案號:2018162A)。
1.2 實驗材料和試劑
TGFβ1 購自北京神州義翹科技有限公司,高糖 DMEM 培養基購自以色列 BI 公司,定量 PCR 引物、Lipofectamine 3000 和 TRIzol 購自美國 Invitrogen 公司,胎牛血清(fetal bovine serum,FBS)購自美國 Hyclone 公司,SYBR? Green PCR Master Mix 和增強化學發光試劑 ECL 購自美國 Bio-Rad 公司,逆轉錄試劑盒(Rever Tra Ace 組合型)購自日本 Toyobo 公司,EdU 細胞增殖檢測試劑盒(Apollo 567)購自廣州銳博生物科技有限公司,放射免疫沉淀法(radioimmunoprecipitation assay,RIPA)裂解液和 BCA 蛋白定量試劑盒購自北京碧云天公司,PVDF 膜購于美國 Millipore 公司。小鼠單克隆抗 β-actin 抗體購于美國 Santa-Cruz 公司,山羊抗小鼠、抗兔 IgG 購于北京中杉金橋公司,鼠單克隆抗 α-SMA、鼠單克隆抗 Collagen Ⅰ、兔多克隆抗 CTGF 及兔單克隆抗 Calnexin 抗體購于美國 Abcam 公司,兔單克隆抗 BIP、兔多克隆抗 ATF4、兔單克隆抗 c-ATF6 抗體、兔單克隆抗 p-IRE1α 抗體由美國 CST 公司提供。
1.3 實驗方法
1.3.1 小鼠胸主動脈縮窄模型建立[24 ]
胸主動脈縮窄(transverse aortic constriction,TAC)模型是一種廣泛使用的壓力超負荷引起心肌肥厚/纖維化的實驗模型。30 只小鼠隨機分為假手術組(Sham)和 TAC 手術組,用異氟烷誘導麻醉后(誘導濃度 2.5%,維持濃度 1.0%),使用 PE90 管進行小鼠氣管插管,并仰臥放置在加熱墊上維持機械通氣。沿胸骨柄剪開,暴露小鼠胸腔后,用 5-0 真絲縫合線綁在 27 號鈍針針頭上,將主動脈弓進行收窄后,移出針頭,分層縫合胸腔。對假手術組進行除了結扎縫線之外的其余手術操作。手術后四周,對小鼠進行超聲心動圖檢查后采集小鼠心臟組織,取部分組織浸泡在 4% 多聚甲醛中用于病理切片,其余組織放在?80℃ 保存待用。
1.3.2 超聲心動圖檢測
應用飛依諾便攜式彩超機(VINNO 6 LAB)進行小鼠超聲心動圖檢測,以評估 TAC 術后四周小鼠心臟重塑情況。操作者在對手術分組不知情的情況下,用異氟烷誘導麻醉小鼠,并仰臥放置熱墊上。在左心室的短軸上,采集圖像以計算收縮期和舒張期的內壁厚度。在 M 型圖像上,獲得左心室心腔尺寸和壁厚。左心室收縮功能通過計算射血分數(ejection fraction,EF)和縮短分數(fractional shortening,FS)進行評估。
1.3.3 組織學檢測
將 4% 多聚甲醛中固定的心臟組織用石蠟包埋,并橫向切成 4~5 μm 厚度的切片,用于蘇木精-伊紅(hematoxylin-eosin staining,HE)染色、Masson 染色以及天狼星紅染色。使用明場顯微鏡拍攝組織切片染色圖像,并評估心臟纖維化程度。
1.3.4 大鼠乳鼠心肌成纖維原代細胞培養及藥物處理
根據實驗室建立的原代細胞分離方法[25],選擇出生 0~3 天的 SD 大鼠乳鼠心臟,洗凈剪碎后,利用二型膠原酶(0.05%)(Gibco)和胰蛋白酶(0.05%)進行消化。組織塊消化干凈后,將細胞離心后重新種板,貼壁 45~60 min,使成纖維細胞貼壁附著于細胞培養瓶/板上。吸出培養上清液,加入新鮮完全培養基(DMEM 高糖,10% 胎牛血清),放置于 37℃、5% CO2 培養箱繼續培養。當細胞密度達到 90% 左右時,對細胞進行傳代,細胞貼壁后用于后續實驗。細胞達到 60%~70% 融合度時,用無血清培養基饑餓處理 4 h 后,更換完全培養基,并加入 TGFβ1(10 ng/mL)處理 24 h[25]。
1.3.5 腺病毒轉導
重組 Calnexin 腺病毒和 sh-Calnexin 腺病毒均由漢恒生物技術有限公司(上海)設計和生產。六孔板每孔接種 2 × 105個細胞,待細胞貼壁后加入病毒濃縮液(MOI50),培養 24 h 后更換新鮮完全培養基,用于后續實驗檢測。用 GFP 腺病毒感染的細胞作為對照。
1.3.6 細胞免疫熒光染色
將成纖維細胞鋪在 48 孔板中,當細胞達到 40%~50% 融合度時,加入 TGFβ1,處理 24 h 后固定封閉細胞,然后加入一抗(α-SMA,1∶200)4℃ 孵育過夜,用 PBS 洗凈多余一抗,室溫避光孵育偶聯熒光劑的相應二抗 2 h。PBS 清洗細胞數次后,用稀釋的 DAPI 孵育 10 min,使用倒置熒光顯微鏡采集圖像,并使用 Image J 軟件進行半定量分析。
1.3.7 熒光定量 PCR 法檢測基因表達變化
按本實驗室建立的 RNA 提取方法[25],采用 TRIzol 試劑提取細胞的總 RNA,逆轉錄為 cDNA 后在 CFX96TM(Bio-Rad)熒光定量 PCR 儀上采用 SYBR? Green PCR Master Mix 進行熒光定量檢測。檢測基因的引物序列見表 1。
1.3.8 Western blot 檢測蛋白表達
成纖維細胞處理后,用 RIPA 裂解液提取細胞總蛋白,根據 BCA 法測定蛋白濃度,并上樣,經過 SDS-PAGE 凝膠電泳后,采用濕轉法將蛋白轉至 PVDF 膜上,5% 脫脂奶粉封閉后,搖床孵育一抗(BIP,1∶1 000;ATF4,1∶1 000;P-IRE1α(S724),1∶1 000;Calnexin,1∶1 000;c-ATF6,1∶1 000;TGF-β,1∶1 000;CTGF,1∶1 000;α-SMA,1∶1 000;β-actin,1∶2 000)過夜。用 TBST 數次洗膜后,室溫孵育相應二抗(1∶2 000)2 h,用 ECL 顯影曝光。β-actin 作為內參,采用 Image J 軟件進行灰度值半定量分析。
1.3.9 EdU 滲入法檢測細胞增殖
EdU 在細胞周期中可插入到正在復制的 DNA 鏈中,與 Apollo?熒光染料反應,從而檢測細胞的增殖活性[26]。其大體步驟如下:成纖維細胞處理完畢后,經過 EdU 孵育、4% 多聚甲醛固定、Apollo?染色反應液及 Hoechst 33342 反應液孵育后,在熒光顯微鏡下觀察、拍照。本實驗中每孔細胞隨機選 5 個視野,每組 3 個復孔,采用 Image J 軟件計算處于 S 期的細胞百分比。
1.3.10 劃痕實驗測定細胞遷移
成纖維細胞種板培養 24 h,加入 1 μg/mL 的絲裂霉素處理 1 h 后,用無菌 200 μL 移液槍頭劃痕并于倒置顯微鏡下拍照。按照細胞分組予以相應處理后,在低血清條件下繼續培養 24 h,再次在倒置顯微鏡下觀察拍照,每孔取 8 個視野,每組 3 個復孔。用 Image J 軟件測量劃痕面積。
1.3.11 數據分析
實驗數據采用 SPSS22.0 軟件進行統計分析,以均數 ± 標準誤(means ± SEM)表示試驗結果,采用獨立樣本 t 檢驗進行兩組間比較,單因素方差分析(One-way ANOVA)進行多組間比較,P < 0.05 認為差異有統計學意義。
2 結果
2.1 Calnexin 在纖維化心臟組織中表達降低
小鼠在 TAC 術后 4 周進行超聲心動圖檢測,并測量小鼠心臟體重比(HW/BW),如圖 1a-g所示,與 Sham 組相比,TAC 小鼠的 HW/BW、左心室舒張末期后壁厚度(left ventricular end-diastolic posterior wall thickness,LVPWd)、室間隔厚度(interventricular septal thickness in diastole,IVSd)和舒張末期的左心室內徑(left ventricular internal diameter in diastole,LVIDd)增加,左心室射血分數和縮短分數降低。觀察心臟組織 Masson 染色發現,TAC 組切片中纖維化面積(藍色)與 Sham 組相比明顯增多,天狼星紅染色中 TAC 組Ⅰ型膠原(紅色)和Ⅲ型膠原(綠色)比 Sham 組明顯增多(見圖 1h)。通過 qPCR 檢測了心肌纖維化指標,如圖 1i所示,TAC 組心肌組織中 COL-1 和 α-SMA 的 mRNA 表達相較于 Sham 組顯著增加。我們用 qPCR 和 Western blot 檢測到 TAC 組中 Calnexin 的 mRNA 和蛋白表達水平與 Sham 組相比均顯著下降(見圖 1j、k)。同時,用 qPCR 的方法檢測實驗室收集的 TAC 術后時間梯度樣本,發現 Calnexin 的表達在術后各個時間點相較于 Sham 組均明顯降低(見圖 1l)。
 圖1
Calnexin 在小鼠 TAC 模型中的表達降低
圖1
Calnexin 在小鼠 TAC 模型中的表達降低
a.心臟重量與體重比值;b.小鼠 TAC 術后超聲心動圖檢測圖像;c-g. 超聲心動圖檢測心功能指標;h. 心臟組織病理切片;i. 纖維化指標 mRNA 相對表達量;j. Calnexin 的 mRNA 相對表達量;k. Calnexin 的蛋白相對表達量;l. Calnexin 在 TAC 術后不同時間的 mRNA 相對表達量。
a. heart weight/body weight; b. representative images of an echocardiographic assessment of mice after TAC; c-g. the cardiac function indicators by echocardiogram; h. the stained sections of hearts; i. the mRNA levels of COL-1 and α-SMA; j. the mRNA level of calnexin; k. the protein level of calnexin; l. the mRNA levels of calnexin with time gradient.
2.2 Calnexin 在活化的心肌成纖維細胞中表達降低
培養的心肌成纖維細胞受到 TGFβ1 刺激后,其增殖能力和遷移能力顯著增強。與對照組相比,TGFβ1 刺激組滲入 EdU 的細胞數量顯著增多(見圖 2a)。劃痕實驗結果顯示,與對照組相比,TGFβ1 刺激組劃痕愈合面積增加了約 50%(見圖 2b)。通過免疫熒光染色進一步驗證不同處理組 α-SMA 的表達變化,圖 2c顯示,TGFβ1 刺激后,α-SMA 熒光強度顯著增加。為了進一步證實心肌成纖維細胞的活化,我們用 qPCR 檢測到纖維化相關標志物 COl-1、CTGF、α-SMA、TGF-β 的 mRNA 水平,與 Control 組相比均顯著升高(見圖 2d)。以上數據表明,TGFβ1 能夠有效誘導心肌成纖維細胞發生活化,并且在活化過程中,Calnexin 蛋白表達顯著下降(見圖 2e)。
 圖2
Calnexin 在心肌成纖維細胞活化過程中的表達降低
圖2
Calnexin 在心肌成纖維細胞活化過程中的表達降低
a. EdU 滲入法檢測心肌成纖維細胞的增殖能力;b. 劃痕實驗檢測心肌成纖維細胞的遷移能力;c. 原代心肌成纖維細胞熒光染色;d. 心肌成纖維細胞活化標志物 mRNA 的相對表達量;e. Calnexin 的蛋白相對表達量。
a. the proliferation rate of cells by EdU staining; b. the migration capability of cardiac fibroblasts by wound healing assay; c. immuno?uorescence staining of α-SMA in cardiac fibroblasts; d. the mRNA levels of fibrotic markers; e. the protein level of calnexin.
2.3 過表達 Calnexin 緩解 TGFβ1 誘導的心肌成纖維細胞活化
為了進一步研究 Calnexin 在心肌成纖維細胞活化中的作用,我們利用編碼 Calnexin 序列的腺病毒轉導心肌成纖維細胞,結果顯示與空載病毒組相比,過表達 Calnexin 組的蛋白表達上調至近 2 倍(見圖 3a)。隨后我們檢測了活化表型轉換的相關基因,結果顯示 Calnexin+TGFβ1 組中 COL-1、α-SMA 和 TGF-β 的 mRNA 表達水平顯著下降(見圖 3b),初步說明過表達 Calnexin 能夠緩解心肌成纖維細胞向活化表型轉換。
 圖3
過表達 Calnexin 緩解 TGFβ1 誘導的心肌成纖維細胞活化
圖3
過表達 Calnexin 緩解 TGFβ1 誘導的心肌成纖維細胞活化
a. 腺病毒轉導效率檢測;b. 過表達 Calnexin 后心肌成纖維細胞活化指標 mRNA 水平變化;c. EdU 滲入法檢測心肌成纖維細胞的增殖能力;d. 劃痕實驗檢測心肌成纖維細胞的遷移能力;e. 心肌成纖維細胞熒光染色;f. 心肌成纖維細胞活化標志物 mRNA 的相對表達量。
a. the transduction effect of adenovirus; b. the mRNA levels of fibrosis markers; c. the proliferation rate of cells by EdU staining; d. the migration capability of cardiac fibroblasts by wound healing assay; e. immuno?uorescence staining of α-SMA in cardiac fibroblasts; f. the mRNA levels of CTGF, α-SMA and TGF-β.
EdU 檢測結果顯示,Calnexin+TGF-β1 組中陽性細胞比例相較 Empty+TGF-β1 組明顯減少(見圖 3c)。劃痕實驗結果顯示,與 Empty+TGF-β1 組相比,Calnexin+TGF-β1 組細胞遷移的能力降低了 30%(見圖 3d)。
由于 Calnexin 過表達,由 TGFβ1 引起的 α-SMA 的相對熒光強度顯著減弱(見圖 3e)。與 Empty+TGFβ1 組相比,Calnexin+TGFβ1 組的纖維化標志物 TGF-β、α-SMA 和 CTGF 的蛋白表達水平明顯下調(見圖 3f)。這些結果表明,過表達 Calnexin 可以緩解 TGFβ1 誘導的心肌成纖維細胞活化。
2.4 敲低 Calnexin 加重 TGFβ1 誘導的心肌成纖維細胞活化
為了雙向驗證 Calnexin 在 TGFβ1 誘導的心肌成纖維細胞活化中的作用,我們利用短發夾腺病毒轉導心肌成纖維細胞,靶向沉默 Calnexin 的表達。用攜帶 GFP 的腺病毒感染的心肌成纖維細胞作為對照,驗證腺病毒的轉導效果(在我們的實驗中達 90% 以上)。與對照組相比,轉導沉默 Calnexin 腺病毒的心肌成纖維細胞中,Calnexin 的蛋白表達水平明顯下降(見圖 4a),且 α-SMA、TGF-β 和 COL-1 在 mRNA 水平上顯著上調(見圖 4b),因此,Calnexin 的下調使心肌成纖維細胞轉變為活化程度更高的表型。EdU 實驗中,敲低 Calnexin 組中陽性細胞數量較 sh-Empty+TGFβ1 組增加了 1 倍(見圖 4c),提示 Calnexin 表達水平低的心肌成纖維細胞有更強的增殖能力。劃痕實驗中,與 sh-Empty+TGFβ1 組相比,sh-Calnexin +TGFβ1 組細胞遷移能力顯著提升(見圖 4d)。由于 Calnexin 敲低,由 TGFβ1 引起的 α-SMA 的相對熒光強度明顯增強(見圖 4e)。與 sh-Empty+TGFβ1 組相比,sh-Calnexin+TGFβ1 組的纖維化標志物 TGF-β、α-SMA 和 CTGF 的蛋白表達水平均顯著上升(見圖 4f)。以上結果表明,敲低 Calnexin 能夠加重 TGFβ1 誘導的心肌成纖維細胞活化。
 圖4
敲低 Calnexin 加重 TGFβ1 誘導的心肌成纖維細胞活化
圖4
敲低 Calnexin 加重 TGFβ1 誘導的心肌成纖維細胞活化
a. 腺病毒轉導效率檢測;b. 沉默 Calnexin 后心肌成纖維細胞活化指標 mRNA 水平變化;c. EdU 滲入法檢測心肌成纖維細胞的增殖能力;d. 劃痕實驗檢測心肌成纖維細胞的遷移能力;e. 心肌成纖維細胞熒光染色;f. 心肌成纖維細胞活化標志物蛋白相對表達量。
a. the transduction effect of adenovirus; b. the mRNA levels of fibrosis markers; c. the proliferation rate of cells by EdU staining; d. the migration capability of cardiac fibroblasts by wound healing assay; e. immuno?uorescence staining of α-SMA in cardiac fibroblasts; f. the protein levels of CTGF, α-SMA and TGF-β.
2.5 Calnexin 影響 ER stress 來調節 TGFβ1 誘導的心肌成纖維細胞活化
為了進一步探索 Calnexin 是否通過 ER stress 途徑介導心肌成纖維細胞的活化,我們檢測了 ER stress 相關信號通路中的蛋白改變。結果顯示,在 TGFβ1 刺激組中,p-IRE1α、ATF4 和 c-ATF6 以及 BIP 蛋白表達水平明顯增加(見圖 5a)。接著我們評估了 Calnexin 在 ER stress 中的作用。實驗結果顯示,敲低 Calnexin 后,進一步促進了 TGFβ1 誘導的 ER stress 的激活,與 sh-Empty 組相比,sh-Calnexin 組的 p-IRE1α、ATF4 和 BIP 蛋白表達水平明顯升高,但 c-ATF6 的蛋白水平沒有明顯改變(見圖 5b)。本研究顯示,過表達 Calnexin 能夠緩解 TGFβ1 誘導的 ER stress 的激活,與 Empty + TGFβ1 組相比,Calnexin + TGFβ1 組中的 BIP、p-IRE1α 和 ATF4 的蛋白表達水平顯著下降,但 c-ATF6 的蛋白表達水平并沒有明顯下降(見圖 5c)。
 圖5
Calnexin 影響 ER stress 來調節 TGFβ1 誘導的心肌成纖維細胞活化
圖5
Calnexin 影響 ER stress 來調節 TGFβ1 誘導的心肌成纖維細胞活化
a. TGFβ1 誘導的心肌成纖維細胞活化激活 ER stress;b. 病毒敲低 Calnexin 后,心肌成纖維細胞中 ER stress 通路蛋白的表達水平;c. 病毒過表達 Calnexin 后,心肌成纖維細胞中 ER stress 通路蛋白的表達水平。*
a. the protein expression of BIP, p-IRE1α, ATF4, and c-ATF6 with TGFβ1 treatment in cardiac fibroblasts; b. the protein levels of BIP, p-IRE1α, ATF4, and c-ATF6 with sh-adenovirus transduction in cardiac fibroblasts; c. the protein levels of BIP, P-IRE1α, ATF4, and c-ATF6 with overexpression-adenovirus transfection in cardiac fibroblasts. *
以上結果表明,Calnexin 在 TGFβ1 誘導的心肌成纖維細胞活化中,可能通過影響 ER stress 水平而調節其活化狀態。
3 討論
近年來,活化的心肌成纖維細胞在介導多種心臟疾病發生發展過程中的作用受到廣泛關注[27]。各種疾病致心肌損傷或應激時,在多種因子調節下,各種來源的成纖維細胞遷移至受損區域,增殖并向肌成纖維細胞的表型轉化。活化的心肌成纖維細胞持續增殖并分泌大量膠原,持續合成細胞外基質,從而使心肌纖維化持續進展。因此,本研究探索了 Calnexin 及 ER stress 在心肌成纖維細胞活化中的作用。在本研究中我們發現,TAC 手術建立的壓力超負荷誘導的心肌肥厚/纖維化模型和 TGFβ1 刺激誘導的心肌成纖維細胞的活化模型中,Calnexin 在基因和蛋白水平的表達均呈現下降。在體外模型中,過表達 Calnexin 能夠緩解心肌成纖維細胞活化,而沉默 Calnexin 能加重其活化,提示 Calnexin 在心肌成纖維細胞活化過程中起到保護性作用,其具體機制至少可能是由于 Calnexin 影響了 ER stress 中 p-IRE1α 和 ATF4 這兩條通路,從而調節了心肌成纖維細胞的活化。
研究顯示,在心肌肥厚相關疾病發展過程中,Calnexin 的蛋白表達呈現下調趨勢,由于 Calnexin 在蛋白折疊過程中發揮著重要作用,Calnexin 含量不足可能導致錯誤折疊蛋白的積累,引起 ER stress,從而造成心肌肥厚的發展[28]。通過對 TAC 時間梯度小鼠模型的研究,我們發現在 TAC 手術組小鼠心肌組織中,Calnexin 基因表達始終低于 Sham 組小鼠的基因表達。這可能是 TAC 術后 ER stress 迅速被激活,繼而隨著時間延長有一定緩解,最后形成新的內質網穩態的潛在原因。這一結果提示,Calnexin 的有效表達在心肌組織維持正常狀態的過程中發揮著積極作用[29]。
TGFβ1 可以誘導心肌成纖維細胞活化并促進其 ECM 分泌[30-31]。我們的研究發現,心肌成纖維細胞在受到 TGFβ1 刺激后,Calnexin 通過介導 ER stress 通路中 IRE1/Xbp1 和 PERK/ATF4 分支引起其活化。研究表明,給予 TGFβ1 刺激之后,α-SMA 陽性的細胞均存在 TGF-β 受體蛋白 1/2 的表達增加[32]。我們發現,TGFβ1 可以負向調控 Calnexin,而另一方面 Calnexin 同樣能夠負向調控 TGF-β 的表達,這提示心肌成纖維細胞活化過程中,TGF-β 受體 1/2 可能和 Calnexin 之間存在相互作用,但這種相互作用的確切機制還有待進一步探討。
4 結論
綜上所述,我們的研究結果表明,心肌肥厚過程中,Calnexin 參與了心肌成纖維細胞的活化。抑制 Calnexin 表達能加重 TGFβ1 誘導的 ER stress,并進一步促進心肌成纖維細胞的活化;而過表達 Calnexin 可緩解 TGFβ1 誘導的 ER stress,同時緩解心肌成纖維細胞的活化。結果提示,Calnexin 通過 ER stress 來調節心肌成纖維細胞活化,這可能成為治療心臟疾病的新的靶點。
利益沖突聲明:本文全體作者均聲明不存在利益沖突。