本研究旨在探索脂肪細胞因子內臟脂肪素(Visfatin)能否誘導血管內皮細胞(VEC)發生炎癥及壞死性凋亡(Necroptosis),并初步探討其機制。體外分離培養人臍靜脈內皮細胞(HUVECs),單獨使用 Visfatin 刺激或在阻斷氧化低密度脂蛋白受體 1(LOX-1)后給予 Visfatin 刺激,采用 Western blot、RT-PCR、免疫細胞化學法、酶聯免疫吸附法(ELISA)、MTT、流式細胞化學法等觀察細胞炎癥及 Necroptosis 的發生情況。結果顯示,100 ng/mL 的 Visfatin 作用 24 h 可誘導 HUVECs 中單核細胞趨化蛋白-1(MCP-1)和 LOX-1 的 mRNA 及蛋白水平表達顯著上調;而 LOX-1 抑制劑聚肌苷酸預處理可明顯降低 Visfatin 誘導的 MCP-1 表達。另外,100 ng/mL 的 Visfatin 作用 24 h 可明顯誘導 HUVECs 中出現壞死樣特征,且 Necroptosis 特異性基因 BMF 的 mRNA 表達顯著增加,細胞增殖率降低;而聚肌苷酸預處理后,細胞增殖率升高,BMF 的基因表達下調。實驗結果提示,Visfatin 通過 LOX-1 介導,引起了血管內皮細胞炎癥反應及 Necroptosis,在動脈粥樣硬化的發生與發展中起著重要的作用。
引用本文: 韓曉宇, 吳文超, 劉小菁, 祝燁. 內臟脂肪素通過氧化低密度脂蛋白受體 1 介導血管內皮細胞炎癥反應及壞死性凋亡的研究. 生物醫學工程學雜志, 2020, 37(5): 834-841, 854. doi: 10.7507/1001-5515.202003067 復制
版權信息: ?四川大學華西醫院華西期刊社《生物醫學工程學雜志》版權所有,未經授權不得轉載、改編
引言
動脈粥樣硬化(atherosclerosis,AS)是嚴重危害人類健康的一種疾病,也是眾多心腦血管疾病的病理基礎[1]。研究表明,動脈粥樣硬化是一個具有慢性炎癥反應特征的病理過程[2]。而肥胖(obesity)是動脈粥樣硬化的獨立危險因素之一,是一種非感染性、慢性、全身性炎癥的病理狀態,可誘導多種具有血管活性的激素和脂肪細胞因子(adipokines)的分泌,如脂聯素(adiponectin)、瘦素(leptin)、腫瘤壞死因子(tumor necrosis factor,TNF-α)等[3]。這些脂肪細胞因子在維持能量及心血管內環境的穩定、免疫應答、葡萄糖及脂質代謝等方面均發揮著重要的作用。因此,研究肥胖與動脈粥樣硬化之間的潛在機制,對于預防和治療動脈粥樣硬化發生發展有著重要的意義。
Visfatin 是近年來新發現的一種主要由脂肪組織分泌的脂肪細胞因子[4],能與胰島素受體結合而具有類胰島素活性,與肥胖及胰島素抵抗密切相關[5]。Dahl 等[6]研究發現,在不穩定心絞痛患者頸動脈和冠狀動脈粥樣硬化斑塊的富含脂質區,泡沫細胞和巨噬細胞中 Visfatin 均呈高表達,提示可能與粥樣斑塊的形成與破裂有關。眾多研究表明,血管內皮細胞中的 Visfatin 可通過誘導炎癥因子,如單核細胞趨化蛋白-1(monocyte chemotactic protein 1,MCP-1)、細胞間黏附分子-1(intercellular cell adhesion molecule-1,ICAM-1)和血管細胞黏附分子-1(vascular cell adhesion molecule-1,VCAM-1)等的表達[7-9],參與動脈粥樣硬化的炎癥過程,進而導致粥樣硬化斑塊的不穩定性及壞死性凋亡(Necroptosis)誘發的內皮功能障礙[6],但 Visfatin 在動脈粥樣硬化發生發展中的具體作用尚不清楚。
動脈粥樣硬化是一個慢性炎癥過程,而血管內皮細胞損傷及功能紊亂是引起血管炎癥反應、啟動動脈粥樣硬化的關鍵因素[10]。LOX-1 是一種廣泛表達于血管內皮細胞的Ⅱ型膜蛋白,也是介導內皮細胞對氧化低密度脂蛋白(oxidized low-density lipoprotein,OxLDL)等促炎物質進行攝取和降解的主要受體,與動脈粥樣硬化的發生、發展密切相關[11]。LOX-1 的表達受多種促炎因子、促氧化劑和機械刺激等因素調控,如 Ox-LDL、血管緊張素-Ⅱ(angiotensin-Ⅱ,Ang-Ⅱ)、TNF-α 和流體切應力等[12-13]。目前研究表明,LOX-1 的異常表達是引起炎癥反應、Necroptosis 誘發的內皮功能障礙及動脈粥樣硬化發生的重要因素[14],但 Visfatin 與 LOX-1 之間的關系及其在動脈粥樣硬化發展中的作用尚未闡明。
為此,本研究將利用細胞生物學、分子生物學、免疫化學等方法來觀察 Visfatin 對血管內皮細胞中炎癥反應及 Necroptosis 的影響,并探討 LOX-1 在其中的作用,以期為動脈粥樣硬化等心血管疾病的防治提供新的靶點。
1 材料與方法
1.1 材料和試劑
M199 培養基、胰蛋白酶、TRIzol 購自美國 Invitrogen 公司;胎牛血清(fetal bovine serum,FBS)購自美國 Hyclone 公司;RT-PCR 試劑盒、SYBR/Eva Green? Real-time PCR Master Mix 購自日本 TOKOBO 公司;BCA 蛋白定量試劑盒購自美國 Pierce 公司;人 MCP-1 ELISA 試劑盒購自美國 R&D 公司;小鼠抗 β-actin 抗體、兔抗 LOX-1 多克隆抗體(H-140)購自美國 Santa Cruz 公司;兔抗 MCP-1 多克隆抗體購自武漢博士德公司;辣根酶標記山羊抗小鼠 IgG(ZF-2305)、辣根酶標記山羊抗兔 IgG(H+L)(ZF-2301)、FITC 標記山羊抗兔 IgG(H+L)(ZF-0311)購自北京中杉金橋公司。其余試劑均為市售分析純產品。
1.2 實驗方法
1.2.1 細胞分離及培養
無菌條件下取剖宮產術后的健康胎兒臍帶(15~20 cm,離體時間小于 4 h),置入 4℃ 的 PBS 緩沖液(含 100 U/mL 青霉素、100 μg/mL 鏈霉素)中并將該臍靜脈沖洗干凈。0.1% Ⅱ型膠原酶灌注靜脈,于 37℃ 孵箱中孵育 20 min 后輕按臍靜脈外部使內皮細胞脫落。吸取消化液,加入等量含 10% FBS 的 M199 培養基終止酶反應。1 500 r/min 離心 10 min,棄上清,沉淀即為分離出的人臍靜脈內皮細胞(human umbilical vein endothelial cells,HUVECs)。
HUVECs 用含 15%~20% FBS、20 μL/mL 內皮細胞生長添加劑(ECGS)的 M199 培養基,于 37℃、5% CO2 的培養箱(濕度 100%)靜置培養。細胞密度達 90% 后,采用胰蛋白酶消化傳代,取對數生長期細胞進行后續實驗。
1.2.2 實驗分組
取對數生長期細胞,在 M199 基礎培養基(含 1% FBS 及 1% BSA)饑餓 6 h 后進行干預。對照組不施加任何處理。干預措施包括:① 分別用 100 nmol/L AngⅡ、100 ng/mL Visfatin、16 μg/mL 或 10 ng/mL Leptin 刺激 24 h;② 250 μg/mL Polyinosinic acid(LOX-1 抑制劑)預處理 1 h 后,再加入 100 ng/mL Visfatin 刺激 24 h;③ 10 μmol/L Necrostatin-1(Necroptosis 抑制劑,Nec-1)預處理 3 h 后,再加入 100 ng/mL Visfatin 刺激 24 h;收集細胞總 RNA、蛋白或上清液進行實驗。
1.2.3 熒光定量 RT-PCR 測定基因表達變化
采用 TRIzol 試劑按操作說明書步驟提取細胞總 RNA,并用紫外分光光度儀測定 RNA 濃度。將 1.5 μg 總 RNA 逆轉錄為互補脫氧核糖核酸(complementary deoxyribonucleic acid,cDNA)后完成 PCR 熒光定量檢測。反應條件為:94℃ 預變性 2 min,94℃ 變性 10 s,58℃ 退火 10 s,72℃ 延伸 15 s,共 40 個循環。所用引物序列如表 1 所示,β-actin 為內參基因。
1.2.4 Western blot 測定蛋白表達變化
細胞進行相應處理后,使用 RIPA 蛋白裂解液收集細胞總蛋白,BCA 法測定蛋白濃度,沸水煮 5 min 變性。取等量蛋白(40 μg)上樣,經 SDS-PAGE 電泳后,將蛋白轉至 PVDF 膜上,封閉后 4℃ 搖床孵育一抗(LOX-1,1∶200;MCP-1,1∶200;β-actin,1∶2 000)過夜,TBST 洗 3 次,室溫孵育二抗(1∶5 000)1 h,增強化學發光(enhanced chemiluminescence,ECL)顯影并通過凝膠成像儀觀察蛋白的表達情況。
1.2.5 免疫細胞化學法檢測蛋白表達變化
接種細胞于 6 孔板中蓋玻片上,待細胞達 70%~80% 融合時,多聚甲醛固定 30 min。脫蠟、水化后,PBS 洗三次,3% H2O2(80% 甲醇)室溫孵育 10 min。進行抗原修復后滴加正常山羊血清室溫封閉 20 min,一抗(37℃ 1 h)、二抗(37℃ 1 h)孵育,后滴加鏈霉親和素-過氧化物酶(streptavidin-peroxidase,SP),37℃ 孵育 1 h,DAB 顯色、蘇木精復染、脫水、透明、封片、鏡檢。
1.2.6 酶聯免疫吸附法(enzyme-linked immunosorbent assay,ELISA)檢測上清液中蛋白表達變化
分別收集對照組和干預組細胞培養上清液,按照試劑盒提供步驟進行操作,使用酶標儀(Model1680,Bio-Rad,美國)檢測 450 nm 處各孔吸光度(OD)值,進而測定 HUVECs 上清液中 MCP-1 蛋白含量。
1.2.7 MTT 法檢測細胞增殖
將 HUVECs 細胞按 1 × 104/孔接種于 96 孔板中,給予不同處理后,向每孔加入 MTT 溶液(5 mg/mL)20 μL,繼續孵育 4 h。后各再加入 150 μL 二甲基亞砜(dimethylsulfoxide,DMSO),振蕩 10 min 使之充分溶解,使用酶標儀檢測 570 nm 處各孔吸光度 A 值。細胞增殖率(或抑制率)=[(對照組 A570 ? 空白孔 A570) ? (實驗組 A570 ? 空白孔 A570)]/(對照組 A570 ? 空白孔 A570) × 100%。
1.2.8 透射電鏡觀察 HUVECs 超微結構
將對照組和干預組細胞進行消化后,300 g 離心 5 min,取細胞沉淀,依次加入 2.5% 戊二醛、1% 四氧化鋨固定,50%、70%、90%、100% 乙醇進行梯度脫水,置于丙酮和純 812 樹脂混合液(1∶1)中 40℃ 浸透 30 min。然后,浸入純 812 樹脂中包埋,切片,醋酸鈾/檸檬酸鉛雙染后置于透射電鏡(H7650,Hitachi,日本)下觀察。
1.2.9 流式細胞化學法檢測細胞周期及凋亡
將對照組和干預組細胞進行消化后,800 r/min 離心 15 min,收集細胞,PBS 洗 2 次。于 70 % 乙醇中 4℃ 固定過夜。再次離心,收集固定細胞并加入適量 PBS 使之重懸,依次加入 RNase-A(50 μg/mL,37℃ 水浴 30 min)和 PI(65 μg/mL,冰浴避光染色 30 min),過濾后使用流式細胞儀(Invitrogen,美國)檢測細胞周期及凋亡情況。
1.2.10 統計學分析
實驗數據以均數 ± 標準差表示,采用 SPSS 17.0 軟件分析處理,多組間比較采用單因素方差分析(One-way ANOVA),組間比較采用 LSD 法。P < 0.05 表示差異有統計學意義。
2 結果
2.1 Visfatin 誘導 HUVECs 中 LOX-1 蛋白和基因表達
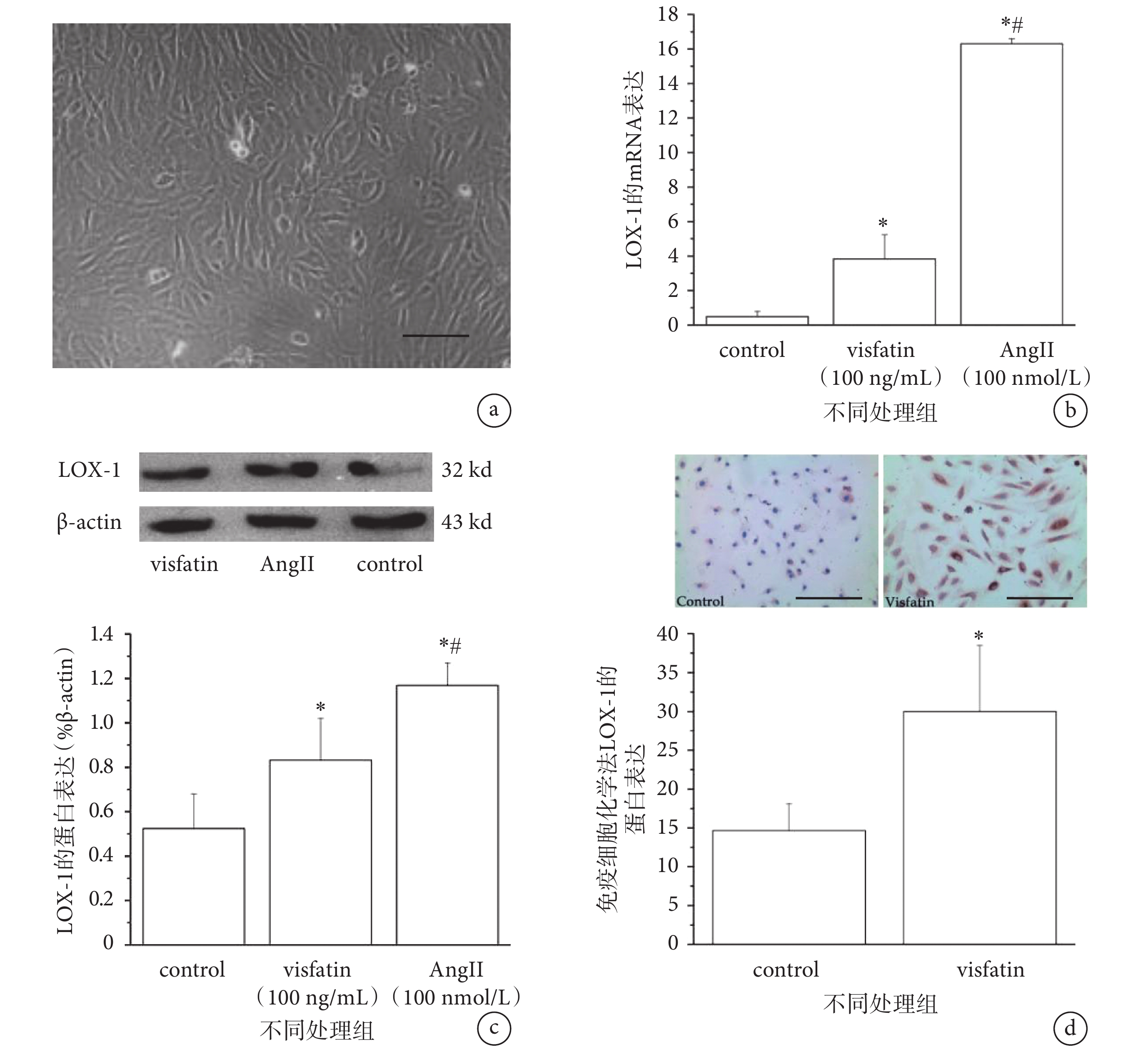
采用倒置相差顯微鏡觀察 HUVECs 細胞形態,如圖 1a 所示,HUVECs 呈扁平、多角形,單層鋪路石狀排列。細胞核呈橢圓形,位于細胞的中央,有 1~3 個核仁。
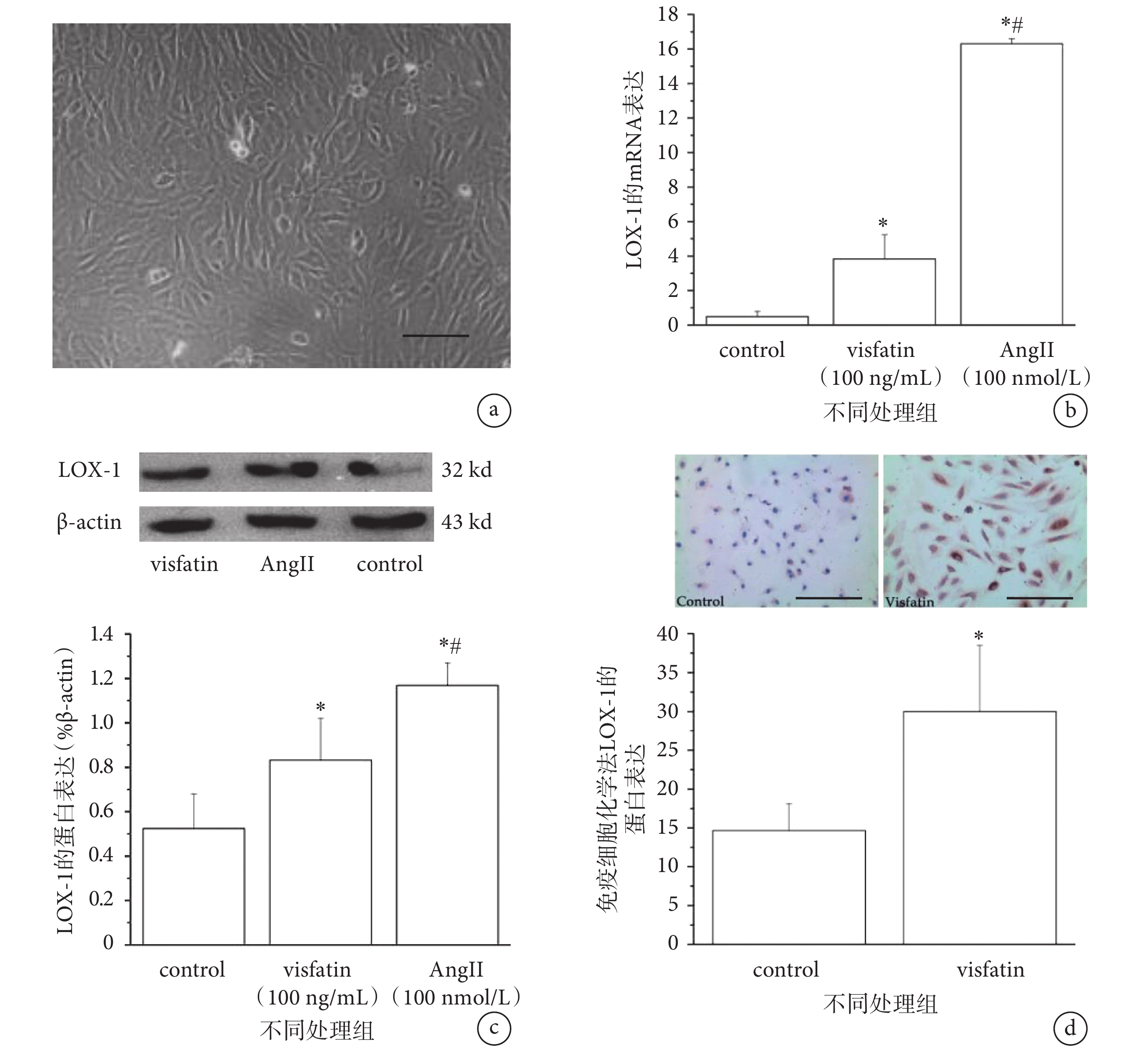 圖1
Visfatin 刺激誘導 HUVECs 中 LOX-1 的表達
圖1
Visfatin 刺激誘導 HUVECs 中 LOX-1 的表達
a. 分離培養的 HUVECs,圖中標尺 = 100 μm;b-c. LOX-1 的基因(b)和蛋白(c)表達;d. 免疫細胞化學法檢測 HUVECs 中 LOX-1 的蛋白表達。*
a. photographs of cultured HUVECs (scale bar = 100 μm); b-c. the mRNA (b) and protein (c) expression of LOX-1; d. the expression of LOX-1 in HUVECs detected by immunocytochemistry. *
為探究 Visfatin 對 LOX-1 表達的影響,我們采用 100 ng/mL 的 Visfatin 對細胞進行預處理,并以 100 nmol/L AngⅡ為陽性對照,通過 RT-PCR、Western blot 等方法檢測 LOX-1 的表達變化。實驗結果顯示,與對照組相比,100 ng/mL 的 Visfatin 作用 HUVECs 24 h 后,可顯著上調 LOX-1 的 mRNA 和蛋白表達水平(P < 0.05)(見圖 1b-c)。免疫細胞化學檢測法結果顯示,與對照組相比較,100 ng/mL Visfatin 作用 24 h 能明顯上調 HUVECs 中 LOX-1 蛋白(圖片中藍色為細胞部分,紅色為 LOX-1 蛋白表達部分)的表達(見圖 1d)。
2.2 LOX-1 介導 Visfatin 誘導 HUVECs 中 MCP-1 蛋白和基因表達
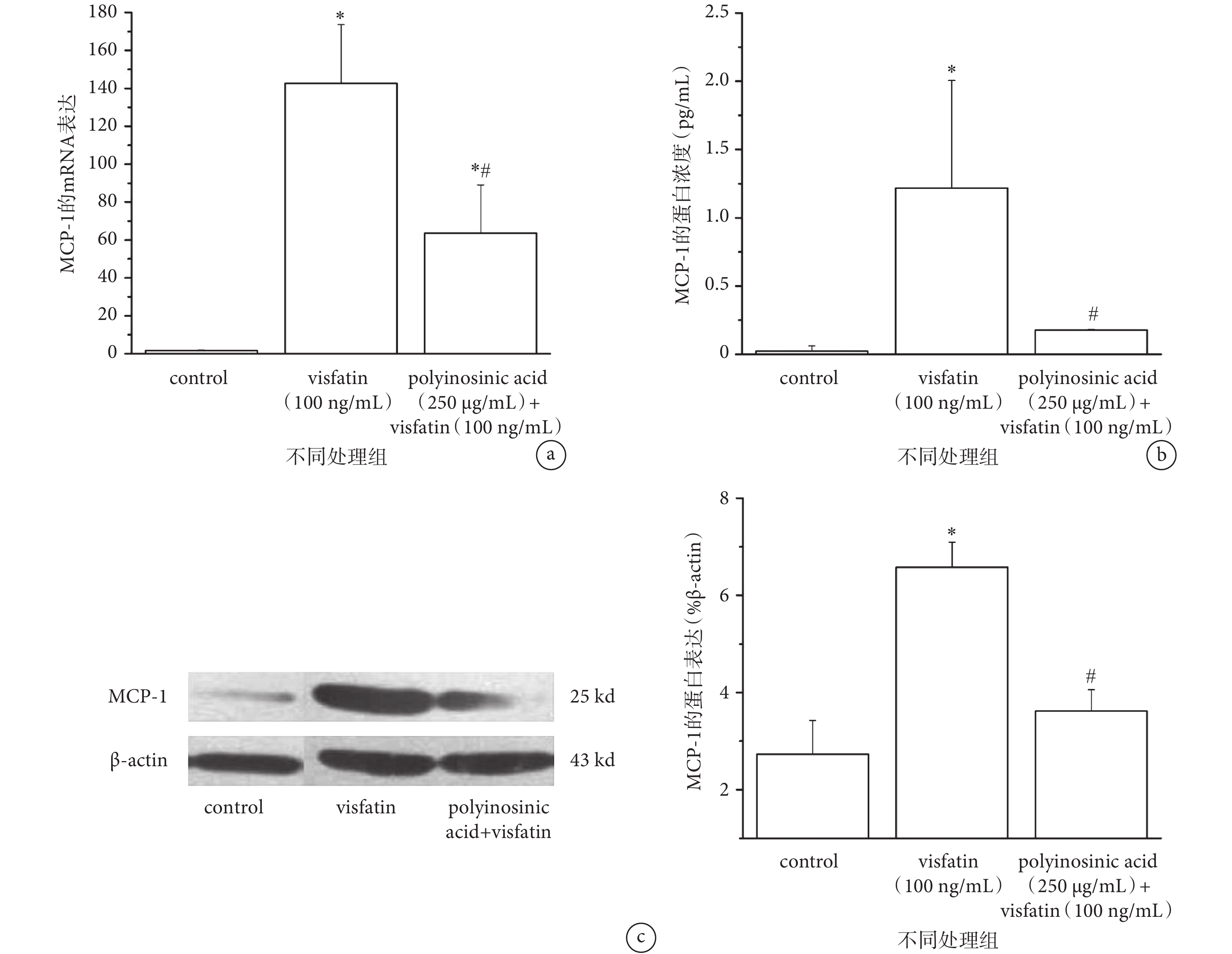
研究表明,Visfatin 具有促進炎癥因子分泌、參與機體炎癥應答、延緩中性粒細胞凋亡等作用[5, 9]。如圖 2a、c 所示,與對照組相比,100 ng/mL 的 Visfatin 作用 24 h 能夠顯著上調 HUVECs 中 MCP-1 的 mRNA 和蛋白表達水平。此外,Visfatin 作用后細胞培養上清液中分泌的 MCP-1 蛋白也出現明顯上調(見圖 2b)。說明 Visfatin 可以促進 HUVECs 中炎癥因子 MCP-1 的表達。
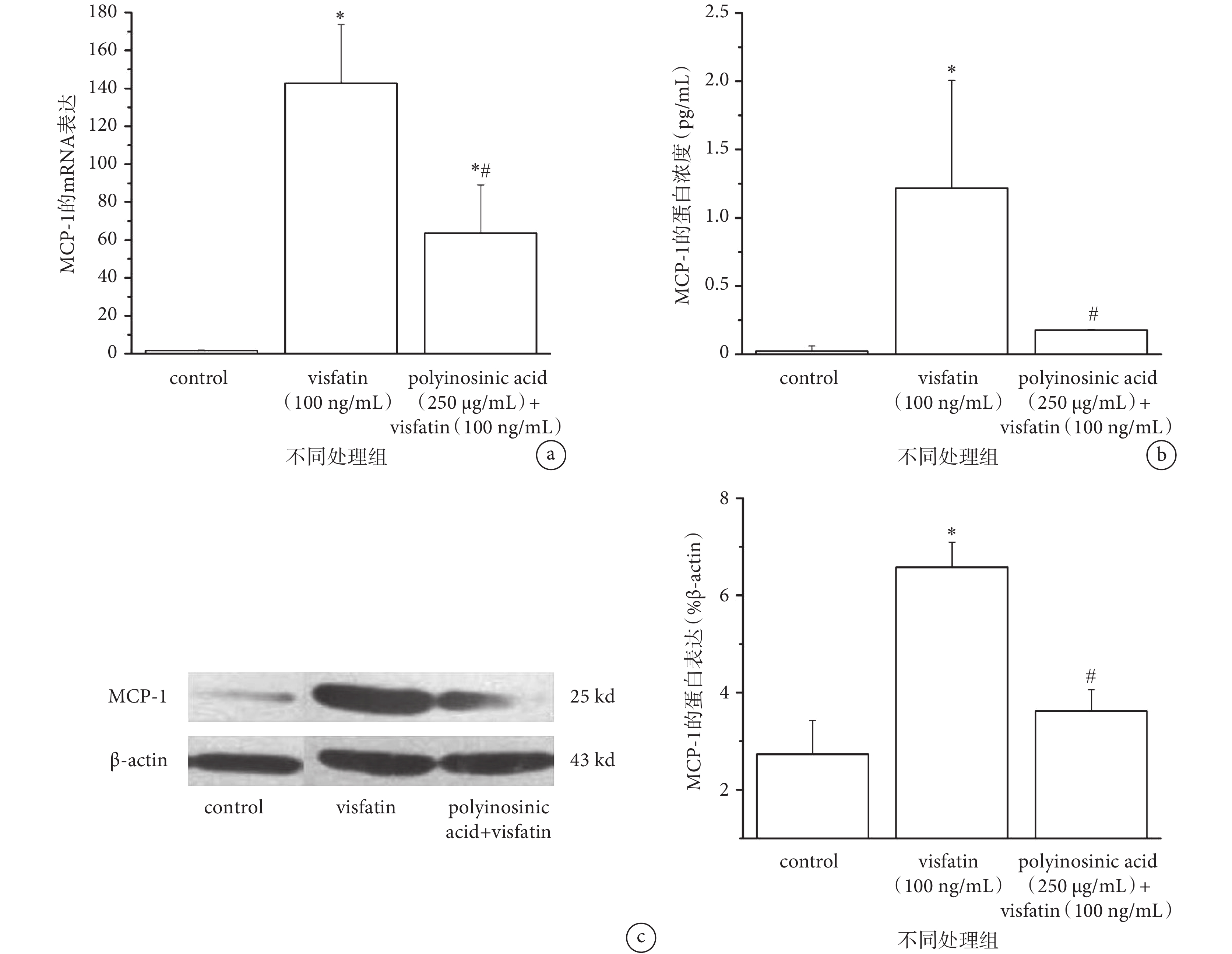 圖2
Visfatin 通過 LOX-1 促進 HUVECs 中炎癥因子 MCP-1 的表達
圖2
Visfatin 通過 LOX-1 促進 HUVECs 中炎癥因子 MCP-1 的表達
a 和 c. MCP-1 的基因(a)和蛋白(c)表達;b. ELISA 法檢測 HUVECs 分泌 MCP-1 蛋白的變化。*
a & c. the mRNA (a) and protein (c) expression of MCP-1; b. the expression of MCP-1 secreted by HUVECs detected by ELISA. *
為進一步檢測 LOX-1 在 Visfatin 誘導血管內皮細胞中 MCP-1 表達中的作用,我們在 Visfatin 刺激前用 250 μg/mL Polyinosinic acid(LOX-1 特異性抑制劑)對細胞進行 1 h 預處理,結果顯示,使用 Polyinosinic acid 后,HUVECs 中 MCP-1 的 mRNA 和蛋白表達較 Visfatin 單獨刺激組明顯降低(P < 0.05)(見圖 2a、c);細胞培養上清液中的分泌 MCP-1 蛋白也顯著減少(見圖 2b)。提示 LOX-1 可能參與介導 Visfatin 上調 HUVECs 中 MCP-1 的表達。
2.3 Visfatin 對 HUVECs 超微結構變化的影響
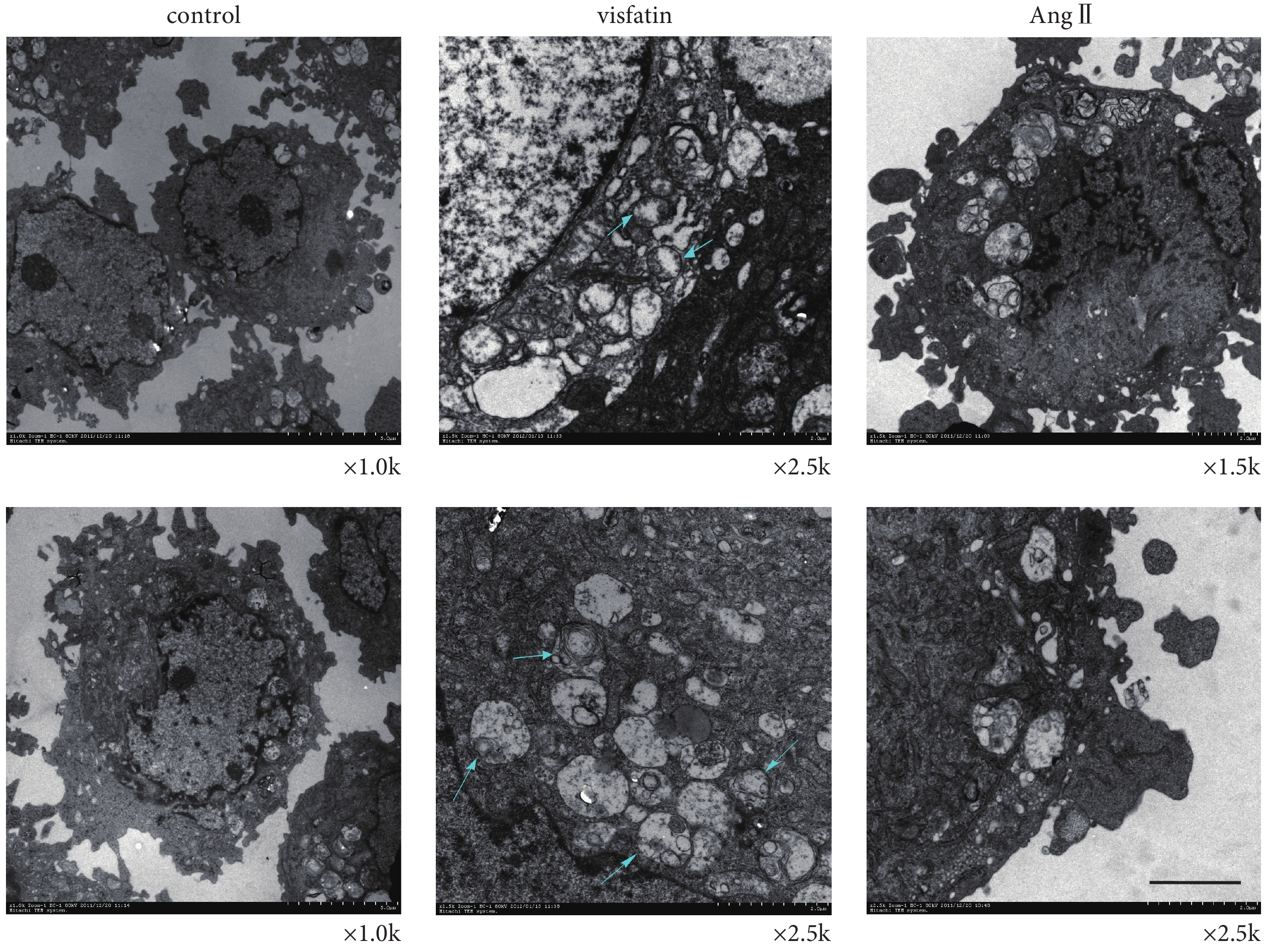
我們利用透射電鏡觀察空白對照組及 Visfatin 刺激組 HUVECs 的超微結構的變化,AngⅡ 刺激組作為陽性對照。如圖 3 所示(圖片位置上、下為同一刺激組或空白對照),Visfatin 刺激組中,出現部分壞死樣形態學特征,如細胞膜完整性的破壞,細胞或細胞器(如線粒體、內質網等)腫脹,甚至崩解,同時核內染色質邊聚、細胞核凝聚,但未見明顯的形態改變。此外,還觀察到部分類似自噬體形態樣結構出現。AngⅡ刺激組可見細胞核內染色質邊聚,細胞膜完整,線粒體有正常的超微結構,但未見明顯凋亡小體。而空白對照組中,均無上述細胞壞死的形態學特征。自噬是 Necroptosis 的普遍下游應答表現[15],因此,以上結果提示,Visfatin 可能誘導細胞發生了 Necroptosis。
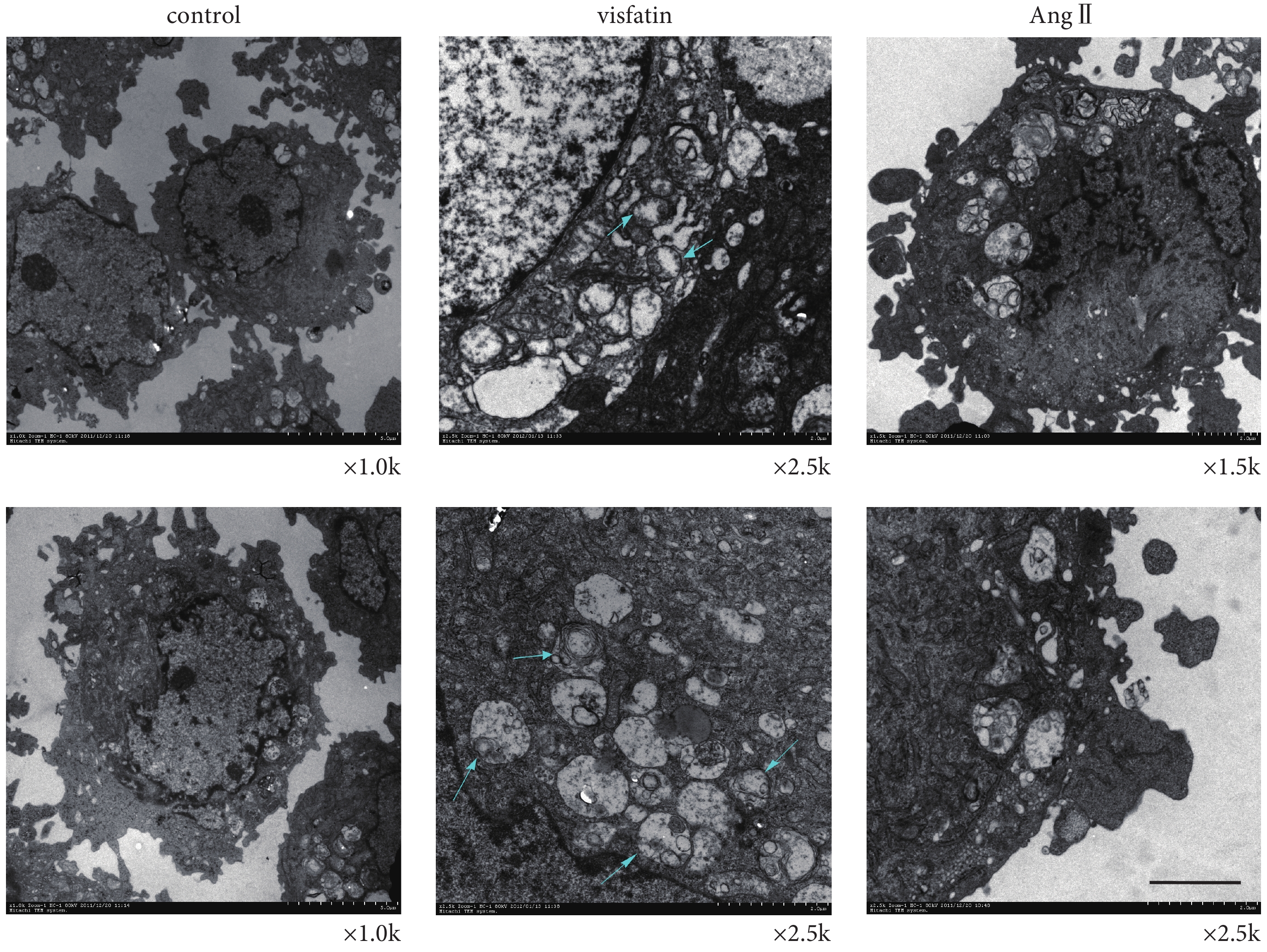 圖3
Visfatin 對 HUVECs 超微結構變化的影響(圖中標尺 = 100 nm)
Figure3.
Ultrastructural organization of HUVECs (scale bar = 100 nm)
圖3
Visfatin 對 HUVECs 超微結構變化的影響(圖中標尺 = 100 nm)
Figure3.
Ultrastructural organization of HUVECs (scale bar = 100 nm)
2.4 LOX-1 參與介導 Visfatin 誘導細胞發生 Necroptosis
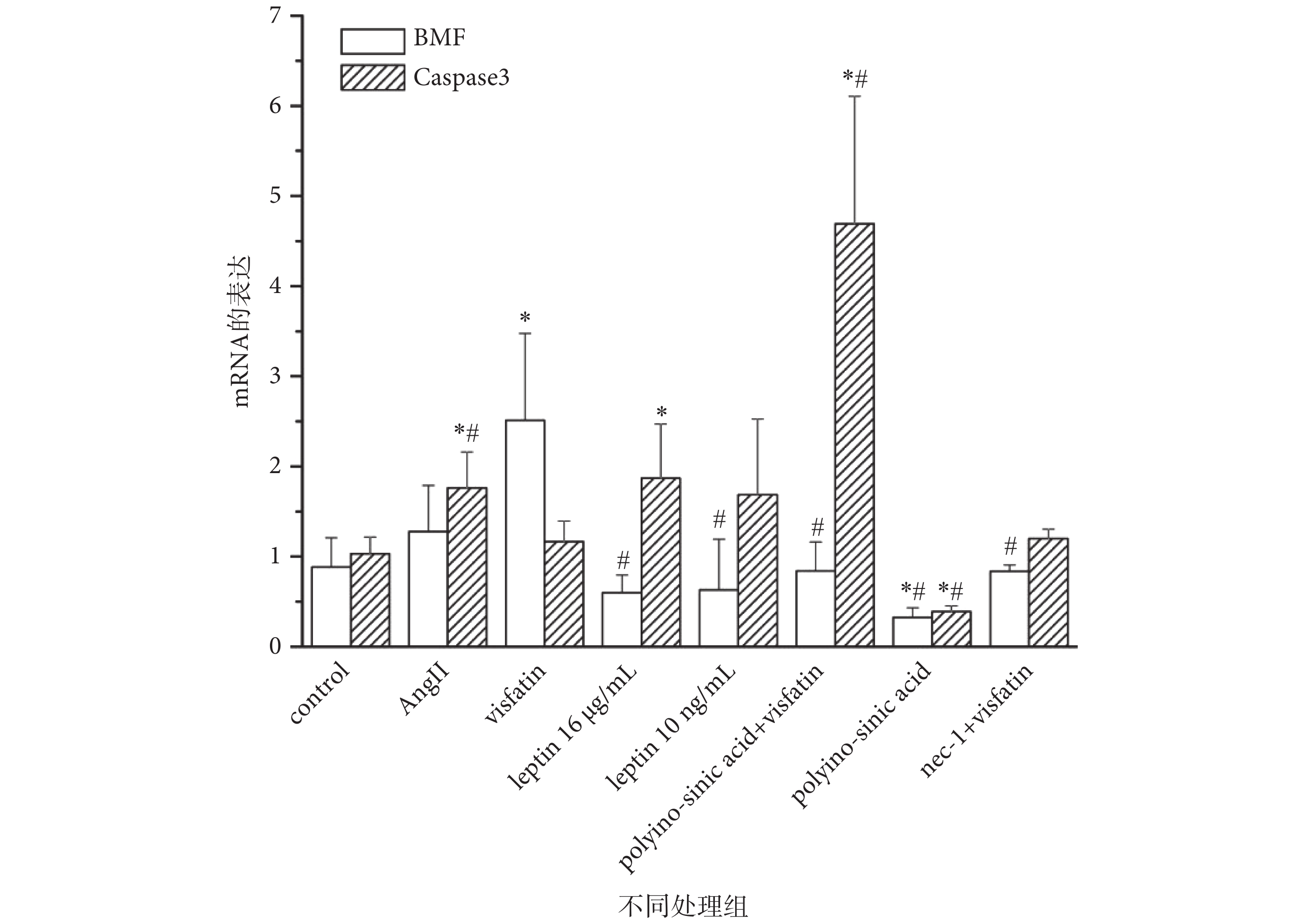
為深入探究 Visfatin 對細胞發生 Necroptosis 和凋亡的影響及其可能機制,我們應用 RT-PCR 方法對 Visfatin、AngⅡ以及 Leptin 干預后細胞中 Necroptosis 特異性基因 BMF[16]和凋亡特異性基因 Caspase3 的基因表達進行檢測。如圖 4 所示,與對照組相比,Visfatin 可明顯上調 HUVECs 細胞中 BMF 的 mRNA 表達(P < 0.05),但對凋亡特異性基因 Caspase3 表達則無明顯的上調作用。而 AngⅡ、Leptin 16 μg/mL 組可以顯著上調 Caspase3 的基因表達(P < 0.05)。此外,流式細胞化學法檢測結果也顯示,Visfatin 刺激組中細胞并無明顯凋亡峰,AngⅡ刺激組中出現了明顯的凋亡峰(見表 2)。說明此濃度的 Visfatin 可誘導細胞發生 Necroptosis,而非凋亡。
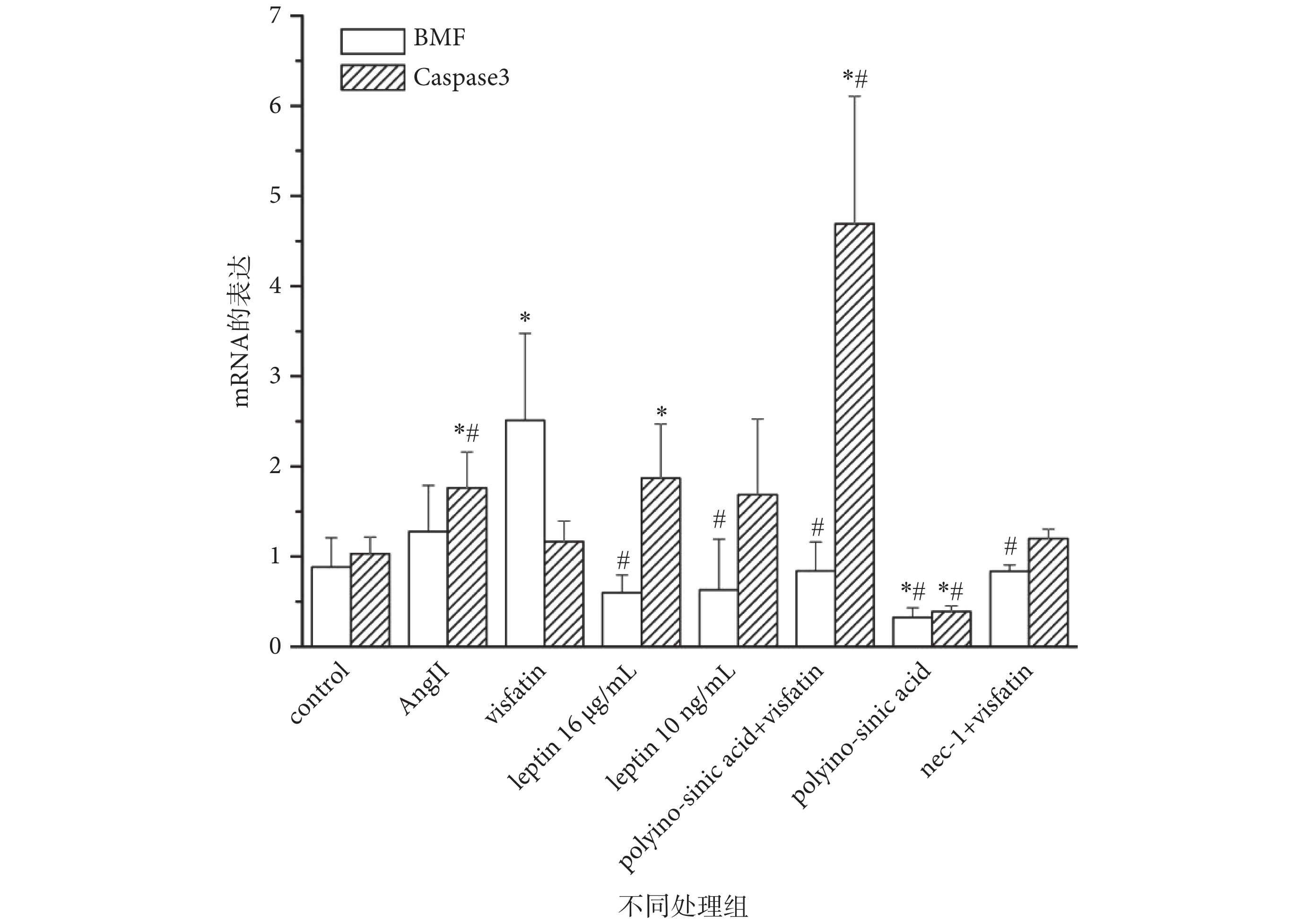 圖4
LOX-1 介導 Visfatin 促進 HUVECs 發生 Necroptosis
圖4
LOX-1 介導 Visfatin 促進 HUVECs 發生 Necroptosis
Necroptosis 特異性基因 BMF 及凋亡相關基因 Caspase3 基因表達. *
the mRNA expression of BMF and Caspase3. *
進一步實驗中我們發現,加用 LOX-1 特異性抑制劑 Polyinosinic acid 或 Necroptosis 特異性抑制劑 Necrostatin-1(Nec-1)后,與單純 Visfatin 刺激組相比,BMF 的基因表達水平顯著降低,而 Caspase3 的表達卻出現明顯增加(P < 0.05)(見圖 4)。流式細胞化學法結果顯示,Polyinosinic acid+visfatin 組中,凋亡峰較 Visfatin 單獨刺激組明顯(見表 2)。以上結果說明,LOX-1 參與介導 Visfatin 誘導 HUVECs 發生 Necroptosis。
2.5 LOX-1 參與介導 Visfatin 抑制細胞增殖
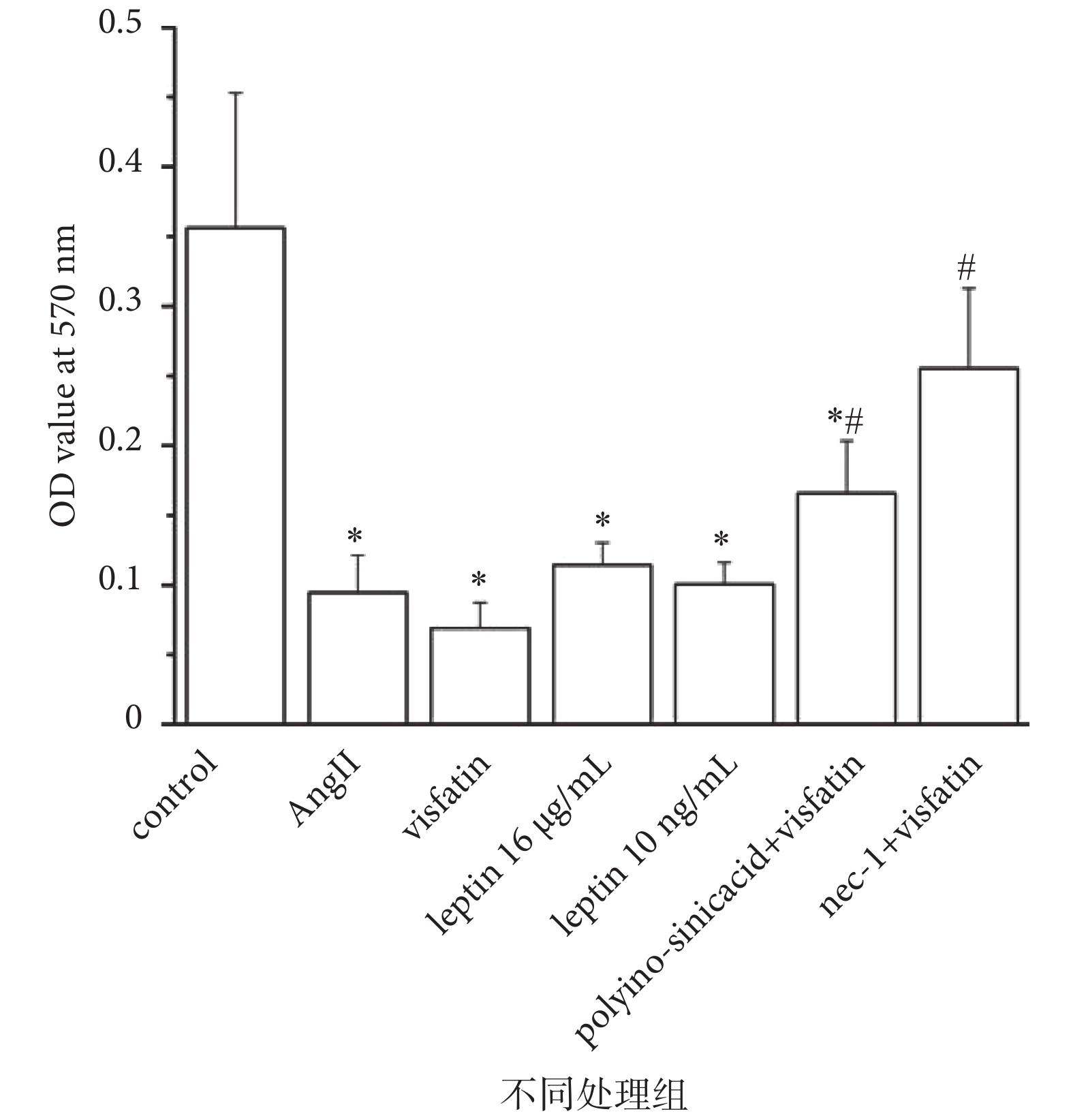
采用 MTT 法檢測不同干預措施對 HUVECs 增殖的影響,結果如圖 5 所示,與對照組相比,Visfatin 組、AngⅡ組和 Leptin 16 μg/mL、Leptin 10 ng/mL 組 HUVECs 細胞增殖均受到顯著抑制(P < 0.05),其中 Visfatin 組作用最為顯著。加用 LOX-1 特異性抑制劑 Polyinosinic acid 或 Necroptosis 特異性抑制劑 Necrostatin-1(Nec-1)后,與單純 Visfatin 刺激組相比,細胞增殖率出現明顯回升(P < 0.05)。
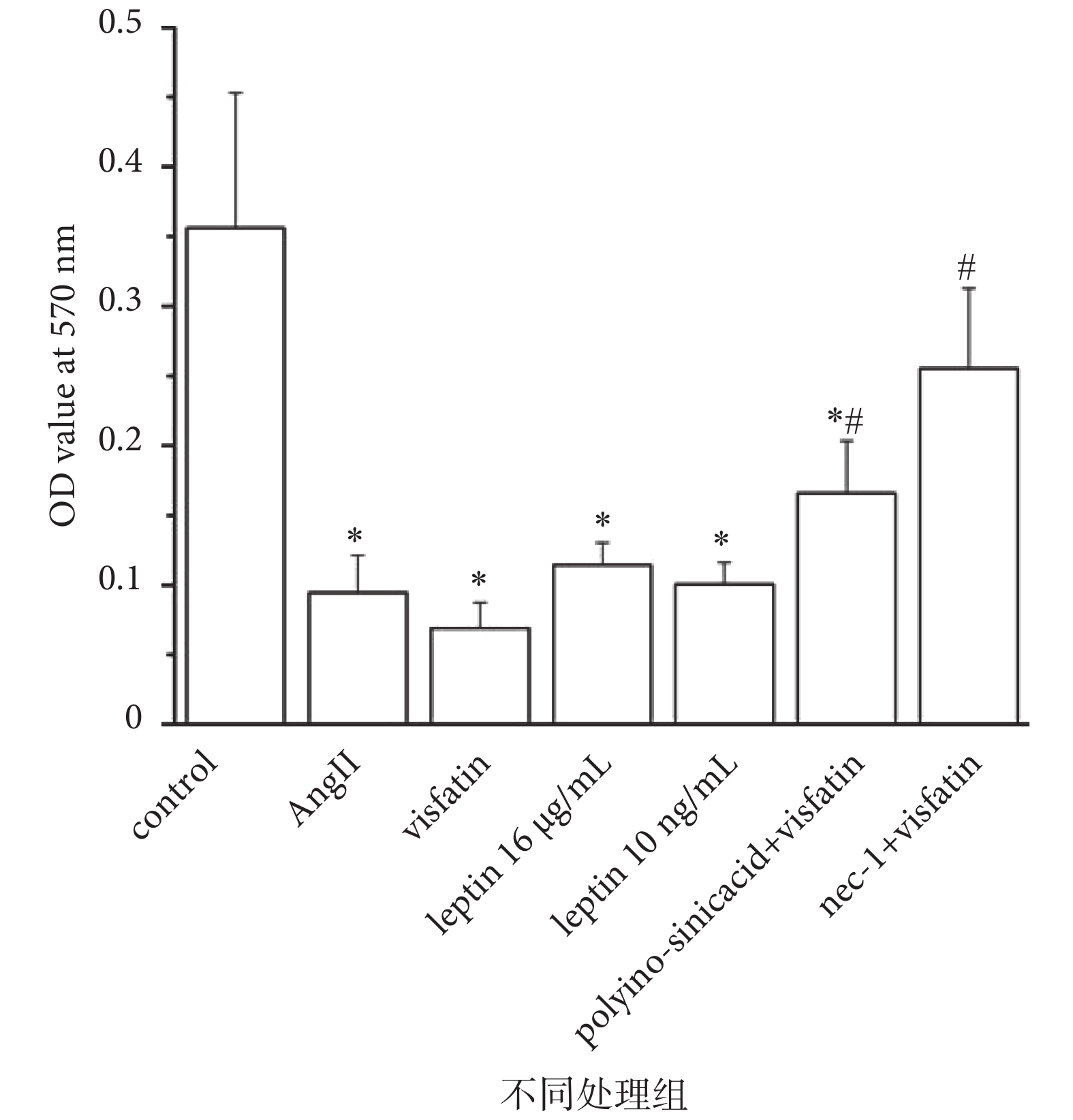 圖5
LOX-1 介導 Visfatin 對 HUVECs 增殖的影響
圖5
LOX-1 介導 Visfatin 對 HUVECs 增殖的影響
MTT 法檢測 HUVECs 細胞增殖。*
the proliferation of HUVECs detected by MTT. *
此外,我們采用流式細胞化學法檢測 Visfatin 對 HUVECs 細胞周期的影響,結果顯示,空白對照組、Visfatin、AngⅡ、Leptin、Polyinosinic acid+visfatin 及 Nec-1+visfatin 組的 S 期分別為 5.1、3.6、3.4、4.0、4.2 及 4.4。與對照組相比,Visfatin、AngⅡ及 Leptin 刺激組細胞 S 期明顯降低;而在使用 LOX-1 特異性抑制劑 Polyinosinic acid 或 Necroptosis 特異性抑制劑 Nec-1 預處理細胞后,較單獨使用 Visfatin 組,細胞 S 期升高(見表 2)。以上結果均提示,Visfatin 可以抑制細胞增殖,而這種抑制作用可能是通過 LOX-1 介導的,且 Necroptosis 很可能是發生此抑制增殖過程的主要途徑。
3 討論
動脈粥樣硬化是一種常見的慢性心腦血管疾病,以血管內皮細胞內和細胞間大量脂質堆積、單核/巨噬細胞浸潤、泡沫細胞形成、血管平滑肌細胞增殖并產生某些炎性因子引起一系列炎癥反應等為特征,而炎癥反應是動脈粥樣硬化過程中典型的病理特征[1-2]。內皮細胞受損及功能障礙在動脈粥樣硬化的發生發展中扮演著重要的角色,內皮完整性破壞使其對脂蛋白通透性增大,促進脂質遷移和沉積,隨后單核/巨噬細胞聚集和平滑肌細胞遷移至內膜,致 T 細胞的活化,并形成泡沫細胞及炎性細胞浸潤,形成脂質池,致使管壁損傷加重,從而促進粥樣斑塊形成,導致動脈粥樣硬化的進一步發展[9]。多項研究表明,Visfatin 是一種脂肪細胞因子,與炎癥反應密切相關,在多種炎癥反應過程中表現活躍并出現升高[17]。本研究也發現 Visfatin 可以誘導內皮細胞 HUVECs 中炎癥因子 MCP-1 的表達,參與調控動脈粥樣硬化的形成和發展(見圖 2)。已知,LOX-1 及某些脂質成分激活血管內皮細胞是動脈粥樣硬化發生和發展的重要環節[18],在動脈粥樣硬化早期受損部位及進展期斑塊的新生血管內皮/巨噬細胞和平滑肌細胞均可發現 LOX-1 的高表達[19]。LOX-1 可以介導血管內皮細胞攝取 Ox-LDL,通過巨噬細胞清道夫受體途徑被巨噬細胞吞噬,形成泡沫細胞并沉積于血管內皮,引起內皮受損及功能紊亂。其中,Visfatin 引起的促炎作用,部分程度上是通過 LOX-1 介導的(見圖 1、2)。Visfatin 通過誘導血管內皮細胞中 LOX-1 的表達引起炎癥,導致內皮細胞損傷及功能紊亂,促進動脈粥樣硬化發生與發展的惡性循環。
除了炎癥因子,凋亡和壞死也是造成血管內皮細胞損傷及功能紊亂的重要途徑。眾所周知,凋亡是一個細胞進行自我調控的主動過程,其中 Caspase 激活是調控凋亡發生的關鍵環節[20]。而 Necroptosis 則是一種由非死亡受體誘導且不依賴于 Caspase 激活的程序性壞死,具有明顯的壞死形態及特性,同時可引起一系列炎癥反應,導致損傷級聯放大,與動脈粥樣硬化的發生密切相關。我們的研究顯示,Visfatin 可以誘導 HUVECs 發生 Necroptosis,包括壞死性特征的出現(見圖 3)以及 Necroptosis 特異性基因 BMF 表達顯著增加等(見圖 4),進而引起內皮細胞損傷及功能障礙,影響細胞增殖(見圖 5),而 LOX-1 很可能是介導這一過程的關鍵受體。另外,我們觀察到 Visfatin 刺激并不能引起 Caspase3 基因表達的明顯變化,提示 LOX-1 在 Visfatin 誘導的凋亡途徑中可能只發揮了極其微弱的作用。有趣的是,當抑制了 LOX-1 這一調控 Necroptosis 途徑后,Caspase3 表達出現顯著升高,Visfatin 可能通過其他途徑誘導細胞發生凋亡。近來研究也表明,在抑制凋亡的情況下,可以引起 Necroptosis 的發生[21];而當抑制了 Necroptosis 后,也可能促使凋亡的發生。提示 Necroptosis 與凋亡之間有著極為密切的關系,二者之間可能存在相互轉化,是兩個相互補充的細胞死亡途徑。
綜上所述,LOX-1 參與介導 Visfatin 誘導血管內皮細胞發生炎癥反應及 Necroptosis,損傷內皮細胞結構及功能,進而促進動脈粥樣硬化的發生發展進程。本研究結果有望為探索肥胖與動脈粥樣硬化之間的潛在關系提供新的理論基礎,也為臨床治療肥胖導致的動脈粥樣硬化等心血管疾病提供潛在的靶點。
利益沖突聲明:本文全體作者均聲明不存在利益沖突。
引言
動脈粥樣硬化(atherosclerosis,AS)是嚴重危害人類健康的一種疾病,也是眾多心腦血管疾病的病理基礎[1]。研究表明,動脈粥樣硬化是一個具有慢性炎癥反應特征的病理過程[2]。而肥胖(obesity)是動脈粥樣硬化的獨立危險因素之一,是一種非感染性、慢性、全身性炎癥的病理狀態,可誘導多種具有血管活性的激素和脂肪細胞因子(adipokines)的分泌,如脂聯素(adiponectin)、瘦素(leptin)、腫瘤壞死因子(tumor necrosis factor,TNF-α)等[3]。這些脂肪細胞因子在維持能量及心血管內環境的穩定、免疫應答、葡萄糖及脂質代謝等方面均發揮著重要的作用。因此,研究肥胖與動脈粥樣硬化之間的潛在機制,對于預防和治療動脈粥樣硬化發生發展有著重要的意義。
Visfatin 是近年來新發現的一種主要由脂肪組織分泌的脂肪細胞因子[4],能與胰島素受體結合而具有類胰島素活性,與肥胖及胰島素抵抗密切相關[5]。Dahl 等[6]研究發現,在不穩定心絞痛患者頸動脈和冠狀動脈粥樣硬化斑塊的富含脂質區,泡沫細胞和巨噬細胞中 Visfatin 均呈高表達,提示可能與粥樣斑塊的形成與破裂有關。眾多研究表明,血管內皮細胞中的 Visfatin 可通過誘導炎癥因子,如單核細胞趨化蛋白-1(monocyte chemotactic protein 1,MCP-1)、細胞間黏附分子-1(intercellular cell adhesion molecule-1,ICAM-1)和血管細胞黏附分子-1(vascular cell adhesion molecule-1,VCAM-1)等的表達[7-9],參與動脈粥樣硬化的炎癥過程,進而導致粥樣硬化斑塊的不穩定性及壞死性凋亡(Necroptosis)誘發的內皮功能障礙[6],但 Visfatin 在動脈粥樣硬化發生發展中的具體作用尚不清楚。
動脈粥樣硬化是一個慢性炎癥過程,而血管內皮細胞損傷及功能紊亂是引起血管炎癥反應、啟動動脈粥樣硬化的關鍵因素[10]。LOX-1 是一種廣泛表達于血管內皮細胞的Ⅱ型膜蛋白,也是介導內皮細胞對氧化低密度脂蛋白(oxidized low-density lipoprotein,OxLDL)等促炎物質進行攝取和降解的主要受體,與動脈粥樣硬化的發生、發展密切相關[11]。LOX-1 的表達受多種促炎因子、促氧化劑和機械刺激等因素調控,如 Ox-LDL、血管緊張素-Ⅱ(angiotensin-Ⅱ,Ang-Ⅱ)、TNF-α 和流體切應力等[12-13]。目前研究表明,LOX-1 的異常表達是引起炎癥反應、Necroptosis 誘發的內皮功能障礙及動脈粥樣硬化發生的重要因素[14],但 Visfatin 與 LOX-1 之間的關系及其在動脈粥樣硬化發展中的作用尚未闡明。
為此,本研究將利用細胞生物學、分子生物學、免疫化學等方法來觀察 Visfatin 對血管內皮細胞中炎癥反應及 Necroptosis 的影響,并探討 LOX-1 在其中的作用,以期為動脈粥樣硬化等心血管疾病的防治提供新的靶點。
1 材料與方法
1.1 材料和試劑
M199 培養基、胰蛋白酶、TRIzol 購自美國 Invitrogen 公司;胎牛血清(fetal bovine serum,FBS)購自美國 Hyclone 公司;RT-PCR 試劑盒、SYBR/Eva Green? Real-time PCR Master Mix 購自日本 TOKOBO 公司;BCA 蛋白定量試劑盒購自美國 Pierce 公司;人 MCP-1 ELISA 試劑盒購自美國 R&D 公司;小鼠抗 β-actin 抗體、兔抗 LOX-1 多克隆抗體(H-140)購自美國 Santa Cruz 公司;兔抗 MCP-1 多克隆抗體購自武漢博士德公司;辣根酶標記山羊抗小鼠 IgG(ZF-2305)、辣根酶標記山羊抗兔 IgG(H+L)(ZF-2301)、FITC 標記山羊抗兔 IgG(H+L)(ZF-0311)購自北京中杉金橋公司。其余試劑均為市售分析純產品。
1.2 實驗方法
1.2.1 細胞分離及培養
無菌條件下取剖宮產術后的健康胎兒臍帶(15~20 cm,離體時間小于 4 h),置入 4℃ 的 PBS 緩沖液(含 100 U/mL 青霉素、100 μg/mL 鏈霉素)中并將該臍靜脈沖洗干凈。0.1% Ⅱ型膠原酶灌注靜脈,于 37℃ 孵箱中孵育 20 min 后輕按臍靜脈外部使內皮細胞脫落。吸取消化液,加入等量含 10% FBS 的 M199 培養基終止酶反應。1 500 r/min 離心 10 min,棄上清,沉淀即為分離出的人臍靜脈內皮細胞(human umbilical vein endothelial cells,HUVECs)。
HUVECs 用含 15%~20% FBS、20 μL/mL 內皮細胞生長添加劑(ECGS)的 M199 培養基,于 37℃、5% CO2 的培養箱(濕度 100%)靜置培養。細胞密度達 90% 后,采用胰蛋白酶消化傳代,取對數生長期細胞進行后續實驗。
1.2.2 實驗分組
取對數生長期細胞,在 M199 基礎培養基(含 1% FBS 及 1% BSA)饑餓 6 h 后進行干預。對照組不施加任何處理。干預措施包括:① 分別用 100 nmol/L AngⅡ、100 ng/mL Visfatin、16 μg/mL 或 10 ng/mL Leptin 刺激 24 h;② 250 μg/mL Polyinosinic acid(LOX-1 抑制劑)預處理 1 h 后,再加入 100 ng/mL Visfatin 刺激 24 h;③ 10 μmol/L Necrostatin-1(Necroptosis 抑制劑,Nec-1)預處理 3 h 后,再加入 100 ng/mL Visfatin 刺激 24 h;收集細胞總 RNA、蛋白或上清液進行實驗。
1.2.3 熒光定量 RT-PCR 測定基因表達變化
采用 TRIzol 試劑按操作說明書步驟提取細胞總 RNA,并用紫外分光光度儀測定 RNA 濃度。將 1.5 μg 總 RNA 逆轉錄為互補脫氧核糖核酸(complementary deoxyribonucleic acid,cDNA)后完成 PCR 熒光定量檢測。反應條件為:94℃ 預變性 2 min,94℃ 變性 10 s,58℃ 退火 10 s,72℃ 延伸 15 s,共 40 個循環。所用引物序列如表 1 所示,β-actin 為內參基因。
1.2.4 Western blot 測定蛋白表達變化
細胞進行相應處理后,使用 RIPA 蛋白裂解液收集細胞總蛋白,BCA 法測定蛋白濃度,沸水煮 5 min 變性。取等量蛋白(40 μg)上樣,經 SDS-PAGE 電泳后,將蛋白轉至 PVDF 膜上,封閉后 4℃ 搖床孵育一抗(LOX-1,1∶200;MCP-1,1∶200;β-actin,1∶2 000)過夜,TBST 洗 3 次,室溫孵育二抗(1∶5 000)1 h,增強化學發光(enhanced chemiluminescence,ECL)顯影并通過凝膠成像儀觀察蛋白的表達情況。
1.2.5 免疫細胞化學法檢測蛋白表達變化
接種細胞于 6 孔板中蓋玻片上,待細胞達 70%~80% 融合時,多聚甲醛固定 30 min。脫蠟、水化后,PBS 洗三次,3% H2O2(80% 甲醇)室溫孵育 10 min。進行抗原修復后滴加正常山羊血清室溫封閉 20 min,一抗(37℃ 1 h)、二抗(37℃ 1 h)孵育,后滴加鏈霉親和素-過氧化物酶(streptavidin-peroxidase,SP),37℃ 孵育 1 h,DAB 顯色、蘇木精復染、脫水、透明、封片、鏡檢。
1.2.6 酶聯免疫吸附法(enzyme-linked immunosorbent assay,ELISA)檢測上清液中蛋白表達變化
分別收集對照組和干預組細胞培養上清液,按照試劑盒提供步驟進行操作,使用酶標儀(Model1680,Bio-Rad,美國)檢測 450 nm 處各孔吸光度(OD)值,進而測定 HUVECs 上清液中 MCP-1 蛋白含量。
1.2.7 MTT 法檢測細胞增殖
將 HUVECs 細胞按 1 × 104/孔接種于 96 孔板中,給予不同處理后,向每孔加入 MTT 溶液(5 mg/mL)20 μL,繼續孵育 4 h。后各再加入 150 μL 二甲基亞砜(dimethylsulfoxide,DMSO),振蕩 10 min 使之充分溶解,使用酶標儀檢測 570 nm 處各孔吸光度 A 值。細胞增殖率(或抑制率)=[(對照組 A570 ? 空白孔 A570) ? (實驗組 A570 ? 空白孔 A570)]/(對照組 A570 ? 空白孔 A570) × 100%。
1.2.8 透射電鏡觀察 HUVECs 超微結構
將對照組和干預組細胞進行消化后,300 g 離心 5 min,取細胞沉淀,依次加入 2.5% 戊二醛、1% 四氧化鋨固定,50%、70%、90%、100% 乙醇進行梯度脫水,置于丙酮和純 812 樹脂混合液(1∶1)中 40℃ 浸透 30 min。然后,浸入純 812 樹脂中包埋,切片,醋酸鈾/檸檬酸鉛雙染后置于透射電鏡(H7650,Hitachi,日本)下觀察。
1.2.9 流式細胞化學法檢測細胞周期及凋亡
將對照組和干預組細胞進行消化后,800 r/min 離心 15 min,收集細胞,PBS 洗 2 次。于 70 % 乙醇中 4℃ 固定過夜。再次離心,收集固定細胞并加入適量 PBS 使之重懸,依次加入 RNase-A(50 μg/mL,37℃ 水浴 30 min)和 PI(65 μg/mL,冰浴避光染色 30 min),過濾后使用流式細胞儀(Invitrogen,美國)檢測細胞周期及凋亡情況。
1.2.10 統計學分析
實驗數據以均數 ± 標準差表示,采用 SPSS 17.0 軟件分析處理,多組間比較采用單因素方差分析(One-way ANOVA),組間比較采用 LSD 法。P < 0.05 表示差異有統計學意義。
2 結果
2.1 Visfatin 誘導 HUVECs 中 LOX-1 蛋白和基因表達
采用倒置相差顯微鏡觀察 HUVECs 細胞形態,如圖 1a 所示,HUVECs 呈扁平、多角形,單層鋪路石狀排列。細胞核呈橢圓形,位于細胞的中央,有 1~3 個核仁。
 圖1
Visfatin 刺激誘導 HUVECs 中 LOX-1 的表達
圖1
Visfatin 刺激誘導 HUVECs 中 LOX-1 的表達
a. 分離培養的 HUVECs,圖中標尺 = 100 μm;b-c. LOX-1 的基因(b)和蛋白(c)表達;d. 免疫細胞化學法檢測 HUVECs 中 LOX-1 的蛋白表達。*
a. photographs of cultured HUVECs (scale bar = 100 μm); b-c. the mRNA (b) and protein (c) expression of LOX-1; d. the expression of LOX-1 in HUVECs detected by immunocytochemistry. *
為探究 Visfatin 對 LOX-1 表達的影響,我們采用 100 ng/mL 的 Visfatin 對細胞進行預處理,并以 100 nmol/L AngⅡ為陽性對照,通過 RT-PCR、Western blot 等方法檢測 LOX-1 的表達變化。實驗結果顯示,與對照組相比,100 ng/mL 的 Visfatin 作用 HUVECs 24 h 后,可顯著上調 LOX-1 的 mRNA 和蛋白表達水平(P < 0.05)(見圖 1b-c)。免疫細胞化學檢測法結果顯示,與對照組相比較,100 ng/mL Visfatin 作用 24 h 能明顯上調 HUVECs 中 LOX-1 蛋白(圖片中藍色為細胞部分,紅色為 LOX-1 蛋白表達部分)的表達(見圖 1d)。
2.2 LOX-1 介導 Visfatin 誘導 HUVECs 中 MCP-1 蛋白和基因表達
研究表明,Visfatin 具有促進炎癥因子分泌、參與機體炎癥應答、延緩中性粒細胞凋亡等作用[5, 9]。如圖 2a、c 所示,與對照組相比,100 ng/mL 的 Visfatin 作用 24 h 能夠顯著上調 HUVECs 中 MCP-1 的 mRNA 和蛋白表達水平。此外,Visfatin 作用后細胞培養上清液中分泌的 MCP-1 蛋白也出現明顯上調(見圖 2b)。說明 Visfatin 可以促進 HUVECs 中炎癥因子 MCP-1 的表達。
 圖2
Visfatin 通過 LOX-1 促進 HUVECs 中炎癥因子 MCP-1 的表達
圖2
Visfatin 通過 LOX-1 促進 HUVECs 中炎癥因子 MCP-1 的表達
a 和 c. MCP-1 的基因(a)和蛋白(c)表達;b. ELISA 法檢測 HUVECs 分泌 MCP-1 蛋白的變化。*
a & c. the mRNA (a) and protein (c) expression of MCP-1; b. the expression of MCP-1 secreted by HUVECs detected by ELISA. *
為進一步檢測 LOX-1 在 Visfatin 誘導血管內皮細胞中 MCP-1 表達中的作用,我們在 Visfatin 刺激前用 250 μg/mL Polyinosinic acid(LOX-1 特異性抑制劑)對細胞進行 1 h 預處理,結果顯示,使用 Polyinosinic acid 后,HUVECs 中 MCP-1 的 mRNA 和蛋白表達較 Visfatin 單獨刺激組明顯降低(P < 0.05)(見圖 2a、c);細胞培養上清液中的分泌 MCP-1 蛋白也顯著減少(見圖 2b)。提示 LOX-1 可能參與介導 Visfatin 上調 HUVECs 中 MCP-1 的表達。
2.3 Visfatin 對 HUVECs 超微結構變化的影響
我們利用透射電鏡觀察空白對照組及 Visfatin 刺激組 HUVECs 的超微結構的變化,AngⅡ 刺激組作為陽性對照。如圖 3 所示(圖片位置上、下為同一刺激組或空白對照),Visfatin 刺激組中,出現部分壞死樣形態學特征,如細胞膜完整性的破壞,細胞或細胞器(如線粒體、內質網等)腫脹,甚至崩解,同時核內染色質邊聚、細胞核凝聚,但未見明顯的形態改變。此外,還觀察到部分類似自噬體形態樣結構出現。AngⅡ刺激組可見細胞核內染色質邊聚,細胞膜完整,線粒體有正常的超微結構,但未見明顯凋亡小體。而空白對照組中,均無上述細胞壞死的形態學特征。自噬是 Necroptosis 的普遍下游應答表現[15],因此,以上結果提示,Visfatin 可能誘導細胞發生了 Necroptosis。
 圖3
Visfatin 對 HUVECs 超微結構變化的影響(圖中標尺 = 100 nm)
Figure3.
Ultrastructural organization of HUVECs (scale bar = 100 nm)
圖3
Visfatin 對 HUVECs 超微結構變化的影響(圖中標尺 = 100 nm)
Figure3.
Ultrastructural organization of HUVECs (scale bar = 100 nm)
2.4 LOX-1 參與介導 Visfatin 誘導細胞發生 Necroptosis
為深入探究 Visfatin 對細胞發生 Necroptosis 和凋亡的影響及其可能機制,我們應用 RT-PCR 方法對 Visfatin、AngⅡ以及 Leptin 干預后細胞中 Necroptosis 特異性基因 BMF[16]和凋亡特異性基因 Caspase3 的基因表達進行檢測。如圖 4 所示,與對照組相比,Visfatin 可明顯上調 HUVECs 細胞中 BMF 的 mRNA 表達(P < 0.05),但對凋亡特異性基因 Caspase3 表達則無明顯的上調作用。而 AngⅡ、Leptin 16 μg/mL 組可以顯著上調 Caspase3 的基因表達(P < 0.05)。此外,流式細胞化學法檢測結果也顯示,Visfatin 刺激組中細胞并無明顯凋亡峰,AngⅡ刺激組中出現了明顯的凋亡峰(見表 2)。說明此濃度的 Visfatin 可誘導細胞發生 Necroptosis,而非凋亡。
 圖4
LOX-1 介導 Visfatin 促進 HUVECs 發生 Necroptosis
圖4
LOX-1 介導 Visfatin 促進 HUVECs 發生 Necroptosis
Necroptosis 特異性基因 BMF 及凋亡相關基因 Caspase3 基因表達. *
the mRNA expression of BMF and Caspase3. *
進一步實驗中我們發現,加用 LOX-1 特異性抑制劑 Polyinosinic acid 或 Necroptosis 特異性抑制劑 Necrostatin-1(Nec-1)后,與單純 Visfatin 刺激組相比,BMF 的基因表達水平顯著降低,而 Caspase3 的表達卻出現明顯增加(P < 0.05)(見圖 4)。流式細胞化學法結果顯示,Polyinosinic acid+visfatin 組中,凋亡峰較 Visfatin 單獨刺激組明顯(見表 2)。以上結果說明,LOX-1 參與介導 Visfatin 誘導 HUVECs 發生 Necroptosis。
2.5 LOX-1 參與介導 Visfatin 抑制細胞增殖
采用 MTT 法檢測不同干預措施對 HUVECs 增殖的影響,結果如圖 5 所示,與對照組相比,Visfatin 組、AngⅡ組和 Leptin 16 μg/mL、Leptin 10 ng/mL 組 HUVECs 細胞增殖均受到顯著抑制(P < 0.05),其中 Visfatin 組作用最為顯著。加用 LOX-1 特異性抑制劑 Polyinosinic acid 或 Necroptosis 特異性抑制劑 Necrostatin-1(Nec-1)后,與單純 Visfatin 刺激組相比,細胞增殖率出現明顯回升(P < 0.05)。
 圖5
LOX-1 介導 Visfatin 對 HUVECs 增殖的影響
圖5
LOX-1 介導 Visfatin 對 HUVECs 增殖的影響
MTT 法檢測 HUVECs 細胞增殖。*
the proliferation of HUVECs detected by MTT. *
此外,我們采用流式細胞化學法檢測 Visfatin 對 HUVECs 細胞周期的影響,結果顯示,空白對照組、Visfatin、AngⅡ、Leptin、Polyinosinic acid+visfatin 及 Nec-1+visfatin 組的 S 期分別為 5.1、3.6、3.4、4.0、4.2 及 4.4。與對照組相比,Visfatin、AngⅡ及 Leptin 刺激組細胞 S 期明顯降低;而在使用 LOX-1 特異性抑制劑 Polyinosinic acid 或 Necroptosis 特異性抑制劑 Nec-1 預處理細胞后,較單獨使用 Visfatin 組,細胞 S 期升高(見表 2)。以上結果均提示,Visfatin 可以抑制細胞增殖,而這種抑制作用可能是通過 LOX-1 介導的,且 Necroptosis 很可能是發生此抑制增殖過程的主要途徑。
3 討論
動脈粥樣硬化是一種常見的慢性心腦血管疾病,以血管內皮細胞內和細胞間大量脂質堆積、單核/巨噬細胞浸潤、泡沫細胞形成、血管平滑肌細胞增殖并產生某些炎性因子引起一系列炎癥反應等為特征,而炎癥反應是動脈粥樣硬化過程中典型的病理特征[1-2]。內皮細胞受損及功能障礙在動脈粥樣硬化的發生發展中扮演著重要的角色,內皮完整性破壞使其對脂蛋白通透性增大,促進脂質遷移和沉積,隨后單核/巨噬細胞聚集和平滑肌細胞遷移至內膜,致 T 細胞的活化,并形成泡沫細胞及炎性細胞浸潤,形成脂質池,致使管壁損傷加重,從而促進粥樣斑塊形成,導致動脈粥樣硬化的進一步發展[9]。多項研究表明,Visfatin 是一種脂肪細胞因子,與炎癥反應密切相關,在多種炎癥反應過程中表現活躍并出現升高[17]。本研究也發現 Visfatin 可以誘導內皮細胞 HUVECs 中炎癥因子 MCP-1 的表達,參與調控動脈粥樣硬化的形成和發展(見圖 2)。已知,LOX-1 及某些脂質成分激活血管內皮細胞是動脈粥樣硬化發生和發展的重要環節[18],在動脈粥樣硬化早期受損部位及進展期斑塊的新生血管內皮/巨噬細胞和平滑肌細胞均可發現 LOX-1 的高表達[19]。LOX-1 可以介導血管內皮細胞攝取 Ox-LDL,通過巨噬細胞清道夫受體途徑被巨噬細胞吞噬,形成泡沫細胞并沉積于血管內皮,引起內皮受損及功能紊亂。其中,Visfatin 引起的促炎作用,部分程度上是通過 LOX-1 介導的(見圖 1、2)。Visfatin 通過誘導血管內皮細胞中 LOX-1 的表達引起炎癥,導致內皮細胞損傷及功能紊亂,促進動脈粥樣硬化發生與發展的惡性循環。
除了炎癥因子,凋亡和壞死也是造成血管內皮細胞損傷及功能紊亂的重要途徑。眾所周知,凋亡是一個細胞進行自我調控的主動過程,其中 Caspase 激活是調控凋亡發生的關鍵環節[20]。而 Necroptosis 則是一種由非死亡受體誘導且不依賴于 Caspase 激活的程序性壞死,具有明顯的壞死形態及特性,同時可引起一系列炎癥反應,導致損傷級聯放大,與動脈粥樣硬化的發生密切相關。我們的研究顯示,Visfatin 可以誘導 HUVECs 發生 Necroptosis,包括壞死性特征的出現(見圖 3)以及 Necroptosis 特異性基因 BMF 表達顯著增加等(見圖 4),進而引起內皮細胞損傷及功能障礙,影響細胞增殖(見圖 5),而 LOX-1 很可能是介導這一過程的關鍵受體。另外,我們觀察到 Visfatin 刺激并不能引起 Caspase3 基因表達的明顯變化,提示 LOX-1 在 Visfatin 誘導的凋亡途徑中可能只發揮了極其微弱的作用。有趣的是,當抑制了 LOX-1 這一調控 Necroptosis 途徑后,Caspase3 表達出現顯著升高,Visfatin 可能通過其他途徑誘導細胞發生凋亡。近來研究也表明,在抑制凋亡的情況下,可以引起 Necroptosis 的發生[21];而當抑制了 Necroptosis 后,也可能促使凋亡的發生。提示 Necroptosis 與凋亡之間有著極為密切的關系,二者之間可能存在相互轉化,是兩個相互補充的細胞死亡途徑。
綜上所述,LOX-1 參與介導 Visfatin 誘導血管內皮細胞發生炎癥反應及 Necroptosis,損傷內皮細胞結構及功能,進而促進動脈粥樣硬化的發生發展進程。本研究結果有望為探索肥胖與動脈粥樣硬化之間的潛在關系提供新的理論基礎,也為臨床治療肥胖導致的動脈粥樣硬化等心血管疾病提供潛在的靶點。
利益沖突聲明:本文全體作者均聲明不存在利益沖突。