脊髓損傷是一個復雜的病理過程。基于臨床前實驗令人鼓舞的結果,部分干細胞治療已轉化為臨床實踐。間充質干細胞因其來源豐富、增殖能力強、低免疫原性,現已成為干細胞移植治療脊髓損傷策略中重要的種子細胞之一。然而,將間充質干細胞移植到脊髓損傷處后的存活率較低,阻礙了其在臨床上的進一步應用。近年來,水凝膠材料因其良好的生物相容性、生物降解性被廣泛應用于組織工程,水凝膠聯合間充質干細胞的治療策略在脊髓損傷修復中已取得一定進展。本綜述討論了間充質干細胞修復脊髓損傷的意義以及目前存在的問題,闡述了水凝膠聯合間充質干細胞修復脊髓損傷的研究進展并對其在臨床研究中的應用進行了展望,旨在為該技術今后在脊髓損傷治療中的應用提供借鑒和新思路。
引用本文: 袁欣, 丁璐, 鄧宇斌. 水凝膠聯合間充質干細胞治療脊髓損傷的研究進展. 生物醫學工程學雜志, 2021, 38(4): 805-811. doi: 10.7507/1001-5515.202005055 復制
版權信息: ?四川大學華西醫院華西期刊社《生物醫學工程學雜志》版權所有,未經授權不得轉載、改編
引言
脊髓損傷(spinal cord injury,SCI)是病情嚴重、預后較差的中樞神經系統(central nervous system,CNS)疾病。SCI 導致受損脊髓以下神經功能障礙,引起感覺或運動能力的部分或全部喪失,患者多遺留四肢癱瘓、頑固性神經痛等嚴重后遺癥。在全球,每年 SCI 新增病例 12~65/10 萬[1],損傷后續的治療費用給患者及社會都帶來沉重的經濟負擔。
SCI 可分為原發性損傷和繼發性損傷兩個階段。原發性損傷會導致脊柱受到機械破壞和脫位,引起脊髓組織受壓或橫斷,損傷中心區域血管系統被破壞,血-脊髓屏障損壞,進而引發持續的繼發性損傷級聯反應,導致脊髓進一步損傷,造成進行性神經細胞死亡和神經功能障礙。血腦屏障功能障礙和血栓形成引起水腫和局部缺血、氧自由基形成以及谷氨酸釋放增加,導致大量神經元死亡;這些損傷反應又反過來引發激烈的退化級聯反應,伴隨白質區少突膠質細胞大量死亡,引起脫髓鞘病變、神經膠質增生和細胞外基質沉積。劇烈的免疫炎癥反應是 SCI 繼發性損傷的核心,也是治療 SCI 的關鍵點之一。炎性微環境導致神經細胞大量死亡,形成致密瘢痕組織,而瘢痕組織是阻礙脊髓軸突再生和功能恢復的重要原因。
目前,除了手術減壓和藥物療法,臨床上尚無其他有效的 SCI 治療方法。近年來,干細胞與生物材料是組織工程與再生醫學領域的研究熱點,對于組織再生具有重要前景。干細胞能不斷自我更新,具有多向分化潛能,并且能夠分泌營養因子、抗炎因子發揮保護細胞和免疫調節等作用,被廣泛應用于 SCI 治療的臨床前研究。大量研究表明移植的干細胞可有效促進 SCI 后的神經再生和運動功能恢復。其中,間充質干細胞(mesenchymal stem cells,MSCs)在體外擴增迅速,可在較短時間內收獲大量細胞以滿足臨床治療需求,且在臨床治療中操作相對簡單。生物材料是能對細胞、組織和器官進行診斷、治療、替換修復或誘導再生的一類天然或人工合成的特殊功能材料,其制品已經被廣泛地應用于臨床和科研。生物材料中的一大類——水凝膠,可以模擬軟組織環境,其化學組成適于整合細胞外基質(extracellular matrix,ECM)分子以及其他黏附蛋白,能夠有效支持和引導軸突再生,因此是生物材料中用于 SCI 修復的極佳選擇。MSCs 與水凝膠聯合應用,水凝膠能夠穩定病變部位炎癥環境,同時負載 MSCs 將其原位遞送到損傷區域進行修復,并為受傷組織的再生提供適宜環境,在 SCI 修復方面有良好的應用前景。下面針對 MSCs 在 SCI 修復中的研究意義以及目前存在的問題進行討論,并對水凝膠聯合 MSCs 在 SCI 修復中的研究進展加以闡述。
1 MSCs 在 SCI 治療中的相關研究進展
MSCs 是成體干細胞的重要成員之一,存在于骨髓、臍血、臍帶、全身結締組織以及器官間質組織中,來源相對容易獲得且在體外能夠有效擴增[2],免疫原性低,是目前在臨床前和臨床研究中最有希望應用于 SCI 修復的干細胞。與其他幾種干細胞相比,MSCs 沒有倫理方面的限制,可用于自體移植,應用于中樞神經系統疾病的修復安全可靠[3-5]。近年來應用不同來源 MSCs 治療 SCI 的研究進展如下所述。
1.1 骨髓間充質干細胞
骨髓間充質干細胞(bone marrow mesenchymal stem cells,BMSCs)與造血干細胞(hematopoietic cells,HSCs)均來源于骨髓,區別于 HSCs,BMSCs 不表達造血干細胞表面標記物 CD14 和 CD34。在挫傷/橫斷的小鼠/大鼠 SCI 模型中,將 BMSCs 移植到損傷處,實驗動物的運動功能均得到改善[6-8]。在大鼠脊髓缺血再灌注損傷模型中,Chen 等[9]向腹主動脈移植 BMSCs,發現睫狀神經營養因子(ciliary neurotrophic factor,CNTF)以及抗炎因子白細胞介素(interleukin,IL)-10 的表達增加,促炎因子 IL-6 的表達減少,脊髓炎癥環境得到改善,Basso-Beattie-Bresnahan(BBB)行為學評分及電生理結果表明大鼠后肢運動功能恢復,說明 BMSCs 起到了抗炎保護作用。BMSCs 還可通過營養支持保護受損的脊髓免受進一步的細胞損傷。茍楊等[10]在大鼠 SCI 后第 1、7 和 14 天移植 BMSCs,通過共同標記 CNPase 與 caspase3,探討 BMSCs 移植能否抑制少突膠質細胞凋亡。實驗結果表明 SCI 后,BMSCs 可能通過分泌腦源性神經營養因子(brain-derived neurotrophic factor,BDNF)來抑制少突膠質細胞凋亡,起到保護神經髓鞘的作用。此外,由于 BMSCs 具有向受損組織遷移的能力,因此可以用作治療的最佳載體。將 BMSCs 移植到大鼠 SCI 模型中,發現經染料標記的 BMSCs 中的線粒體可以轉移到經氧-糖剝奪(oxygen-glucose deprivation,OGD)損傷的神經元上,OGD 運動神經元活性在線粒體遷移后得到改善,細胞凋亡減少,足跡分析結果表明大鼠前后肢協調性恢復良好[11]。在臨床研究方面,2020 年由 Sharma 等[12]完成的一項針對 180 位 SCI 患者的開放性研究中,通過腰椎穿刺注射 1.06×108個細胞,移植后(9 ± 7)月后對患者進行隨訪,以功能獨立性指標(functional independence measure,FIM)和 SCI 步行指數(walking index for SCI,WISCI)作為評價指標,結果發現,69.44% 的患者在 FIM 量表上得分得到改善,而 37.22% 的患者在 WISCI 上得分得到改善,但不足的是,該項臨床試驗缺少對照組。
1.2 臍帶間充質干細胞
臍帶間充質干細胞(umbilical cord-MSCs,UMSCs)可以通過臍帶或者新生兒的臍帶血獲得,具有低免疫原性。許多臨床前研究表明,UMSCs 在小鼠或大鼠 SCI 模型中對動物運動功能的恢復均具有一定的治療效果。Yousefifard 等[13]在大鼠 SCI 后一周移植 BMSCs 或 UMSCs,發現 BMSCs 或 UMSCs 均可減輕神經性疼痛癥狀,但 UMSCs 的存活率和處理后大鼠脊髓的電生理檢測結果明顯優于 BMSCs。目前,已有研究使用大規模中空纖維生物反應器擴增 UMSCs。研究發現經典擴增和大規模擴增 UMSCs 的方法在細胞向成脂、成骨和成軟骨方面的分化能力方面沒有差異[14],這種大規模擴增 UMSCs 的方式為將來在 SCI 患者中進行大規模應用奠定了一定基礎。
1.3 脂肪干細胞
與其他來源的 MSCs 相比,脂肪干細胞(adipose-derived MSCs,ADSCs)可以使用微創技術或脂肪抽吸術以微創的方式從脂肪組織中大量獲取。Kim 等[15]對急性 SCI 比格犬靜脈注射 ADSCs,發現小膠質細胞浸潤減少,動物后肢運動功能得到改善。Khan 等[16]同樣使用 ADSCs 治療 SCI 后的比格犬,發現病變中心神經纖維絲、抗炎因子 IL-10 表達明顯升高,促炎因子 IL-6、TNF-α 和 IL-1β 表達降低,星型膠質瘢痕減少,說明 ADSCs 通過改善炎癥環境保護神經,使動物后肢功能得到改善。ADSCs 能夠改善炎癥環境可能是以旁分泌形式起作用的,其分泌物主要由生長因子、細胞外基質成分、蛋白酶、細胞因子和多種促進血管生成、傷口愈合的免疫調節分子組成。這些生物活性分子被認為有助于組織再生,并通過抑制淋巴細胞的增殖活化減輕炎癥[17],以達到改善 SCI 微環境的目的。Maqueda 等[18]發現,以 H2O2 脈沖處理 ADSCs 能提高 ADSCs 在 SCI 微環境中的存活能力。大鼠 SCI 后 48 h 后移植該 ADSCs,發現細胞存活率升高,星形膠質瘢痕減少。此外,Barberini 等[19]對鞘內注射高劑量同種異體 ADSCs 的安全性做了研究。從寰枕向鞘內給實驗對象馬注射 GFP 標記的 1×108個 ADSCs,注射前后檢測血液和腦脊液中炎癥因子,均未見明顯變化,動物未出現不良反應,熒光檢測發現 ADSCs 遷移到腰椎區域,說明鞘內注射高劑量同種異體 ADSCs 是一種安全的方法。關于 ADSCs 的臨床試驗也已經開展。梅奧診所正在進行的一項臨床試驗(NCT03308565)CELLTOP,旨在研究鞘內注射 ADSCs 到創傷性 SCI 患者中的安全性和有效性。患者于受傷后 11 個月通過 L3-4 腰椎穿刺接受鞘內注射 1×108個自體 ADSCs。患者對手術耐受良好,沒有發生嚴重的不良事件,上下肢運動功能得到顯著改善[20]。
多年來,MSCs 一直是臨床試驗的主題,但臨床試驗的結果未能達到多種疾病模型的臨床前數據的良好結果。其中主要原因在于 MSCs 在 SCI 環境下存活率低、存活困難,難以維持自身優越的生物性能,嚴重限制了其臨床潛力。此外,直接注射會導致損傷部位細胞丟失,以及細胞移植后到其成熟表型(包括神經元、星形膠質細胞和少突膠質細胞)的分化不受控制。
近年來,已經提出基于組織工程和再生醫學的方法作為 SCI 修復/再生的替代方法。水凝膠與干細胞移植的結合也得到了廣泛的探索,期望水凝膠穩定病變部位微環境,同時將干細胞遞送到病變部位,并為受傷組織的再生提供適當的環境。下文將介紹使用水凝膠作為干細胞載體的重要性,以及這些有前途的神經組織再生工具的最新進展和成就。
2 水凝膠聯合 MSCs 在 SCI 修復中的應用
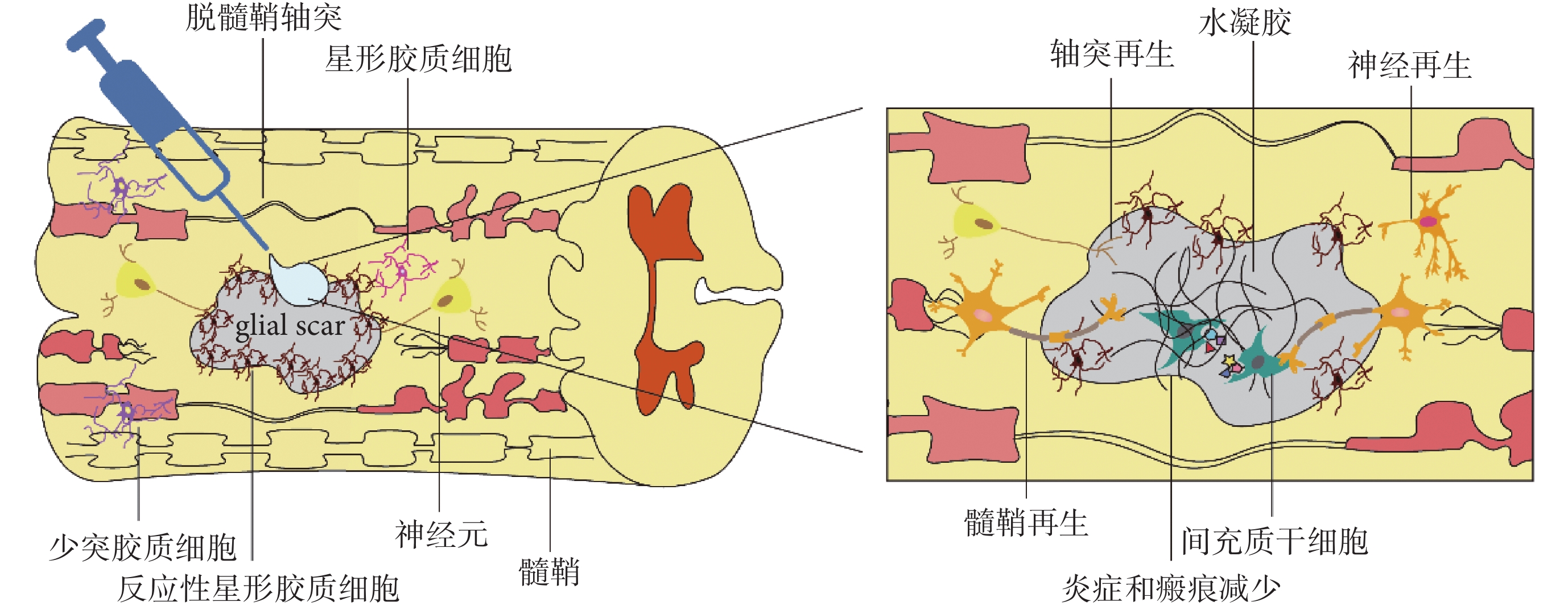
材料科學的發展為 SCI 修復提供了更多可能。水凝膠是一個能夠封裝 MSCs 的良好環境,具有高彈性、高透氣性、無毒以及力學性能良好的特點,將其用于 SCI 的修復具有三個優點:首先,水凝膠本身能夠充當載體,負載 MSCs 到達損傷部位,減少細胞向周圍組織丟失而脫靶;第二,水凝膠提供三維空間支持,利于細胞遷移、增殖及分化;第三,水凝膠能夠緩釋生物活性因子,保護抑制性微環境中 MSCs 活性及其生物功能(見圖 1)。以下將從天然高分子水凝膠、人工合成水凝膠以及天然高分子-人工合成復合水凝膠三方面對于水凝膠聯合 MSCs 修復 SCI 的研究進展進行闡述。
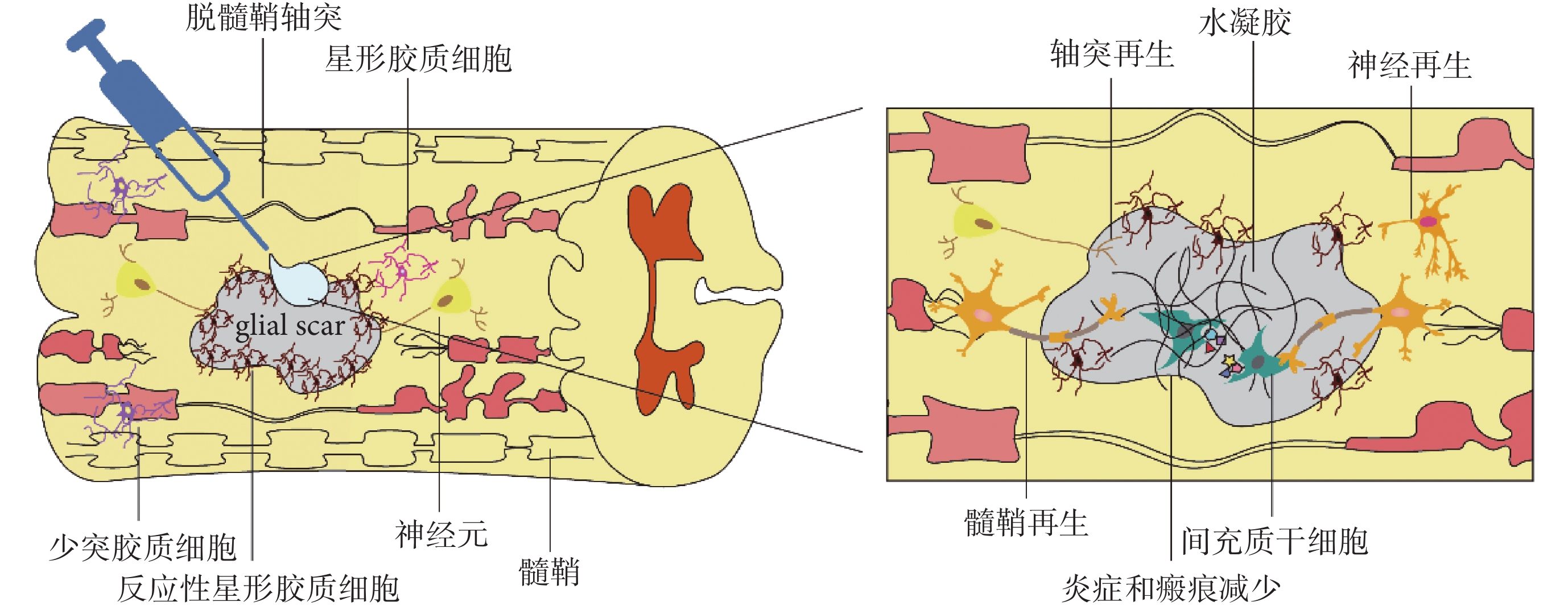 圖1
間充質干細胞聯合水凝膠修復脊髓損傷示意圖
Figure1.
Schematic diagram of mesenchymal stem cells combined with hydrogels to repair spinal cord injury
圖1
間充質干細胞聯合水凝膠修復脊髓損傷示意圖
Figure1.
Schematic diagram of mesenchymal stem cells combined with hydrogels to repair spinal cord injury
2.1 天然高分子水凝膠
為了保持生物材料和生物組織的相似性,水凝膠研究首先以生物組織中天然存在的分子為主,最為合適的天然高分子有膠原、透明質酸以及多糖(包括瓊脂糖、海藻酸鹽、纖維素、木葡聚糖等)。天然高分子具有生物相容性強、酶促降解性、孔隙大、柔軟且能使細胞黏附和遷移的特點[21]。有文獻報道,天然高分子水凝膠能夠通過類似外周神經神經內膜和神經束膜的作用橋接損傷區域分離的軸索束來促進軸突再生[22]。
2.1.1 纖連蛋白水凝膠
纖連蛋白水凝膠支架由纖維蛋白網絡交聯構成,具有生物相容性好、無毒無過敏、生物降解、易加工等特點。除此之外,纖連蛋白水凝膠能夠任意改變形狀和大小,許多生物因子可以與纖連蛋白支架相結合。根據需要封裝的細胞數目多少,改變合成物的濃度就能控制水凝膠的硬度。水凝膠本身的特性在損傷修復方面也起到了一定作用。Mukhamedshina 等[23]使用纖連蛋白水凝膠培養 ADSCs,移植修復 SCI,發現損傷中心空腔面積減少,GFAP、Iba1 的表達降低,說明將 ADSCs 與纖維蛋白水凝膠聯合應用于 SCI 修復可刺激神經組織再生。
2.1.2 透明質酸水凝膠
透明質酸是應用最為廣泛的生物大分子之一,是細胞外基質的組成成分之一,在各類生物反應進程中起到重要作用。此外,透明質酸還能夠在炎癥環境中清除自由基[24]。透明質酸是一種在形態、硬度和生物活性方面都適合制作水凝膠的理想材料。使用 BDNF 轉染 MSCs,并用一段黏附性肽段 PPFLMLLKGSTR 修飾透明質酸,聯合植入 SCI 大鼠模型中,可有效改善脊髓組織的完整性,抑制神經膠質瘢痕形成并減輕炎癥反應,而單獨注射細胞組修復效果不如聯合移植組[25]。Zaviskova 等[26]用 RGD 修飾透明質酸的羥苯基衍生物并酶促交聯以獲得柔軟的可注射水凝膠。將獲得的水凝膠與水凝膠+MSCs 移植治療 SCI,發現聯合使用時,軸突向損傷中心的生長能力更強。在病變微環境中活性氧的產生會嚴重損害 SCI 的干細胞治療。通過將 MnO2 納米顆粒分散在 PPFLMLLKGSTR 肽修飾的透明質酸水凝膠中來制備含有 MnO2 納米顆粒的水凝膠,肽修飾的水凝膠使 MSCs 和神經組織橋接發生黏附性生長,MnO2 納米顆粒通過緩解氧化程度以有效提高 MSCs 的生存活性。MSCs 聯合 MnO2 納米顆粒以及肽修飾的 HA 水凝膠移植到大鼠 SCI 全橫斷(4 ± 0.5)mm 模型上,肽修飾的水凝膠誘導植入的 MSCs 在體內整合并向神經分化,從而使得軸突再生,大鼠運動功能顯著恢復[27]。
2.1.3 明膠
明膠因具有較高的生物相容性、生物可降解性且體內降解后不產生其他副產物,無免疫原性,血液相容性好以及與膠原有相同的組分和生物性質,被廣泛應用于組織工程和藥物遞送系統中,但同時,明膠也存在體內降解速度過快和機械性能差等問題。Wang 等[28]設計了一種由 H2O2 和辣根過氧化物酶(horseradish peroxidase,HRP)催化 3,4-羥基苯基丙酸(3,4-Hydroxyphenylpropionic acid,HPA)部分氧化偶聯形成的由明膠-羥苯基丙酸(Gtn-HPA)共軛物組成的水凝膠。這種水凝膠可通過改變 H2O2 的濃度而無需改變聚合物前體的濃度來調節材料硬度,從而控制明膠中 MSCs 的增殖速率和分化。研究發現水凝膠硬度強烈影響著細胞的增殖速率,MSCs 增殖速率隨水凝膠硬度的降低而增加,且 MSCs 的神經發生由水凝膠硬度控制,而無需使用任何其他生化信號。與在較硬(G’=841 Pa)明膠中培養的 MSCs 相比,較軟水凝膠(G’=281 Pa)中 MSCs 神經元標志物表達更高。Gtn-HPA 水凝膠為 MSCs 在組織工程中的再生應用提供了一個很有前景的系統。
2.2 人工合成水凝膠
人工合成水凝膠在組織工程領域有顯著優點:支架結構允許細胞侵入,允許營養物質以及廢棄物滲透以及新毛細血管網絡形成。水凝膠支架孔隙應為細胞遷移和血管形成提供可用空間,因此人工合成水凝膠在調節空孔隙大小上具有優越性。與天然來源水凝膠相比,合成聚合物為設計和控制材料特性提供了更廣闊的空間。另外,使用完全人工的、不含動物蛋白的生物相容性材料能明顯降低過敏風險[29],且人工合成材料易于大規模生產。
2.2.1 聚甲基丙烯酸 2-羥乙酯
合成水凝膠中適合作為三維支架培養的材料是聚甲基丙烯酸酯(poly(hydroxethyl methacrylate)),例如聚甲基丙烯酸 2-羥乙酯(Poly(2-hydroxyethylmethacrylate),PHEMA)。PHEMA 不具有細胞黏附性,因此需要對該聚合物進行其他修飾以促進材料與細胞間的相互作用。為了改善 PHEMA 支架的生物活性,需要引入帶正電荷基團[30]或者使用層粘連蛋白衍生肽修飾[31]。Kubinová等[32]將甲基丙烯酸 2-[(甲氧基羰基)甲氧基]乙酯(MCMEMA)引入水凝膠提供羧基基團,以提高膽固醇修飾的 PHEMA 水凝膠的溶脹能力和柔軟性。將改良 PHEMA 水凝膠移植到大鼠 SCI 模型,發現植入的修飾后 PHEMA 很好地摻入了周圍組織,結締組織逐漸浸潤,神經纖維絲、施旺細胞和血管向水凝膠孔內生長。這些結果表明,高度多孔的膽固醇改良的 PHEMA 水凝膠具有生物黏附特性,能夠橋接 SCI 病變區域。Hej?l 等[33]使用 SIKVAV 修飾 PHEMA,聯合 MSCs 移植到大鼠 SCI 損傷區。研究發現 SIKVAV-PHEMA 支架的孔在第一周內完全充滿了結締組織成分,軸突逐步延伸到水凝膠支架中,并且在移植入水凝膠支架后的前 4 周內逐漸伸長,之后長度保持穩定,有極少部分軸突能夠穿過空腔連接脊髓尾端。在之后的研究中,相關方向研究者可能需要進一步研究 PHEMA 的修飾以使得軸突更多地與損傷尾端相接,使軸突能夠長時間地逐漸滲透到支架中以形成新的突觸,促進整個 SCI 處連續且持久的組織再生。
2.2.2 聚乳酸-羥基乙酸共聚物
聚乳酸-羥基乙酸共聚物(poly(lactic-co-glycolic acid),PLGA)是組織工程中最常用的生物可降解合成生物材料之一,具有制作簡單、機械強度高、可降解性好等優點。Yang 等[34]在成年大鼠 SCI 3 mm 的橫斷間隙移植負載了活化雪旺細胞(activated Schwann cells,ASCs)和 MSCs 的 PLGA。移植后大鼠神經功能明顯恢復,病變部位長出神經纖維束。除表達成熟神經元標志物外,少量 MSCs 衍生的神經元樣細胞還在共移植損傷部位表達 ChAT。多通道 PLGA 支架有效彌合了全橫切 SCI 大鼠的病變間隙,促進了 MSCs 的存活和分化為神經元樣細胞,從而增強了軸突的再生和功能恢復。Han 等[35]則就 PLGA 支架硬度對 hMSCs 的影響做了研究,使用低/軟(含 10% PLGA)或高/硬(含 40% PLGA)的 PLGA 負載 MSCs,與對照組相比,硬度高的 PLGA 激活 MSCs 機械轉導和向中胚層譜系分化,而軟 PLGA-MSCs 通過激活神經修復功能相關機制改善感覺運動功能,這說明 MSCs 聯合 PLGA 修復 SCI 時,較低的硬度更適合神經再生。
2.3 天然高分子-人工合成復合水凝膠
天然高分子-人工合成復合水凝膠是指使用天然高分子單體例如纖連蛋白、層粘連蛋白或者瓊脂糖來包被人工合成的聚合物從而提高細胞黏附和細胞活性。天然高分子-人工合成復合水凝膠是合成物和天然高分子之間發生嵌段共聚或是通過物理相互作用的互聚物復合物。這種復合水凝膠將天然水凝膠的生物相容性與合成水凝膠的力學可調節性能結合起來。例如,添加多聚賴氨酸到 PEG,或者添加殼聚糖到甲基丙烯酰胺都能夠增加材料的粘性。
2.3.1 瓊脂糖羧基乙烯共聚物
以瓊脂糖羧基乙烯共聚物(copolymer of agarose and carbomer,AC)為主要成分的水凝膠模擬體內的細胞外基質,適合構建 3D 培養的 MSCs 體系。AC 水凝膠從材料縮聚開始細胞就已經潛入材料并且保持活力,材料可用表面大,使得細胞間接觸更充分。高特異性的表面可以實現細胞黏附,高密度孔隙可以促進細胞生長、遷移以及有效運輸液體和營養成分。共聚物形成的微孔對于毛細血管向內生長以及細胞與細胞外基質間的相互作用尤其重要,而大孔隙度則與營養供給以及細胞代謝廢物相關。將 MSCs 封裝在 AC 中,對細胞活力進行了測試,細胞活力保持(55 ± 5)%,這為 AC 搭載 MSCs 應用于組織工程,修復 SCI 損傷提供了良好基礎[36]。
2.3.2 甲基丙烯酸酯化明膠
甲基丙烯酸酯化明膠(methacrylated gelatin,GelMA)由甲基丙烯酸酐(MA)與明膠制備獲得,是一種光敏性的生物水凝膠材料。然而,尚未有文獻報道 GelMA 與 MSCs 聯合修復 SCI。Fan 等[37]于 2018 年將 GelMA 水凝膠與 iPSCs 衍生的 NSCs(iNSCs)結合,研究修復 SCI 的效果,發現 GelMA / iNSCs 聯合植入組炎癥減輕,空腔面積明顯減少,大鼠運動功能顯著恢復。為進一步讓再生神經能夠連接損傷首尾兩端,Chen 等[38]利用 GelMA 和電紡絲技術構建了一種新的用于脊髓再生的定向水凝膠超細纖維支架。與神經軸突一致的定向多孔水凝膠纖維支架對于指導細胞遷移和軸突延伸至關重要。GelMA 水凝膠楊氏模量較低,為神經元細胞提供了良好的生存和代謝環境。用 GelMA 水凝膠纖維構建的柔軟的仿生支架不僅可促進神經干細胞的遷移并誘導其分化為神經元,還可抑制神經膠質瘢痕的形成,促進血管生成。基于 GelMA 的諸多優點,與 MSCs 聯合使用修復 SCI 的研究效果令人期待。
3 展望
SCI 的治療受到了越來越多研究者的關注。本文對 MSCs 以及聯合水凝膠治療 SCI 的研究進行了概述,包括不同來源 MSCs(BMSCs、UMSCs、ADSCs)治療 SCI 的優缺點以及相關研究,回顧了近五年利用水凝膠聯合 MSCs 修復 SCI 的研究進展。由于生物材料的逐漸發展,水凝膠治療 SCI 還有巨大的發展空間。
水凝膠具有優越的生物相容性,制備的生物支架能夠較好地促進細胞分化和遷移,但在模擬細胞外基質的結構方面不如靜電紡絲能夠構建模擬細胞外基質的納米纖維結構。此外,水凝膠無法控制遞送,例如使用空間位阻低的藥物時,藥物會在水凝膠網狀結構中擴散,以及負載疏水分子對水凝膠結構性能的影響。而 SCI 后面臨的是一個復雜的炎癥微環境,需要合理組合細胞、藥物、營養因子,才能實現 SCI 的治療效率最大化。水凝膠實現同時負載細胞、藥物、營養因子并且在特定階段釋放負載物仍然是十分困難的。
針對水凝膠的這些局限性,就模擬細胞外基質而言,可以考慮將靜電紡絲技術與水凝膠的特點相結合,而對于藥物遞送的控制,水凝膠的聚合物鏈可以被藥物或具有不同聚合后策略的分子功能化,例如形成化學鍵。在這種情況下,藥物的控制傳遞是由打破這種結合的能力控制的。對于 SCI 修復的機制方面,近幾年外泌體在 SCI 修復中的效果也受到廣泛關注,在之后的研究工作中,在組合策略中加入外泌體是一個研究熱點。2020 年 Gao 實驗室[39]將 MSCs 來源的外泌體固定在一種經肽修飾的水凝膠中進行移植,使得植入的外泌體在宿主神經組織中表現出有效的保留和持續釋放,從而誘導 SCI 微環境的有效全面緩解,解決了水凝膠對于緩釋的控制以及探討外泌體在 SCI 修復中的效果。針對外泌體在 SCI 修復中發揮作用的潛在機制進行進一步研究可能會讓 MSCs 移植成為更加具有針對性的療法。要實現水凝膠更好地治療 SCI,首先水凝膠在性能特點上需要考慮其他生物材料的優點,除了使用細胞治療和生物材料治療 SCI,組織工程提供了替代技術,如 3D 生物打印和微流控設備。為了使水凝膠能夠進一步符合臨床應用,3D 打印脊髓組織已成為再生醫學研究的熱點。2019 年有研究報道能夠快速打印出符合臨床患者 SCI 形狀的組織,并在大鼠 SCI 模型中觀察到軸突完全穿過病變部位[40],展現出對于 SCI 修復的良好應用前景。隨著生物墨水的進一步開發以及 3D 打印設備的發展,3D 打印修復 SCI 將是未來的主要研究發展方向。
利益沖突聲明:本文全體作者均聲明不存在利益沖突。
引言
脊髓損傷(spinal cord injury,SCI)是病情嚴重、預后較差的中樞神經系統(central nervous system,CNS)疾病。SCI 導致受損脊髓以下神經功能障礙,引起感覺或運動能力的部分或全部喪失,患者多遺留四肢癱瘓、頑固性神經痛等嚴重后遺癥。在全球,每年 SCI 新增病例 12~65/10 萬[1],損傷后續的治療費用給患者及社會都帶來沉重的經濟負擔。
SCI 可分為原發性損傷和繼發性損傷兩個階段。原發性損傷會導致脊柱受到機械破壞和脫位,引起脊髓組織受壓或橫斷,損傷中心區域血管系統被破壞,血-脊髓屏障損壞,進而引發持續的繼發性損傷級聯反應,導致脊髓進一步損傷,造成進行性神經細胞死亡和神經功能障礙。血腦屏障功能障礙和血栓形成引起水腫和局部缺血、氧自由基形成以及谷氨酸釋放增加,導致大量神經元死亡;這些損傷反應又反過來引發激烈的退化級聯反應,伴隨白質區少突膠質細胞大量死亡,引起脫髓鞘病變、神經膠質增生和細胞外基質沉積。劇烈的免疫炎癥反應是 SCI 繼發性損傷的核心,也是治療 SCI 的關鍵點之一。炎性微環境導致神經細胞大量死亡,形成致密瘢痕組織,而瘢痕組織是阻礙脊髓軸突再生和功能恢復的重要原因。
目前,除了手術減壓和藥物療法,臨床上尚無其他有效的 SCI 治療方法。近年來,干細胞與生物材料是組織工程與再生醫學領域的研究熱點,對于組織再生具有重要前景。干細胞能不斷自我更新,具有多向分化潛能,并且能夠分泌營養因子、抗炎因子發揮保護細胞和免疫調節等作用,被廣泛應用于 SCI 治療的臨床前研究。大量研究表明移植的干細胞可有效促進 SCI 后的神經再生和運動功能恢復。其中,間充質干細胞(mesenchymal stem cells,MSCs)在體外擴增迅速,可在較短時間內收獲大量細胞以滿足臨床治療需求,且在臨床治療中操作相對簡單。生物材料是能對細胞、組織和器官進行診斷、治療、替換修復或誘導再生的一類天然或人工合成的特殊功能材料,其制品已經被廣泛地應用于臨床和科研。生物材料中的一大類——水凝膠,可以模擬軟組織環境,其化學組成適于整合細胞外基質(extracellular matrix,ECM)分子以及其他黏附蛋白,能夠有效支持和引導軸突再生,因此是生物材料中用于 SCI 修復的極佳選擇。MSCs 與水凝膠聯合應用,水凝膠能夠穩定病變部位炎癥環境,同時負載 MSCs 將其原位遞送到損傷區域進行修復,并為受傷組織的再生提供適宜環境,在 SCI 修復方面有良好的應用前景。下面針對 MSCs 在 SCI 修復中的研究意義以及目前存在的問題進行討論,并對水凝膠聯合 MSCs 在 SCI 修復中的研究進展加以闡述。
1 MSCs 在 SCI 治療中的相關研究進展
MSCs 是成體干細胞的重要成員之一,存在于骨髓、臍血、臍帶、全身結締組織以及器官間質組織中,來源相對容易獲得且在體外能夠有效擴增[2],免疫原性低,是目前在臨床前和臨床研究中最有希望應用于 SCI 修復的干細胞。與其他幾種干細胞相比,MSCs 沒有倫理方面的限制,可用于自體移植,應用于中樞神經系統疾病的修復安全可靠[3-5]。近年來應用不同來源 MSCs 治療 SCI 的研究進展如下所述。
1.1 骨髓間充質干細胞
骨髓間充質干細胞(bone marrow mesenchymal stem cells,BMSCs)與造血干細胞(hematopoietic cells,HSCs)均來源于骨髓,區別于 HSCs,BMSCs 不表達造血干細胞表面標記物 CD14 和 CD34。在挫傷/橫斷的小鼠/大鼠 SCI 模型中,將 BMSCs 移植到損傷處,實驗動物的運動功能均得到改善[6-8]。在大鼠脊髓缺血再灌注損傷模型中,Chen 等[9]向腹主動脈移植 BMSCs,發現睫狀神經營養因子(ciliary neurotrophic factor,CNTF)以及抗炎因子白細胞介素(interleukin,IL)-10 的表達增加,促炎因子 IL-6 的表達減少,脊髓炎癥環境得到改善,Basso-Beattie-Bresnahan(BBB)行為學評分及電生理結果表明大鼠后肢運動功能恢復,說明 BMSCs 起到了抗炎保護作用。BMSCs 還可通過營養支持保護受損的脊髓免受進一步的細胞損傷。茍楊等[10]在大鼠 SCI 后第 1、7 和 14 天移植 BMSCs,通過共同標記 CNPase 與 caspase3,探討 BMSCs 移植能否抑制少突膠質細胞凋亡。實驗結果表明 SCI 后,BMSCs 可能通過分泌腦源性神經營養因子(brain-derived neurotrophic factor,BDNF)來抑制少突膠質細胞凋亡,起到保護神經髓鞘的作用。此外,由于 BMSCs 具有向受損組織遷移的能力,因此可以用作治療的最佳載體。將 BMSCs 移植到大鼠 SCI 模型中,發現經染料標記的 BMSCs 中的線粒體可以轉移到經氧-糖剝奪(oxygen-glucose deprivation,OGD)損傷的神經元上,OGD 運動神經元活性在線粒體遷移后得到改善,細胞凋亡減少,足跡分析結果表明大鼠前后肢協調性恢復良好[11]。在臨床研究方面,2020 年由 Sharma 等[12]完成的一項針對 180 位 SCI 患者的開放性研究中,通過腰椎穿刺注射 1.06×108個細胞,移植后(9 ± 7)月后對患者進行隨訪,以功能獨立性指標(functional independence measure,FIM)和 SCI 步行指數(walking index for SCI,WISCI)作為評價指標,結果發現,69.44% 的患者在 FIM 量表上得分得到改善,而 37.22% 的患者在 WISCI 上得分得到改善,但不足的是,該項臨床試驗缺少對照組。
1.2 臍帶間充質干細胞
臍帶間充質干細胞(umbilical cord-MSCs,UMSCs)可以通過臍帶或者新生兒的臍帶血獲得,具有低免疫原性。許多臨床前研究表明,UMSCs 在小鼠或大鼠 SCI 模型中對動物運動功能的恢復均具有一定的治療效果。Yousefifard 等[13]在大鼠 SCI 后一周移植 BMSCs 或 UMSCs,發現 BMSCs 或 UMSCs 均可減輕神經性疼痛癥狀,但 UMSCs 的存活率和處理后大鼠脊髓的電生理檢測結果明顯優于 BMSCs。目前,已有研究使用大規模中空纖維生物反應器擴增 UMSCs。研究發現經典擴增和大規模擴增 UMSCs 的方法在細胞向成脂、成骨和成軟骨方面的分化能力方面沒有差異[14],這種大規模擴增 UMSCs 的方式為將來在 SCI 患者中進行大規模應用奠定了一定基礎。
1.3 脂肪干細胞
與其他來源的 MSCs 相比,脂肪干細胞(adipose-derived MSCs,ADSCs)可以使用微創技術或脂肪抽吸術以微創的方式從脂肪組織中大量獲取。Kim 等[15]對急性 SCI 比格犬靜脈注射 ADSCs,發現小膠質細胞浸潤減少,動物后肢運動功能得到改善。Khan 等[16]同樣使用 ADSCs 治療 SCI 后的比格犬,發現病變中心神經纖維絲、抗炎因子 IL-10 表達明顯升高,促炎因子 IL-6、TNF-α 和 IL-1β 表達降低,星型膠質瘢痕減少,說明 ADSCs 通過改善炎癥環境保護神經,使動物后肢功能得到改善。ADSCs 能夠改善炎癥環境可能是以旁分泌形式起作用的,其分泌物主要由生長因子、細胞外基質成分、蛋白酶、細胞因子和多種促進血管生成、傷口愈合的免疫調節分子組成。這些生物活性分子被認為有助于組織再生,并通過抑制淋巴細胞的增殖活化減輕炎癥[17],以達到改善 SCI 微環境的目的。Maqueda 等[18]發現,以 H2O2 脈沖處理 ADSCs 能提高 ADSCs 在 SCI 微環境中的存活能力。大鼠 SCI 后 48 h 后移植該 ADSCs,發現細胞存活率升高,星形膠質瘢痕減少。此外,Barberini 等[19]對鞘內注射高劑量同種異體 ADSCs 的安全性做了研究。從寰枕向鞘內給實驗對象馬注射 GFP 標記的 1×108個 ADSCs,注射前后檢測血液和腦脊液中炎癥因子,均未見明顯變化,動物未出現不良反應,熒光檢測發現 ADSCs 遷移到腰椎區域,說明鞘內注射高劑量同種異體 ADSCs 是一種安全的方法。關于 ADSCs 的臨床試驗也已經開展。梅奧診所正在進行的一項臨床試驗(NCT03308565)CELLTOP,旨在研究鞘內注射 ADSCs 到創傷性 SCI 患者中的安全性和有效性。患者于受傷后 11 個月通過 L3-4 腰椎穿刺接受鞘內注射 1×108個自體 ADSCs。患者對手術耐受良好,沒有發生嚴重的不良事件,上下肢運動功能得到顯著改善[20]。
多年來,MSCs 一直是臨床試驗的主題,但臨床試驗的結果未能達到多種疾病模型的臨床前數據的良好結果。其中主要原因在于 MSCs 在 SCI 環境下存活率低、存活困難,難以維持自身優越的生物性能,嚴重限制了其臨床潛力。此外,直接注射會導致損傷部位細胞丟失,以及細胞移植后到其成熟表型(包括神經元、星形膠質細胞和少突膠質細胞)的分化不受控制。
近年來,已經提出基于組織工程和再生醫學的方法作為 SCI 修復/再生的替代方法。水凝膠與干細胞移植的結合也得到了廣泛的探索,期望水凝膠穩定病變部位微環境,同時將干細胞遞送到病變部位,并為受傷組織的再生提供適當的環境。下文將介紹使用水凝膠作為干細胞載體的重要性,以及這些有前途的神經組織再生工具的最新進展和成就。
2 水凝膠聯合 MSCs 在 SCI 修復中的應用
材料科學的發展為 SCI 修復提供了更多可能。水凝膠是一個能夠封裝 MSCs 的良好環境,具有高彈性、高透氣性、無毒以及力學性能良好的特點,將其用于 SCI 的修復具有三個優點:首先,水凝膠本身能夠充當載體,負載 MSCs 到達損傷部位,減少細胞向周圍組織丟失而脫靶;第二,水凝膠提供三維空間支持,利于細胞遷移、增殖及分化;第三,水凝膠能夠緩釋生物活性因子,保護抑制性微環境中 MSCs 活性及其生物功能(見圖 1)。以下將從天然高分子水凝膠、人工合成水凝膠以及天然高分子-人工合成復合水凝膠三方面對于水凝膠聯合 MSCs 修復 SCI 的研究進展進行闡述。
 圖1
間充質干細胞聯合水凝膠修復脊髓損傷示意圖
Figure1.
Schematic diagram of mesenchymal stem cells combined with hydrogels to repair spinal cord injury
圖1
間充質干細胞聯合水凝膠修復脊髓損傷示意圖
Figure1.
Schematic diagram of mesenchymal stem cells combined with hydrogels to repair spinal cord injury
2.1 天然高分子水凝膠
為了保持生物材料和生物組織的相似性,水凝膠研究首先以生物組織中天然存在的分子為主,最為合適的天然高分子有膠原、透明質酸以及多糖(包括瓊脂糖、海藻酸鹽、纖維素、木葡聚糖等)。天然高分子具有生物相容性強、酶促降解性、孔隙大、柔軟且能使細胞黏附和遷移的特點[21]。有文獻報道,天然高分子水凝膠能夠通過類似外周神經神經內膜和神經束膜的作用橋接損傷區域分離的軸索束來促進軸突再生[22]。
2.1.1 纖連蛋白水凝膠
纖連蛋白水凝膠支架由纖維蛋白網絡交聯構成,具有生物相容性好、無毒無過敏、生物降解、易加工等特點。除此之外,纖連蛋白水凝膠能夠任意改變形狀和大小,許多生物因子可以與纖連蛋白支架相結合。根據需要封裝的細胞數目多少,改變合成物的濃度就能控制水凝膠的硬度。水凝膠本身的特性在損傷修復方面也起到了一定作用。Mukhamedshina 等[23]使用纖連蛋白水凝膠培養 ADSCs,移植修復 SCI,發現損傷中心空腔面積減少,GFAP、Iba1 的表達降低,說明將 ADSCs 與纖維蛋白水凝膠聯合應用于 SCI 修復可刺激神經組織再生。
2.1.2 透明質酸水凝膠
透明質酸是應用最為廣泛的生物大分子之一,是細胞外基質的組成成分之一,在各類生物反應進程中起到重要作用。此外,透明質酸還能夠在炎癥環境中清除自由基[24]。透明質酸是一種在形態、硬度和生物活性方面都適合制作水凝膠的理想材料。使用 BDNF 轉染 MSCs,并用一段黏附性肽段 PPFLMLLKGSTR 修飾透明質酸,聯合植入 SCI 大鼠模型中,可有效改善脊髓組織的完整性,抑制神經膠質瘢痕形成并減輕炎癥反應,而單獨注射細胞組修復效果不如聯合移植組[25]。Zaviskova 等[26]用 RGD 修飾透明質酸的羥苯基衍生物并酶促交聯以獲得柔軟的可注射水凝膠。將獲得的水凝膠與水凝膠+MSCs 移植治療 SCI,發現聯合使用時,軸突向損傷中心的生長能力更強。在病變微環境中活性氧的產生會嚴重損害 SCI 的干細胞治療。通過將 MnO2 納米顆粒分散在 PPFLMLLKGSTR 肽修飾的透明質酸水凝膠中來制備含有 MnO2 納米顆粒的水凝膠,肽修飾的水凝膠使 MSCs 和神經組織橋接發生黏附性生長,MnO2 納米顆粒通過緩解氧化程度以有效提高 MSCs 的生存活性。MSCs 聯合 MnO2 納米顆粒以及肽修飾的 HA 水凝膠移植到大鼠 SCI 全橫斷(4 ± 0.5)mm 模型上,肽修飾的水凝膠誘導植入的 MSCs 在體內整合并向神經分化,從而使得軸突再生,大鼠運動功能顯著恢復[27]。
2.1.3 明膠
明膠因具有較高的生物相容性、生物可降解性且體內降解后不產生其他副產物,無免疫原性,血液相容性好以及與膠原有相同的組分和生物性質,被廣泛應用于組織工程和藥物遞送系統中,但同時,明膠也存在體內降解速度過快和機械性能差等問題。Wang 等[28]設計了一種由 H2O2 和辣根過氧化物酶(horseradish peroxidase,HRP)催化 3,4-羥基苯基丙酸(3,4-Hydroxyphenylpropionic acid,HPA)部分氧化偶聯形成的由明膠-羥苯基丙酸(Gtn-HPA)共軛物組成的水凝膠。這種水凝膠可通過改變 H2O2 的濃度而無需改變聚合物前體的濃度來調節材料硬度,從而控制明膠中 MSCs 的增殖速率和分化。研究發現水凝膠硬度強烈影響著細胞的增殖速率,MSCs 增殖速率隨水凝膠硬度的降低而增加,且 MSCs 的神經發生由水凝膠硬度控制,而無需使用任何其他生化信號。與在較硬(G’=841 Pa)明膠中培養的 MSCs 相比,較軟水凝膠(G’=281 Pa)中 MSCs 神經元標志物表達更高。Gtn-HPA 水凝膠為 MSCs 在組織工程中的再生應用提供了一個很有前景的系統。
2.2 人工合成水凝膠
人工合成水凝膠在組織工程領域有顯著優點:支架結構允許細胞侵入,允許營養物質以及廢棄物滲透以及新毛細血管網絡形成。水凝膠支架孔隙應為細胞遷移和血管形成提供可用空間,因此人工合成水凝膠在調節空孔隙大小上具有優越性。與天然來源水凝膠相比,合成聚合物為設計和控制材料特性提供了更廣闊的空間。另外,使用完全人工的、不含動物蛋白的生物相容性材料能明顯降低過敏風險[29],且人工合成材料易于大規模生產。
2.2.1 聚甲基丙烯酸 2-羥乙酯
合成水凝膠中適合作為三維支架培養的材料是聚甲基丙烯酸酯(poly(hydroxethyl methacrylate)),例如聚甲基丙烯酸 2-羥乙酯(Poly(2-hydroxyethylmethacrylate),PHEMA)。PHEMA 不具有細胞黏附性,因此需要對該聚合物進行其他修飾以促進材料與細胞間的相互作用。為了改善 PHEMA 支架的生物活性,需要引入帶正電荷基團[30]或者使用層粘連蛋白衍生肽修飾[31]。Kubinová等[32]將甲基丙烯酸 2-[(甲氧基羰基)甲氧基]乙酯(MCMEMA)引入水凝膠提供羧基基團,以提高膽固醇修飾的 PHEMA 水凝膠的溶脹能力和柔軟性。將改良 PHEMA 水凝膠移植到大鼠 SCI 模型,發現植入的修飾后 PHEMA 很好地摻入了周圍組織,結締組織逐漸浸潤,神經纖維絲、施旺細胞和血管向水凝膠孔內生長。這些結果表明,高度多孔的膽固醇改良的 PHEMA 水凝膠具有生物黏附特性,能夠橋接 SCI 病變區域。Hej?l 等[33]使用 SIKVAV 修飾 PHEMA,聯合 MSCs 移植到大鼠 SCI 損傷區。研究發現 SIKVAV-PHEMA 支架的孔在第一周內完全充滿了結締組織成分,軸突逐步延伸到水凝膠支架中,并且在移植入水凝膠支架后的前 4 周內逐漸伸長,之后長度保持穩定,有極少部分軸突能夠穿過空腔連接脊髓尾端。在之后的研究中,相關方向研究者可能需要進一步研究 PHEMA 的修飾以使得軸突更多地與損傷尾端相接,使軸突能夠長時間地逐漸滲透到支架中以形成新的突觸,促進整個 SCI 處連續且持久的組織再生。
2.2.2 聚乳酸-羥基乙酸共聚物
聚乳酸-羥基乙酸共聚物(poly(lactic-co-glycolic acid),PLGA)是組織工程中最常用的生物可降解合成生物材料之一,具有制作簡單、機械強度高、可降解性好等優點。Yang 等[34]在成年大鼠 SCI 3 mm 的橫斷間隙移植負載了活化雪旺細胞(activated Schwann cells,ASCs)和 MSCs 的 PLGA。移植后大鼠神經功能明顯恢復,病變部位長出神經纖維束。除表達成熟神經元標志物外,少量 MSCs 衍生的神經元樣細胞還在共移植損傷部位表達 ChAT。多通道 PLGA 支架有效彌合了全橫切 SCI 大鼠的病變間隙,促進了 MSCs 的存活和分化為神經元樣細胞,從而增強了軸突的再生和功能恢復。Han 等[35]則就 PLGA 支架硬度對 hMSCs 的影響做了研究,使用低/軟(含 10% PLGA)或高/硬(含 40% PLGA)的 PLGA 負載 MSCs,與對照組相比,硬度高的 PLGA 激活 MSCs 機械轉導和向中胚層譜系分化,而軟 PLGA-MSCs 通過激活神經修復功能相關機制改善感覺運動功能,這說明 MSCs 聯合 PLGA 修復 SCI 時,較低的硬度更適合神經再生。
2.3 天然高分子-人工合成復合水凝膠
天然高分子-人工合成復合水凝膠是指使用天然高分子單體例如纖連蛋白、層粘連蛋白或者瓊脂糖來包被人工合成的聚合物從而提高細胞黏附和細胞活性。天然高分子-人工合成復合水凝膠是合成物和天然高分子之間發生嵌段共聚或是通過物理相互作用的互聚物復合物。這種復合水凝膠將天然水凝膠的生物相容性與合成水凝膠的力學可調節性能結合起來。例如,添加多聚賴氨酸到 PEG,或者添加殼聚糖到甲基丙烯酰胺都能夠增加材料的粘性。
2.3.1 瓊脂糖羧基乙烯共聚物
以瓊脂糖羧基乙烯共聚物(copolymer of agarose and carbomer,AC)為主要成分的水凝膠模擬體內的細胞外基質,適合構建 3D 培養的 MSCs 體系。AC 水凝膠從材料縮聚開始細胞就已經潛入材料并且保持活力,材料可用表面大,使得細胞間接觸更充分。高特異性的表面可以實現細胞黏附,高密度孔隙可以促進細胞生長、遷移以及有效運輸液體和營養成分。共聚物形成的微孔對于毛細血管向內生長以及細胞與細胞外基質間的相互作用尤其重要,而大孔隙度則與營養供給以及細胞代謝廢物相關。將 MSCs 封裝在 AC 中,對細胞活力進行了測試,細胞活力保持(55 ± 5)%,這為 AC 搭載 MSCs 應用于組織工程,修復 SCI 損傷提供了良好基礎[36]。
2.3.2 甲基丙烯酸酯化明膠
甲基丙烯酸酯化明膠(methacrylated gelatin,GelMA)由甲基丙烯酸酐(MA)與明膠制備獲得,是一種光敏性的生物水凝膠材料。然而,尚未有文獻報道 GelMA 與 MSCs 聯合修復 SCI。Fan 等[37]于 2018 年將 GelMA 水凝膠與 iPSCs 衍生的 NSCs(iNSCs)結合,研究修復 SCI 的效果,發現 GelMA / iNSCs 聯合植入組炎癥減輕,空腔面積明顯減少,大鼠運動功能顯著恢復。為進一步讓再生神經能夠連接損傷首尾兩端,Chen 等[38]利用 GelMA 和電紡絲技術構建了一種新的用于脊髓再生的定向水凝膠超細纖維支架。與神經軸突一致的定向多孔水凝膠纖維支架對于指導細胞遷移和軸突延伸至關重要。GelMA 水凝膠楊氏模量較低,為神經元細胞提供了良好的生存和代謝環境。用 GelMA 水凝膠纖維構建的柔軟的仿生支架不僅可促進神經干細胞的遷移并誘導其分化為神經元,還可抑制神經膠質瘢痕的形成,促進血管生成。基于 GelMA 的諸多優點,與 MSCs 聯合使用修復 SCI 的研究效果令人期待。
3 展望
SCI 的治療受到了越來越多研究者的關注。本文對 MSCs 以及聯合水凝膠治療 SCI 的研究進行了概述,包括不同來源 MSCs(BMSCs、UMSCs、ADSCs)治療 SCI 的優缺點以及相關研究,回顧了近五年利用水凝膠聯合 MSCs 修復 SCI 的研究進展。由于生物材料的逐漸發展,水凝膠治療 SCI 還有巨大的發展空間。
水凝膠具有優越的生物相容性,制備的生物支架能夠較好地促進細胞分化和遷移,但在模擬細胞外基質的結構方面不如靜電紡絲能夠構建模擬細胞外基質的納米纖維結構。此外,水凝膠無法控制遞送,例如使用空間位阻低的藥物時,藥物會在水凝膠網狀結構中擴散,以及負載疏水分子對水凝膠結構性能的影響。而 SCI 后面臨的是一個復雜的炎癥微環境,需要合理組合細胞、藥物、營養因子,才能實現 SCI 的治療效率最大化。水凝膠實現同時負載細胞、藥物、營養因子并且在特定階段釋放負載物仍然是十分困難的。
針對水凝膠的這些局限性,就模擬細胞外基質而言,可以考慮將靜電紡絲技術與水凝膠的特點相結合,而對于藥物遞送的控制,水凝膠的聚合物鏈可以被藥物或具有不同聚合后策略的分子功能化,例如形成化學鍵。在這種情況下,藥物的控制傳遞是由打破這種結合的能力控制的。對于 SCI 修復的機制方面,近幾年外泌體在 SCI 修復中的效果也受到廣泛關注,在之后的研究工作中,在組合策略中加入外泌體是一個研究熱點。2020 年 Gao 實驗室[39]將 MSCs 來源的外泌體固定在一種經肽修飾的水凝膠中進行移植,使得植入的外泌體在宿主神經組織中表現出有效的保留和持續釋放,從而誘導 SCI 微環境的有效全面緩解,解決了水凝膠對于緩釋的控制以及探討外泌體在 SCI 修復中的效果。針對外泌體在 SCI 修復中發揮作用的潛在機制進行進一步研究可能會讓 MSCs 移植成為更加具有針對性的療法。要實現水凝膠更好地治療 SCI,首先水凝膠在性能特點上需要考慮其他生物材料的優點,除了使用細胞治療和生物材料治療 SCI,組織工程提供了替代技術,如 3D 生物打印和微流控設備。為了使水凝膠能夠進一步符合臨床應用,3D 打印脊髓組織已成為再生醫學研究的熱點。2019 年有研究報道能夠快速打印出符合臨床患者 SCI 形狀的組織,并在大鼠 SCI 模型中觀察到軸突完全穿過病變部位[40],展現出對于 SCI 修復的良好應用前景。隨著生物墨水的進一步開發以及 3D 打印設備的發展,3D 打印修復 SCI 將是未來的主要研究發展方向。
利益沖突聲明:本文全體作者均聲明不存在利益沖突。