隨著光熱納米材料的開發,基于近紅外光激發的光熱療法在細菌感染的傷口治療中顯示出巨大的潛力。同時,為提高傷口感染部位的光熱抗菌效果,降低光熱對健康組織的高溫損傷,靶向細菌策略也逐漸被應用于傷口的光熱治療中。本文分類介紹了常用的光熱納米材料及其靶向細菌策略,闡述了它們在光熱抗菌治療,尤其是在細菌感染傷口中的應用,分析了靶向光熱抗菌療法在傷口愈合應用中面臨的難題與挑戰,最后對靶向光熱抗菌材料的發展提出展望,以期為傷口光熱治療提供一條新的思路。
引用本文: 袁香楠, 譚紹潔, 高晶, 王璐. 靶向光熱抗菌納米材料及其在傷口愈合中的應用研究進展. 生物醫學工程學雜志, 2022, 39(1): 207-216. doi: 10.7507/1001-5515.202103022 復制
版權信息: ?四川大學華西醫院華西期刊社《生物醫學工程學雜志》版權所有,未經授權不得轉載、改編
引言
細菌感染嚴重威脅了人類的生命安全。據估計,每年約有一千五百萬人死于細菌感染。過去幾十年里,抗生素一直作為治療細菌感染最有效的藥物,但長期濫用抗生素導致了耐藥細菌反復出現,嚴重影響治療效果[1-4]。對于創傷或疾病等原因形成的傷口來說,其表面環境一般較為潮濕溫暖,更容易受到細菌感染,從而延長傷口愈合的時間,甚至導致組織的壞死。目前,細菌感染及細菌耐藥性已成為傷口治療和管理的主要挑戰[5-6]。因此,迫切需要開發安全有效的新型抗菌材料用于細菌感染傷口的治療。
自1862年巴斯德提出巴氏殺菌法后,熱處理法被證明對所有病原體的清除都有一定的效果。近年來,基于紅外光激發的光熱療法(photothermal therapy,PTT)逐漸應用于感染傷口的治療,因其不會產生耐藥性,且具有廣譜抗菌性,成為最有前景的抗生素替代療法[7-10]。PTT是指在近紅外光(near-infrared light,NIR)照射下,光熱材料由于表面等離子體激元共振效應或能級躍遷原理表現出強烈的光吸收,并將所吸收的光能轉換為熱能,局部熱量升高并向周圍擴散。高溫隨后破壞細菌細胞壁、細胞膜的結構完整性,導致胞內重要物質流出,細菌內部結構遭到破壞;同時引起蛋白質、酶變性甚至脫氧核糖核酸損傷,干擾細胞代謝活動,對細菌產生不可逆轉的損害,從而達到光熱殺菌的目的。這種基于物理原理的抗菌療法不僅可以抑制耐藥細菌的生成,而且可以通過破壞細菌結構防止生物膜的形成[3,11-12]。
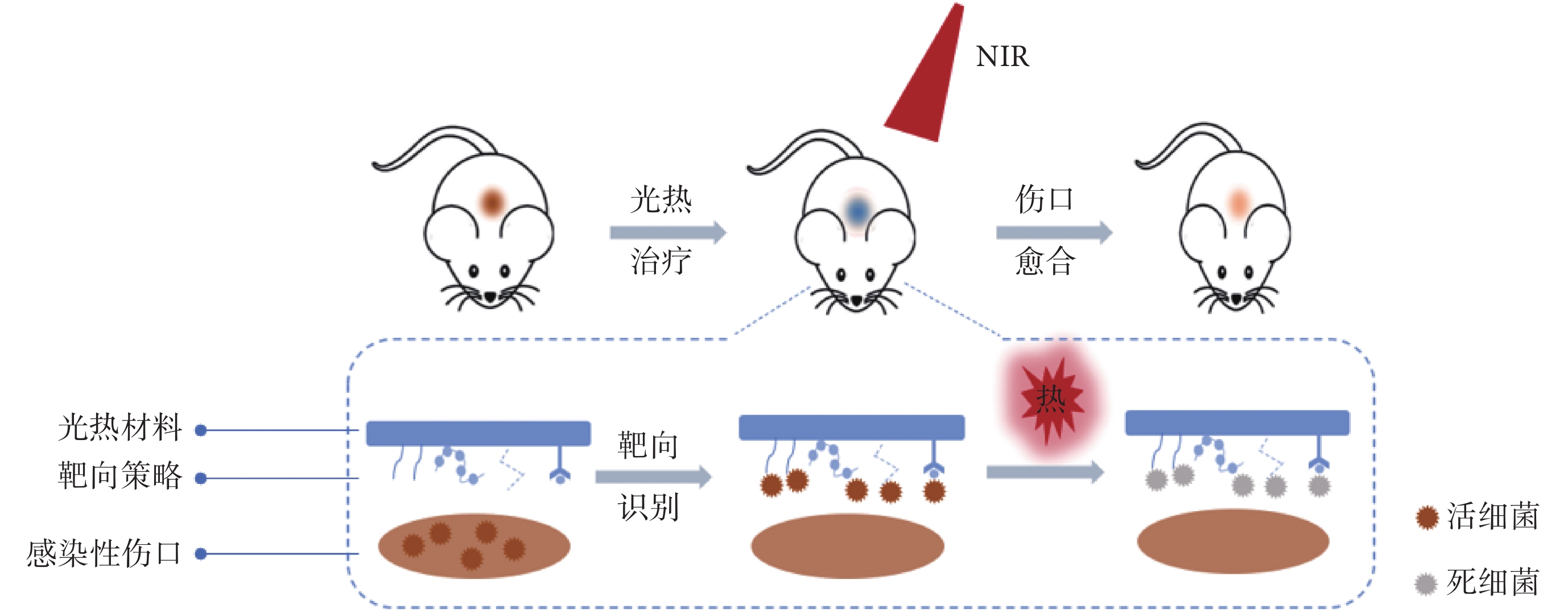
PTT在治療細菌感染方面顯示出巨大的潛力,但這種基于高溫殺菌的治療策略在實際應用中仍存在局限性。由于缺乏細菌靶向性,光熱材料并不能識別并結合細菌細胞,無法高效、快速地聚集在細菌周圍。而在隨后的NIR激發下,光熱材料將光能轉換為熱能,所產生的熱量向周圍擴散,難以直接并特異地高溫加熱細菌,大大降低了高溫抗菌效率。尤其是應用于細菌感染的皮膚傷口時,非局部加熱和高溫不僅會影響光熱抗菌效果,而且會對傷口周圍的健康組織造成很大的損害,這將對感染傷口的愈合產生負面影響。因此,如何賦予光熱材料細菌靶向性已成為PTT的研究重點[5,13]。近年來,各種各樣的靶向細菌策略已被開發并廣泛應用于細菌檢測領域,主要是通過引入具有靶向性的物質使得材料能夠特異性結合細菌[14-15]。基于此原理,研究人員已通過表面修飾等方法賦予光熱材料靶向細菌的能力,從而提高局部高溫抗菌效率,降低對正常組織的傷害,實現細菌感染傷口處的靶向光熱抗菌治療[3,5,12],如圖1所示。
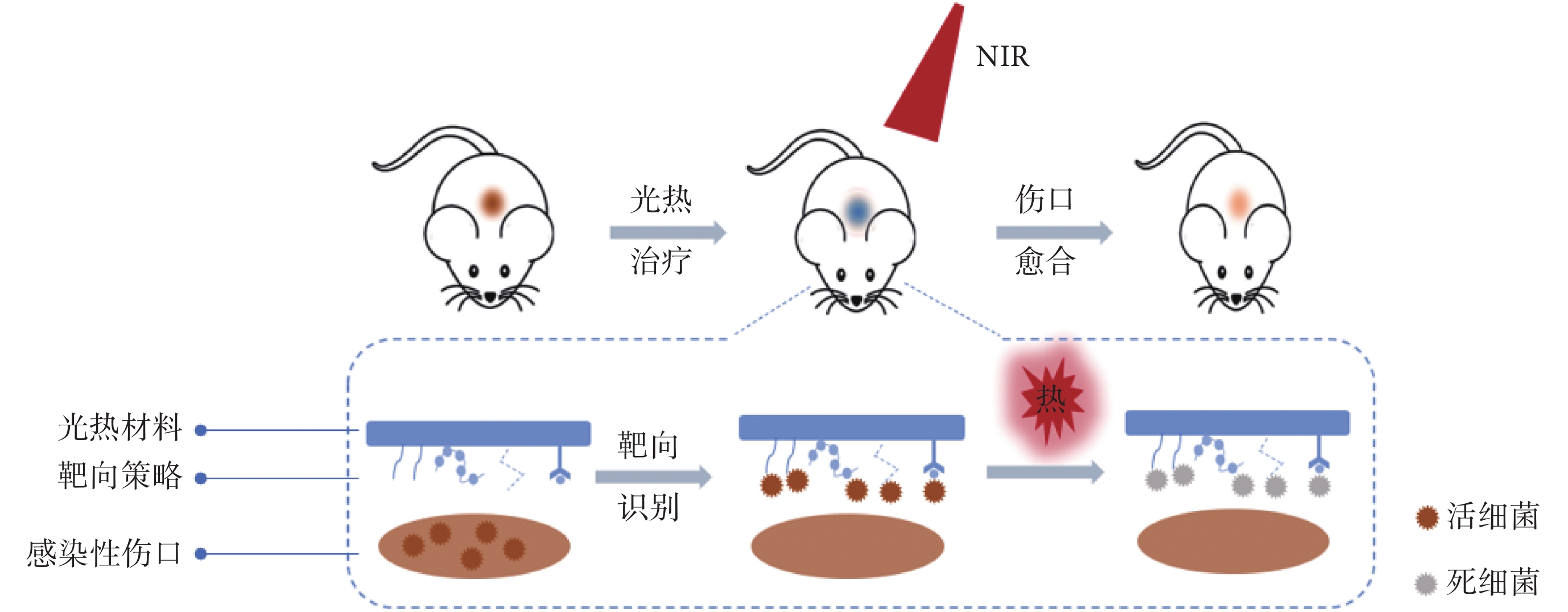 圖1
細菌感染傷口處的靶向光熱抗菌治療機制示意圖
Figure1.
Schematic illustration of the targeted antimicrobial mechanism of photothermal materials for bacteria-infected wound healing
圖1
細菌感染傷口處的靶向光熱抗菌治療機制示意圖
Figure1.
Schematic illustration of the targeted antimicrobial mechanism of photothermal materials for bacteria-infected wound healing
此外,光熱材料應該具有較高的光吸收率、光穩定性及光熱轉換效率,而且必須具備良好的生物相容性以滿足臨床要求。隨著納米技術的發展和納米材料的深入研究,各種各樣的納米材料被發現具有良好的光熱特性,同時由于其本身具有易于化學修飾、結構可調控等優勢,光熱納米材料(photothermal nanomaterials,PTM)已成為PTT的首選材料[7,12]。
1 常見PTM
PTM分為無機PTM和有機PTM兩種。無機PTM主要包括貴金屬納米材料、碳基納米材料、半導體材料和其他新型納米材料等,有機PTM主要包括小分子染料、超分子復合物、共軛聚合物等。
1.1 金納米材料
金納米材料是光熱治療中一種常用的貴金屬納米材料。憑借強大的局部表面等離子共振效應,金納米材料具有較高的紅外光吸收效率和低發光量子產率,可實現光子到聲子的高轉換效率(光到熱的轉換)。圖2概括了金納米材料的主要形態結構,包括納米棒、納米籠、納米板、納米簇、納米星和納米殼[7]。
 圖2
金納米材料的主要形態結構
Figure2.
Diversified gold nanostructures
圖2
金納米材料的主要形態結構
Figure2.
Diversified gold nanostructures
Li等[8]協同金納米孔陣列和氧化石墨烯納米片的光熱特性,與柔性聚酰亞胺薄膜相結合,制備了一種柔性貼片,用于NIR照射下快速高效治療皮膚傷口感染。活體實驗中,用發光二極管陣列(940 nm,10 W)照射貼片5 min,貼片表面溫度升高到52 ℃,傷口感染部位顯示良好的愈合效果,而未經光照組則出現壞死的肌纖維和細菌浸潤。盡管金納米材料具有光熱效果好、易于制備、易表征等優點,但體內穩定性、細菌靶向性及潛在生物毒性的缺陷限制了金納米材料在生物領域的應用[11,16]。最近,一些研究學者在金納米材料表面修飾細菌靶向性物質[17-19],或制備納米復合物[16,20-21]等,以提高納米材料的光熱抗菌靶向性和穩定性,并降低納米粒子聚集引起的生物毒性。
1.2 碳納米管
碳納米管分為單壁碳納米管和多壁碳納米管,都可用于PTT[22]。然而,碳納米管的分散性及細菌錨定作用差,限制了其在感染傷口處的應用[23]。Liang等[24]利用聚多巴胺包覆碳納米管,以增強碳納米管的分散性和生物活性,并將其與明膠接枝的多巴胺、殼聚糖和強力霉素結合形成水凝膠,用于治療感染皮膚傷口。結果證明,當聚多巴胺包覆碳納米管濃度為2 wt%時,光照(808 nm,1.0 W/cm2)10 min后,溫度升高了21.3 ℃,在體內外對大腸桿菌(Escherichia coli,E.coli)和金黃色葡萄球菌(Staphylococcus aureus,S. aureus)的殺菌率達100%。為增強碳納米管的光熱消融細菌作用,Yang等[22]將一種溫敏型聚合物刷(聚N-異丙基丙烯酰胺)修飾在碳納米管表面。合成的納米試劑在NIR激發下可從親水分散轉變為疏水聚集,從而控制細菌的捕獲、殺滅等。體外抗菌和體內傷口愈合實驗表明,該納米制劑對S. aureus的殺菌率在NIR激發幾分鐘后可達100%。以上均證明了碳納米管在抗病原菌和治療皮膚傷口感染方面的潛在應用前景。
1.3 石墨烯材料
2004年,英國科學家Novoselov等[25]首次制備了以sp2雜化連接的單層碳原子晶體——石墨烯。石墨烯材料本身具有一定的抗菌性,但因易受材料本身結構或外界環境的影響,至今仍存在爭議[26-28]。憑借較大的比表面積、優異的機械強度、熱穩定性和光熱轉換能力,石墨烯材料在光熱誘導的抗菌治療中優勢明顯。基于此,氧化石墨烯[29-31]、還原氧化石墨烯[8,32-33]、羧基化石墨烯[9,34]等已被用于預防或治療傷口感染。Pan等[34]開發了一種氧化還原石墨烯/氧化鐵納米復合系統,光熱效應產生的局部熱聯合芬頓反應可加速耐藥菌感染的膿腫皮膚創面的愈合。但石墨烯材料表面性質、聚集狀態等可能導致其具有潛在的細胞毒性,從而影響它們的體內應用。對此,研究人員可通過功能改性、物理包覆等方式賦予其長期生物相容性,例如通過多巴胺對石墨烯材料進行還原改性,降低其生物毒性,并同時提供協同光熱效果。
1.4 金屬硫化物
硫化銅、二硫化鉬等金屬硫化物屬于半導體材料,在成本和生物相容性方面優于貴金屬材料,已廣泛用于光熱研究及治療中。其中,硫化銅是一種具有代表性的PTM[35]。Qiao等[10]開發了一種超微小硫化銅納米點(約6 nm)的雙功能納米系統,用于治療耐多藥細菌感染的慢性傷口。光照(808 nm,2.5 W/cm2)條件下,納米系統的光熱效應在體內和體外對耐甲氧西林的S. aureus和耐廣譜內酰胺酶的E. coli顯示出很強的殺菌效果。在細菌感染的創面愈合實驗中,上述兩種治療系統均表現出良好的促愈合效果,這不僅歸因于硫化銅納米材料的d-d能帶躍遷產生的光熱效應,也受益于系統中銅元素或銅離子的釋放。有文獻指出,銅離子促進成纖維細胞的增殖、遷移和血管生成相關基因的表達,在傷口愈合中也發揮著積極的作用[36]。
除了硫化銅之外,二硫化鉬作為一種新型二維過渡金屬硫化物,是一種比納米金更穩定、比石墨烯更親水的PTM。2013年,Chou等[37]首次證明二硫化鉬在NIR下具有光熱效應,可用作一種新型納米光熱劑。為增強二硫化鉬的穩定性以及對S. aureus的靶向識別能力,于歡[38]利用聚乙二醇和S. aureus抗體修飾二硫化鉬納米片表面。實驗結果表明,當PTM濃度達到30 μg/mL時,材料可以達到99%的靶向抗菌效果。此外,二硫化鉬也具有良好的光催化性,可與光熱效應協同抗菌。Zhang等[39]將其與硫化銅微球相結合并嵌入到水凝膠中,雙光激發(808 nm,660 nm)15 min,材料對S. aureus和E. coli殺菌率分別達99.3%和99.5%,顯示了優異的光熱和光動力協同抗菌性;類似地,作者在另一項研究[40]中則將二硫化鉬與光催化納米材料相結合制備水凝膠,對S. aureus表現快速(雙光激發5 min)、高效(99.9%)的抗菌效果,同樣可用于感染傷口的炎癥消除和快速愈合。
1.5 黑磷量子點
2015年,Sun等[41]合成了一種超小黑磷量子點,這種橫向尺寸約2.6 nm、厚度約1.5 nm的超小黑磷量子點表現出優異的NIR光熱性,光熱轉換效率高達28.4%,并且具有良好的光穩定性。此外,黑磷量子點在生理環境中可逐漸降解為無毒磷酸鹽,具有優異的生物相容性[42]。Zhang等[43]將黑磷量子點和藥物包裹在熱敏脂質體中,開發了一種光響應抗菌納米平臺。NIR照射下,黑磷量子點產生熱量破壞脂質體并釋放出抗生素,同時光熱效應也會引起局部細菌消融,顯著提高了對耐藥細菌的抗菌效率,耐藥菌引起的皮膚膿腫模型實驗進一步證明了該平臺具有優異的體內抗菌效果。
1.6 普魯士藍
普魯士藍是一種古老的染料,2003年被美國食品藥品監督管理局(Food and Drug Administration,FDA)批準用于臨床治療放射性元素中毒[44]。2012年,Fu等[45]首次證明普魯士藍可作為一種新型光熱試劑用于癌癥治療。相較于無機PTM,這類有機小分子染料具有生物安全性高、無毒等優勢,摩爾消光系數比碳納米管、硫化銅等高2~3個數量級,與納米金同數量級,NIR吸收能力強,光熱轉換穩定性好。但大多數對普魯士藍的研究集中在腫瘤的光熱治療領域[46-47]。近年來,基于普魯士藍良好的生物相容性、可降解等特性,研究人員開始將其應用于皮膚創面愈合研究。研究證明普魯士藍不僅可以作為NIR響應性的藥物釋放平臺[48-49],也可用作感染傷口處的光熱抗菌劑[49-51]。
1.7 聚苯胺和聚多巴胺
聚苯胺和聚多巴胺都屬于有機共軛聚合物,通常由有機小分子單體通過氧化聚合方式獲得。二者都屬于導電聚合物,本身具有促進細胞生長和增殖的優勢,因此可被應用于皮膚再生、敷料等領域。2011年,Yang等[52]首次證明聚苯胺在NIR激發下可用于光熱治療。聚苯胺憑借良好的機械柔韌性、生物降解性和抗氧化活性,且在酸性環境下還表現出更強的光熱轉換效率,被廣泛用于腫瘤和細菌感染的光熱治療[53]。Korupalli等[54]和Yan等[55]都將聚苯胺pH響應的光熱轉換特性和殼聚糖衍生物pH響應的表面電荷轉變特性相結合,開發出了靶向納米平臺,實現對酸性細菌感染部位的特異性光熱效應,加速耐多藥細菌感染的皮膚膿腫處的傷口愈合。
多巴胺是人體的腦神經原物質,在堿性條件下可自身聚合形成類似于黑色素結構的聚多巴胺,而黑色素是廣泛存在于生物體中的天然聚合物,因此聚多巴胺具有良好的生物相容性。2012年,Liu等[56]提出了聚多巴胺作為光熱劑的可能性,結果證明其光熱轉換效率高達40%,優于金納米棒(22%),是非常具有潛力的光熱治療材料。最近,含聚多巴胺的光療體系已被開發并用于清除生物膜和細菌相關的感染,為感染創面的快速恢復提供了安全可行的策略[57-58]。趙妍[59]將聚多巴胺應用于糖尿病創面感染模型的PTT,與無機納米材料白蛋白-硫化銅相比,應用相同濃度的聚多巴胺和更低功率的激光就可達到滿意的抗菌效果,同時聚多巴胺合成更簡易、穩定性好,具有更高的光熱轉換性能,其毒副作用更低,更加適合臨床使用。
2 PTM靶向細菌策略及其在傷口愈合中的應用
目前,靶向技術已在腫瘤治療[60]、細菌檢測[61]、病原體感染治療等生物醫學領域得到了廣泛研究。其中,靶向細菌策略是通過與細菌表面產生相互作用,識別細菌表面受體、響應細菌特殊微環境的靶向處理方法,也可分為主動靶向和被動靶向[3]。前者利用細菌特異性配體主動識別細菌病原體;后者主要考慮特殊的細菌微環境,如pH以及細菌分泌的酶、毒素等[5]。基于此原理,研究人員已通過表面修飾等方法,向PTM引入靶向性物質,賦予PTM靶向識別細菌或細菌微環境的能力。當靶向修飾后的PTM應用于傷口感染部位時,材料表面的靶向物質將主動識別并結合細菌病原體,從而增強PTM與細菌的相互作用,這種靶向細菌行為將促使PTM富集于細菌周圍。在NIR照射下,PTM將吸收的光能轉換為熱能,實現精準局部的高溫抗菌治療。基于靶向細菌策略的PTM具有以下幾個顯著優勢:① 提高光熱效率和抗菌效率;② 降低對傷口周圍正常組織的高溫損害;③ 減少納米材料的用量,從而降低對哺乳動物細胞的潛在毒性[62]。目前,陽離子聚合物、抗菌肽、硼酸及其衍生物、多價糖配體、抗體、萬古霉素、巨噬細胞膜和pH響應性材料等都可賦予PTM靶向細菌作用,下面將圍繞PTM中的靶向細菌原理及其在傷口中的應用作具體闡述。
2.1 陽離子聚合物
陽離子聚合物主要是指含胺或季胺基的聚合物等,可以通過靜電作用有效捕獲帶負電荷的細菌[63]。Dai等[64]利用季胺基的噻唑衍生物修飾硫化銅納米粒子,得到了具有良好生物相容性和高效細菌靶向性的硫化銅納米簇。噻唑衍生物作為細菌膜靶向陰離子配體,錨定細菌并吸引細菌聚集在納米簇周圍,增強了硫化銅納米顆粒的光熱細菌消融效果。實驗證明,經季胺基修飾的硫化銅具有靶向光熱抗菌效應,可有效促進細菌感染的大鼠傷口愈合,治療后傷口溫度不超過50 ℃,不會對正常組織造成非特異性損傷。除了季胺類聚合物,殼寡糖也是一種表面帶有許多正電荷氨基的陽離子聚合物。Lin等[65]將殼寡糖與石墨烯量子點結合以賦予材料表面正電荷特性,促進材料與細菌的相互作用。體內外實驗證明,構建的殼寡糖-石墨烯量子點抗菌系統可通過靜電吸引作用捕捉細菌,增強材料的光熱和光動力協同抗菌效果,有效消除細菌感染引起的炎癥,促進細菌感染傷口的快速愈合。
2.2 抗菌肽
近年來,抗菌肽作為一種治療耐藥細菌感染的新型抗菌劑逐漸受到人們關注[66]。天然抗菌肽來自于天然免疫系統,其表面含有高密度的正電荷和大量的疏水氨基酸。一方面能與細菌或生物膜表面發生靜電吸引相互作用,另一方面可以特異性作用于細胞膜上的靶點[67]。如果將抗菌肽固定在光熱納米粒子上,在提高多肽穩定性的同時可以利用多肽與細菌細胞膜上的特異性相互作用,進一步增強光熱納米粒子的光熱效率,實現靶向光熱殺菌,降低高溫對傷口周圍正常組織的損傷。
凡小利[68]利用抗菌肽與細菌的特異性黏附作用,將抗菌肽Magainin1修飾于光熱聚多巴胺納米粒子表面,獲得了具有精準細菌微局部光熱的納米材料,降低細菌對溫度的耐受性。光照條件下(808 nm,2 W/cm2),抗菌肽修飾聚多巴胺納米粒子溶液溫度僅為48 ℃時就實現了有效殺菌,而對于無抗菌肽修飾的納米粒子,溫度需要上升到77.3 ℃才能獲得相當的殺菌效果。Sankari等[69]將抗菌肽LL-37、神經肽與金納米棒相結合,用于感染傷口的光熱治療。結果證明,肽通過與細菌膜間的靜電相互作用提供了靶向結合細菌的特異性,增強了金納米棒的光熱殺菌效果,提高了感染傷口愈合速率。由此看來,抗菌肽功能化將顯著提升材料的抗菌效率,有望改善PTT因環境溫度過高而帶來的組織損傷問題。
2.3 硼酸及其衍生物
作為一類穩定且較易合成的小分子,硼酸衍生物中的硼酸基團可以通過形成環酯選擇性地與順式二醇共價結合,廣泛用于糖類和糖基化合物的靈敏檢測。因為E. coli等革蘭氏陰性菌表面分布的脂多糖含有大量的順式二醇分子,有研究人員也將硼酸衍生物應用于革蘭氏陰性菌的識別和檢測[70]。基于獨特的靶向性、易于合成、無明顯毒性、體內穩定性好等優勢,硼酸衍生物在構建功能材料方面具有顯著優勢。
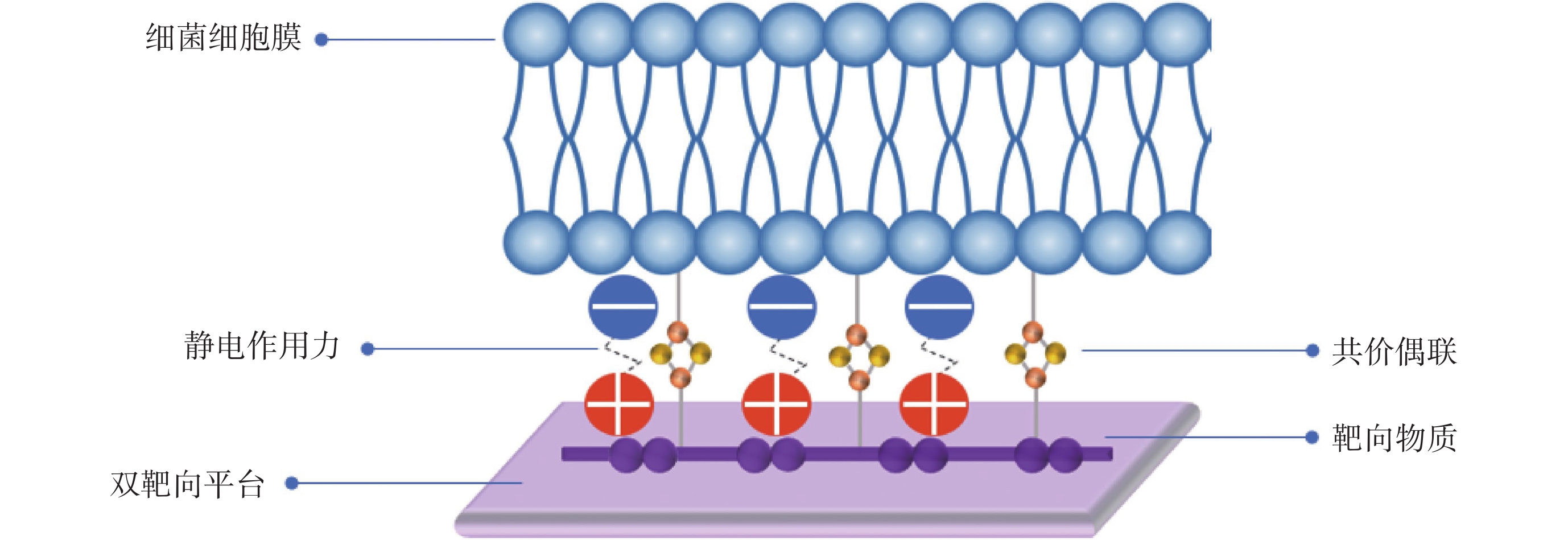
Wang等[63]成功設計了硼酸功能化季銨鹽石墨烯基納米抗菌平臺,該平臺集成化學和光熱抗菌效應,通過季銨鹽的靜電黏附和硼酸共價偶聯的雙靶向作用,特異性結合到細菌及其生物膜上,確保細菌與PTM之間更直接、更有效的相互作用,解決了單一靶向平臺細菌黏附力較弱的問題。與未添加靶向材料的石墨烯基平臺和只添加季銨鹽或硼酸的單一靶向平臺相比,該平臺對耐多藥革蘭氏陰性菌及其生物膜顯示了更強的靶向能力和殺菌能力,對耐多藥細菌銅綠假單胞菌感染的創面和皮下膿腫模型顯示了良好的促愈合效果。圖3所示為雙靶向抗菌機制示意圖。Niu等[71]受細菌感染微環境特點和細菌細胞膜特性的啟發,將苯硼酸修飾的金納米棒與pH誘導的電荷可轉換叔胺基團相結合,開發出一種多靶點納米結構。該納米材料通過表面修飾的苯硼酸與細菌特異結合,同時材料在酸性感染微環境下表現的正電荷特性進一步增強了靶向細菌能力。基于多靶點結構與細菌強大的親和力,金納米棒在NIR激發下產生熱量,靶向光熱殺死細菌細胞,抑制生物膜形成,最終加快多種細菌感染的糖尿病潰瘍傷口愈合。總的來說,目前研究人員為構建更為理想的靶向細菌體系,將硼酸衍生物與陽離子聚合物[63]、pH電荷轉換材料[71]等其他靶向策略相聯合,為PTM提供了更精準、更高效的多模式靶向細菌平臺,充分消除細菌以促進傷口愈合。
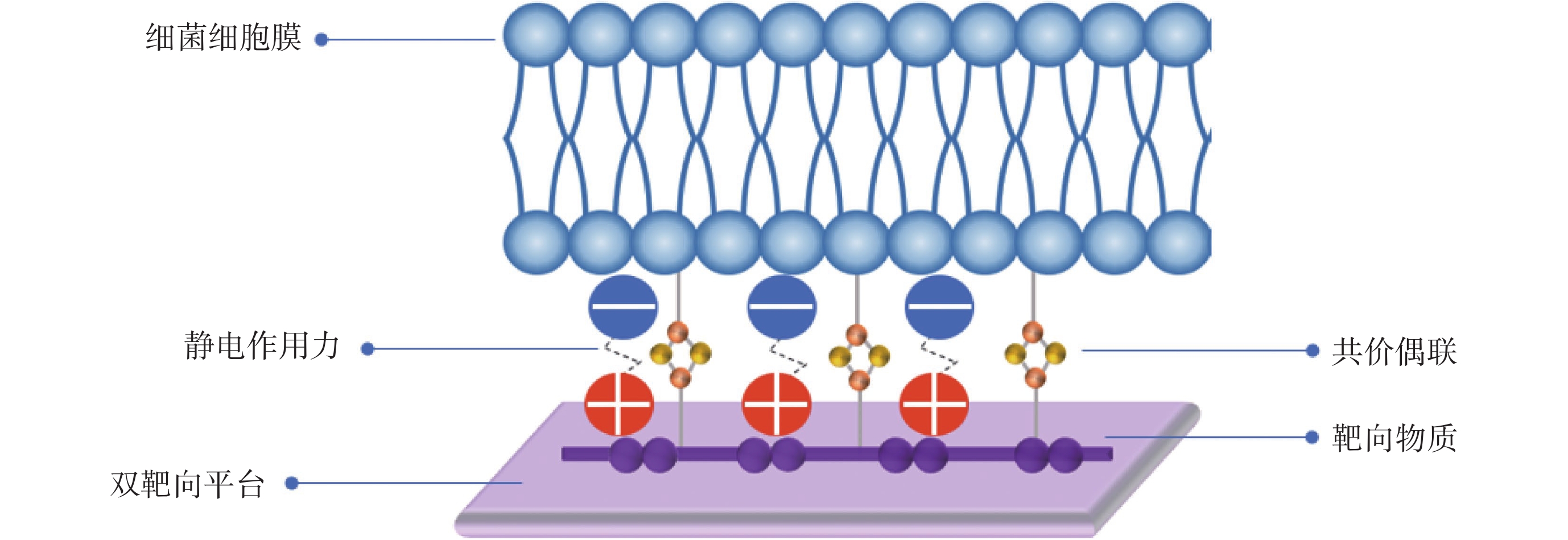 圖3
雙靶向平臺抗菌機制示意圖
Figure3.
Schematic illustration of the antimicrobial mechanism of dual-targeted platform
圖3
雙靶向平臺抗菌機制示意圖
Figure3.
Schematic illustration of the antimicrobial mechanism of dual-targeted platform
2.4 多價糖配體
基于碳水化合物-碳水化合物及碳水化合物-蛋白質間的相互作用是許多細胞生長、黏附、分化、感染等過程中不可或缺的一部分,而多價糖配體的細菌識別平臺已被證明具有較高的靈敏度和選擇性[14,72]。Zhao等[18]通過模擬細菌表面碳水化合物和蛋白質間的自然相互作用,開發了一種基于金納米粒子/擬糖聚合物的抗菌納米系統。該系統可以特異性結合細菌表面的蛋白質——凝集素LecA和LecB,干擾凝集素介導的銅綠假單胞菌的黏附、內化和生物膜形成,表現出高效的生物膜抑制效率(約90%)和殺菌能力(約100%)。應用于細菌感染的皮下膿腫模型時,光照下(808 nm,2 W/cm2)可減少炎癥反應,有利于感染創面愈合。Guo等[73]報道了一種半乳糖功能化的黑磷納米材料,基于半乳糖對細菌凝集素的選擇性結合,該納米平臺可主動靶向細菌。在NIR照射下,黑磷溫度升高,光熱協同釋放的抗生素可主動靶向殺滅傷口細菌,有效促進感染傷口愈合。
2.5 抗體和萬古霉素
抗體和萬古霉素都屬于高度特異的細菌識別元件。金納米顆粒、硫化鉬納米片、多壁碳納米管等PTM都可以結合特異性抗體識別細菌表面蛋白,并在NIR激發下光熱消融細菌以對抗細菌感染[11]。其中,抗葡萄球菌A蛋白抗體可特異性識別S. aureus表面的蛋白A的表達,常用于靶向光熱治療。例如,張玉倩[74]構建了抗葡萄球菌A蛋白抗體功能化的硫化鉬納米片材料,促進PTM在細菌生物膜處的靶向聚集,縮小光熱試劑與細菌間的距離,可實現小鼠感染傷口部位S. aureus的高效靶向光熱抗菌效率(99.9%),顯著促進感染傷口愈合。萬古霉素作為一種抗菌劑,也可通過結合細菌細胞壁上某些物質特異性識別S. aureus等革蘭氏陽性菌。Hao等[75]將萬古霉素摻雜的普魯士藍納米粒子應用于感染小鼠傷口愈合中,結果證明NIR(808 nm,0.5 W/cm2)治療組創面愈合更快,愈合效果更好。Wang等[76]將萬古霉素共價結合到金納米星上,旨在通過光熱效應高效、準確地殺死耐甲氧西林的S. aureus。由于萬古霉素可以主動靶向革蘭氏陽性菌細胞壁,促使所修飾的PTM固定在細菌表面。在隨后的NIR激發下,PTM將在細菌感染部位進行原位熱療,進一步導致細菌死亡。體內感染傷口實驗證明,在NIR激發下,與對照組相比,經萬古霉素修飾的光熱材料明顯減輕了感染傷口的炎癥反應,有利于傷口快速愈合。
2.6 巨噬細胞膜
作為機體先天免疫的重要執行者,巨噬細胞表面表達的一系列模式受體能夠識別病原體表面特定的分子結構,進而清除病原體。利用特定細菌培養巨噬細胞膜時,其膜上識別受體的表達將顯著增加[77]。因此,巨噬細胞膜上受體與細菌相關分子模式間的相互作用,也可用于主動靶向細菌策略中。Wang等[78]報道了一種預處理后的巨噬細胞膜包覆的金納米籠,顯著增加了納米材料在細菌上的黏附和積累,延長了金納米籠在感染部位的滯留時間,最終提高了感染部位的光熱效率和殺菌效率。基于此,為降低納米顆粒被身體重新吸收而帶來的潛在毒性,Li等[20]將細菌處理后的巨噬細胞膜包覆在水凝膠材料上,該水凝膠材料由N-丙烯酰甘氨酰胺單體溶液與聚多巴胺包覆的金納米棒經一步聚合而成。制備的納米復合水凝膠不僅表現出高強度、高韌性,而且可以特異性捕獲細菌并在NIR(808 nm,2 W/cm2)激發下快速高效(5 min)地殺死細菌。進一步地,水凝膠在S. aureus感染的全層皮膚缺損模型中表現出優異的促愈合效果,具有作為傷口敷料的潛力。
2.7 pH響應性材料
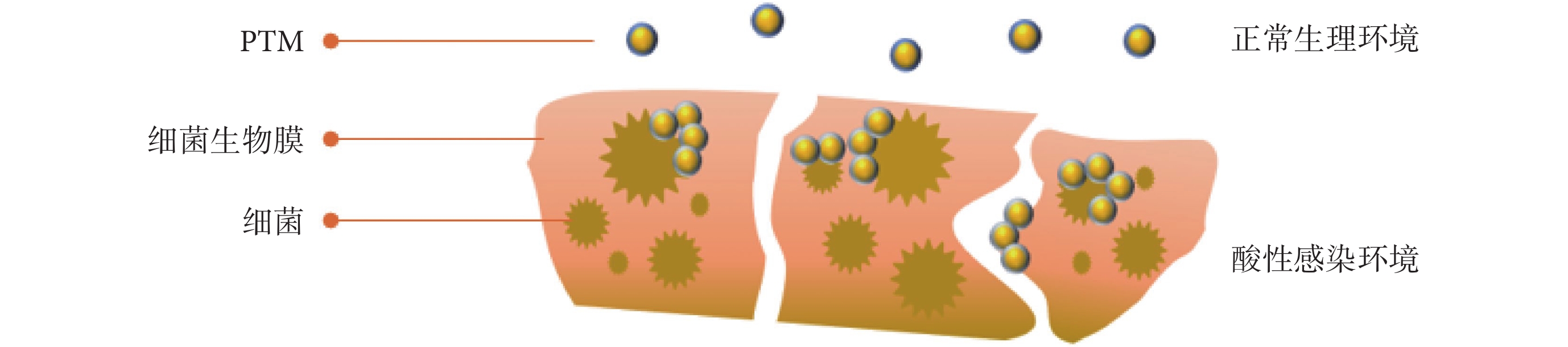
利用細菌感染的微酸環境,一方面通過表面自適應性兩性粒子實現PTM的自由分布和聚集狀態轉換,另一方面也可通過殼聚糖及其衍生物材料等實現材料的表面正負電荷的轉換[13]。如圖4所示,涂層兩性離子膜的金納米粒子具有快速的pH響應性,酸性環境下(pH = 5.5)表面負電荷轉變為正電荷并形成聚集物。與在健康組織(pH = 7.4)中分散性狀態相比,這種微環境自適應的設計增強了金納米粒子對耐甲氧西林的S. aureus生物膜的光熱效應。皮膚膿腫感染模型證明,治療過程中周圍組織無明顯的溫度升高,而感染部位則快速升溫至55 ℃左右[17]。乙二醇殼聚糖(glycol chitosan,GCS)是一種pH依賴電荷的殼聚糖衍生物,具有良好的水溶性和生物相容性,通常以納米顆粒等形式用于生物醫學研究。Korupalli等[54]和Qian等[9]均利用酸性條件觸發的GCS靶向細菌作用分別合成了pH響應型的聚苯胺-殼聚糖納米粒子(polyaniline conjugated glycol chitosan,PANI-GCS)、殼聚糖-羧基化石墨烯納米膜(glycol chitosan conjugated carboxyl graphene,GCS-CG)。正常生理條件(pH = 7.4)下,材料表面顯示中性(PANI-GCS)或微弱的負電荷(GCS-CG),與鄰近宿主細胞親和力差,所以對健康組織光熱損傷小;當處于細菌感染的酸性膿腫環境(pH = 6.3)中,表面從負電荷轉變為正電荷,通過靜電作用與帶有負電荷的細菌細胞表面產生強烈的結合,導致細菌聚集。體外實驗中,細菌與材料的體外相互作用和抗菌結果證實了GCS功能化的PTM具有pH依賴性的細菌特異性相互作用,同時在NIR下顯示出明顯優于其他組的高效抗菌效果。具體表現為:PANI-GCS(808 nm)組細胞活性降低約98%,遠高于未照射組(活性降低約7%);GCS-CG(無光照)組殺菌效果僅為13%~15%,GCS-CG(808 nm)組殺菌率接近100%。體內細菌感染的鼠膿腫傷口愈合實驗結果表明,紅外照射后,感染傷口和正常組織溫度均迅速上升到50 ℃左右,隨后,正常組織表面溫度出現明顯下降,而感染傷口溫度繼續上升并最終維持在55 ℃左右。證實了納米材料對pH的響應性,以及它們在局部感染中表現出的特異性原位靶向和聚集細菌的潛力,從而減少對組織的損傷,加速傷口愈合。
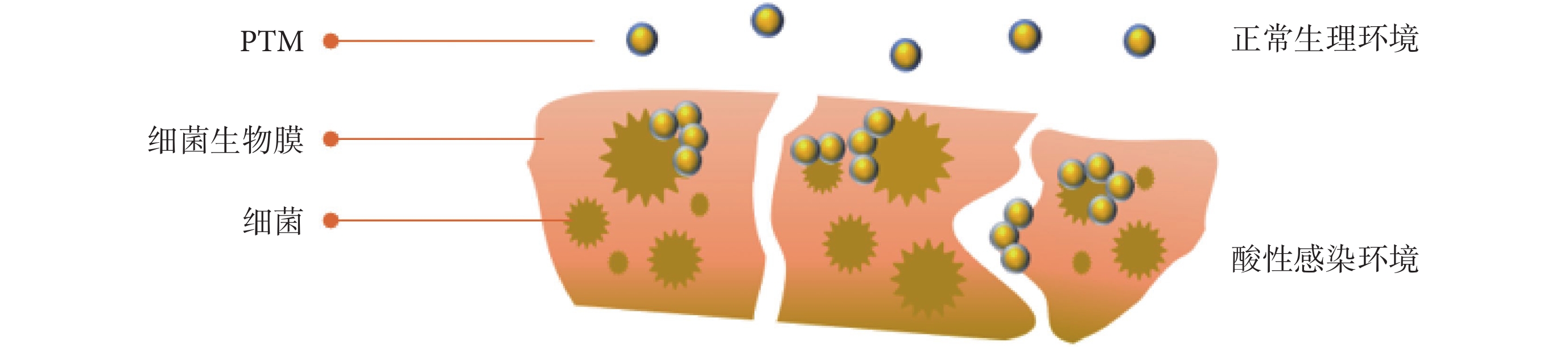 圖4
酸性微環境觸發對細菌生物膜的有效黏附并增強光熱消融效果
Figure4.
The effective adherence and enhanced photothermal ablation of bacteria biofilm triggered by acidic microenvironment
圖4
酸性微環境觸發對細菌生物膜的有效黏附并增強光熱消融效果
Figure4.
The effective adherence and enhanced photothermal ablation of bacteria biofilm triggered by acidic microenvironment
3 結論及展望
隨著各種PTM的開發,PTT在細菌感染的傷口治療中顯示出巨大的潛力。同時,為提高傷口感染部位抗菌效果,降低光熱對周圍健康組織的高溫損傷,靶向細菌策略也逐漸被應用于傷口的光熱治療中。但是,還有很多問題和挑戰需要解決:
(1)需要開發同時具有高光熱轉換效率和低生物毒性的PTM。目前有機納米材料如金、碳納米管、石墨烯、硫化銅、硫化鉬等都具有較高的光熱轉換效率,但它們對生物體的毒性損害還需要一定時間進行考察。無機納米材料具有良好的生物相容性,但光照下穩定性較弱,易發生光降解,不利于長期發揮光熱抗菌效果。
(2)靶向光熱抗菌機制和評價體系仍待完善。大量研究已證明利用靶向細菌策略可提高PTM與細菌的結合及在傷口感染部位的聚集,實現局部高溫抗菌,對健康組織損傷較小。但是各項研究參數不同,導致重復性低、臨床應用參考性差。
(3)PTM的構建忽略了傷口愈合階段是動態變化的。無論是否結合靶向細菌策略,PTM大多是直接注射或涂抹在傷口部位,部分以水凝膠等形式應用于傷口,而且大多數研究只重視了傷口抗菌消炎階段。雖然殺菌抑菌是感染傷口的治療重點,但傷口部位組織再生和重塑也影響了最終的傷口愈合效果。
針對以上問題,我們提出一些可能的解決方法:
(1)優化納米材料的制備方法,通過表面修飾等方法改性并構建納米復合材料平臺,獲得毒副作用更低、光熱效果更優、抗菌效果更好的PTM。
(2)建立系統的靶向光熱抗菌評價體系。基于抗菌評價方法和現有的細菌檢測技術,以PTM、靶向策略、靶向細菌目標等為分類依據,以殺菌率、感染部位溫度及其與周圍健康組織溫差等為評價標準,系統性評價靶向光熱抗菌的效果及優勢。
(3)協同其他抗菌治療方法。一方面,可以結合傳統抗生素協同抗菌,或利用光熱響應性在傷口處實現抗生素的按需釋放;另一方面也可以與光動力療法等相結合,構建一體化傷口治療平臺,輔助PTT,降低激光密度及局部光熱溫度,實現良好的協同抗菌效果。
(4)將靶向光熱抗菌療法與傳統敷料相結合,開發適用于傷口各個階段愈合的新型敷料。根據傷口類型及傷口愈合各階段的需求,通過不同功能的材料復合形成多功能性的傷口敷料,應用于傷口管理中,提高靶向光熱抗菌療法應用于傷口治療的可行性。例如,利用改性氧化石墨烯等作為光熱劑,結合水凝膠的吸水保濕性和紡織品的力學性能,制備同時具有良好吸水性能、力學性能、光熱抗菌性能的復合材料,旨在實現傷口敷料的多功能性,滿足傷口愈合要求。
雖然靶向光熱抗菌納米材料真正應用于傷口治療還需要大量的時間,但我們相信,隨著PTM研究的不斷深入和靶向細菌策略的不斷完善,靶向光熱療法將成為促進感染傷口愈合的一種有效治療手段。
重要聲明
利益沖突聲明:本文全體作者均聲明不存在利益沖突。
作者貢獻聲明:袁香楠為綜述主要撰寫人,完成相關文獻資料的收集和分析及論文初稿的寫作;譚紹潔參與文獻資料的分析、整理;高晶為論文的構思者及負責人,指導論文寫作;王璐為論文的主要審核人。
引言
細菌感染嚴重威脅了人類的生命安全。據估計,每年約有一千五百萬人死于細菌感染。過去幾十年里,抗生素一直作為治療細菌感染最有效的藥物,但長期濫用抗生素導致了耐藥細菌反復出現,嚴重影響治療效果[1-4]。對于創傷或疾病等原因形成的傷口來說,其表面環境一般較為潮濕溫暖,更容易受到細菌感染,從而延長傷口愈合的時間,甚至導致組織的壞死。目前,細菌感染及細菌耐藥性已成為傷口治療和管理的主要挑戰[5-6]。因此,迫切需要開發安全有效的新型抗菌材料用于細菌感染傷口的治療。
自1862年巴斯德提出巴氏殺菌法后,熱處理法被證明對所有病原體的清除都有一定的效果。近年來,基于紅外光激發的光熱療法(photothermal therapy,PTT)逐漸應用于感染傷口的治療,因其不會產生耐藥性,且具有廣譜抗菌性,成為最有前景的抗生素替代療法[7-10]。PTT是指在近紅外光(near-infrared light,NIR)照射下,光熱材料由于表面等離子體激元共振效應或能級躍遷原理表現出強烈的光吸收,并將所吸收的光能轉換為熱能,局部熱量升高并向周圍擴散。高溫隨后破壞細菌細胞壁、細胞膜的結構完整性,導致胞內重要物質流出,細菌內部結構遭到破壞;同時引起蛋白質、酶變性甚至脫氧核糖核酸損傷,干擾細胞代謝活動,對細菌產生不可逆轉的損害,從而達到光熱殺菌的目的。這種基于物理原理的抗菌療法不僅可以抑制耐藥細菌的生成,而且可以通過破壞細菌結構防止生物膜的形成[3,11-12]。
PTT在治療細菌感染方面顯示出巨大的潛力,但這種基于高溫殺菌的治療策略在實際應用中仍存在局限性。由于缺乏細菌靶向性,光熱材料并不能識別并結合細菌細胞,無法高效、快速地聚集在細菌周圍。而在隨后的NIR激發下,光熱材料將光能轉換為熱能,所產生的熱量向周圍擴散,難以直接并特異地高溫加熱細菌,大大降低了高溫抗菌效率。尤其是應用于細菌感染的皮膚傷口時,非局部加熱和高溫不僅會影響光熱抗菌效果,而且會對傷口周圍的健康組織造成很大的損害,這將對感染傷口的愈合產生負面影響。因此,如何賦予光熱材料細菌靶向性已成為PTT的研究重點[5,13]。近年來,各種各樣的靶向細菌策略已被開發并廣泛應用于細菌檢測領域,主要是通過引入具有靶向性的物質使得材料能夠特異性結合細菌[14-15]。基于此原理,研究人員已通過表面修飾等方法賦予光熱材料靶向細菌的能力,從而提高局部高溫抗菌效率,降低對正常組織的傷害,實現細菌感染傷口處的靶向光熱抗菌治療[3,5,12],如圖1所示。
 圖1
細菌感染傷口處的靶向光熱抗菌治療機制示意圖
Figure1.
Schematic illustration of the targeted antimicrobial mechanism of photothermal materials for bacteria-infected wound healing
圖1
細菌感染傷口處的靶向光熱抗菌治療機制示意圖
Figure1.
Schematic illustration of the targeted antimicrobial mechanism of photothermal materials for bacteria-infected wound healing
此外,光熱材料應該具有較高的光吸收率、光穩定性及光熱轉換效率,而且必須具備良好的生物相容性以滿足臨床要求。隨著納米技術的發展和納米材料的深入研究,各種各樣的納米材料被發現具有良好的光熱特性,同時由于其本身具有易于化學修飾、結構可調控等優勢,光熱納米材料(photothermal nanomaterials,PTM)已成為PTT的首選材料[7,12]。
1 常見PTM
PTM分為無機PTM和有機PTM兩種。無機PTM主要包括貴金屬納米材料、碳基納米材料、半導體材料和其他新型納米材料等,有機PTM主要包括小分子染料、超分子復合物、共軛聚合物等。
1.1 金納米材料
金納米材料是光熱治療中一種常用的貴金屬納米材料。憑借強大的局部表面等離子共振效應,金納米材料具有較高的紅外光吸收效率和低發光量子產率,可實現光子到聲子的高轉換效率(光到熱的轉換)。圖2概括了金納米材料的主要形態結構,包括納米棒、納米籠、納米板、納米簇、納米星和納米殼[7]。
 圖2
金納米材料的主要形態結構
Figure2.
Diversified gold nanostructures
圖2
金納米材料的主要形態結構
Figure2.
Diversified gold nanostructures
Li等[8]協同金納米孔陣列和氧化石墨烯納米片的光熱特性,與柔性聚酰亞胺薄膜相結合,制備了一種柔性貼片,用于NIR照射下快速高效治療皮膚傷口感染。活體實驗中,用發光二極管陣列(940 nm,10 W)照射貼片5 min,貼片表面溫度升高到52 ℃,傷口感染部位顯示良好的愈合效果,而未經光照組則出現壞死的肌纖維和細菌浸潤。盡管金納米材料具有光熱效果好、易于制備、易表征等優點,但體內穩定性、細菌靶向性及潛在生物毒性的缺陷限制了金納米材料在生物領域的應用[11,16]。最近,一些研究學者在金納米材料表面修飾細菌靶向性物質[17-19],或制備納米復合物[16,20-21]等,以提高納米材料的光熱抗菌靶向性和穩定性,并降低納米粒子聚集引起的生物毒性。
1.2 碳納米管
碳納米管分為單壁碳納米管和多壁碳納米管,都可用于PTT[22]。然而,碳納米管的分散性及細菌錨定作用差,限制了其在感染傷口處的應用[23]。Liang等[24]利用聚多巴胺包覆碳納米管,以增強碳納米管的分散性和生物活性,并將其與明膠接枝的多巴胺、殼聚糖和強力霉素結合形成水凝膠,用于治療感染皮膚傷口。結果證明,當聚多巴胺包覆碳納米管濃度為2 wt%時,光照(808 nm,1.0 W/cm2)10 min后,溫度升高了21.3 ℃,在體內外對大腸桿菌(Escherichia coli,E.coli)和金黃色葡萄球菌(Staphylococcus aureus,S. aureus)的殺菌率達100%。為增強碳納米管的光熱消融細菌作用,Yang等[22]將一種溫敏型聚合物刷(聚N-異丙基丙烯酰胺)修飾在碳納米管表面。合成的納米試劑在NIR激發下可從親水分散轉變為疏水聚集,從而控制細菌的捕獲、殺滅等。體外抗菌和體內傷口愈合實驗表明,該納米制劑對S. aureus的殺菌率在NIR激發幾分鐘后可達100%。以上均證明了碳納米管在抗病原菌和治療皮膚傷口感染方面的潛在應用前景。
1.3 石墨烯材料
2004年,英國科學家Novoselov等[25]首次制備了以sp2雜化連接的單層碳原子晶體——石墨烯。石墨烯材料本身具有一定的抗菌性,但因易受材料本身結構或外界環境的影響,至今仍存在爭議[26-28]。憑借較大的比表面積、優異的機械強度、熱穩定性和光熱轉換能力,石墨烯材料在光熱誘導的抗菌治療中優勢明顯。基于此,氧化石墨烯[29-31]、還原氧化石墨烯[8,32-33]、羧基化石墨烯[9,34]等已被用于預防或治療傷口感染。Pan等[34]開發了一種氧化還原石墨烯/氧化鐵納米復合系統,光熱效應產生的局部熱聯合芬頓反應可加速耐藥菌感染的膿腫皮膚創面的愈合。但石墨烯材料表面性質、聚集狀態等可能導致其具有潛在的細胞毒性,從而影響它們的體內應用。對此,研究人員可通過功能改性、物理包覆等方式賦予其長期生物相容性,例如通過多巴胺對石墨烯材料進行還原改性,降低其生物毒性,并同時提供協同光熱效果。
1.4 金屬硫化物
硫化銅、二硫化鉬等金屬硫化物屬于半導體材料,在成本和生物相容性方面優于貴金屬材料,已廣泛用于光熱研究及治療中。其中,硫化銅是一種具有代表性的PTM[35]。Qiao等[10]開發了一種超微小硫化銅納米點(約6 nm)的雙功能納米系統,用于治療耐多藥細菌感染的慢性傷口。光照(808 nm,2.5 W/cm2)條件下,納米系統的光熱效應在體內和體外對耐甲氧西林的S. aureus和耐廣譜內酰胺酶的E. coli顯示出很強的殺菌效果。在細菌感染的創面愈合實驗中,上述兩種治療系統均表現出良好的促愈合效果,這不僅歸因于硫化銅納米材料的d-d能帶躍遷產生的光熱效應,也受益于系統中銅元素或銅離子的釋放。有文獻指出,銅離子促進成纖維細胞的增殖、遷移和血管生成相關基因的表達,在傷口愈合中也發揮著積極的作用[36]。
除了硫化銅之外,二硫化鉬作為一種新型二維過渡金屬硫化物,是一種比納米金更穩定、比石墨烯更親水的PTM。2013年,Chou等[37]首次證明二硫化鉬在NIR下具有光熱效應,可用作一種新型納米光熱劑。為增強二硫化鉬的穩定性以及對S. aureus的靶向識別能力,于歡[38]利用聚乙二醇和S. aureus抗體修飾二硫化鉬納米片表面。實驗結果表明,當PTM濃度達到30 μg/mL時,材料可以達到99%的靶向抗菌效果。此外,二硫化鉬也具有良好的光催化性,可與光熱效應協同抗菌。Zhang等[39]將其與硫化銅微球相結合并嵌入到水凝膠中,雙光激發(808 nm,660 nm)15 min,材料對S. aureus和E. coli殺菌率分別達99.3%和99.5%,顯示了優異的光熱和光動力協同抗菌性;類似地,作者在另一項研究[40]中則將二硫化鉬與光催化納米材料相結合制備水凝膠,對S. aureus表現快速(雙光激發5 min)、高效(99.9%)的抗菌效果,同樣可用于感染傷口的炎癥消除和快速愈合。
1.5 黑磷量子點
2015年,Sun等[41]合成了一種超小黑磷量子點,這種橫向尺寸約2.6 nm、厚度約1.5 nm的超小黑磷量子點表現出優異的NIR光熱性,光熱轉換效率高達28.4%,并且具有良好的光穩定性。此外,黑磷量子點在生理環境中可逐漸降解為無毒磷酸鹽,具有優異的生物相容性[42]。Zhang等[43]將黑磷量子點和藥物包裹在熱敏脂質體中,開發了一種光響應抗菌納米平臺。NIR照射下,黑磷量子點產生熱量破壞脂質體并釋放出抗生素,同時光熱效應也會引起局部細菌消融,顯著提高了對耐藥細菌的抗菌效率,耐藥菌引起的皮膚膿腫模型實驗進一步證明了該平臺具有優異的體內抗菌效果。
1.6 普魯士藍
普魯士藍是一種古老的染料,2003年被美國食品藥品監督管理局(Food and Drug Administration,FDA)批準用于臨床治療放射性元素中毒[44]。2012年,Fu等[45]首次證明普魯士藍可作為一種新型光熱試劑用于癌癥治療。相較于無機PTM,這類有機小分子染料具有生物安全性高、無毒等優勢,摩爾消光系數比碳納米管、硫化銅等高2~3個數量級,與納米金同數量級,NIR吸收能力強,光熱轉換穩定性好。但大多數對普魯士藍的研究集中在腫瘤的光熱治療領域[46-47]。近年來,基于普魯士藍良好的生物相容性、可降解等特性,研究人員開始將其應用于皮膚創面愈合研究。研究證明普魯士藍不僅可以作為NIR響應性的藥物釋放平臺[48-49],也可用作感染傷口處的光熱抗菌劑[49-51]。
1.7 聚苯胺和聚多巴胺
聚苯胺和聚多巴胺都屬于有機共軛聚合物,通常由有機小分子單體通過氧化聚合方式獲得。二者都屬于導電聚合物,本身具有促進細胞生長和增殖的優勢,因此可被應用于皮膚再生、敷料等領域。2011年,Yang等[52]首次證明聚苯胺在NIR激發下可用于光熱治療。聚苯胺憑借良好的機械柔韌性、生物降解性和抗氧化活性,且在酸性環境下還表現出更強的光熱轉換效率,被廣泛用于腫瘤和細菌感染的光熱治療[53]。Korupalli等[54]和Yan等[55]都將聚苯胺pH響應的光熱轉換特性和殼聚糖衍生物pH響應的表面電荷轉變特性相結合,開發出了靶向納米平臺,實現對酸性細菌感染部位的特異性光熱效應,加速耐多藥細菌感染的皮膚膿腫處的傷口愈合。
多巴胺是人體的腦神經原物質,在堿性條件下可自身聚合形成類似于黑色素結構的聚多巴胺,而黑色素是廣泛存在于生物體中的天然聚合物,因此聚多巴胺具有良好的生物相容性。2012年,Liu等[56]提出了聚多巴胺作為光熱劑的可能性,結果證明其光熱轉換效率高達40%,優于金納米棒(22%),是非常具有潛力的光熱治療材料。最近,含聚多巴胺的光療體系已被開發并用于清除生物膜和細菌相關的感染,為感染創面的快速恢復提供了安全可行的策略[57-58]。趙妍[59]將聚多巴胺應用于糖尿病創面感染模型的PTT,與無機納米材料白蛋白-硫化銅相比,應用相同濃度的聚多巴胺和更低功率的激光就可達到滿意的抗菌效果,同時聚多巴胺合成更簡易、穩定性好,具有更高的光熱轉換性能,其毒副作用更低,更加適合臨床使用。
2 PTM靶向細菌策略及其在傷口愈合中的應用
目前,靶向技術已在腫瘤治療[60]、細菌檢測[61]、病原體感染治療等生物醫學領域得到了廣泛研究。其中,靶向細菌策略是通過與細菌表面產生相互作用,識別細菌表面受體、響應細菌特殊微環境的靶向處理方法,也可分為主動靶向和被動靶向[3]。前者利用細菌特異性配體主動識別細菌病原體;后者主要考慮特殊的細菌微環境,如pH以及細菌分泌的酶、毒素等[5]。基于此原理,研究人員已通過表面修飾等方法,向PTM引入靶向性物質,賦予PTM靶向識別細菌或細菌微環境的能力。當靶向修飾后的PTM應用于傷口感染部位時,材料表面的靶向物質將主動識別并結合細菌病原體,從而增強PTM與細菌的相互作用,這種靶向細菌行為將促使PTM富集于細菌周圍。在NIR照射下,PTM將吸收的光能轉換為熱能,實現精準局部的高溫抗菌治療。基于靶向細菌策略的PTM具有以下幾個顯著優勢:① 提高光熱效率和抗菌效率;② 降低對傷口周圍正常組織的高溫損害;③ 減少納米材料的用量,從而降低對哺乳動物細胞的潛在毒性[62]。目前,陽離子聚合物、抗菌肽、硼酸及其衍生物、多價糖配體、抗體、萬古霉素、巨噬細胞膜和pH響應性材料等都可賦予PTM靶向細菌作用,下面將圍繞PTM中的靶向細菌原理及其在傷口中的應用作具體闡述。
2.1 陽離子聚合物
陽離子聚合物主要是指含胺或季胺基的聚合物等,可以通過靜電作用有效捕獲帶負電荷的細菌[63]。Dai等[64]利用季胺基的噻唑衍生物修飾硫化銅納米粒子,得到了具有良好生物相容性和高效細菌靶向性的硫化銅納米簇。噻唑衍生物作為細菌膜靶向陰離子配體,錨定細菌并吸引細菌聚集在納米簇周圍,增強了硫化銅納米顆粒的光熱細菌消融效果。實驗證明,經季胺基修飾的硫化銅具有靶向光熱抗菌效應,可有效促進細菌感染的大鼠傷口愈合,治療后傷口溫度不超過50 ℃,不會對正常組織造成非特異性損傷。除了季胺類聚合物,殼寡糖也是一種表面帶有許多正電荷氨基的陽離子聚合物。Lin等[65]將殼寡糖與石墨烯量子點結合以賦予材料表面正電荷特性,促進材料與細菌的相互作用。體內外實驗證明,構建的殼寡糖-石墨烯量子點抗菌系統可通過靜電吸引作用捕捉細菌,增強材料的光熱和光動力協同抗菌效果,有效消除細菌感染引起的炎癥,促進細菌感染傷口的快速愈合。
2.2 抗菌肽
近年來,抗菌肽作為一種治療耐藥細菌感染的新型抗菌劑逐漸受到人們關注[66]。天然抗菌肽來自于天然免疫系統,其表面含有高密度的正電荷和大量的疏水氨基酸。一方面能與細菌或生物膜表面發生靜電吸引相互作用,另一方面可以特異性作用于細胞膜上的靶點[67]。如果將抗菌肽固定在光熱納米粒子上,在提高多肽穩定性的同時可以利用多肽與細菌細胞膜上的特異性相互作用,進一步增強光熱納米粒子的光熱效率,實現靶向光熱殺菌,降低高溫對傷口周圍正常組織的損傷。
凡小利[68]利用抗菌肽與細菌的特異性黏附作用,將抗菌肽Magainin1修飾于光熱聚多巴胺納米粒子表面,獲得了具有精準細菌微局部光熱的納米材料,降低細菌對溫度的耐受性。光照條件下(808 nm,2 W/cm2),抗菌肽修飾聚多巴胺納米粒子溶液溫度僅為48 ℃時就實現了有效殺菌,而對于無抗菌肽修飾的納米粒子,溫度需要上升到77.3 ℃才能獲得相當的殺菌效果。Sankari等[69]將抗菌肽LL-37、神經肽與金納米棒相結合,用于感染傷口的光熱治療。結果證明,肽通過與細菌膜間的靜電相互作用提供了靶向結合細菌的特異性,增強了金納米棒的光熱殺菌效果,提高了感染傷口愈合速率。由此看來,抗菌肽功能化將顯著提升材料的抗菌效率,有望改善PTT因環境溫度過高而帶來的組織損傷問題。
2.3 硼酸及其衍生物
作為一類穩定且較易合成的小分子,硼酸衍生物中的硼酸基團可以通過形成環酯選擇性地與順式二醇共價結合,廣泛用于糖類和糖基化合物的靈敏檢測。因為E. coli等革蘭氏陰性菌表面分布的脂多糖含有大量的順式二醇分子,有研究人員也將硼酸衍生物應用于革蘭氏陰性菌的識別和檢測[70]。基于獨特的靶向性、易于合成、無明顯毒性、體內穩定性好等優勢,硼酸衍生物在構建功能材料方面具有顯著優勢。
Wang等[63]成功設計了硼酸功能化季銨鹽石墨烯基納米抗菌平臺,該平臺集成化學和光熱抗菌效應,通過季銨鹽的靜電黏附和硼酸共價偶聯的雙靶向作用,特異性結合到細菌及其生物膜上,確保細菌與PTM之間更直接、更有效的相互作用,解決了單一靶向平臺細菌黏附力較弱的問題。與未添加靶向材料的石墨烯基平臺和只添加季銨鹽或硼酸的單一靶向平臺相比,該平臺對耐多藥革蘭氏陰性菌及其生物膜顯示了更強的靶向能力和殺菌能力,對耐多藥細菌銅綠假單胞菌感染的創面和皮下膿腫模型顯示了良好的促愈合效果。圖3所示為雙靶向抗菌機制示意圖。Niu等[71]受細菌感染微環境特點和細菌細胞膜特性的啟發,將苯硼酸修飾的金納米棒與pH誘導的電荷可轉換叔胺基團相結合,開發出一種多靶點納米結構。該納米材料通過表面修飾的苯硼酸與細菌特異結合,同時材料在酸性感染微環境下表現的正電荷特性進一步增強了靶向細菌能力。基于多靶點結構與細菌強大的親和力,金納米棒在NIR激發下產生熱量,靶向光熱殺死細菌細胞,抑制生物膜形成,最終加快多種細菌感染的糖尿病潰瘍傷口愈合。總的來說,目前研究人員為構建更為理想的靶向細菌體系,將硼酸衍生物與陽離子聚合物[63]、pH電荷轉換材料[71]等其他靶向策略相聯合,為PTM提供了更精準、更高效的多模式靶向細菌平臺,充分消除細菌以促進傷口愈合。
 圖3
雙靶向平臺抗菌機制示意圖
Figure3.
Schematic illustration of the antimicrobial mechanism of dual-targeted platform
圖3
雙靶向平臺抗菌機制示意圖
Figure3.
Schematic illustration of the antimicrobial mechanism of dual-targeted platform
2.4 多價糖配體
基于碳水化合物-碳水化合物及碳水化合物-蛋白質間的相互作用是許多細胞生長、黏附、分化、感染等過程中不可或缺的一部分,而多價糖配體的細菌識別平臺已被證明具有較高的靈敏度和選擇性[14,72]。Zhao等[18]通過模擬細菌表面碳水化合物和蛋白質間的自然相互作用,開發了一種基于金納米粒子/擬糖聚合物的抗菌納米系統。該系統可以特異性結合細菌表面的蛋白質——凝集素LecA和LecB,干擾凝集素介導的銅綠假單胞菌的黏附、內化和生物膜形成,表現出高效的生物膜抑制效率(約90%)和殺菌能力(約100%)。應用于細菌感染的皮下膿腫模型時,光照下(808 nm,2 W/cm2)可減少炎癥反應,有利于感染創面愈合。Guo等[73]報道了一種半乳糖功能化的黑磷納米材料,基于半乳糖對細菌凝集素的選擇性結合,該納米平臺可主動靶向細菌。在NIR照射下,黑磷溫度升高,光熱協同釋放的抗生素可主動靶向殺滅傷口細菌,有效促進感染傷口愈合。
2.5 抗體和萬古霉素
抗體和萬古霉素都屬于高度特異的細菌識別元件。金納米顆粒、硫化鉬納米片、多壁碳納米管等PTM都可以結合特異性抗體識別細菌表面蛋白,并在NIR激發下光熱消融細菌以對抗細菌感染[11]。其中,抗葡萄球菌A蛋白抗體可特異性識別S. aureus表面的蛋白A的表達,常用于靶向光熱治療。例如,張玉倩[74]構建了抗葡萄球菌A蛋白抗體功能化的硫化鉬納米片材料,促進PTM在細菌生物膜處的靶向聚集,縮小光熱試劑與細菌間的距離,可實現小鼠感染傷口部位S. aureus的高效靶向光熱抗菌效率(99.9%),顯著促進感染傷口愈合。萬古霉素作為一種抗菌劑,也可通過結合細菌細胞壁上某些物質特異性識別S. aureus等革蘭氏陽性菌。Hao等[75]將萬古霉素摻雜的普魯士藍納米粒子應用于感染小鼠傷口愈合中,結果證明NIR(808 nm,0.5 W/cm2)治療組創面愈合更快,愈合效果更好。Wang等[76]將萬古霉素共價結合到金納米星上,旨在通過光熱效應高效、準確地殺死耐甲氧西林的S. aureus。由于萬古霉素可以主動靶向革蘭氏陽性菌細胞壁,促使所修飾的PTM固定在細菌表面。在隨后的NIR激發下,PTM將在細菌感染部位進行原位熱療,進一步導致細菌死亡。體內感染傷口實驗證明,在NIR激發下,與對照組相比,經萬古霉素修飾的光熱材料明顯減輕了感染傷口的炎癥反應,有利于傷口快速愈合。
2.6 巨噬細胞膜
作為機體先天免疫的重要執行者,巨噬細胞表面表達的一系列模式受體能夠識別病原體表面特定的分子結構,進而清除病原體。利用特定細菌培養巨噬細胞膜時,其膜上識別受體的表達將顯著增加[77]。因此,巨噬細胞膜上受體與細菌相關分子模式間的相互作用,也可用于主動靶向細菌策略中。Wang等[78]報道了一種預處理后的巨噬細胞膜包覆的金納米籠,顯著增加了納米材料在細菌上的黏附和積累,延長了金納米籠在感染部位的滯留時間,最終提高了感染部位的光熱效率和殺菌效率。基于此,為降低納米顆粒被身體重新吸收而帶來的潛在毒性,Li等[20]將細菌處理后的巨噬細胞膜包覆在水凝膠材料上,該水凝膠材料由N-丙烯酰甘氨酰胺單體溶液與聚多巴胺包覆的金納米棒經一步聚合而成。制備的納米復合水凝膠不僅表現出高強度、高韌性,而且可以特異性捕獲細菌并在NIR(808 nm,2 W/cm2)激發下快速高效(5 min)地殺死細菌。進一步地,水凝膠在S. aureus感染的全層皮膚缺損模型中表現出優異的促愈合效果,具有作為傷口敷料的潛力。
2.7 pH響應性材料
利用細菌感染的微酸環境,一方面通過表面自適應性兩性粒子實現PTM的自由分布和聚集狀態轉換,另一方面也可通過殼聚糖及其衍生物材料等實現材料的表面正負電荷的轉換[13]。如圖4所示,涂層兩性離子膜的金納米粒子具有快速的pH響應性,酸性環境下(pH = 5.5)表面負電荷轉變為正電荷并形成聚集物。與在健康組織(pH = 7.4)中分散性狀態相比,這種微環境自適應的設計增強了金納米粒子對耐甲氧西林的S. aureus生物膜的光熱效應。皮膚膿腫感染模型證明,治療過程中周圍組織無明顯的溫度升高,而感染部位則快速升溫至55 ℃左右[17]。乙二醇殼聚糖(glycol chitosan,GCS)是一種pH依賴電荷的殼聚糖衍生物,具有良好的水溶性和生物相容性,通常以納米顆粒等形式用于生物醫學研究。Korupalli等[54]和Qian等[9]均利用酸性條件觸發的GCS靶向細菌作用分別合成了pH響應型的聚苯胺-殼聚糖納米粒子(polyaniline conjugated glycol chitosan,PANI-GCS)、殼聚糖-羧基化石墨烯納米膜(glycol chitosan conjugated carboxyl graphene,GCS-CG)。正常生理條件(pH = 7.4)下,材料表面顯示中性(PANI-GCS)或微弱的負電荷(GCS-CG),與鄰近宿主細胞親和力差,所以對健康組織光熱損傷小;當處于細菌感染的酸性膿腫環境(pH = 6.3)中,表面從負電荷轉變為正電荷,通過靜電作用與帶有負電荷的細菌細胞表面產生強烈的結合,導致細菌聚集。體外實驗中,細菌與材料的體外相互作用和抗菌結果證實了GCS功能化的PTM具有pH依賴性的細菌特異性相互作用,同時在NIR下顯示出明顯優于其他組的高效抗菌效果。具體表現為:PANI-GCS(808 nm)組細胞活性降低約98%,遠高于未照射組(活性降低約7%);GCS-CG(無光照)組殺菌效果僅為13%~15%,GCS-CG(808 nm)組殺菌率接近100%。體內細菌感染的鼠膿腫傷口愈合實驗結果表明,紅外照射后,感染傷口和正常組織溫度均迅速上升到50 ℃左右,隨后,正常組織表面溫度出現明顯下降,而感染傷口溫度繼續上升并最終維持在55 ℃左右。證實了納米材料對pH的響應性,以及它們在局部感染中表現出的特異性原位靶向和聚集細菌的潛力,從而減少對組織的損傷,加速傷口愈合。
 圖4
酸性微環境觸發對細菌生物膜的有效黏附并增強光熱消融效果
Figure4.
The effective adherence and enhanced photothermal ablation of bacteria biofilm triggered by acidic microenvironment
圖4
酸性微環境觸發對細菌生物膜的有效黏附并增強光熱消融效果
Figure4.
The effective adherence and enhanced photothermal ablation of bacteria biofilm triggered by acidic microenvironment
3 結論及展望
隨著各種PTM的開發,PTT在細菌感染的傷口治療中顯示出巨大的潛力。同時,為提高傷口感染部位抗菌效果,降低光熱對周圍健康組織的高溫損傷,靶向細菌策略也逐漸被應用于傷口的光熱治療中。但是,還有很多問題和挑戰需要解決:
(1)需要開發同時具有高光熱轉換效率和低生物毒性的PTM。目前有機納米材料如金、碳納米管、石墨烯、硫化銅、硫化鉬等都具有較高的光熱轉換效率,但它們對生物體的毒性損害還需要一定時間進行考察。無機納米材料具有良好的生物相容性,但光照下穩定性較弱,易發生光降解,不利于長期發揮光熱抗菌效果。
(2)靶向光熱抗菌機制和評價體系仍待完善。大量研究已證明利用靶向細菌策略可提高PTM與細菌的結合及在傷口感染部位的聚集,實現局部高溫抗菌,對健康組織損傷較小。但是各項研究參數不同,導致重復性低、臨床應用參考性差。
(3)PTM的構建忽略了傷口愈合階段是動態變化的。無論是否結合靶向細菌策略,PTM大多是直接注射或涂抹在傷口部位,部分以水凝膠等形式應用于傷口,而且大多數研究只重視了傷口抗菌消炎階段。雖然殺菌抑菌是感染傷口的治療重點,但傷口部位組織再生和重塑也影響了最終的傷口愈合效果。
針對以上問題,我們提出一些可能的解決方法:
(1)優化納米材料的制備方法,通過表面修飾等方法改性并構建納米復合材料平臺,獲得毒副作用更低、光熱效果更優、抗菌效果更好的PTM。
(2)建立系統的靶向光熱抗菌評價體系。基于抗菌評價方法和現有的細菌檢測技術,以PTM、靶向策略、靶向細菌目標等為分類依據,以殺菌率、感染部位溫度及其與周圍健康組織溫差等為評價標準,系統性評價靶向光熱抗菌的效果及優勢。
(3)協同其他抗菌治療方法。一方面,可以結合傳統抗生素協同抗菌,或利用光熱響應性在傷口處實現抗生素的按需釋放;另一方面也可以與光動力療法等相結合,構建一體化傷口治療平臺,輔助PTT,降低激光密度及局部光熱溫度,實現良好的協同抗菌效果。
(4)將靶向光熱抗菌療法與傳統敷料相結合,開發適用于傷口各個階段愈合的新型敷料。根據傷口類型及傷口愈合各階段的需求,通過不同功能的材料復合形成多功能性的傷口敷料,應用于傷口管理中,提高靶向光熱抗菌療法應用于傷口治療的可行性。例如,利用改性氧化石墨烯等作為光熱劑,結合水凝膠的吸水保濕性和紡織品的力學性能,制備同時具有良好吸水性能、力學性能、光熱抗菌性能的復合材料,旨在實現傷口敷料的多功能性,滿足傷口愈合要求。
雖然靶向光熱抗菌納米材料真正應用于傷口治療還需要大量的時間,但我們相信,隨著PTM研究的不斷深入和靶向細菌策略的不斷完善,靶向光熱療法將成為促進感染傷口愈合的一種有效治療手段。
重要聲明
利益沖突聲明:本文全體作者均聲明不存在利益沖突。
作者貢獻聲明:袁香楠為綜述主要撰寫人,完成相關文獻資料的收集和分析及論文初稿的寫作;譚紹潔參與文獻資料的分析、整理;高晶為論文的構思者及負責人,指導論文寫作;王璐為論文的主要審核人。