現有膽紅素定量檢測方法存在成本高、靈敏度低的問題。由于血清膽紅素水平與心血管疾病風險呈負相關,為實現對低水平膽紅素的測定,本文運用層層自組裝方法,將能發出藍色熒光和紅色熒光的金納米簇探針沉積于同一薄膜中,對兩種探針的熒光強度比值進行定量,構建比率型熒光傳感器。在此傳感器基礎上,根據膽紅素對薄膜傳感器發生的熒光猝滅效應,設計了一種便攜式的比率型血清膽紅素熒光檢測系統。系統硬件部分主要由主控芯片STM32F407、TSL237及TSL238T光頻傳感器組成。本系統通過三維打印設計了避光的檢測暗室,減少環境光干擾。實驗表明,所設計的比率型熒光檢測系統具有較強的抗干擾性、穩定性和準確性。該系統檢測膽紅素的線性相關度為0.987,具有良好的線性關系,在重復性實驗以及與標準儀器測試結果的對比中都具有較好的效果。本系統有望用于對低水平血清膽紅素的測定。
引用本文: 肖文香, 支冬燦. 比率型血清膽紅素熒光檢測系統的設計與實現. 生物醫學工程學雜志, 2022, 39(4): 784-791. doi: 10.7507/1001-5515.202107066 復制
版權信息: ?四川大學華西醫院華西期刊社《生物醫學工程學雜志》版權所有,未經授權不得轉載、改編
引言
近年來,隨著人口老齡化加劇,我國慢性病患者人數迅速增長,其中心血管疾病已經成為人類健康的一大威脅[1-2]。血清膽紅素作為人體內重要的抗氧化劑,其抗氧化功能對降低動脈粥脈硬化、降低冠心病發生概率具有重要意義[3-5]。膽紅素是人體內血紅素分解代謝后產生的最終物質。一些具有肝功能障礙及患有黃疸病的患者其體內的血清膽紅素水平過高,而心血管疾病患者,如小動脈硬化、高血壓和糖尿病并發癥患者,體內膽紅素水平的高低與疾病風險呈負相關[6-10]。目前,用于定量檢測膽紅素的主要方法有色譜法、經皮法、酶法等[11-13],以上方法在對膽紅素進行檢測時,存在操作復雜、檢測時間長、成本高等缺點。
本文所設計的比率型血清膽紅素檢測系統,將分別能發射藍色熒光(B-AuNCs)及紅色熒光(R-AuNCs)的金納米簇,通過層層自組裝(layer-by-layer self-assembly,LBL)技術沉積于同一薄膜,得到比率型的熒光薄膜傳感器,比率型熒光探針具有自參比特性,可有效避免來自環境的干擾,提高檢測精度[14]。
1 檢測方法建立及系統總體設計
1.1 檢測原理
膽紅素在紫外-可見光范圍不具有熒光特性,因此采用能發射藍色/紅色熒光的金納米簇作為熒光探針測定膽紅素。以牛血清白蛋白(bovine serum albumin,BSA)為模板在生理條件下制備金納米簇,BSA能起到還原劑和穩定劑的作用,可形成穩定的金納米簇。BSA與游離膽紅素形成復合物,當BSA保護的金納米簇與膽紅素溶液發生作用時,形成非熒光的基態復合物,使得金納米簇發生熒光猝滅現象[15-18],且熒光猝滅程度與所加入被測樣本中膽紅素濃度存在線性關系。
1.2 藍/紅熒光金納米簇溶液的制備及其熒光光譜
本文通過水熱法制備分別能發射藍色及紅色熒光的金納米簇溶液(BSA-AuNCs)。制備方法如下:① B-AuNCs溶液的制備:取5 mL氯金酸溶液(10 mmol/L)與5 mL BSA溶液(50 mg/mL)混合,加入10 μL的組氨酸溶液(100 mmol/L),使用10 mmol/L的NaOH溶液將混合液的pH值調至5.5,將溶液置于37 ℃水浴加熱6 h,得到B-AuNCs。將B-AuNCs溶液在蒸餾水中進行2天透析,透析后的溶液冷凍干燥,4 ℃保存備用。② R-AuNCs溶液的制備:取5 mL的HAuCl4水溶液(10 mmol/L,37 ℃),在劇烈攪拌條件下加入到5 mL BSA溶液(50 mg/mL,37 ℃)中,繼續攪拌2 min,加入NaOH溶液(1 mol/L)將pH值調至12~13,溫育12 h,可見溶液由淡黃色變成棕色,得到R-AuNCs。之后采用鋅離子共沉淀法對R-AuNCs進行純化,純化后的溶液進行冷凍干燥,4 ℃保存備用。
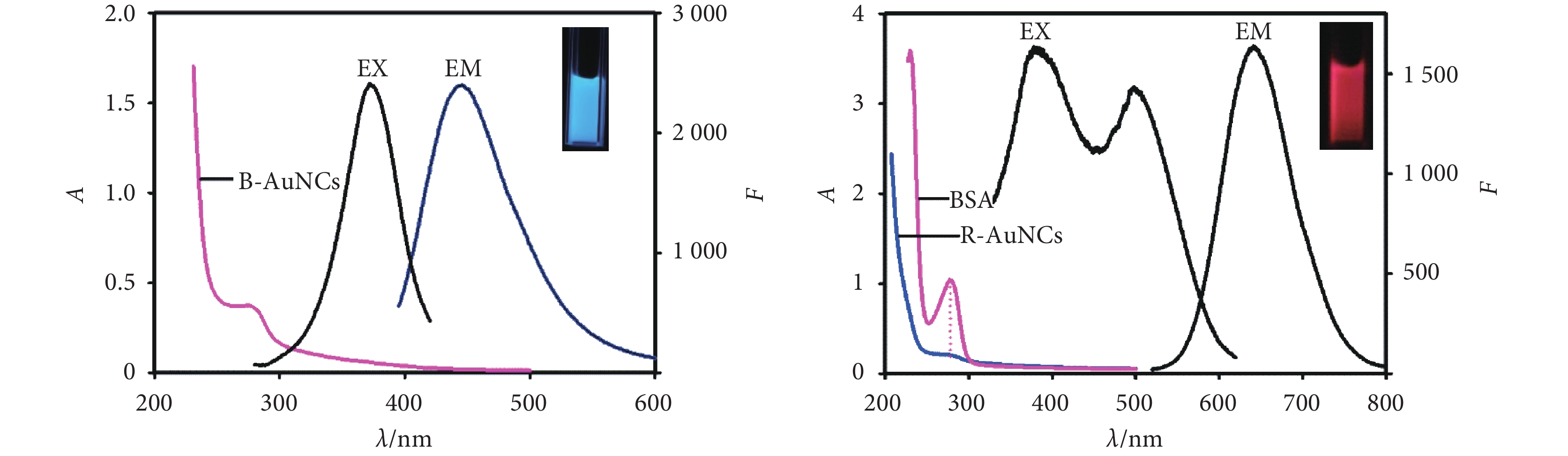
圖1為日立F-4600熒光分光光度計(日本)測得的藍/紅金納米簇溶液的激發光譜和發射光譜。由圖可知藍光金納米簇在激發光源波長為365 nm產生激發峰,最大發射峰位于443 nm處;紅光金納米簇在激發光源波長為365 nm和501 nm處產生激發峰,最大發射峰位于623 nm處。
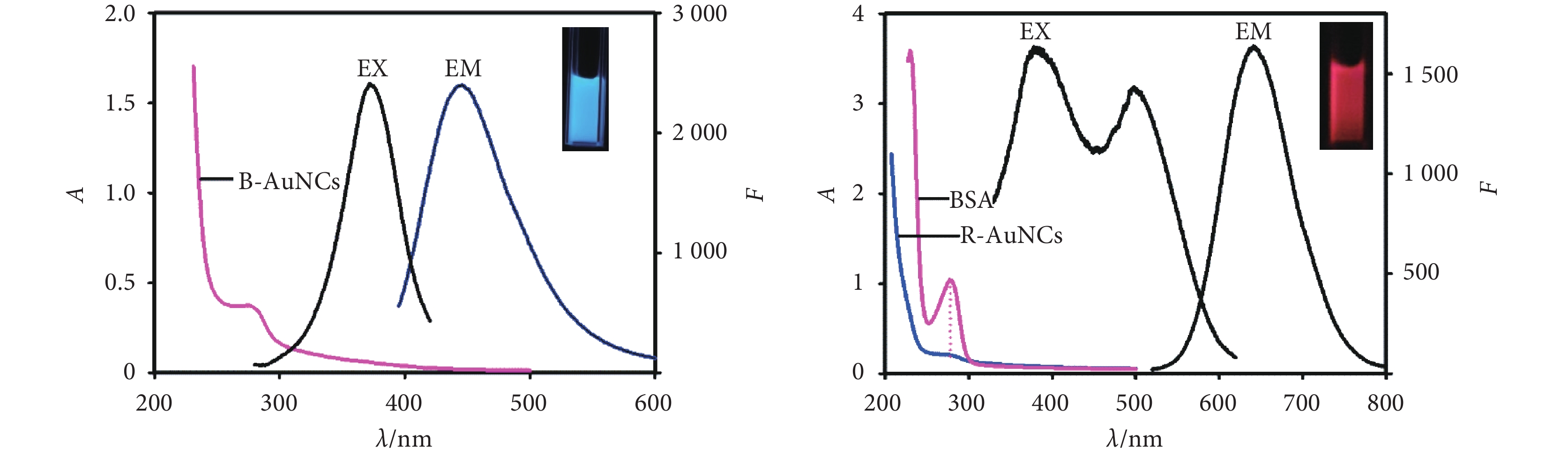 圖1
藍色熒光(左)和紅色熒光(右)金納米簇溶液的熒光光譜和吸收光譜
Figure1.
Fluorescence and absorbance spectra of blue (left)/ red (right)-emitting gold nanoclusters
圖1
藍色熒光(左)和紅色熒光(右)金納米簇溶液的熒光光譜和吸收光譜
Figure1.
Fluorescence and absorbance spectra of blue (left)/ red (right)-emitting gold nanoclusters
1.3 薄膜傳感器的制備與其熒光性能
熒光探針在均相溶液中進行測定時受外界干擾較大且具有耗費試劑、增加實驗成本、無法重復利用等缺點[19],因而采用LBL技術,將藍/紅兩種金納米簇溶液偶聯后的交聯物進行組裝,得到具有雙發射峰的熒光薄膜傳感器。層層靜電自組裝技術是一種比較有效的有序組裝納米分子材料的方法,可以制備均勻、多層復合膜,并且操作簡單。利用這種方法可以將不同的分子有序地組合到薄膜上,通過調控薄膜的厚度和結構,能夠實現薄膜光、電、非線性光學等特性的功能化[20-21]。
本文制備的BSA-AuNCs表面帶負電荷,聚烯丙胺鹽酸鹽(polyallylamine hydrochloride,PAH)帶正電荷,利用靜電作用將藍色及紅色熒光金納米簇逐層組裝到石英基片上,得到LBL熒光薄膜。薄膜制備的主要流程如下。分別取R-AuNCs、B-AuNCs固體溶解于磷酸鹽(phosphate buffer saline,PBS)緩沖液(pH = 7.4,50 mmol/L)中,獲得20 mg/mL的溶液。在2 mL R-AuNCs溶液中加入碳二亞胺(EDC,2 mg)與N-羥基琥珀酰亞胺(NHS,3 mg)固體用來提高偶聯效率,在37 ℃水浴加熱15 min后加入2 mL B-AuNCs溶液(20 mg/mL),37 ℃水浴加熱12 h,得到藍/紅熒光金納米簇交聯物溶液(20 mg/mL)。將處理好的石英基片置于PAH溶液(2 mg/mL)中浸泡10 min,這時基片表面帶正電,之后將石英基片浸泡在藍/紅熒光金納米簇交聯物溶液10 min,帶負電的交聯物沉積于基片上。重復上述步驟n次便得到了n層的雙發射比率型熒光探針薄膜。
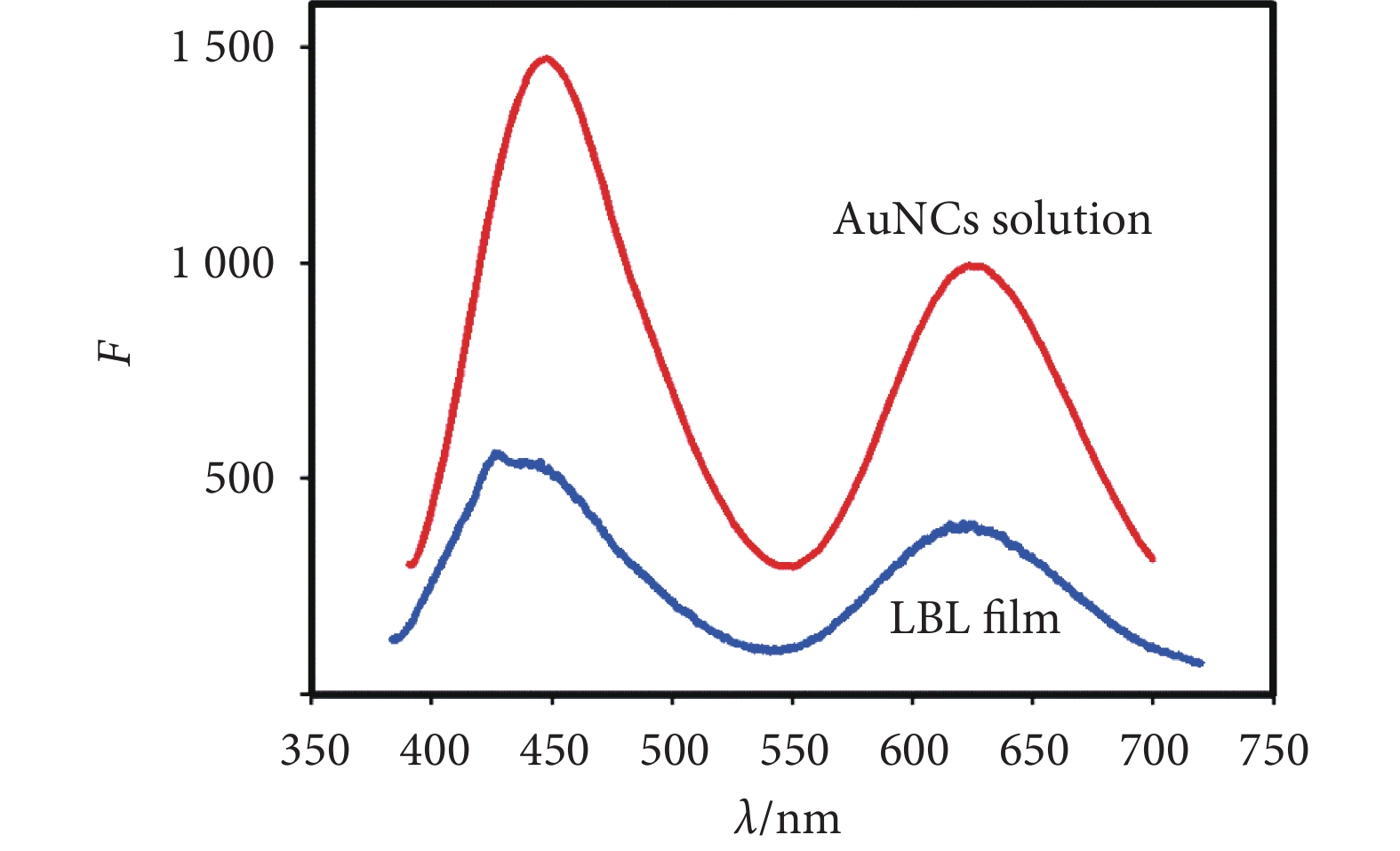
由圖2可知,在激發光源為365 nm時,交聯物溶液(20 mg/mL)在443 nm處與623 nm處存在熒光發射峰,因此交聯過程并未改變兩者的熒光性質。在石英基片上組裝14層交聯物后,薄膜具有較強的熒光,其熒光發射峰位于443 nm和623 nm,與溶液的熒光一致。
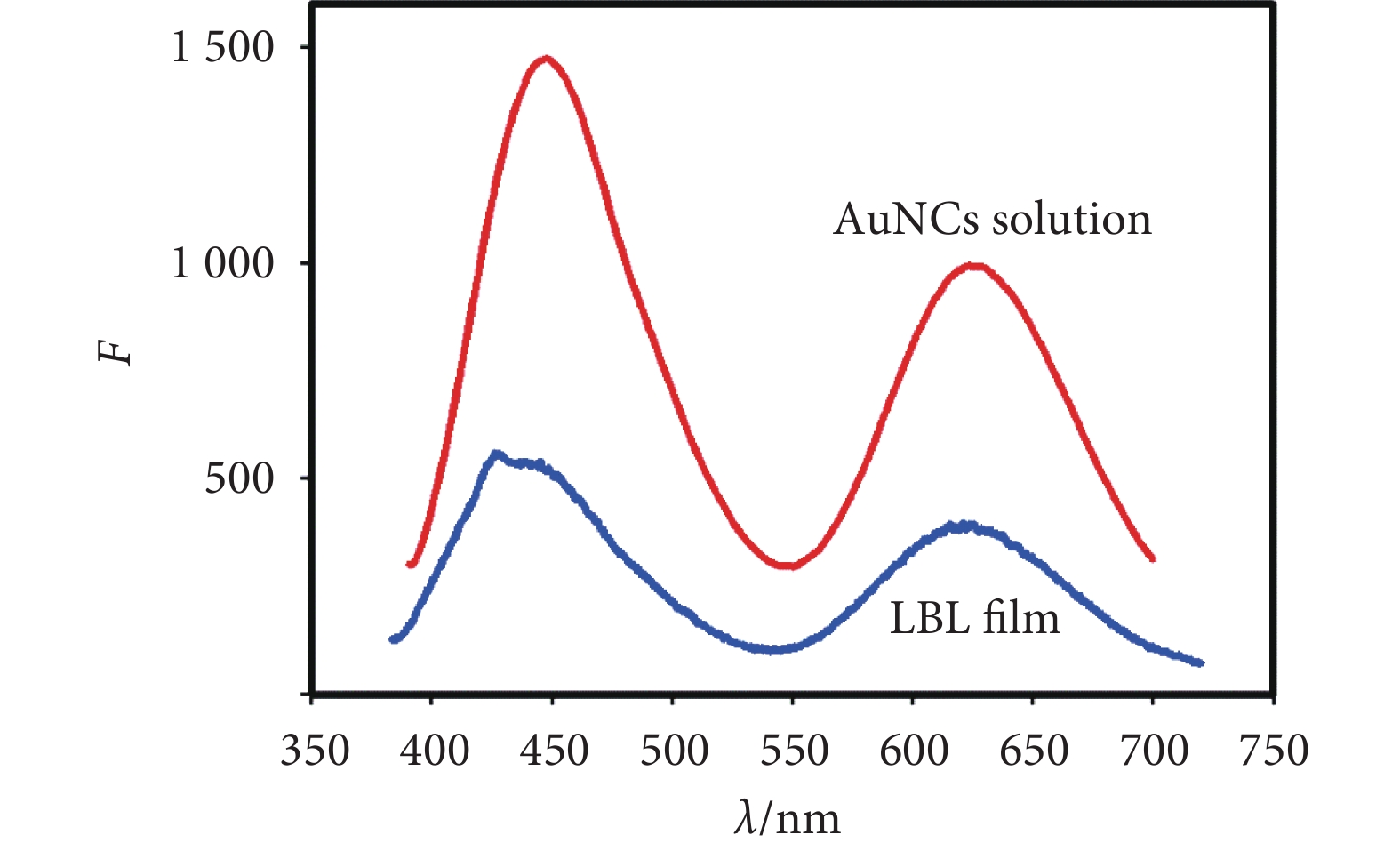 圖2
溶液與薄膜熒光性質對比
Figure2.
Comparison of fluorescence properties between solution and film
圖2
溶液與薄膜熒光性質對比
Figure2.
Comparison of fluorescence properties between solution and film
1.4 比率型熒光檢測方法的建立
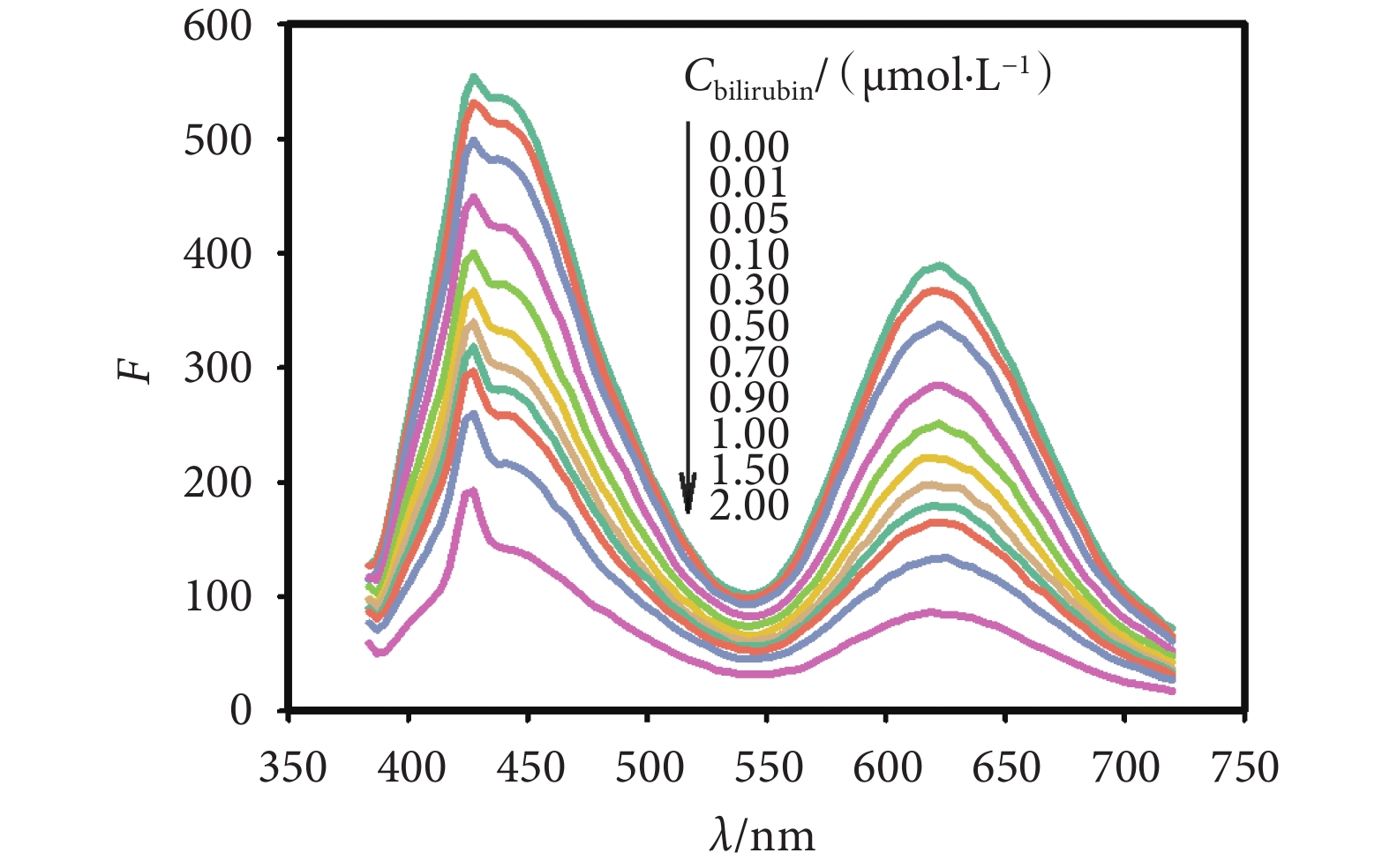
本文通過前期實驗確定,當金納米簇溶液鋪膜濃度為20 mg/mL、層數為14時,薄膜傳感器的熒光性能最優,且對膽紅素的最佳檢測時間為120 s。采用365 nm的激發光源對其進行激發,在薄膜上滴加一定濃度梯度的膽紅素標準液后,采用熒光分光光度計檢測薄膜的熒光光譜,熒光探針發射峰熒光強度的變化情況如圖3所示。隨著膽紅素濃度增加,兩個峰熒光強度下降的程度越發明顯,且峰值之間的比值與膽紅素標準液濃度存在線性關系。因此,建立了一種雙發射型的比率薄膜傳感器,通過同時檢測波長1(443 nm)與波長2(623 nm)處的熒光強度F1、F2,將檢測結果做比例運算(F1/F2),達到對血清膽紅素濃度進行測定的目的。
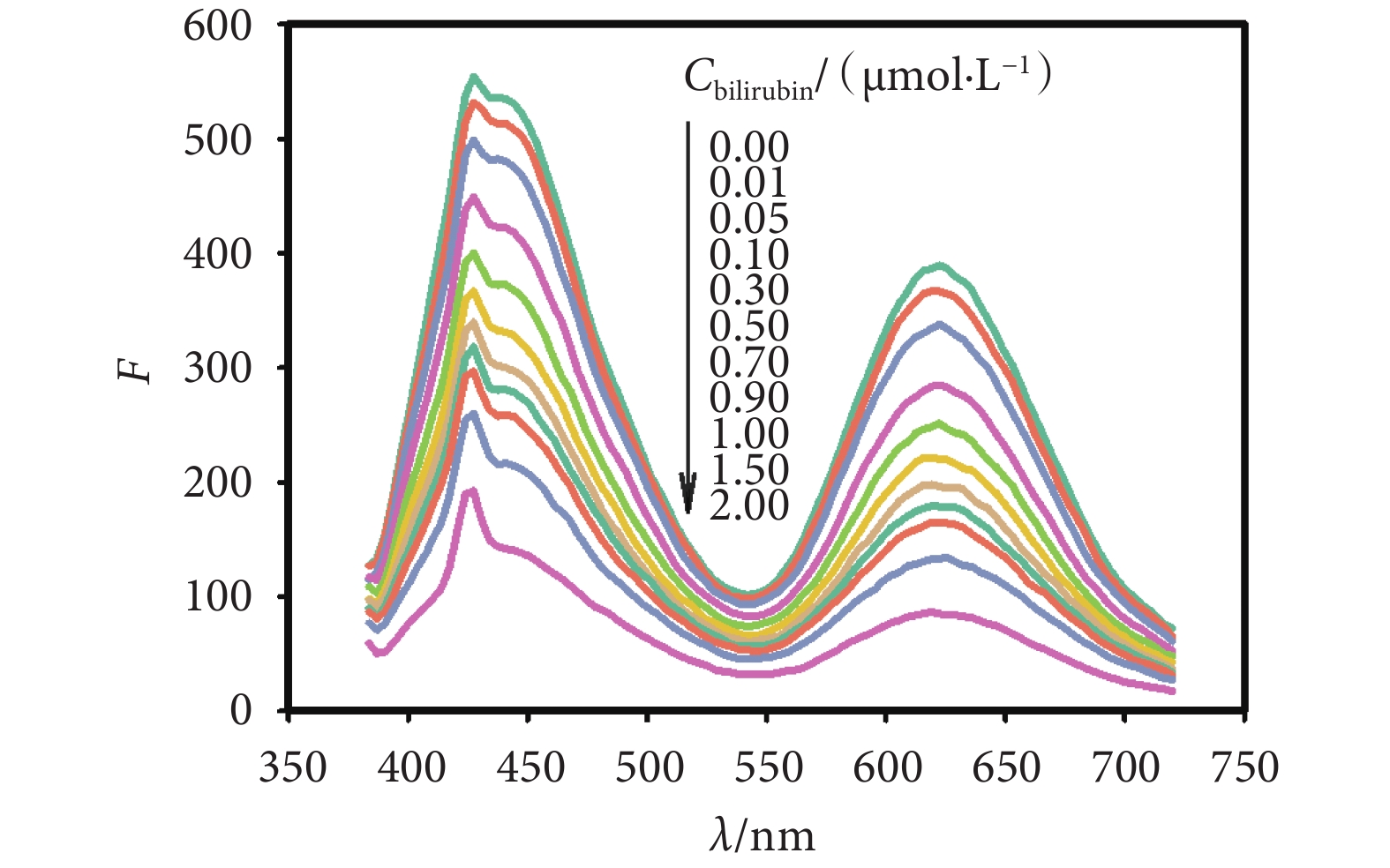 圖3
加入膽紅素標準液后薄膜熒光光強變化情況
Figure3.
Fluorescence quenching of the film by adding bilirubin standard solution
圖3
加入膽紅素標準液后薄膜熒光光強變化情況
Figure3.
Fluorescence quenching of the film by adding bilirubin standard solution
為了確定比率熒光膜傳感器的性能,我們進行了紅色熒光金納米簇單一探針及薄膜對膽紅素響應的對比實驗。在水溶液中采用單一的熒光探針測定膽紅素,其熒光猝滅程度與膽紅素濃度的Stern-Volmer線性擬合方程為:F0/F?1=0.097 1C?1.012,F0為滴加膽紅素前熒光峰強度,F為滴加膽紅素后的熒光峰強度,C為膽紅素標準液濃度(單位為μmol/L),膽紅素濃度線性范圍為11.19~23.14 μmol/L。本文中的比率型熒光薄膜對膽紅素測定的線性方程為F1/F2=0.35C+1.46,C為膽紅素標準液濃度(單位為μmol/L),膽紅素濃度線性范圍為0.01~2.00 μmol/L。從二者標準曲線的斜率及線性范圍可知,比率型金納米簇熒光膜的靈敏度更高,適用于低濃度水平血清膽紅素的測定。
2 檢測系統總體設計
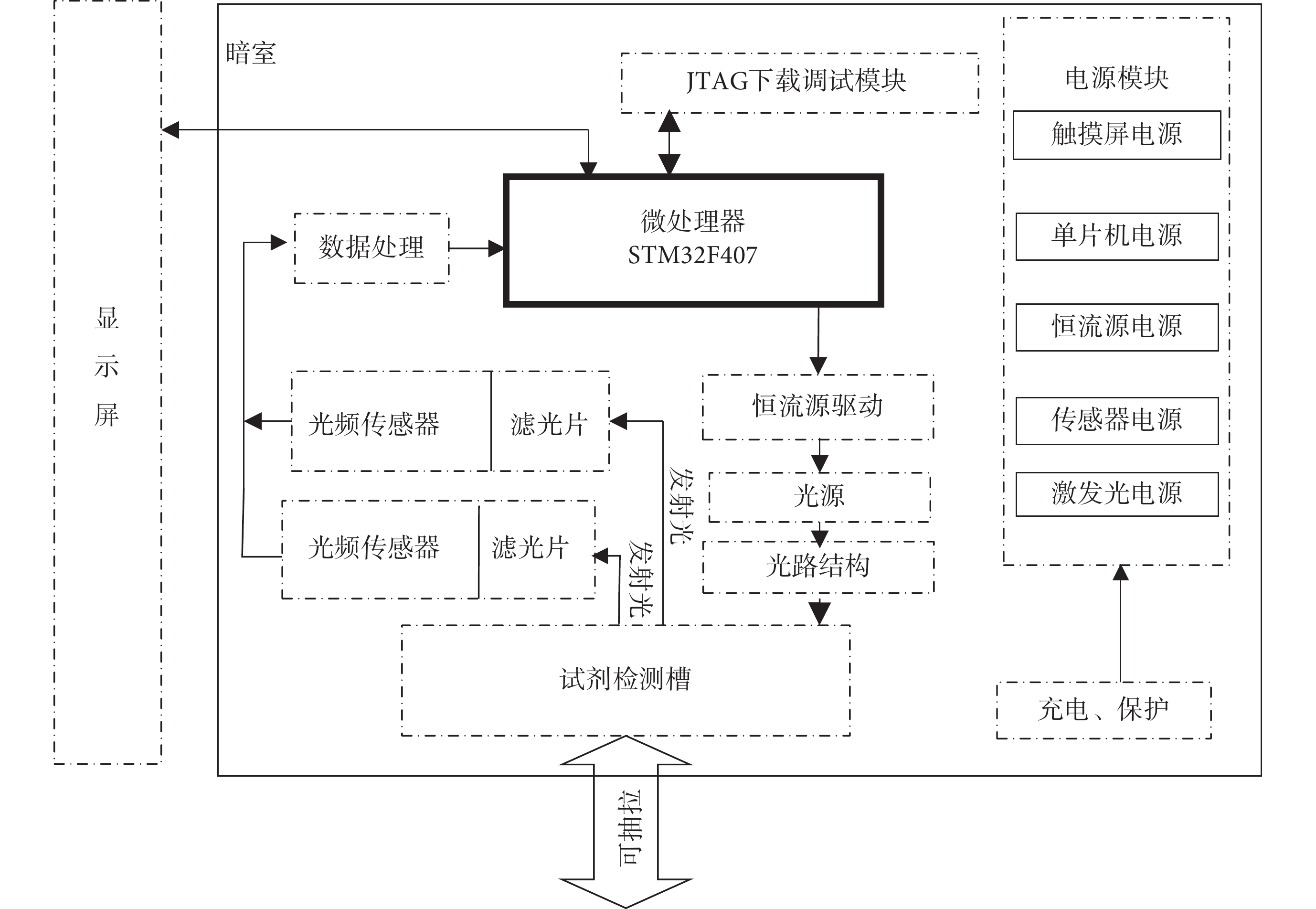
基于上述檢測原理,設計了一種便攜式比率型血清膽紅素熒光檢測系統,該系統總體框圖如圖4所示。系統主要由微處理器、程序下載模塊、電源模塊、恒流源模塊、光頻轉換模塊、顯示屏模塊、暗室等組成。微處理模塊的功能是控制其他外設電路工作,并且對采集的數據進行分析;程序下載模塊的功能為下載程序以及初期階段代碼調試,確保軟件正常運行;電源模塊的功能主要是為本系統中其他模塊提供電壓輸入,并且配置了充電保護,使得系統可長時間使用;恒流源模塊是用來為激發光源提供穩定的電流輸入,確保激發光源工作穩定;光頻傳感器模塊用來檢測LBL薄膜在加入膽紅素前后的熒光強度值;顯示屏模塊將所滴加膽紅素的濃度進行顯示。為了避免環境光的干擾,除顯示屏外,其余模塊均置于三維打印制作的暗盒中。
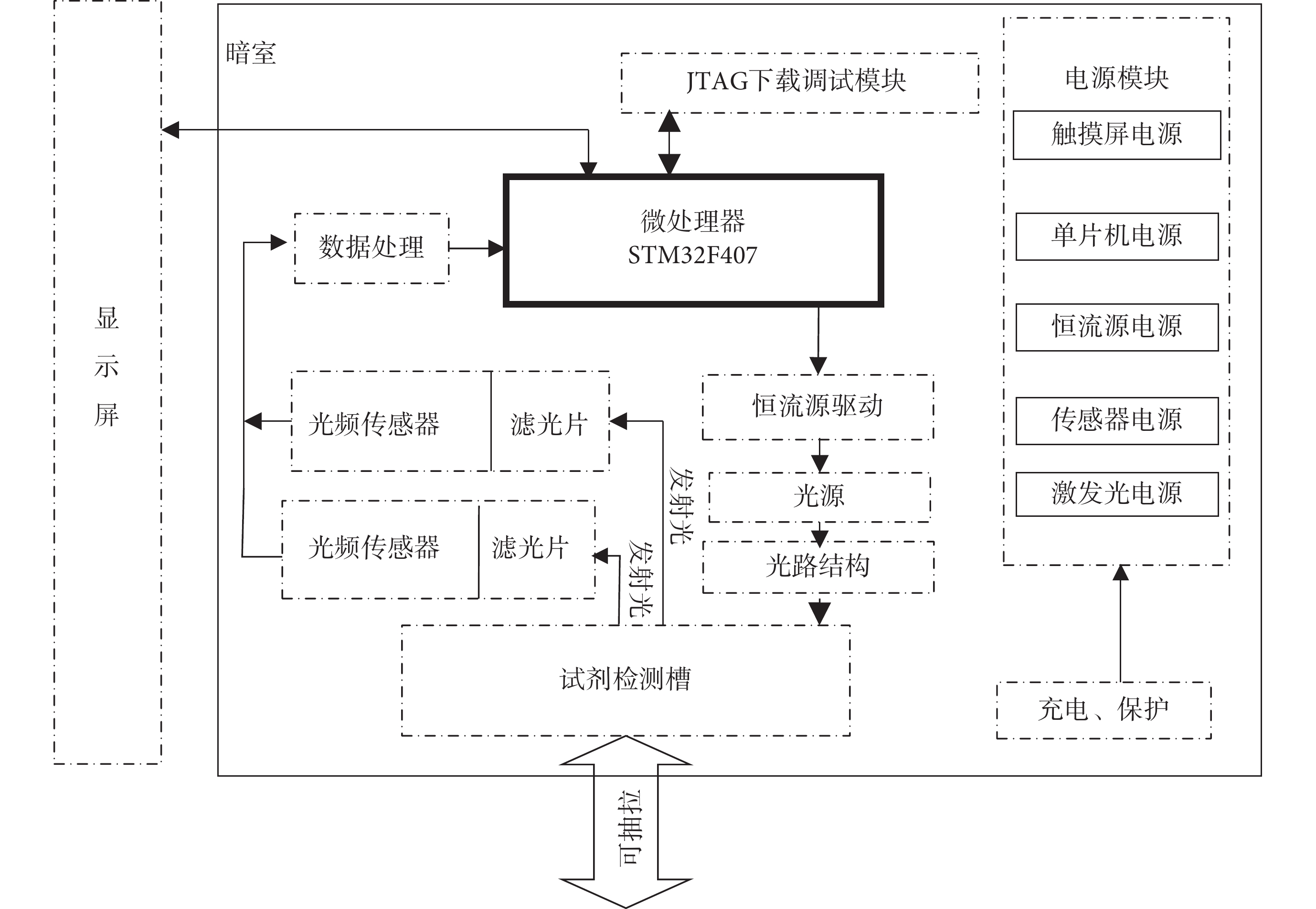 圖4
便攜式比率型血清膽紅素熒光檢測系統總體框架圖
Figure4.
Overall framework of the ratiometric fluorescence detection system for serum bilirubin
圖4
便攜式比率型血清膽紅素熒光檢測系統總體框架圖
Figure4.
Overall framework of the ratiometric fluorescence detection system for serum bilirubin
系統啟動后,STM32驅動恒流源芯片對激發光源進行調控確保其穩定工作,激發光經過光路結構后,照射到可抽拉的檢測槽上,對放置好的LBL薄膜進行激發。由于金納米簇具有熒光特性,因此LBL膜受到特定的激發光照射后,會產生一定強度的熒光發射。通過濾光片將其他波段的雜光濾除,只允許波長為兩個發射熒光峰(F1、F2)的熒光信號通過,之后分別經過位于濾光片后的聚光鏡匯聚到光頻傳感器光窗,被光頻傳感器轉換成脈沖電信號,最終返回到主控芯片進行數據分析與處理,液晶顯示屏對分析后的數據進行顯示。為了防止外界環境對檢測結果的干擾,整個實驗過程在室溫(20~25℃)條件下的暗室中進行。
3 系統硬件實現
3.1 微處理器模塊
本系統采用STM32F407ZGT6作為主控芯片,其在低功耗模式下電流僅為1.7 μA,功耗較少。STM32F407ZGT6是CortexTM-M4為內核的STM32F4系列高性能微控制器,支持浮點型運算,在數據處理方面十分出色[22]。
3.2 電源模塊
本系統中采用鋰電池供電,電池最大輸出電壓為3.7 V,輸入電壓為4.5 V。為了達到長期使用的目的,為鋰電池設計了充電電路。使用功率計對系統功耗進行測定,靜息態時實際功耗為0.81 W。
3.3 激發光源模塊
本系統中,當激發光源的波長為365 nm時,測定443、623 nm兩個波長處LBL薄膜的熒光強度,應該采用紫外光源作為激發光源。在熒光檢測中常用的紫外光源有氙燈、激光、鎢燈和LED光源等[23]。本實驗選用LED作為激發光源,LED具有成本低、光源穩定、散熱量小的優點。根據LBL薄膜的最佳激發波長,系統選用的LED為鴻光電子公司生產,其峰值波長為 365 nm,帶寬10 nm,功率為0.5 W,通過恒流源芯片AMC7150驅動可滿足實驗的需要。
3.4 光頻轉換模塊
系統中采用雙通道比率檢測方法,因此需要兩個光頻傳感器來采集熒光信號。由于光電二極管靈敏度高、響應快并且擁有良好的線性測量范圍,在弱光檢測中被廣泛使用[24-25]。本系統選擇內部集成了光電二極管和電流頻率轉換器的光頻傳感器TSL237和TSL238T作為熒光光強檢測器。
在光頻傳感器前需放置濾光片用來濾除雜光的干擾,其主要功能是允許特定波段的光通過[26],本次實驗中使用的濾光片為億照公司生產的截止深度為OD5的帶通濾光片,中心波長分別為620 nm和440 nm,帶寬為20 nm。
經過濾光片濾除雜光干擾后,特定波段的熒光信號分別照射到TSL237、TSL238T的光窗上。TSL237內部COMS集成電路上集成了光電二極管和電流頻率轉換器,光信號經過轉換后輸出占空比為50%的方波信號,且輸出頻率與照射到傳感器內的光電二極管的光照強度成正比,數字輸出允許直接與微控制器或其他邏輯接口相連接。器件經過溫度補償,適用于320 ~ 700 nm的紫外-可見光范圍,并可對320 ~ 1050 nm范圍內的光強作出響應,在波長524 nm處具有最強輻照響應度,故用于443 nm熒光的檢測。TSL238T內部與TSL237類似,不同的是,TSL238T輸出使能(output enable,OE)為低電平時芯片工作,OE輸入線便于同一個總線在掛接多個設備時操作;TSL238T在波長640 nm處具有最強輻照響應度,故用于623 nm熒光的檢測。
3.5 顯示屏模塊
顯示屏的主要作用是用來顯示檢測物質濃度及系統的其他一些信息。本系統采用的為2.8寸的電阻型觸摸屏,其內部驅動芯片為ILI9341。電阻屏具有觸摸靈敏度高、視角廣、反應速度快等優點,并且支持眾多的芯片,本文通過FSMC總線對屏幕進行驅動[27]。
3.6 檢測光路及檢測暗室模塊
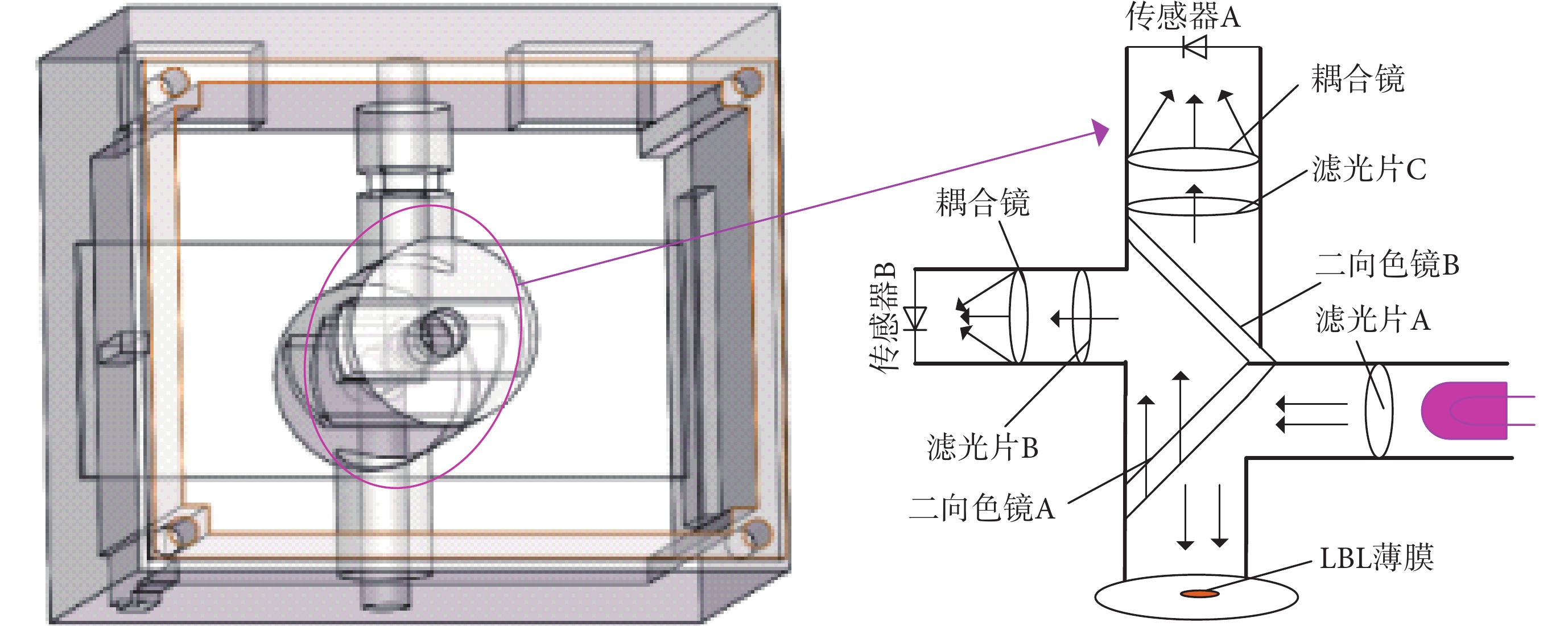
光路的結構決定了發射光和激發光在系統內部的傳遞方向,本系統采用傳統的熒光激發光路,該光路結構在一定程度上可減少激發光源的干擾,且對熒光信號的收集具有良好的效果[28-30]。圖5為本系統的光路結構及整個系統示意圖,主要光路工作原理為:在檢測區域放置LBL薄膜,激發光源經過濾光片A后,通過二向色鏡A反射到檢測池中對薄膜進行激發,所產生的熒光透射過二向色鏡A,在經過二向色鏡B時,443 nm附近波段的光折射到濾光片B后,被耦合鏡收集在傳感器B的光窗上,623 nm波長附近的光透射到濾光片C后,被耦合鏡收集在傳感器A的光窗上。傳感器將光信號轉換為電信號輸出,并將數據傳入系統主控芯片進行數據分析。
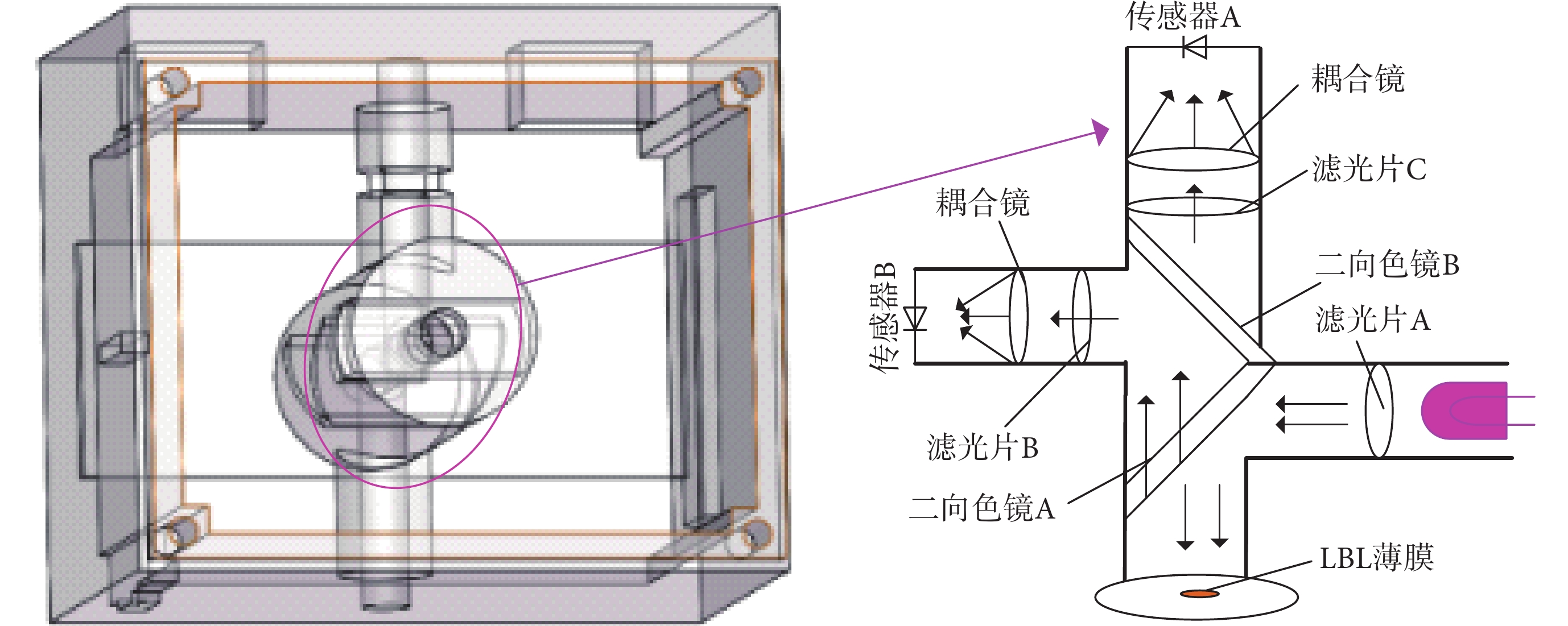 圖5
系統結構示意圖
Figure5.
System structure diagram
圖5
系統結構示意圖
Figure5.
System structure diagram
本系統中的暗室模塊主要是用來將檢測光路、檢測槽及其他硬件模塊嵌入其中,建立一個避光的檢測環境,減少環境光的干擾。
4 系統軟件實現
系統下位機軟件設計是基于ST公司提供的官方固件庫開發,使用Keil 5集成開發平臺,在系統工作及模塊驅動方面采用C語言編寫,實現了光源控制、信號采集、信號預處理等功能。系統的上位機軟件開發是基于開源的littleVGL官方庫開發,使用Code Blocks平臺,最后將開發好的圖形用戶界面(graphical user interface,GUI)移植到微處理器中。
5 實驗結果分析
5.1 系統重復性測試
使用PBS溶液(pH = 7.0)配置不同濃度梯度的血清膽紅素標準液,打開系統中的激發光源等待光源穩定(10 s)。在光源穩定后取出檢測槽,將LBL薄膜放入檢測槽中,之后將檢測槽緩緩推入暗室,在顯示界面可看到F1與F2的值,待數值穩定后將檢測槽拉出,使用移液槍吸取50 μL濃度為0.4 μmol/L的膽紅素標準液滴加在LBL薄膜上,使用濾紙將多余的溶液吸干,之后將檢測槽推入暗室反應120 s,上述流程重復五次。在對系統進行重復性實驗時通常都采用相對標準偏差(relative standard deviation,RSD)作為評價系統重復性的指標,其定義為標準差(standard deviation,SD)與平均值(Mean)之比。
 |
 |
實驗結果如表1所示。由表1可知,在加入膽紅素后,由于熒光猝滅作用,F1、F2的值均發生下降,且五次重復實驗測試結果所得到的F1/F2值一致性較好,RSD值為1.8%,由此可知本系統具有良好的重復性。
5.2 系統穩定性測試
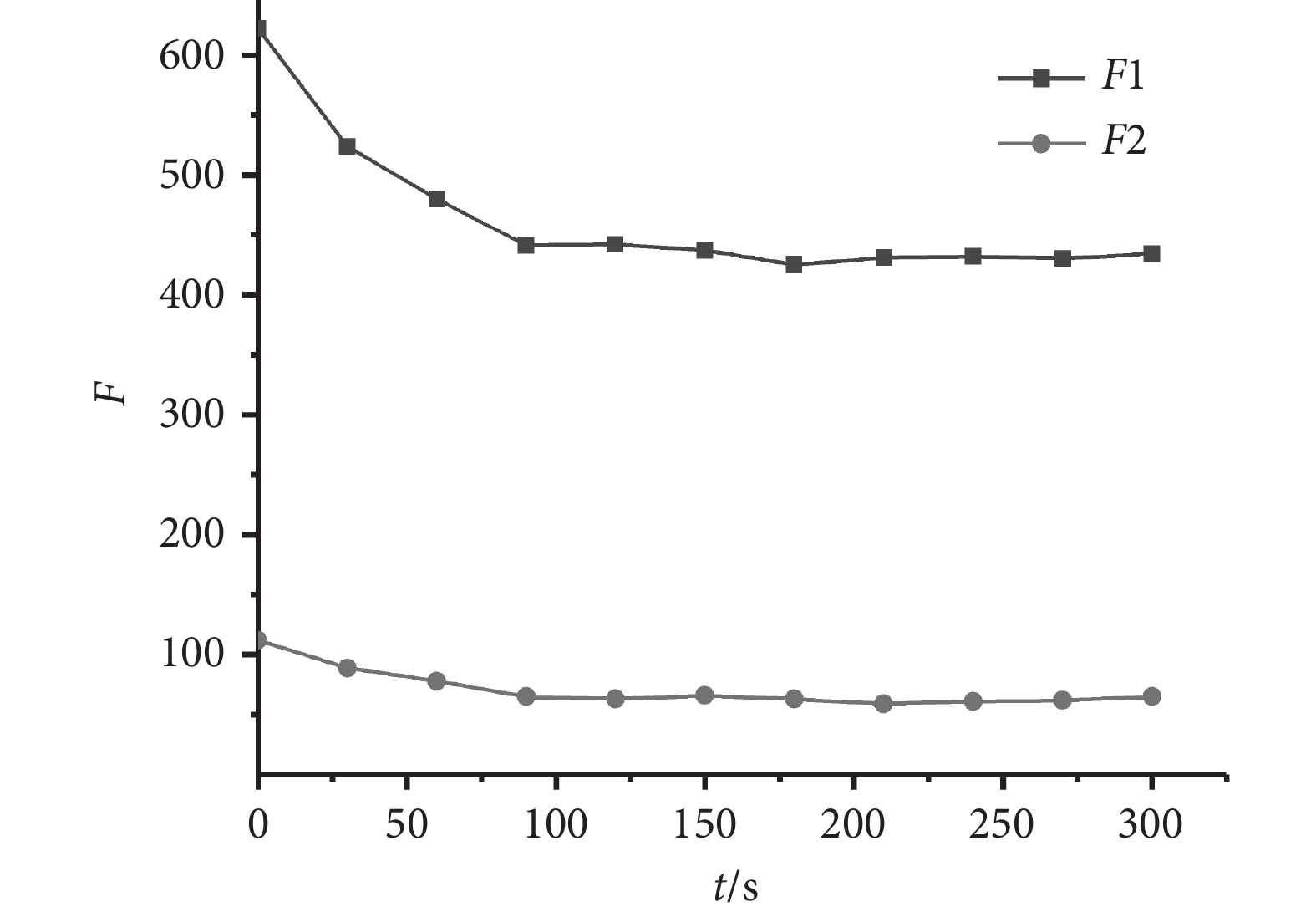
為了對系統的穩定性進行測試,在最佳的實驗條件下,本文以濃度為0.6 μmol/L的膽紅素標準液作為實驗對象,持續5 min對系統所檢測的熒光光強數據進行記錄,結果如圖6所示。隨著反應時間的增加,F1和F2的熒光強度均下降,在0~90 s范圍內,熒光強度下降較為明顯,90 s之后熒光值基本達到平衡。該平衡時間反映了LBL膜中BSA保護的金納米簇對膽紅素的分子識別過程,由于BSA與膽紅素結合成非熒光性的復合物,削弱了BSA與金納米簇之間的結合作用,導致LBL膜的熒光強度下降。BSA與膽紅素之間的結合作用是一個動態的平衡過程,到達平衡之前,隨著膽紅素的結合量增加,熒光下降明顯,當膽紅素分子完全被結合之后,熒光強度不再變化,達到穩定值。從系統穩定性測試結果可知,該系統能實時反映分子識別過程,其平衡時間為90 s,且信號穩定時間在3 min以上,穩定時間滿足檢測需要。
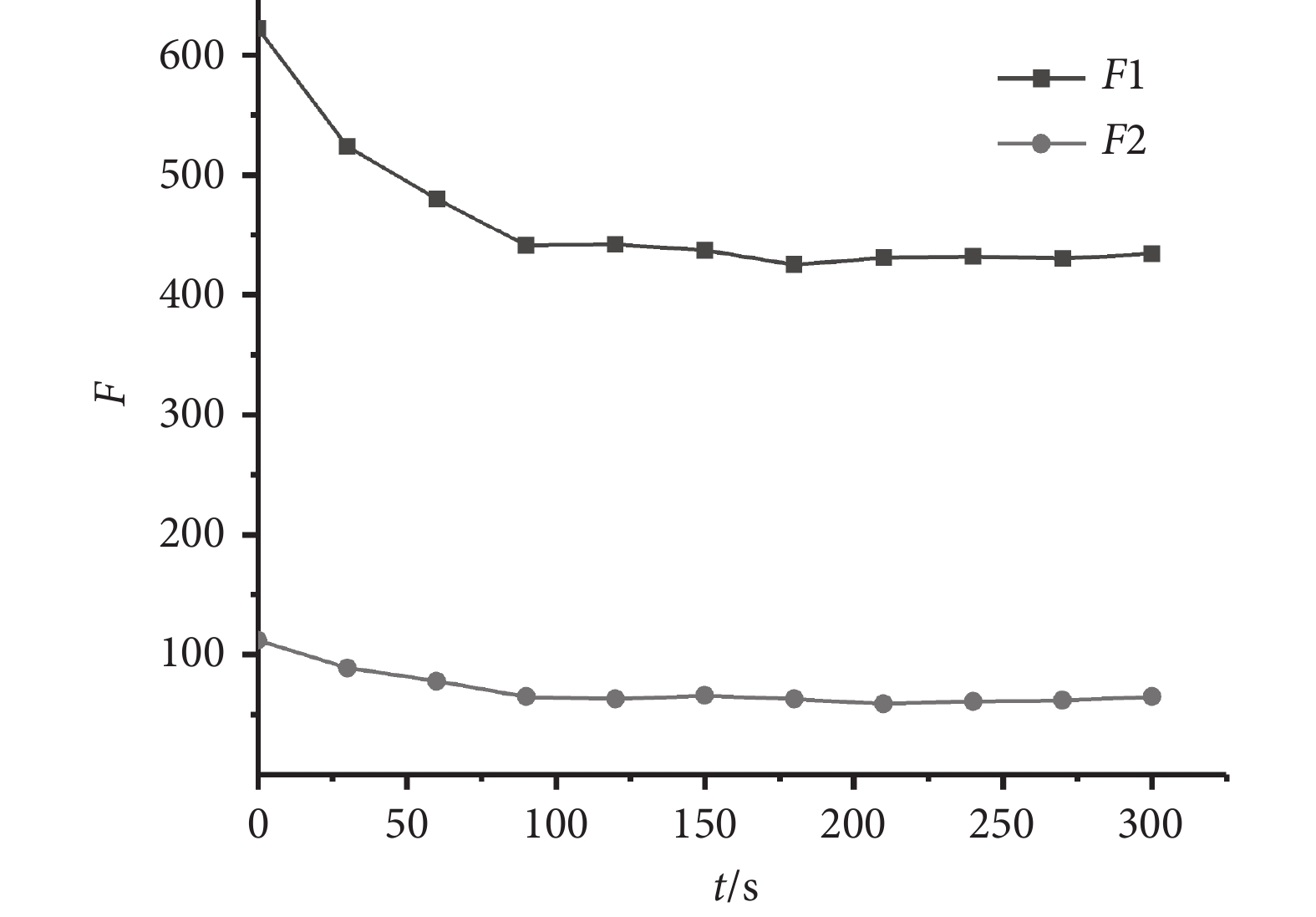 圖6
系統穩定性測試
Figure6.
System stability test
圖6
系統穩定性測試
Figure6.
System stability test
5.3 系統標準工作曲線及驗證
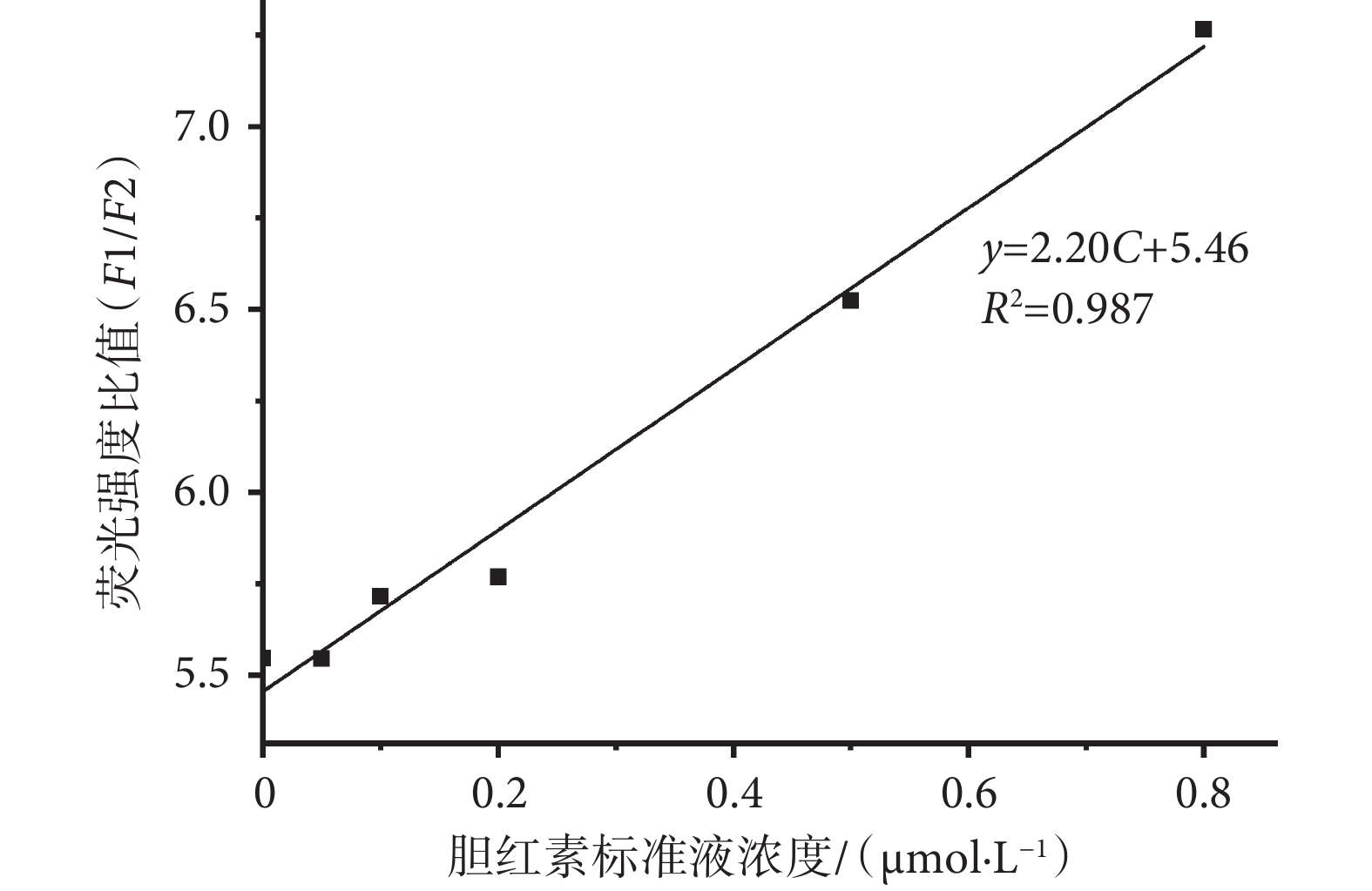
根據上述實驗方法流程,取五組不同濃度的標準液(0.05、0.10、0.20、0.50、0.80 μmol/L)進行平行實驗,將得到的多組實驗數據去除粗大誤差后,取平均值作為每組濃度的實驗結果。使用該檢測結果與濃度進行標準工作曲線的繪制,如圖7所示,標準工作曲線方程為y = 2.20C + 5.46,其中y為熒光強度比值,C為膽紅素標準液濃度(單位為μmol/L),兩者相關系數R2 = 0.987,說明該系統檢測到的LBL薄膜的雙熒光峰強度比值與膽紅素濃度具有較好的相關性。
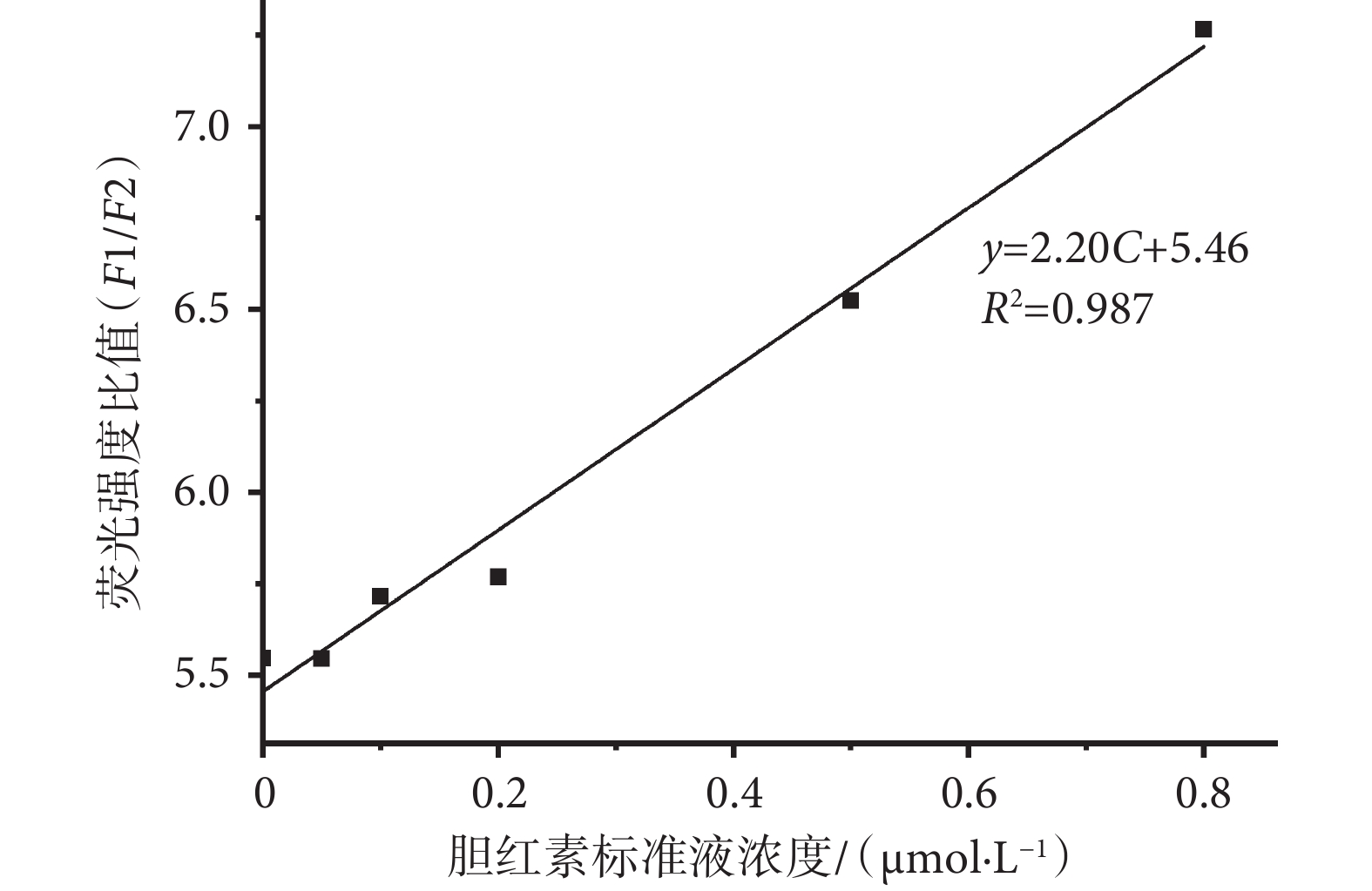 圖7
系統標準曲線
Figure7.
System standard curve
圖7
系統標準曲線
Figure7.
System standard curve
取驗證標準工作曲線之外的4種膽紅素標準液濃度(0.08、0.15、0.30、0.40 μmol/L)作為驗證集,將這4種濃度的溶液按照上述實驗方法進行10次平行實驗,將檢測結果通過標準工作曲線換算成系統所測濃度C,上述濃度實測RSD值依次為9.0%、7.3%、3.1%、2.5%。雖然存在一定誤差,但是由于薄膜制備上的差異及系統電路上存在的噪聲影響,總體來說,此實驗數據可表明該系統具有較高的準確性。
5.4 測量結果與標準儀器對比
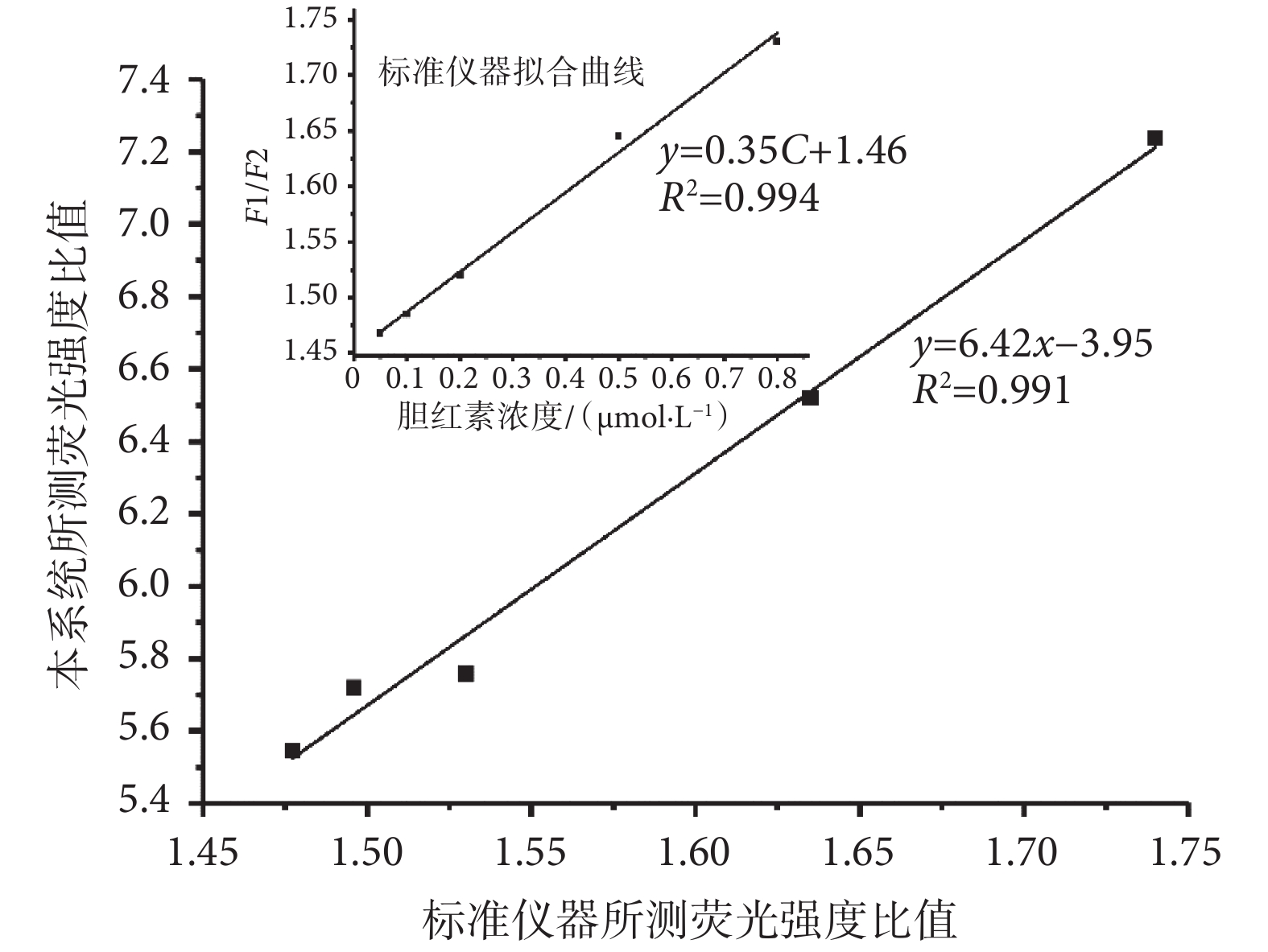
將日立F-4600熒光分光光度計作為商品化標準儀器進行對比。使用標準儀器對膽紅素標準液的檢測流程與本系統類似,首先使用五個樣本進行五次平行實驗,去除誤差后,繪制出標準儀器的工作曲線如圖8所示,標準儀器對膽紅素檢測的標準曲線為y = 0.35C + 1.46,其中y為熒光強度比值,C為血清膽紅素標準液濃度(單位為μmol/L),兩者相關系數R2 = 0.994,由此可知標準儀器在對膽紅素進行檢測時,具有較高的可信度。之后將本系統與標準儀器在相同濃度下所檢測的熒光強度比值進行分析,由圖8可知二者擬合曲線為y = 6.42x ? 3.59,其中x為標準儀器檢測值,y為本系統檢測值,兩者相關系數R2 = 0.991。本系統的最低檢測限度為0.02 μmol/L,比標準儀器的檢測限略高,主要是由于本系統中激發光源的發光強度有限,且儀器內部硬件性能差異,也使得兩者所檢測的熒光強度比值存在一定差別,但二者具有較強的相關性,并不影響本系統的正常使用。以上結果表明,盡管本檢測儀器與標準儀器相比還存在一定差異,但本系統對低水平膽紅素濃度的檢測具有可行性。
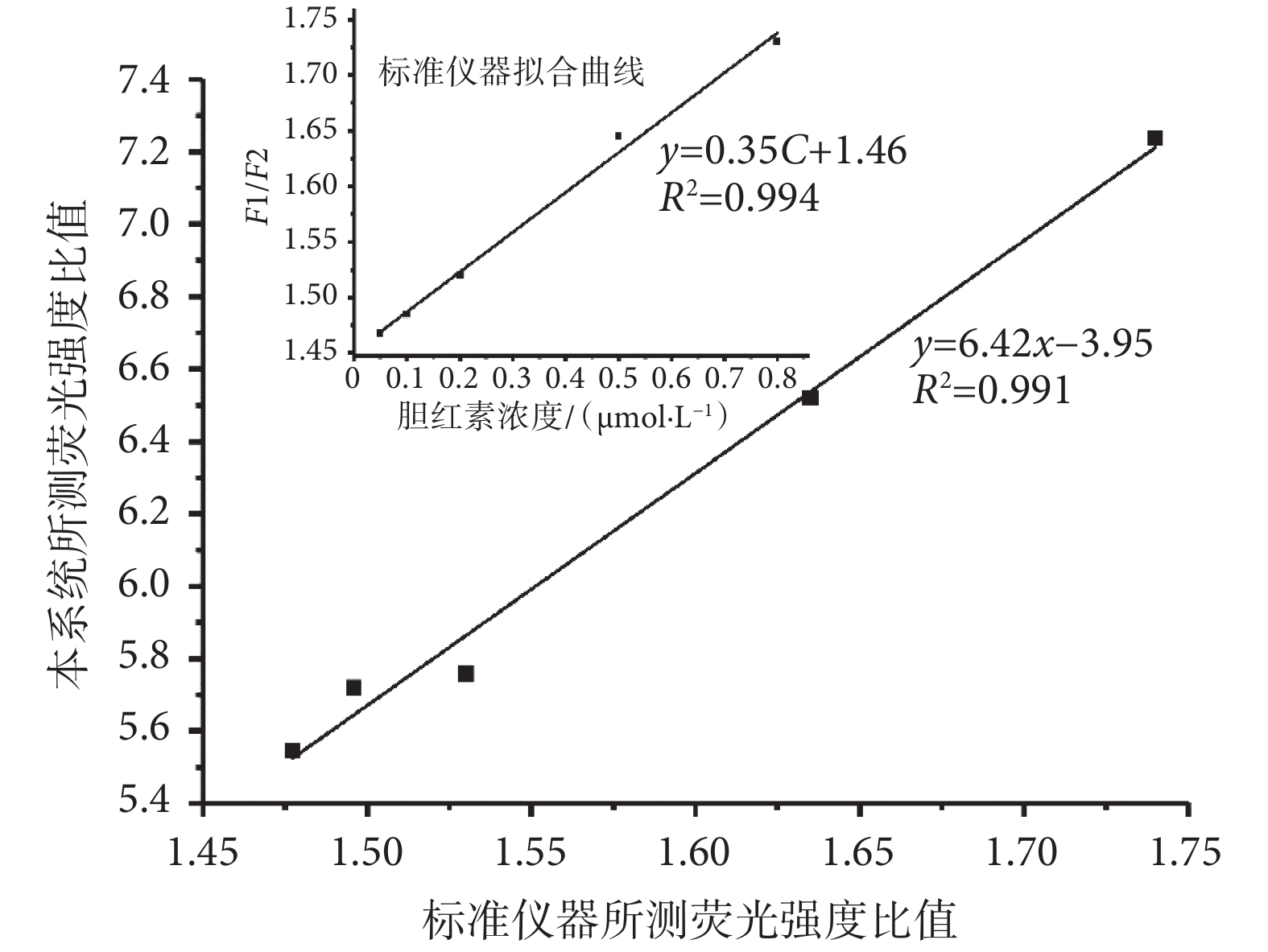 圖8
本系統與標準儀器測量值關系圖
Figure8.
The relationship between the data measured by our sys tem and the standard instrument
圖8
本系統與標準儀器測量值關系圖
Figure8.
The relationship between the data measured by our sys tem and the standard instrument
5.5 系統抗干擾性實驗
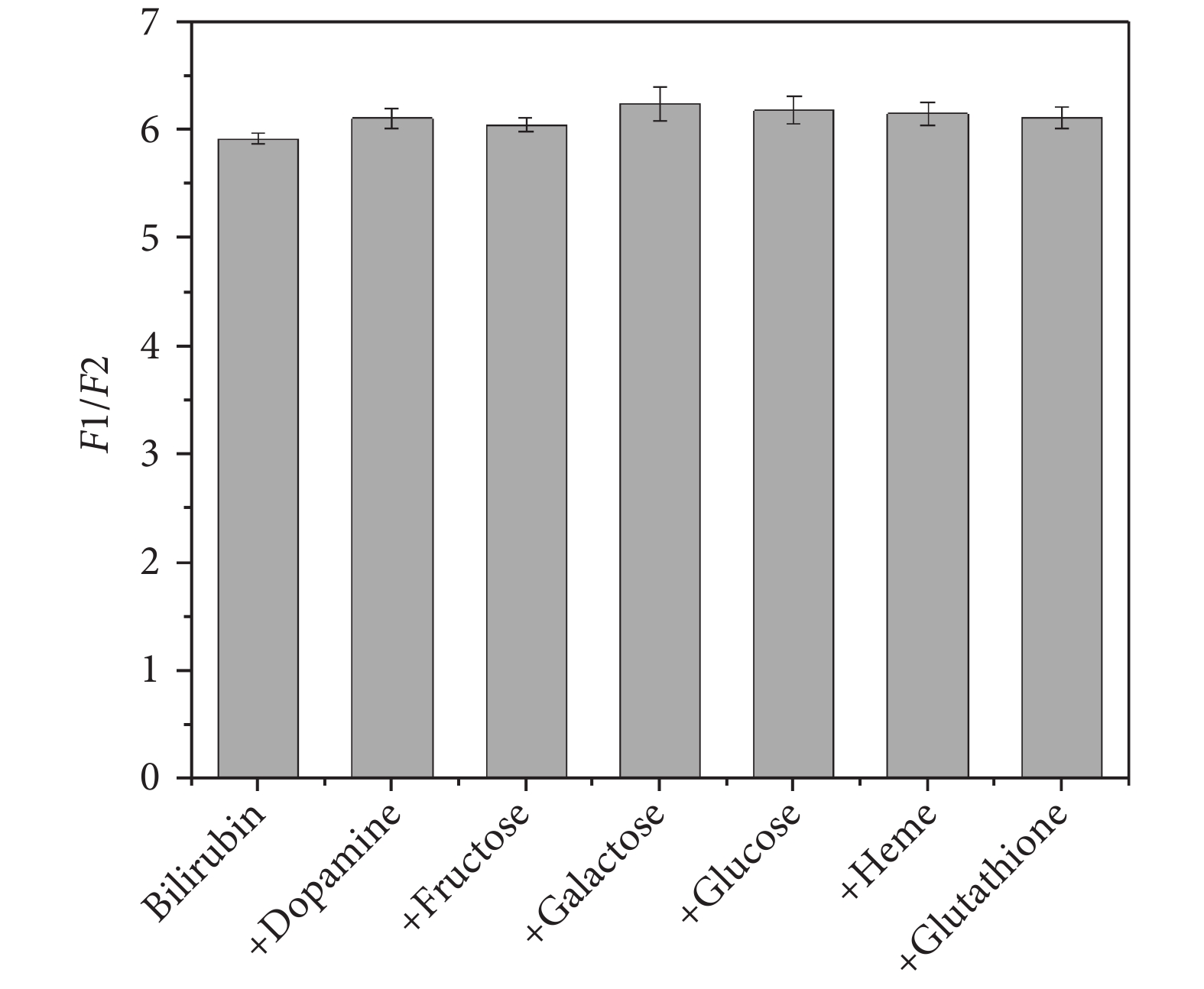
在血清膽紅素中存在多巴胺(Dopamine)、果糖(Fructose)、半乳糖(Galactose)、葡萄糖(Glucose)、血紅素(Heme)、谷胱甘肽(Glutathione)等共存物,為了驗證這些共存物是否會對檢測結果產生影響,在膽紅素溶液(0.2 μmol/L)中添加共存物(0.1 mmol/L),根據上述的實驗流程進行測定。實驗結果如圖9所示,在共存物濃度為膽紅素濃度的500倍時,所檢測的熒光強度比值并不存在明顯的上升或下降,可知這些共存物的存在并不影響該系統對血清膽紅素的測定。
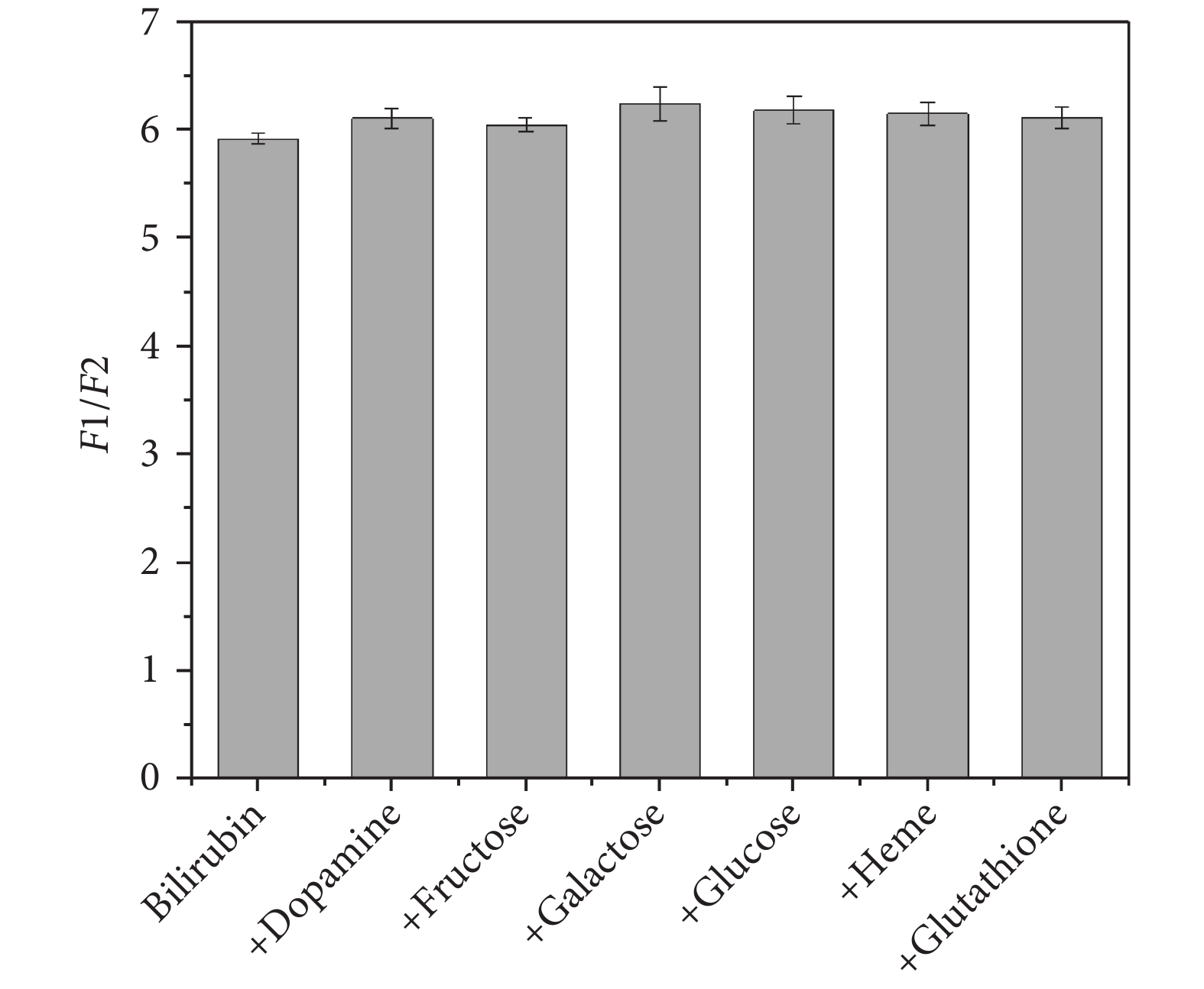 圖9
系統干擾性測試
Figure9.
System interference test
圖9
系統干擾性測試
Figure9.
System interference test
6 結論
為了滿足對低水平血清膽紅素濃度進行檢測的需要,本文構建了比率型膽紅素熒光薄膜傳感器,基于此傳感器,設計了一套小巧、便攜的膽紅素檢測系統。實驗結果表明,該系統具有較高的靈敏度、較好的重復性以及很強的抗干擾性,該系統檢測結果與標準儀器相比具有很強的相關性,相關系數為0.991,檢測時間僅為2 min,可以實現對血清低水平膽紅素的定量檢測。
重要聲明
利益沖突聲明:本文全體作者均聲明不存在利益沖突。
作者貢獻聲明:支冬燦為主要撰寫人,完成文獻資料的整理收集與分析,嵌入式系統的搭建以及論文初稿的撰寫;肖文香參與前期化學實驗指導以及論文修改。
引言
近年來,隨著人口老齡化加劇,我國慢性病患者人數迅速增長,其中心血管疾病已經成為人類健康的一大威脅[1-2]。血清膽紅素作為人體內重要的抗氧化劑,其抗氧化功能對降低動脈粥脈硬化、降低冠心病發生概率具有重要意義[3-5]。膽紅素是人體內血紅素分解代謝后產生的最終物質。一些具有肝功能障礙及患有黃疸病的患者其體內的血清膽紅素水平過高,而心血管疾病患者,如小動脈硬化、高血壓和糖尿病并發癥患者,體內膽紅素水平的高低與疾病風險呈負相關[6-10]。目前,用于定量檢測膽紅素的主要方法有色譜法、經皮法、酶法等[11-13],以上方法在對膽紅素進行檢測時,存在操作復雜、檢測時間長、成本高等缺點。
本文所設計的比率型血清膽紅素檢測系統,將分別能發射藍色熒光(B-AuNCs)及紅色熒光(R-AuNCs)的金納米簇,通過層層自組裝(layer-by-layer self-assembly,LBL)技術沉積于同一薄膜,得到比率型的熒光薄膜傳感器,比率型熒光探針具有自參比特性,可有效避免來自環境的干擾,提高檢測精度[14]。
1 檢測方法建立及系統總體設計
1.1 檢測原理
膽紅素在紫外-可見光范圍不具有熒光特性,因此采用能發射藍色/紅色熒光的金納米簇作為熒光探針測定膽紅素。以牛血清白蛋白(bovine serum albumin,BSA)為模板在生理條件下制備金納米簇,BSA能起到還原劑和穩定劑的作用,可形成穩定的金納米簇。BSA與游離膽紅素形成復合物,當BSA保護的金納米簇與膽紅素溶液發生作用時,形成非熒光的基態復合物,使得金納米簇發生熒光猝滅現象[15-18],且熒光猝滅程度與所加入被測樣本中膽紅素濃度存在線性關系。
1.2 藍/紅熒光金納米簇溶液的制備及其熒光光譜
本文通過水熱法制備分別能發射藍色及紅色熒光的金納米簇溶液(BSA-AuNCs)。制備方法如下:① B-AuNCs溶液的制備:取5 mL氯金酸溶液(10 mmol/L)與5 mL BSA溶液(50 mg/mL)混合,加入10 μL的組氨酸溶液(100 mmol/L),使用10 mmol/L的NaOH溶液將混合液的pH值調至5.5,將溶液置于37 ℃水浴加熱6 h,得到B-AuNCs。將B-AuNCs溶液在蒸餾水中進行2天透析,透析后的溶液冷凍干燥,4 ℃保存備用。② R-AuNCs溶液的制備:取5 mL的HAuCl4水溶液(10 mmol/L,37 ℃),在劇烈攪拌條件下加入到5 mL BSA溶液(50 mg/mL,37 ℃)中,繼續攪拌2 min,加入NaOH溶液(1 mol/L)將pH值調至12~13,溫育12 h,可見溶液由淡黃色變成棕色,得到R-AuNCs。之后采用鋅離子共沉淀法對R-AuNCs進行純化,純化后的溶液進行冷凍干燥,4 ℃保存備用。
圖1為日立F-4600熒光分光光度計(日本)測得的藍/紅金納米簇溶液的激發光譜和發射光譜。由圖可知藍光金納米簇在激發光源波長為365 nm產生激發峰,最大發射峰位于443 nm處;紅光金納米簇在激發光源波長為365 nm和501 nm處產生激發峰,最大發射峰位于623 nm處。
 圖1
藍色熒光(左)和紅色熒光(右)金納米簇溶液的熒光光譜和吸收光譜
Figure1.
Fluorescence and absorbance spectra of blue (left)/ red (right)-emitting gold nanoclusters
圖1
藍色熒光(左)和紅色熒光(右)金納米簇溶液的熒光光譜和吸收光譜
Figure1.
Fluorescence and absorbance spectra of blue (left)/ red (right)-emitting gold nanoclusters
1.3 薄膜傳感器的制備與其熒光性能
熒光探針在均相溶液中進行測定時受外界干擾較大且具有耗費試劑、增加實驗成本、無法重復利用等缺點[19],因而采用LBL技術,將藍/紅兩種金納米簇溶液偶聯后的交聯物進行組裝,得到具有雙發射峰的熒光薄膜傳感器。層層靜電自組裝技術是一種比較有效的有序組裝納米分子材料的方法,可以制備均勻、多層復合膜,并且操作簡單。利用這種方法可以將不同的分子有序地組合到薄膜上,通過調控薄膜的厚度和結構,能夠實現薄膜光、電、非線性光學等特性的功能化[20-21]。
本文制備的BSA-AuNCs表面帶負電荷,聚烯丙胺鹽酸鹽(polyallylamine hydrochloride,PAH)帶正電荷,利用靜電作用將藍色及紅色熒光金納米簇逐層組裝到石英基片上,得到LBL熒光薄膜。薄膜制備的主要流程如下。分別取R-AuNCs、B-AuNCs固體溶解于磷酸鹽(phosphate buffer saline,PBS)緩沖液(pH = 7.4,50 mmol/L)中,獲得20 mg/mL的溶液。在2 mL R-AuNCs溶液中加入碳二亞胺(EDC,2 mg)與N-羥基琥珀酰亞胺(NHS,3 mg)固體用來提高偶聯效率,在37 ℃水浴加熱15 min后加入2 mL B-AuNCs溶液(20 mg/mL),37 ℃水浴加熱12 h,得到藍/紅熒光金納米簇交聯物溶液(20 mg/mL)。將處理好的石英基片置于PAH溶液(2 mg/mL)中浸泡10 min,這時基片表面帶正電,之后將石英基片浸泡在藍/紅熒光金納米簇交聯物溶液10 min,帶負電的交聯物沉積于基片上。重復上述步驟n次便得到了n層的雙發射比率型熒光探針薄膜。
由圖2可知,在激發光源為365 nm時,交聯物溶液(20 mg/mL)在443 nm處與623 nm處存在熒光發射峰,因此交聯過程并未改變兩者的熒光性質。在石英基片上組裝14層交聯物后,薄膜具有較強的熒光,其熒光發射峰位于443 nm和623 nm,與溶液的熒光一致。
 圖2
溶液與薄膜熒光性質對比
Figure2.
Comparison of fluorescence properties between solution and film
圖2
溶液與薄膜熒光性質對比
Figure2.
Comparison of fluorescence properties between solution and film
1.4 比率型熒光檢測方法的建立
本文通過前期實驗確定,當金納米簇溶液鋪膜濃度為20 mg/mL、層數為14時,薄膜傳感器的熒光性能最優,且對膽紅素的最佳檢測時間為120 s。采用365 nm的激發光源對其進行激發,在薄膜上滴加一定濃度梯度的膽紅素標準液后,采用熒光分光光度計檢測薄膜的熒光光譜,熒光探針發射峰熒光強度的變化情況如圖3所示。隨著膽紅素濃度增加,兩個峰熒光強度下降的程度越發明顯,且峰值之間的比值與膽紅素標準液濃度存在線性關系。因此,建立了一種雙發射型的比率薄膜傳感器,通過同時檢測波長1(443 nm)與波長2(623 nm)處的熒光強度F1、F2,將檢測結果做比例運算(F1/F2),達到對血清膽紅素濃度進行測定的目的。
 圖3
加入膽紅素標準液后薄膜熒光光強變化情況
Figure3.
Fluorescence quenching of the film by adding bilirubin standard solution
圖3
加入膽紅素標準液后薄膜熒光光強變化情況
Figure3.
Fluorescence quenching of the film by adding bilirubin standard solution
為了確定比率熒光膜傳感器的性能,我們進行了紅色熒光金納米簇單一探針及薄膜對膽紅素響應的對比實驗。在水溶液中采用單一的熒光探針測定膽紅素,其熒光猝滅程度與膽紅素濃度的Stern-Volmer線性擬合方程為:F0/F?1=0.097 1C?1.012,F0為滴加膽紅素前熒光峰強度,F為滴加膽紅素后的熒光峰強度,C為膽紅素標準液濃度(單位為μmol/L),膽紅素濃度線性范圍為11.19~23.14 μmol/L。本文中的比率型熒光薄膜對膽紅素測定的線性方程為F1/F2=0.35C+1.46,C為膽紅素標準液濃度(單位為μmol/L),膽紅素濃度線性范圍為0.01~2.00 μmol/L。從二者標準曲線的斜率及線性范圍可知,比率型金納米簇熒光膜的靈敏度更高,適用于低濃度水平血清膽紅素的測定。
2 檢測系統總體設計
基于上述檢測原理,設計了一種便攜式比率型血清膽紅素熒光檢測系統,該系統總體框圖如圖4所示。系統主要由微處理器、程序下載模塊、電源模塊、恒流源模塊、光頻轉換模塊、顯示屏模塊、暗室等組成。微處理模塊的功能是控制其他外設電路工作,并且對采集的數據進行分析;程序下載模塊的功能為下載程序以及初期階段代碼調試,確保軟件正常運行;電源模塊的功能主要是為本系統中其他模塊提供電壓輸入,并且配置了充電保護,使得系統可長時間使用;恒流源模塊是用來為激發光源提供穩定的電流輸入,確保激發光源工作穩定;光頻傳感器模塊用來檢測LBL薄膜在加入膽紅素前后的熒光強度值;顯示屏模塊將所滴加膽紅素的濃度進行顯示。為了避免環境光的干擾,除顯示屏外,其余模塊均置于三維打印制作的暗盒中。
 圖4
便攜式比率型血清膽紅素熒光檢測系統總體框架圖
Figure4.
Overall framework of the ratiometric fluorescence detection system for serum bilirubin
圖4
便攜式比率型血清膽紅素熒光檢測系統總體框架圖
Figure4.
Overall framework of the ratiometric fluorescence detection system for serum bilirubin
系統啟動后,STM32驅動恒流源芯片對激發光源進行調控確保其穩定工作,激發光經過光路結構后,照射到可抽拉的檢測槽上,對放置好的LBL薄膜進行激發。由于金納米簇具有熒光特性,因此LBL膜受到特定的激發光照射后,會產生一定強度的熒光發射。通過濾光片將其他波段的雜光濾除,只允許波長為兩個發射熒光峰(F1、F2)的熒光信號通過,之后分別經過位于濾光片后的聚光鏡匯聚到光頻傳感器光窗,被光頻傳感器轉換成脈沖電信號,最終返回到主控芯片進行數據分析與處理,液晶顯示屏對分析后的數據進行顯示。為了防止外界環境對檢測結果的干擾,整個實驗過程在室溫(20~25℃)條件下的暗室中進行。
3 系統硬件實現
3.1 微處理器模塊
本系統采用STM32F407ZGT6作為主控芯片,其在低功耗模式下電流僅為1.7 μA,功耗較少。STM32F407ZGT6是CortexTM-M4為內核的STM32F4系列高性能微控制器,支持浮點型運算,在數據處理方面十分出色[22]。
3.2 電源模塊
本系統中采用鋰電池供電,電池最大輸出電壓為3.7 V,輸入電壓為4.5 V。為了達到長期使用的目的,為鋰電池設計了充電電路。使用功率計對系統功耗進行測定,靜息態時實際功耗為0.81 W。
3.3 激發光源模塊
本系統中,當激發光源的波長為365 nm時,測定443、623 nm兩個波長處LBL薄膜的熒光強度,應該采用紫外光源作為激發光源。在熒光檢測中常用的紫外光源有氙燈、激光、鎢燈和LED光源等[23]。本實驗選用LED作為激發光源,LED具有成本低、光源穩定、散熱量小的優點。根據LBL薄膜的最佳激發波長,系統選用的LED為鴻光電子公司生產,其峰值波長為 365 nm,帶寬10 nm,功率為0.5 W,通過恒流源芯片AMC7150驅動可滿足實驗的需要。
3.4 光頻轉換模塊
系統中采用雙通道比率檢測方法,因此需要兩個光頻傳感器來采集熒光信號。由于光電二極管靈敏度高、響應快并且擁有良好的線性測量范圍,在弱光檢測中被廣泛使用[24-25]。本系統選擇內部集成了光電二極管和電流頻率轉換器的光頻傳感器TSL237和TSL238T作為熒光光強檢測器。
在光頻傳感器前需放置濾光片用來濾除雜光的干擾,其主要功能是允許特定波段的光通過[26],本次實驗中使用的濾光片為億照公司生產的截止深度為OD5的帶通濾光片,中心波長分別為620 nm和440 nm,帶寬為20 nm。
經過濾光片濾除雜光干擾后,特定波段的熒光信號分別照射到TSL237、TSL238T的光窗上。TSL237內部COMS集成電路上集成了光電二極管和電流頻率轉換器,光信號經過轉換后輸出占空比為50%的方波信號,且輸出頻率與照射到傳感器內的光電二極管的光照強度成正比,數字輸出允許直接與微控制器或其他邏輯接口相連接。器件經過溫度補償,適用于320 ~ 700 nm的紫外-可見光范圍,并可對320 ~ 1050 nm范圍內的光強作出響應,在波長524 nm處具有最強輻照響應度,故用于443 nm熒光的檢測。TSL238T內部與TSL237類似,不同的是,TSL238T輸出使能(output enable,OE)為低電平時芯片工作,OE輸入線便于同一個總線在掛接多個設備時操作;TSL238T在波長640 nm處具有最強輻照響應度,故用于623 nm熒光的檢測。
3.5 顯示屏模塊
顯示屏的主要作用是用來顯示檢測物質濃度及系統的其他一些信息。本系統采用的為2.8寸的電阻型觸摸屏,其內部驅動芯片為ILI9341。電阻屏具有觸摸靈敏度高、視角廣、反應速度快等優點,并且支持眾多的芯片,本文通過FSMC總線對屏幕進行驅動[27]。
3.6 檢測光路及檢測暗室模塊
光路的結構決定了發射光和激發光在系統內部的傳遞方向,本系統采用傳統的熒光激發光路,該光路結構在一定程度上可減少激發光源的干擾,且對熒光信號的收集具有良好的效果[28-30]。圖5為本系統的光路結構及整個系統示意圖,主要光路工作原理為:在檢測區域放置LBL薄膜,激發光源經過濾光片A后,通過二向色鏡A反射到檢測池中對薄膜進行激發,所產生的熒光透射過二向色鏡A,在經過二向色鏡B時,443 nm附近波段的光折射到濾光片B后,被耦合鏡收集在傳感器B的光窗上,623 nm波長附近的光透射到濾光片C后,被耦合鏡收集在傳感器A的光窗上。傳感器將光信號轉換為電信號輸出,并將數據傳入系統主控芯片進行數據分析。
 圖5
系統結構示意圖
Figure5.
System structure diagram
圖5
系統結構示意圖
Figure5.
System structure diagram
本系統中的暗室模塊主要是用來將檢測光路、檢測槽及其他硬件模塊嵌入其中,建立一個避光的檢測環境,減少環境光的干擾。
4 系統軟件實現
系統下位機軟件設計是基于ST公司提供的官方固件庫開發,使用Keil 5集成開發平臺,在系統工作及模塊驅動方面采用C語言編寫,實現了光源控制、信號采集、信號預處理等功能。系統的上位機軟件開發是基于開源的littleVGL官方庫開發,使用Code Blocks平臺,最后將開發好的圖形用戶界面(graphical user interface,GUI)移植到微處理器中。
5 實驗結果分析
5.1 系統重復性測試
使用PBS溶液(pH = 7.0)配置不同濃度梯度的血清膽紅素標準液,打開系統中的激發光源等待光源穩定(10 s)。在光源穩定后取出檢測槽,將LBL薄膜放入檢測槽中,之后將檢測槽緩緩推入暗室,在顯示界面可看到F1與F2的值,待數值穩定后將檢測槽拉出,使用移液槍吸取50 μL濃度為0.4 μmol/L的膽紅素標準液滴加在LBL薄膜上,使用濾紙將多余的溶液吸干,之后將檢測槽推入暗室反應120 s,上述流程重復五次。在對系統進行重復性實驗時通常都采用相對標準偏差(relative standard deviation,RSD)作為評價系統重復性的指標,其定義為標準差(standard deviation,SD)與平均值(Mean)之比。
 |
 |
實驗結果如表1所示。由表1可知,在加入膽紅素后,由于熒光猝滅作用,F1、F2的值均發生下降,且五次重復實驗測試結果所得到的F1/F2值一致性較好,RSD值為1.8%,由此可知本系統具有良好的重復性。
5.2 系統穩定性測試
為了對系統的穩定性進行測試,在最佳的實驗條件下,本文以濃度為0.6 μmol/L的膽紅素標準液作為實驗對象,持續5 min對系統所檢測的熒光光強數據進行記錄,結果如圖6所示。隨著反應時間的增加,F1和F2的熒光強度均下降,在0~90 s范圍內,熒光強度下降較為明顯,90 s之后熒光值基本達到平衡。該平衡時間反映了LBL膜中BSA保護的金納米簇對膽紅素的分子識別過程,由于BSA與膽紅素結合成非熒光性的復合物,削弱了BSA與金納米簇之間的結合作用,導致LBL膜的熒光強度下降。BSA與膽紅素之間的結合作用是一個動態的平衡過程,到達平衡之前,隨著膽紅素的結合量增加,熒光下降明顯,當膽紅素分子完全被結合之后,熒光強度不再變化,達到穩定值。從系統穩定性測試結果可知,該系統能實時反映分子識別過程,其平衡時間為90 s,且信號穩定時間在3 min以上,穩定時間滿足檢測需要。
 圖6
系統穩定性測試
Figure6.
System stability test
圖6
系統穩定性測試
Figure6.
System stability test
5.3 系統標準工作曲線及驗證
根據上述實驗方法流程,取五組不同濃度的標準液(0.05、0.10、0.20、0.50、0.80 μmol/L)進行平行實驗,將得到的多組實驗數據去除粗大誤差后,取平均值作為每組濃度的實驗結果。使用該檢測結果與濃度進行標準工作曲線的繪制,如圖7所示,標準工作曲線方程為y = 2.20C + 5.46,其中y為熒光強度比值,C為膽紅素標準液濃度(單位為μmol/L),兩者相關系數R2 = 0.987,說明該系統檢測到的LBL薄膜的雙熒光峰強度比值與膽紅素濃度具有較好的相關性。
 圖7
系統標準曲線
Figure7.
System standard curve
圖7
系統標準曲線
Figure7.
System standard curve
取驗證標準工作曲線之外的4種膽紅素標準液濃度(0.08、0.15、0.30、0.40 μmol/L)作為驗證集,將這4種濃度的溶液按照上述實驗方法進行10次平行實驗,將檢測結果通過標準工作曲線換算成系統所測濃度C,上述濃度實測RSD值依次為9.0%、7.3%、3.1%、2.5%。雖然存在一定誤差,但是由于薄膜制備上的差異及系統電路上存在的噪聲影響,總體來說,此實驗數據可表明該系統具有較高的準確性。
5.4 測量結果與標準儀器對比
將日立F-4600熒光分光光度計作為商品化標準儀器進行對比。使用標準儀器對膽紅素標準液的檢測流程與本系統類似,首先使用五個樣本進行五次平行實驗,去除誤差后,繪制出標準儀器的工作曲線如圖8所示,標準儀器對膽紅素檢測的標準曲線為y = 0.35C + 1.46,其中y為熒光強度比值,C為血清膽紅素標準液濃度(單位為μmol/L),兩者相關系數R2 = 0.994,由此可知標準儀器在對膽紅素進行檢測時,具有較高的可信度。之后將本系統與標準儀器在相同濃度下所檢測的熒光強度比值進行分析,由圖8可知二者擬合曲線為y = 6.42x ? 3.59,其中x為標準儀器檢測值,y為本系統檢測值,兩者相關系數R2 = 0.991。本系統的最低檢測限度為0.02 μmol/L,比標準儀器的檢測限略高,主要是由于本系統中激發光源的發光強度有限,且儀器內部硬件性能差異,也使得兩者所檢測的熒光強度比值存在一定差別,但二者具有較強的相關性,并不影響本系統的正常使用。以上結果表明,盡管本檢測儀器與標準儀器相比還存在一定差異,但本系統對低水平膽紅素濃度的檢測具有可行性。
 圖8
本系統與標準儀器測量值關系圖
Figure8.
The relationship between the data measured by our sys tem and the standard instrument
圖8
本系統與標準儀器測量值關系圖
Figure8.
The relationship between the data measured by our sys tem and the standard instrument
5.5 系統抗干擾性實驗
在血清膽紅素中存在多巴胺(Dopamine)、果糖(Fructose)、半乳糖(Galactose)、葡萄糖(Glucose)、血紅素(Heme)、谷胱甘肽(Glutathione)等共存物,為了驗證這些共存物是否會對檢測結果產生影響,在膽紅素溶液(0.2 μmol/L)中添加共存物(0.1 mmol/L),根據上述的實驗流程進行測定。實驗結果如圖9所示,在共存物濃度為膽紅素濃度的500倍時,所檢測的熒光強度比值并不存在明顯的上升或下降,可知這些共存物的存在并不影響該系統對血清膽紅素的測定。
 圖9
系統干擾性測試
Figure9.
System interference test
圖9
系統干擾性測試
Figure9.
System interference test
6 結論
為了滿足對低水平血清膽紅素濃度進行檢測的需要,本文構建了比率型膽紅素熒光薄膜傳感器,基于此傳感器,設計了一套小巧、便攜的膽紅素檢測系統。實驗結果表明,該系統具有較高的靈敏度、較好的重復性以及很強的抗干擾性,該系統檢測結果與標準儀器相比具有很強的相關性,相關系數為0.991,檢測時間僅為2 min,可以實現對血清低水平膽紅素的定量檢測。
重要聲明
利益沖突聲明:本文全體作者均聲明不存在利益沖突。
作者貢獻聲明:支冬燦為主要撰寫人,完成文獻資料的整理收集與分析,嵌入式系統的搭建以及論文初稿的撰寫;肖文香參與前期化學實驗指導以及論文修改。