已有研究發現,下肢截肢患者心血管疾病發病率顯著高于正常人,但少有學者從血流動力學角度研究下肢截肢與心血管疾病之間的關系。本文采用數值仿真,通過改變外周阻抗和電容模擬不同截肢水平,研究截肢對主動脈血流動力學環境的影響。結果發現,截肢后主動脈血壓升高,腎下腹主動脈時均壁面切應力降低,且左右側壁振蕩剪切指數呈不對稱分布;截肢側髂動脈時均壁面切應力降低且振蕩剪切指數增大;同時隨截肢水平提高,上述變化更加顯著,增加了截肢者患動脈粥樣硬化與腹主動脈瘤的風險。本文初步揭示了下肢截肢對心血管疾病的影響規律,為截肢后康復訓練設計與心血管疾病治療方案優化提供理論指導。
引用本文: 魏君如, 李忠友, 刁珺杰, 李瀟, 閔磊, 蔣文濤, 晏菲. 下肢截肢水平對主動脈血流動力學影響的數值研究. 生物醫學工程學雜志, 2022, 39(1): 67-74. doi: 10.7507/1001-5515.202108031 復制
版權信息: ?四川大學華西醫院華西期刊社《生物醫學工程學雜志》版權所有,未經授權不得轉載、改編
引言
下肢截肢術是為挽救患者生命所進行的一種不可逆的醫療手段,截肢的主要原因包括腿部嚴重創傷與感染、股動脈閉塞與栓塞、糖尿病足以及惡性腫瘤等。對于截肢后的治療和康復,臨床主要關注的是殘肢本身,而統計學研究發現截肢者心血管疾病致死率是普通人的2.2倍[1]、毀容軍人的1.6倍[2],患缺血性心臟病比率是普通人的2倍[3],患腹主動脈瘤比率是普通人的5.3倍[4]。由此可見,對截肢患者心血管疾病的關注不容忽視。
為解釋截肢與心血管疾病的關系,前期已有很多相關研究,如Frugoli等[5]認為截肢患者運動量減少,肥胖和高血壓頻發,因而心血管疾病發病率增高;Peles等[6]研究發現,截肢者易出現與心血管疾病危險因素聚集有關的胰島素抵抗;Bhatnagar等[7]進行回顧性分析指出,下肢截肢者患代謝綜合征幾率更高,且雙側截肢患病率高于單側(21.9% vs. 14.9%)。然而,這些研究均無法解釋不同截肢高度以及單、雙側截肢后心血管疾病死亡率與發病率的差異[4, 8],如膝上截肢死亡率高于膝下截肢(76.6% vs. 63.1%)[9],雙側膝上截肢發病率高于單側膝上截肢(17.5% vs. 11.8%)[2]等。而除開上述致病因素,血流動力學環境改變對心血管疾病的影響已受到廣泛認可,例如低或振蕩的壁面切應力可加速內皮細胞損傷,促進動脈瘤與粥樣硬化斑塊的出現[10-11],但縱觀已有研究,少有文獻涉及截肢對血流動力學環境的改變及其與心血管疾病的關系。事實上,術后患者腿部肢體缺失,血管樹結構變化,血液正常流動受阻,這均可總結為外周阻抗的改變,然而截肢后出現的外周阻抗變化會對主動脈血流環境造成何種影響尚不清楚,能否從新的角度厘清截肢和心血管疾病的聯系還需進一步研究。
因此,本文建立了從升主動脈至主—髂分叉的理想幾何模型,通過改變單側髂總動脈遠端阻抗模擬不同截肢水平,分析了血壓、時均壁面切應力(time averaged wall shear stress,TAWSS)和振蕩剪切指數(oscillatory shear index,OSI)等血流動力學參數,探尋截肢后主動脈血流動力學環境變化規律,為揭示截肢對心血管疾病影響的血流動力學機制提供理論支撐。
1 模型與方法
1.1 幾何模型
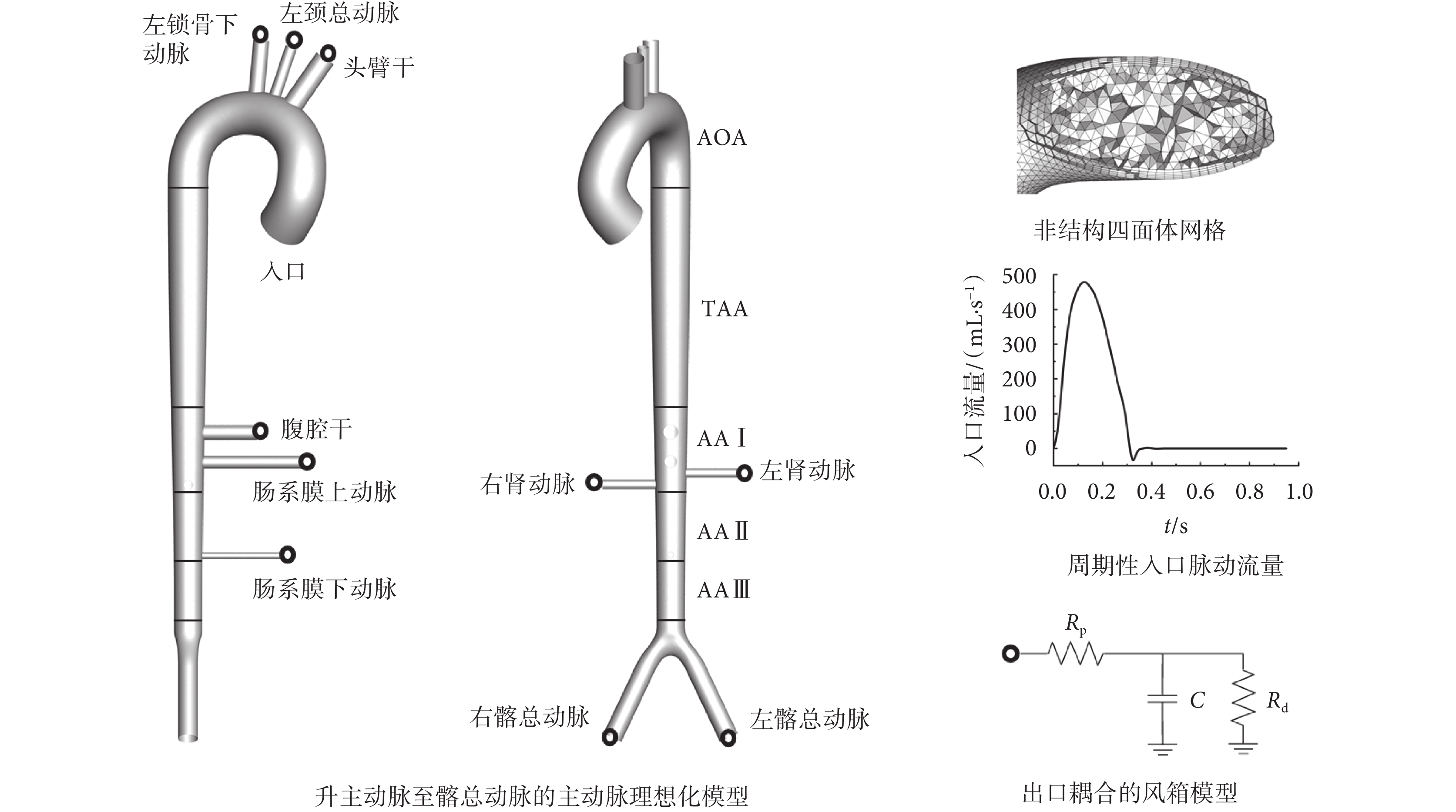
為使研究具有普遍性和可比性,避免個性化差異對結果的影響,本文利用三維建模軟件Solidworks 2017(Dassault Systemes Inc.,美國)建立主動脈理想化幾何模型,模型尺寸來自Xiao等[12]的研究,如圖1所示。模型包括主動脈(升主動脈至主—髂分叉)與分支動脈(分別為頭臂干、左頸總動脈、左鎖骨下動脈、腹腔干、上下腸系膜動脈、左右腎動脈、左右髂總動脈)。將模型導入計算機輔助工程前處理軟件ICEM CFD 17.0(ANSYS Inc.,美國)進行非結構四面體網格劃分,壁面邊界采用5層棱柱型網格加密,在穩態計算中進行敏感性分析保證了網格獨立性,最終獲得網格單元數量962 270個。此外,為便于結果分析,將主動脈分為多個片段:主動脈弓段(aortic arch,AOA)、胸主動脈段(thoracic aorta,TAA)、腹主動脈I段(abdominal aorta Ⅰ,AA Ⅰ)、腹主動脈II段(abdominal aorta Ⅱ,AA Ⅱ)以及腹主動脈III段(abdominal aorta Ⅲ,AA Ⅲ)。
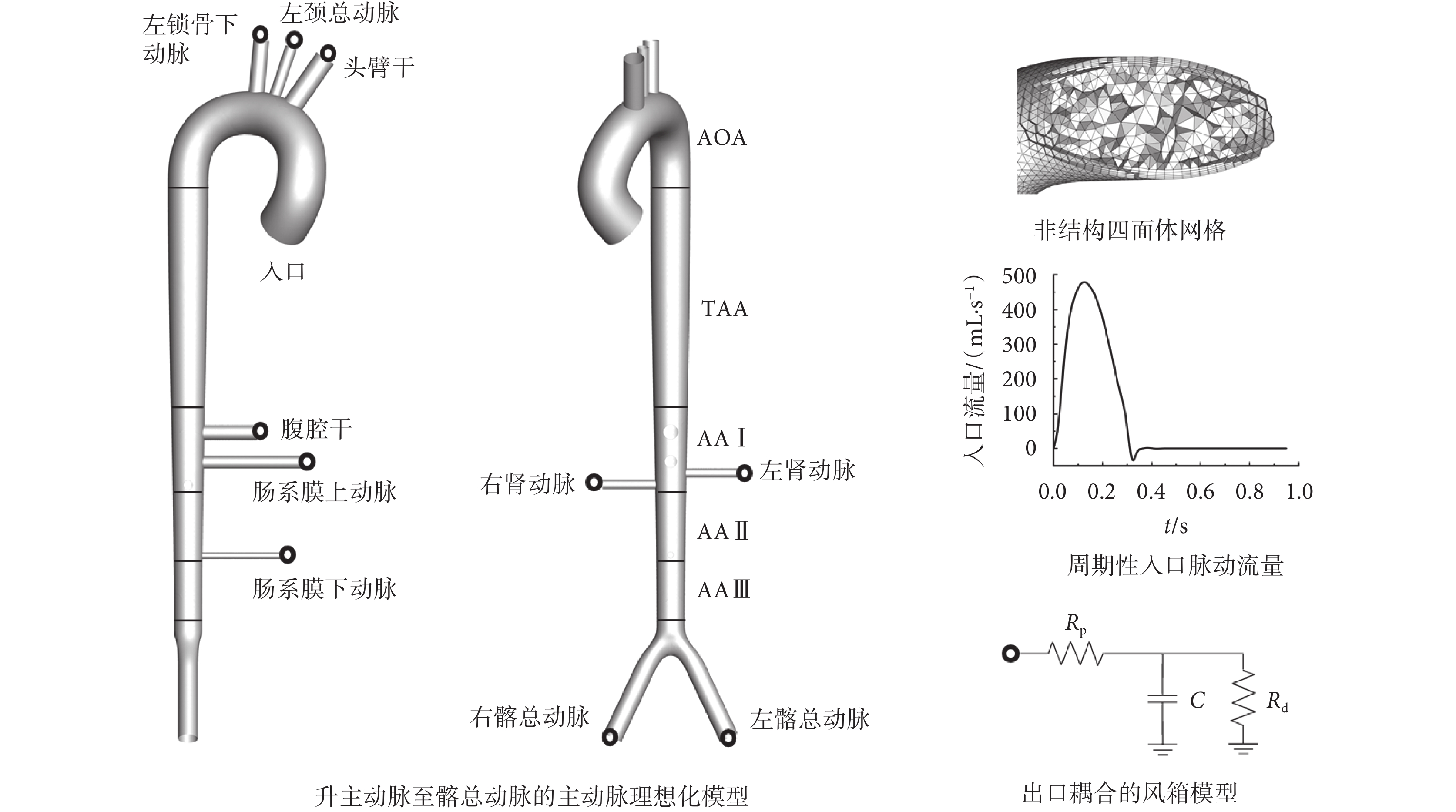 圖1
主動脈理想化幾何模型、非結構四面體網格及邊界層、入口流量曲線與風箱模型
Figure1.
Idealized geometric model of aorta, unstructured tetrahedral meshes and boundary layers, inlet flow rate and Windkessel model
圖1
主動脈理想化幾何模型、非結構四面體網格及邊界層、入口流量曲線與風箱模型
Figure1.
Idealized geometric model of aorta, unstructured tetrahedral meshes and boundary layers, inlet flow rate and Windkessel model
1.2 控制方程
假定血液為各向同性的不可壓縮牛頓流體,血管壁為剛性無滑移壁面。血液流動的控制方程可由連續性方程和納維-斯托克斯(Navier-Stokes)方程表達,如式(1)和式(2)所示:
 |
 |
其中,u、P、ρ和μ分別為流體速度、壓力、血液密度(ρ=1 050 kg/m3)以及動力粘度(μ=0.003 5 Pa·s)。三維流場的計算在有限體積法商業軟件FLUENT 17.0(ANSYS Inc.,美國)中進行,由基于壓力耦合方程組的半隱式方法實現壓力—速度耦合,選擇基于網格的最小二乘法, 二階和二階迎風格式對梯度、壓力與動量進行離散。
1.3 邊界條件
如圖1所示,模型入口選擇升主動脈脈動流Q0;各出口均連接一個3參數風箱(3 Windkessel, 3WK)模型[12]。3WK模型包括代表大動脈對血液流動阻力的近端阻抗Rp、代表小動脈及毛細血管阻力的遠端阻抗Rd以及代表血管順應性的電容C。由基爾霍夫定律,各出口壓力和流量的關系如式(3)所示:
 |
其中,Q、P分別為各出口截面的瞬時平均流量和瞬時平均壓力。
根據血管直徑d與文獻[13],獲取正常人各出口平均流量及平均壓力,計算得到外周阻抗Rt = Rp + Rd、總外周阻抗RT [14]與總電容CT[12];近端阻抗Rp采用對應一維模型特征阻抗[12];電容C由總電容CT按各出口生理流量占比進行分配[15–18]。正常人各出口邊界3WK模型參數及計算所得心搏出量占比如表1所示。
通過用戶自定義函數,在每個三維計算時間步,傳遞出口截面上的流量與壓力,并由顯式歐拉法求解如式(3)所示的常微分方程,實現零維的3WK模型與三維模型的耦合,時間步長為0.005 s,一個心動周期為0.95 s,5個心動周期后計算收斂,取最后一個周期數據進行分析。
1.4 截肢模型
下肢截肢將丟失部分下肢血液循環系統,盡管原有側支血管可維持一部分血液回心,但手術造成了主要動靜脈結扎,血液正常流動受阻,表現為外周阻抗Rt增加[19];而在短期內與血管直徑、脈搏波速度相關的近端阻抗Rp并不會出現明顯變化,因此可通過改變遠端阻抗Rd來模擬不同截肢水平。基于此,用術后單側髂動脈遠端阻抗Rd*與正常人髂動脈遠端阻抗Rd0的比值定義截肢嚴重程度,以截肢度N表示,如式(4)所示:
 |
由此設計5組模型,研究正常人因外傷導致右下肢截肢后主動脈血流動力學變化:模型一,為健康組(N = 1),出口邊界由前述方法確定;模型二至模型五,分別對應經脛骨截肢(N = 1.5)、膝離斷(N = 2)、經股骨截肢(N = 4)和髖離斷(N = 6)。其中,右下肢側稱為截肢側,左下肢側稱為健側。
肢體丟失后血管可儲存血量減小,表現為外周血管順應性降低,又考慮到任何一維舒張壓衰減時間常數CTRT為一定值[14],且遠端阻抗Rd遠大于近端阻抗Rp [20],本文忽略近端阻抗Rp對電容C的影響,認為截肢后截肢側電容C減小N倍,即C = C0/N。
1.5 主要血流動力學參數
由于血壓是心血管疾病高危因素,而壁面切應力是影響血管內皮細胞結構和功能的重要指標,與血管病變密切相關[10-11],因此本文重點比較截肢前后主動脈這些參數的變化。
以TAWSS(以符號TAWSS表示)評估心動周期內壁面切應力高低,計算方法如式(5)所示:
 |
其中,T表示一個心動周期時長,取定值為0.95 s;WSS(t)表示不同時刻的壁面切應力。
以OSI(以符號OSI表示)評估心動周期內壁面切應力方向變化快慢,計算方法如式(6)所示:
 |
其中,以TAWSS < 0.57 Pa為低切區[11],OSI > 0.3為高振蕩區[21],通過分析低切區與高振蕩區在各主動脈片段中的面積占比來反映截肢后主動脈切應力變化趨勢。
2 結果
2.1 截肢對血流量及血壓的影響
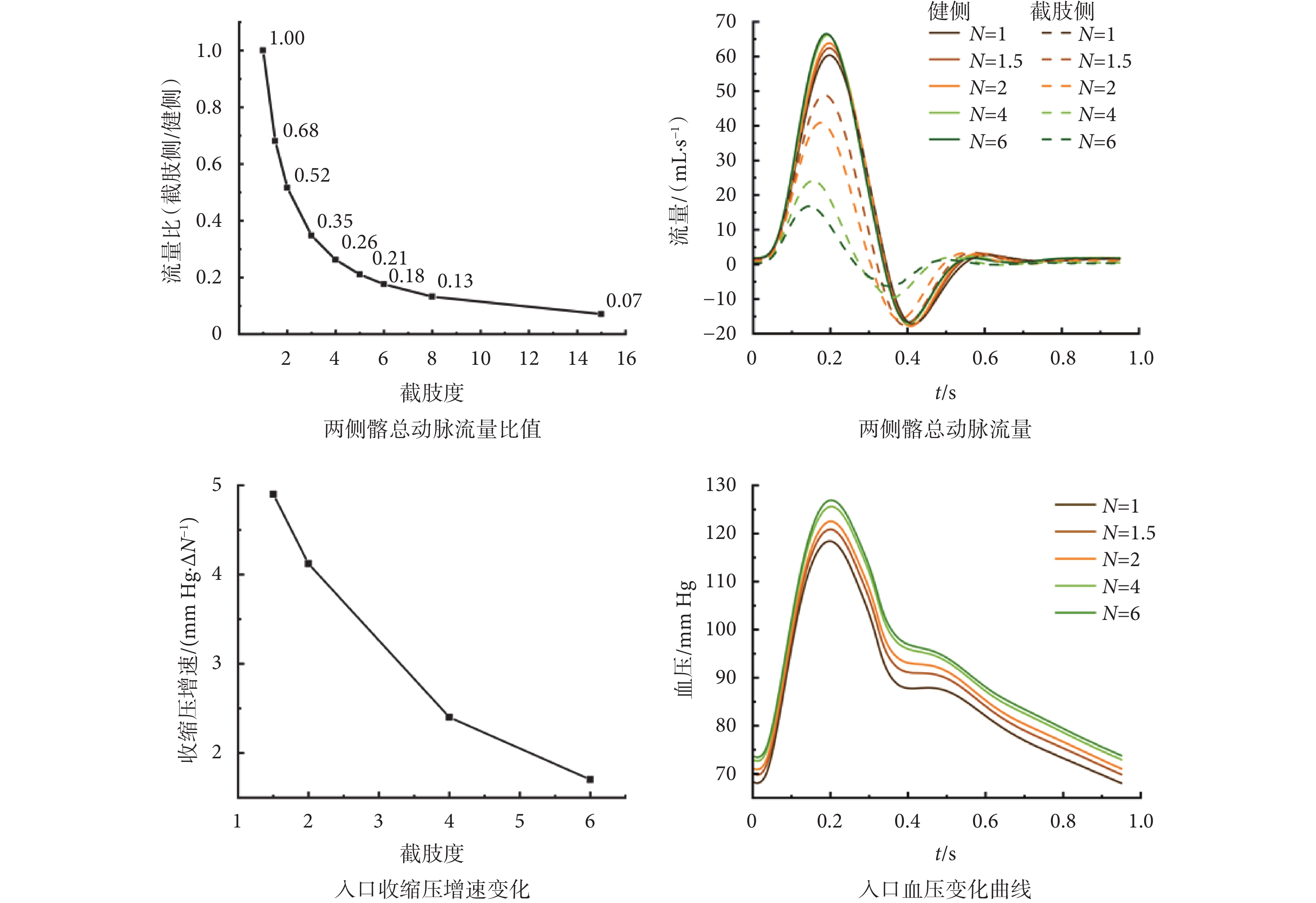
不同截肢度髂總動脈血流量及主動脈入口壓力變化如圖2所示。右下肢按不同比例截肢后,截肢側與健側髂動脈流量比與截肢度呈反比例關系,N > 6后流量比趨于穩定,故本文探討的最大截肢度為N = 6。截肢后兩側髂動脈流量提前,健側髂動脈流量峰值逐漸增加,反流峰值基本不變;截肢側髂動脈流量峰值逐漸減小,N ≤ 4時流量峰值降低速度快于反流峰值降低速度,在一個心動周期內,反流占比增加,而N > 4后反流占比減小;兩側髂動脈流量變化使得腎下腹主動脈的反流占比在N = 2前后先增后減。至于血管壓力,截肢后主動脈血壓升高,截肢度N越大血壓增加量越大,但隨截肢度增加壓力增速放緩,可推測最終入口收縮壓與舒張壓會增至某一閾值,但該閾值低于高血壓標準,即截肢后患者血壓偏高,但不會直接出現高血壓現象。除此之外,截肢后截肢側壓力提前,使主動脈分叉處壓力隨時間呈左高右低或左低右高的不對稱分布;且截肢側收縮壓較健側略有提升(小于1 mm Hg)。
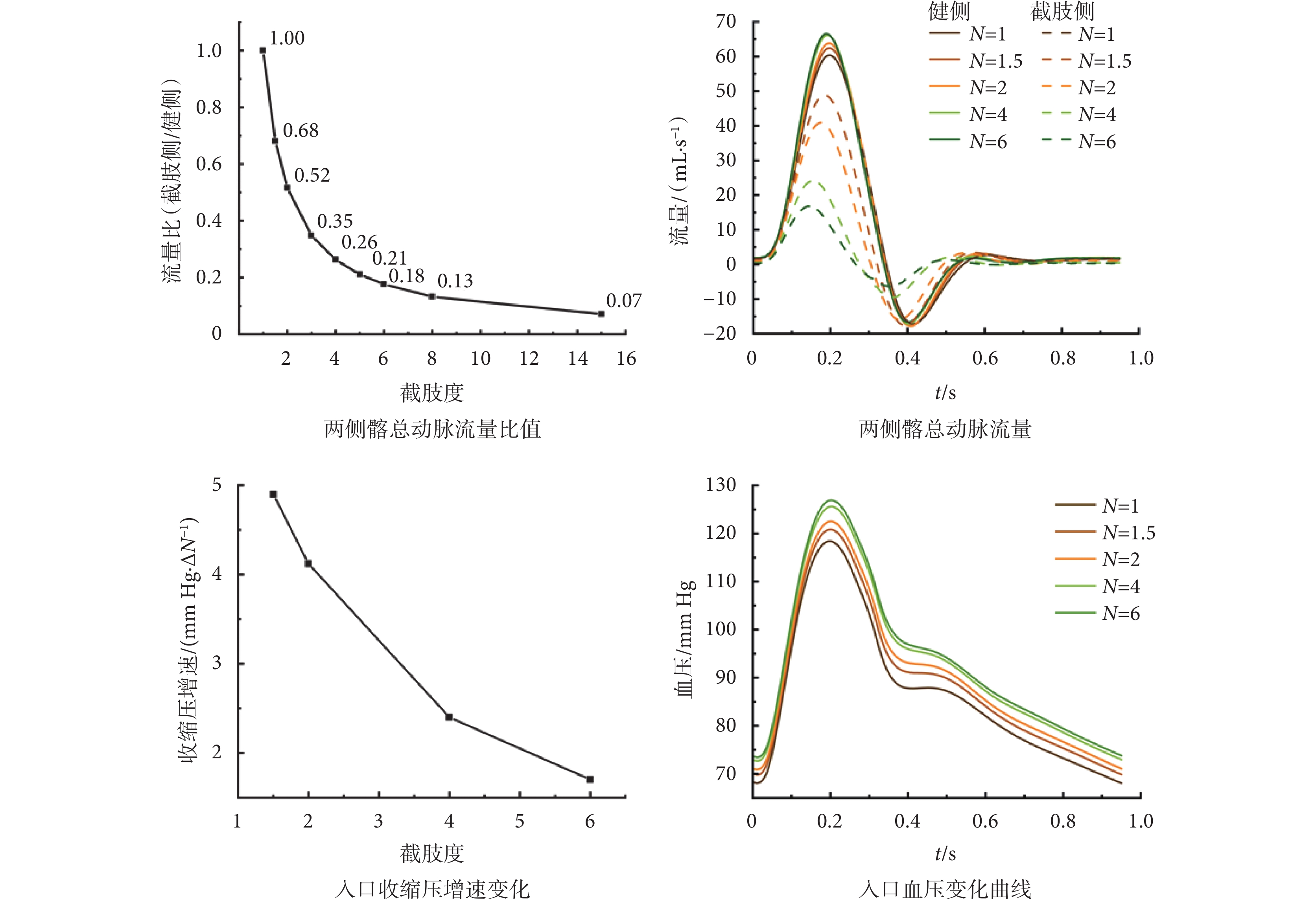 圖2
不同截肢度髂動脈血流量及主動脈入口血壓變化
Figure2.
Changes of common iliac artery blood flow and aortic inlet blood pressure in different amputation degrees
圖2
不同截肢度髂動脈血流量及主動脈入口血壓變化
Figure2.
Changes of common iliac artery blood flow and aortic inlet blood pressure in different amputation degrees
2.2 截肢對動脈壁面切應力分布的影響
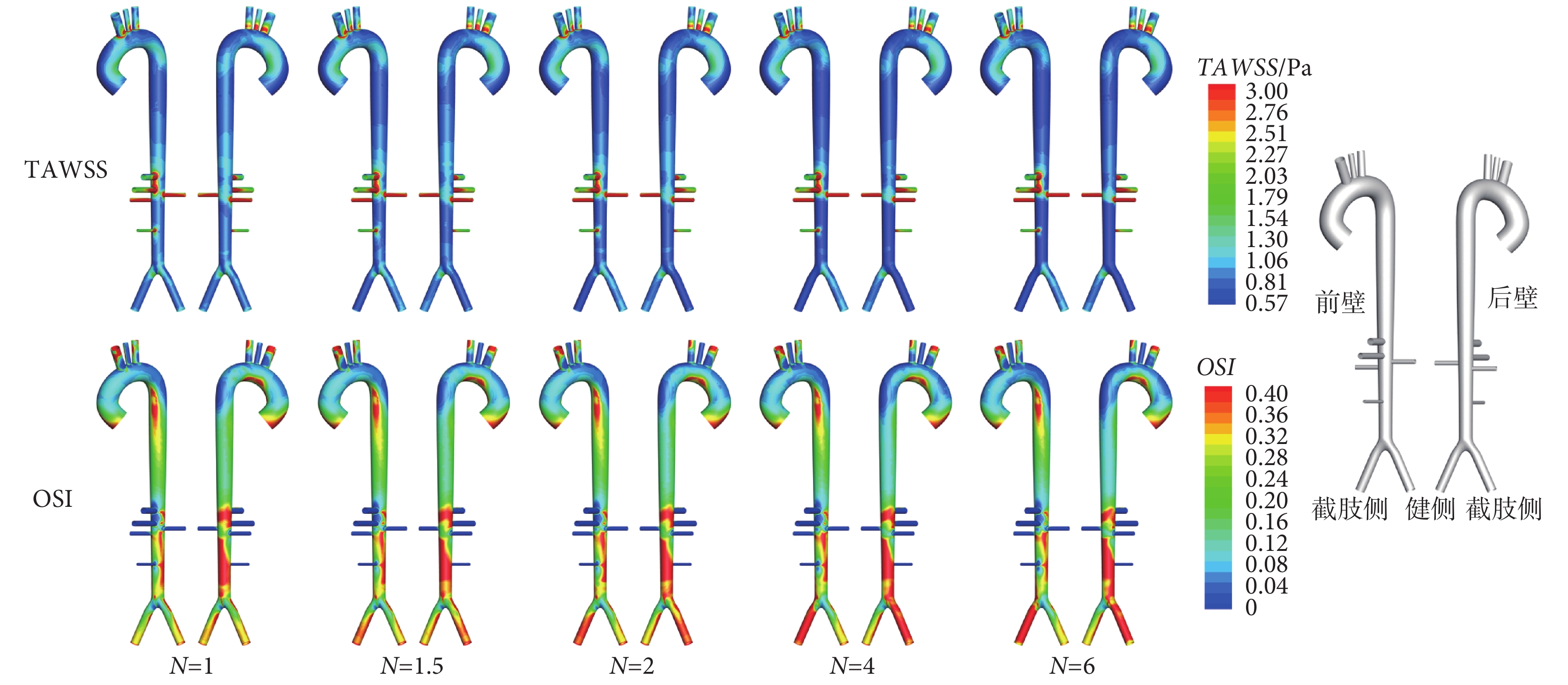
不同截肢度TAWSS與OSI變化如圖3所示。隨截肢度N增大,頭臂干、腹腔干、腎動脈等分支血管因血流量增加,TAWSS有小幅度提升,OSI無明顯變化;但是截肢側髂動脈TAWSS快速下降,且管內回流加強,OSI以N = 4為界先增后減;而主動脈AOA至AA Ⅲ片段,TAWSS呈下降趨勢,OSI變化不顯著。
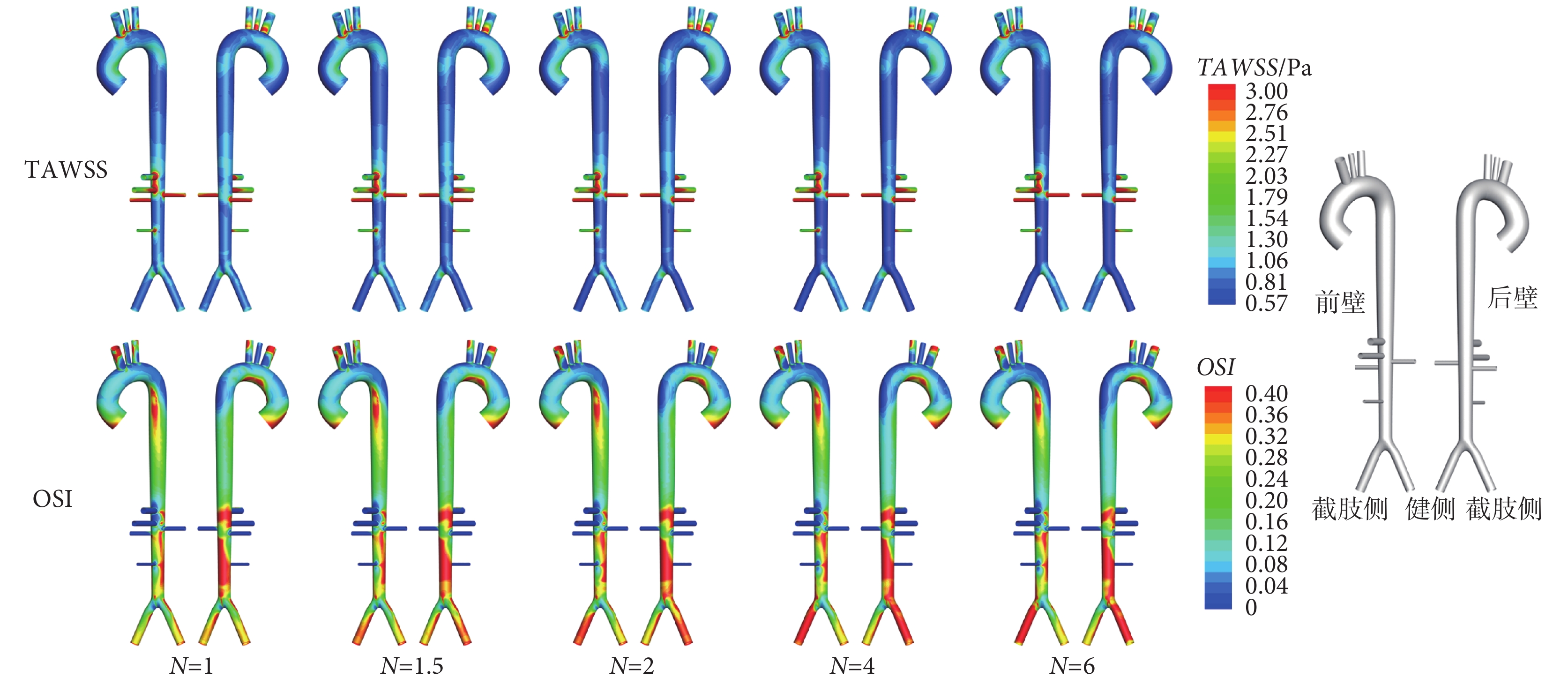 圖3
不同截肢度主動脈TAWSS與OSI變化
Figure3.
Changes of TAWSS and OSI at different amputation degrees
圖3
不同截肢度主動脈TAWSS與OSI變化
Figure3.
Changes of TAWSS and OSI at different amputation degrees
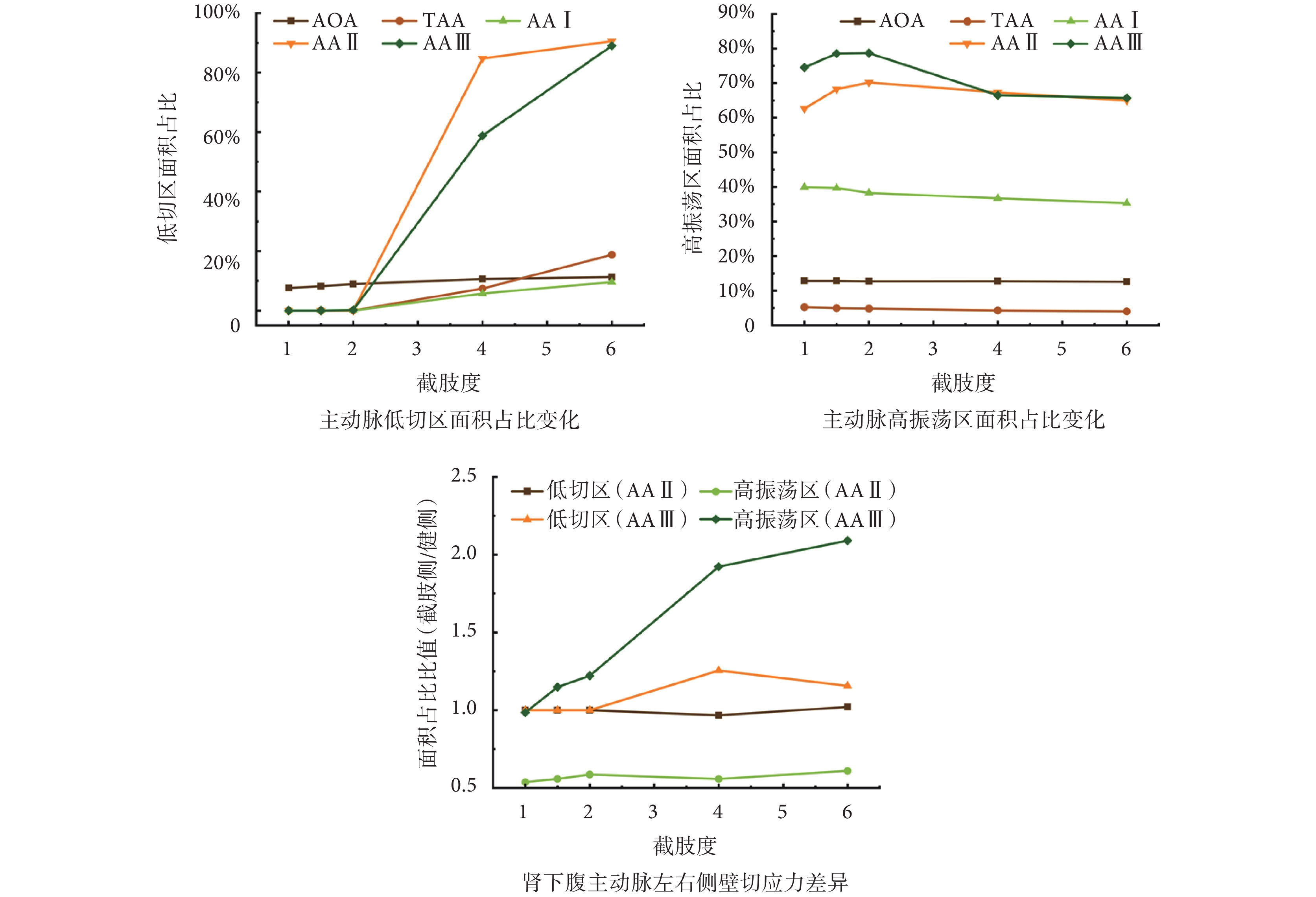
為了更細致了解主動脈壁面切應力分布規律,針對主動脈各片段低切區與高振蕩區面積占比進行了定量分析,如圖4所示。結果發現,截肢對AOA及TAA段影響較小,切應力變化主要集中于腹主動脈,又以腎下腹主動脈(AA II與AA III)最為明顯。腎下主動脈低切區面積在N > 2后迅速增大,至N = 6時80%以上區域均處于低切應力狀態;而腹主動脈高振蕩區占比以N = 2為分界先增加后減小,與前述腹主動脈反流占比變化規律一致。
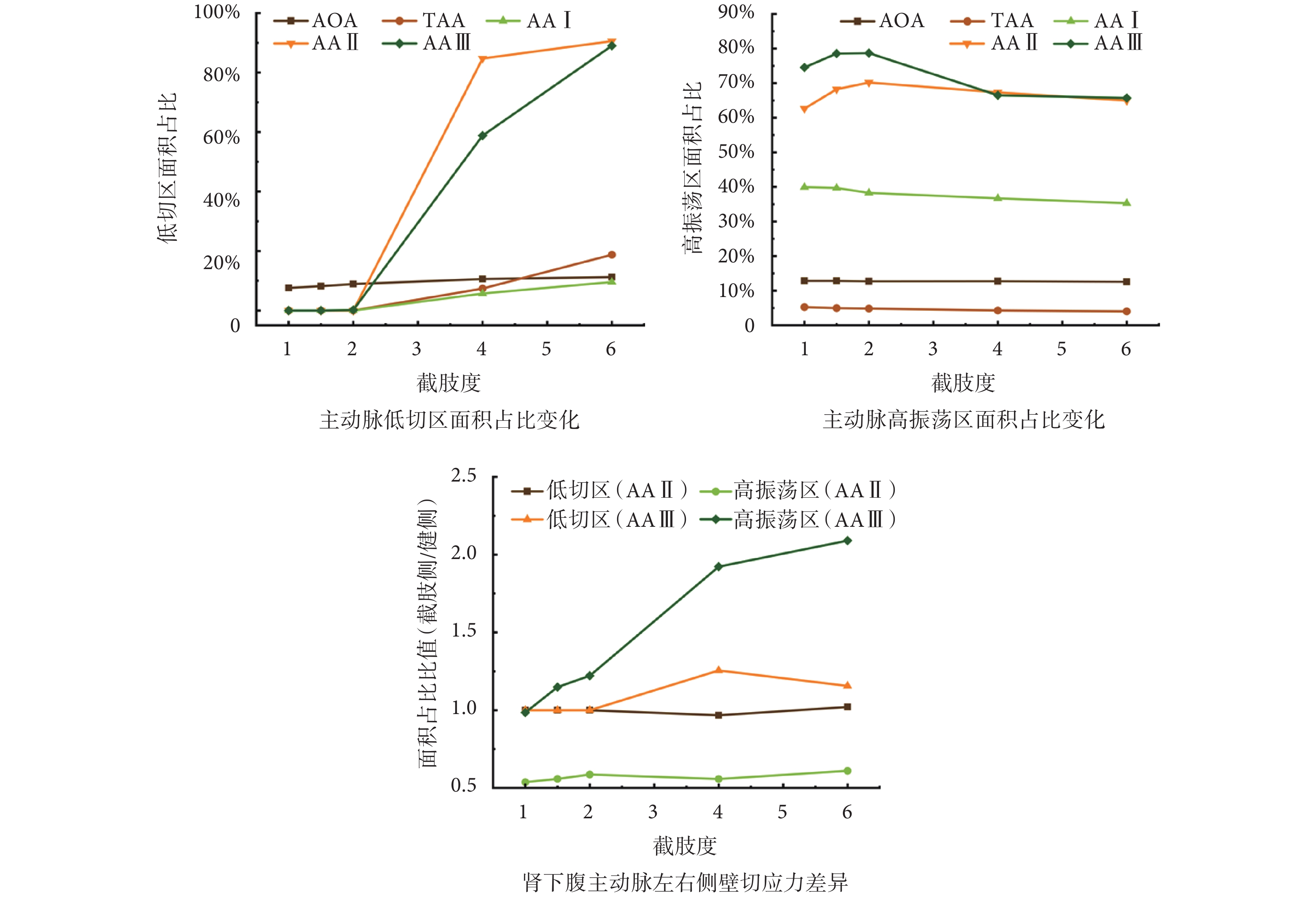 圖4
主動脈各片段低切區與高振蕩區面積占比變化及左右側壁面切應力差異
Figure4.
Changes in the proportion of low-TAWSS and high-OSI in aorta regions and difference of TAWSS and OSI between left and right walls
圖4
主動脈各片段低切區與高振蕩區面積占比變化及左右側壁面切應力差異
Figure4.
Changes in the proportion of low-TAWSS and high-OSI in aorta regions and difference of TAWSS and OSI between left and right walls
截肢后不對稱血流對主動脈分叉近端流場影響顯著,因此對腎下腹主動脈健側與截肢側(左右側壁)切應力進行對比分析,如圖4所示。由于幾何構造差異,AA II段截肢側高振蕩區僅為健側一半,但TAWSS分布較為均勻,且兩者分布受截肢影響不大。與之不同的是,隨截肢度N增加,AA III段的TAWSS與OSI呈現出明顯的非對稱性,N > 2后截肢側低切區面積更大,且該側血液流場變化更為復雜,OSI差異持續增大。
3 討論
現有臨床調研將下肢截肢患者心血管疾病高發歸因于肥胖、少運動等常規高危因素。盡管血流動力學對主動脈的影響已廣受認可,但仍然少有人關注截肢者此方面的改變,為此本文建立健康人外傷截肢模型,探討肢后外周阻抗變化引起的血流動力學環境改變對人體心血管系統的影響。
健康組(N = 1)的結果顯示,各分支出口的心搏出量占比和入口收縮壓、舒張壓均在生理范圍內[12, 15–18];其TAWSS在AAⅠ段后壁、AA Ⅱ段近端、髂動脈近端外壁較低,在髂動脈近端內壁較高,分布規律與Taylor等[22]的研究吻合。此外,右下肢截肢使血流量減少,當N = 2時,截肢側髂動脈流量僅為健側的52%,這與臨床對截肢者血流量變化的調查結果(截肢側流量為健側的53.6%、42.6%)一致[23-24];同時腹主動脈流向下肢的血流量因截肢減少,導致該段流速降低,必將使腹主動脈TAWSS出現下降,而本文結果也證實了這一規律。最后,截肢使主動脈血壓升高,這一現象符合關于阻抗變化對心血管影響的現有研究[15, 18]。由此可見,本文所建立的計算模型與結果能夠反映正常人的血流動力學特征以及截肢對血流動力學的影響。
在異常自身調節與等長自身調節作用下,人體心輸出量不會因心臟后負荷增加,即主動脈壓力增大,而出現劇烈變化[25]。在此基礎上增大殘肢髂動脈遠端阻抗,主動脈反射波提前、血壓升高。過高的血壓易促使血管向內增厚,管徑縮小,以致于降低動脈順應性并增加阻抗,進一步提高血壓[26],這可能是膝上截肢者有更大高血壓比例的原因[3]。而長期的主動脈高壓會導致心臟出現病理性病變,如左心室肥大,此時將減小心博出量[27],促使其他心血管疾病的出現。然而,Hoshina等[28]結扎大鼠髂動脈后并未發現血壓升高,臨床上對截肢是否會造成高血壓也存在爭議[2, 29]。事實上,在血壓波動時,生物體可通過壓力感受性反射進行快速調節,以維持機體血壓穩定[30],因此截肢后增加的血壓在生理上不會立即體現,不過這種反饋調節機制存在閾值,在同樣生活方式下,截肢者有更大的高血壓風險。
此外,截肢使得截肢側髂動脈TAWSS降低且OSI增大,腎下腹主動脈TAWSS降低且TAWSS與OSI分布不對稱,N > 2時上述現象更加突出。已有大量研究表明,機械力是細胞功能的重要調節劑,而內皮細胞對壁面切應力高度敏感[31-32]。較低或振蕩的切應力會誘導血管出現炎癥,加速內皮細胞損傷,使脂質等大分子更易在內皮下聚集,促進動脈粥樣硬化相關基因表達[33-34],促使粥樣硬化斑塊的出現[10, 35-36],同時也會導致管壁進行萎縮型血管重塑[11, 37]。因此,在創傷性下肢截肢的患者中,截肢后血流動力學環境的改變會加速患者髂動脈及腹主動脈硬化,且截肢平面越高截肢側髂動脈越易發生血管萎縮,這提醒醫生要注重殘肢血管狹窄問題,避免因外周血管疾病導致二次截肢。另外,類似于脊髓損傷的阻力性血流動力學條件,截肢極大地減少了主動脈遠端血流,隨之出現的低且振蕩的壁面切應力將促使一系列蛋白水解酶的釋放,導致主動脈中層破壞、血管平滑肌細胞凋亡和功能障礙[38],改變血管力學性質與生理狀態,且伴隨截肢后增加的主動脈壓力,易引起動脈瘤擴張[39-41],動物實驗與臨床調研也證實這一點[4, 28]。再者,有統計研究表示這種動脈瘤呈現向截肢側突起的不對稱形態[4],可能是因為截肢側腹主動脈壁有更大的高振蕩區與低切區,使得本側動脈壁更易受到損傷。而Doyle等[42]在計算中引入不對稱血管,發現動脈瘤峰值壁應力增加48%,由此可知截肢后產生的側突腹主動脈瘤破裂風險也更高,因此對于單側膝上截肢患者,臨床應對其腹主動脈給予額外關注。最后,雖然計算結果顯示主動脈弓及胸主動脈的血流動力學環境變化不大,但仍不可忽視下肢截肢對腎上主動脈的影響。畢竟人體作為一個循環整體,髂動脈和腹主動脈處產生的病變,最終仍可能影響包括心臟在內的上游血管系統。
盡管在康復期,患者殘肢的側支血管會因壁面切應力增加而促使管腔增大,快速建立新的末端循環系統[43-44],使遠端阻抗較截肢術后出現回降,改善血流環境。但目前這種改善是依賴患者自身的生理調節以及術后和康復階段的治療,很難恢復到截肢前的正常生理水平。因此,有必要在康復過程中采用促血管再生和擴張的手段促進末端循環系統的形成;同時加強腿部運動,強化殘肢肌肉,增加下行血流[39],以緩解截肢后的不對稱血流動力學狀況。
截肢后主動脈血壓升高、TAWSS降低、腎下腹主動脈切應力分布不對稱且髂動脈OSI顯著增大,提示應注重截肢患者心血管護理。截肢者下肢血管易狹窄和萎縮,膝上截肢者腹主動脈易出現不對稱動脈瘤,此二處應被給予重點關注。而更大的高血壓風險意味著患者需保持更健康的生活方式;并且也應加強殘肢鍛煉,減少肌肉萎縮。
4 結論
本文通過改變末端阻抗研究不同截肢水平對患者心血管系統的影響。研究發現,截肢后患者血壓升高,腎下主動脈出現不對稱的、低且振蕩的壁面切應力,易導致高血壓、動脈粥樣硬化、側突腹主動脈瘤以及下肢血管萎縮和狹窄。本文初步揭示了下肢截肢對心血管疾病的影響規律,為研究截肢后心血管疾病預防和治療、患者康復訓練設計,以及與此相關的體外實驗研究提供了理論指導。
重要聲明
利益沖突聲明:本文全體作者均聲明不存在利益沖突。
作者貢獻聲明:蔣文濤主要負責項目主持、程序算法設計、協調溝通、計劃安排以及論文審閱修訂;魏君如主要負責耦合算法設計與編寫、仿真計算、數據分析及論文編寫;李忠友主要負責數據分析指導及論文審閱修訂;刁珺杰、李瀟、閔磊參與結果討論及論文審閱修訂;晏菲主要負責算法設計及數據分析指導。
引言
下肢截肢術是為挽救患者生命所進行的一種不可逆的醫療手段,截肢的主要原因包括腿部嚴重創傷與感染、股動脈閉塞與栓塞、糖尿病足以及惡性腫瘤等。對于截肢后的治療和康復,臨床主要關注的是殘肢本身,而統計學研究發現截肢者心血管疾病致死率是普通人的2.2倍[1]、毀容軍人的1.6倍[2],患缺血性心臟病比率是普通人的2倍[3],患腹主動脈瘤比率是普通人的5.3倍[4]。由此可見,對截肢患者心血管疾病的關注不容忽視。
為解釋截肢與心血管疾病的關系,前期已有很多相關研究,如Frugoli等[5]認為截肢患者運動量減少,肥胖和高血壓頻發,因而心血管疾病發病率增高;Peles等[6]研究發現,截肢者易出現與心血管疾病危險因素聚集有關的胰島素抵抗;Bhatnagar等[7]進行回顧性分析指出,下肢截肢者患代謝綜合征幾率更高,且雙側截肢患病率高于單側(21.9% vs. 14.9%)。然而,這些研究均無法解釋不同截肢高度以及單、雙側截肢后心血管疾病死亡率與發病率的差異[4, 8],如膝上截肢死亡率高于膝下截肢(76.6% vs. 63.1%)[9],雙側膝上截肢發病率高于單側膝上截肢(17.5% vs. 11.8%)[2]等。而除開上述致病因素,血流動力學環境改變對心血管疾病的影響已受到廣泛認可,例如低或振蕩的壁面切應力可加速內皮細胞損傷,促進動脈瘤與粥樣硬化斑塊的出現[10-11],但縱觀已有研究,少有文獻涉及截肢對血流動力學環境的改變及其與心血管疾病的關系。事實上,術后患者腿部肢體缺失,血管樹結構變化,血液正常流動受阻,這均可總結為外周阻抗的改變,然而截肢后出現的外周阻抗變化會對主動脈血流環境造成何種影響尚不清楚,能否從新的角度厘清截肢和心血管疾病的聯系還需進一步研究。
因此,本文建立了從升主動脈至主—髂分叉的理想幾何模型,通過改變單側髂總動脈遠端阻抗模擬不同截肢水平,分析了血壓、時均壁面切應力(time averaged wall shear stress,TAWSS)和振蕩剪切指數(oscillatory shear index,OSI)等血流動力學參數,探尋截肢后主動脈血流動力學環境變化規律,為揭示截肢對心血管疾病影響的血流動力學機制提供理論支撐。
1 模型與方法
1.1 幾何模型
為使研究具有普遍性和可比性,避免個性化差異對結果的影響,本文利用三維建模軟件Solidworks 2017(Dassault Systemes Inc.,美國)建立主動脈理想化幾何模型,模型尺寸來自Xiao等[12]的研究,如圖1所示。模型包括主動脈(升主動脈至主—髂分叉)與分支動脈(分別為頭臂干、左頸總動脈、左鎖骨下動脈、腹腔干、上下腸系膜動脈、左右腎動脈、左右髂總動脈)。將模型導入計算機輔助工程前處理軟件ICEM CFD 17.0(ANSYS Inc.,美國)進行非結構四面體網格劃分,壁面邊界采用5層棱柱型網格加密,在穩態計算中進行敏感性分析保證了網格獨立性,最終獲得網格單元數量962 270個。此外,為便于結果分析,將主動脈分為多個片段:主動脈弓段(aortic arch,AOA)、胸主動脈段(thoracic aorta,TAA)、腹主動脈I段(abdominal aorta Ⅰ,AA Ⅰ)、腹主動脈II段(abdominal aorta Ⅱ,AA Ⅱ)以及腹主動脈III段(abdominal aorta Ⅲ,AA Ⅲ)。
 圖1
主動脈理想化幾何模型、非結構四面體網格及邊界層、入口流量曲線與風箱模型
Figure1.
Idealized geometric model of aorta, unstructured tetrahedral meshes and boundary layers, inlet flow rate and Windkessel model
圖1
主動脈理想化幾何模型、非結構四面體網格及邊界層、入口流量曲線與風箱模型
Figure1.
Idealized geometric model of aorta, unstructured tetrahedral meshes and boundary layers, inlet flow rate and Windkessel model
1.2 控制方程
假定血液為各向同性的不可壓縮牛頓流體,血管壁為剛性無滑移壁面。血液流動的控制方程可由連續性方程和納維-斯托克斯(Navier-Stokes)方程表達,如式(1)和式(2)所示:
 |
 |
其中,u、P、ρ和μ分別為流體速度、壓力、血液密度(ρ=1 050 kg/m3)以及動力粘度(μ=0.003 5 Pa·s)。三維流場的計算在有限體積法商業軟件FLUENT 17.0(ANSYS Inc.,美國)中進行,由基于壓力耦合方程組的半隱式方法實現壓力—速度耦合,選擇基于網格的最小二乘法, 二階和二階迎風格式對梯度、壓力與動量進行離散。
1.3 邊界條件
如圖1所示,模型入口選擇升主動脈脈動流Q0;各出口均連接一個3參數風箱(3 Windkessel, 3WK)模型[12]。3WK模型包括代表大動脈對血液流動阻力的近端阻抗Rp、代表小動脈及毛細血管阻力的遠端阻抗Rd以及代表血管順應性的電容C。由基爾霍夫定律,各出口壓力和流量的關系如式(3)所示:
 |
其中,Q、P分別為各出口截面的瞬時平均流量和瞬時平均壓力。
根據血管直徑d與文獻[13],獲取正常人各出口平均流量及平均壓力,計算得到外周阻抗Rt = Rp + Rd、總外周阻抗RT [14]與總電容CT[12];近端阻抗Rp采用對應一維模型特征阻抗[12];電容C由總電容CT按各出口生理流量占比進行分配[15–18]。正常人各出口邊界3WK模型參數及計算所得心搏出量占比如表1所示。
通過用戶自定義函數,在每個三維計算時間步,傳遞出口截面上的流量與壓力,并由顯式歐拉法求解如式(3)所示的常微分方程,實現零維的3WK模型與三維模型的耦合,時間步長為0.005 s,一個心動周期為0.95 s,5個心動周期后計算收斂,取最后一個周期數據進行分析。
1.4 截肢模型
下肢截肢將丟失部分下肢血液循環系統,盡管原有側支血管可維持一部分血液回心,但手術造成了主要動靜脈結扎,血液正常流動受阻,表現為外周阻抗Rt增加[19];而在短期內與血管直徑、脈搏波速度相關的近端阻抗Rp并不會出現明顯變化,因此可通過改變遠端阻抗Rd來模擬不同截肢水平。基于此,用術后單側髂動脈遠端阻抗Rd*與正常人髂動脈遠端阻抗Rd0的比值定義截肢嚴重程度,以截肢度N表示,如式(4)所示:
 |
由此設計5組模型,研究正常人因外傷導致右下肢截肢后主動脈血流動力學變化:模型一,為健康組(N = 1),出口邊界由前述方法確定;模型二至模型五,分別對應經脛骨截肢(N = 1.5)、膝離斷(N = 2)、經股骨截肢(N = 4)和髖離斷(N = 6)。其中,右下肢側稱為截肢側,左下肢側稱為健側。
肢體丟失后血管可儲存血量減小,表現為外周血管順應性降低,又考慮到任何一維舒張壓衰減時間常數CTRT為一定值[14],且遠端阻抗Rd遠大于近端阻抗Rp [20],本文忽略近端阻抗Rp對電容C的影響,認為截肢后截肢側電容C減小N倍,即C = C0/N。
1.5 主要血流動力學參數
由于血壓是心血管疾病高危因素,而壁面切應力是影響血管內皮細胞結構和功能的重要指標,與血管病變密切相關[10-11],因此本文重點比較截肢前后主動脈這些參數的變化。
以TAWSS(以符號TAWSS表示)評估心動周期內壁面切應力高低,計算方法如式(5)所示:
 |
其中,T表示一個心動周期時長,取定值為0.95 s;WSS(t)表示不同時刻的壁面切應力。
以OSI(以符號OSI表示)評估心動周期內壁面切應力方向變化快慢,計算方法如式(6)所示:
 |
其中,以TAWSS < 0.57 Pa為低切區[11],OSI > 0.3為高振蕩區[21],通過分析低切區與高振蕩區在各主動脈片段中的面積占比來反映截肢后主動脈切應力變化趨勢。
2 結果
2.1 截肢對血流量及血壓的影響
不同截肢度髂總動脈血流量及主動脈入口壓力變化如圖2所示。右下肢按不同比例截肢后,截肢側與健側髂動脈流量比與截肢度呈反比例關系,N > 6后流量比趨于穩定,故本文探討的最大截肢度為N = 6。截肢后兩側髂動脈流量提前,健側髂動脈流量峰值逐漸增加,反流峰值基本不變;截肢側髂動脈流量峰值逐漸減小,N ≤ 4時流量峰值降低速度快于反流峰值降低速度,在一個心動周期內,反流占比增加,而N > 4后反流占比減小;兩側髂動脈流量變化使得腎下腹主動脈的反流占比在N = 2前后先增后減。至于血管壓力,截肢后主動脈血壓升高,截肢度N越大血壓增加量越大,但隨截肢度增加壓力增速放緩,可推測最終入口收縮壓與舒張壓會增至某一閾值,但該閾值低于高血壓標準,即截肢后患者血壓偏高,但不會直接出現高血壓現象。除此之外,截肢后截肢側壓力提前,使主動脈分叉處壓力隨時間呈左高右低或左低右高的不對稱分布;且截肢側收縮壓較健側略有提升(小于1 mm Hg)。
 圖2
不同截肢度髂動脈血流量及主動脈入口血壓變化
Figure2.
Changes of common iliac artery blood flow and aortic inlet blood pressure in different amputation degrees
圖2
不同截肢度髂動脈血流量及主動脈入口血壓變化
Figure2.
Changes of common iliac artery blood flow and aortic inlet blood pressure in different amputation degrees
2.2 截肢對動脈壁面切應力分布的影響
不同截肢度TAWSS與OSI變化如圖3所示。隨截肢度N增大,頭臂干、腹腔干、腎動脈等分支血管因血流量增加,TAWSS有小幅度提升,OSI無明顯變化;但是截肢側髂動脈TAWSS快速下降,且管內回流加強,OSI以N = 4為界先增后減;而主動脈AOA至AA Ⅲ片段,TAWSS呈下降趨勢,OSI變化不顯著。
 圖3
不同截肢度主動脈TAWSS與OSI變化
Figure3.
Changes of TAWSS and OSI at different amputation degrees
圖3
不同截肢度主動脈TAWSS與OSI變化
Figure3.
Changes of TAWSS and OSI at different amputation degrees
為了更細致了解主動脈壁面切應力分布規律,針對主動脈各片段低切區與高振蕩區面積占比進行了定量分析,如圖4所示。結果發現,截肢對AOA及TAA段影響較小,切應力變化主要集中于腹主動脈,又以腎下腹主動脈(AA II與AA III)最為明顯。腎下主動脈低切區面積在N > 2后迅速增大,至N = 6時80%以上區域均處于低切應力狀態;而腹主動脈高振蕩區占比以N = 2為分界先增加后減小,與前述腹主動脈反流占比變化規律一致。
 圖4
主動脈各片段低切區與高振蕩區面積占比變化及左右側壁面切應力差異
Figure4.
Changes in the proportion of low-TAWSS and high-OSI in aorta regions and difference of TAWSS and OSI between left and right walls
圖4
主動脈各片段低切區與高振蕩區面積占比變化及左右側壁面切應力差異
Figure4.
Changes in the proportion of low-TAWSS and high-OSI in aorta regions and difference of TAWSS and OSI between left and right walls
截肢后不對稱血流對主動脈分叉近端流場影響顯著,因此對腎下腹主動脈健側與截肢側(左右側壁)切應力進行對比分析,如圖4所示。由于幾何構造差異,AA II段截肢側高振蕩區僅為健側一半,但TAWSS分布較為均勻,且兩者分布受截肢影響不大。與之不同的是,隨截肢度N增加,AA III段的TAWSS與OSI呈現出明顯的非對稱性,N > 2后截肢側低切區面積更大,且該側血液流場變化更為復雜,OSI差異持續增大。
3 討論
現有臨床調研將下肢截肢患者心血管疾病高發歸因于肥胖、少運動等常規高危因素。盡管血流動力學對主動脈的影響已廣受認可,但仍然少有人關注截肢者此方面的改變,為此本文建立健康人外傷截肢模型,探討肢后外周阻抗變化引起的血流動力學環境改變對人體心血管系統的影響。
健康組(N = 1)的結果顯示,各分支出口的心搏出量占比和入口收縮壓、舒張壓均在生理范圍內[12, 15–18];其TAWSS在AAⅠ段后壁、AA Ⅱ段近端、髂動脈近端外壁較低,在髂動脈近端內壁較高,分布規律與Taylor等[22]的研究吻合。此外,右下肢截肢使血流量減少,當N = 2時,截肢側髂動脈流量僅為健側的52%,這與臨床對截肢者血流量變化的調查結果(截肢側流量為健側的53.6%、42.6%)一致[23-24];同時腹主動脈流向下肢的血流量因截肢減少,導致該段流速降低,必將使腹主動脈TAWSS出現下降,而本文結果也證實了這一規律。最后,截肢使主動脈血壓升高,這一現象符合關于阻抗變化對心血管影響的現有研究[15, 18]。由此可見,本文所建立的計算模型與結果能夠反映正常人的血流動力學特征以及截肢對血流動力學的影響。
在異常自身調節與等長自身調節作用下,人體心輸出量不會因心臟后負荷增加,即主動脈壓力增大,而出現劇烈變化[25]。在此基礎上增大殘肢髂動脈遠端阻抗,主動脈反射波提前、血壓升高。過高的血壓易促使血管向內增厚,管徑縮小,以致于降低動脈順應性并增加阻抗,進一步提高血壓[26],這可能是膝上截肢者有更大高血壓比例的原因[3]。而長期的主動脈高壓會導致心臟出現病理性病變,如左心室肥大,此時將減小心博出量[27],促使其他心血管疾病的出現。然而,Hoshina等[28]結扎大鼠髂動脈后并未發現血壓升高,臨床上對截肢是否會造成高血壓也存在爭議[2, 29]。事實上,在血壓波動時,生物體可通過壓力感受性反射進行快速調節,以維持機體血壓穩定[30],因此截肢后增加的血壓在生理上不會立即體現,不過這種反饋調節機制存在閾值,在同樣生活方式下,截肢者有更大的高血壓風險。
此外,截肢使得截肢側髂動脈TAWSS降低且OSI增大,腎下腹主動脈TAWSS降低且TAWSS與OSI分布不對稱,N > 2時上述現象更加突出。已有大量研究表明,機械力是細胞功能的重要調節劑,而內皮細胞對壁面切應力高度敏感[31-32]。較低或振蕩的切應力會誘導血管出現炎癥,加速內皮細胞損傷,使脂質等大分子更易在內皮下聚集,促進動脈粥樣硬化相關基因表達[33-34],促使粥樣硬化斑塊的出現[10, 35-36],同時也會導致管壁進行萎縮型血管重塑[11, 37]。因此,在創傷性下肢截肢的患者中,截肢后血流動力學環境的改變會加速患者髂動脈及腹主動脈硬化,且截肢平面越高截肢側髂動脈越易發生血管萎縮,這提醒醫生要注重殘肢血管狹窄問題,避免因外周血管疾病導致二次截肢。另外,類似于脊髓損傷的阻力性血流動力學條件,截肢極大地減少了主動脈遠端血流,隨之出現的低且振蕩的壁面切應力將促使一系列蛋白水解酶的釋放,導致主動脈中層破壞、血管平滑肌細胞凋亡和功能障礙[38],改變血管力學性質與生理狀態,且伴隨截肢后增加的主動脈壓力,易引起動脈瘤擴張[39-41],動物實驗與臨床調研也證實這一點[4, 28]。再者,有統計研究表示這種動脈瘤呈現向截肢側突起的不對稱形態[4],可能是因為截肢側腹主動脈壁有更大的高振蕩區與低切區,使得本側動脈壁更易受到損傷。而Doyle等[42]在計算中引入不對稱血管,發現動脈瘤峰值壁應力增加48%,由此可知截肢后產生的側突腹主動脈瘤破裂風險也更高,因此對于單側膝上截肢患者,臨床應對其腹主動脈給予額外關注。最后,雖然計算結果顯示主動脈弓及胸主動脈的血流動力學環境變化不大,但仍不可忽視下肢截肢對腎上主動脈的影響。畢竟人體作為一個循環整體,髂動脈和腹主動脈處產生的病變,最終仍可能影響包括心臟在內的上游血管系統。
盡管在康復期,患者殘肢的側支血管會因壁面切應力增加而促使管腔增大,快速建立新的末端循環系統[43-44],使遠端阻抗較截肢術后出現回降,改善血流環境。但目前這種改善是依賴患者自身的生理調節以及術后和康復階段的治療,很難恢復到截肢前的正常生理水平。因此,有必要在康復過程中采用促血管再生和擴張的手段促進末端循環系統的形成;同時加強腿部運動,強化殘肢肌肉,增加下行血流[39],以緩解截肢后的不對稱血流動力學狀況。
截肢后主動脈血壓升高、TAWSS降低、腎下腹主動脈切應力分布不對稱且髂動脈OSI顯著增大,提示應注重截肢患者心血管護理。截肢者下肢血管易狹窄和萎縮,膝上截肢者腹主動脈易出現不對稱動脈瘤,此二處應被給予重點關注。而更大的高血壓風險意味著患者需保持更健康的生活方式;并且也應加強殘肢鍛煉,減少肌肉萎縮。
4 結論
本文通過改變末端阻抗研究不同截肢水平對患者心血管系統的影響。研究發現,截肢后患者血壓升高,腎下主動脈出現不對稱的、低且振蕩的壁面切應力,易導致高血壓、動脈粥樣硬化、側突腹主動脈瘤以及下肢血管萎縮和狹窄。本文初步揭示了下肢截肢對心血管疾病的影響規律,為研究截肢后心血管疾病預防和治療、患者康復訓練設計,以及與此相關的體外實驗研究提供了理論指導。
重要聲明
利益沖突聲明:本文全體作者均聲明不存在利益沖突。
作者貢獻聲明:蔣文濤主要負責項目主持、程序算法設計、協調溝通、計劃安排以及論文審閱修訂;魏君如主要負責耦合算法設計與編寫、仿真計算、數據分析及論文編寫;李忠友主要負責數據分析指導及論文審閱修訂;刁珺杰、李瀟、閔磊參與結果討論及論文審閱修訂;晏菲主要負責算法設計及數據分析指導。