介入栓塞治療廣泛用于腫瘤靶向治療、抗器官功能亢進和止血等手術。栓塞劑注射過程中,醫師需要在X線照射環境下工作;而且,栓塞劑注射操作很大程度上依賴于醫生的經驗與手感,栓塞劑的過量注射會導致反流,造成異位栓塞并引發嚴重的并發癥。作為降低射線照射、提高介入栓塞治療成功率的有效手段,栓塞劑注射機器人受到高度期待,但如何決策栓塞劑的推注流速,是一個尚待解決的問題。本文在流體力學仿真和實驗的基礎上,建立了可避免反流的平均動脈壓-注射流速邊界曲線模型,為栓塞劑智能注射系統的控制提供了設計依據,并且搭建了注射系統的體外實驗平臺,進行了驗證實驗。結果顯示,在反流臨界流速曲線模型的引導下設計的栓塞劑注射流速曲線,可有效避免栓塞劑反流,同時縮短栓塞劑注射時間,超出該模型的流速限制將引發正常血管被栓塞的風險。本文確認了依據反流臨界流速曲線設計栓塞劑注射流速的有效性,可在實現栓塞劑的快速注射的同時避免反流,為栓塞劑注射機器人的設計提供了依據。
引用本文: 李嘉晟, 任東城, 周波, 郭士杰, 郭寶磊. 栓塞劑智能注射系統注射流速決策方法研究. 生物醫學工程學雜志, 2022, 39(3): 579-585. doi: 10.7507/1001-5515.202201006 復制
版權信息: ?四川大學華西醫院華西期刊社《生物醫學工程學雜志》版權所有,未經授權不得轉載、改編
引言
介入栓塞治療已廣泛用于腫瘤靶向治療、抗器官功能亢進和止血等手術中。通過介入導管精確注射適量栓塞劑,靶向性阻塞血液流通,可達到多種治療目的,如止血、腫瘤治療、組織切除等[1-2]。栓塞劑注射過程中,醫師需要在X線照射環境下工作,透視靶血管內栓塞劑的流動狀態,以避免發生反流。當栓塞接近預期狀態時,需要降低注射流速,直至栓塞完成[3-4]。在X線照射環境下,醫師不得不穿著厚重的鉛衣,導致疲勞和工作效率下降。而且,即使穿著鉛衣,輻射危害也往往難以避免。此外,栓塞劑注射操作很大程度上依賴于醫生的經驗與感受,而栓塞劑的過量注射會導致反流,造成異位栓塞并引發嚴重的并發癥[5-7],過少的栓塞劑則達不到預期的治療效果。
為了增加介入栓塞手術的安全性和成功率,減少醫生和患者在術中受到輻射的時間,栓塞劑注射機器人的研發受到醫學界的高度期待。機器人技術已廣泛應用于藥液自動注射治療。高壓注射器是介入治療中最常見的藥液自動注射裝置,已廣泛應用于心血管造影檢查、計算機斷層掃描(computed tomography,CT)增強造影掃描和磁共振成像(magnetic resonance imaging,MRI)增強掃描的顯影劑注射。它可在規定的時間內,通過經皮穿刺進入血管或利用人體的自然孔道,將足夠量的高濃度X線造影劑快速、準確地注射到檢查部位[8-10]。但是,現有藥物注射器主要對注射藥物的總量進行精確控制,對于注射流速及其變化并未關注[11]。在介入栓塞治療過程中,栓塞劑通過導管和動脈血管被注射到病變組織的毛細血管中,通過在毛細血管中的積聚,達到堵塞毛細血管、切斷病變組織血液供給的效果。隨著栓塞劑的注射,血流動力學參數如血流量、血壓以及流動阻力會發生變化,這意味著栓塞劑注射流速應隨著栓塞程度的變化而不斷調整,才能保證栓塞劑適量、準確地到達病灶組織。常規的定時、定量注射模式不能滿足栓塞劑注射要求。分析介入栓塞手術過程中的血流動力學參數變化,確定不同栓塞程度下不發生栓塞劑反流的目標注射流速,是實現栓塞劑自動注射的關鍵。
本文首先利用多孔介質對栓塞部位進行了建模,在此基礎上搭建了可模擬介入栓塞手術主要特征的體外實驗平臺;其次,通過流體力學數值仿真分析了栓塞過程的血流動力學變化,結合仿真與實驗,找出了栓塞劑推注過程中的反流臨界流速曲線,并以此為依據,設計栓塞劑注射反饋控制系統;最后,開展體外實驗,驗證模型引導下的栓塞劑自動注射效果,實現快速且不出現反流的栓塞劑注射。
1 體外實驗平臺搭建
在介入栓塞治療中,最終栓塞的部位往往是腎臟、肝臟等器官的毛細血管,直徑小且空間結構復雜,無論是用于計算流體力學仿真的幾何模型還是體外實驗平臺中的結構表達,都難以復刻真實的血管形狀。為了搭建可表征介入栓塞手術主要特征且有工程實現價值的體外實驗平臺,有必要建立栓塞部位的流體力學模型。
1.1 流體力學建模
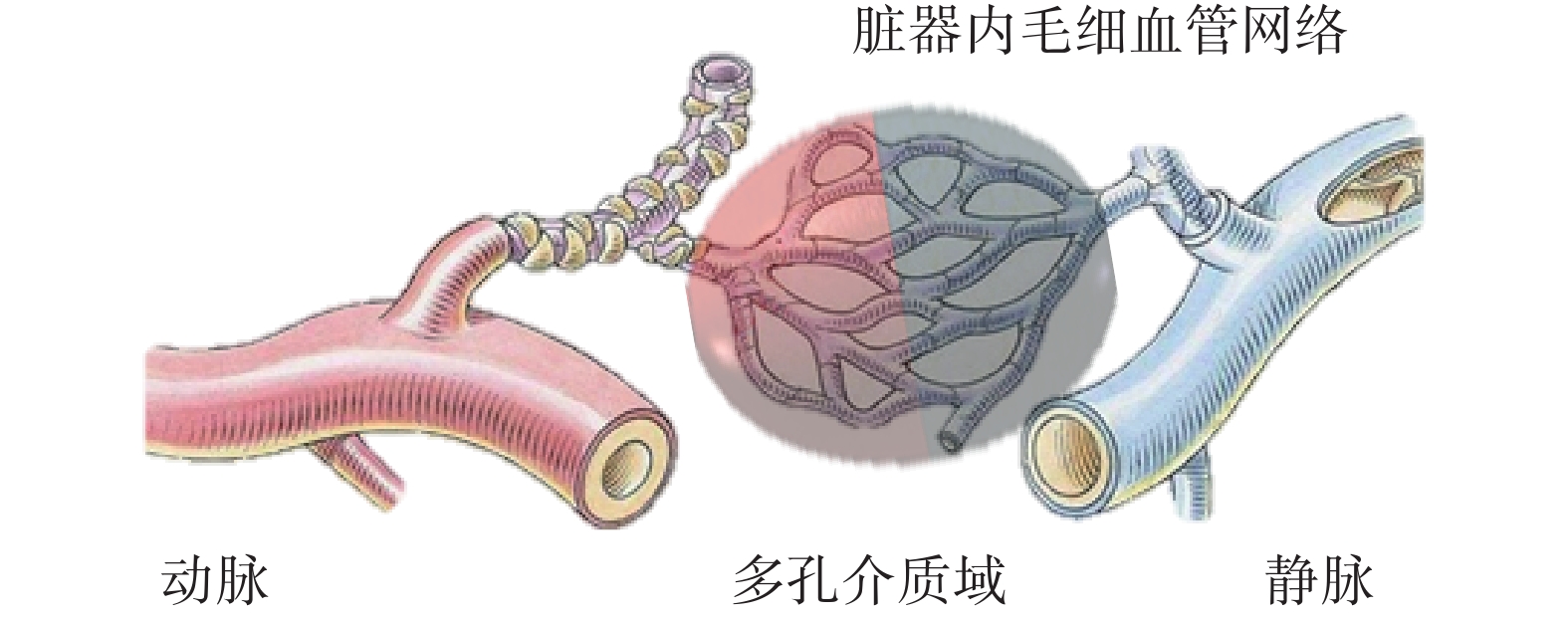
由于器官毛細血管多孔隙、幾何結構復雜等原因,傳統的流體力學模型不適合于栓塞劑注射過程血流動力學建模。本文著眼于栓塞劑注射機器人的設計,重點關注栓塞劑進入血管后血液的整體流動,而不是栓塞劑在毛細血管內被輸送的過程。多孔介質模型是解決上述問題的有效方法,已被廣泛用于研究人體或動物組織中的血液和組織液流動特性,如使用多孔介質模擬腫瘤和肌肉中的血流狀態[12-13]或藥物和營養物質在組織中的轉運過程[14-15],以及將臟器組織作為多孔介質研究組織傳熱過程中的血流情況等[16-18]。在介入栓塞治療方面,用于治療顱內動脈瘤的顱內支架多孔介質建模的相關研究較為多見[19]。
栓塞部位的毛細血管可等效為多孔介質域(見圖1)[20-22]。栓塞所產生的血液流動阻力可通過流經多孔介質域的動量損失表示[23]:
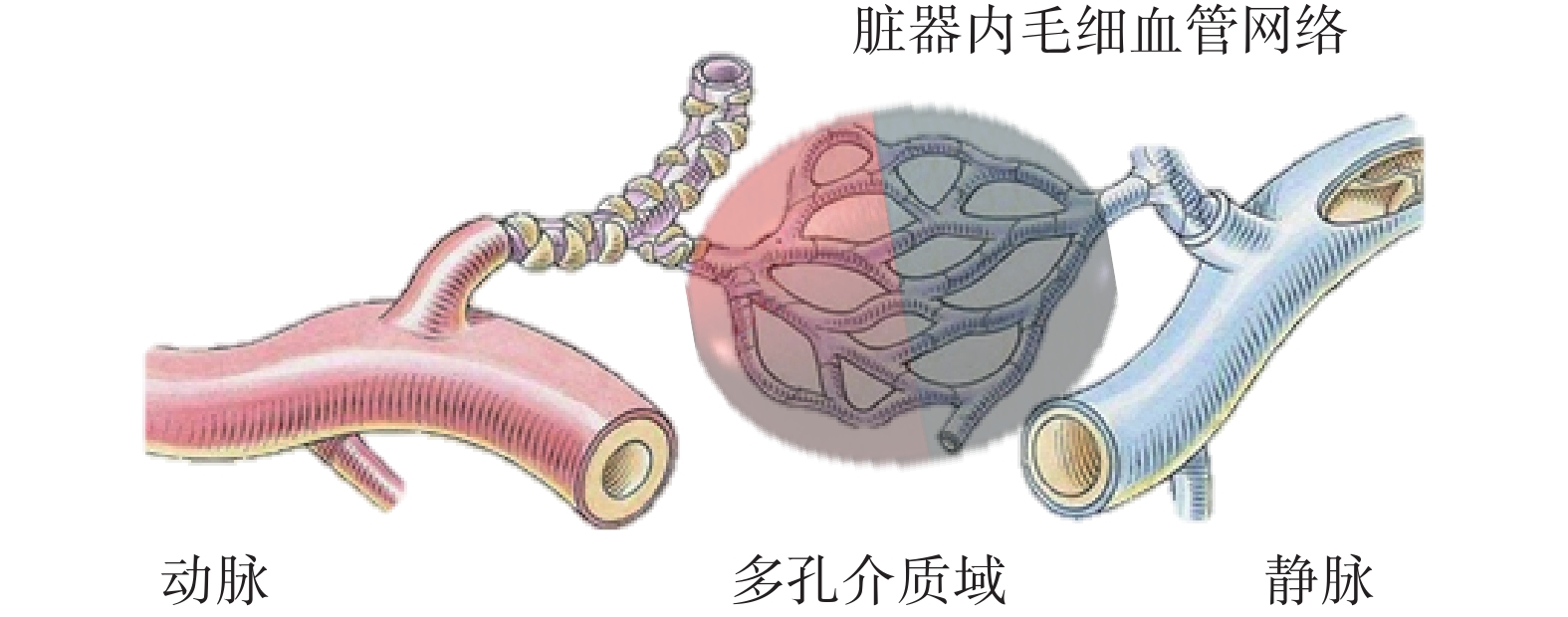 圖1
多孔介質域等效示意圖
Figure1.
Porous media domain
圖1
多孔介質域等效示意圖
Figure1.
Porous media domain
 |
其中  為動量衰減,
為動量衰減, 和
和  分別表示不同方向的血液流速及其絕對值。
分別表示不同方向的血液流速及其絕對值。 表示粘性阻力系數,
表示粘性阻力系數, 表示血液粘度,
表示血液粘度, 表示血液密度,
表示血液密度, 為慣性阻力系數。
為慣性阻力系數。
1.2 體外實驗平臺搭建
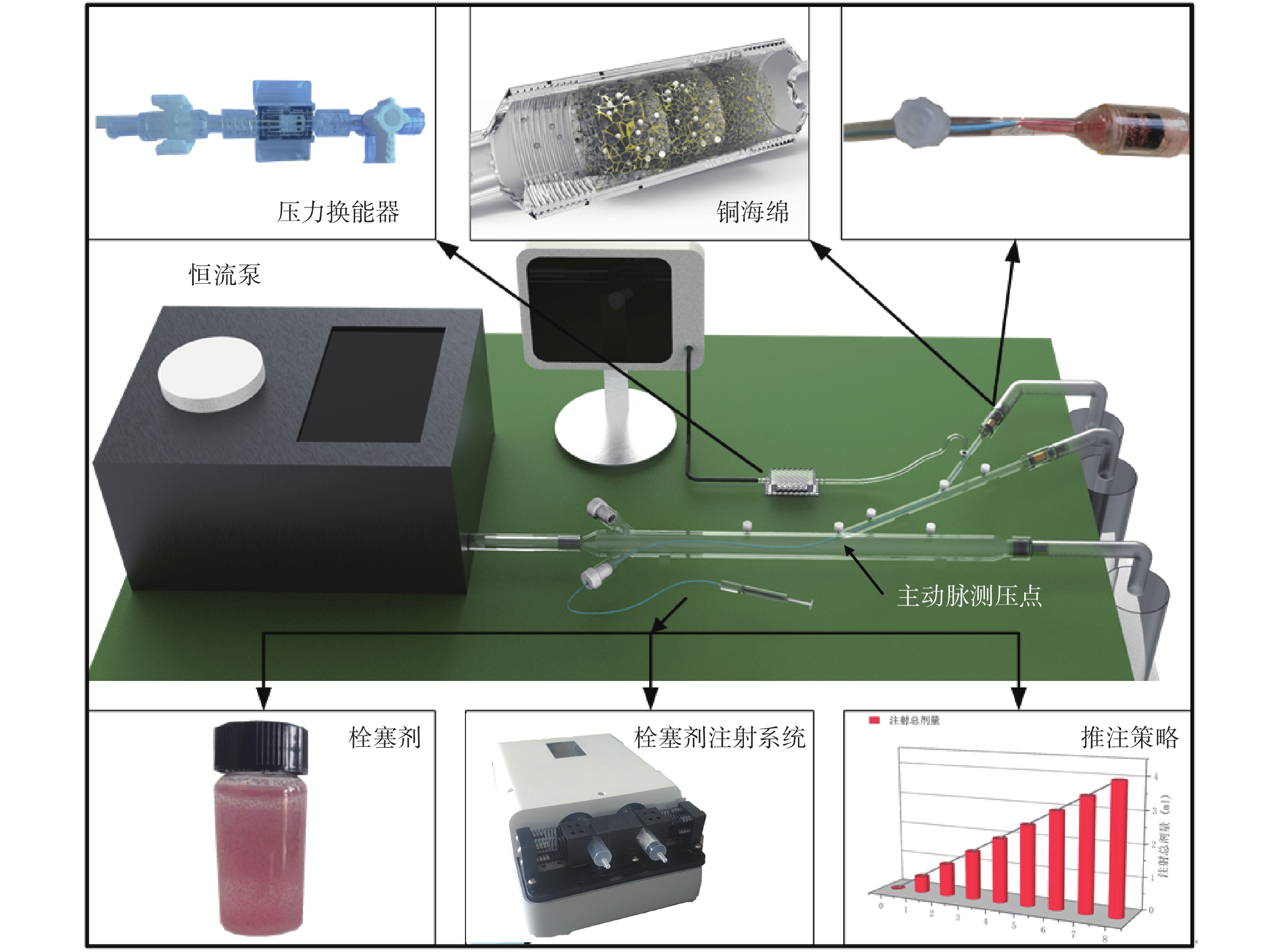
為了模擬手術過程,本文設計了如圖2所示的體外實驗平臺。實驗平臺由可模擬心臟脈動的恒流泵、模擬血管的管路、模擬栓塞器官的海綿體以及栓塞劑注射系統、壓力檢測傳感器等構成。實驗用流體為水,栓塞劑配置參考了臨床上廣泛使用的300 ~ 500 μm規格的栓塞劑(恒瑞醫藥)。栓塞顆粒為知益微球科技有限公司生產的PS塑料微球,將200、300、400 μm粒徑的三種規格微球等質量混合至1 g后,加入到與其密度相近的20 mL鹽水中,微球在溶液中呈現懸濁狀態,這有利于在栓塞劑注射過程中栓塞顆粒能均勻地進入到栓塞部位。鹽水中含紅色染料,以便于觀察栓塞劑進入管路后的流動情況。
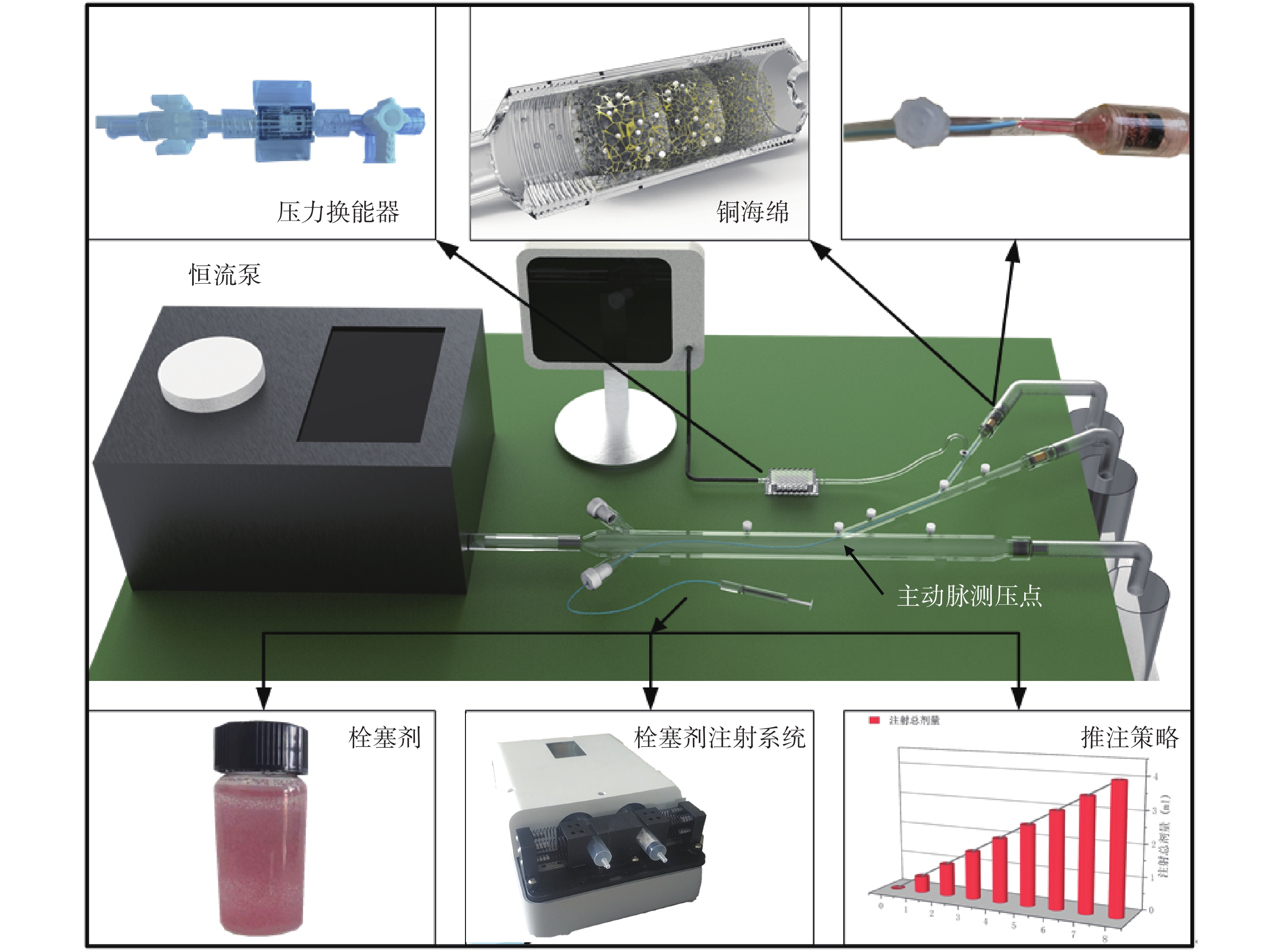 圖2
體外實驗平臺
Figure2.
In vitro experiment platform
圖2
體外實驗平臺
Figure2.
In vitro experiment platform
恒流泵(寧波創導三維醫療科技有限公司制造)提供50 mL/s的恒流量輸入,栓塞劑注射機器人通過4 Fr導管向器官動脈分支注射栓塞劑,血管模擬管路采用透明光敏樹脂三維打印而成,呈透明狀態,其結構與仿真模型相對應,包含主動脈段、器官動脈段和器官動脈分支,在血管模擬管路上設置了多個可與壓力換能器(Abbott 42584-05,ICU Medical, Inc.,美國)相連的快換接口,以便測量管路內的壓力。
在模擬血管的管路的末端,設置栓塞模擬區,該區域具有以下作用:① 可攔截栓塞顆粒,隨著栓塞顆粒的堆積,阻塞血管,模擬真實的栓塞過程。這要求該區域的結構應具備可供栓塞劑流通的變徑通道。② 可與仿真中多孔介質對應,以便將實驗與仿真結果聯合分析。
為此,本文提出了用多段銅海綿(平均孔徑按流動方向依次為0.4、0.3、0.2 mm)的結構滿足上述要求。首先,海綿結構是典型的多孔介質,銅海綿具有一定的強度,結構穩定可靠,不會像普通海綿一樣在壓力作用下自身產生明顯變形;其次,根據栓塞顆粒的粒徑設置海綿孔徑,可控制顆粒聚集區域,使其進入前兩段海綿內,而不進入最后一段海綿,使顆粒在前兩段海綿內不斷堆積,達到模擬血管內栓塞的目的[24]。
2 流體力學仿真與實驗
手術過程中,隨著栓塞劑在毛細血管網絡的堆積,栓塞分支的流量會逐漸降低。本文通過流體力學數值仿真,分析了栓塞過程的血流動力學變化。結果顯示,栓塞劑的注射流速是栓塞劑是否反流的決定因素。以此為依據,本文在體外實驗平臺上找出了探索栓塞劑反流臨界流速的流速-壓力曲線。
2.1 流體力學仿真
在介入栓塞治療中,導管通常由股動脈進入主動脈血管,在導絲導引下進入病灶器官動脈,由醫生根據患者的具體病情將導管超選至需要栓塞部位的主要供血小動脈內(器官動脈的下級分支),然后注入栓塞劑直至栓塞完成[1-2]。結合上述手術過程,本文構建了如圖3(左)所示的仿真模型,模型中共包含主動脈段、器官動脈段和器官動脈分支,器官動脈及器官動脈分支末端均有一段各向同性均勻多孔介質域,用于模擬血管后端的毛細血管網。各血管段直徑與人體血管相近,主動脈直徑20 mm,器官動脈直徑6 mm,器官動脈分支直徑3 mm。模型中間中空部分表示4 Fr介入導管進入器官動脈分支進行栓塞劑注射時所占用的血管內空間。
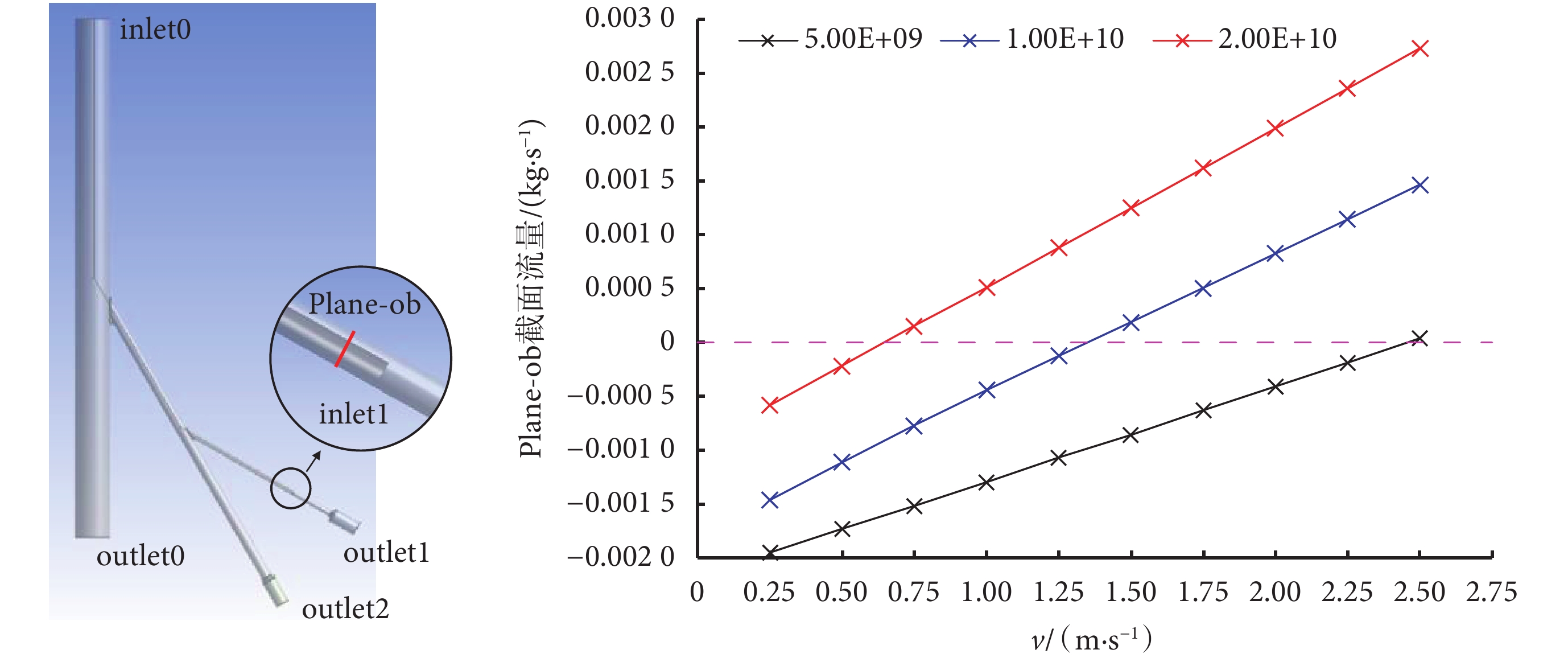 圖3
反流仿真模型(左)與反流仿真結果(右)
Figure3.
Reflux simulation model (left) and simulation results (right)
圖3
反流仿真模型(左)與反流仿真結果(右)
Figure3.
Reflux simulation model (left) and simulation results (right)
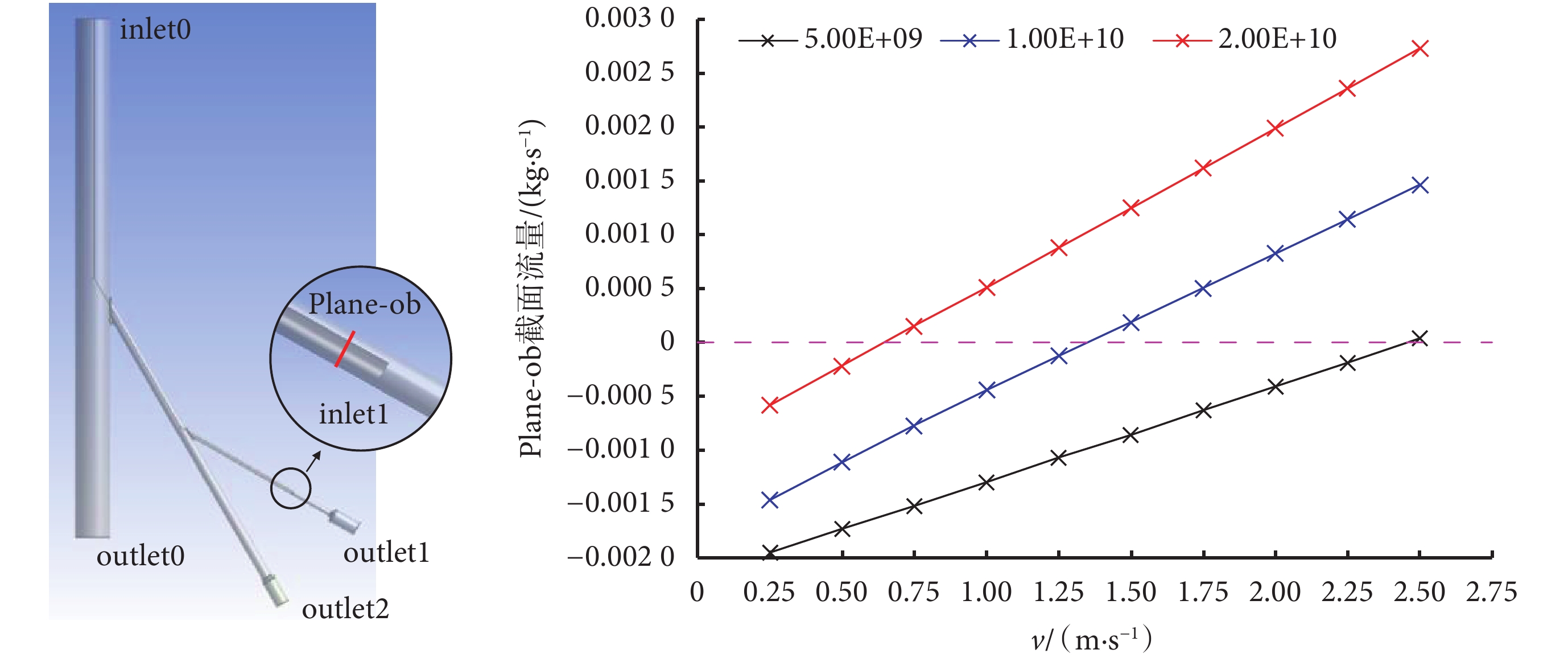
本文利用商用軟件Fluent進行了基于上述模型的流體力學仿真,有限元模型的網格數為6 753 239個,模型共有兩個流體入口和三個流體出口,入口分別是主動脈段上部入口inlet0和介入導管口inlet1;出口分別是主動脈段下部出口outlet0以及兩個多孔介質段末端出口outlet1和outlet2。為了便于將仿真與實驗結果進行比較,仿真中的部分設置與體外實驗中的實驗值保持一致,仿真和實驗中流體均用水代替血液,inlet0設置為50 mL/s的恒流量入口,outlet0設置為50 mm Hg的恒壓出口,多孔介質段末端表示血液流經動脈、毛細血管網后流入靜脈系統,因此將outlet1和outlet2設置為0 mm Hg的恒壓出口。由于流速慢,雷諾數較低,我們利用層流模型進行了仿真。依據達西定律,在多孔介質設置中可以忽略慣性損耗[23],同時將器官動脈分支后的多孔介質粘性阻力系數依次設置為5 × 109、1 × 1010、和2×1010進行了三組仿真,分別代表未栓塞、栓塞進行一段時間后和栓塞接近完成時的血流阻力。器官動脈末端的多孔介質粘性阻力系數設置為一個不變的常數1 × 109,代表栓塞未對其他血管造成影響。為了驗證栓塞劑的注射流速是否為栓塞劑反流的決定因素,我們將inlet1設置為速度入口,速度分別設置為0.25、0.50、0.75、1.00、1.25、1.50、1.75、2.00、2.25、2.50 m/s,記錄Plane-ob處的流量以觀察其是否出現反流,Plane-ob設置在導管出口inlet1上游2 mm處。
仿真結果如圖3(右)所示,橫坐標為栓塞劑注射流速,即inlet1處流速,縱坐標為Plane-ob處流量,如果Plane-ob處流量為正,說明該截面處已出現反流現象。隨著栓塞程度的增加,三組仿真中栓塞劑反流的臨界流速也逐漸降低。這表明在機器人進行栓塞劑推注時,需要不斷降低栓塞劑注射流速,以保證栓塞過程中栓塞劑顆粒不會出現反流。
2.2 平均動脈壓-注射流速曲線
利用體外實驗平臺,測量注射0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0 mL栓塞劑情況下恰好出現栓塞劑反流的注射流速。設置恒流泵提供50 mL/s的恒流脈動輸入。首先,通過4 Fr導管向器官動脈分支內推注0.5 mL栓塞劑,注射過程中觀察紅色的栓塞劑在血管內的流動情況,保證不出現反流至其他血管的情況,注射后使用清水將導管內殘留的栓塞劑顆粒全部沖入分支血管內。然后使用注射系統向分支內以恒定流速注射混有紅色染色劑的清水,觀察是否出現反流現象。圖4的左圖為正常流動,若紅色液體超過導管頭部的白色區域,如右圖所示,即判斷為已發生反流。如果出現反流則減小注射流速,如果未出現則增大注射流速繼續觀察,直至找出該栓塞程度下不出現反流現象的臨界流速。不斷重復上述過程直至銅海綿前端可見栓塞顆粒堆積,說明此時栓塞模擬區內的栓塞顆粒已經飽和,栓塞完成,此時已注射的栓塞劑劑量為4 mL。實驗結果如表1所示。
 圖4
正常流動狀態與反流狀態
Figure4.
Normal flow state and reflux state
圖4
正常流動狀態與反流狀態
Figure4.
Normal flow state and reflux state
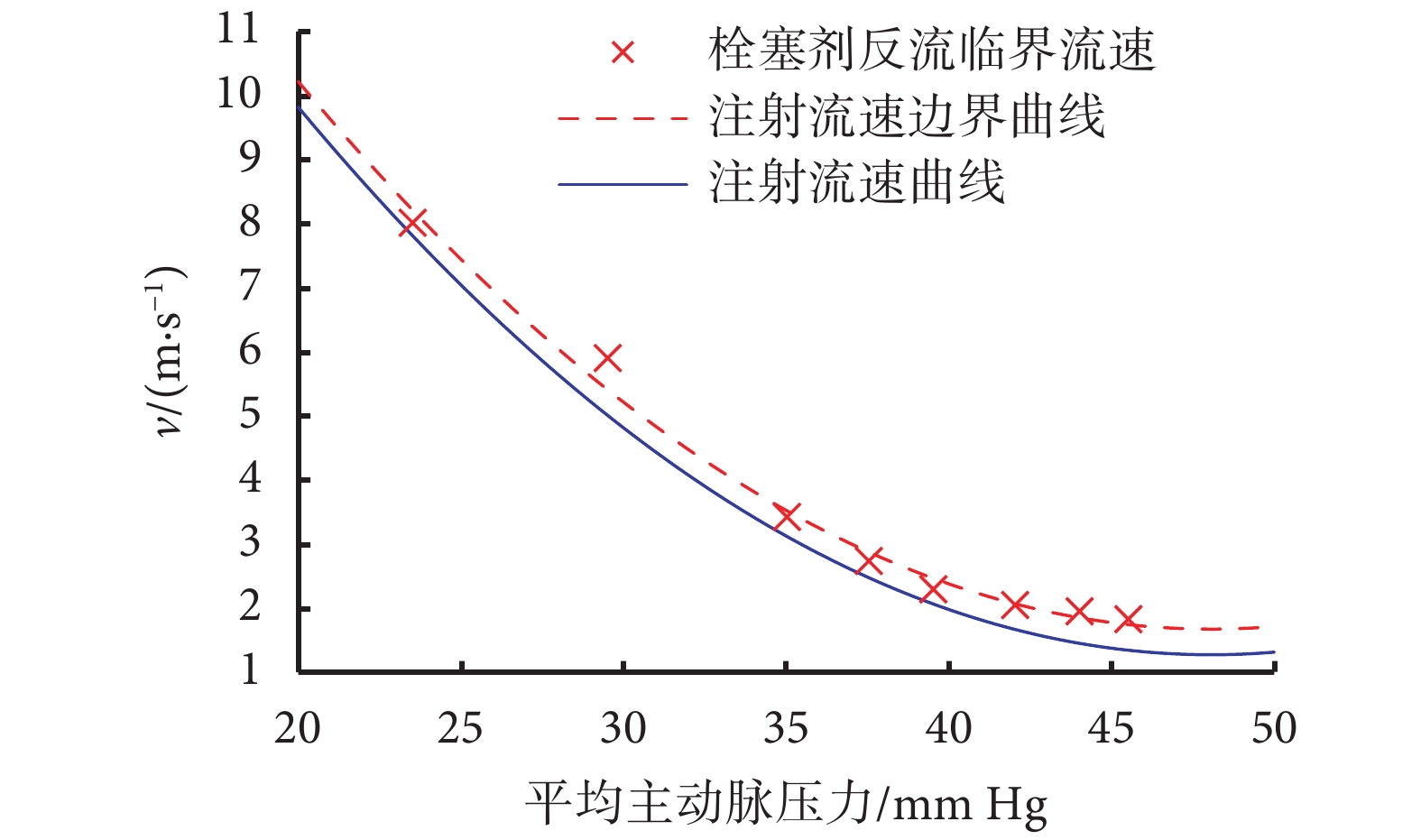
將表1中的數據進行擬合,得到體現栓塞劑反流臨界流速的平均動脈壓-注射流速曲線,如圖5所示(紅色虛線)。為了保證注射過程中栓塞劑顆粒不出現反流現象,注射流速應時刻位于流速邊界的下方,同時為了縮短手術時間,減少患者所受到的輻射量,應在不出現反流的區域內選擇較大的注射流速(藍色實線)。
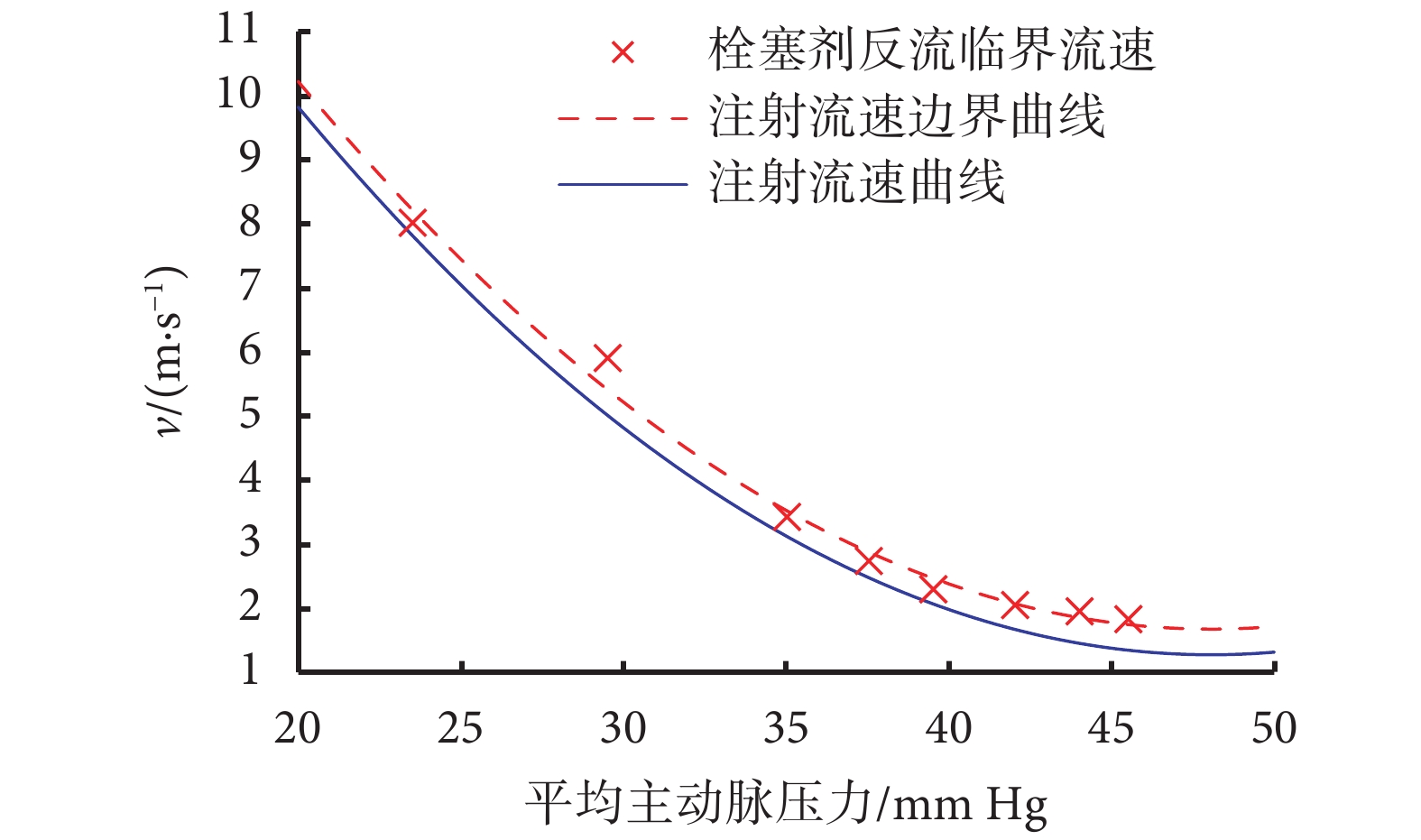 圖5
注射流速邊界與注射流速曲線
Figure5.
Injection flow velocity boundary and injection flow velocity
圖5
注射流速邊界與注射流速曲線
Figure5.
Injection flow velocity boundary and injection flow velocity
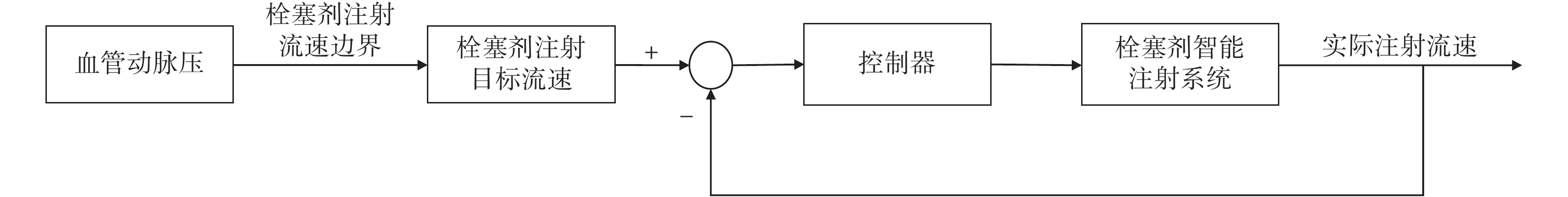
3 實驗驗證
為驗證圖5所示的反流條件以及基于此條件能否實現快速且無反流的栓塞劑注射,搭建了如圖6所示的控制器。注射系統基于檢測到的平均動脈壓,根據圖5所示的曲線確定注射流速的目標值,進行反饋控制。
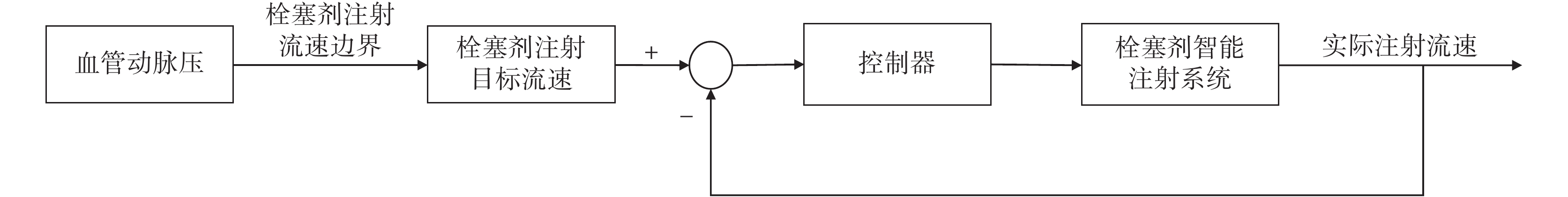 圖6
栓塞劑注射系統控制流程圖
Figure6.
Control flow chart of embolic agent injection system
圖6
栓塞劑注射系統控制流程圖
Figure6.
Control flow chart of embolic agent injection system
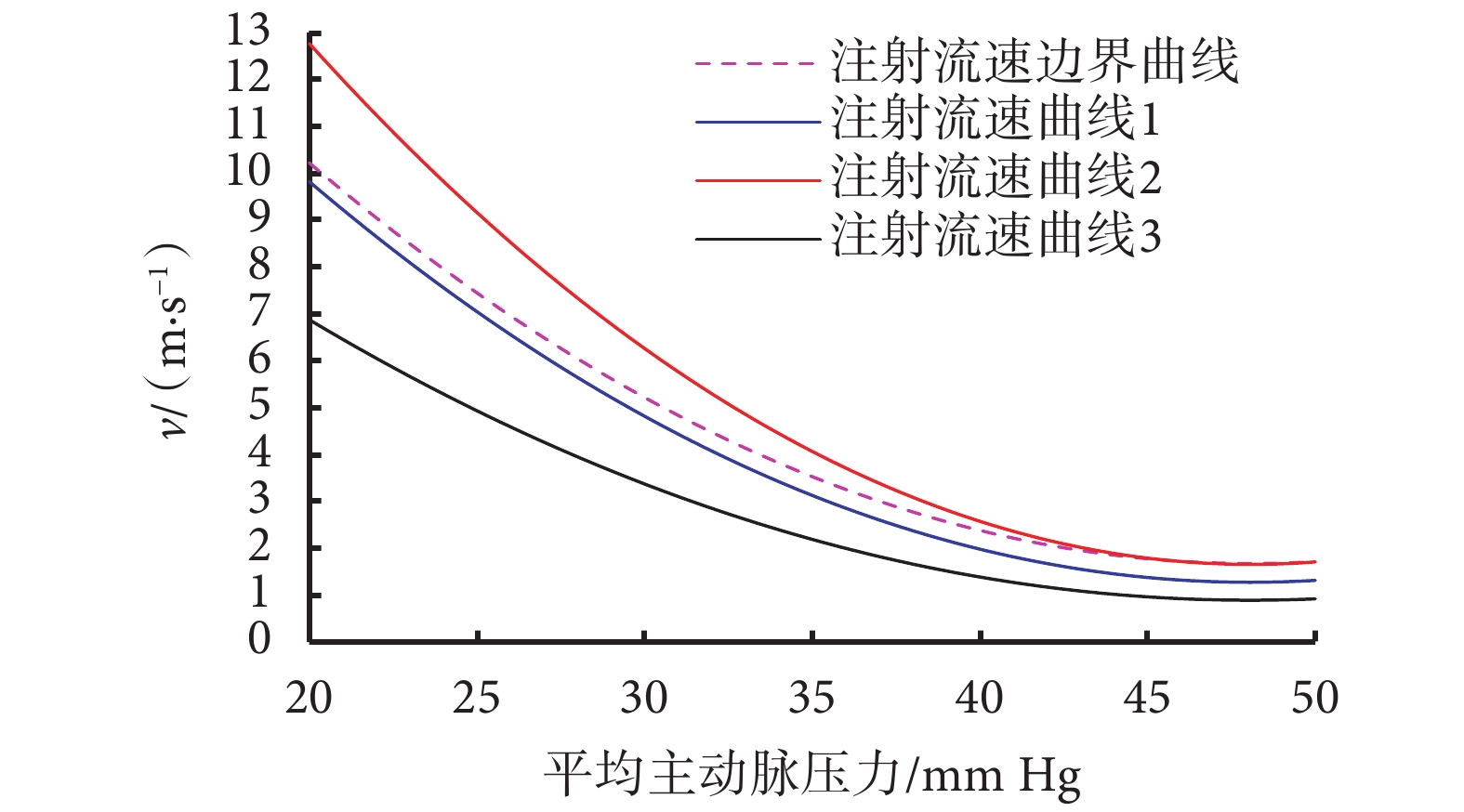
分別向注射系統輸入三種不同的控制策略(見圖7),控制其向體外實驗裝置注射栓塞劑的流速,其中注射流速曲線1為2.2節中所得到的流速曲線,流速曲線2的流速值時刻大于流速曲線1且超過了流速邊界,流速曲線3的流速值時刻小于流速曲線1,分別比較栓塞后的流量、過程中是否出現栓塞劑反流以及注射完成時間三方面信息,綜合比較栓塞效果。實驗結果如表2所示。
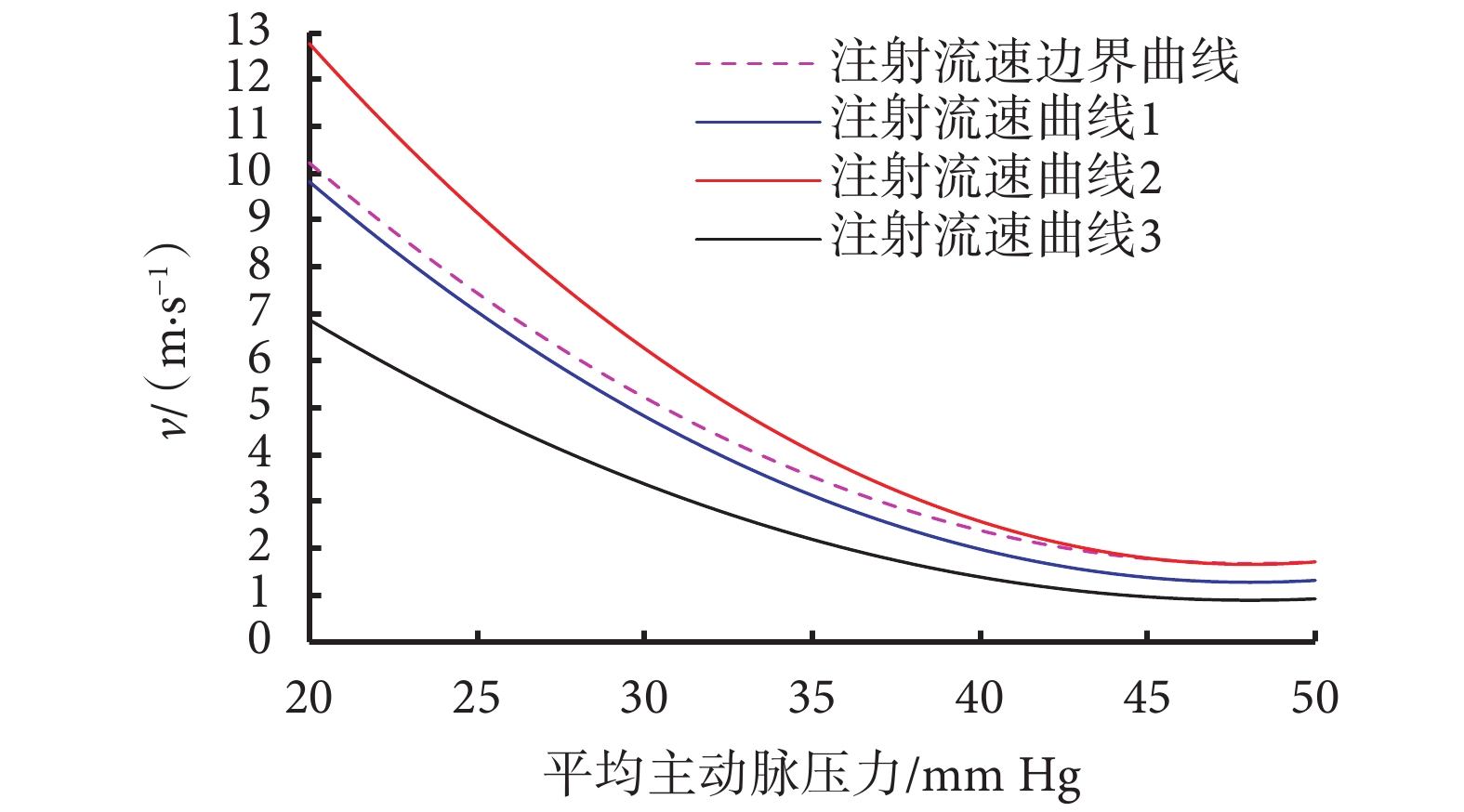 圖7
控制策略實驗驗證
Figure7.
Experimental results of control strategy
圖7
控制策略實驗驗證
Figure7.
Experimental results of control strategy
實驗結果表明,三種控制策略均能有效地對器官分支完成栓塞。使用流速曲線2時,由于初始時注射流速超過邊界曲線,所以出現了較明顯的反流;使用流速曲線3時,過程中并未出現反流現象,但是時長明顯高于流速曲線1。綜上所述,本文所設計的控制策略可以有效地完成栓塞,過程當中并未出現反流現象,同時縮短了手術時長。
4 總結與討論
本文為實現安全、快速的栓塞劑自動化推注,基于仿真和實驗提出了一種栓塞劑注射流速的控制目標決策方法。利用多孔介質對器官毛細血管進行了建模,在此基礎上搭建了體外實驗平臺。仿真和實驗結果顯示,栓塞劑的注射流速是反流的決定因素,存在栓塞劑反流的臨界注射流速。三組仿真結果對比表明,隨著栓塞程度的不斷加強(阻力系數由低到高),出現反流的臨界注射流速逐漸降低,這表明在使用智能注射系統進行栓塞劑推注時,需要不斷降低栓塞劑注射流速,以保證栓塞過程中栓塞劑顆粒不會反流至其他正常血管。
本文建立了體現反流臨界流速的平均動脈壓-注射流速邊界曲線模型,并以此提出了栓塞劑注射系統的控制策略。該模型引導下的栓塞劑自動注射可以在更短的時間內完成栓塞且不出現栓塞劑反流現象,而超出該模型的注射流速限制將引發正常血管被栓塞的風險。
本文提出并驗證了依據反流臨界流速曲線確定栓塞劑注射流速方法的有效性,可有效避免反流,實現栓塞劑的快速注射,為栓塞劑注射機器人的設計提供了依據。本文在體外實驗中使用平均動脈壓作為模型輸入,在實際臨床過程中,人體脈動血壓可能會引起栓塞劑臨界注射流速的波動,所以在選取注射流速時需要與流速邊界曲線保持相應的安全閾值,以此保證栓塞劑在注射過程中不會出現反流現象。同時,在未來實際臨床應用中,可以對不同個體的注射流速邊界曲線構建數據庫,并且輔以機器學習等手段來實現反流臨界流速曲線的預測與控制策略的建立。
重要聲明
利益沖突聲明:本文全體作者均聲明不存在利益沖突。
作者貢獻聲明:任東城、周波、郭寶磊負責流體力學建模,李嘉晟、任東城負責流體力學仿真,李嘉晟、任東城、周波負責體外實驗平臺的設計與搭建,李嘉晟、任東城負責體外實驗設計與數據采集,李嘉晟、郭士杰負責控制策略的提出與設計,李嘉晟負責論文撰寫。
引言
介入栓塞治療已廣泛用于腫瘤靶向治療、抗器官功能亢進和止血等手術中。通過介入導管精確注射適量栓塞劑,靶向性阻塞血液流通,可達到多種治療目的,如止血、腫瘤治療、組織切除等[1-2]。栓塞劑注射過程中,醫師需要在X線照射環境下工作,透視靶血管內栓塞劑的流動狀態,以避免發生反流。當栓塞接近預期狀態時,需要降低注射流速,直至栓塞完成[3-4]。在X線照射環境下,醫師不得不穿著厚重的鉛衣,導致疲勞和工作效率下降。而且,即使穿著鉛衣,輻射危害也往往難以避免。此外,栓塞劑注射操作很大程度上依賴于醫生的經驗與感受,而栓塞劑的過量注射會導致反流,造成異位栓塞并引發嚴重的并發癥[5-7],過少的栓塞劑則達不到預期的治療效果。
為了增加介入栓塞手術的安全性和成功率,減少醫生和患者在術中受到輻射的時間,栓塞劑注射機器人的研發受到醫學界的高度期待。機器人技術已廣泛應用于藥液自動注射治療。高壓注射器是介入治療中最常見的藥液自動注射裝置,已廣泛應用于心血管造影檢查、計算機斷層掃描(computed tomography,CT)增強造影掃描和磁共振成像(magnetic resonance imaging,MRI)增強掃描的顯影劑注射。它可在規定的時間內,通過經皮穿刺進入血管或利用人體的自然孔道,將足夠量的高濃度X線造影劑快速、準確地注射到檢查部位[8-10]。但是,現有藥物注射器主要對注射藥物的總量進行精確控制,對于注射流速及其變化并未關注[11]。在介入栓塞治療過程中,栓塞劑通過導管和動脈血管被注射到病變組織的毛細血管中,通過在毛細血管中的積聚,達到堵塞毛細血管、切斷病變組織血液供給的效果。隨著栓塞劑的注射,血流動力學參數如血流量、血壓以及流動阻力會發生變化,這意味著栓塞劑注射流速應隨著栓塞程度的變化而不斷調整,才能保證栓塞劑適量、準確地到達病灶組織。常規的定時、定量注射模式不能滿足栓塞劑注射要求。分析介入栓塞手術過程中的血流動力學參數變化,確定不同栓塞程度下不發生栓塞劑反流的目標注射流速,是實現栓塞劑自動注射的關鍵。
本文首先利用多孔介質對栓塞部位進行了建模,在此基礎上搭建了可模擬介入栓塞手術主要特征的體外實驗平臺;其次,通過流體力學數值仿真分析了栓塞過程的血流動力學變化,結合仿真與實驗,找出了栓塞劑推注過程中的反流臨界流速曲線,并以此為依據,設計栓塞劑注射反饋控制系統;最后,開展體外實驗,驗證模型引導下的栓塞劑自動注射效果,實現快速且不出現反流的栓塞劑注射。
1 體外實驗平臺搭建
在介入栓塞治療中,最終栓塞的部位往往是腎臟、肝臟等器官的毛細血管,直徑小且空間結構復雜,無論是用于計算流體力學仿真的幾何模型還是體外實驗平臺中的結構表達,都難以復刻真實的血管形狀。為了搭建可表征介入栓塞手術主要特征且有工程實現價值的體外實驗平臺,有必要建立栓塞部位的流體力學模型。
1.1 流體力學建模
由于器官毛細血管多孔隙、幾何結構復雜等原因,傳統的流體力學模型不適合于栓塞劑注射過程血流動力學建模。本文著眼于栓塞劑注射機器人的設計,重點關注栓塞劑進入血管后血液的整體流動,而不是栓塞劑在毛細血管內被輸送的過程。多孔介質模型是解決上述問題的有效方法,已被廣泛用于研究人體或動物組織中的血液和組織液流動特性,如使用多孔介質模擬腫瘤和肌肉中的血流狀態[12-13]或藥物和營養物質在組織中的轉運過程[14-15],以及將臟器組織作為多孔介質研究組織傳熱過程中的血流情況等[16-18]。在介入栓塞治療方面,用于治療顱內動脈瘤的顱內支架多孔介質建模的相關研究較為多見[19]。
栓塞部位的毛細血管可等效為多孔介質域(見圖1)[20-22]。栓塞所產生的血液流動阻力可通過流經多孔介質域的動量損失表示[23]:
 圖1
多孔介質域等效示意圖
Figure1.
Porous media domain
圖1
多孔介質域等效示意圖
Figure1.
Porous media domain
 |
其中  為動量衰減,
為動量衰減, 和
和  分別表示不同方向的血液流速及其絕對值。
分別表示不同方向的血液流速及其絕對值。 表示粘性阻力系數,
表示粘性阻力系數, 表示血液粘度,
表示血液粘度, 表示血液密度,
表示血液密度, 為慣性阻力系數。
為慣性阻力系數。
1.2 體外實驗平臺搭建
為了模擬手術過程,本文設計了如圖2所示的體外實驗平臺。實驗平臺由可模擬心臟脈動的恒流泵、模擬血管的管路、模擬栓塞器官的海綿體以及栓塞劑注射系統、壓力檢測傳感器等構成。實驗用流體為水,栓塞劑配置參考了臨床上廣泛使用的300 ~ 500 μm規格的栓塞劑(恒瑞醫藥)。栓塞顆粒為知益微球科技有限公司生產的PS塑料微球,將200、300、400 μm粒徑的三種規格微球等質量混合至1 g后,加入到與其密度相近的20 mL鹽水中,微球在溶液中呈現懸濁狀態,這有利于在栓塞劑注射過程中栓塞顆粒能均勻地進入到栓塞部位。鹽水中含紅色染料,以便于觀察栓塞劑進入管路后的流動情況。
 圖2
體外實驗平臺
Figure2.
In vitro experiment platform
圖2
體外實驗平臺
Figure2.
In vitro experiment platform
恒流泵(寧波創導三維醫療科技有限公司制造)提供50 mL/s的恒流量輸入,栓塞劑注射機器人通過4 Fr導管向器官動脈分支注射栓塞劑,血管模擬管路采用透明光敏樹脂三維打印而成,呈透明狀態,其結構與仿真模型相對應,包含主動脈段、器官動脈段和器官動脈分支,在血管模擬管路上設置了多個可與壓力換能器(Abbott 42584-05,ICU Medical, Inc.,美國)相連的快換接口,以便測量管路內的壓力。
在模擬血管的管路的末端,設置栓塞模擬區,該區域具有以下作用:① 可攔截栓塞顆粒,隨著栓塞顆粒的堆積,阻塞血管,模擬真實的栓塞過程。這要求該區域的結構應具備可供栓塞劑流通的變徑通道。② 可與仿真中多孔介質對應,以便將實驗與仿真結果聯合分析。
為此,本文提出了用多段銅海綿(平均孔徑按流動方向依次為0.4、0.3、0.2 mm)的結構滿足上述要求。首先,海綿結構是典型的多孔介質,銅海綿具有一定的強度,結構穩定可靠,不會像普通海綿一樣在壓力作用下自身產生明顯變形;其次,根據栓塞顆粒的粒徑設置海綿孔徑,可控制顆粒聚集區域,使其進入前兩段海綿內,而不進入最后一段海綿,使顆粒在前兩段海綿內不斷堆積,達到模擬血管內栓塞的目的[24]。
2 流體力學仿真與實驗
手術過程中,隨著栓塞劑在毛細血管網絡的堆積,栓塞分支的流量會逐漸降低。本文通過流體力學數值仿真,分析了栓塞過程的血流動力學變化。結果顯示,栓塞劑的注射流速是栓塞劑是否反流的決定因素。以此為依據,本文在體外實驗平臺上找出了探索栓塞劑反流臨界流速的流速-壓力曲線。
2.1 流體力學仿真
在介入栓塞治療中,導管通常由股動脈進入主動脈血管,在導絲導引下進入病灶器官動脈,由醫生根據患者的具體病情將導管超選至需要栓塞部位的主要供血小動脈內(器官動脈的下級分支),然后注入栓塞劑直至栓塞完成[1-2]。結合上述手術過程,本文構建了如圖3(左)所示的仿真模型,模型中共包含主動脈段、器官動脈段和器官動脈分支,器官動脈及器官動脈分支末端均有一段各向同性均勻多孔介質域,用于模擬血管后端的毛細血管網。各血管段直徑與人體血管相近,主動脈直徑20 mm,器官動脈直徑6 mm,器官動脈分支直徑3 mm。模型中間中空部分表示4 Fr介入導管進入器官動脈分支進行栓塞劑注射時所占用的血管內空間。
 圖3
反流仿真模型(左)與反流仿真結果(右)
Figure3.
Reflux simulation model (left) and simulation results (right)
圖3
反流仿真模型(左)與反流仿真結果(右)
Figure3.
Reflux simulation model (left) and simulation results (right)
本文利用商用軟件Fluent進行了基于上述模型的流體力學仿真,有限元模型的網格數為6 753 239個,模型共有兩個流體入口和三個流體出口,入口分別是主動脈段上部入口inlet0和介入導管口inlet1;出口分別是主動脈段下部出口outlet0以及兩個多孔介質段末端出口outlet1和outlet2。為了便于將仿真與實驗結果進行比較,仿真中的部分設置與體外實驗中的實驗值保持一致,仿真和實驗中流體均用水代替血液,inlet0設置為50 mL/s的恒流量入口,outlet0設置為50 mm Hg的恒壓出口,多孔介質段末端表示血液流經動脈、毛細血管網后流入靜脈系統,因此將outlet1和outlet2設置為0 mm Hg的恒壓出口。由于流速慢,雷諾數較低,我們利用層流模型進行了仿真。依據達西定律,在多孔介質設置中可以忽略慣性損耗[23],同時將器官動脈分支后的多孔介質粘性阻力系數依次設置為5 × 109、1 × 1010、和2×1010進行了三組仿真,分別代表未栓塞、栓塞進行一段時間后和栓塞接近完成時的血流阻力。器官動脈末端的多孔介質粘性阻力系數設置為一個不變的常數1 × 109,代表栓塞未對其他血管造成影響。為了驗證栓塞劑的注射流速是否為栓塞劑反流的決定因素,我們將inlet1設置為速度入口,速度分別設置為0.25、0.50、0.75、1.00、1.25、1.50、1.75、2.00、2.25、2.50 m/s,記錄Plane-ob處的流量以觀察其是否出現反流,Plane-ob設置在導管出口inlet1上游2 mm處。
仿真結果如圖3(右)所示,橫坐標為栓塞劑注射流速,即inlet1處流速,縱坐標為Plane-ob處流量,如果Plane-ob處流量為正,說明該截面處已出現反流現象。隨著栓塞程度的增加,三組仿真中栓塞劑反流的臨界流速也逐漸降低。這表明在機器人進行栓塞劑推注時,需要不斷降低栓塞劑注射流速,以保證栓塞過程中栓塞劑顆粒不會出現反流。
2.2 平均動脈壓-注射流速曲線
利用體外實驗平臺,測量注射0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0 mL栓塞劑情況下恰好出現栓塞劑反流的注射流速。設置恒流泵提供50 mL/s的恒流脈動輸入。首先,通過4 Fr導管向器官動脈分支內推注0.5 mL栓塞劑,注射過程中觀察紅色的栓塞劑在血管內的流動情況,保證不出現反流至其他血管的情況,注射后使用清水將導管內殘留的栓塞劑顆粒全部沖入分支血管內。然后使用注射系統向分支內以恒定流速注射混有紅色染色劑的清水,觀察是否出現反流現象。圖4的左圖為正常流動,若紅色液體超過導管頭部的白色區域,如右圖所示,即判斷為已發生反流。如果出現反流則減小注射流速,如果未出現則增大注射流速繼續觀察,直至找出該栓塞程度下不出現反流現象的臨界流速。不斷重復上述過程直至銅海綿前端可見栓塞顆粒堆積,說明此時栓塞模擬區內的栓塞顆粒已經飽和,栓塞完成,此時已注射的栓塞劑劑量為4 mL。實驗結果如表1所示。
 圖4
正常流動狀態與反流狀態
Figure4.
Normal flow state and reflux state
圖4
正常流動狀態與反流狀態
Figure4.
Normal flow state and reflux state
將表1中的數據進行擬合,得到體現栓塞劑反流臨界流速的平均動脈壓-注射流速曲線,如圖5所示(紅色虛線)。為了保證注射過程中栓塞劑顆粒不出現反流現象,注射流速應時刻位于流速邊界的下方,同時為了縮短手術時間,減少患者所受到的輻射量,應在不出現反流的區域內選擇較大的注射流速(藍色實線)。
 圖5
注射流速邊界與注射流速曲線
Figure5.
Injection flow velocity boundary and injection flow velocity
圖5
注射流速邊界與注射流速曲線
Figure5.
Injection flow velocity boundary and injection flow velocity
3 實驗驗證
為驗證圖5所示的反流條件以及基于此條件能否實現快速且無反流的栓塞劑注射,搭建了如圖6所示的控制器。注射系統基于檢測到的平均動脈壓,根據圖5所示的曲線確定注射流速的目標值,進行反饋控制。
 圖6
栓塞劑注射系統控制流程圖
Figure6.
Control flow chart of embolic agent injection system
圖6
栓塞劑注射系統控制流程圖
Figure6.
Control flow chart of embolic agent injection system
分別向注射系統輸入三種不同的控制策略(見圖7),控制其向體外實驗裝置注射栓塞劑的流速,其中注射流速曲線1為2.2節中所得到的流速曲線,流速曲線2的流速值時刻大于流速曲線1且超過了流速邊界,流速曲線3的流速值時刻小于流速曲線1,分別比較栓塞后的流量、過程中是否出現栓塞劑反流以及注射完成時間三方面信息,綜合比較栓塞效果。實驗結果如表2所示。
 圖7
控制策略實驗驗證
Figure7.
Experimental results of control strategy
圖7
控制策略實驗驗證
Figure7.
Experimental results of control strategy
實驗結果表明,三種控制策略均能有效地對器官分支完成栓塞。使用流速曲線2時,由于初始時注射流速超過邊界曲線,所以出現了較明顯的反流;使用流速曲線3時,過程中并未出現反流現象,但是時長明顯高于流速曲線1。綜上所述,本文所設計的控制策略可以有效地完成栓塞,過程當中并未出現反流現象,同時縮短了手術時長。
4 總結與討論
本文為實現安全、快速的栓塞劑自動化推注,基于仿真和實驗提出了一種栓塞劑注射流速的控制目標決策方法。利用多孔介質對器官毛細血管進行了建模,在此基礎上搭建了體外實驗平臺。仿真和實驗結果顯示,栓塞劑的注射流速是反流的決定因素,存在栓塞劑反流的臨界注射流速。三組仿真結果對比表明,隨著栓塞程度的不斷加強(阻力系數由低到高),出現反流的臨界注射流速逐漸降低,這表明在使用智能注射系統進行栓塞劑推注時,需要不斷降低栓塞劑注射流速,以保證栓塞過程中栓塞劑顆粒不會反流至其他正常血管。
本文建立了體現反流臨界流速的平均動脈壓-注射流速邊界曲線模型,并以此提出了栓塞劑注射系統的控制策略。該模型引導下的栓塞劑自動注射可以在更短的時間內完成栓塞且不出現栓塞劑反流現象,而超出該模型的注射流速限制將引發正常血管被栓塞的風險。
本文提出并驗證了依據反流臨界流速曲線確定栓塞劑注射流速方法的有效性,可有效避免反流,實現栓塞劑的快速注射,為栓塞劑注射機器人的設計提供了依據。本文在體外實驗中使用平均動脈壓作為模型輸入,在實際臨床過程中,人體脈動血壓可能會引起栓塞劑臨界注射流速的波動,所以在選取注射流速時需要與流速邊界曲線保持相應的安全閾值,以此保證栓塞劑在注射過程中不會出現反流現象。同時,在未來實際臨床應用中,可以對不同個體的注射流速邊界曲線構建數據庫,并且輔以機器學習等手段來實現反流臨界流速曲線的預測與控制策略的建立。
重要聲明
利益沖突聲明:本文全體作者均聲明不存在利益沖突。
作者貢獻聲明:任東城、周波、郭寶磊負責流體力學建模,李嘉晟、任東城負責流體力學仿真,李嘉晟、任東城、周波負責體外實驗平臺的設計與搭建,李嘉晟、任東城負責體外實驗設計與數據采集,李嘉晟、郭士杰負責控制策略的提出與設計,李嘉晟負責論文撰寫。