鋅(Zn)合金具有良好的細胞相容性和適宜的降解速率,是一種極具臨床應用前景的生物可降解金屬。本文總結了可降解Zn合金作為骨植入材料的生物學作用,歸納了不同Zn合金材料的力學性能及其作為骨植入材料的優缺點,分析了不同加工策略(如合金化、增材制造等)對Zn合金力學性能的影響。全文從材料選擇、產品加工處理及結構拓撲優化等方面為生物可降解Zn合金骨植入材料提供了系統化的設計思路,并對其應用前景進行了展望,以期更好地服務于臨床。
引用本文: 張天蔚, 劉宇宸, 王韋丹, 趙德偉. 生物可降解鋅合金作為骨植入材料的研究現狀和進展. 生物醫學工程學雜志, 2023, 40(3): 589-594. doi: 10.7507/1001-5515.202204077 復制
版權信息: ?四川大學華西醫院華西期刊社《生物醫學工程學雜志》版權所有,未經授權不得轉載、改編
0 引言
生物可降解金屬材料具有良好的力學強度和生物可降解性,可有效地解決應力遮擋和二次手術相關的臨床問題,是一種極具應用前景的骨植入材料。理想的生物可降解金屬骨植入材料應滿足以下幾點: ① 在炎癥和修復階段,植入物應具有足夠的強度來支撐骨折或缺損區域的應力,提供足夠的結構穩定性。② 在骨重建階段,骨折或缺損的部位需要適當的刺激,即應力刺激,以保證骨的有效愈合。隨著金屬的降解,材料剛度逐漸降低,利于載荷轉移到骨,避免應力遮擋引起的骨吸收。③ 骨折愈合后,不需要二次手術取出[1]。除此以外,近年來生物可降解金屬骨植入材料正向功能化發展,即材料本身具有骨誘導性,可促進骨組織的再生。目前生物可降解金屬材料的研究主要包括鎂(Mg)、鋅(Zn)和鐵(Fe)三個體系。由于Fe的降解速率過慢,容易引起和不可降解金屬同樣的應力遮蔽問題,最終導致骨密度降低(骨量減少),因此應用受限。Mg合金具有很好的生物相容性和成骨活性,具有與天然骨骼相似的力學性能,已被用做骨修復材料。目前,德國的Mg-釔(Y)-鑭(Re) -鋯(Zr)合金螺釘已經成功通過歐洲一致性認證,獲批進入醫療器械市場應用于各類骨折手術。韓國Mg-鈣(Ca)-Zn合金螺釘、我國的高純Mg螺釘和Mg-釹(Nd)-Zn-Zr合金螺釘均已陸續開展臨床試驗,均獲得了良好的效果[2]。但Mg在人體環境中降解速率過快,降解時產生較多的氫氣,可能會影響植入術后的切口愈合。Zn的降解速率介于Mg和Fe之間,可在生物體內均勻降解,降解過程中不產生氫氣,同時具備骨植入材料的服役要求,不產生應力遮擋,逐漸被認為是一種極具應用前景的骨植入材料[3]。目前已有Zn合金接骨板用于人體下頜骨骨折。生物可降解Zn合金骨植入材料的應用主要包括骨接合植入器件(如接骨板、接骨螺釘)和骨修復材料(如金屬補塊)等。根據使用部位是否負重,對Zn合金的生物活性、機械強度和韌性等要求也不同。本文總結了生物可降解Zn合金骨植入材料的生物學作用和研究成果,分析了不同加工方式對Zn合金材料性能的影響,為制備滿足不同服役條件的Zn合金骨植入材料提供了系統的設計理念,為研究者提供更為全面的參考。
1 生物可降解Zn合金作為骨植入材料的生物作用
Zn是人體第二大必需微量元素,它參與機體基因表達、信號傳導等重要的生理過程[4]。Zn能夠通過多種途徑影響人體內骨的形成[5]。研究表明,Zn可通過調控成骨細胞特異性轉錄因子2(runt-related transcription factor 2,Runx2)的表達,提升骨鈣素、I型膠原蛋白和堿性磷酸酶的合成和活性[6-7],增加Ca和磷(P)的積累,促進骨生成。此外,Zn能刺激成骨細胞產生骨保護素(osteoprotegerin, OPG),OPG可與核因子-κB(nuclear factor kappa-B,NF-κB)配體的受體激活劑(receptor activator of NF-κB ligand,RANKL)結合,從而抑制RANKL與破骨前體細胞NF-κB受體激活劑(receptor activator of NF-κB,RANK)的結合,減少破骨細胞形成,防止骨質流失。因此Zn合金是一種具有生物活性的生物可降解材料[8]。
現有理論認為,攝入過量的Zn可以通過腎臟排出體外,但長期攝入可能會對人體肝、脾、大腦、心臟等重要器官產生損傷,同時導致銅缺乏并對脂蛋白譜產生不利影響[9]。但Qu等[10]對純Zn進行了體外細胞相容性評價,發現純Zn對小鼠前成骨細胞的增殖活性無明顯影響。Bowen等[11]將純Zn絲植入到老鼠血管內,結果表明Zn以及其降解產物不會引起溶血反應和周圍組織的炎癥反應,同時Zn能夠抑制平滑肌細胞增殖、抑制血管再狹窄,實驗過程中動物并未表現出全身或局部的毒性反應。生物可降解Zn合金材料的降解速率通常較慢,因此局部小范圍的應用一般不會引起整體內環境的改變,所以生物可降解Zn合金作為骨植入材料理論上也是安全可行的。但目前對于可降解Zn合金材料的生物安全性仍缺乏一致性評價,缺乏行業內部的相關標準,因此在生物可降解Zn合金骨植入物材料開發過程中必須對其生物相容性給予足夠的關注與評價。
2 合金化對生物可降解Zn合金骨植入材料的性能影響
與鈦(Ti)或不銹鋼材料相比,Zn的力學性能更接近人體骨骼,但具有密排六方晶體結構的純Zn只有兩個獨立的滑移系,因此在鑄態下表現出極低的伸長率和屈服強度,且純Zn再結晶溫度低,在室溫會產生蠕變現象,很難滿足骨植入材料對力學性能的基本要求。合金化被認為是一種提高Zn力學性能的有效手段。
2.1 二元合金
近年來,國內外科研人員陸續開發出了一系列具有優良力學性能的可降解二元Zn合金體系。但作為骨植入材料,合金元素的選擇需要充分考慮元素的生物安全性,通常選擇人體自身含有的金屬元素或者對人體無毒副作用的元素。Li等[12]從微觀結構、力學性能、降解速率和體內外生物相容性等方面系統評價了Mg、Ca、鍶(Sr)等8種營養元素組成的新型Zn基二元合金(Zn-1X),其中X指代該研究里Mg、Ca、Sr等8種任意營養元素,這類元素的添加顯著改善了純Zn的力學性能和生物相容性。Ti是目前應用最為廣泛的骨植入材料,具良好的生物相容性和力學性能。Wang等[13]對不同加工方式的Zn-xTi合金(x表示Zn-xTi合金中鈦元素的質量分數,以下沿用這種表達方式)的力學性能進行了研究,發現軋制后的Zn-xTi合金力學性能顯著提升,適合在人體負重區使用。Jia等[14]在純Zn中加入不同質量分數的微量元素錳(Mn),制備生物可降解的Zn-xMn合金,Mn的加入提高了純Zn的力學性能,其中Zn-0.8Mn合金的延伸率達到(83.96 ± 2.36)%,因此耐疲勞性更好,Mn還可促進骨形成,可用于設計具有骨誘導功能的植入材料。研究表明Sr具有良好的成骨作用和促血管生成作用, 因此Zn-Sr合金可能是一種良好骨組織工程材料,可用于創傷造成的骨缺損[15-16]。目前常見的生物可降解Zn-1X合金[12-22],如表1所示。
2.2 三元合金
三元合金體系仍缺乏研究,目前骨科植入產品主要在Zn-Mg合金的基礎上添加例如Sr、Ca和Fe等人體必須元素來提升Zn合金的綜合性能。Klíma等[23]將Zn–0.8Mg–0.2Sr合金螺釘植入白兔脛骨中,120 d內未觀察到炎癥反應或骨吸收,這種含Sr的Zn合金植入體表面可見到結構規則的骨和軟骨形成。Sun等[24]研制一種屈服強度高達317 MPa的Zn-0.8Mn-0.4Mg合金螺釘并用于兔前交叉韌帶重建術中,Mn元素的添加可顯著加速新骨形成并進一步誘導肌腱礦化,促進腱—骨整合,利于早期關節功能恢復和康復訓練,可能在未來具有廣泛的臨床應用前景。Shao等[25]設計了一種三元合金Zn-xMg-xFe,Fe元素使Zn-xMg合金具備更為優良的力學強度,由該合金制備成接骨板目前已經成功應用于人體下頜骨骨折的固定。在這些研究中,新型Zn基三元合金具有更為理想的力學性能和生物活性,為生物可降解骨植入材料提供了更多的選擇。
目前Zn合金種類繁多,多項研究從促進骨生成、改善降解行為、提高體外力學性能等多方面提出了生物可降解Zn合金作為骨植入物的合金化設計策略。人們還可以根據不同元素的生物學作用,選擇不同的合金化元素,制備更符合臨床實際應用的生物可降解Zn合金骨科植入產品。
3 不同加工工藝對生物可降解Zn合金骨植入材料的性能影響
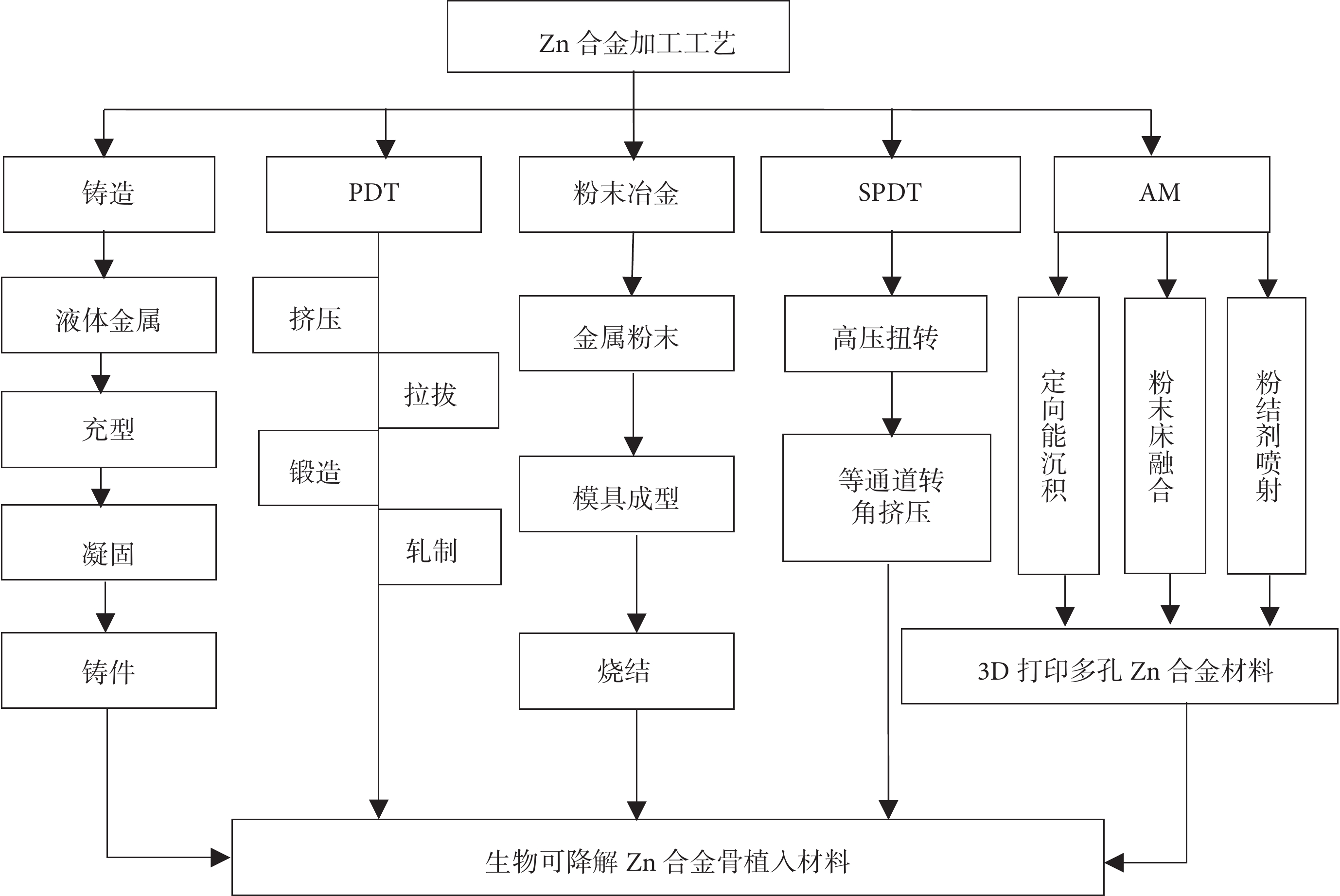
除合金化方法外,熱處理、變形加工等加工工藝可通過改變Zn合金的顯微結構,從而提升Zn合金的綜合力學性能,滿足不同骨科植入材料的臨床服役要求。目前生物可降解Zn合金的加工方法包括傳統的鑄造、塑性變形加工技術 (plastic deformation technique,PDT)和眾多先進的加工方法,包括常規粉末冶金(powder metallurgy,PM)、劇烈PDT (severe PDT,SPDT)、增材制造(additive manufacturing,AM)等。目前常見的生物可降解Zn合金所采用的加工工藝如圖1所示。
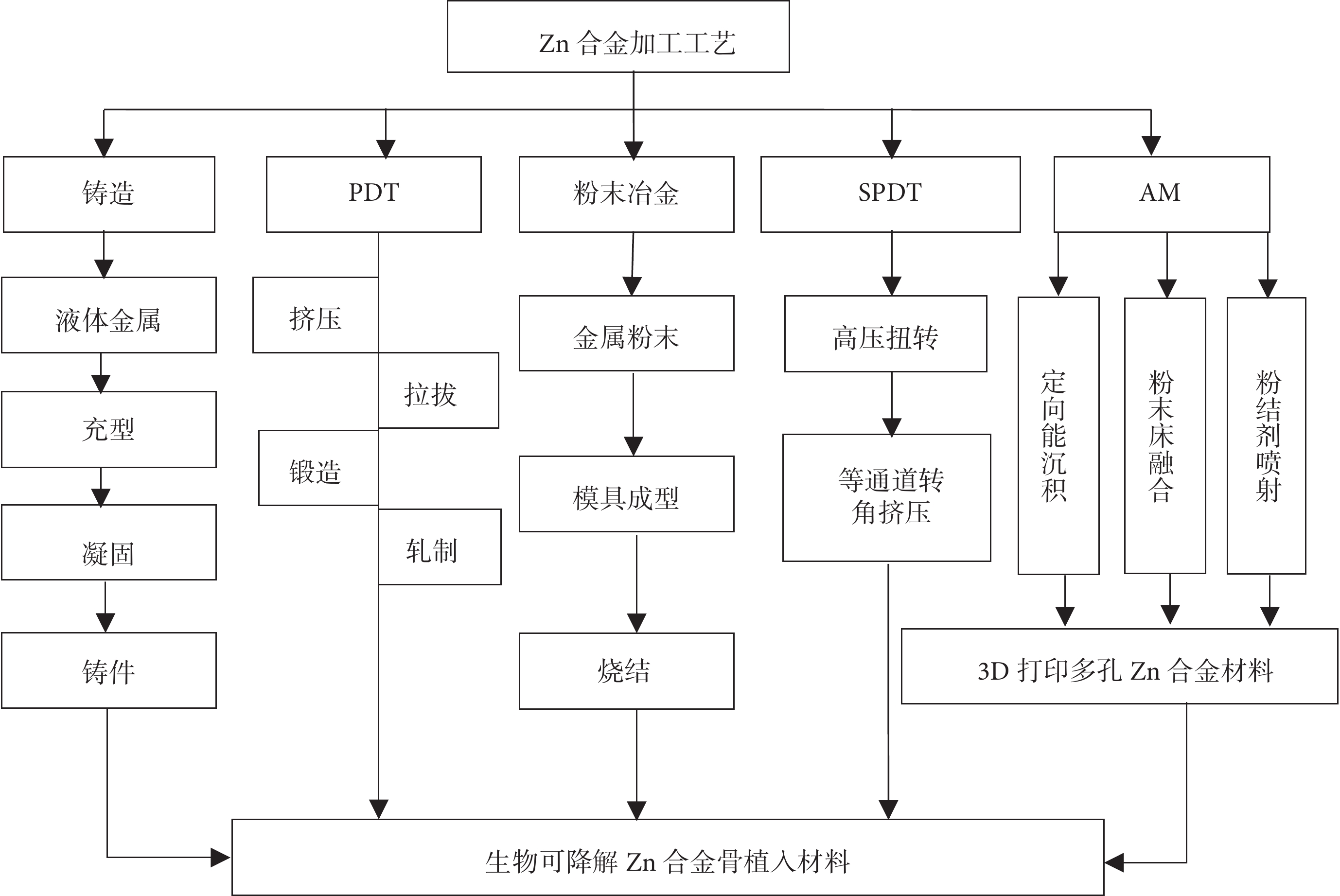 圖1
常見生物可降解Zn合金骨植入材料的加工工藝
Figure1.
Processing technology of biodegradable Zn alloy used for bone implant
圖1
常見生物可降解Zn合金骨植入材料的加工工藝
Figure1.
Processing technology of biodegradable Zn alloy used for bone implant
3.1 傳統方法
鑄造工藝可分為擠壓鑄造、重力鑄造和砂型鑄造三類,其中擠壓鑄造是可降解Zn合金最常用的加工工藝。鑄造的Zn合金表現出非常低的抗拉強度,無法滿足骨科植入物的力學要求,但鑄造可以直接創建所需的產品輪廓(例如接骨板內固定系統),作為后續加工過程的原材料。目前常用的PDT方法包括擠壓、拉拔、鍛造和軋制等。Yang等[26]利用熱擠壓技術生產的Zn-0.4Mg合金板屈服強度(yield strength ,YS)、抗拉強度(tensile strength,TS)、延伸率分別為284 MPa、353 MPa、15.2%,符合生物可降解骨科內固定材料的力學標準(YS>230 MPa、TS>300Mpa、延伸率>18%)[27]。因此,PDT也是常用于改善Zn合金骨科植入材料力學性能的二次加工技術。
3.2 先進加工技術
Zn合金的晶粒結構是六邊形密堆積,室溫下的加工能力較差,傳統鑄造等加工工藝效率偏低、成本較高[28],因此不適合Zn合金骨植入材料的批量生產。近年來,隨著Zn合金作為可降解骨植入材料的研究越來越深入,為了滿足臨床多元化的要求,已有越來越多的先進加工技術用于可降解Zn合金骨科植入產品的研發。
粉末冶金是制備復合材料的常用方法,該方法可制備出成分均勻、晶粒細小、性能優異的Zn合金,幾乎可達到骨植入材料最終的成形要求。Sotoudeh等[29]采用粉末冶金方法制備具有納米結構Zn-Mn合金,該合金具有較高的抗壓強度和斷裂伸長率,同時具有良好耐腐蝕性能,符合骨植入物的基本力學要求。SPDT技術(如高壓扭轉、等通道轉角擠壓等)可以產出超細晶粒,因而可以提高合金材料的塑性。W?troba等[30]通過高壓扭轉技術合成了Zn–3Ag-0.5Mg合金,該超細晶金屬復合物具有極高的硬度,未來可能制備用于負重部位骨折的釘板內固定系統。Liu等[31]采用12道次等通道轉角擠壓工藝制備了Zn-1.6Mg合金,使其屈服強度和延伸率從鑄態時的82.3 MPa和1.4%提高到361 MPa和5.2%,極大地拓展了該合金的應用范圍。雖然粉末冶金和SPDT技術可以進一步提升Zn合金材料的力學性能,然而在應用過程中,還需綜合考慮Zn合金材料抗疲勞性能以及存儲過程中的力學性能的變化和臨床使用過程中的降解情況。
由各種原因導致的骨缺損一直是臨床醫生面臨的棘手問題。為了高效的組織再生和大骨缺損的重建,植入物需要具備合適的孔隙率和孔隙間的互聯性,以利于細胞的有效遷移和滲透。傳統粉末冶金等方法制備的多孔金屬不能產生完全互聯的多孔結構,也無法滿足復雜骨缺損的外部設計和復雜的內部結構。AM技術是目前生產多孔Zn合金材料最具前景技術,它通過“分層制造、逐層疊加”的方式快速構造出任意復雜物理結構的三維(three dimension,3D)打印多孔Zn合金骨科植入材料。AM技術包括直接能量成形(direct energy deposition,DED)、粉床熔融成形(powder bed fusion,PBF)和黏結劑噴射成形(binder jetting,BJ)等。DED和PBF可以進一步分為激光DED(laser DED,LDED)、電子束DED(electron beam DED, EB-DED)、激光PBF(laser PBF,LPBF)和電子束PBF(electron beam PBF,EB-PBF)技術。其中LPBF技術已用于制備生物可降解3D打印多孔Zn合金骨科植入材料。該方法可使Zn合金材料的晶粒細化,其力學性能比鑄態和變形態的Zn合金材料明顯提高[32-34]。目前利用AM技術可以構建與缺損骨組織外形相匹配且與人皮質骨或松質骨具有相近彈性模量的3D打印多孔Zn合金骨植入材料[35]。Li等[36]采用LPBF技術制備出具有密度梯度的3D打印多孔Zn合金材料,通過28 d的動態體外降解實驗發現,其體積損失為7.1%~11.9%,彈性模量和屈服強度的力學性能均在人類松質骨的范圍內。但研究中,由于Zn的熔點和沸點較低,在激光熔化過程中會發生大量蒸發,導致嚴重的飛濺和氣孔,使激光能量輸入在粉床上不穩定,導致材料的成型質量過低[37]。因此需要調節粉體性能、工藝參數、掃描策略和氣體流量等各種因素以提高成型質量[38-39]。未來,除了不斷優化3D打印多孔Zn合金材料的加工參數外,還應通過改變孔隙形狀、孔隙率等方面入手模擬骨小梁的結構特點,設計制造出更加仿真的3D打印多孔Zn合金骨科植入材料,以有利于人體的血管和肌肉長入,便于運送血液和營養物質,真正可實現人工骨骼替代[40]。
4 生物可降解Zn合金骨科植入材料結構的優化設計
在尸體標本上進行生物力學測試是判斷離體骨植入材料初始穩定性的“金標準”,但在體內應用生物可降解Zn合金骨植入材料后,其機械強度會隨著時間的推移而降低,因此需要充分考慮材料的生物降解速率[41]。拓撲優化技術可根據給定的負載情況和性能指標,對材料進行數學運算,從而設計出某種力學性能最優且滿足負載條件的結構。Vautrin等[42]運用了一種時間依賴的計算方法,建立包含Mg合金體內降解和骨折愈合的有限元模型,驗證了生物可降解Mg合金釘板系統在人體下頜骨骨折愈合早期(手術后兩個月)的力學穩定性,并通過計算機模擬實現對該釘板內固定系統結構的優化設計。Zhang等[43]通過建立材料的降解模型,利用所提出的拓撲優化方法設計出在骨修復階段強度最大化的可降解金屬骨植入物,并提出一種同時考慮拓撲優化和材料降解的新設計方法,可結合AM技術獲得增強骨折愈合的高性能植入物。目前,針對生物可降解Zn合金骨植入材料的拓撲優化設計還很少,人們可以借鑒現有Mg合金等可降解金屬材料的研究成果開發適合可降解Zn合金骨植入材料的演變模型,設計出滿足力學強度要求、結構最為簡化的可降解Zn合金骨科植入材料。未來,還可以結合AM技術實現生物可降解Zn合金骨植入材料的個性化打印,以滿足患者的多元需求。
5 前景與展望
雖然采用合金化、二次加工處理等方法使生物可降解Zn合金骨植入材料的性能逐步完善,但過多合金元素的添加容易導致植入物的局部非均勻降解,難以保證服役期間的力學完整性[44]。表面改性技術在增強Zn合金力學性能的同時還可保持材料的整體性能,是一種低成本且簡單有效的方法。目前常見的表面改性技術如沉積涂層、轉化涂層和復合涂層等已被用于制備生物可降解Zn合金骨植入材料。近年來一些機械涂層技術如等離子體表面工程、磁控濺射等,通過直接在金屬表面進行機械加工,使 Zn合金表面晶粒細化,優化合金元素分布,減少生物可降解Zn合金骨植入材料的局部腐蝕,從而改善服役行為[45]。這些技術和方法也將有力推動生物可降解Zn合金骨植入材料的應用。
從生物安全性的角度來看,關于生物可降解Zn合金骨植入材料用于體內的研究仍較少,所以需要更多的接近人體應用環境的大動物實驗(原位)研究進行長期驗證。從機械強度的角度來說,純Zn不滿足作為骨植入物的要求,雖然可通過復雜多樣的加工工藝提升Zn合金的力學性能,但缺乏相對各類工藝對生物可降解Zn合金骨植入材料力學性能和腐蝕性能等影響的系統性評價。值得一提的是,很少有研究強調抗蠕變對骨植入材料的重要性,在使用生物可降解Zn合金骨科植入材料時,應考慮大的蠕變應變可能造成的植入物松動。相信隨著研究的不斷深入,生物可降解Zn合金骨植入物的綜合性能會更為出色,各類相關產品將會問世并造福人類。
重要聲明
利益沖突聲明:本文全體作者均聲明不存在利益沖突。
作者貢獻聲明:張天蔚負責綜述構思、資料收集、文章撰寫;劉宇宸、王韋丹參與文章修改整理、分析總結;趙德偉對文章的知識性內容作批評性審閱,并提出重要參考意見。
0 引言
生物可降解金屬材料具有良好的力學強度和生物可降解性,可有效地解決應力遮擋和二次手術相關的臨床問題,是一種極具應用前景的骨植入材料。理想的生物可降解金屬骨植入材料應滿足以下幾點: ① 在炎癥和修復階段,植入物應具有足夠的強度來支撐骨折或缺損區域的應力,提供足夠的結構穩定性。② 在骨重建階段,骨折或缺損的部位需要適當的刺激,即應力刺激,以保證骨的有效愈合。隨著金屬的降解,材料剛度逐漸降低,利于載荷轉移到骨,避免應力遮擋引起的骨吸收。③ 骨折愈合后,不需要二次手術取出[1]。除此以外,近年來生物可降解金屬骨植入材料正向功能化發展,即材料本身具有骨誘導性,可促進骨組織的再生。目前生物可降解金屬材料的研究主要包括鎂(Mg)、鋅(Zn)和鐵(Fe)三個體系。由于Fe的降解速率過慢,容易引起和不可降解金屬同樣的應力遮蔽問題,最終導致骨密度降低(骨量減少),因此應用受限。Mg合金具有很好的生物相容性和成骨活性,具有與天然骨骼相似的力學性能,已被用做骨修復材料。目前,德國的Mg-釔(Y)-鑭(Re) -鋯(Zr)合金螺釘已經成功通過歐洲一致性認證,獲批進入醫療器械市場應用于各類骨折手術。韓國Mg-鈣(Ca)-Zn合金螺釘、我國的高純Mg螺釘和Mg-釹(Nd)-Zn-Zr合金螺釘均已陸續開展臨床試驗,均獲得了良好的效果[2]。但Mg在人體環境中降解速率過快,降解時產生較多的氫氣,可能會影響植入術后的切口愈合。Zn的降解速率介于Mg和Fe之間,可在生物體內均勻降解,降解過程中不產生氫氣,同時具備骨植入材料的服役要求,不產生應力遮擋,逐漸被認為是一種極具應用前景的骨植入材料[3]。目前已有Zn合金接骨板用于人體下頜骨骨折。生物可降解Zn合金骨植入材料的應用主要包括骨接合植入器件(如接骨板、接骨螺釘)和骨修復材料(如金屬補塊)等。根據使用部位是否負重,對Zn合金的生物活性、機械強度和韌性等要求也不同。本文總結了生物可降解Zn合金骨植入材料的生物學作用和研究成果,分析了不同加工方式對Zn合金材料性能的影響,為制備滿足不同服役條件的Zn合金骨植入材料提供了系統的設計理念,為研究者提供更為全面的參考。
1 生物可降解Zn合金作為骨植入材料的生物作用
Zn是人體第二大必需微量元素,它參與機體基因表達、信號傳導等重要的生理過程[4]。Zn能夠通過多種途徑影響人體內骨的形成[5]。研究表明,Zn可通過調控成骨細胞特異性轉錄因子2(runt-related transcription factor 2,Runx2)的表達,提升骨鈣素、I型膠原蛋白和堿性磷酸酶的合成和活性[6-7],增加Ca和磷(P)的積累,促進骨生成。此外,Zn能刺激成骨細胞產生骨保護素(osteoprotegerin, OPG),OPG可與核因子-κB(nuclear factor kappa-B,NF-κB)配體的受體激活劑(receptor activator of NF-κB ligand,RANKL)結合,從而抑制RANKL與破骨前體細胞NF-κB受體激活劑(receptor activator of NF-κB,RANK)的結合,減少破骨細胞形成,防止骨質流失。因此Zn合金是一種具有生物活性的生物可降解材料[8]。
現有理論認為,攝入過量的Zn可以通過腎臟排出體外,但長期攝入可能會對人體肝、脾、大腦、心臟等重要器官產生損傷,同時導致銅缺乏并對脂蛋白譜產生不利影響[9]。但Qu等[10]對純Zn進行了體外細胞相容性評價,發現純Zn對小鼠前成骨細胞的增殖活性無明顯影響。Bowen等[11]將純Zn絲植入到老鼠血管內,結果表明Zn以及其降解產物不會引起溶血反應和周圍組織的炎癥反應,同時Zn能夠抑制平滑肌細胞增殖、抑制血管再狹窄,實驗過程中動物并未表現出全身或局部的毒性反應。生物可降解Zn合金材料的降解速率通常較慢,因此局部小范圍的應用一般不會引起整體內環境的改變,所以生物可降解Zn合金作為骨植入材料理論上也是安全可行的。但目前對于可降解Zn合金材料的生物安全性仍缺乏一致性評價,缺乏行業內部的相關標準,因此在生物可降解Zn合金骨植入物材料開發過程中必須對其生物相容性給予足夠的關注與評價。
2 合金化對生物可降解Zn合金骨植入材料的性能影響
與鈦(Ti)或不銹鋼材料相比,Zn的力學性能更接近人體骨骼,但具有密排六方晶體結構的純Zn只有兩個獨立的滑移系,因此在鑄態下表現出極低的伸長率和屈服強度,且純Zn再結晶溫度低,在室溫會產生蠕變現象,很難滿足骨植入材料對力學性能的基本要求。合金化被認為是一種提高Zn力學性能的有效手段。
2.1 二元合金
近年來,國內外科研人員陸續開發出了一系列具有優良力學性能的可降解二元Zn合金體系。但作為骨植入材料,合金元素的選擇需要充分考慮元素的生物安全性,通常選擇人體自身含有的金屬元素或者對人體無毒副作用的元素。Li等[12]從微觀結構、力學性能、降解速率和體內外生物相容性等方面系統評價了Mg、Ca、鍶(Sr)等8種營養元素組成的新型Zn基二元合金(Zn-1X),其中X指代該研究里Mg、Ca、Sr等8種任意營養元素,這類元素的添加顯著改善了純Zn的力學性能和生物相容性。Ti是目前應用最為廣泛的骨植入材料,具良好的生物相容性和力學性能。Wang等[13]對不同加工方式的Zn-xTi合金(x表示Zn-xTi合金中鈦元素的質量分數,以下沿用這種表達方式)的力學性能進行了研究,發現軋制后的Zn-xTi合金力學性能顯著提升,適合在人體負重區使用。Jia等[14]在純Zn中加入不同質量分數的微量元素錳(Mn),制備生物可降解的Zn-xMn合金,Mn的加入提高了純Zn的力學性能,其中Zn-0.8Mn合金的延伸率達到(83.96 ± 2.36)%,因此耐疲勞性更好,Mn還可促進骨形成,可用于設計具有骨誘導功能的植入材料。研究表明Sr具有良好的成骨作用和促血管生成作用, 因此Zn-Sr合金可能是一種良好骨組織工程材料,可用于創傷造成的骨缺損[15-16]。目前常見的生物可降解Zn-1X合金[12-22],如表1所示。
2.2 三元合金
三元合金體系仍缺乏研究,目前骨科植入產品主要在Zn-Mg合金的基礎上添加例如Sr、Ca和Fe等人體必須元素來提升Zn合金的綜合性能。Klíma等[23]將Zn–0.8Mg–0.2Sr合金螺釘植入白兔脛骨中,120 d內未觀察到炎癥反應或骨吸收,這種含Sr的Zn合金植入體表面可見到結構規則的骨和軟骨形成。Sun等[24]研制一種屈服強度高達317 MPa的Zn-0.8Mn-0.4Mg合金螺釘并用于兔前交叉韌帶重建術中,Mn元素的添加可顯著加速新骨形成并進一步誘導肌腱礦化,促進腱—骨整合,利于早期關節功能恢復和康復訓練,可能在未來具有廣泛的臨床應用前景。Shao等[25]設計了一種三元合金Zn-xMg-xFe,Fe元素使Zn-xMg合金具備更為優良的力學強度,由該合金制備成接骨板目前已經成功應用于人體下頜骨骨折的固定。在這些研究中,新型Zn基三元合金具有更為理想的力學性能和生物活性,為生物可降解骨植入材料提供了更多的選擇。
目前Zn合金種類繁多,多項研究從促進骨生成、改善降解行為、提高體外力學性能等多方面提出了生物可降解Zn合金作為骨植入物的合金化設計策略。人們還可以根據不同元素的生物學作用,選擇不同的合金化元素,制備更符合臨床實際應用的生物可降解Zn合金骨科植入產品。
3 不同加工工藝對生物可降解Zn合金骨植入材料的性能影響
除合金化方法外,熱處理、變形加工等加工工藝可通過改變Zn合金的顯微結構,從而提升Zn合金的綜合力學性能,滿足不同骨科植入材料的臨床服役要求。目前生物可降解Zn合金的加工方法包括傳統的鑄造、塑性變形加工技術 (plastic deformation technique,PDT)和眾多先進的加工方法,包括常規粉末冶金(powder metallurgy,PM)、劇烈PDT (severe PDT,SPDT)、增材制造(additive manufacturing,AM)等。目前常見的生物可降解Zn合金所采用的加工工藝如圖1所示。
 圖1
常見生物可降解Zn合金骨植入材料的加工工藝
Figure1.
Processing technology of biodegradable Zn alloy used for bone implant
圖1
常見生物可降解Zn合金骨植入材料的加工工藝
Figure1.
Processing technology of biodegradable Zn alloy used for bone implant
3.1 傳統方法
鑄造工藝可分為擠壓鑄造、重力鑄造和砂型鑄造三類,其中擠壓鑄造是可降解Zn合金最常用的加工工藝。鑄造的Zn合金表現出非常低的抗拉強度,無法滿足骨科植入物的力學要求,但鑄造可以直接創建所需的產品輪廓(例如接骨板內固定系統),作為后續加工過程的原材料。目前常用的PDT方法包括擠壓、拉拔、鍛造和軋制等。Yang等[26]利用熱擠壓技術生產的Zn-0.4Mg合金板屈服強度(yield strength ,YS)、抗拉強度(tensile strength,TS)、延伸率分別為284 MPa、353 MPa、15.2%,符合生物可降解骨科內固定材料的力學標準(YS>230 MPa、TS>300Mpa、延伸率>18%)[27]。因此,PDT也是常用于改善Zn合金骨科植入材料力學性能的二次加工技術。
3.2 先進加工技術
Zn合金的晶粒結構是六邊形密堆積,室溫下的加工能力較差,傳統鑄造等加工工藝效率偏低、成本較高[28],因此不適合Zn合金骨植入材料的批量生產。近年來,隨著Zn合金作為可降解骨植入材料的研究越來越深入,為了滿足臨床多元化的要求,已有越來越多的先進加工技術用于可降解Zn合金骨科植入產品的研發。
粉末冶金是制備復合材料的常用方法,該方法可制備出成分均勻、晶粒細小、性能優異的Zn合金,幾乎可達到骨植入材料最終的成形要求。Sotoudeh等[29]采用粉末冶金方法制備具有納米結構Zn-Mn合金,該合金具有較高的抗壓強度和斷裂伸長率,同時具有良好耐腐蝕性能,符合骨植入物的基本力學要求。SPDT技術(如高壓扭轉、等通道轉角擠壓等)可以產出超細晶粒,因而可以提高合金材料的塑性。W?troba等[30]通過高壓扭轉技術合成了Zn–3Ag-0.5Mg合金,該超細晶金屬復合物具有極高的硬度,未來可能制備用于負重部位骨折的釘板內固定系統。Liu等[31]采用12道次等通道轉角擠壓工藝制備了Zn-1.6Mg合金,使其屈服強度和延伸率從鑄態時的82.3 MPa和1.4%提高到361 MPa和5.2%,極大地拓展了該合金的應用范圍。雖然粉末冶金和SPDT技術可以進一步提升Zn合金材料的力學性能,然而在應用過程中,還需綜合考慮Zn合金材料抗疲勞性能以及存儲過程中的力學性能的變化和臨床使用過程中的降解情況。
由各種原因導致的骨缺損一直是臨床醫生面臨的棘手問題。為了高效的組織再生和大骨缺損的重建,植入物需要具備合適的孔隙率和孔隙間的互聯性,以利于細胞的有效遷移和滲透。傳統粉末冶金等方法制備的多孔金屬不能產生完全互聯的多孔結構,也無法滿足復雜骨缺損的外部設計和復雜的內部結構。AM技術是目前生產多孔Zn合金材料最具前景技術,它通過“分層制造、逐層疊加”的方式快速構造出任意復雜物理結構的三維(three dimension,3D)打印多孔Zn合金骨科植入材料。AM技術包括直接能量成形(direct energy deposition,DED)、粉床熔融成形(powder bed fusion,PBF)和黏結劑噴射成形(binder jetting,BJ)等。DED和PBF可以進一步分為激光DED(laser DED,LDED)、電子束DED(electron beam DED, EB-DED)、激光PBF(laser PBF,LPBF)和電子束PBF(electron beam PBF,EB-PBF)技術。其中LPBF技術已用于制備生物可降解3D打印多孔Zn合金骨科植入材料。該方法可使Zn合金材料的晶粒細化,其力學性能比鑄態和變形態的Zn合金材料明顯提高[32-34]。目前利用AM技術可以構建與缺損骨組織外形相匹配且與人皮質骨或松質骨具有相近彈性模量的3D打印多孔Zn合金骨植入材料[35]。Li等[36]采用LPBF技術制備出具有密度梯度的3D打印多孔Zn合金材料,通過28 d的動態體外降解實驗發現,其體積損失為7.1%~11.9%,彈性模量和屈服強度的力學性能均在人類松質骨的范圍內。但研究中,由于Zn的熔點和沸點較低,在激光熔化過程中會發生大量蒸發,導致嚴重的飛濺和氣孔,使激光能量輸入在粉床上不穩定,導致材料的成型質量過低[37]。因此需要調節粉體性能、工藝參數、掃描策略和氣體流量等各種因素以提高成型質量[38-39]。未來,除了不斷優化3D打印多孔Zn合金材料的加工參數外,還應通過改變孔隙形狀、孔隙率等方面入手模擬骨小梁的結構特點,設計制造出更加仿真的3D打印多孔Zn合金骨科植入材料,以有利于人體的血管和肌肉長入,便于運送血液和營養物質,真正可實現人工骨骼替代[40]。
4 生物可降解Zn合金骨科植入材料結構的優化設計
在尸體標本上進行生物力學測試是判斷離體骨植入材料初始穩定性的“金標準”,但在體內應用生物可降解Zn合金骨植入材料后,其機械強度會隨著時間的推移而降低,因此需要充分考慮材料的生物降解速率[41]。拓撲優化技術可根據給定的負載情況和性能指標,對材料進行數學運算,從而設計出某種力學性能最優且滿足負載條件的結構。Vautrin等[42]運用了一種時間依賴的計算方法,建立包含Mg合金體內降解和骨折愈合的有限元模型,驗證了生物可降解Mg合金釘板系統在人體下頜骨骨折愈合早期(手術后兩個月)的力學穩定性,并通過計算機模擬實現對該釘板內固定系統結構的優化設計。Zhang等[43]通過建立材料的降解模型,利用所提出的拓撲優化方法設計出在骨修復階段強度最大化的可降解金屬骨植入物,并提出一種同時考慮拓撲優化和材料降解的新設計方法,可結合AM技術獲得增強骨折愈合的高性能植入物。目前,針對生物可降解Zn合金骨植入材料的拓撲優化設計還很少,人們可以借鑒現有Mg合金等可降解金屬材料的研究成果開發適合可降解Zn合金骨植入材料的演變模型,設計出滿足力學強度要求、結構最為簡化的可降解Zn合金骨科植入材料。未來,還可以結合AM技術實現生物可降解Zn合金骨植入材料的個性化打印,以滿足患者的多元需求。
5 前景與展望
雖然采用合金化、二次加工處理等方法使生物可降解Zn合金骨植入材料的性能逐步完善,但過多合金元素的添加容易導致植入物的局部非均勻降解,難以保證服役期間的力學完整性[44]。表面改性技術在增強Zn合金力學性能的同時還可保持材料的整體性能,是一種低成本且簡單有效的方法。目前常見的表面改性技術如沉積涂層、轉化涂層和復合涂層等已被用于制備生物可降解Zn合金骨植入材料。近年來一些機械涂層技術如等離子體表面工程、磁控濺射等,通過直接在金屬表面進行機械加工,使 Zn合金表面晶粒細化,優化合金元素分布,減少生物可降解Zn合金骨植入材料的局部腐蝕,從而改善服役行為[45]。這些技術和方法也將有力推動生物可降解Zn合金骨植入材料的應用。
從生物安全性的角度來看,關于生物可降解Zn合金骨植入材料用于體內的研究仍較少,所以需要更多的接近人體應用環境的大動物實驗(原位)研究進行長期驗證。從機械強度的角度來說,純Zn不滿足作為骨植入物的要求,雖然可通過復雜多樣的加工工藝提升Zn合金的力學性能,但缺乏相對各類工藝對生物可降解Zn合金骨植入材料力學性能和腐蝕性能等影響的系統性評價。值得一提的是,很少有研究強調抗蠕變對骨植入材料的重要性,在使用生物可降解Zn合金骨科植入材料時,應考慮大的蠕變應變可能造成的植入物松動。相信隨著研究的不斷深入,生物可降解Zn合金骨植入物的綜合性能會更為出色,各類相關產品將會問世并造福人類。
重要聲明
利益沖突聲明:本文全體作者均聲明不存在利益沖突。
作者貢獻聲明:張天蔚負責綜述構思、資料收集、文章撰寫;劉宇宸、王韋丹參與文章修改整理、分析總結;趙德偉對文章的知識性內容作批評性審閱,并提出重要參考意見。