本研究旨在探索脈沖電磁場(PEMF)調控間充質干細胞外泌體(MSCs-Exo)對軟骨細胞凋亡的作用。采用強度1 mT,頻率15、45、75 Hz的PEMF在體外干預MSCs 30 min后提取外泌體并鑒定。熒光標記PEMF干預前后的MSCs-Exo,并分別與星形孢菌素(STS)誘導的軟骨細胞共培養24 h,觀察軟骨細胞對MSCs-Exo的攝取、細胞的凋亡及細胞內aggrecan、caspase-3和collagenⅡA的基因和蛋白表達變化。與15 Hz組和45 Hz組相比,75 Hz的PEMF顯著增強了MSCs-Exo抑制軟骨細胞凋亡、促進細胞外基質合成的作用。本研究為應用PEMF調控MSCs-Exo的生物學功能提供了研究基礎,為優化利用MSCs-Exo抑制軟骨細胞凋亡提供了新的研究方向。
引用本文: 徐揚, 王謙, 汪香秀, 向小娜, 彭佳蕾, 張獎銀, 何紅晨. 脈沖電磁場調控間充質干細胞外泌體抑制軟骨細胞凋亡的研究. 生物醫學工程學雜志, 2023, 40(1): 95-102. doi: 10.7507/1001-5515.202209053 復制
版權信息: ?四川大學華西醫院華西期刊社《生物醫學工程學雜志》版權所有,未經授權不得轉載、改編
0 引言
骨關節炎(osteoarthritis,OA)是一種常見的慢性疾病,也是老年人殘疾的主要原因[1]。在骨關節炎疾病進程中,關節軟骨的再生是治療骨關節炎的主要挑戰之一[2-3]。骨關節炎的發病機制與軟骨細胞凋亡和組織減少有關,由于關節軟骨完全依賴軟骨細胞來維持細胞外基質,因此軟骨細胞的功能受損和細胞死亡將導致關節軟骨的退變[2,4]。文獻顯示軟骨損傷程度與軟骨細胞凋亡有一定的相關性,軟骨細胞死亡和基質丟失可能形成惡性循環[5]。因此探索安全有效的抑制關節軟骨細胞凋亡[6]、促進關節軟骨再生修復的方法是促進骨關節炎患者全面康復的迫切需求。
關節軟骨作為一種終末分化的結締纖維組織,缺乏血液供應、淋巴循環及神經支配,其損傷與退變難以自身修復[2]。目前正在探索的關節軟骨再生修復技術包括骨髓刺激技術、骨軟骨移植、軟骨細胞植入、干細胞技術及組織工程等[7]。其中,間充質干細胞(mesenchymal stem cells,MSCs)因其廣泛的來源、較強的增殖特性和多樣的分化潛能而被廣泛應用于骨與軟骨組織的再生修復[8]。而間充質干細胞外泌體(mesenchymal stem cells-derived exosomes,MSCs-Exo)通過旁分泌作用傳遞MSCs的生物學功能[9],避免了對于同種異體MSCs治療導致腫瘤、疾病傳播和宿主免疫排斥反應的擔憂,作為一種具有較好生物相容性、低免疫原性和低致瘤性的治療手段[10],被廣泛用于骨關節炎的再生治療研究。
多項研究發現,MSCs及其外泌體可通過抑制軟骨細胞的凋亡減輕骨關節炎的癥狀,促進關節軟骨修復[11]。然而,MSCs-Exo的異質性導致的治療效果不佳已成為制約其臨床轉化的主要瓶頸[10]。因此,如何調控MSCs-Exo的生物學功能,并促進它對骨關節炎軟骨損傷的再生修復是MSCs-Exo轉化與應用的研究熱點。在康復醫學領域,脈沖電磁場(pulsed electromagnetic field,PEMF)作為一種物理因子治療方法,在臨床上應用于骨折延遲愈合、骨質疏松及骨關節炎的治療[12-14]。研究發現,8 Hz、3.8 mT和75 Hz、1.6 mT的PEMF均能促進骨關節炎軟骨損傷修復,改善軟骨下骨重建;抑制腫瘤壞死因子α(tumour necrosis factor-α,TNF-α)、白細胞介素-6(interleukin-6,IL-6)等炎癥因子,實現抑制Caspase 3/8軸誘導的軟骨細胞凋亡[15-17]。最新的研究發現,經過10 min的PEMF干預,MSCs的上清液也具有類似MSCs的生物學功能,如促進成軟骨分化、抑制骨關節炎軟骨細胞炎癥和凋亡、增加軟骨細胞遷移,提示PEMF可能通過調控MSCs的外泌體促進其抗凋亡作用[18]。但不同頻率的PEMF對于MSCs-Exo的作用尚未得到探索,通過PEMF調控MSCs-Exo治療骨關節炎的最佳頻率尚未得到統一。因此,本研究旨在探索不同頻率PEMF干預后的MSCs-Exo對軟骨細胞凋亡的作用。
1 材料和方法
1.1 材料
1.1.1 主要材料和試劑
Sprague-Dawley(SD)大鼠軟骨細胞與原代細胞DMEM/F-12基礎培養基、SD大鼠脂肪間充質干細胞(adipose mesenchymal stem cells,AMSCs)與原代細胞DMEM低糖基礎培養基、胎牛血清(Gibco,美國);細胞膜熒光探針(3,3′-dioctadecyloxacarbocyanine perchlorate,DiO)染色劑(優逸蘭迪,蘇州);Annexin V binding buffer、Annexin V-FITC、CFSE染色劑(索萊寶,北京);反轉錄試劑盒(翌圣,上海);anti-CD9/TSG101/SOX9/CASPASE-3(Abcam,英國)。
1.1.2 主要儀器設備
Cyto flex S流式細胞儀(Beckman,美國);western blot電泳系統(Bio-rad,美國);脈沖電磁場體外細胞干預系統[定制設計的PEMF系統包括一個波形信號發生器(DG1022U,RIGOL,蘇州)、一個可調開關電源(MS-605D,東莞麥生)、一個功率放大器和帶有3線圈陣列的亥姆霍茲線圈];細胞培養箱(Thermo,美國);酶標儀(Bio-rad,美國);超凈工作臺(Thermo,美國);倒置熒光顯微鏡(Leica,德國);MILi-Qso型超純水儀(Millipore,美國);高速冷凍離心機(Eppendorf,德國);Optima? XE超速離心機(Beckman Coulter,美國)。
1.2 實驗方法
1.2.1 SD大鼠軟骨細胞和AMSCs的體外培養
取兩周齡SD大鼠膝關節,用含100 U/mL青-鏈霉素的磷酸鹽緩沖液(phosphate buffer saline,PBS)將大鼠關節軟骨沖洗干凈,以0.25%胰酶在37 ℃、5% CO2培養箱中消化1 h后用無菌PBS沖洗兩次,將軟骨剪碎至勻漿狀,加入等體積完全培養基[10%胎牛血清(fetal bovine serum,FBS)+100 U/mL青-鏈霉素+DMEM/F-12基礎培養基],1 000 r/min離心5 min,再次加入含有0.5 μg/mL Ⅱ型膠原酶的完全培養基重懸細胞,過濾除菌后接種于培養皿中消化24 h,收集細胞懸液,加入等體積的完全培養基,300 g離心5 min,再次加入完全培養基重懸細胞,接種于新的細胞培養皿中。
取四周齡SD大鼠腹股溝處脂肪組織,去除表面的結締組織后放入含100 U/mL青-鏈霉素PBS的離心管中。將清洗后的脂肪組織轉移到干燥的培養基中,剪至漿糊狀后,加入2倍脂肪體積量的0.1%濃度Ⅰ型膠原酶,轉移至離心管中,置于37 ℃搖床上消化60 min。后加入含10% FBS的低糖基礎培養基(Dulbecco’s Modified Eagle Medium,DMEM)中和,300 g離心10 min,丟棄上層組織和液體后加入完全培養基重懸細胞,接種于培養皿中,24 h后首次換液。
兩種細胞分別置于細胞培養箱中進行培養,每3天更換一次培養基,細胞密度達80%~90%時傳代。
1.2.2 AMSCs的鑒定和三系分化
在干細胞培養至第三代時,用流式細胞術檢測AMSCs表型:將細胞用胰酶消化,用含Ca2+、游離Mg2+的PBS,1%牛血清白蛋白和13.6 mmol/L檸檬酸鈉的熒光激活細胞分選緩沖液沖洗2次,離心計數(1×107 cells/mL)。在200 μL細胞懸液中分別加入CD90、CD34、CD44和CD45抗體。隨后,同免疫球蛋白和異硫氰酸酯(fluorescein isothiocyanate,FITC)(10 μL)完全混合,室溫下反應30 min。離心后用流式細胞分析儀來檢測細胞表面抗原,之后用Flowjo軟件分析結果。
使用大鼠AMSCs成軟骨、成骨和成脂誘導試劑盒(賽業生物科技有限公司,美國),按照試劑盒操作方法對三代AMSCs進行成軟骨、成骨和成脂分化誘導操作。成軟骨誘導培養結束后行石蠟包埋切片,用阿利辛藍染色判定誘導結果:低倍鏡下可見藍色著色的酸性粘多糖說明該AMSCs具有成軟骨能力。成骨誘導培養結束后用4%中性甲醛固定,用茜素紅染色后于顯微鏡下觀察判定誘導結果:低倍鏡下可見紅色著色的鈣結節說明該AMSCs具有成骨能力。成脂誘導培養結束后用4%中性甲醛固定,用油紅O染液染色后于顯微鏡下觀察判定誘導結果:低倍鏡下可見大面積紅色著色點或20/40倍鏡下可見細胞內有紅色球形的脂滴說明該AMSCs具有成脂能力。
1.2.3 脈沖電磁場干預AMSCs
PEMF干預采用報道過的干預體系[19]置于37 ℃細胞恒溫培養箱中,該體系主要由PEMF信號發射器與圓柱電磁線圈組成(見附圖1)。信號發射器可發出脈沖持續時間300 μs,輸出強度1 mT、可調頻率的電磁場。第3~4代AMSCs 細胞接種于培養皿上,以無血清培養基培養,并置于PEMF 發生器內,給予強度1 mT,頻率分別為0、15、45、75 Hz 的PEMF干預30 min,24 h后取上清。
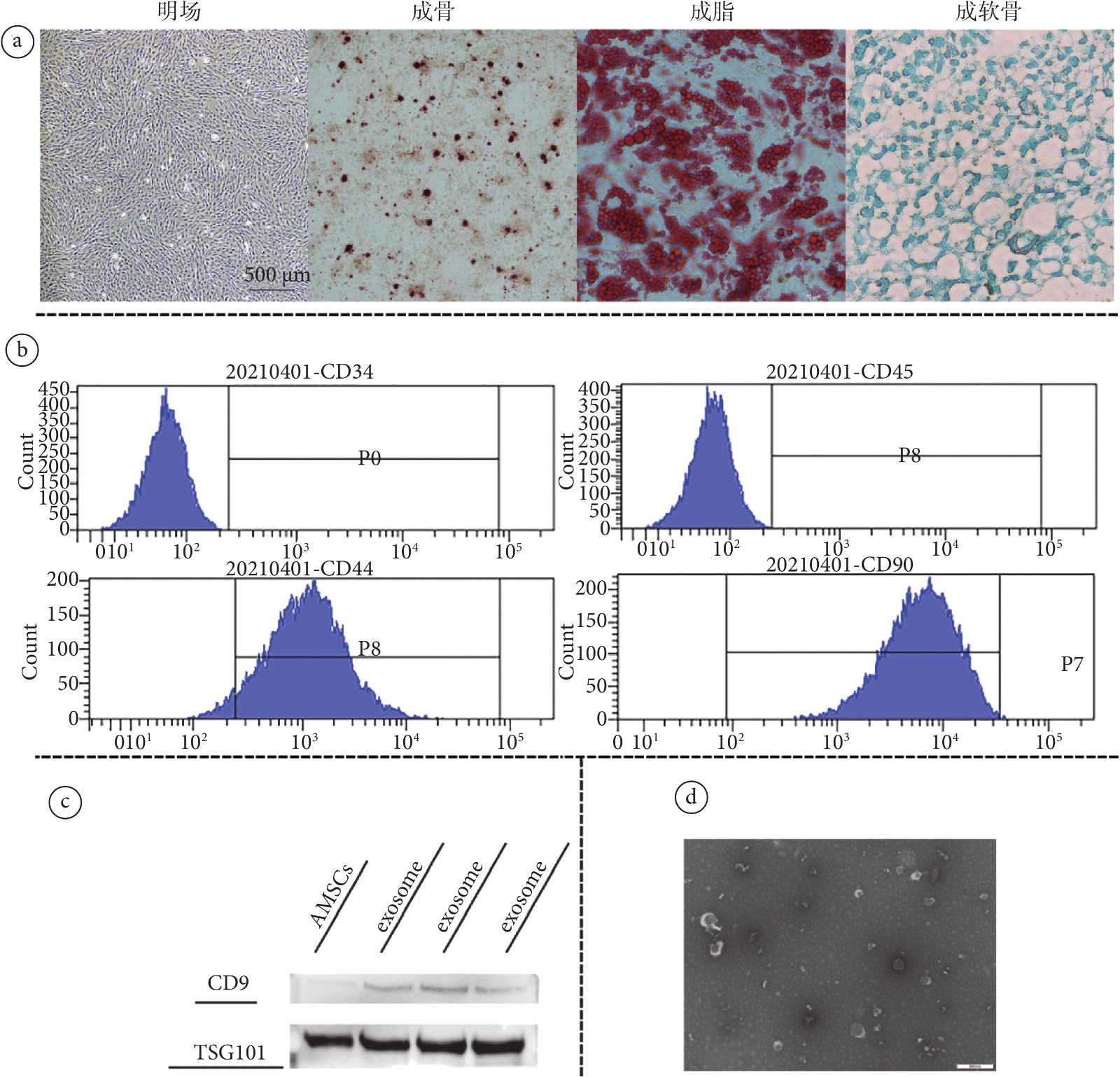
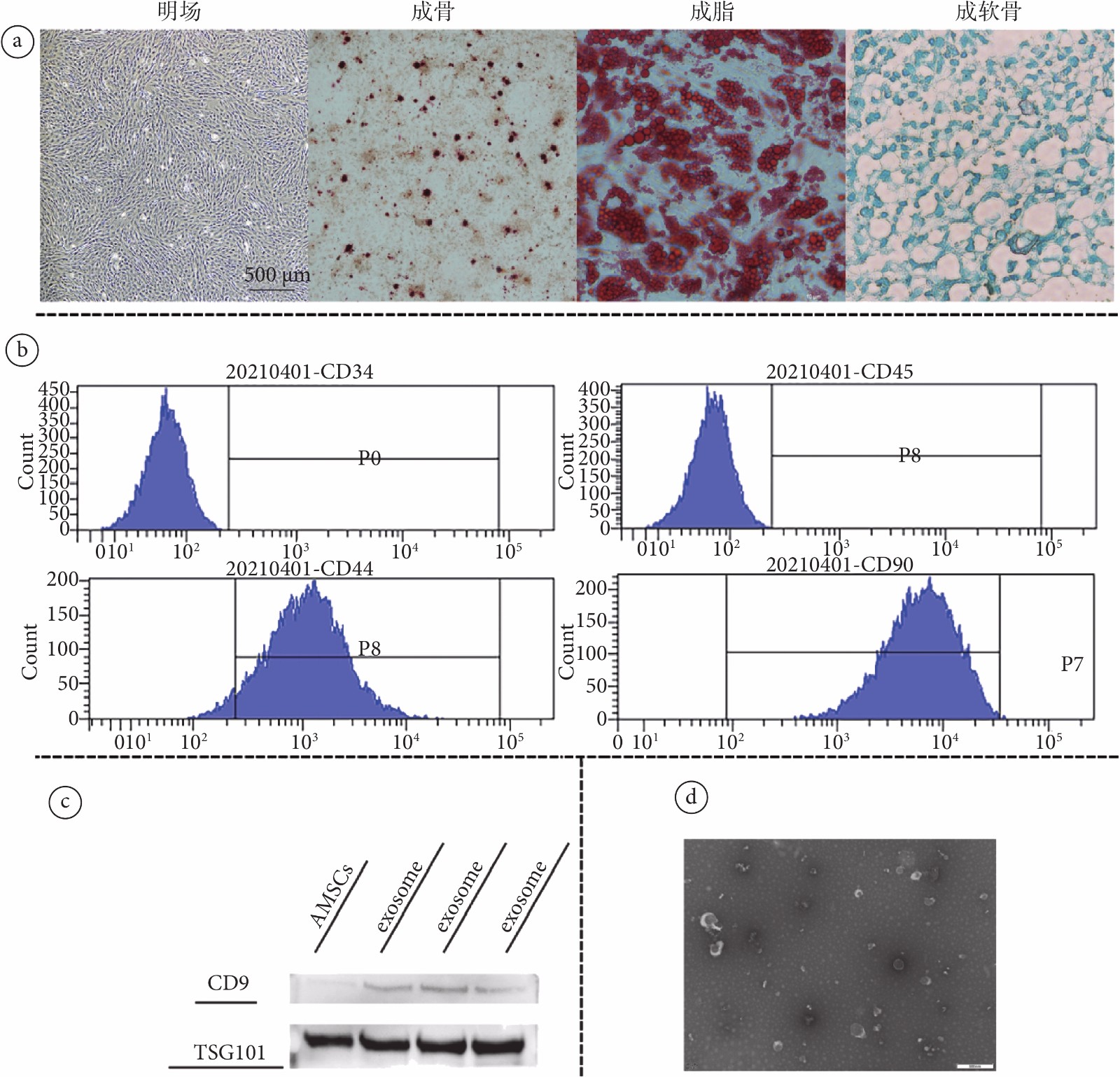 圖1
AMSCs及其外泌體的培養與鑒定
圖1
AMSCs及其外泌體的培養與鑒定
a. 間充質干細胞明場及三系分化誘導圖片;b. AMSC的流式鑒定結果,檢測到細胞表面抗原CD34、CD44、CD45和CD90;c. 外泌體WB結果圖片(三組exosome為平行實驗組);d. 外泌體電鏡結果
Figure1. Isolation and characterization of rat AMSCs and exosomesa. the osteogenic induction, adipogenic induction and chondrogenic induction of mesenchymal stem cells; b. cell surface antigens CD34, CD44, CD45 and CD90 were detected by flow cytometry; c. WB results of antibodies CD9 and TSG101 in exosomes; d. TEM result of exosomes
1.2.4 AMSCs外泌體的提取和鑒定
將AMSCs傳代培養至第3~4代,待細胞融合度達90%左右時,使用無血清的DMEM換液。放入細胞培養箱24 h后將培養皿取出,收集上清至離心管內,重復離心兩次取上清后,用0.22 μm過濾器過濾上清,取濾液以2 200 g離心35 min。取離心后上清于濃縮管中,1 360 g離心10 min,將濃縮管中上層液體轉移至離心管內。將離心管放入適配器中配平(差距小于0.1 g)后,于超高速離心機中以4 ℃、140 000 g離心90 min。離心結束后棄上清,所得沉淀重懸后即為外泌體懸液。
外泌體形態學觀察:吸取50 μL外泌體懸液滴在銅網上,室溫靜置1 min,用濾紙從側面吸干液體,使用2%磷鎢酸溶液在室溫下負染1 min,濾紙吸干染液,室溫晾干,于透射電鏡(transmission electron microscope,TEM)下觀察并拍照。用納米顆粒跟蹤分析(nanoparticle tracking analysis,NTA)測定外泌體濃度。外泌體標志蛋白檢測:通過免疫印跡分析(western blot,WB)進行外泌體表面標志物CD9、TSG101檢測。
1.2.5 DiO標記外泌體后與軟骨細胞共培養
按照DiO熒光染料試劑盒操作說明標記MSCs-Exo,該染料可染雙層分子膜使其呈紅色熒光。外泌體提取后用1 mL無菌PBS稀釋,加入1 μL DiO染料混勻后置于37 ℃避光孵育30 min,配平后120 000 g離心90 min,棄上清,用軟骨細胞的完全培養基重懸后與軟骨細胞共培養。20 h后使用4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)標記軟骨細胞,該染料可使細胞核呈藍色熒光。
1.2.6 外泌體對軟骨細胞凋亡的作用探索
將軟骨細胞以0.3×106個/孔的密度接種于6孔板內,分6組培養:A、對照組(control);B、凋亡組[星形孢菌素(staurosporine,STS)];C、外泌體治療組(STS+Exo);D、15 Hz外泌體治療組(STS+Exo,15 Hz);E、45 Hz外泌體治療組(STS+Exo,45 Hz);F、75 Hz外泌體治療組(STS+Exo,75 Hz)。該分組在圖片中均以A、B、C、D、E、F指代。對照組換液后將正常軟骨細胞培養24 h,凋亡組將4 μmol/L STS與軟骨細胞共培養24 h,治療組將不同頻率(0、15、45、75 Hz)、1 mT的PEMF干預后的外泌體(1×108個/mL)與4 μmol/L STS共同加入培養基中,與軟骨細胞共培養24 h。
軟骨細胞攝取外泌體情況:培養結束后,收集各組軟骨細胞,經胰酶消化并用基礎細胞培養基吹打成單細胞懸浮液。將細胞懸浮液直接涂片后在倒置熒光顯微鏡下拍照。
軟骨細胞凋亡檢測:根據凋亡檢測試劑盒說明,采用流式細胞術檢測軟骨細胞的凋亡情況。培養結束后,0.25%胰酶消化,離心后棄上清,用PBS洗滌一次,離心后棄上清;用1×Annexin V binding buffer重懸細胞,加入Annexin V-FITC,避光孵育10 min;加入PI和1×Annexin V binding buffer繼續避光孵育5 min,1 h內上機檢測。
軟骨細胞蛋白表達測定:用WB法,將提取的蛋白原液用WB試劑盒按照標準操作流程進行蛋白濃度測定,并將獲得的蛋白原液與上樣緩沖液配置混勻后于100 ℃加熱5 min進行變性,然后于120 V電泳。于冰浴中250 mA轉膜后,放入5%脫脂牛奶封閉1 h,結束后加入一抗,4 ℃孵育過夜。孵育結束后用1×TBST洗滌10 min,重復三次,加入二抗室溫孵育1 h。孵育結束后用1×TBST洗滌10 min,重復三次。使用顯影液在儀器上對條帶進行曝光并拍攝照片。
軟骨細胞核糖核酸(ribonucleic acid,RNA)表達測定:用反轉錄定量聚合酶鏈反應(real time-PCR,RT-PCR)法,采用Eastep?Super總RNA提取試劑盒提取RNA,去除基因組脫氧核糖核酸(deoxyribonucleic acid,DNA)反應后進行反轉錄,將反轉錄得到的液體稀釋后向96孔板上樣。完成上樣后放入熒光定量PCR儀進行PCR分析。得到的數據經過Excel處理后用Prism5.0軟件進行數據分析及圖像制作。引物序列見附表1。
1.3 統計學分析
采用SPSS 22.0統計軟件進行統計,實驗定量數據以 ±s表示,使用單因素方差分析比較多樣本均數差異,檢驗水準為0.05,在總體差異有統計學意義時,進一步用Bonferroni校正進行顯著性檢驗。
±s表示,使用單因素方差分析比較多樣本均數差異,檢驗水準為0.05,在總體差異有統計學意義時,進一步用Bonferroni校正進行顯著性檢驗。
2 結果
2.1 AMSCs培養及鑒定
觀察培養的AMSCs,可見細胞呈梭形,為典型的AMSCs形態(見圖1a)。流式細胞學鑒定檢測到細胞表面抗原CD34、CD44、CD45和CD90(見圖1b)。對細胞進行三系分化誘導,證明該細胞具有分化為軟骨細胞、骨細胞和脂肪細胞的能力(見圖1a)。以上結果均證明提取大鼠腹股溝脂肪進行原代細胞培養所得為AMSCs。
2.2 MSCs-Exo的鑒定
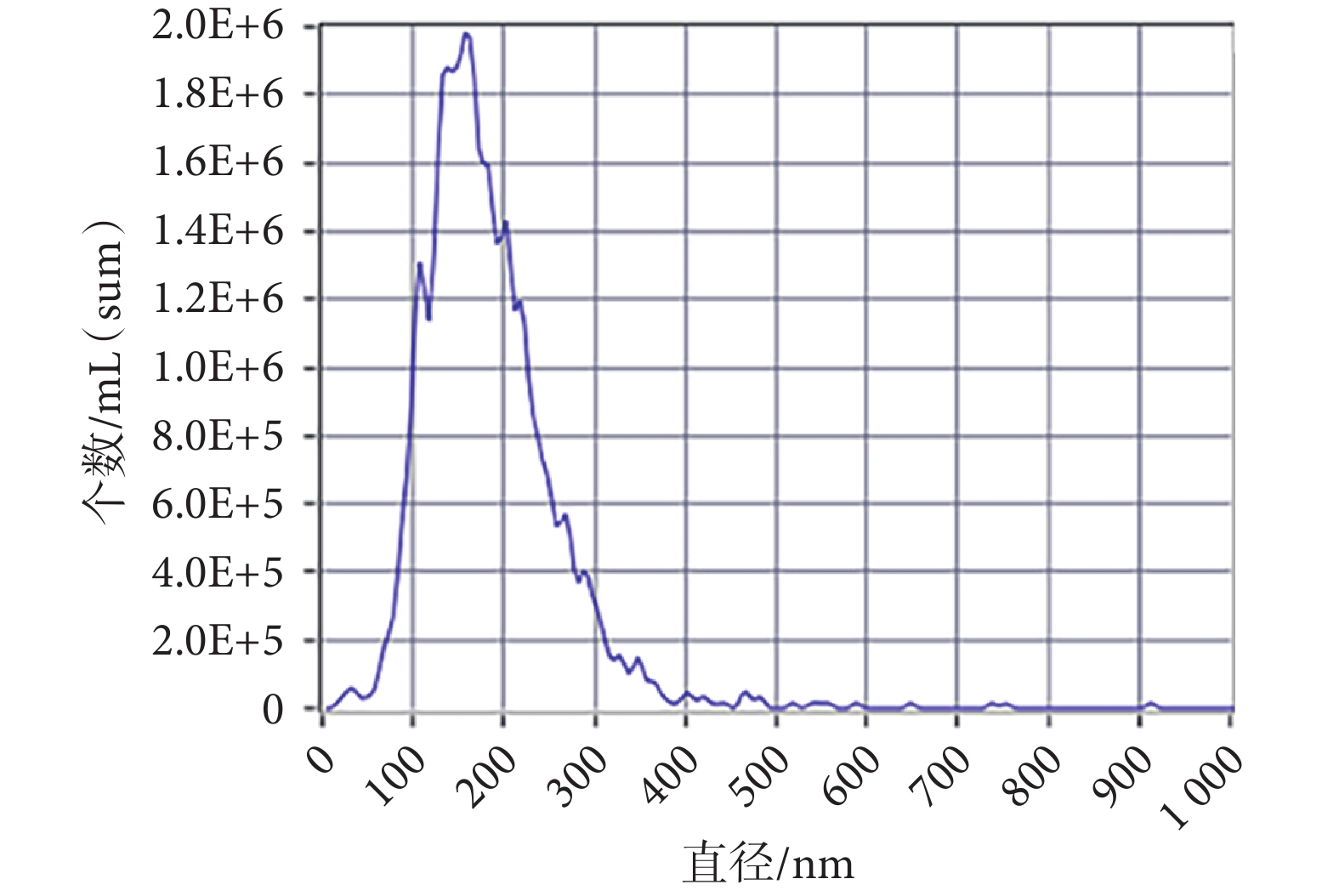
從外泌體中提取蛋白進行免疫印跡分析,檢測到外泌體內抗體CD9、TSG101表達相較于AMSCs內均增加(見圖1c,P < 0.01)。在TEM下觀察見外泌體形態呈茶托狀雙層膜結構(見圖1d)。NTA測得外泌體平均直徑為164.5 nm(見附圖2)。以上結果證明,通過超高速離心細胞上清所獲得的為AMSCs的外泌體。
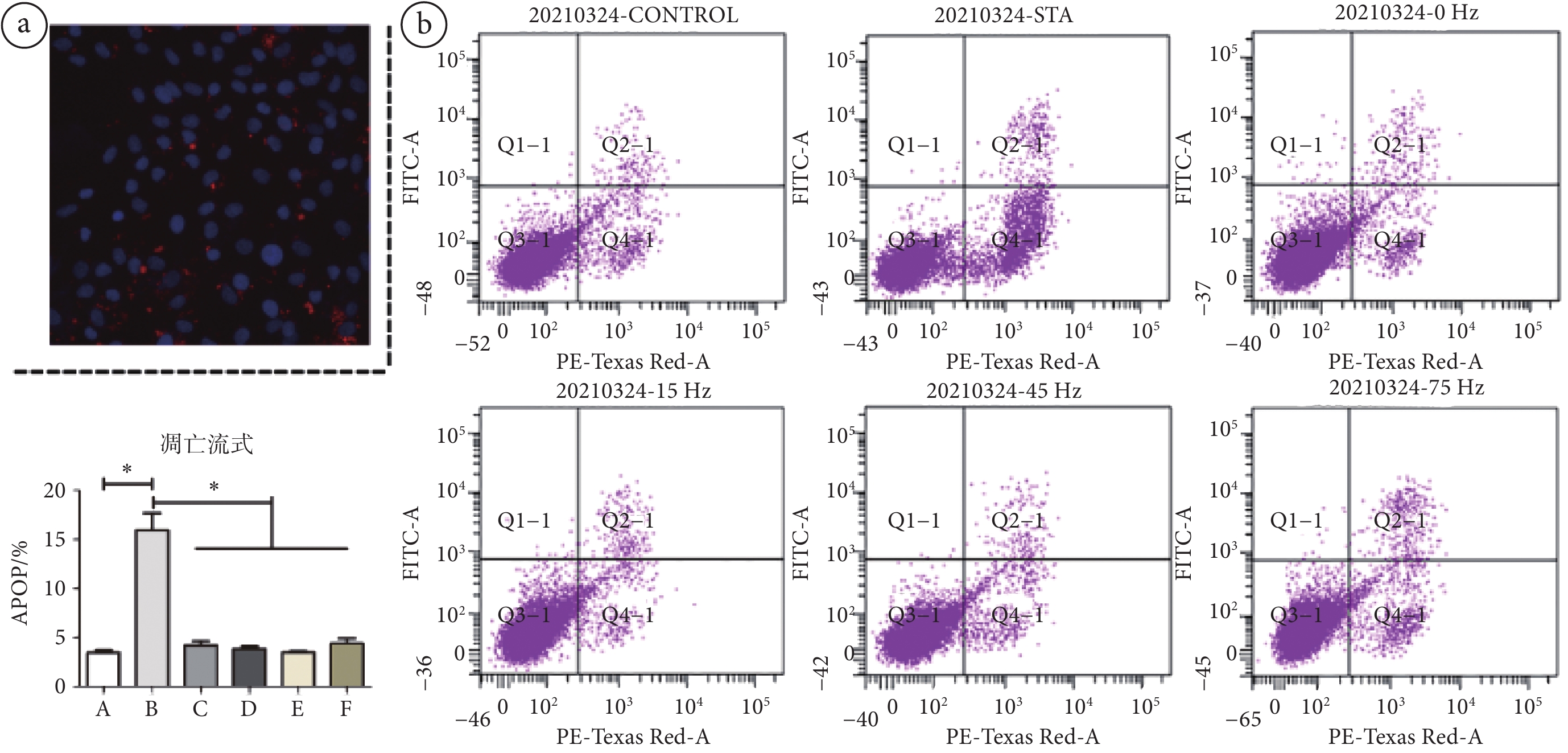
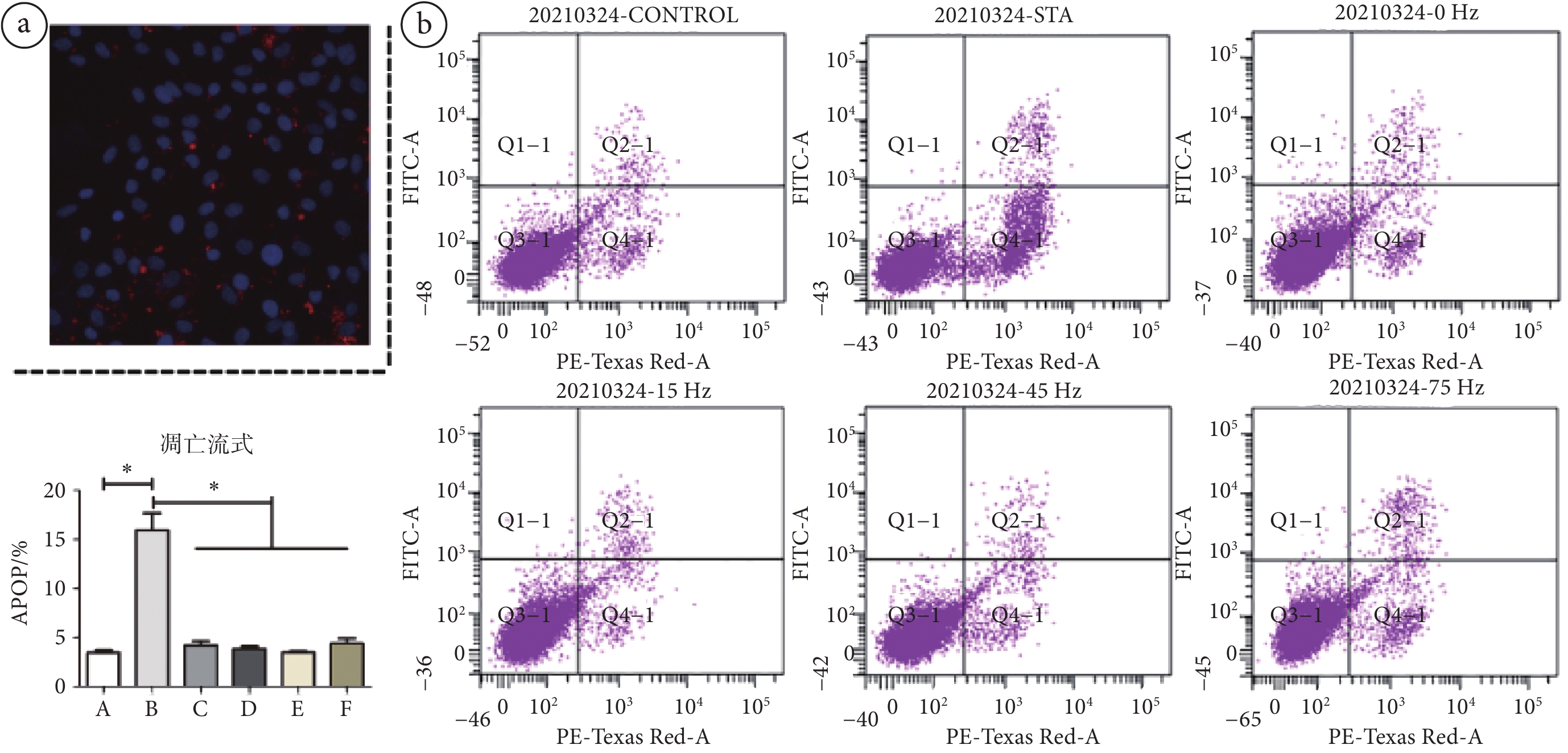 圖2
外泌體與軟骨細胞共培養
圖2
外泌體與軟骨細胞共培養
a. 軟骨細胞對外泌體的攝取;b. 流式細胞術檢測細胞凋亡率。*:
a. exosomes were endocytosed by chondrocytes thorough co-culture; b. the apoptosis rate was detected by flow cytometry. *:
2.3 軟骨細胞攝取外泌體
DiO標記的MSCs-Exo(紅色熒光)與DAPI標記的軟骨細胞(細胞核呈藍色熒光)共培養后,通過倒置熒光顯微鏡觀察,在軟骨細胞中可觀察到紅色點狀熒光(見圖2a)。結果證明,外泌體可通過與軟骨細胞共培養而被軟骨細胞攝取。
2.4 STS誘導軟骨細胞凋亡
流式細胞術檢測軟骨細胞凋亡的實驗結果如圖2b所示,在細胞培養基中加入4 μmol/L STS可使軟骨細胞凋亡率顯著增高(P < 0.01)。RT-PCR檢測結果(見圖3a)顯示,與對照組相比,STS誘導的凋亡組軟骨細胞內可聚蛋白多糖(aggrecan,ACAN)、Y染色體性別決定區(sex-determing region of Y chromosome,SRY)-盒轉錄因子9(SRY-box transcription factor 9,SOX9)、Ⅱ型膠原(Type Ⅱ collagen,COL2A)的mRNA表達顯著降低(P < 0.01,P < 0.01,P < 0.01),半胱氨酸-天冬氨酸蛋白酶-3(caspase-3)的mRNA表達明顯升高(P < 0.01);且WB結果(見圖3b)顯示,STS誘導顯著下調了軟骨細胞內SOX9的蛋白表達(P < 0.01),上調了caspase-3的蛋白表達(P < 0.01)。結果表明,STS誘導可抑制軟骨細胞活性,使軟骨細胞凋亡的生物標志物caspase-3合成增加,從而增加軟骨細胞凋亡;可造成細胞基質合成ACAN和COL2A能力下降,減少軟骨細胞細胞外基質的合成;還可造成SOX9合成降低,減少軟骨細胞分化。
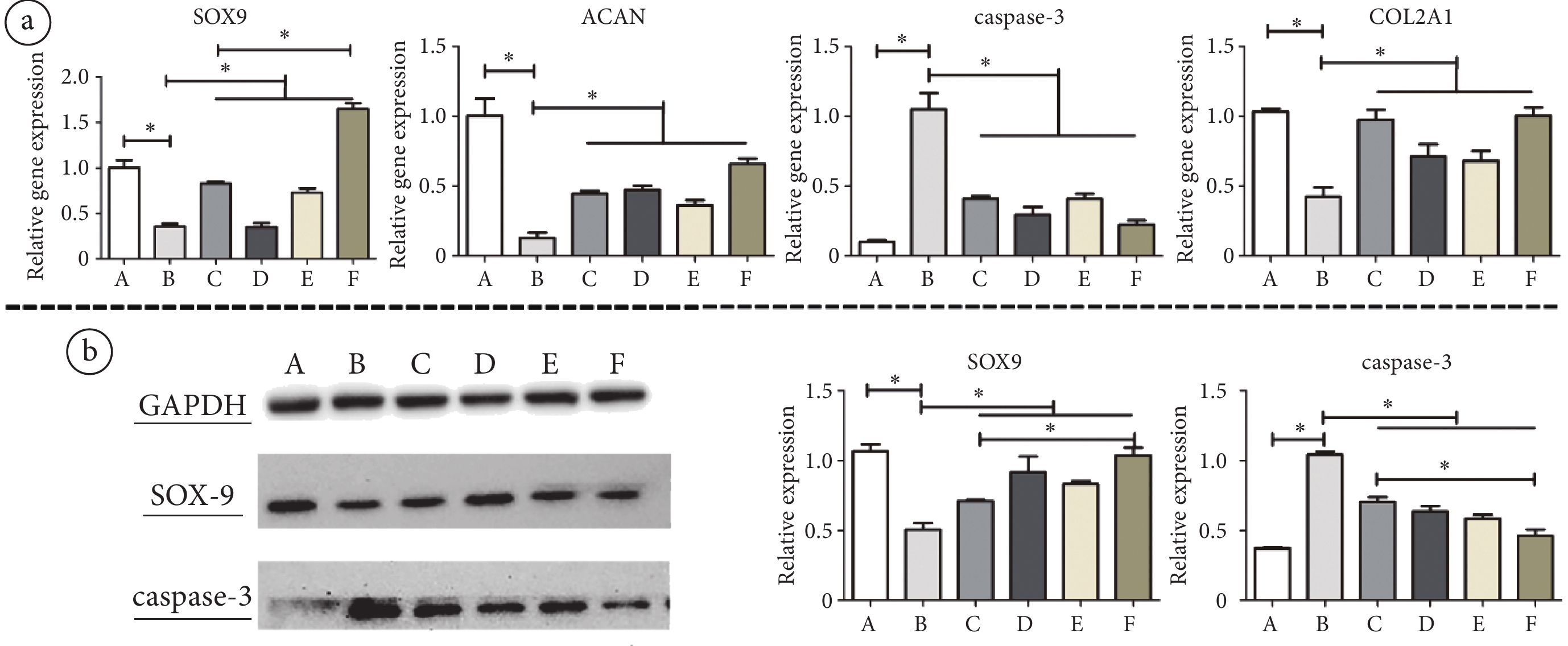
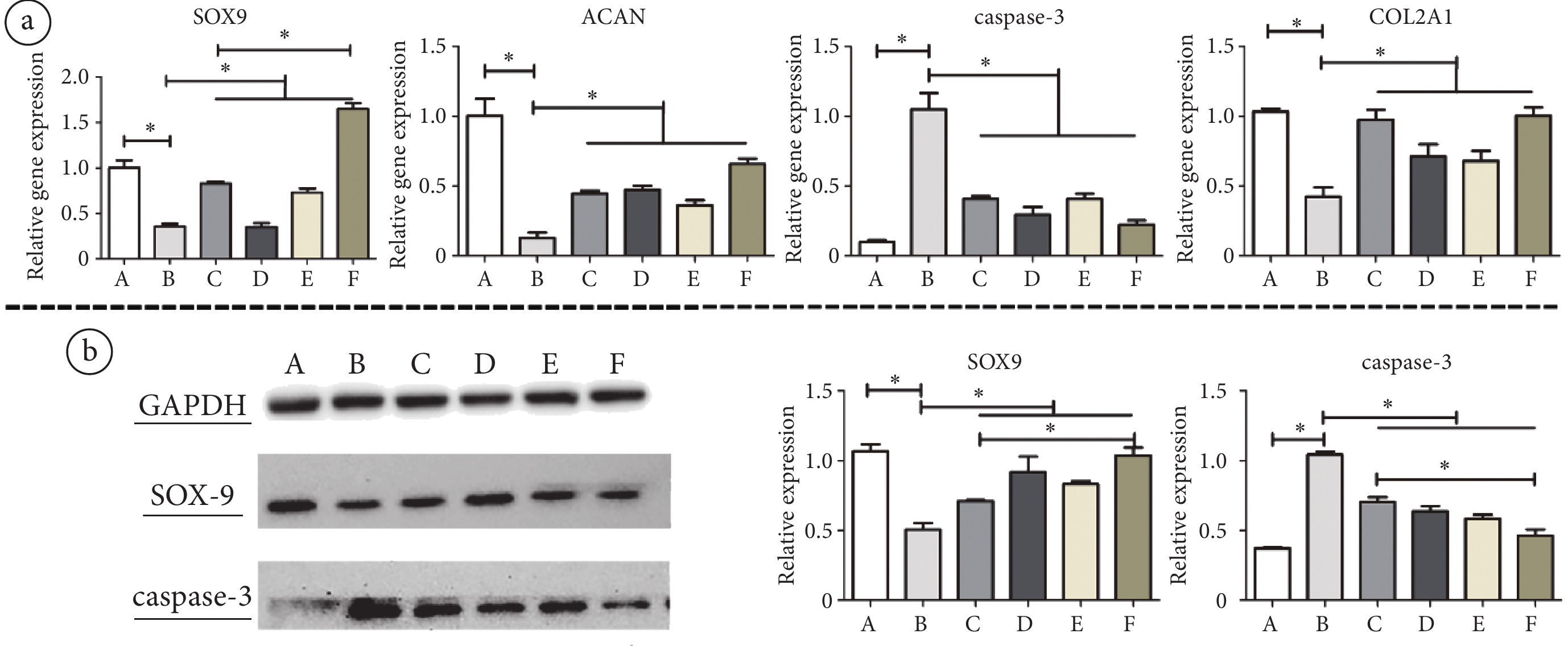 圖3
不同頻率PEMF干預后MSCs-Exo對STS誘導后的軟骨細胞凋亡及細胞外基質合成影響
圖3
不同頻率PEMF干預后MSCs-Exo對STS誘導后的軟骨細胞凋亡及細胞外基質合成影響
a. RT-qPCR檢測各組軟骨細胞內SOX9、ACAN、caspase-3和COL2A1的RNA相對表達量;b. WB檢測各組軟骨細胞內SOX9和caspase-3的相對蛋白表達量。*:
a. RT-qPCR results showed the relative gene expression levels of SOX9, ACAN, caspase-3 and COL2A1 in chondrocytes of each group; b. WB results showed the relative protein expression levels of SOX9 and caspase-3 in chondrocytes of each group. *:
2.5 MSCs-Exo抑制STS誘導的軟骨細胞凋亡
軟骨細胞的流式細胞學檢測結果顯示,MSCs-Exo與軟骨細胞共培養可顯著降低STS誘導的軟骨細胞凋亡(P < 0.01),抑制STS的促凋亡作用(見圖2a)。RT-PCR檢測結果顯示,與凋亡組相比,未經磁場干預的外泌體治療組的軟骨細胞內SOX9、ACAN、COL2A的mRNA表達明顯升高(P < 0.01,P < 0.01,P < 0.01),caspase-3的mRNA表達明顯降低(P < 0.01)(見圖3a);WB結果顯示,與外泌體共培養后軟骨細胞內SOX9的蛋白表達升高(P < 0.01),caspase-3的蛋白表達降低(P < 0.01)(見圖3b)。因此,AMSCs來源的外泌體能抑制STS誘導的軟骨細胞凋亡,增加軟骨細胞的細胞外基質合成。
2.6 不同頻率PEMF對MSCs-Exo抑制軟骨細胞凋亡的影響
RT-PCR和WB結果顯示(見圖3a~b),與STS誘導的凋亡組相比,15、45、75 Hz PEMF干預后的MSCs-Exo均可不同程度上調STS誘導后的軟骨細胞內ACAN、COL2A和SOX9的mRNA表達(P < 0.01,P < 0.01,P < 0.01)以及SOX9的蛋白表達(P < 0.01);且三種頻率PEMF干預后的MSCs-Exo均可下調STS誘導所致的軟骨細胞內caspase-3的mRNA和蛋白表達升高(P < 0.01,P < 0.01)。這些結果表明,不同頻率的PEMF干預后的MSCs-Exo對于STS誘導的軟骨細胞凋亡均具有一定的治療作用。然而,與未經磁場干預的MSCs-Exo治療組的軟骨細胞相比,僅75 Hz PEMF干預后的MSCs-Exo治療組軟骨細胞內COL2A的mRNA(P < 0.01)和SOX9的蛋白表達量(P < 0.01)明顯升高,caspase-3的蛋白表達量明顯降低(P < 0.01)。上述結果提示,頻率15 Hz和45 Hz的PEMF對MSCs-Exo抑制細胞凋亡的作用沒有顯著影響,而75 Hz PEMF可明顯增強MSCs-Exo對軟骨細胞的抗凋亡和促進基質合成的作用。
3 討論與結論
骨性關節炎是一種緩慢進展的惰性疾病[20],人們一直在尋求能夠有效防止關節軟骨破壞的治療手段。鑒于軟骨細胞活力的喪失是骨關節炎的一個重要標志,軟骨細胞的凋亡將是防止軟骨破壞、減緩軟骨退變的潛在治療靶點[21-22]。MSCs作為一種多能干細胞,存在于骨髓、脂肪、臍帶等多種組織內,具有抗凋亡、抗炎和免疫抑制等功能[23]。其中AMSCs具有來源廣、易獲取等特性,可被廣泛應用于再生修復治療領域,如骨關節炎等退行性疾病[24-25]。研究發現,MSCs的外泌體是其生物學功能的傳遞者[26]。MSCs來源的外泌體通過靶向遞送miRNAs,抑制軟骨細胞凋亡,抑制炎癥因子分泌,促進軟骨組織再生和修復[27-28]。這與本研究的結果相符。
相關研究發現,組織工程技術、細胞預處理、基因調控等技術能調控MSCs-Exo的生物學功能[29-30]。PEMF是由脈沖發生器的電流在線圈中所產生的一種交變電磁場,具有調控細胞功能的物理-生物學效應,如激活細胞內信號通路、影響基因表達、改善線粒體能量代謝等[31-34]。已有研究證實,PEMF可通過調節MSCs的旁分泌功能抑制軟骨細胞的凋亡[18]。Ongaro等[35]報道,1.5 mT、75 Hz PEMF通過抑制前列腺素E2(prostaglandin E2,PGE2)、白細胞介素-1β(interleukin-1β,IL-1β)和IL-6的釋放來增加軟骨細胞的抗炎性能。Fitzsimmons等[36]的研究證明,1 mT、15 Hz的PEMF顯著降低了軟骨細胞中IL-1α和IL-6的產生,并參與調控軟骨細胞的凋亡。然而,現有研究中PEMF參數異質性較大,無法比較不同頻率的PEMF對MSCs-Exo抗凋亡作用的影響。本實驗通過體外用固定強度(1 mT)、不同頻率(15、45、75 Hz)的PEMF分別干預AMSCs 30 min,并提取干預后的MSCs-Exo與STS誘導后的軟骨細胞共培養,初步觀察不同頻率PEMF干預后的MSCs-Exo對STS誘導的軟骨細胞凋亡的影響。實驗結果證實了在三個干預組中,75 Hz的PEMF可顯著提高MSCs-Exo抑制STS誘導的軟骨細胞凋亡和細胞外基質合成減少的作用。
STS可通過caspase依賴性和caspase非依賴性機制誘導細胞凋亡,并已被廣泛用于軟骨細胞的凋亡模型誘導[37]。它通過影響關節軟骨細胞的活性,干擾必要結構蛋白的產生,包括SOX9、Ⅱ型膠原蛋白和聚集蛋白[38]。COL2A1是軟骨基質的主要成分,在介導軟骨細胞-軟骨細胞和軟骨細胞-基質相互作用中發揮著重要作用,可與其他蛋白和蛋白聚糖共同形成復雜的細胞外支架,承擔機械力,維持生理穩態,為軟骨細胞、細胞外基質分子和生長因子提供錨定位點,而且COL2A1的降解和減少是骨性關節炎軟骨典型的病理改變[39-41]。因此,COL2A1、SOX9和ACAN在本研究中被作為軟骨細胞基質合成的標志物。在本研究中,75 Hz PEMF干預的MSCs-Exo在改善STS誘導的大鼠軟骨細胞凋亡、caspase-3上調和SOX9下調方面效果最好。這些觀察結果表明,75 Hz PEMF干預后的MSCs-Exo優于15 Hz和45 Hz PEMF干預的外泌體,可以抑制軟骨細胞凋亡,促進細胞的基質合成,從而增強軟骨修復。
PEMF通過調控MSCs-Exo促進骨關節炎再生修復的具體機制尚未見深入研究。研究已證明,軟骨細胞過度凋亡和增殖減少常伴隨軟骨降解。磷脂酰肌醇三激酶/蛋白激酶B(PI3K/AKT)信號通路是軟骨細胞存活和凋亡的重要調節因子[42]。越來越多的證據表明,多種生長因子,如成纖維細胞生長因子18(fibroblast growth factor 18,FGF18)、類胰島素一號生長因子(insulin-like growth factor-1,IGF-1)和血小板源性生長因子,可以通過激活PI3K/AKT來拯救線粒體相關凋亡的增加。不僅如此,許多生物活性化合物也通過激活PI3K/AKT發揮類似的抗凋亡作用[43-44]。與這些結果一致的是,其他證據表明激活PI3K/AKT可以阻斷TNF-α和脂多糖(lipopolysaccharide,LPS)誘導的骨關節炎軟骨細胞凋亡[45-46]。綜上所述,PI3K/AKT信號通路可在多種病理條件下負向調節軟骨細胞凋亡,激活的信號通路可以通過減少軟骨細胞凋亡來治療骨關節炎。因此,下一步實驗中我們將重點探索PI3K/AKT信號通路在PEMF干預MSCs-Exo調控骨關節炎軟骨細胞凋亡過程中的作用機制。
綜上所述,本研究證實AMSC-Exo存在與其來源親本干細胞類似的作用效果,可抑制軟骨細胞的凋亡,且75 Hz的PEMF可顯著增強MSCs-Exo的作用效果。本研究為探索PEMF調控MSCs-Exo修復關節軟骨損傷的分子機制奠定了基礎,為新型“無細胞”治療方法的轉化與臨床應用提供基礎數據,為骨關節炎的防治提供了更為廣闊的思路。
重要聲明
利益沖突聲明:本文全體作者均聲明不存在利益沖突。
作者貢獻聲明:王謙、汪香秀、徐揚負責實驗設計,徐揚、汪香秀、張獎銀負責實驗實施,何紅晨負責實驗評估,向小娜、彭佳蕾負責資料收集,徐揚、王謙撰寫論文,徐揚、王謙、何紅晨負責文章審校。
本文附表、附圖見本刊網站的電子版本(www.biomedeng.cn)。
 圖A1
PEMF干預脂肪間充質干細胞
FigureA1.
MSCs were exposed to the PEMF with this machine
圖A1
PEMF干預脂肪間充質干細胞
FigureA1.
MSCs were exposed to the PEMF with this machine
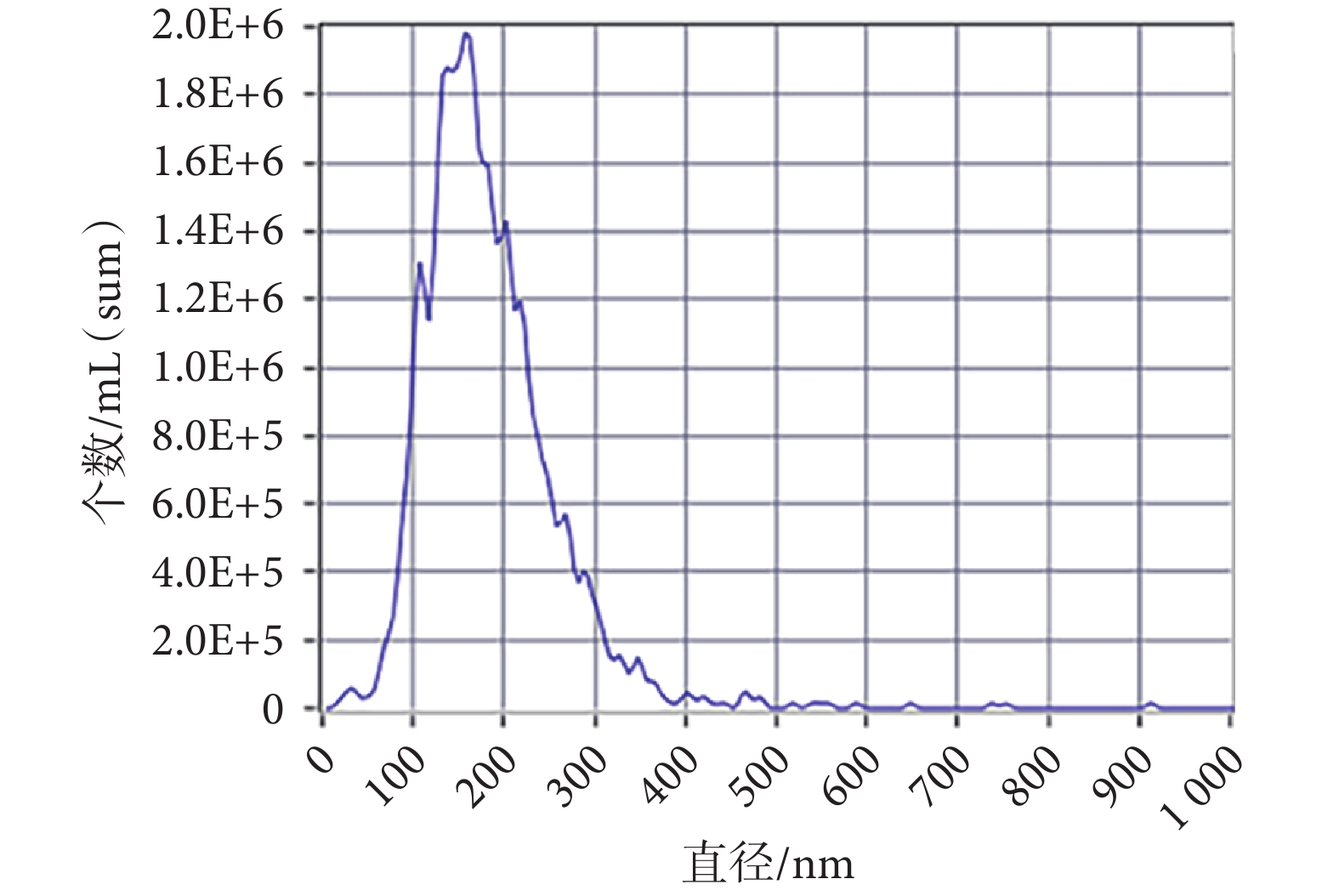 圖A2
外泌體NTA檢測結果
FigureA2.
Results of NTA detection of exosomes
圖A2
外泌體NTA檢測結果
FigureA2.
Results of NTA detection of exosomes
0 引言
骨關節炎(osteoarthritis,OA)是一種常見的慢性疾病,也是老年人殘疾的主要原因[1]。在骨關節炎疾病進程中,關節軟骨的再生是治療骨關節炎的主要挑戰之一[2-3]。骨關節炎的發病機制與軟骨細胞凋亡和組織減少有關,由于關節軟骨完全依賴軟骨細胞來維持細胞外基質,因此軟骨細胞的功能受損和細胞死亡將導致關節軟骨的退變[2,4]。文獻顯示軟骨損傷程度與軟骨細胞凋亡有一定的相關性,軟骨細胞死亡和基質丟失可能形成惡性循環[5]。因此探索安全有效的抑制關節軟骨細胞凋亡[6]、促進關節軟骨再生修復的方法是促進骨關節炎患者全面康復的迫切需求。
關節軟骨作為一種終末分化的結締纖維組織,缺乏血液供應、淋巴循環及神經支配,其損傷與退變難以自身修復[2]。目前正在探索的關節軟骨再生修復技術包括骨髓刺激技術、骨軟骨移植、軟骨細胞植入、干細胞技術及組織工程等[7]。其中,間充質干細胞(mesenchymal stem cells,MSCs)因其廣泛的來源、較強的增殖特性和多樣的分化潛能而被廣泛應用于骨與軟骨組織的再生修復[8]。而間充質干細胞外泌體(mesenchymal stem cells-derived exosomes,MSCs-Exo)通過旁分泌作用傳遞MSCs的生物學功能[9],避免了對于同種異體MSCs治療導致腫瘤、疾病傳播和宿主免疫排斥反應的擔憂,作為一種具有較好生物相容性、低免疫原性和低致瘤性的治療手段[10],被廣泛用于骨關節炎的再生治療研究。
多項研究發現,MSCs及其外泌體可通過抑制軟骨細胞的凋亡減輕骨關節炎的癥狀,促進關節軟骨修復[11]。然而,MSCs-Exo的異質性導致的治療效果不佳已成為制約其臨床轉化的主要瓶頸[10]。因此,如何調控MSCs-Exo的生物學功能,并促進它對骨關節炎軟骨損傷的再生修復是MSCs-Exo轉化與應用的研究熱點。在康復醫學領域,脈沖電磁場(pulsed electromagnetic field,PEMF)作為一種物理因子治療方法,在臨床上應用于骨折延遲愈合、骨質疏松及骨關節炎的治療[12-14]。研究發現,8 Hz、3.8 mT和75 Hz、1.6 mT的PEMF均能促進骨關節炎軟骨損傷修復,改善軟骨下骨重建;抑制腫瘤壞死因子α(tumour necrosis factor-α,TNF-α)、白細胞介素-6(interleukin-6,IL-6)等炎癥因子,實現抑制Caspase 3/8軸誘導的軟骨細胞凋亡[15-17]。最新的研究發現,經過10 min的PEMF干預,MSCs的上清液也具有類似MSCs的生物學功能,如促進成軟骨分化、抑制骨關節炎軟骨細胞炎癥和凋亡、增加軟骨細胞遷移,提示PEMF可能通過調控MSCs的外泌體促進其抗凋亡作用[18]。但不同頻率的PEMF對于MSCs-Exo的作用尚未得到探索,通過PEMF調控MSCs-Exo治療骨關節炎的最佳頻率尚未得到統一。因此,本研究旨在探索不同頻率PEMF干預后的MSCs-Exo對軟骨細胞凋亡的作用。
1 材料和方法
1.1 材料
1.1.1 主要材料和試劑
Sprague-Dawley(SD)大鼠軟骨細胞與原代細胞DMEM/F-12基礎培養基、SD大鼠脂肪間充質干細胞(adipose mesenchymal stem cells,AMSCs)與原代細胞DMEM低糖基礎培養基、胎牛血清(Gibco,美國);細胞膜熒光探針(3,3′-dioctadecyloxacarbocyanine perchlorate,DiO)染色劑(優逸蘭迪,蘇州);Annexin V binding buffer、Annexin V-FITC、CFSE染色劑(索萊寶,北京);反轉錄試劑盒(翌圣,上海);anti-CD9/TSG101/SOX9/CASPASE-3(Abcam,英國)。
1.1.2 主要儀器設備
Cyto flex S流式細胞儀(Beckman,美國);western blot電泳系統(Bio-rad,美國);脈沖電磁場體外細胞干預系統[定制設計的PEMF系統包括一個波形信號發生器(DG1022U,RIGOL,蘇州)、一個可調開關電源(MS-605D,東莞麥生)、一個功率放大器和帶有3線圈陣列的亥姆霍茲線圈];細胞培養箱(Thermo,美國);酶標儀(Bio-rad,美國);超凈工作臺(Thermo,美國);倒置熒光顯微鏡(Leica,德國);MILi-Qso型超純水儀(Millipore,美國);高速冷凍離心機(Eppendorf,德國);Optima? XE超速離心機(Beckman Coulter,美國)。
1.2 實驗方法
1.2.1 SD大鼠軟骨細胞和AMSCs的體外培養
取兩周齡SD大鼠膝關節,用含100 U/mL青-鏈霉素的磷酸鹽緩沖液(phosphate buffer saline,PBS)將大鼠關節軟骨沖洗干凈,以0.25%胰酶在37 ℃、5% CO2培養箱中消化1 h后用無菌PBS沖洗兩次,將軟骨剪碎至勻漿狀,加入等體積完全培養基[10%胎牛血清(fetal bovine serum,FBS)+100 U/mL青-鏈霉素+DMEM/F-12基礎培養基],1 000 r/min離心5 min,再次加入含有0.5 μg/mL Ⅱ型膠原酶的完全培養基重懸細胞,過濾除菌后接種于培養皿中消化24 h,收集細胞懸液,加入等體積的完全培養基,300 g離心5 min,再次加入完全培養基重懸細胞,接種于新的細胞培養皿中。
取四周齡SD大鼠腹股溝處脂肪組織,去除表面的結締組織后放入含100 U/mL青-鏈霉素PBS的離心管中。將清洗后的脂肪組織轉移到干燥的培養基中,剪至漿糊狀后,加入2倍脂肪體積量的0.1%濃度Ⅰ型膠原酶,轉移至離心管中,置于37 ℃搖床上消化60 min。后加入含10% FBS的低糖基礎培養基(Dulbecco’s Modified Eagle Medium,DMEM)中和,300 g離心10 min,丟棄上層組織和液體后加入完全培養基重懸細胞,接種于培養皿中,24 h后首次換液。
兩種細胞分別置于細胞培養箱中進行培養,每3天更換一次培養基,細胞密度達80%~90%時傳代。
1.2.2 AMSCs的鑒定和三系分化
在干細胞培養至第三代時,用流式細胞術檢測AMSCs表型:將細胞用胰酶消化,用含Ca2+、游離Mg2+的PBS,1%牛血清白蛋白和13.6 mmol/L檸檬酸鈉的熒光激活細胞分選緩沖液沖洗2次,離心計數(1×107 cells/mL)。在200 μL細胞懸液中分別加入CD90、CD34、CD44和CD45抗體。隨后,同免疫球蛋白和異硫氰酸酯(fluorescein isothiocyanate,FITC)(10 μL)完全混合,室溫下反應30 min。離心后用流式細胞分析儀來檢測細胞表面抗原,之后用Flowjo軟件分析結果。
使用大鼠AMSCs成軟骨、成骨和成脂誘導試劑盒(賽業生物科技有限公司,美國),按照試劑盒操作方法對三代AMSCs進行成軟骨、成骨和成脂分化誘導操作。成軟骨誘導培養結束后行石蠟包埋切片,用阿利辛藍染色判定誘導結果:低倍鏡下可見藍色著色的酸性粘多糖說明該AMSCs具有成軟骨能力。成骨誘導培養結束后用4%中性甲醛固定,用茜素紅染色后于顯微鏡下觀察判定誘導結果:低倍鏡下可見紅色著色的鈣結節說明該AMSCs具有成骨能力。成脂誘導培養結束后用4%中性甲醛固定,用油紅O染液染色后于顯微鏡下觀察判定誘導結果:低倍鏡下可見大面積紅色著色點或20/40倍鏡下可見細胞內有紅色球形的脂滴說明該AMSCs具有成脂能力。
1.2.3 脈沖電磁場干預AMSCs
PEMF干預采用報道過的干預體系[19]置于37 ℃細胞恒溫培養箱中,該體系主要由PEMF信號發射器與圓柱電磁線圈組成(見附圖1)。信號發射器可發出脈沖持續時間300 μs,輸出強度1 mT、可調頻率的電磁場。第3~4代AMSCs 細胞接種于培養皿上,以無血清培養基培養,并置于PEMF 發生器內,給予強度1 mT,頻率分別為0、15、45、75 Hz 的PEMF干預30 min,24 h后取上清。
 圖1
AMSCs及其外泌體的培養與鑒定
圖1
AMSCs及其外泌體的培養與鑒定
a. 間充質干細胞明場及三系分化誘導圖片;b. AMSC的流式鑒定結果,檢測到細胞表面抗原CD34、CD44、CD45和CD90;c. 外泌體WB結果圖片(三組exosome為平行實驗組);d. 外泌體電鏡結果
Figure1. Isolation and characterization of rat AMSCs and exosomesa. the osteogenic induction, adipogenic induction and chondrogenic induction of mesenchymal stem cells; b. cell surface antigens CD34, CD44, CD45 and CD90 were detected by flow cytometry; c. WB results of antibodies CD9 and TSG101 in exosomes; d. TEM result of exosomes
1.2.4 AMSCs外泌體的提取和鑒定
將AMSCs傳代培養至第3~4代,待細胞融合度達90%左右時,使用無血清的DMEM換液。放入細胞培養箱24 h后將培養皿取出,收集上清至離心管內,重復離心兩次取上清后,用0.22 μm過濾器過濾上清,取濾液以2 200 g離心35 min。取離心后上清于濃縮管中,1 360 g離心10 min,將濃縮管中上層液體轉移至離心管內。將離心管放入適配器中配平(差距小于0.1 g)后,于超高速離心機中以4 ℃、140 000 g離心90 min。離心結束后棄上清,所得沉淀重懸后即為外泌體懸液。
外泌體形態學觀察:吸取50 μL外泌體懸液滴在銅網上,室溫靜置1 min,用濾紙從側面吸干液體,使用2%磷鎢酸溶液在室溫下負染1 min,濾紙吸干染液,室溫晾干,于透射電鏡(transmission electron microscope,TEM)下觀察并拍照。用納米顆粒跟蹤分析(nanoparticle tracking analysis,NTA)測定外泌體濃度。外泌體標志蛋白檢測:通過免疫印跡分析(western blot,WB)進行外泌體表面標志物CD9、TSG101檢測。
1.2.5 DiO標記外泌體后與軟骨細胞共培養
按照DiO熒光染料試劑盒操作說明標記MSCs-Exo,該染料可染雙層分子膜使其呈紅色熒光。外泌體提取后用1 mL無菌PBS稀釋,加入1 μL DiO染料混勻后置于37 ℃避光孵育30 min,配平后120 000 g離心90 min,棄上清,用軟骨細胞的完全培養基重懸后與軟骨細胞共培養。20 h后使用4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)標記軟骨細胞,該染料可使細胞核呈藍色熒光。
1.2.6 外泌體對軟骨細胞凋亡的作用探索
將軟骨細胞以0.3×106個/孔的密度接種于6孔板內,分6組培養:A、對照組(control);B、凋亡組[星形孢菌素(staurosporine,STS)];C、外泌體治療組(STS+Exo);D、15 Hz外泌體治療組(STS+Exo,15 Hz);E、45 Hz外泌體治療組(STS+Exo,45 Hz);F、75 Hz外泌體治療組(STS+Exo,75 Hz)。該分組在圖片中均以A、B、C、D、E、F指代。對照組換液后將正常軟骨細胞培養24 h,凋亡組將4 μmol/L STS與軟骨細胞共培養24 h,治療組將不同頻率(0、15、45、75 Hz)、1 mT的PEMF干預后的外泌體(1×108個/mL)與4 μmol/L STS共同加入培養基中,與軟骨細胞共培養24 h。
軟骨細胞攝取外泌體情況:培養結束后,收集各組軟骨細胞,經胰酶消化并用基礎細胞培養基吹打成單細胞懸浮液。將細胞懸浮液直接涂片后在倒置熒光顯微鏡下拍照。
軟骨細胞凋亡檢測:根據凋亡檢測試劑盒說明,采用流式細胞術檢測軟骨細胞的凋亡情況。培養結束后,0.25%胰酶消化,離心后棄上清,用PBS洗滌一次,離心后棄上清;用1×Annexin V binding buffer重懸細胞,加入Annexin V-FITC,避光孵育10 min;加入PI和1×Annexin V binding buffer繼續避光孵育5 min,1 h內上機檢測。
軟骨細胞蛋白表達測定:用WB法,將提取的蛋白原液用WB試劑盒按照標準操作流程進行蛋白濃度測定,并將獲得的蛋白原液與上樣緩沖液配置混勻后于100 ℃加熱5 min進行變性,然后于120 V電泳。于冰浴中250 mA轉膜后,放入5%脫脂牛奶封閉1 h,結束后加入一抗,4 ℃孵育過夜。孵育結束后用1×TBST洗滌10 min,重復三次,加入二抗室溫孵育1 h。孵育結束后用1×TBST洗滌10 min,重復三次。使用顯影液在儀器上對條帶進行曝光并拍攝照片。
軟骨細胞核糖核酸(ribonucleic acid,RNA)表達測定:用反轉錄定量聚合酶鏈反應(real time-PCR,RT-PCR)法,采用Eastep?Super總RNA提取試劑盒提取RNA,去除基因組脫氧核糖核酸(deoxyribonucleic acid,DNA)反應后進行反轉錄,將反轉錄得到的液體稀釋后向96孔板上樣。完成上樣后放入熒光定量PCR儀進行PCR分析。得到的數據經過Excel處理后用Prism5.0軟件進行數據分析及圖像制作。引物序列見附表1。
1.3 統計學分析
采用SPSS 22.0統計軟件進行統計,實驗定量數據以 ±s表示,使用單因素方差分析比較多樣本均數差異,檢驗水準為0.05,在總體差異有統計學意義時,進一步用Bonferroni校正進行顯著性檢驗。
±s表示,使用單因素方差分析比較多樣本均數差異,檢驗水準為0.05,在總體差異有統計學意義時,進一步用Bonferroni校正進行顯著性檢驗。
2 結果
2.1 AMSCs培養及鑒定
觀察培養的AMSCs,可見細胞呈梭形,為典型的AMSCs形態(見圖1a)。流式細胞學鑒定檢測到細胞表面抗原CD34、CD44、CD45和CD90(見圖1b)。對細胞進行三系分化誘導,證明該細胞具有分化為軟骨細胞、骨細胞和脂肪細胞的能力(見圖1a)。以上結果均證明提取大鼠腹股溝脂肪進行原代細胞培養所得為AMSCs。
2.2 MSCs-Exo的鑒定
從外泌體中提取蛋白進行免疫印跡分析,檢測到外泌體內抗體CD9、TSG101表達相較于AMSCs內均增加(見圖1c,P < 0.01)。在TEM下觀察見外泌體形態呈茶托狀雙層膜結構(見圖1d)。NTA測得外泌體平均直徑為164.5 nm(見附圖2)。以上結果證明,通過超高速離心細胞上清所獲得的為AMSCs的外泌體。
 圖2
外泌體與軟骨細胞共培養
圖2
外泌體與軟骨細胞共培養
a. 軟骨細胞對外泌體的攝取;b. 流式細胞術檢測細胞凋亡率。*:
a. exosomes were endocytosed by chondrocytes thorough co-culture; b. the apoptosis rate was detected by flow cytometry. *:
2.3 軟骨細胞攝取外泌體
DiO標記的MSCs-Exo(紅色熒光)與DAPI標記的軟骨細胞(細胞核呈藍色熒光)共培養后,通過倒置熒光顯微鏡觀察,在軟骨細胞中可觀察到紅色點狀熒光(見圖2a)。結果證明,外泌體可通過與軟骨細胞共培養而被軟骨細胞攝取。
2.4 STS誘導軟骨細胞凋亡
流式細胞術檢測軟骨細胞凋亡的實驗結果如圖2b所示,在細胞培養基中加入4 μmol/L STS可使軟骨細胞凋亡率顯著增高(P < 0.01)。RT-PCR檢測結果(見圖3a)顯示,與對照組相比,STS誘導的凋亡組軟骨細胞內可聚蛋白多糖(aggrecan,ACAN)、Y染色體性別決定區(sex-determing region of Y chromosome,SRY)-盒轉錄因子9(SRY-box transcription factor 9,SOX9)、Ⅱ型膠原(Type Ⅱ collagen,COL2A)的mRNA表達顯著降低(P < 0.01,P < 0.01,P < 0.01),半胱氨酸-天冬氨酸蛋白酶-3(caspase-3)的mRNA表達明顯升高(P < 0.01);且WB結果(見圖3b)顯示,STS誘導顯著下調了軟骨細胞內SOX9的蛋白表達(P < 0.01),上調了caspase-3的蛋白表達(P < 0.01)。結果表明,STS誘導可抑制軟骨細胞活性,使軟骨細胞凋亡的生物標志物caspase-3合成增加,從而增加軟骨細胞凋亡;可造成細胞基質合成ACAN和COL2A能力下降,減少軟骨細胞細胞外基質的合成;還可造成SOX9合成降低,減少軟骨細胞分化。
 圖3
不同頻率PEMF干預后MSCs-Exo對STS誘導后的軟骨細胞凋亡及細胞外基質合成影響
圖3
不同頻率PEMF干預后MSCs-Exo對STS誘導后的軟骨細胞凋亡及細胞外基質合成影響
a. RT-qPCR檢測各組軟骨細胞內SOX9、ACAN、caspase-3和COL2A1的RNA相對表達量;b. WB檢測各組軟骨細胞內SOX9和caspase-3的相對蛋白表達量。*:
a. RT-qPCR results showed the relative gene expression levels of SOX9, ACAN, caspase-3 and COL2A1 in chondrocytes of each group; b. WB results showed the relative protein expression levels of SOX9 and caspase-3 in chondrocytes of each group. *:
2.5 MSCs-Exo抑制STS誘導的軟骨細胞凋亡
軟骨細胞的流式細胞學檢測結果顯示,MSCs-Exo與軟骨細胞共培養可顯著降低STS誘導的軟骨細胞凋亡(P < 0.01),抑制STS的促凋亡作用(見圖2a)。RT-PCR檢測結果顯示,與凋亡組相比,未經磁場干預的外泌體治療組的軟骨細胞內SOX9、ACAN、COL2A的mRNA表達明顯升高(P < 0.01,P < 0.01,P < 0.01),caspase-3的mRNA表達明顯降低(P < 0.01)(見圖3a);WB結果顯示,與外泌體共培養后軟骨細胞內SOX9的蛋白表達升高(P < 0.01),caspase-3的蛋白表達降低(P < 0.01)(見圖3b)。因此,AMSCs來源的外泌體能抑制STS誘導的軟骨細胞凋亡,增加軟骨細胞的細胞外基質合成。
2.6 不同頻率PEMF對MSCs-Exo抑制軟骨細胞凋亡的影響
RT-PCR和WB結果顯示(見圖3a~b),與STS誘導的凋亡組相比,15、45、75 Hz PEMF干預后的MSCs-Exo均可不同程度上調STS誘導后的軟骨細胞內ACAN、COL2A和SOX9的mRNA表達(P < 0.01,P < 0.01,P < 0.01)以及SOX9的蛋白表達(P < 0.01);且三種頻率PEMF干預后的MSCs-Exo均可下調STS誘導所致的軟骨細胞內caspase-3的mRNA和蛋白表達升高(P < 0.01,P < 0.01)。這些結果表明,不同頻率的PEMF干預后的MSCs-Exo對于STS誘導的軟骨細胞凋亡均具有一定的治療作用。然而,與未經磁場干預的MSCs-Exo治療組的軟骨細胞相比,僅75 Hz PEMF干預后的MSCs-Exo治療組軟骨細胞內COL2A的mRNA(P < 0.01)和SOX9的蛋白表達量(P < 0.01)明顯升高,caspase-3的蛋白表達量明顯降低(P < 0.01)。上述結果提示,頻率15 Hz和45 Hz的PEMF對MSCs-Exo抑制細胞凋亡的作用沒有顯著影響,而75 Hz PEMF可明顯增強MSCs-Exo對軟骨細胞的抗凋亡和促進基質合成的作用。
3 討論與結論
骨性關節炎是一種緩慢進展的惰性疾病[20],人們一直在尋求能夠有效防止關節軟骨破壞的治療手段。鑒于軟骨細胞活力的喪失是骨關節炎的一個重要標志,軟骨細胞的凋亡將是防止軟骨破壞、減緩軟骨退變的潛在治療靶點[21-22]。MSCs作為一種多能干細胞,存在于骨髓、脂肪、臍帶等多種組織內,具有抗凋亡、抗炎和免疫抑制等功能[23]。其中AMSCs具有來源廣、易獲取等特性,可被廣泛應用于再生修復治療領域,如骨關節炎等退行性疾病[24-25]。研究發現,MSCs的外泌體是其生物學功能的傳遞者[26]。MSCs來源的外泌體通過靶向遞送miRNAs,抑制軟骨細胞凋亡,抑制炎癥因子分泌,促進軟骨組織再生和修復[27-28]。這與本研究的結果相符。
相關研究發現,組織工程技術、細胞預處理、基因調控等技術能調控MSCs-Exo的生物學功能[29-30]。PEMF是由脈沖發生器的電流在線圈中所產生的一種交變電磁場,具有調控細胞功能的物理-生物學效應,如激活細胞內信號通路、影響基因表達、改善線粒體能量代謝等[31-34]。已有研究證實,PEMF可通過調節MSCs的旁分泌功能抑制軟骨細胞的凋亡[18]。Ongaro等[35]報道,1.5 mT、75 Hz PEMF通過抑制前列腺素E2(prostaglandin E2,PGE2)、白細胞介素-1β(interleukin-1β,IL-1β)和IL-6的釋放來增加軟骨細胞的抗炎性能。Fitzsimmons等[36]的研究證明,1 mT、15 Hz的PEMF顯著降低了軟骨細胞中IL-1α和IL-6的產生,并參與調控軟骨細胞的凋亡。然而,現有研究中PEMF參數異質性較大,無法比較不同頻率的PEMF對MSCs-Exo抗凋亡作用的影響。本實驗通過體外用固定強度(1 mT)、不同頻率(15、45、75 Hz)的PEMF分別干預AMSCs 30 min,并提取干預后的MSCs-Exo與STS誘導后的軟骨細胞共培養,初步觀察不同頻率PEMF干預后的MSCs-Exo對STS誘導的軟骨細胞凋亡的影響。實驗結果證實了在三個干預組中,75 Hz的PEMF可顯著提高MSCs-Exo抑制STS誘導的軟骨細胞凋亡和細胞外基質合成減少的作用。
STS可通過caspase依賴性和caspase非依賴性機制誘導細胞凋亡,并已被廣泛用于軟骨細胞的凋亡模型誘導[37]。它通過影響關節軟骨細胞的活性,干擾必要結構蛋白的產生,包括SOX9、Ⅱ型膠原蛋白和聚集蛋白[38]。COL2A1是軟骨基質的主要成分,在介導軟骨細胞-軟骨細胞和軟骨細胞-基質相互作用中發揮著重要作用,可與其他蛋白和蛋白聚糖共同形成復雜的細胞外支架,承擔機械力,維持生理穩態,為軟骨細胞、細胞外基質分子和生長因子提供錨定位點,而且COL2A1的降解和減少是骨性關節炎軟骨典型的病理改變[39-41]。因此,COL2A1、SOX9和ACAN在本研究中被作為軟骨細胞基質合成的標志物。在本研究中,75 Hz PEMF干預的MSCs-Exo在改善STS誘導的大鼠軟骨細胞凋亡、caspase-3上調和SOX9下調方面效果最好。這些觀察結果表明,75 Hz PEMF干預后的MSCs-Exo優于15 Hz和45 Hz PEMF干預的外泌體,可以抑制軟骨細胞凋亡,促進細胞的基質合成,從而增強軟骨修復。
PEMF通過調控MSCs-Exo促進骨關節炎再生修復的具體機制尚未見深入研究。研究已證明,軟骨細胞過度凋亡和增殖減少常伴隨軟骨降解。磷脂酰肌醇三激酶/蛋白激酶B(PI3K/AKT)信號通路是軟骨細胞存活和凋亡的重要調節因子[42]。越來越多的證據表明,多種生長因子,如成纖維細胞生長因子18(fibroblast growth factor 18,FGF18)、類胰島素一號生長因子(insulin-like growth factor-1,IGF-1)和血小板源性生長因子,可以通過激活PI3K/AKT來拯救線粒體相關凋亡的增加。不僅如此,許多生物活性化合物也通過激活PI3K/AKT發揮類似的抗凋亡作用[43-44]。與這些結果一致的是,其他證據表明激活PI3K/AKT可以阻斷TNF-α和脂多糖(lipopolysaccharide,LPS)誘導的骨關節炎軟骨細胞凋亡[45-46]。綜上所述,PI3K/AKT信號通路可在多種病理條件下負向調節軟骨細胞凋亡,激活的信號通路可以通過減少軟骨細胞凋亡來治療骨關節炎。因此,下一步實驗中我們將重點探索PI3K/AKT信號通路在PEMF干預MSCs-Exo調控骨關節炎軟骨細胞凋亡過程中的作用機制。
綜上所述,本研究證實AMSC-Exo存在與其來源親本干細胞類似的作用效果,可抑制軟骨細胞的凋亡,且75 Hz的PEMF可顯著增強MSCs-Exo的作用效果。本研究為探索PEMF調控MSCs-Exo修復關節軟骨損傷的分子機制奠定了基礎,為新型“無細胞”治療方法的轉化與臨床應用提供基礎數據,為骨關節炎的防治提供了更為廣闊的思路。
重要聲明
利益沖突聲明:本文全體作者均聲明不存在利益沖突。
作者貢獻聲明:王謙、汪香秀、徐揚負責實驗設計,徐揚、汪香秀、張獎銀負責實驗實施,何紅晨負責實驗評估,向小娜、彭佳蕾負責資料收集,徐揚、王謙撰寫論文,徐揚、王謙、何紅晨負責文章審校。
本文附表、附圖見本刊網站的電子版本(www.biomedeng.cn)。
 圖A1
PEMF干預脂肪間充質干細胞
FigureA1.
MSCs were exposed to the PEMF with this machine
圖A1
PEMF干預脂肪間充質干細胞
FigureA1.
MSCs were exposed to the PEMF with this machine
 圖A2
外泌體NTA檢測結果
FigureA2.
Results of NTA detection of exosomes
圖A2
外泌體NTA檢測結果
FigureA2.
Results of NTA detection of exosomes