海藻酸鈉(SA)是從褐藻類海帶中提取的一種天然高分子材料,具備出色的生物相容性、無毒性、生物降解性以及豐富的儲存量。海藻酸鈉凝膠形成的條件溫和,可有效避免活性物質的失活。經過多種制備方法,海藻酸鈉微球被廣泛用于生物材料和組織工程等領域。本文綜述了制備海藻酸鈉微球的常見方法,包括擠出法、乳化法、靜電噴射法、噴霧干燥法和同軸氣流法,并探討了它在骨修復、止血以及藥物遞送等生物醫學領域的應用。
引用本文: 劉軒妤, 王玉輝, 梁紫微, 連小潔, 黃棣, 胡銀春, 魏延. 海藻酸鈉微球的制備及應用研究進展. 生物醫學工程學雜志, 2023, 40(4): 792-798. doi: 10.7507/1001-5515.202211048 復制
版權信息: ?四川大學華西醫院華西期刊社《生物醫學工程學雜志》版權所有,未經授權不得轉載、改編
0 引言
海藻酸鈉(sodium alginate,SA)是一種常用的生物材料,是天然多糖碳水化合物中的一種。這種化合物可以從褐藻類的海帶中提取,屬于藻類衍生物,具有優異的生物相容性、無毒性、穩定性且儲存量豐富,已經被廣泛應用于諸如骨組織治療、受損組織的止血以及疾病治療等生物醫學領域。
1 海藻酸鈉的理化性質
海藻酸鈉是存在于褐藻類海洋生物中的線性陰離子天然多糖,由β-D-甘露糖醛酸(M)和α-L-古羅糖醛酸(G)鍵聚合而成[1-2]。海藻酸鈉是一種白色或者淡黃色不定形的粉末,無毒,溶于水,不溶于有機溶劑且無臭無味[3-4]。溶于水后形成粘稠的膠狀物,當含水量超過95%時,容易從溶膠狀變成凝膠狀[5]。當pH值為6~9時黏性穩定,加熱至80 ℃以上時,黏性降低[6]。隨著pH的降低,海藻酸鈉溶液的黏度不斷增強。
2 海藻酸鈉微球的制備方法
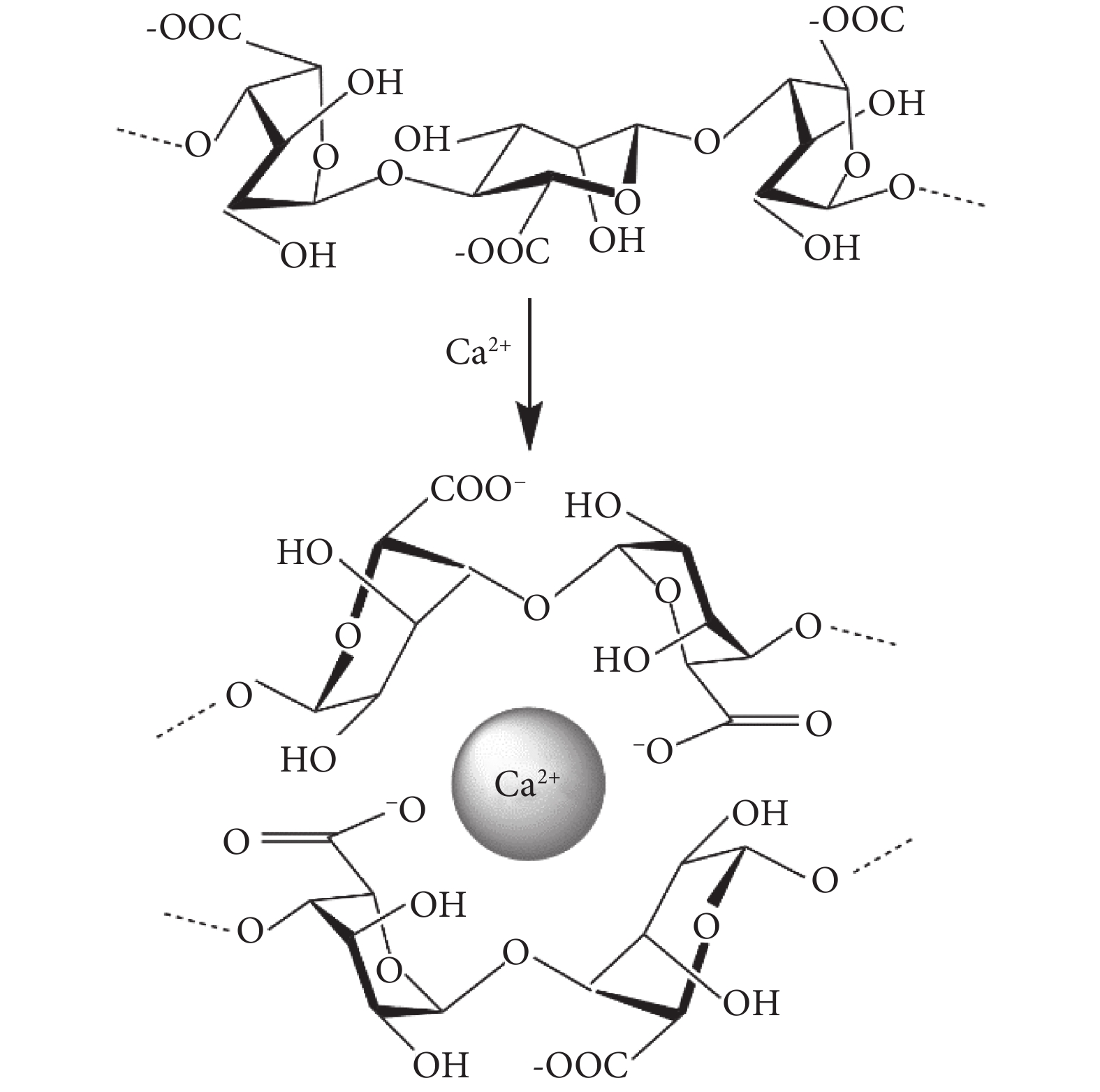
海藻酸鈉含有大量的-COO-,在水溶液中可表現出聚陰離子行為,可以和二價陽離子交聯形成凝膠[7](見圖1、表1)。海藻酸鈉的結構與活組織的細胞外基質相似,可廣泛應用于傷口愈合、小分子藥物和蛋白質等生物活性劑的輸送和細胞移植[8-9]。目前,海藻酸鈉微球的制備方法主要有擠出法、乳化交聯法、靜電噴射法、同軸氣流法以及噴霧干燥法等。
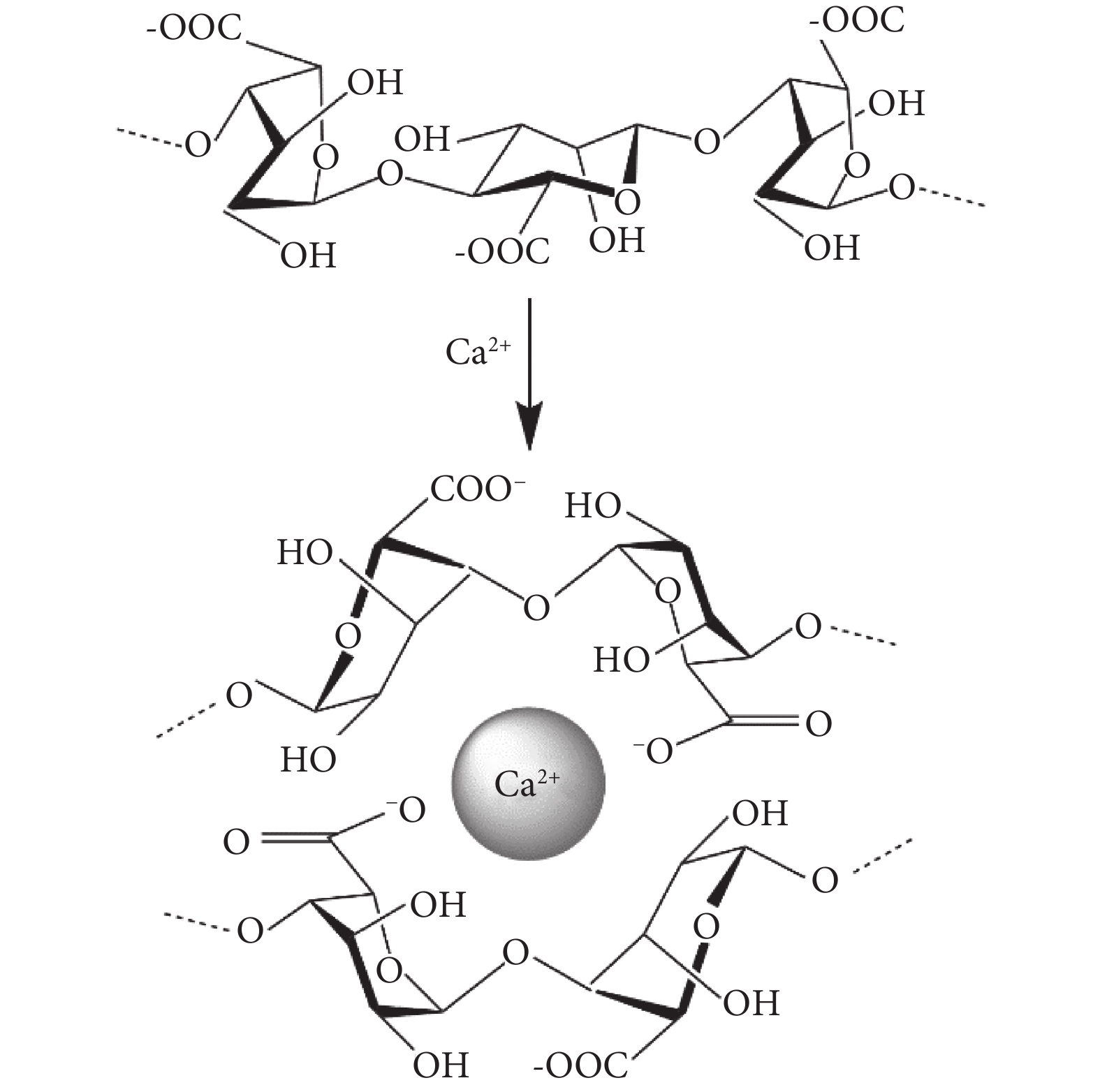 圖1
SA和Ca2+交聯示意圖
Figure1.
Schematic diagram of SA and Ca2+ cross-linkage
圖1
SA和Ca2+交聯示意圖
Figure1.
Schematic diagram of SA and Ca2+ cross-linkage
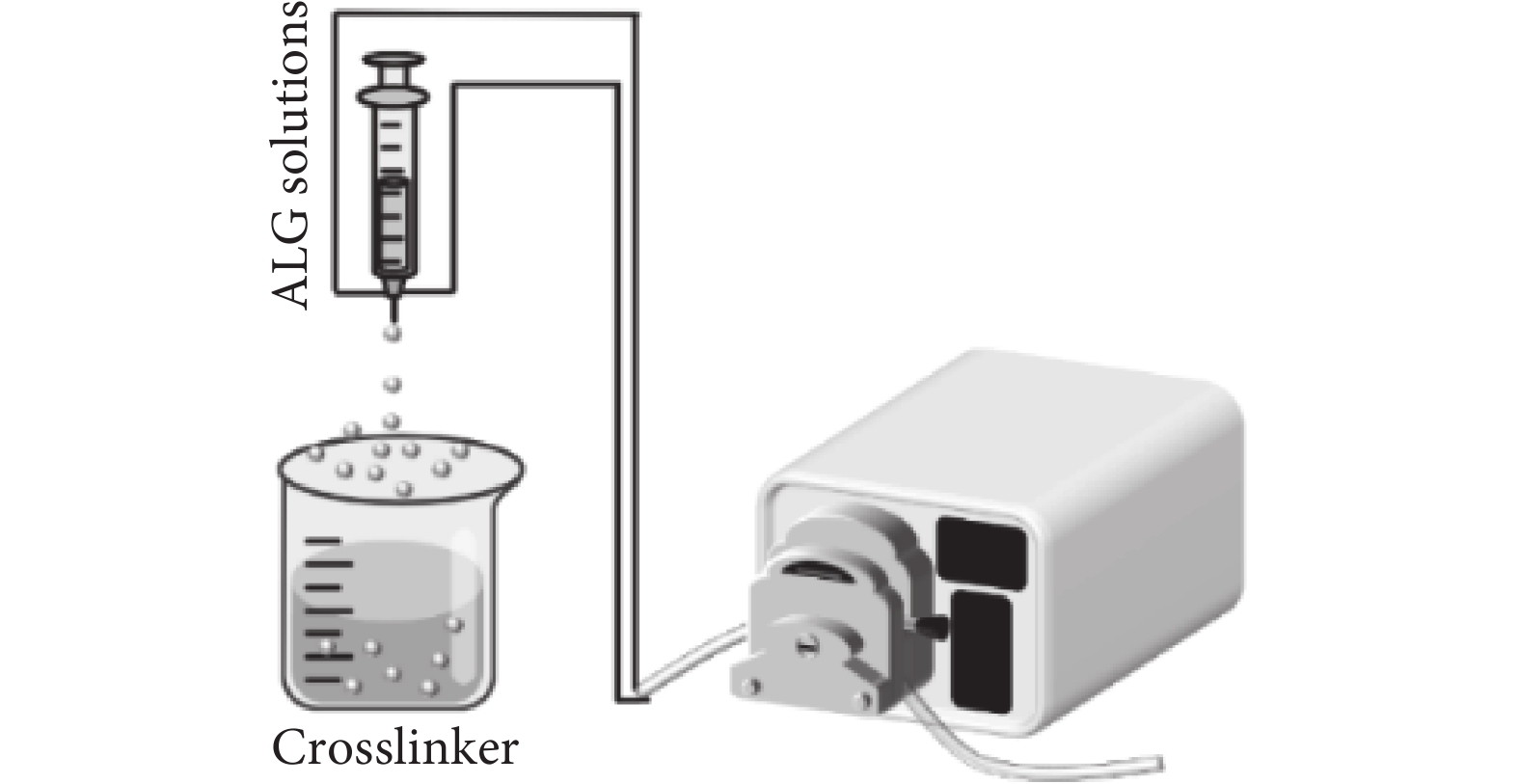
2.1 擠出法
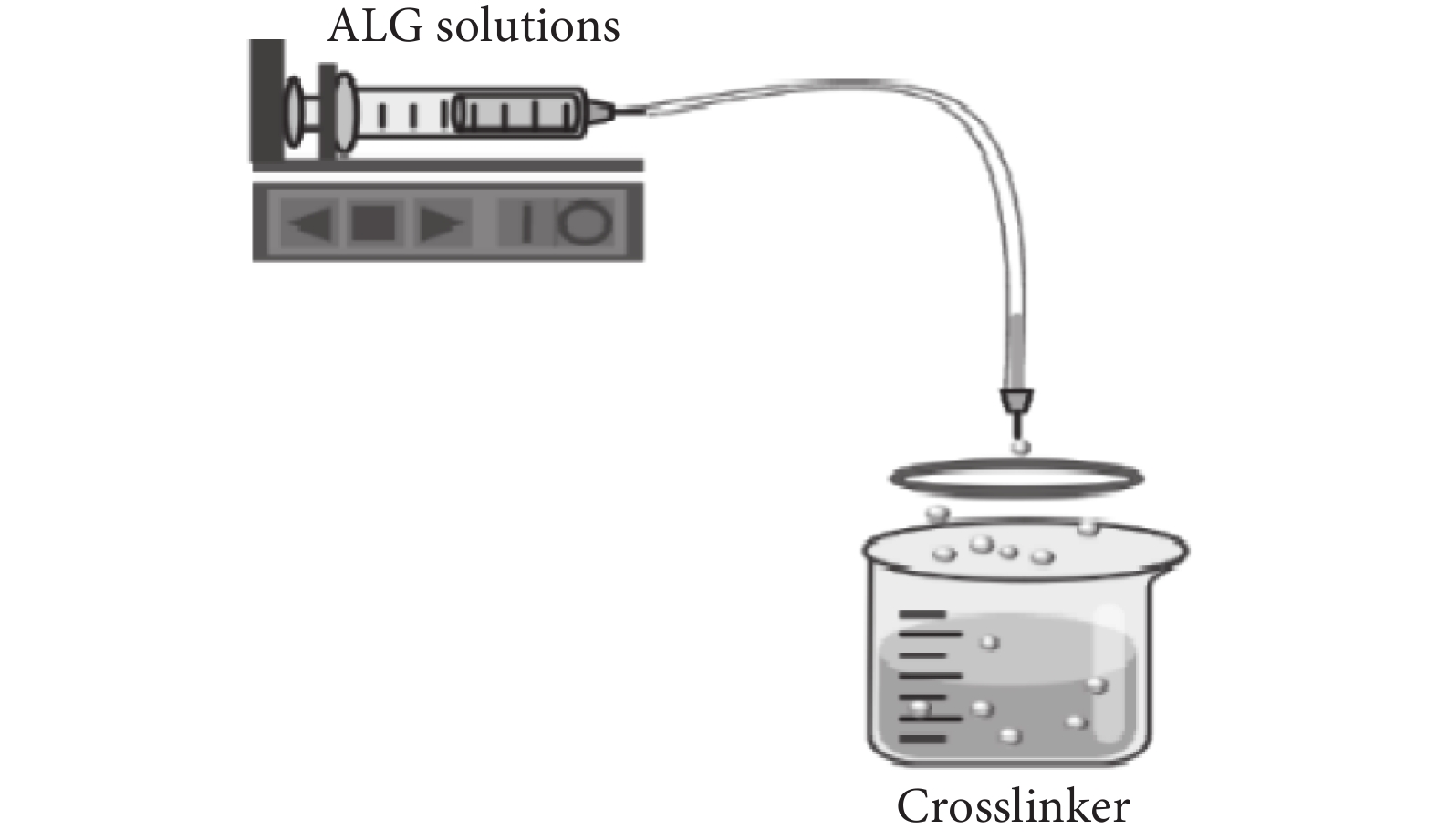
擠出法(見圖2)是操作最簡單、應用最普遍的微球制備技術。這種制備方法通常是將含有海藻酸鈉溶液的滴管或者帶有針頭的注射器借助外力相互擠壓,使之滴落在含有金屬陽離子的交聯劑中以此產生海藻酸鈉微球。其粒徑通常會受到液滴下落的距離、針頭尺寸、溶液濃度以及交聯劑濃度等因素的影響[10-11],通常情況下微球粒徑的范圍在500~1 000 μm。運用擠出法所制備微球的也有明顯的缺點,比如粒徑較大、表面粗糙且大小不均。為此,現有研究對擠出法做出了進一步的改善,即利用靜電噴射法或同軸氣流技術來控制藻酸鹽微球的形狀和尺寸[12-13]。該方法可以用于工業、食品和生物醫學工程等方面。Liao等[14]用溶液擠壓法在工業上生產出連續纖維電池,功能部件之間的層流保證了它們在擠壓過程中的無縫界面。
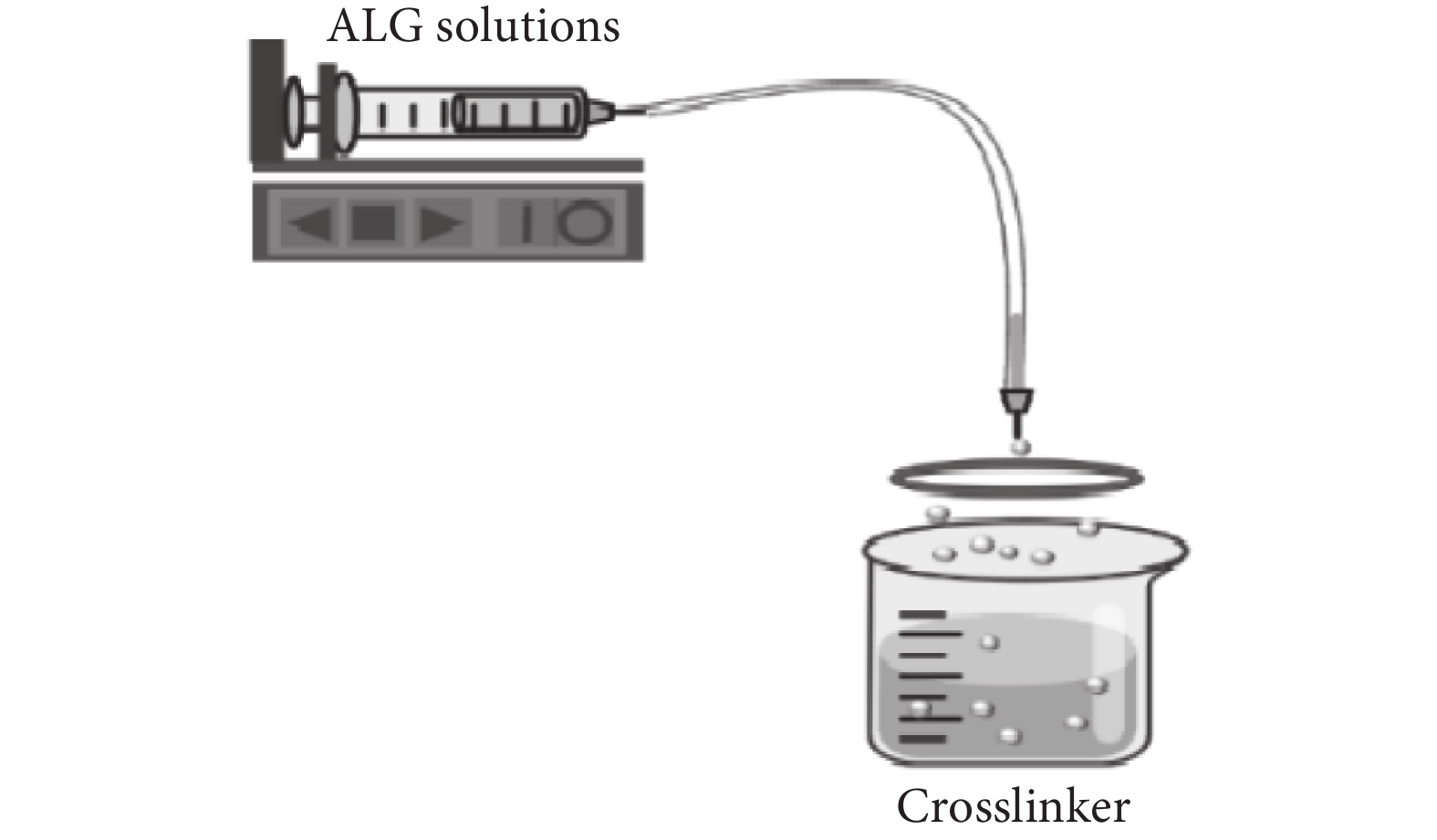 圖2
擠出法示意圖
Figure2.
Schematic diagram of extrusion method
圖2
擠出法示意圖
Figure2.
Schematic diagram of extrusion method
2.2 乳化交聯法
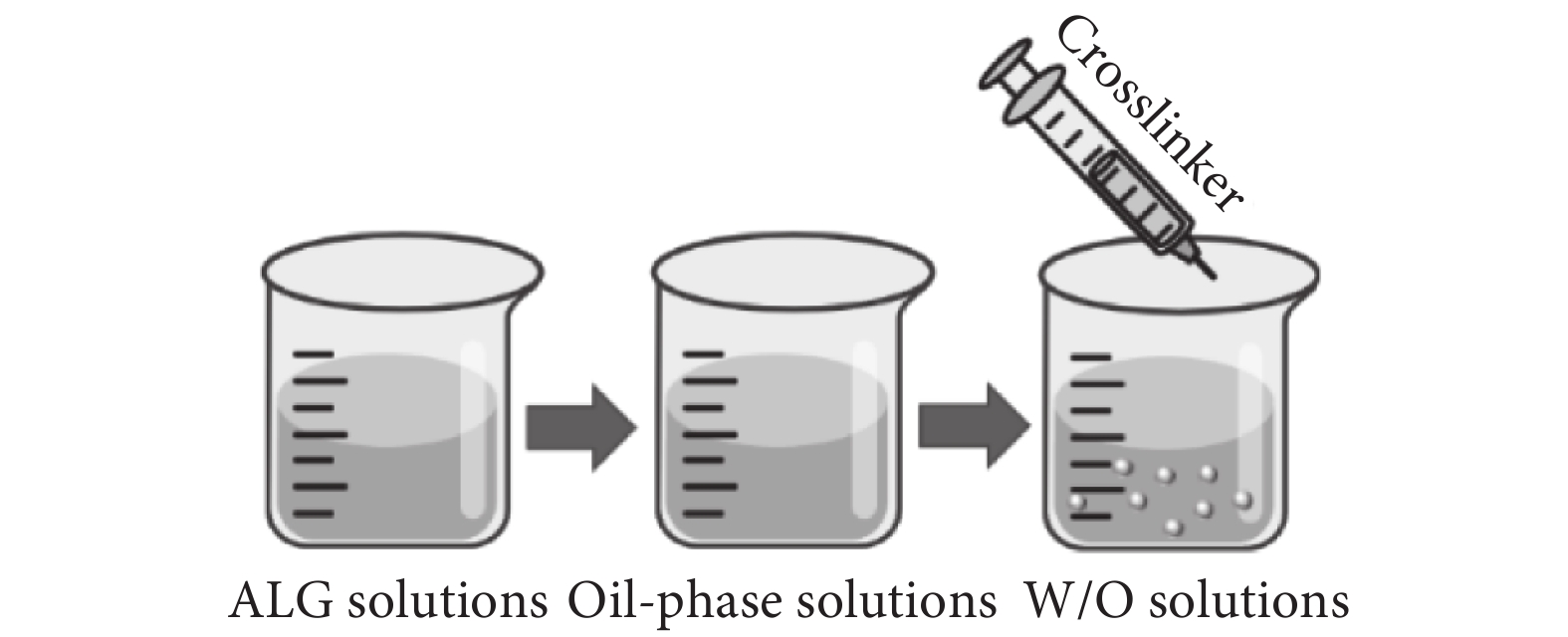
目前,運用乳化交聯法(見圖3)制備海藻酸鈉微球是應用最廣泛的技術。該方法由至少兩種不混溶的液相組成,其中一種以球形液滴的形式分散在另一種液相中,并通過乳化劑或表面活性劑穩定存在[12]。關于海藻酸鈉微球的制備,將海藻酸鈉水溶液作為分散相加入至含有表面活性劑的油相溶液中,制得油包水(W/O)溶液,再加入金屬陽離子(常為Ca2+)進行交聯[15-16]。該方法制備的粒徑通常在10~1 000 μm。乳化法的主要缺點是包封在微球內部的活性物質或細胞會暴露于有毒性的連續相中,并且在微球形成后需要使用有機溶劑洗滌殘留的油相[17]。Ali等[18]利用乳化法制備了地塞米松納米顆粒,該納米顆粒可以實現零級釋放動力學。
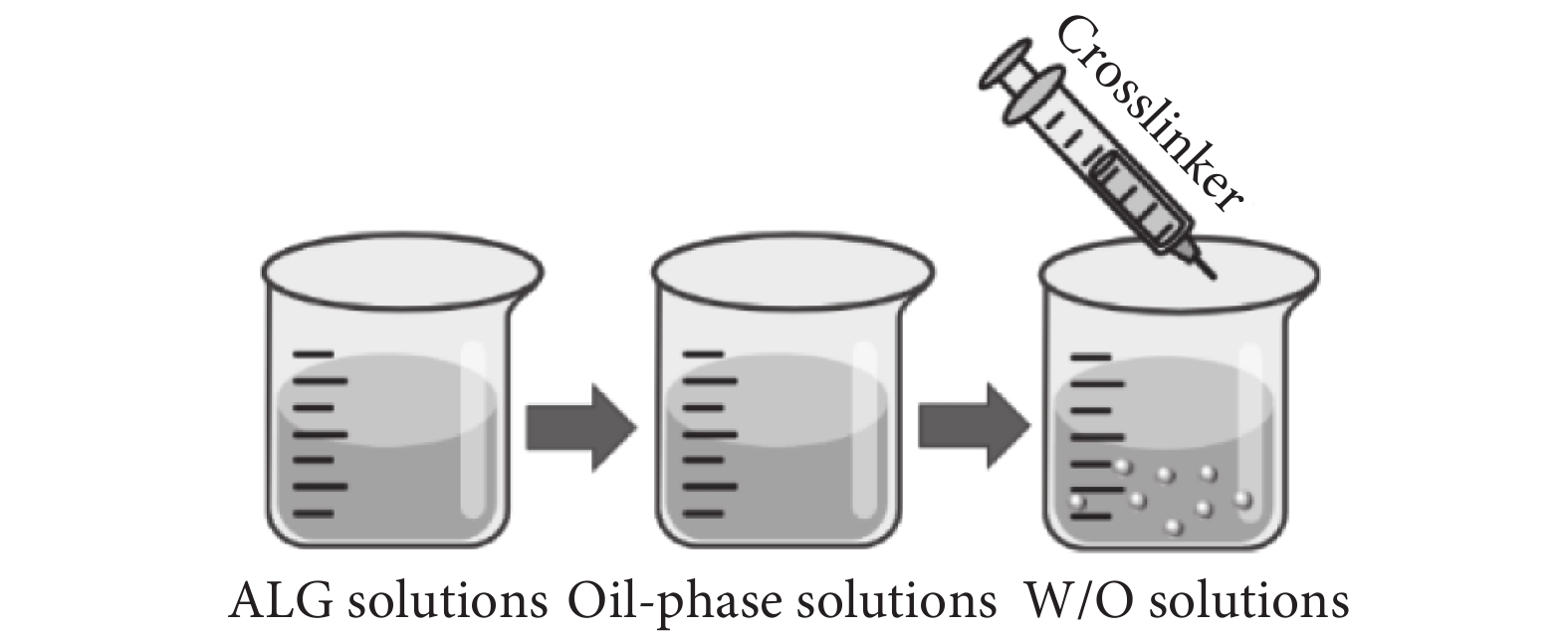 圖3
乳化交聯法示意圖
Figure3.
Schematic diagram of emulsion cross-linking method
圖3
乳化交聯法示意圖
Figure3.
Schematic diagram of emulsion cross-linking method
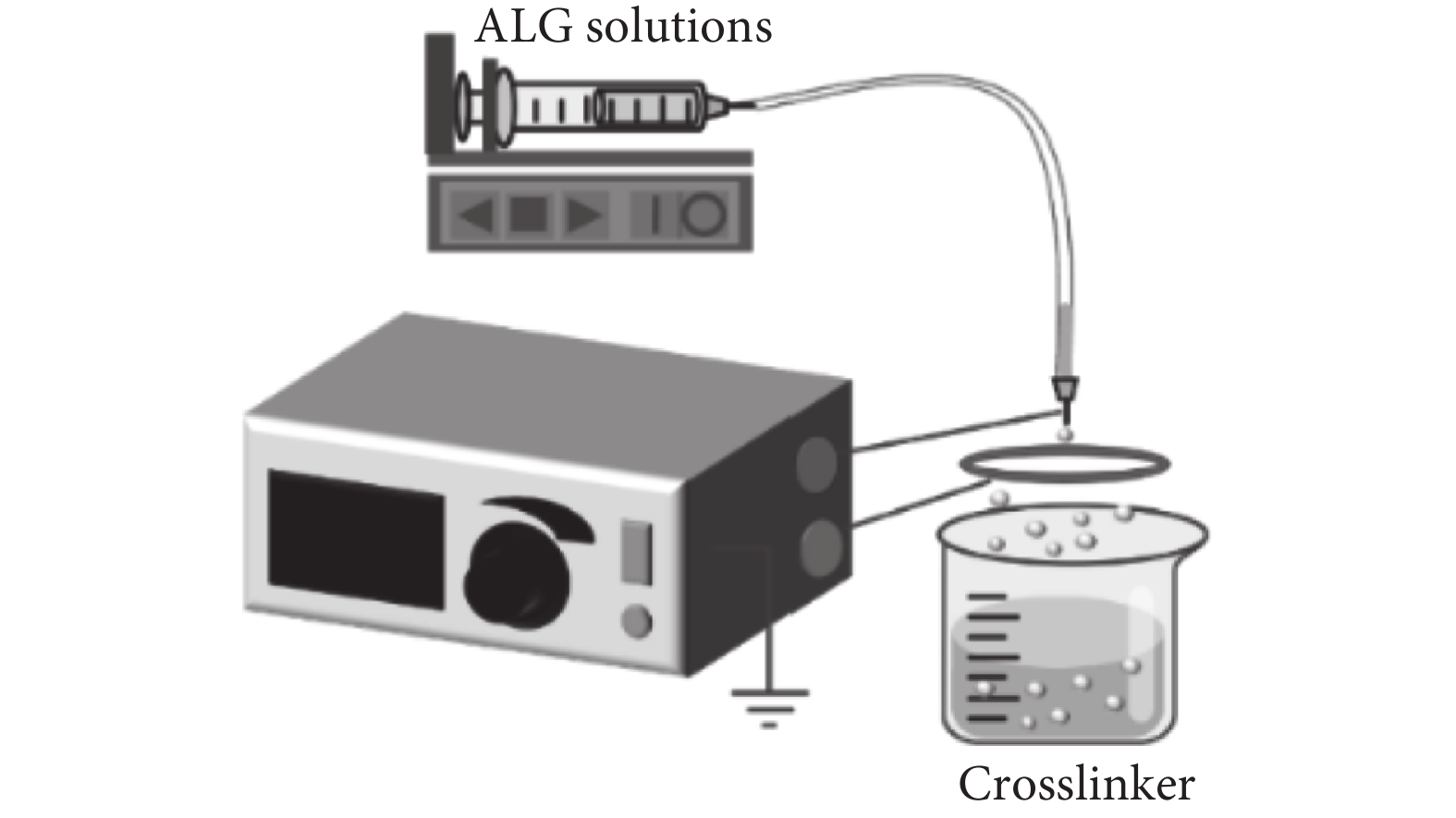
2.3 靜電噴射法
通常來說尺寸較小以及尺寸分布比較窄的微球通過傳統的制備方法是比較難以獲得的。因此,靜電噴射技術(見圖4)在制備微球方面取得了廣泛的關注。Hayati等[19]在1987年研究了外加電場對流動液滴的影響,隨著電場的增加,可以觀察到水滴形狀的變化和滴速的增加,這就是所謂的滴水模式。在持續性電壓的作用下,液體以臨界體積從針頭處滴落,這取決于液體的表面張力[20]。當電場力的強度足以克服海藻酸鈉溶液的表面張力時,針頭處的液滴形成噴射狀從而產生微液滴,這些微液滴可以與鈣離子交聯,繼而產生微球[21]。與此同時,所得微球的粒徑和形狀與電壓、推進速度以及海藻酸鈉濃度等因素有關[22],通常情況下微球的粒徑在50~500 μm。與乳化交聯方法相比,不會降低生物活性是靜電噴射技術的主要優點。Castrovilli等[23]應用電噴的方法作為酶固定化技術,制造了一種新的、無金屬的漆酶基生物傳感器,具有前所未有的可重復使用和存儲能力。
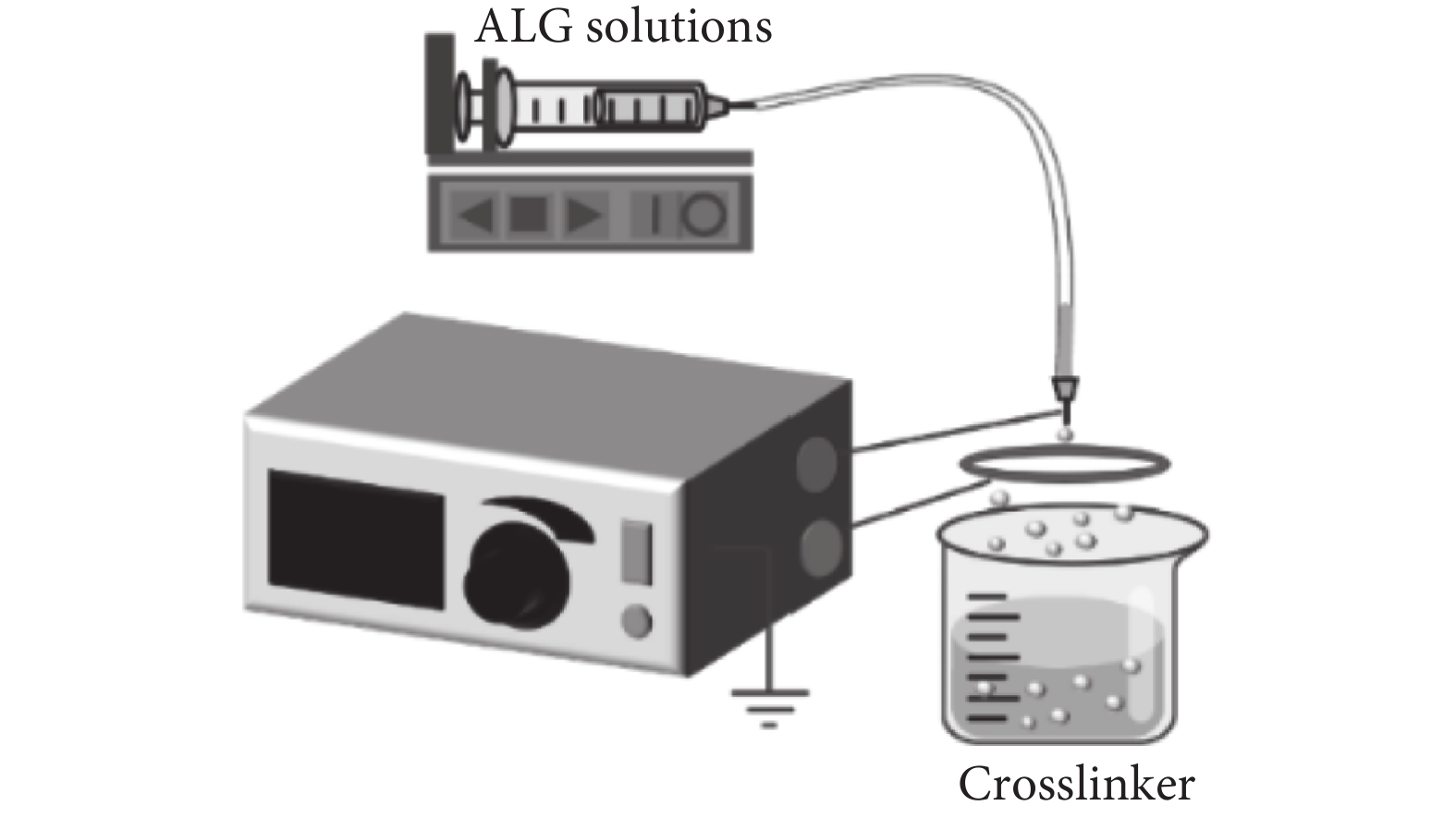 圖4
靜電噴射法示意圖
Figure4.
Schematic diagram of electrostatic spraying method
圖4
靜電噴射法示意圖
Figure4.
Schematic diagram of electrostatic spraying method
2.4 同軸氣流噴射法
擠出法的衍生就是同軸氣流技術(見圖5),高速氣流的引入有利于將擠出的液體裂解成更小的液滴,從而形成不同的噴射模式,例如滴落或噴射狀態[24- 25]。同軸氣流促使液滴從針尖中噴射至交聯劑中,與交聯劑固化形成微球。氣體流速、溶液濃度以及針頭尺寸等因素會影響微球粒徑的大小[26]。與靜電噴射技術類似,該技術所制備出的微球粒徑也小于500 μm。同軸氣流壓力對液滴位移和體積的影響與電壓幅值、脈沖寬度和脈沖頻率有關[27]。相對于靜電噴射技術而言,同軸氣流技術的微球生產率有一定優勢,但是該方法可能會形成非球形的微球并且對黏度較高的海藻酸鈉并不敏感[28],因此該技術依舊未能用于大批量生產。
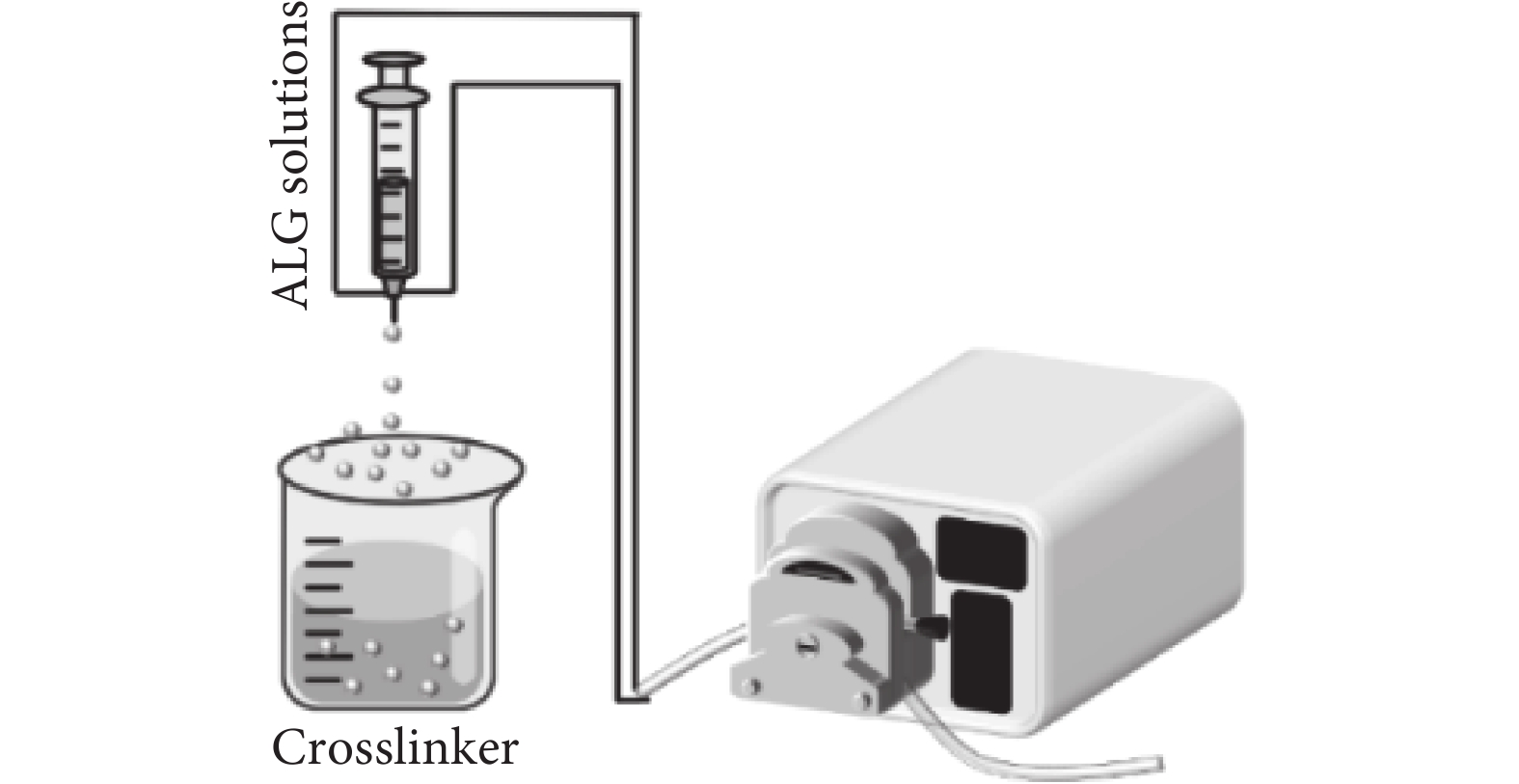 圖5
同軸氣流噴射法示意圖
Figure5.
Schematic diagram of the coaxial airflow method
圖5
同軸氣流噴射法示意圖
Figure5.
Schematic diagram of the coaxial airflow method
2.5 噴霧干燥法
噴霧干燥法(見圖6)是通過霧化器把海藻酸鈉溶液噴散成霧滴,并在高溫氣流中使霧滴干燥而形成的粉狀制品[5]。采用該方法所制備的微球粒徑及其形貌會受到進風溫度、前驅體溶液濃度、進料速度以及前驅體溶液組成的影響[29]。通常情況下,所制備微球粒徑在10~100 μm。Grenha等[30]通過噴霧法制備出了載蛋白納米顆粒,可系統地將治療性大分子輸送到肺部。
 圖6
噴霧干燥法示意圖
Figure6.
Schematic diagram of spray drying method
圖6
噴霧干燥法示意圖
Figure6.
Schematic diagram of spray drying method
3 海藻酸鈉微球的應用
3.1 在骨修復中的應用
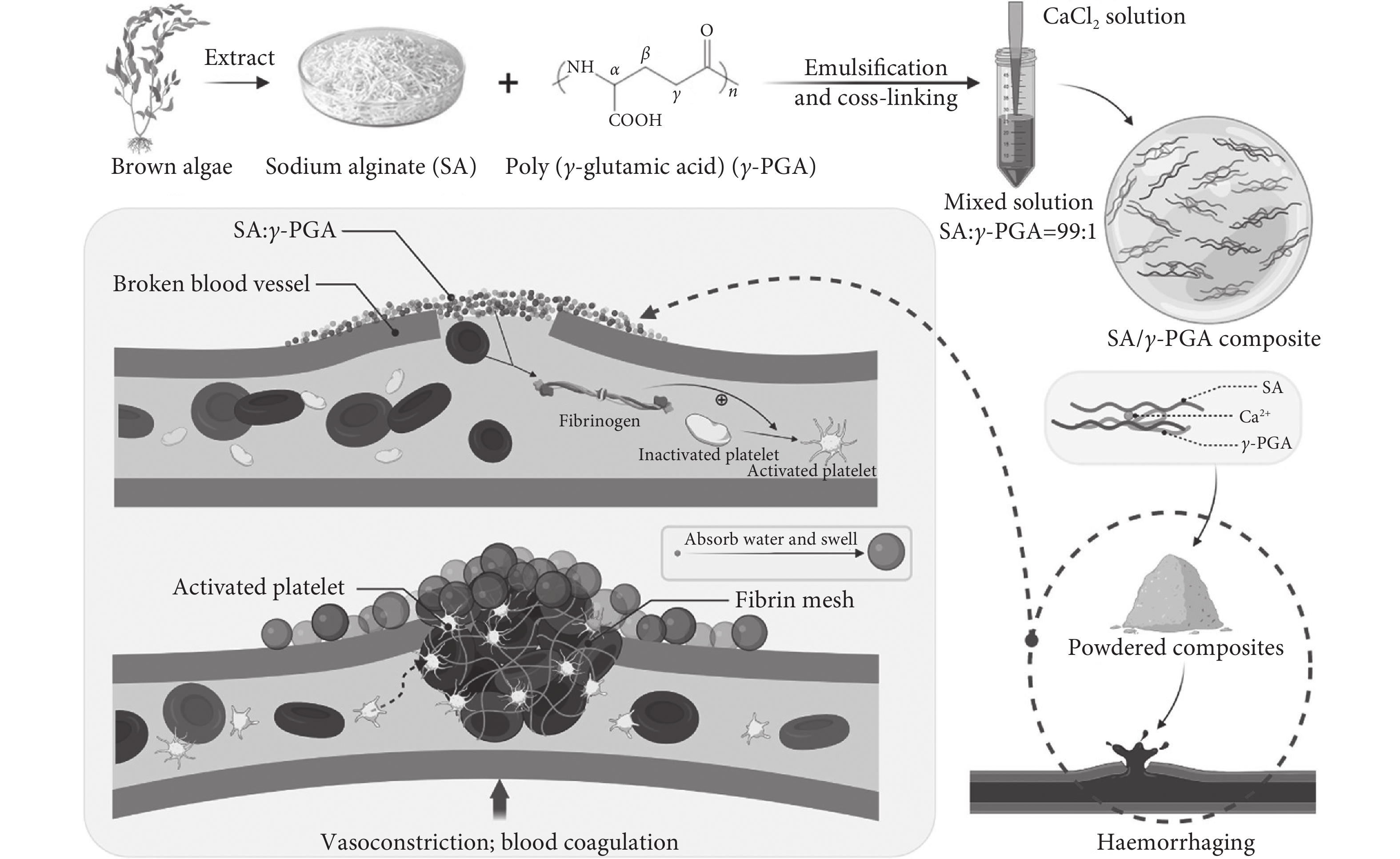
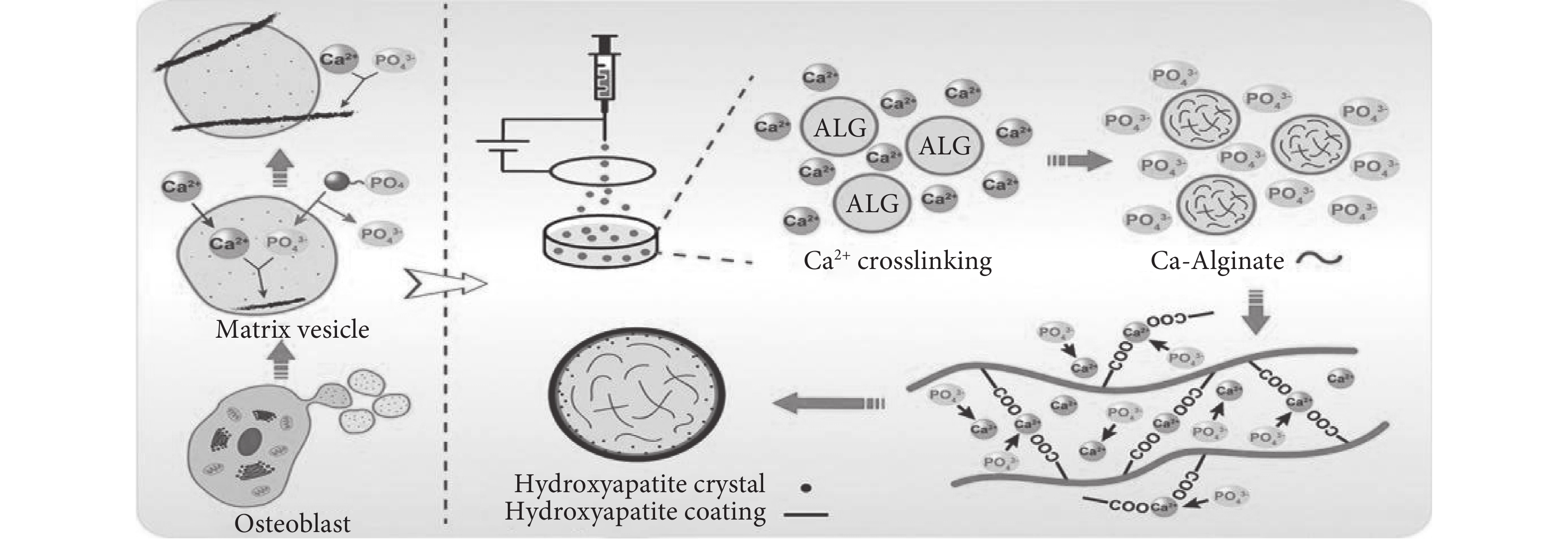
近年來與骨缺損治療相關的醫療技術的快速發展為臨床管理提供了多種選擇,自體骨移植或異體骨移植被廣泛用于治療嚴重骨缺損,但移植骨來源有限,迫切需要有應用價值的骨組織工程支架作為骨替代材料。間充質干細胞(mesenchymal stem cells,MSCs)對組織修復的生物學作用主要是通過細胞外囊泡的分泌作用介導的,而不是直接分化成實質細胞來修復或替換受損組織。筆者所在的課題組[22]受骨基質囊泡(matrix vesicles,MVs)初始礦化過程的啟發(見圖7),研究發現了基于靜電噴霧法制備的藻酸鹽微球(alginate microspheres,ALG)以及礦化的藻酸鹽微球(mineralised alginate microspheres,M-ALG)具有良好的生物相容性和成骨性能。礦化后產生的羥基磷灰石(hydroxy-apatite,HA)涂層也有利于成骨細胞向M-ALG微球表面的主動遷移。這是由于HA晶體首先形成并錨定在微球膜上,就像HA晶體最初沉積在MVs內部一樣。隨著礦物晶體的不斷生長和積累,最終在ALG微球上形成HA涂層。HA涂層也有利于成骨細胞向M-ALG微球表面的主動遷移。總之,ALG微球上的骨樣HA具有促進骨缺損修復的良好前景。Yashaswini Devi等[31]研究制備了鈣離子交聯的海藻酸鹽復合微球作為骨移植的替代物。采用模擬體液溶液進行體外生物礦化研究,在微球表面觀察到磷灰石形成。研究制備的微球與人骨肉瘤細胞(MG-63)共同培養,體外研究表明使用成骨細胞具有良好的生物相容性以及促成骨生成作用。Thomas等[32]研究并制備了一種基于海藻酸鈉的微球,將MSCs包封在一個隔室中,在不同時間點對微球的力學完整性進行了測試。結果表明,海藻酸鹽微球在較長時間內具有機械穩定性。通過磁操縱測試加載IONP/MSCs的微球,使用電磁操縱設備進行靶向MSCs遞送以進行軟骨修復。Zhao等[33]研究制備了海藻酸鹽水凝膠,研究了和水凝膠培養的兔骨髓基質細胞的活性、增殖、初始黏附和成骨分化情況,結果表明該凝膠具有良好的生物相容性,包埋的兔骨髓基質細胞具有成骨分化能力。筆者所在的課題組Miao等[34]以海藻酸鈉為原料研究制備了三維雜化水凝膠,可以模擬天然細胞外基質的結構和生物功能。支架內相互連接且均勻的孔隙有利于骨再生過程中營養物質的運輸。結果表明,HA顆粒均勻分布在水凝膠表面,與MC3T3-E1細胞共培養實驗表明,礦化后的雜化水凝膠具有良好的生物相容性,有利于骨組織的生長。
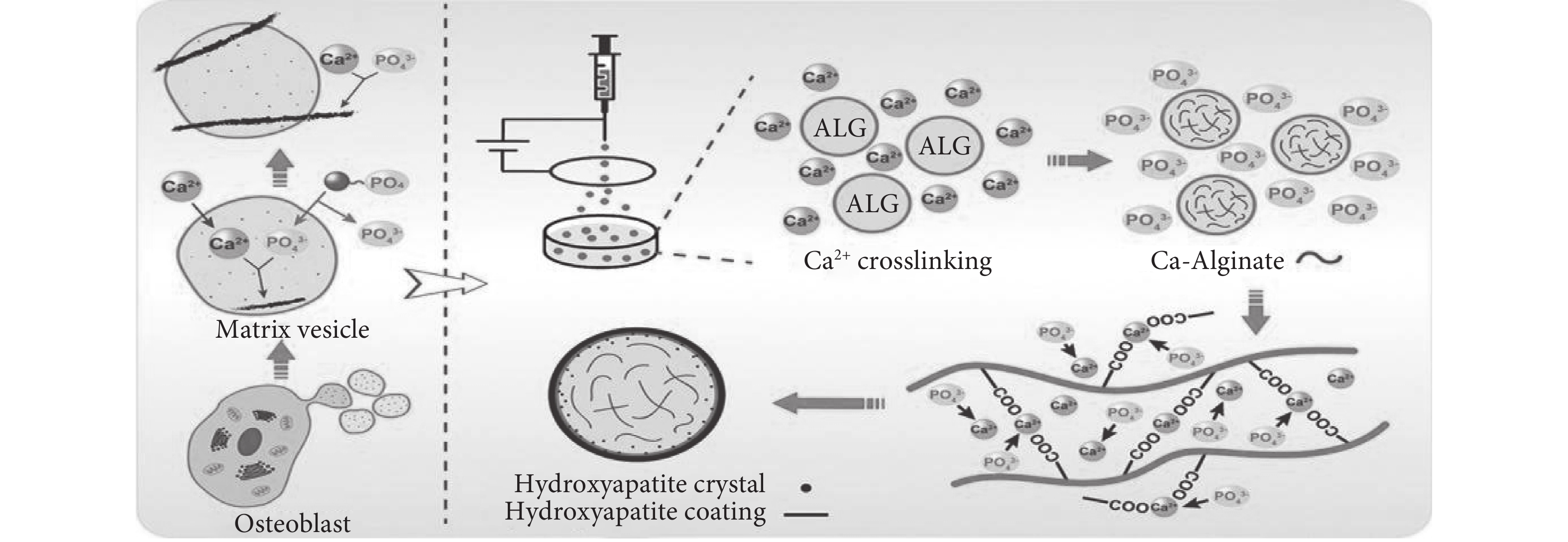 圖7
MVs作為礦化的初始位置參與骨組織的形成以及受MVs啟發以ALG微球為基質的仿生礦化機制[22]
Figure7.
MVs as the initial site of mineralization participate in the formation of bone tissue and the biomimetic mineralization mechanism inspired by MVs with ALG microspheres as the matrix
圖7
MVs作為礦化的初始位置參與骨組織的形成以及受MVs啟發以ALG微球為基質的仿生礦化機制[22]
Figure7.
MVs as the initial site of mineralization participate in the formation of bone tissue and the biomimetic mineralization mechanism inspired by MVs with ALG microspheres as the matrix
reprinted with permission from ref. [22] (Xu et al. 2022) Copyright ? 2022 Published by Elsevier Ltd
3.2 在止血中的應用
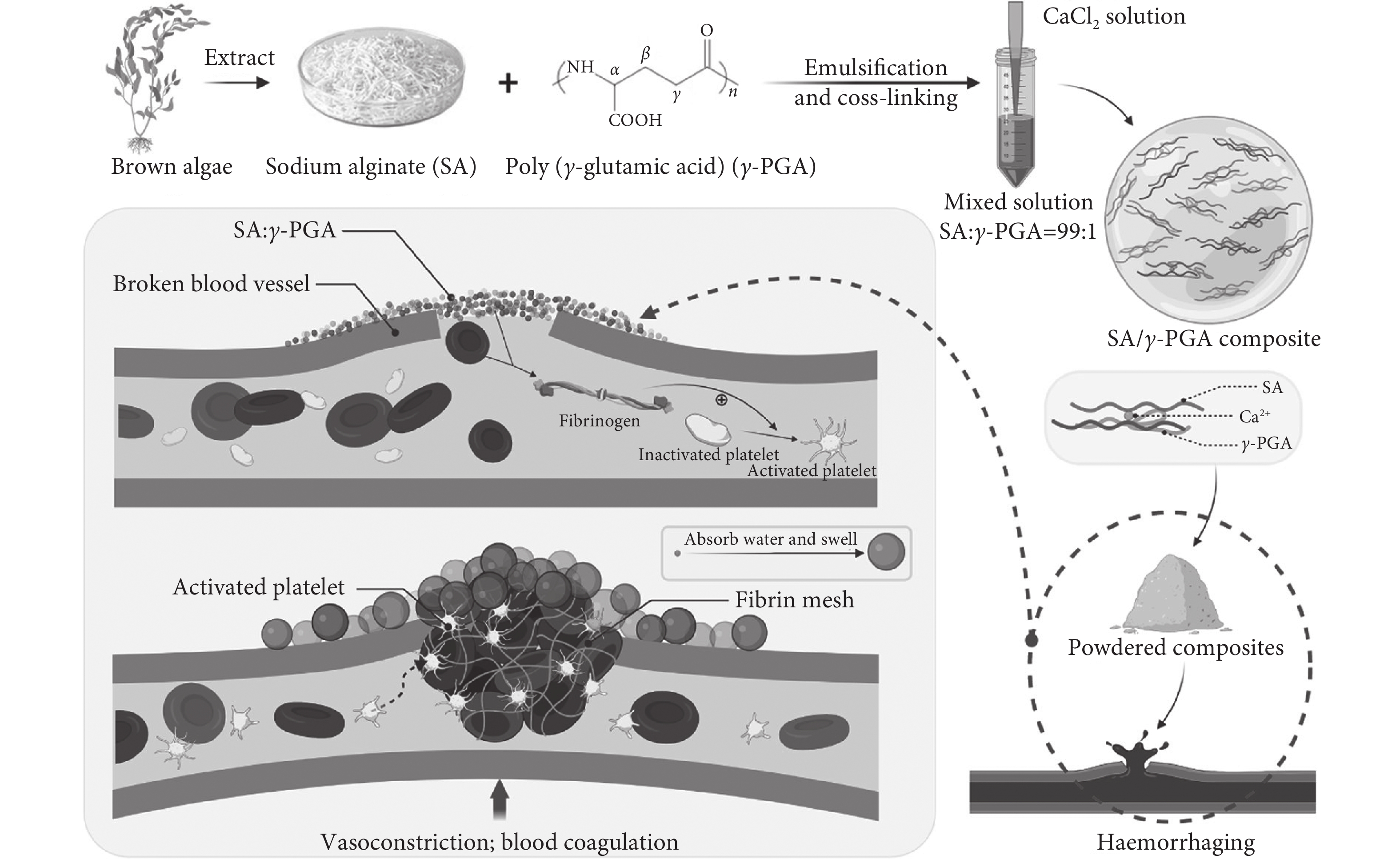
在傷口愈合過程中,促進止血和細胞黏附是必不可少的。及時的止血治療對于減少失血和提高生存率至關重要。當血液接觸異物時,表面吸附的纖維蛋白原誘導血小板的黏附和激活,從而觸發凝血。Huang等[35]為提高凝血速度設計并制備了不同表面粗糙度的海藻酸鈉止血微球。采用掃描電子顯微鏡、紅外光譜和凝血實驗分析表面形貌和止血性能,結果表明,這些微球可以聚集大量的血小板,具有最快的凝血速度和最強的凝血強度。微球不僅無細胞毒性,而且還促進細胞生長。體外和體內凝血實驗表明,微球可以減少出血時間和出血量,提高止血效率,這表明微球是具有優異生物安全性的潛在止血劑。Jin等[36]設計并制備了一種新型海藻酸鹽復合微球并對其理化性質、體內外止血能力、生物相容性、傷口愈合以及生物降解性等進行了研究。結果表明,該微球既能止血,又能通過加快凝血和傷口愈合速度來提高愈合效率。此外,微球無明顯的皮內刺激反應,無明顯的溶血反應。更重要的是,它可以在體內降解,對生理、生物化學和組織沒有顯著影響。該研究將為進一步研究體內止血實驗提供重要信息。Wang等[37]研究制備了海藻酸鈉復合止血微球(見圖8),具有良好的生物相容性、吸水性和黏度。測定了微球使用過程中止血壓力與止血時間的關系并通過構建肝、脾、股動脈出血模型分析了止血效果。復合微球具有良好的體內耐受性,在動物實驗中表現出較微孔多糖粉末化合物更好的止血效果。研究結果表明,該微球是一種止血效果好且安全性高的材料,具有很大的臨床應用潛力。Xie等[38]研究開發了一種基于海藻酸鈉的多功能水凝膠。該水凝膠可以通過快速凝膠,牢固地附著在創面皮膚上,實現快速止血。體外全血凝血實驗表明,水凝膠能黏附紅細胞,對大鼠肝損傷和斷尾模型具有良好的止血作用。該水凝膠具有生物相容性,在止血和創面愈合方面具有廣闊的應用前景。
3.3 在藥物遞送中的應用
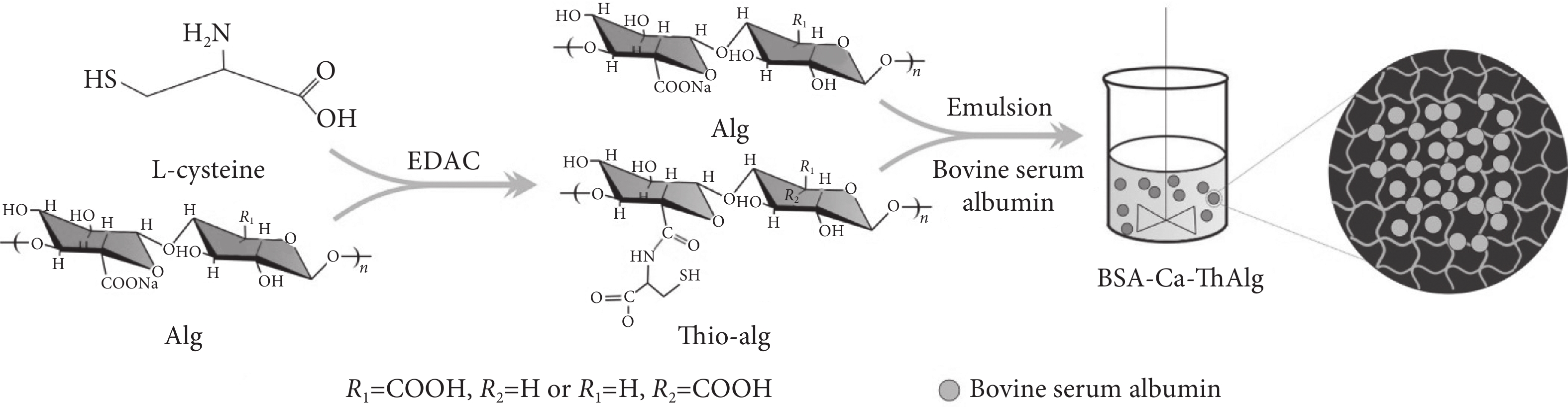
海藻酸微球作為一種新型給藥系統,由于價格低廉、無毒、生物相容性和生物降解性等優點而受到廣泛關注。在新型給藥系統中,藥物載體是一種底物,它使藥物能夠被運輸到靶部位,以可控的速率釋放藥物,從而提高藥物的生物利用度。Chang等[39]以海藻酸鈉為原料制備了pH和溫度敏感的納米凝膠。細胞毒性試驗表明,納米顆粒具有較低的細胞毒性和較高的生物相容性。pH敏感和溫度敏感實驗表明,在pH=5.5和31 ℃以上,該水凝膠的顆粒尺寸減小。體外載藥和藥物釋放實驗也證實了這一發現,表明新合成的水凝膠可以根據環境的變化釋放藥物。Mao等[40]將海藻酸鈉進行乳化,得到了一種腸道靶向的多肽口服給藥微球(見圖9)。以胎牛血清蛋白模擬藥物,考察微球作為腸道給藥載體的可行性。結果表明,該微球粒徑分布較窄。此外,微球可以保持結構的完整性,并在胃的強酸性環境中保存藥物。而且,微球表現出持續的腸道靶向藥物釋放能力。
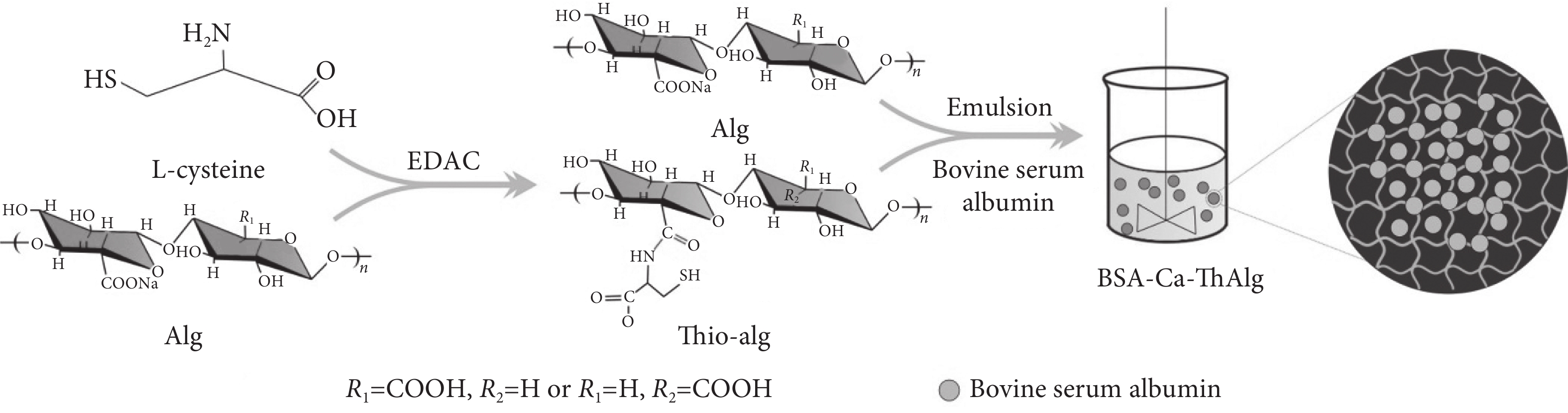 圖9
BSA-Ca-ThAlg微球的制備原理圖
圖9
BSA-Ca-ThAlg微球的制備原理圖
以胎牛血清蛋白為模擬藥物,考察微球作為腸道給藥載體的可行性[40]
Figure9. Schematic illustration for the preparation of BSA-Ca-ThAlg microspheresbovine serum albumin was used as the simulating drug to assess the feasibility of microspheres as intestinal delivery carriers. Reprinted with permission from ref. [40] (Mao et al. 2019) Copyright © 2019 American Chemical Society
4 結論及展望
在天然聚合物中,海藻酸鹽通常可以從棕色海藻中獲得,已經被廣泛應用于生物醫學領域。海藻酸微球傷口敷料可以維持生理濕潤的微環境,減少傷口部位的細菌感染,進而促進傷口愈合。海藻酸鈉微球可以用來延長藥物作用的時間以此增強藥效。開發新型的細胞和組織相互作用的海藻酸鹽凝膠,可以促進組織工程的未來發展。
殼聚糖是天然多糖甲殼素脫除部分乙酰基的產物,是一種常用的生物材料,親水性高,無毒,具有良好的生物降解性、生物相容性以及抑菌性質。殼聚糖在傷口管理領域以其止血特性而聞名。此外,它還具有其他生物活性,并可影響巨噬細胞功能,有助于加快傷口愈合。目前,提高殼聚糖應用價值的最有效途徑之一是對殼聚糖進行化學修飾,形成殼聚糖衍生物。如果將海藻酸鈉和殼聚糖結合形成復合微球,可以用于藥物緩釋、癌癥治療以及傷口敷料中,以此來降低藥物的毒副作用,減少服藥次數,增強藥物的穩定性和利用率。同時,它還可以應用于抗菌,可有效抑制細菌的增長。另外可以利用殼聚糖胺基和海藻酸鈉羧基之間的強離子鍵,制備一種相比殼聚糖來說力學性能更好、結構更穩定的天然聚合物基復合支架,具有較好的應用前景。另外,根據修復組織或器官損傷的實際情況,結合三維打印技術以及海藻酸鈉微球的優勢,可制備出包埋微球的組織類器官芯片,進行智能修復。總之,因海藻酸鈉優良的理化及生物相容性,制備的微球應用前景廣闊,但是因制備方法以及材料本身性質的限制,微球的尺寸仍然難以達到納米級,在診斷以及治療領域的應用還有限制,因此制備方法還需要加大探索。
重要聲明
利益沖突聲明:本文全體作者均聲明不存在利益沖突。
作者貢獻聲明:劉軒妤完成文章的撰寫;王玉輝進行文獻收集工作;魏延、梁紫薇、黃棣、連小潔、胡銀春進行文章指導工作。
0 引言
海藻酸鈉(sodium alginate,SA)是一種常用的生物材料,是天然多糖碳水化合物中的一種。這種化合物可以從褐藻類的海帶中提取,屬于藻類衍生物,具有優異的生物相容性、無毒性、穩定性且儲存量豐富,已經被廣泛應用于諸如骨組織治療、受損組織的止血以及疾病治療等生物醫學領域。
1 海藻酸鈉的理化性質
海藻酸鈉是存在于褐藻類海洋生物中的線性陰離子天然多糖,由β-D-甘露糖醛酸(M)和α-L-古羅糖醛酸(G)鍵聚合而成[1-2]。海藻酸鈉是一種白色或者淡黃色不定形的粉末,無毒,溶于水,不溶于有機溶劑且無臭無味[3-4]。溶于水后形成粘稠的膠狀物,當含水量超過95%時,容易從溶膠狀變成凝膠狀[5]。當pH值為6~9時黏性穩定,加熱至80 ℃以上時,黏性降低[6]。隨著pH的降低,海藻酸鈉溶液的黏度不斷增強。
2 海藻酸鈉微球的制備方法
海藻酸鈉含有大量的-COO-,在水溶液中可表現出聚陰離子行為,可以和二價陽離子交聯形成凝膠[7](見圖1、表1)。海藻酸鈉的結構與活組織的細胞外基質相似,可廣泛應用于傷口愈合、小分子藥物和蛋白質等生物活性劑的輸送和細胞移植[8-9]。目前,海藻酸鈉微球的制備方法主要有擠出法、乳化交聯法、靜電噴射法、同軸氣流法以及噴霧干燥法等。
 圖1
SA和Ca2+交聯示意圖
Figure1.
Schematic diagram of SA and Ca2+ cross-linkage
圖1
SA和Ca2+交聯示意圖
Figure1.
Schematic diagram of SA and Ca2+ cross-linkage
2.1 擠出法
擠出法(見圖2)是操作最簡單、應用最普遍的微球制備技術。這種制備方法通常是將含有海藻酸鈉溶液的滴管或者帶有針頭的注射器借助外力相互擠壓,使之滴落在含有金屬陽離子的交聯劑中以此產生海藻酸鈉微球。其粒徑通常會受到液滴下落的距離、針頭尺寸、溶液濃度以及交聯劑濃度等因素的影響[10-11],通常情況下微球粒徑的范圍在500~1 000 μm。運用擠出法所制備微球的也有明顯的缺點,比如粒徑較大、表面粗糙且大小不均。為此,現有研究對擠出法做出了進一步的改善,即利用靜電噴射法或同軸氣流技術來控制藻酸鹽微球的形狀和尺寸[12-13]。該方法可以用于工業、食品和生物醫學工程等方面。Liao等[14]用溶液擠壓法在工業上生產出連續纖維電池,功能部件之間的層流保證了它們在擠壓過程中的無縫界面。
 圖2
擠出法示意圖
Figure2.
Schematic diagram of extrusion method
圖2
擠出法示意圖
Figure2.
Schematic diagram of extrusion method
2.2 乳化交聯法
目前,運用乳化交聯法(見圖3)制備海藻酸鈉微球是應用最廣泛的技術。該方法由至少兩種不混溶的液相組成,其中一種以球形液滴的形式分散在另一種液相中,并通過乳化劑或表面活性劑穩定存在[12]。關于海藻酸鈉微球的制備,將海藻酸鈉水溶液作為分散相加入至含有表面活性劑的油相溶液中,制得油包水(W/O)溶液,再加入金屬陽離子(常為Ca2+)進行交聯[15-16]。該方法制備的粒徑通常在10~1 000 μm。乳化法的主要缺點是包封在微球內部的活性物質或細胞會暴露于有毒性的連續相中,并且在微球形成后需要使用有機溶劑洗滌殘留的油相[17]。Ali等[18]利用乳化法制備了地塞米松納米顆粒,該納米顆粒可以實現零級釋放動力學。
 圖3
乳化交聯法示意圖
Figure3.
Schematic diagram of emulsion cross-linking method
圖3
乳化交聯法示意圖
Figure3.
Schematic diagram of emulsion cross-linking method
2.3 靜電噴射法
通常來說尺寸較小以及尺寸分布比較窄的微球通過傳統的制備方法是比較難以獲得的。因此,靜電噴射技術(見圖4)在制備微球方面取得了廣泛的關注。Hayati等[19]在1987年研究了外加電場對流動液滴的影響,隨著電場的增加,可以觀察到水滴形狀的變化和滴速的增加,這就是所謂的滴水模式。在持續性電壓的作用下,液體以臨界體積從針頭處滴落,這取決于液體的表面張力[20]。當電場力的強度足以克服海藻酸鈉溶液的表面張力時,針頭處的液滴形成噴射狀從而產生微液滴,這些微液滴可以與鈣離子交聯,繼而產生微球[21]。與此同時,所得微球的粒徑和形狀與電壓、推進速度以及海藻酸鈉濃度等因素有關[22],通常情況下微球的粒徑在50~500 μm。與乳化交聯方法相比,不會降低生物活性是靜電噴射技術的主要優點。Castrovilli等[23]應用電噴的方法作為酶固定化技術,制造了一種新的、無金屬的漆酶基生物傳感器,具有前所未有的可重復使用和存儲能力。
 圖4
靜電噴射法示意圖
Figure4.
Schematic diagram of electrostatic spraying method
圖4
靜電噴射法示意圖
Figure4.
Schematic diagram of electrostatic spraying method
2.4 同軸氣流噴射法
擠出法的衍生就是同軸氣流技術(見圖5),高速氣流的引入有利于將擠出的液體裂解成更小的液滴,從而形成不同的噴射模式,例如滴落或噴射狀態[24- 25]。同軸氣流促使液滴從針尖中噴射至交聯劑中,與交聯劑固化形成微球。氣體流速、溶液濃度以及針頭尺寸等因素會影響微球粒徑的大小[26]。與靜電噴射技術類似,該技術所制備出的微球粒徑也小于500 μm。同軸氣流壓力對液滴位移和體積的影響與電壓幅值、脈沖寬度和脈沖頻率有關[27]。相對于靜電噴射技術而言,同軸氣流技術的微球生產率有一定優勢,但是該方法可能會形成非球形的微球并且對黏度較高的海藻酸鈉并不敏感[28],因此該技術依舊未能用于大批量生產。
 圖5
同軸氣流噴射法示意圖
Figure5.
Schematic diagram of the coaxial airflow method
圖5
同軸氣流噴射法示意圖
Figure5.
Schematic diagram of the coaxial airflow method
2.5 噴霧干燥法
噴霧干燥法(見圖6)是通過霧化器把海藻酸鈉溶液噴散成霧滴,并在高溫氣流中使霧滴干燥而形成的粉狀制品[5]。采用該方法所制備的微球粒徑及其形貌會受到進風溫度、前驅體溶液濃度、進料速度以及前驅體溶液組成的影響[29]。通常情況下,所制備微球粒徑在10~100 μm。Grenha等[30]通過噴霧法制備出了載蛋白納米顆粒,可系統地將治療性大分子輸送到肺部。
 圖6
噴霧干燥法示意圖
Figure6.
Schematic diagram of spray drying method
圖6
噴霧干燥法示意圖
Figure6.
Schematic diagram of spray drying method
3 海藻酸鈉微球的應用
3.1 在骨修復中的應用
近年來與骨缺損治療相關的醫療技術的快速發展為臨床管理提供了多種選擇,自體骨移植或異體骨移植被廣泛用于治療嚴重骨缺損,但移植骨來源有限,迫切需要有應用價值的骨組織工程支架作為骨替代材料。間充質干細胞(mesenchymal stem cells,MSCs)對組織修復的生物學作用主要是通過細胞外囊泡的分泌作用介導的,而不是直接分化成實質細胞來修復或替換受損組織。筆者所在的課題組[22]受骨基質囊泡(matrix vesicles,MVs)初始礦化過程的啟發(見圖7),研究發現了基于靜電噴霧法制備的藻酸鹽微球(alginate microspheres,ALG)以及礦化的藻酸鹽微球(mineralised alginate microspheres,M-ALG)具有良好的生物相容性和成骨性能。礦化后產生的羥基磷灰石(hydroxy-apatite,HA)涂層也有利于成骨細胞向M-ALG微球表面的主動遷移。這是由于HA晶體首先形成并錨定在微球膜上,就像HA晶體最初沉積在MVs內部一樣。隨著礦物晶體的不斷生長和積累,最終在ALG微球上形成HA涂層。HA涂層也有利于成骨細胞向M-ALG微球表面的主動遷移。總之,ALG微球上的骨樣HA具有促進骨缺損修復的良好前景。Yashaswini Devi等[31]研究制備了鈣離子交聯的海藻酸鹽復合微球作為骨移植的替代物。采用模擬體液溶液進行體外生物礦化研究,在微球表面觀察到磷灰石形成。研究制備的微球與人骨肉瘤細胞(MG-63)共同培養,體外研究表明使用成骨細胞具有良好的生物相容性以及促成骨生成作用。Thomas等[32]研究并制備了一種基于海藻酸鈉的微球,將MSCs包封在一個隔室中,在不同時間點對微球的力學完整性進行了測試。結果表明,海藻酸鹽微球在較長時間內具有機械穩定性。通過磁操縱測試加載IONP/MSCs的微球,使用電磁操縱設備進行靶向MSCs遞送以進行軟骨修復。Zhao等[33]研究制備了海藻酸鹽水凝膠,研究了和水凝膠培養的兔骨髓基質細胞的活性、增殖、初始黏附和成骨分化情況,結果表明該凝膠具有良好的生物相容性,包埋的兔骨髓基質細胞具有成骨分化能力。筆者所在的課題組Miao等[34]以海藻酸鈉為原料研究制備了三維雜化水凝膠,可以模擬天然細胞外基質的結構和生物功能。支架內相互連接且均勻的孔隙有利于骨再生過程中營養物質的運輸。結果表明,HA顆粒均勻分布在水凝膠表面,與MC3T3-E1細胞共培養實驗表明,礦化后的雜化水凝膠具有良好的生物相容性,有利于骨組織的生長。
 圖7
MVs作為礦化的初始位置參與骨組織的形成以及受MVs啟發以ALG微球為基質的仿生礦化機制[22]
Figure7.
MVs as the initial site of mineralization participate in the formation of bone tissue and the biomimetic mineralization mechanism inspired by MVs with ALG microspheres as the matrix
圖7
MVs作為礦化的初始位置參與骨組織的形成以及受MVs啟發以ALG微球為基質的仿生礦化機制[22]
Figure7.
MVs as the initial site of mineralization participate in the formation of bone tissue and the biomimetic mineralization mechanism inspired by MVs with ALG microspheres as the matrix
reprinted with permission from ref. [22] (Xu et al. 2022) Copyright ? 2022 Published by Elsevier Ltd
3.2 在止血中的應用
在傷口愈合過程中,促進止血和細胞黏附是必不可少的。及時的止血治療對于減少失血和提高生存率至關重要。當血液接觸異物時,表面吸附的纖維蛋白原誘導血小板的黏附和激活,從而觸發凝血。Huang等[35]為提高凝血速度設計并制備了不同表面粗糙度的海藻酸鈉止血微球。采用掃描電子顯微鏡、紅外光譜和凝血實驗分析表面形貌和止血性能,結果表明,這些微球可以聚集大量的血小板,具有最快的凝血速度和最強的凝血強度。微球不僅無細胞毒性,而且還促進細胞生長。體外和體內凝血實驗表明,微球可以減少出血時間和出血量,提高止血效率,這表明微球是具有優異生物安全性的潛在止血劑。Jin等[36]設計并制備了一種新型海藻酸鹽復合微球并對其理化性質、體內外止血能力、生物相容性、傷口愈合以及生物降解性等進行了研究。結果表明,該微球既能止血,又能通過加快凝血和傷口愈合速度來提高愈合效率。此外,微球無明顯的皮內刺激反應,無明顯的溶血反應。更重要的是,它可以在體內降解,對生理、生物化學和組織沒有顯著影響。該研究將為進一步研究體內止血實驗提供重要信息。Wang等[37]研究制備了海藻酸鈉復合止血微球(見圖8),具有良好的生物相容性、吸水性和黏度。測定了微球使用過程中止血壓力與止血時間的關系并通過構建肝、脾、股動脈出血模型分析了止血效果。復合微球具有良好的體內耐受性,在動物實驗中表現出較微孔多糖粉末化合物更好的止血效果。研究結果表明,該微球是一種止血效果好且安全性高的材料,具有很大的臨床應用潛力。Xie等[38]研究開發了一種基于海藻酸鈉的多功能水凝膠。該水凝膠可以通過快速凝膠,牢固地附著在創面皮膚上,實現快速止血。體外全血凝血實驗表明,水凝膠能黏附紅細胞,對大鼠肝損傷和斷尾模型具有良好的止血作用。該水凝膠具有生物相容性,在止血和創面愈合方面具有廣闊的應用前景。
3.3 在藥物遞送中的應用
海藻酸微球作為一種新型給藥系統,由于價格低廉、無毒、生物相容性和生物降解性等優點而受到廣泛關注。在新型給藥系統中,藥物載體是一種底物,它使藥物能夠被運輸到靶部位,以可控的速率釋放藥物,從而提高藥物的生物利用度。Chang等[39]以海藻酸鈉為原料制備了pH和溫度敏感的納米凝膠。細胞毒性試驗表明,納米顆粒具有較低的細胞毒性和較高的生物相容性。pH敏感和溫度敏感實驗表明,在pH=5.5和31 ℃以上,該水凝膠的顆粒尺寸減小。體外載藥和藥物釋放實驗也證實了這一發現,表明新合成的水凝膠可以根據環境的變化釋放藥物。Mao等[40]將海藻酸鈉進行乳化,得到了一種腸道靶向的多肽口服給藥微球(見圖9)。以胎牛血清蛋白模擬藥物,考察微球作為腸道給藥載體的可行性。結果表明,該微球粒徑分布較窄。此外,微球可以保持結構的完整性,并在胃的強酸性環境中保存藥物。而且,微球表現出持續的腸道靶向藥物釋放能力。
 圖9
BSA-Ca-ThAlg微球的制備原理圖
圖9
BSA-Ca-ThAlg微球的制備原理圖
以胎牛血清蛋白為模擬藥物,考察微球作為腸道給藥載體的可行性[40]
Figure9. Schematic illustration for the preparation of BSA-Ca-ThAlg microspheresbovine serum albumin was used as the simulating drug to assess the feasibility of microspheres as intestinal delivery carriers. Reprinted with permission from ref. [40] (Mao et al. 2019) Copyright © 2019 American Chemical Society
4 結論及展望
在天然聚合物中,海藻酸鹽通常可以從棕色海藻中獲得,已經被廣泛應用于生物醫學領域。海藻酸微球傷口敷料可以維持生理濕潤的微環境,減少傷口部位的細菌感染,進而促進傷口愈合。海藻酸鈉微球可以用來延長藥物作用的時間以此增強藥效。開發新型的細胞和組織相互作用的海藻酸鹽凝膠,可以促進組織工程的未來發展。
殼聚糖是天然多糖甲殼素脫除部分乙酰基的產物,是一種常用的生物材料,親水性高,無毒,具有良好的生物降解性、生物相容性以及抑菌性質。殼聚糖在傷口管理領域以其止血特性而聞名。此外,它還具有其他生物活性,并可影響巨噬細胞功能,有助于加快傷口愈合。目前,提高殼聚糖應用價值的最有效途徑之一是對殼聚糖進行化學修飾,形成殼聚糖衍生物。如果將海藻酸鈉和殼聚糖結合形成復合微球,可以用于藥物緩釋、癌癥治療以及傷口敷料中,以此來降低藥物的毒副作用,減少服藥次數,增強藥物的穩定性和利用率。同時,它還可以應用于抗菌,可有效抑制細菌的增長。另外可以利用殼聚糖胺基和海藻酸鈉羧基之間的強離子鍵,制備一種相比殼聚糖來說力學性能更好、結構更穩定的天然聚合物基復合支架,具有較好的應用前景。另外,根據修復組織或器官損傷的實際情況,結合三維打印技術以及海藻酸鈉微球的優勢,可制備出包埋微球的組織類器官芯片,進行智能修復。總之,因海藻酸鈉優良的理化及生物相容性,制備的微球應用前景廣闊,但是因制備方法以及材料本身性質的限制,微球的尺寸仍然難以達到納米級,在診斷以及治療領域的應用還有限制,因此制備方法還需要加大探索。
重要聲明
利益沖突聲明:本文全體作者均聲明不存在利益沖突。
作者貢獻聲明:劉軒妤完成文章的撰寫;王玉輝進行文獻收集工作;魏延、梁紫薇、黃棣、連小潔、胡銀春進行文章指導工作。