本文開發了基于結構光體表成像的無創放療患者擺位引導方法和系統,并評估其臨床可行性。首先,選用結構光傳感器實時獲取放療擺位場景全景點云,基于光學標定和姿態估計實現點云融合和坐標變換,并參照預設感興趣區域(ROI)實現體表點云分割。然后,基于隨機抽樣一致(RANSAC)和迭代最近點(ICP)等算法實現跨源點云全局—局部配準,以計算6自由度擺位偏差并引導移床校正。本研究基于剛性成人模體和志愿者人體對系統進行評估,包括擺位誤差測量、相關性分析和受試者操作特征(ROC)分析。模體測試以錐形束計算機斷層掃描(CBCT)作為金標準,本文開發系統最大平移和旋轉誤差分別為(1.5 ± 0.9)mm[垂直(Vrt)方向,胸部]和(0.7 ± 0.3)°[俯仰(Pitch)方向,頭頸部];系統整體輸出結果與CBCT驗證之間的皮爾遜(Pearson)相關系數分布在[0.80, 0.84]區間內;ROC分析顯示,平移和旋轉ROC曲線下區域面積(AUC)值分別為0.82和0.85。而在志愿者人體4自由度精度測試中,最大平移和旋轉誤差分別為(2.6 ± 1.1)mm(Vrt方向,胸腹部)和(0.8 ± 0.4)°[旋轉(Rtn)方向,胸腹部]。綜上,本文提出的基于結構光體表成像的擺位系統在無體表標記和額外劑量的前提下,可確保擺位精度,具備臨床應用可行性。
版權信息: ?四川大學華西醫院華西期刊社《生物醫學工程學雜志》版權所有,未經授權不得轉載、改編
0 引言
精準擺位,是放療實施的重要前提。研究表明,組織器官的形狀體積在放療分次內和分次間持續變化,對放療劑量分布和療效影響巨大[1-4]。近年來,立體定向、質子重離子等先進放療技術能使放療時的能量沉積更集中,這對患者擺位準確性和可重復性提出了更高的要求。傳統方法多使用激光十字和體表標記的方式實現擺位,并采用包括電子射野成像系統(electronic portal imaging device,EPID)和錐形束計算機斷層掃描(cone beam computed tomography,CBCT)等射線裝置進行位置驗證,例如:瓦里安加速器機載影像系統(on-board imager,OBI)(Varian Medical Systems Inc.,美國)和醫科達X射線容積成像系統(X-ray volumetric imaging,XVI)(Elakta Inc.,瑞典)等。常規手段在成像驗證過程會產生不可忽視的額外劑量,影響計劃劑量分布,并增加患者繼發癌癥風險[5];而且,還存在難以實現分次內連續監測、標記物易損等局限。放療光學體表追蹤與監測系統(Catalyst,C-RAD Inc.,瑞典)、表面引導放療系統(AlignRT,Vision RT Inc.,英國)等商業系統的應用表明了光學體表引導放療(surface guided radiation therapy,SGRT)在放療擺位中的臨床價值[6-8],但其產品軟、硬件嚴密封裝,核心技術被國外壟斷。另有多數文章公開了基于飛行時間法(time of flight, ToF)的光學擺位方法[9-11],但其精度和穩定性較為受限。本研究旨在突破國外技術壟斷壁壘,自主開發基于結構光體表成像的放療擺位方法和系統。同時,基于剛性成人模體和志愿者人體測試其精度,以期為光學體表擺位系統研究開發及其性能改進、流程優化和自主產業化提供參考。
1 資料與方法
1.1 光學硬件與參數設置
選用基于結構光傳感器(One+ Large,Zivid Inc.,挪威)獲取光學體表圖像,即獲取包括紅綠藍(red,green,blue,RGB)色彩模式和三維空間位置坐標的6通道點云數據。結構光傳感器在焦距1 800 mm的工作距離處,視場角(field of view,FoV)和空間分辨率分別為2 069 mm×1 310 mm和0.67 mm,深度方向上具有3.67×10-4 mm的出色分辨率,且6.5 ms的最短曝光時間(即幀率最大154 幀/s)可充分滿足患者擺位引導系統的實時性要求(以3~5 s的典型患者呼吸周期為例,系統幀率應大于等于4 幀/s)。為確保加速器機房環境下的點云質量,本研究在結構光傳感器標定和位姿估計過程中采取一組固定曝光參數,包括曝光時間、光圈、增益和投影亮度等。在模體和人體表面圖像采集中,綜合設定3組曝光參數以實現高動態范圍(high dynamic range,HDR)成像,如表1所示。同時,基于一系列濾波除噪算法實現點云預處理,包括采用信噪比(signal-to-noise-ratio,SNR)、濾波器(閾值設為0.7)、對比度失真和反射強度校正等圖像處理操作。此外,對局部區域內的像素進行高斯平滑(西格瑪值設為1.5)以抑制稀疏噪聲并將像素與網格對齊。放療擺位場景點云以結構光傳感器(One+ Large,Zivid Inc.,挪威)專用數據格式(.ZDF)存儲。
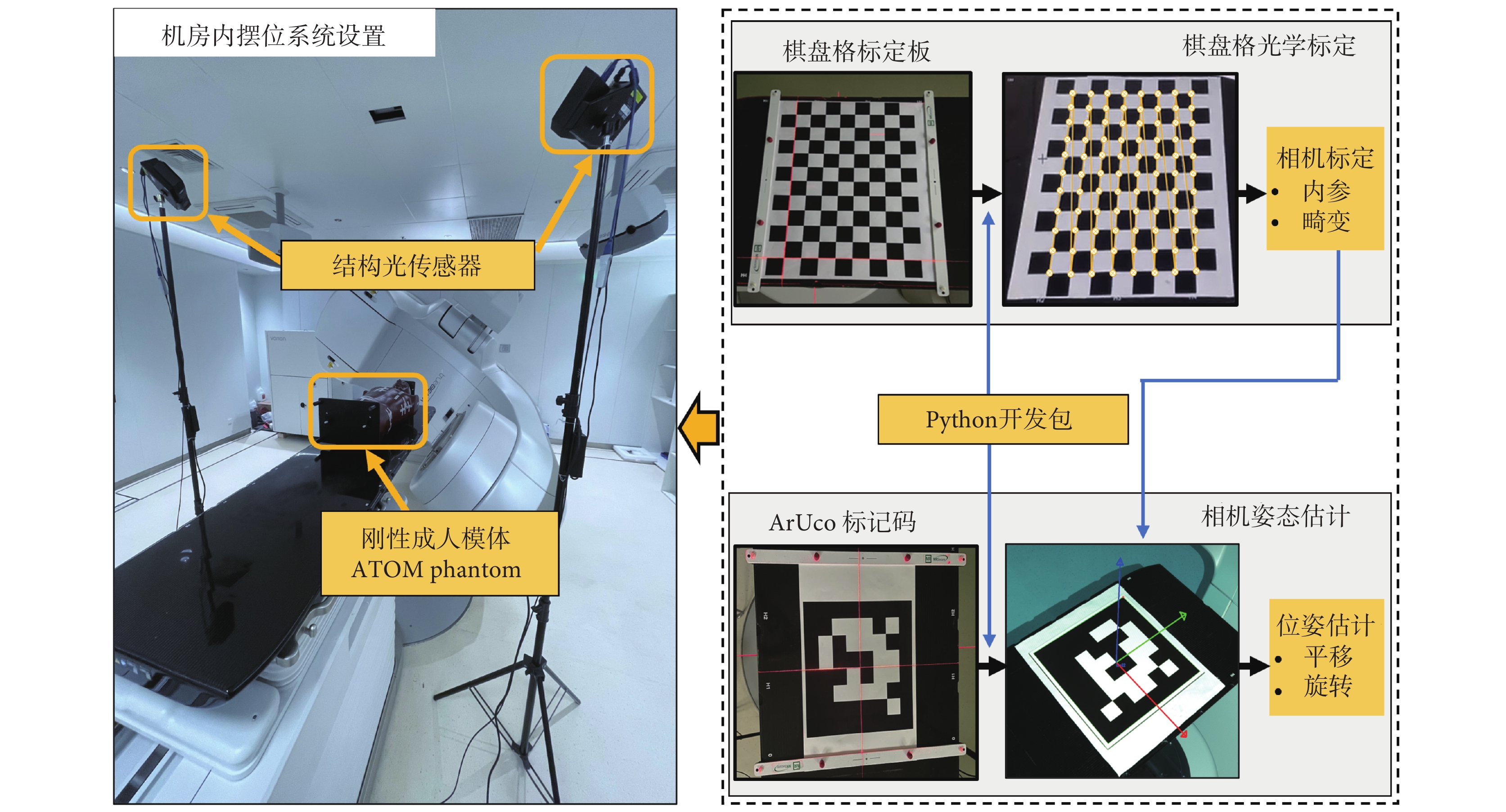
1.2 光學標定和傳感器位姿估計
為實現全景點云的融合和坐標變換,本研究對2臺結構光傳感器分別進行光學標定和位姿估計,其與等中心距離設定為150 cm,系統擺位場景設置、標定和位姿估計流程如圖1所示。選定邊長為30 mm的12 × 9氧化鋁棋盤格標定板 (checkerboard),基于張正友標定法[12]測量傳感器光學幾何模型參數。借助瓦里安加速器(Truebeam,Varian Medical Systems Inc.,美國)放療六維床,共采集27張不同角度、不同距離的標定圖像,并執行亞像素點檢測以提高標定精度。測量傳感器畸變參數和內參,以分別實現由光學組件制作及裝配引起的直線投影偏差校正和像素坐標Cpix到傳感器坐標系Ccam轉換,如式(1)~式(2)所示:
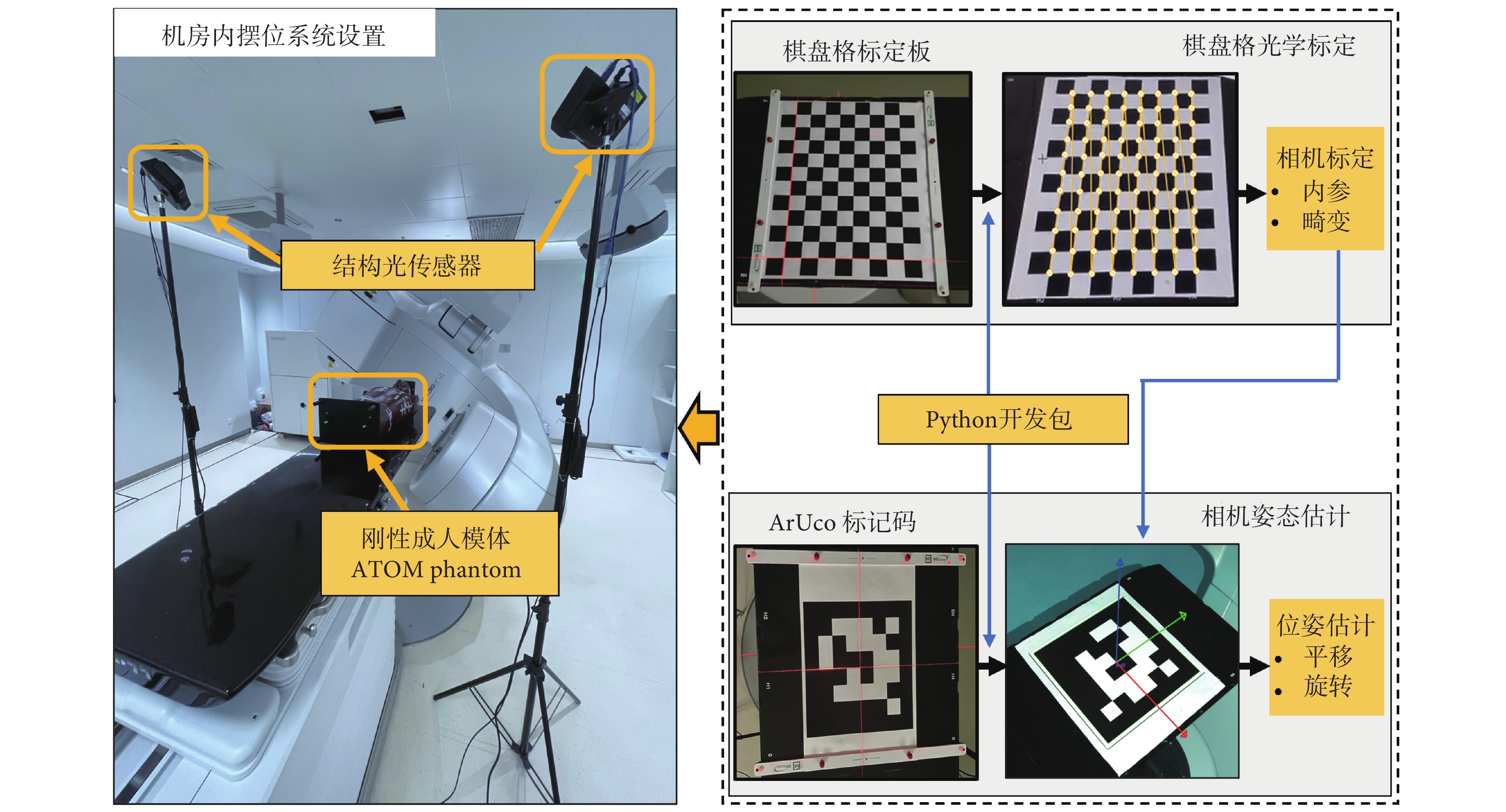 圖1
基于結構光相傳感器擺位系統設置及標定和位姿估計流程
Figure1.
Structured light sensor-based positioning system setting and calibration-pose estimation process
圖1
基于結構光相傳感器擺位系統設置及標定和位姿估計流程
Figure1.
Structured light sensor-based positioning system setting and calibration-pose estimation process
 |
 |
其中,Disr(?)表示像素坐標的徑向畸變校正,k1、k2、k3是像素主點泰勒級數展開所得畸變參數,m表示p的二維分量平方和;Min表示傳感器內參矩陣;f和Zc分別表示焦距和光學中心到物體距離比例因子;x和y表示像素物理尺寸, 和
和 表示中心像素坐標。
表示中心像素坐標。
以基于科爾多瓦大學增強現實(augmented reality university of cordoba,ArUco)的二進制標記碼測量包括旋轉和平移變換關系的傳感器外參,實現點云從Ccam到以等中心為原點的加速器機械坐標系Cacc空間轉換,如式(3)~式(4)所示:
 |
 |
其中,Mex為傳感器外參矩陣,Rxyz和Txyz分別為空間旋轉和平移矩陣,Xacc、Yacc和Zacc為光學源點云PCS在加速器機械坐標系Cacc中的坐標分量。本研究標定和位姿估計基于計算機視覺和機器學習軟件庫擴展模塊OpenCV-contrib(4.6.0,OpenCV,美國)和編程語言Python3.8(Centrum Wiskunde & Informatica,荷蘭)實現。事實上,作為傳感器固有屬性的內參和畸變參數只需測量一次,外參也僅在傳感器固定位置改變時需要測量,因此在臨床應用中,上述操作對所開發系統的效率并無影響。
1.3 體表點云配準
基于跨源體表點云配準獲取6自由度(degrees of freedom,DoF)移床值以引導放療擺位,配準對象包括源點云PCS和目標點云PCT。其中,源點云為基于結構光傳感器實時獲取并經圖像處理的光學體表點云;關于目標點云,首先基于西門子大孔徑模擬定位機 (SOMATOM confidence,Siemens Healthineers LLC.,德國)獲取剛性成人模體定位X射線電子計算機斷層掃描(computed tomography,CT)圖像,像素間距s和切片厚度t分別設置為0.976 6 mm和1 mm,物理師通過放療計劃系統(Eclipse,Varian Medical Systems Inc.,美國)勾畫身體輪廓并與CT圖像共同導出為醫學數字成像和通信(Digital imaging and communications in medicine,DICOM)格式結構化文件;對定位CT取二值掩膜并獲得表面體素索引集IDCT,并實施CT影像坐標系CCT與加速器機械坐標Cacc的變換以得到PCT,如式(5)所示:
 |
其中,TCT-acc表示CCT和Cacc之間的坐標變換矩陣。
臨床放療主要考慮感興趣區域(regions of interest,ROI)范圍內患者定位和劑量傳輸的準確性。體表區域限定將減少由全身表面配準帶來的額外誤差,例如胸部放療的肢體偏移,或腹部運動對頭部放療的影響,同時點云數量的減少也顯著提高跨源配準的效率。如表2所示,配準實施前,分別在前后(anterior-posterior,A-P)和上下(superior-inferior,S-I)方向,對PCS和PCT在頭頸部、胸部和盆腔三個部分定義了ROI,而在左右(left-right,L-R)方向,選取全范圍體表點云。
基于半徑濾波(radius-filter,rf)法去除點云異常值,其中相鄰點的半徑和點云數量閾值分別設置為3 mm和60,并進行3 mm網格下采樣。使用全局—局部的剛性方法來平衡配準速度和準確性,結合快速點特征直方圖(fast point feature histogram,FPFH)特征描述子[13],基于隨機抽樣一致(random sample consensus,RANSAC)實現對跨源體表點云PCS和PCT之間的全局配準,為局部優化提供初始變換矩陣并提高配準效率;局部優化基于點到面的迭代最近點(iterative closest point,ICP)算法[14-15]實現,其相比常規ICP算法更容易收斂。為計算點云配準相關空間平移矩陣RT和旋轉矩陣RR,該算法迭代優化跨源點云最近點匹配和變換估計步驟,直到目標函數達到預設閾值,如式(6)所示:
 |
其中,DS-T表示跨源點云平方距離,N是點的數量,nT表示目標點處的法向量。在Cacc中對于RT進行維度交換并獲得在垂直(Vrt)、進出(Lng)和左右(Lat)方向的三維平移床值,同時將矩陣RR轉換為歐拉角并獲得在冠狀位轉動(Rtn)、俯仰(Pitch)和橫滾(Roll)方向的三維旋轉床值,并最終得到6自由度的擺位校正床值。
1.4 系統精度評估
本研究分別基于剛性成人模體ATOM phantom和志愿者作為受試對象,在直線加速器機房中測試和評估所提出系統的可行性。
在剛性成人模體測試中,首先將剛性成人模體置于加速器治療床,基于所開發系統獲取6自由度擺位校正床值;其次,獲取模體CBCT圖像,并與定位CT圖像進行骨性配準,將配準結果作為量化擺位偏差的金標準。上述擺位過程對基于預設ROI實現分割的模體頭頸部、胸部和盆腔各重復20次。本文采取多項評價指標對系統精度進行綜合評估:① 采用兩組床值之間差異的絕對值量化系統精度;② 計算兩組床值之間的皮爾遜(Pearson)相關系數r;③ 采用受試者操作特征(receiver operating characteristic,ROC)分析方法,對系統在界定患者運動是否超出閾值方面的能力進行評估,其中所選閾值均勻分布于系統測試誤差范圍。
在志愿者測試中,本項工作共招募了4名志愿者,年齡在25~32歲,其中男性、女性各2位,所有志愿者均采取仰臥體位,擺位狀態均選用“呼氣末”。為便于實施,擺位部位分為頭頸部和胸腹部,且在4自由度(Vrt、Lng、Lat和Rtn)開展試驗。試驗設計及過程已通過山東第一醫科大學附屬腫瘤醫院倫理委員會批準(編號:SDTHEC2021012052),試驗前遵從受試者自愿參與的原則,對受試者及其家人詳細描述了試驗流程。本次研究采用體外測試,所采集數據僅用于科研研究,不作為診斷和治療依據,對受試者沒有風險,根據國家規定和赫爾辛基宣言的倫理學準則,經倫理委員會審查和批準后免于受試者的知情同意。試驗過程中,首先,采集初始位置體表點云作為參考點云;其次,以1 mm(或1°)為步長在1~6 mm(或1~6 °)范圍內平移(或旋轉)治療床,每個方向分別重復12次。采用系統的輸出結果與實際執行的平移(或旋轉)床值之間差異的絕對值量化系統精度。基于志愿者的測試分別在頭頸部和胸腹部進行。
2 結果
2.1 模體測試6自由度擺位結果
本文所提系統針對各部位的光學體表點云融合效果,及其與三維重建CT的跨源點云配準效果如圖2所示。其中,紅色/深藍色為不同結構光傳感器采集的光學體表點云融合效果,而黃色/淺藍色分別為結構光傳感器和重建CT的跨源點云配準。在共計60次擺位測試中,用于配準的頭頸部、胸部和盆腔的光學體表點云數量平均值分別為1.1 × 105、1.7 × 105和1.3 × 105。以CBCT為金標準的系統擺位測試誤差如表3所示,其中最大平移誤差為(1.5 ± 0.9) mm,出現在胸部擺位的Vrt方向;最大旋轉誤差為(0.7 ± 0.3)°,出現在頭頸部擺位的Pitch方向;最小平移誤差分別為(0.7 ± 0.5) mm,出現在頭頸部擺位的Lng方向,最小旋轉誤差為(0.2 ± 0.2)°,出現在頭頸部擺位的Rtn方向。總體上,所提出系統在Lat、Vrt和Lng方向的擺位平移誤差分別為(1.0 ± 0.7)mm、(1.4 ± 0.9)mm和(0.8 ± 0.6)mm;在Rtn、Pitch和Roll方向的擺位旋轉誤差分別為(0.2 ± 0.1)°、(0.6 ± 0.3)°和(0.4 ± 0.3)°。
 圖2
模體擺位系統測試中光學體表點云融合及其與重建CT點云配準效果
Figure2.
Optical surface point cloud fusion and registration with reconstructed CT point cloud in phantom-based system test
圖2
模體擺位系統測試中光學體表點云融合及其與重建CT點云配準效果
Figure2.
Optical surface point cloud fusion and registration with reconstructed CT point cloud in phantom-based system test
2.2 模體測試Pearson相關性分析結果
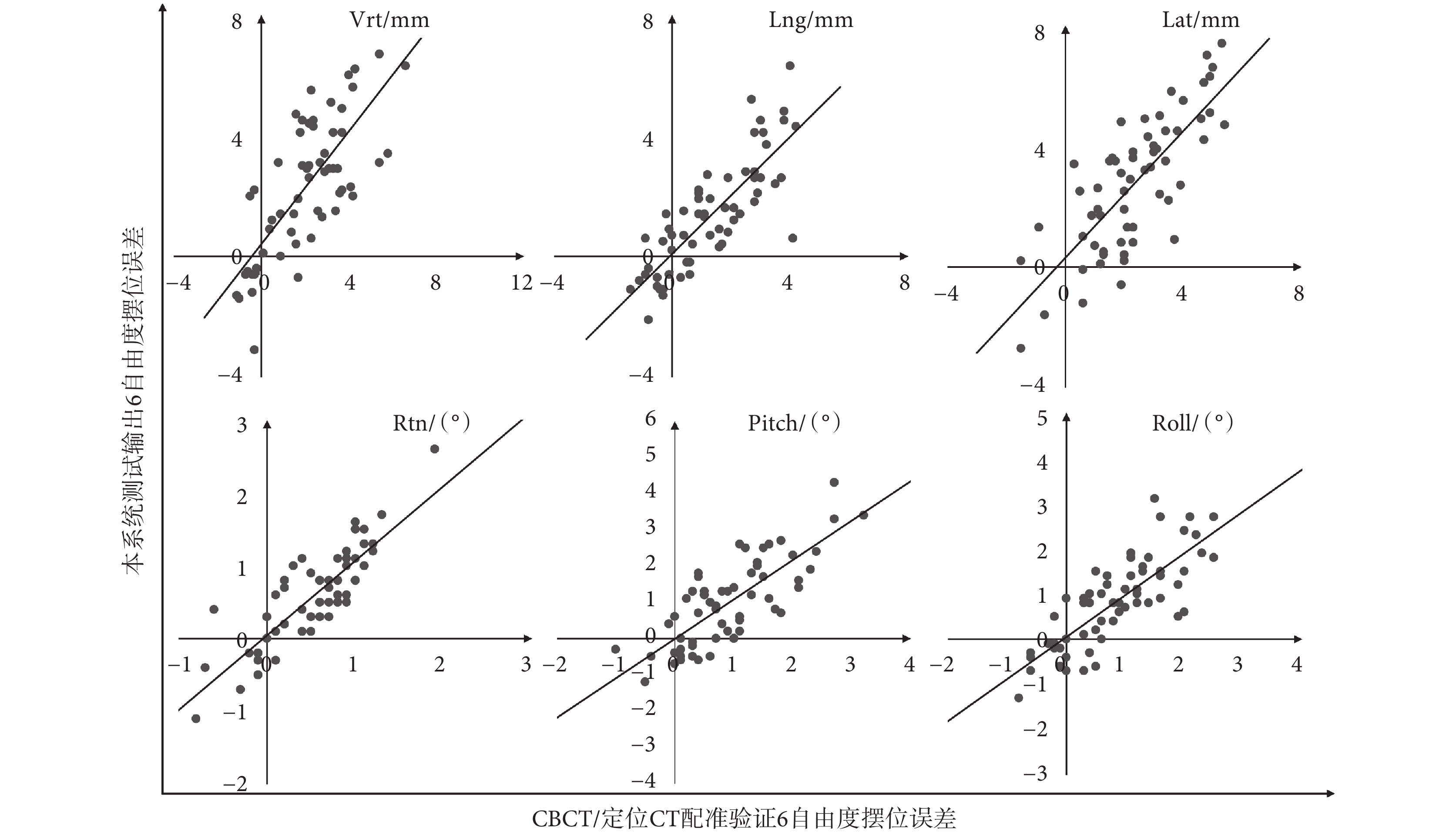
本文對于頭頸部、胸部和盆腔的總體擺位系統測試結果顯示,在各平移和旋轉方向上的Pearson相關系數r分布在 [0.80, 0.84] 的區間內。平移方向上,r值分別為0.80(Vrt方向)、0.83(Lng方向)和0.82(Lat方向);旋轉方向上,r值分別為0.84(Rtn方向)、0.80(Pitch方向)和0.81(Roll方向)。誤差分布及其與CBCT驗證結果的相關性分析如圖3所示。
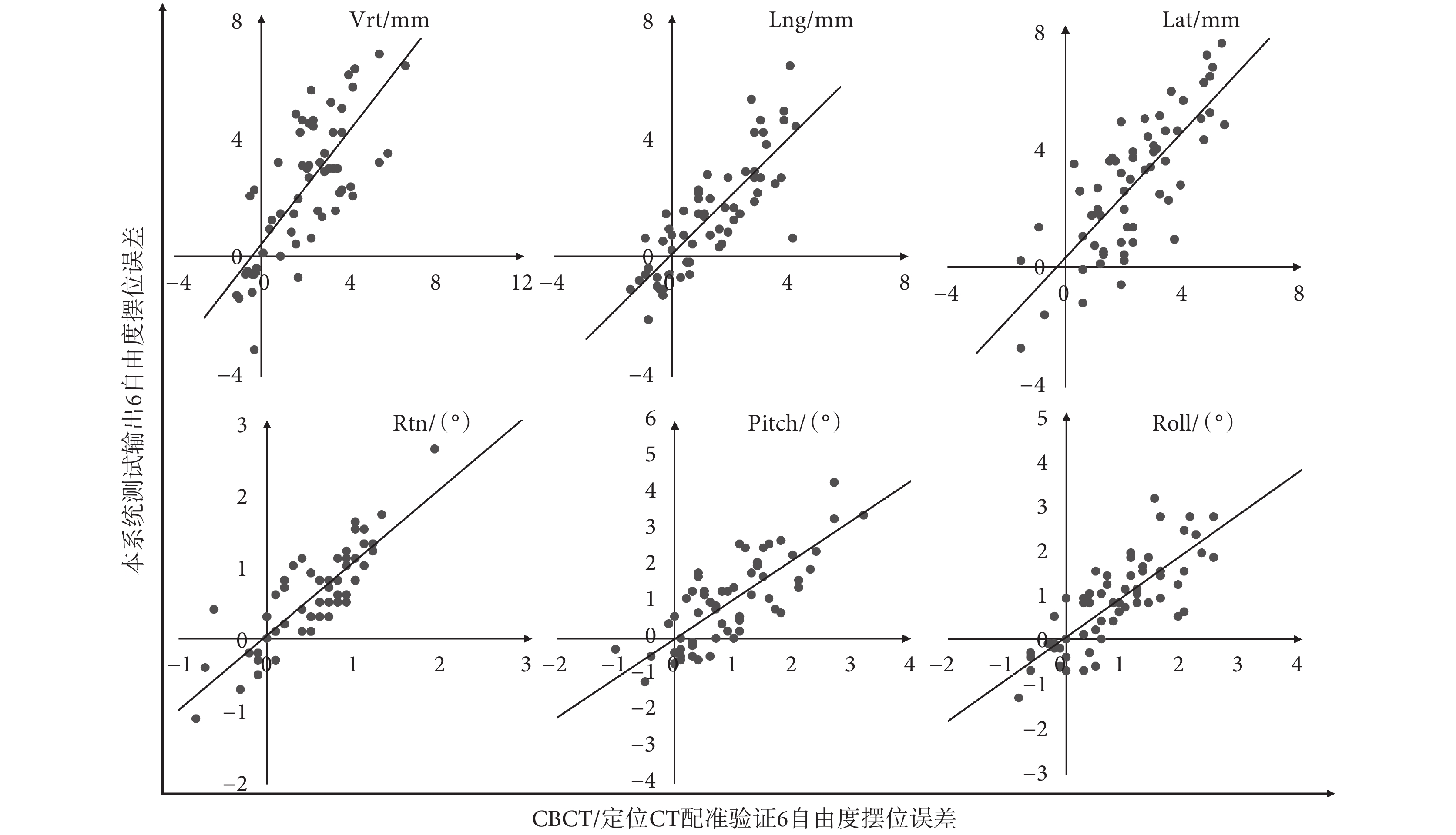 圖3
系統測試6自由度整體擺位誤差與CBCT驗證誤差分布和相關性分析
Figure3.
Distribution and correlation analysis of the system positioning errors and CBCT verification errors in 6 degrees of freedom
圖3
系統測試6自由度整體擺位誤差與CBCT驗證誤差分布和相關性分析
Figure3.
Distribution and correlation analysis of the system positioning errors and CBCT verification errors in 6 degrees of freedom
2.3 模體測試ROC分析結果
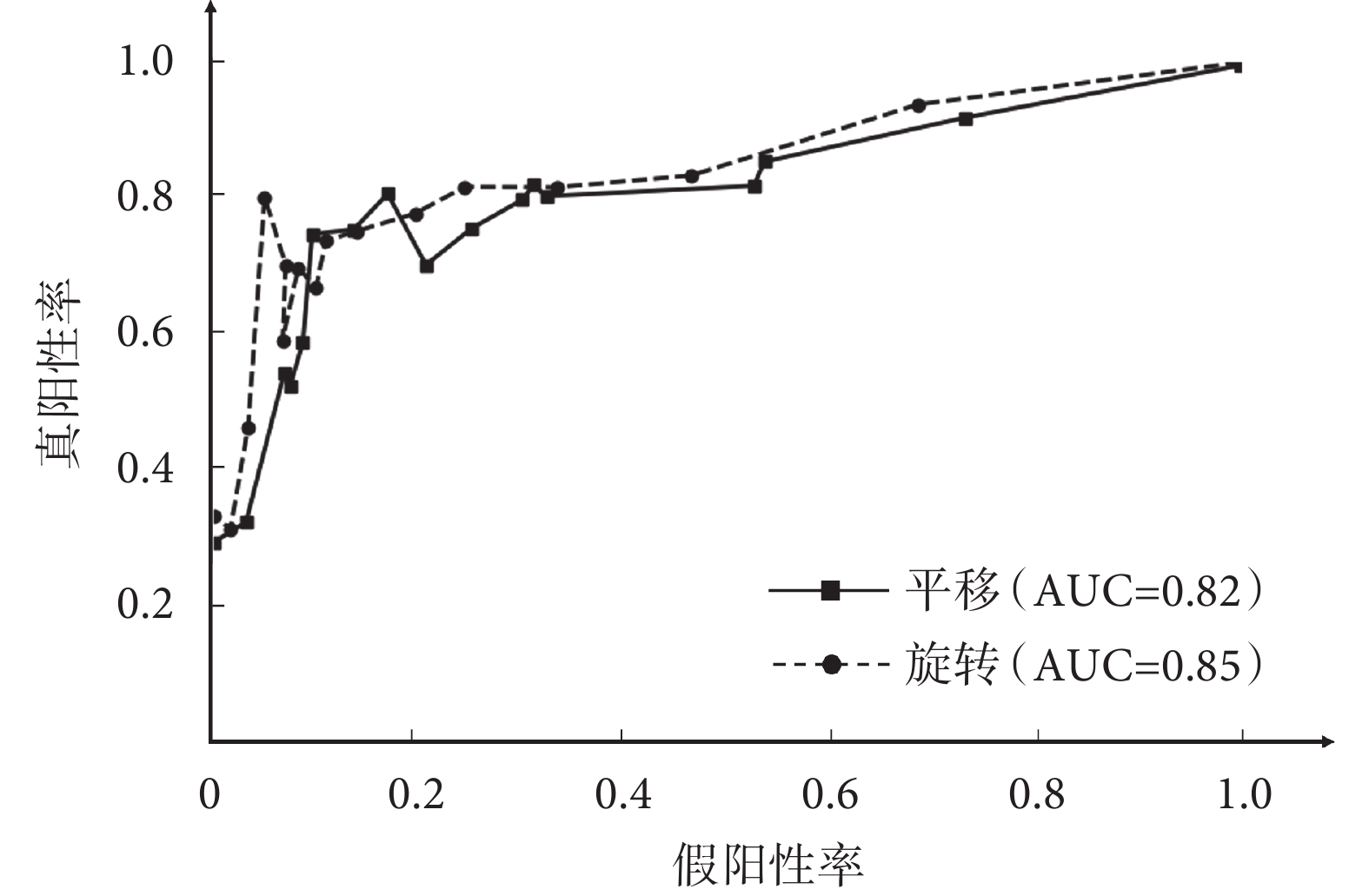
本文對采用均勻分布于系統測試誤差范圍的閾值進行ROC分析,對三個部位的整體擺位平移和旋轉結果如圖4所示,其中ROC曲線下區域面積 (area under curve,AUC) 值分別為0.82和0.85。
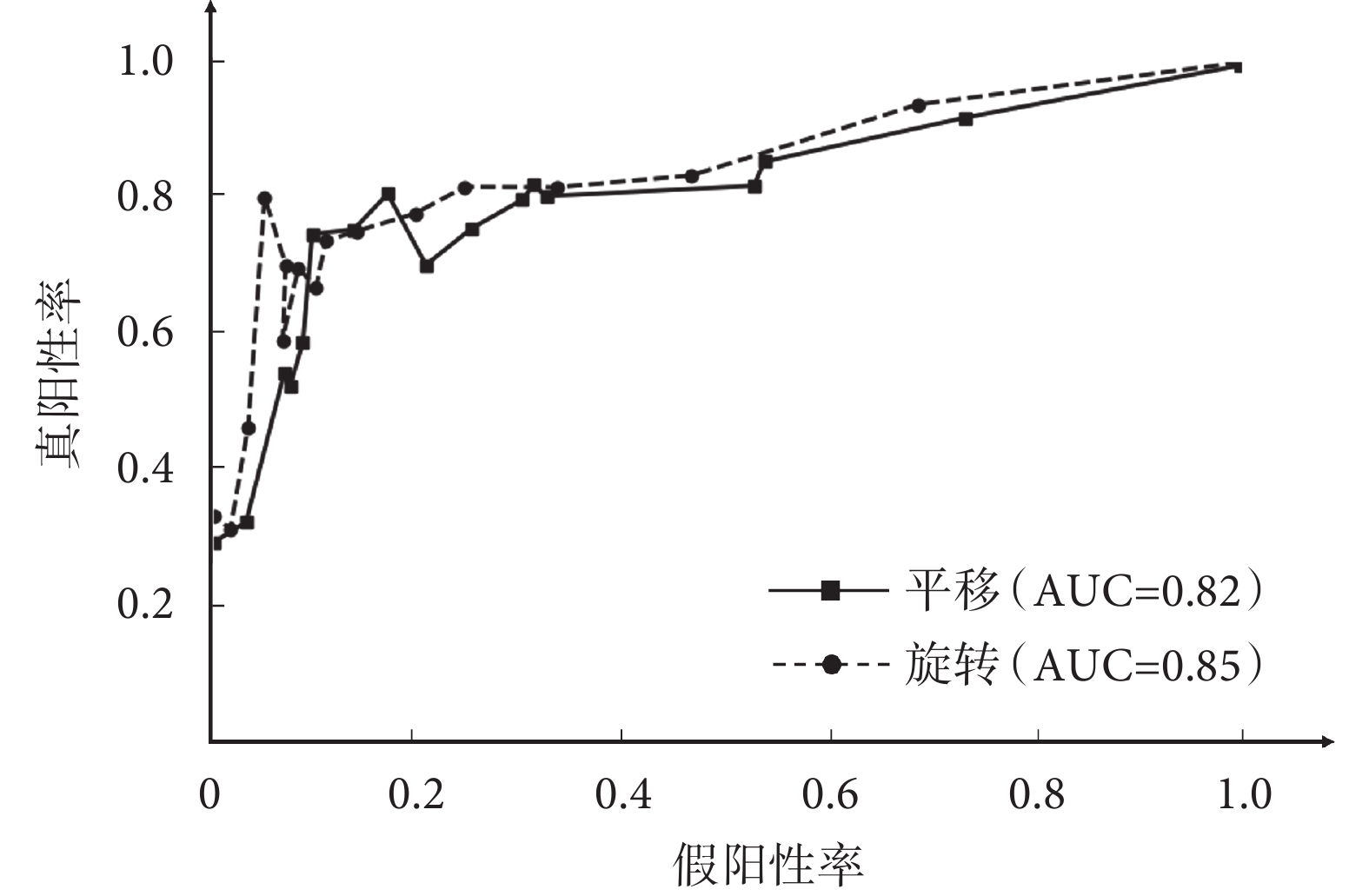 圖4
本系統對于模體放療擺位在平移和旋轉方向的ROC曲線
Figure4.
ROC curve of the system for phantom radiotherapy positioning in translation and rotation directions
圖4
本系統對于模體放療擺位在平移和旋轉方向的ROC曲線
Figure4.
ROC curve of the system for phantom radiotherapy positioning in translation and rotation directions
2.4 志愿者人體4自由度精度測試結果
本文基于志愿者人體的精度測試結果如表4所示,用于配準的志愿者人體頭頸部和胸腹部光學體表點云數量分別為1.19 × 105和1.94 × 105。與加速器治療床平移(旋轉)值的對比結果顯示,最大平移誤差為(2.6 ± 1.1)mm,出現在胸腹部擺位的Vrt方向,最小平移誤差為(1.4 ± 0.9)mm,出現在頭頸部擺位的Lng方向;在Rtn方向上,兩種部位的擺位誤差均小于1°;在所有方向上,頭頸部擺位誤差和胸腹部擺位誤差均有差異。
3 討論
3.1 傳統放療擺位技術的局限性
擺位精度是放療發揮解剖學優勢的先決條件。傳統基于皮膚標記和射線成像的擺位方式可提供精確位置引導和驗證,但其產生的額外非治療性劑量對計劃劑量分布的影響不可忽略,會增加對正常組織的損傷并提高繼發性癌癥的發生率。放療擺位中CBCT成像劑量已被諸多研究詳盡評估[16-18],在不同X射線球管電流/電壓參數設定下,成像劑量可達20~70 mGy不等;Murphy等[5]在美國醫學物理學家協會(American association of physicists in medicine,AAPM)75號報告中回顧分析了多種影像引導放射治療技術的額外劑量,并認為臨床醫生有義務在放療中評估影像劑量的副作用,作者基于國際放射防護委員會第60號出版物(Publication 60 of International Commission on Radiological Protection,ICRP-60)[19]中的參數對輻射誘發癌癥的概率進行估計,結果表明在30分次的宮頸癌放療中,室內CT產生的額外有效劑量為246 mSv并使得輻射誘發的風險癌癥提高1.2%。此外,傳統方法的固有局限性還體現在單時態成像無法實時提供分次內位置跟蹤和監測,以及易損體表標記對療程連續性的影響等。
3.2 新擺位技術的臨床應用
雖然傳統方式仍為最廣泛應用的擺位手段,但新的替代方案也已逐步開發以滿足放療的安全性和智能化發展趨勢。例如,磁共振成像(magnetic resonance imaging,MRI)引導放療是潛在手段之一,但受限于硬件耦合、磁場影響和設備成本等因素,影響該技術的普及[20]。而SGRT作為應用日益廣泛的臨床放療擺位技術,其無輻射、無標記引導的方式主要基于激光掃描、雙目立體視覺、結構光和ToF等光學成像原理。本文總結了現有文獻中前述幾種技術的商用系統評估或實驗測試結果,如表5所示。已有研究對基于雙目立體視覺和基于結構光的商業系統進行評估,研究表明它們在臨床擺位引導、實時監測和門控治療方面具有卓越性能,其準確度已達到臨床可接受的標準,且工作效率較傳統方法而言更高[21-24]。雙目立體視覺技術功耗和成本低,但其對光照變化敏感,對紋理單調或缺乏紋理的場景精度較低;而ToF傳感器作為發展較快的深度傳感設備,研究者們現已開展多項研究探索其應用于SGRT的可行性[9-11]。相比前述兩種技術,該技術在幀率方面優勢突出,且不需依托于硬件裝配的復雜參數設定,但其準確性和穩定性仍需進一步提高和測試。
3.3 本系統的臨床應用可行性
結構光成像技術的缺陷在于易受鏡面反射和極強光影響,但在放療場景中可完全規避,因此作為一種廣泛應用于醫療和工業領域的立體視覺技術,其在精度、幀率和抗環境光干擾等方面擁有優越的整體性能。本研究自主搭建基于結構光原理的放療患者擺位引導系統,并基于剛性成人模體和志愿者人體對其可行性進行評估。對于不同的擺位目標區域,兩臺傳感器共提供約1 × 105~2 × 105個光學空間幾何點用于身體表面定位和重建。本文基于剛性成人模體的測試結果表明,系統平移和旋轉的最大誤差值分別為(1.5 ± 0.9)mm和(0.7 ± 0.3)°,在臨床可接受范圍(≤ 2 mm/1°)之內;且不同部位在同一方向以及相同部位在不同方向的擺位誤差均存在差異,例如在Vrt方向,頭頸部、胸部和盆腔擺位誤差分別為(1.2 ± 0.8)mm,(1.5 ± 0.9)mm和(1.4 ± 0.8)mm;在頭頸部擺位測試中,Rtn、Pitch、Roll方向的擺位誤差分別為(0.2 ± 0.2)°,(0.7 ± 0.3)°和(0.4 ± 0.3)°。當前分析認為,影響點云提取、重建精度的因素至少包含以下幾個方面:一是不同體表區域表面曲率、重建面片數量及法向角度構成存在差異;二是表面面片缺失,例如頭頸部測試中頜骨周圍區域遮擋會造成的空間點缺失;三是傳感器相對于表面的距離,以及角度對曝光性能、光柵信號反饋和噪聲強度的影響。另外,在志愿者人體測試中,所有方向上頭頸部擺位誤差均小于胸腹部擺位誤差,對比差異明顯,初步判斷其可能與重復測試中患者每次呼氣末狀態體表幅度偏差有關;其他潛在因素以及各項因素的具體影響程度還需進一步測定。此外,剛性成人模體測試中,各方向整體Pearson相關系數不低于0.80,這反映了本開發系統測試和CBCT驗證結果之間的相關性,并且進一步證實了多自由度擺位誤差測試結果的有效性。ROC分析結果表明,本文所提系統可較好界定患者(模體)運動閾值,這表明結構光傳感器具備在放療分次內監測和門控的潛在效用,本課題組將在今后工作中進一步研發驗證相關功能。
3.4 本研究的不足與改進策略
本系統開發和測試工作仍存在多項待改進之處。其一,提升結構光傳感器的光學標定和姿態估計;由于標定板制造精度和像素檢測算法可能為多坐標系點云坐標變換引入亞毫米或毫米級偏差,故定制更為精密的標定板以及研究亞像素檢測算法可提高相關精度。其二,實現跨源點云配準;這在6自由度變換中是較難解決的不適定問題,下一步將考慮采用彈性配準方法來提高準確性,或嘗試基于深度學習的點云配準網絡架構[25-26]。其三,擴大測試評估范圍;本研究基于剛性成人模體和志愿者人體測試系統精度,由于志愿者人體為非腫瘤患者,暫未考慮對其進行射線類成像以避免造成劑量損傷。因此,下一步可嘗試提高系統的集成度和在機房內的裝配完整性,以在不影響患者治療的情況下進行患者人體測試,包括結合深吸氣屏氣(deep inspiration breath-hold,DIBH)、實時腫瘤追蹤(real-time tumor tracking,RTTT)等技術,以評估呼吸運動等對系統精度的影響。其四,完善內部解剖結構;建立皮膚表面和內部解剖結構之間的運動相關性是SGRT當前普遍面臨的挑戰之一,這限制了該技術在盆腔、消化道等深部位腫瘤的應用,故參照立體定位射波手術系統(Cyber knife,Accuray,美國)的定位追蹤原理,充分利用SGRT的實時表面成像優勢,引入低使用次數的間隔輻射成像設備,建立光學—輻射成像之間的關聯模型,可能提供解決方案。其五,減少結構光傳感器數量;現階段商業化SGRT系統一般采用3臺傳感器以保證體表點云采集完整性。但傳感器數量的減少,將導致有限視場角和有限點云規模,因此存在配準錯誤和效率降低的風險,具體體現在:一方面,需要對視場角區域外體表進行準確估計,以盡可能地排除患者局部區域異常變形所帶來的誤差;另一方面,傳感器三維位置和方向的選擇將變得困難,例如頭頸腫瘤、乳腺腫瘤、盆腔腫瘤和四肢腫瘤患者可能需要不同的成像區域。而本研究在確保全景點云覆蓋的前提下采用了2臺傳感器,這在一定程度上節約了成本,并節省了機房空間。在未來工作中,將進一步評估有限視場角對SGRT系統臨床應用可行性、系統精度和治療安全性的影響,以為單傳感器系統可行性提供依據。其六,完善信息管理和質量控制;Al-Hallaq等[27]認為SGRT在提高放療整體工作流的安全性、質量控制和提高工作效率等方面具備潛在效用但未被有效開發,未來工作中將借助增強/混合現實(augmented/mixed reality,AR/MR)技術優越的多維信息擴充和人機交互手段[28],或者集成人臉識別、射頻識別和生物特征識別等技術,探究SGRT在無紙化放療信息管理、器具核對、病例關聯和團隊協作等方面的作用。此外,放療擺位的最終配準對象是腫瘤,而在實際臨床應用中,無論是傳統激光十字和皮膚標記擺位還是SGRT,擺位對象都局限于體表。因此,必須承認SGRT雖然是對基于標記的擺位技術的迭代,但射線成像驗證仍是必要的。
重要聲明
利益沖突聲明:本文全體作者均聲明不存在利益沖突。
作者貢獻聲明:王云剛、張功森負責技術研發、實驗測試、數據分析和論文撰寫;王琳琳、朱健負責收集方案設計、技術指導及論文修訂審閱;閆先瑞、楊光杰、王尉參與具體研究和數據分析。
倫理聲明:本研究通過了山東第一醫科大學附屬腫瘤醫院倫理委員會的審批(批文編號:SDTHEC2021012052)。
0 引言
精準擺位,是放療實施的重要前提。研究表明,組織器官的形狀體積在放療分次內和分次間持續變化,對放療劑量分布和療效影響巨大[1-4]。近年來,立體定向、質子重離子等先進放療技術能使放療時的能量沉積更集中,這對患者擺位準確性和可重復性提出了更高的要求。傳統方法多使用激光十字和體表標記的方式實現擺位,并采用包括電子射野成像系統(electronic portal imaging device,EPID)和錐形束計算機斷層掃描(cone beam computed tomography,CBCT)等射線裝置進行位置驗證,例如:瓦里安加速器機載影像系統(on-board imager,OBI)(Varian Medical Systems Inc.,美國)和醫科達X射線容積成像系統(X-ray volumetric imaging,XVI)(Elakta Inc.,瑞典)等。常規手段在成像驗證過程會產生不可忽視的額外劑量,影響計劃劑量分布,并增加患者繼發癌癥風險[5];而且,還存在難以實現分次內連續監測、標記物易損等局限。放療光學體表追蹤與監測系統(Catalyst,C-RAD Inc.,瑞典)、表面引導放療系統(AlignRT,Vision RT Inc.,英國)等商業系統的應用表明了光學體表引導放療(surface guided radiation therapy,SGRT)在放療擺位中的臨床價值[6-8],但其產品軟、硬件嚴密封裝,核心技術被國外壟斷。另有多數文章公開了基于飛行時間法(time of flight, ToF)的光學擺位方法[9-11],但其精度和穩定性較為受限。本研究旨在突破國外技術壟斷壁壘,自主開發基于結構光體表成像的放療擺位方法和系統。同時,基于剛性成人模體和志愿者人體測試其精度,以期為光學體表擺位系統研究開發及其性能改進、流程優化和自主產業化提供參考。
1 資料與方法
1.1 光學硬件與參數設置
選用基于結構光傳感器(One+ Large,Zivid Inc.,挪威)獲取光學體表圖像,即獲取包括紅綠藍(red,green,blue,RGB)色彩模式和三維空間位置坐標的6通道點云數據。結構光傳感器在焦距1 800 mm的工作距離處,視場角(field of view,FoV)和空間分辨率分別為2 069 mm×1 310 mm和0.67 mm,深度方向上具有3.67×10-4 mm的出色分辨率,且6.5 ms的最短曝光時間(即幀率最大154 幀/s)可充分滿足患者擺位引導系統的實時性要求(以3~5 s的典型患者呼吸周期為例,系統幀率應大于等于4 幀/s)。為確保加速器機房環境下的點云質量,本研究在結構光傳感器標定和位姿估計過程中采取一組固定曝光參數,包括曝光時間、光圈、增益和投影亮度等。在模體和人體表面圖像采集中,綜合設定3組曝光參數以實現高動態范圍(high dynamic range,HDR)成像,如表1所示。同時,基于一系列濾波除噪算法實現點云預處理,包括采用信噪比(signal-to-noise-ratio,SNR)、濾波器(閾值設為0.7)、對比度失真和反射強度校正等圖像處理操作。此外,對局部區域內的像素進行高斯平滑(西格瑪值設為1.5)以抑制稀疏噪聲并將像素與網格對齊。放療擺位場景點云以結構光傳感器(One+ Large,Zivid Inc.,挪威)專用數據格式(.ZDF)存儲。
1.2 光學標定和傳感器位姿估計
為實現全景點云的融合和坐標變換,本研究對2臺結構光傳感器分別進行光學標定和位姿估計,其與等中心距離設定為150 cm,系統擺位場景設置、標定和位姿估計流程如圖1所示。選定邊長為30 mm的12 × 9氧化鋁棋盤格標定板 (checkerboard),基于張正友標定法[12]測量傳感器光學幾何模型參數。借助瓦里安加速器(Truebeam,Varian Medical Systems Inc.,美國)放療六維床,共采集27張不同角度、不同距離的標定圖像,并執行亞像素點檢測以提高標定精度。測量傳感器畸變參數和內參,以分別實現由光學組件制作及裝配引起的直線投影偏差校正和像素坐標Cpix到傳感器坐標系Ccam轉換,如式(1)~式(2)所示:
 圖1
基于結構光相傳感器擺位系統設置及標定和位姿估計流程
Figure1.
Structured light sensor-based positioning system setting and calibration-pose estimation process
圖1
基于結構光相傳感器擺位系統設置及標定和位姿估計流程
Figure1.
Structured light sensor-based positioning system setting and calibration-pose estimation process
 |
 |
其中,Disr(?)表示像素坐標的徑向畸變校正,k1、k2、k3是像素主點泰勒級數展開所得畸變參數,m表示p的二維分量平方和;Min表示傳感器內參矩陣;f和Zc分別表示焦距和光學中心到物體距離比例因子;x和y表示像素物理尺寸, 和
和 表示中心像素坐標。
表示中心像素坐標。
以基于科爾多瓦大學增強現實(augmented reality university of cordoba,ArUco)的二進制標記碼測量包括旋轉和平移變換關系的傳感器外參,實現點云從Ccam到以等中心為原點的加速器機械坐標系Cacc空間轉換,如式(3)~式(4)所示:
 |
 |
其中,Mex為傳感器外參矩陣,Rxyz和Txyz分別為空間旋轉和平移矩陣,Xacc、Yacc和Zacc為光學源點云PCS在加速器機械坐標系Cacc中的坐標分量。本研究標定和位姿估計基于計算機視覺和機器學習軟件庫擴展模塊OpenCV-contrib(4.6.0,OpenCV,美國)和編程語言Python3.8(Centrum Wiskunde & Informatica,荷蘭)實現。事實上,作為傳感器固有屬性的內參和畸變參數只需測量一次,外參也僅在傳感器固定位置改變時需要測量,因此在臨床應用中,上述操作對所開發系統的效率并無影響。
1.3 體表點云配準
基于跨源體表點云配準獲取6自由度(degrees of freedom,DoF)移床值以引導放療擺位,配準對象包括源點云PCS和目標點云PCT。其中,源點云為基于結構光傳感器實時獲取并經圖像處理的光學體表點云;關于目標點云,首先基于西門子大孔徑模擬定位機 (SOMATOM confidence,Siemens Healthineers LLC.,德國)獲取剛性成人模體定位X射線電子計算機斷層掃描(computed tomography,CT)圖像,像素間距s和切片厚度t分別設置為0.976 6 mm和1 mm,物理師通過放療計劃系統(Eclipse,Varian Medical Systems Inc.,美國)勾畫身體輪廓并與CT圖像共同導出為醫學數字成像和通信(Digital imaging and communications in medicine,DICOM)格式結構化文件;對定位CT取二值掩膜并獲得表面體素索引集IDCT,并實施CT影像坐標系CCT與加速器機械坐標Cacc的變換以得到PCT,如式(5)所示:
 |
其中,TCT-acc表示CCT和Cacc之間的坐標變換矩陣。
臨床放療主要考慮感興趣區域(regions of interest,ROI)范圍內患者定位和劑量傳輸的準確性。體表區域限定將減少由全身表面配準帶來的額外誤差,例如胸部放療的肢體偏移,或腹部運動對頭部放療的影響,同時點云數量的減少也顯著提高跨源配準的效率。如表2所示,配準實施前,分別在前后(anterior-posterior,A-P)和上下(superior-inferior,S-I)方向,對PCS和PCT在頭頸部、胸部和盆腔三個部分定義了ROI,而在左右(left-right,L-R)方向,選取全范圍體表點云。
基于半徑濾波(radius-filter,rf)法去除點云異常值,其中相鄰點的半徑和點云數量閾值分別設置為3 mm和60,并進行3 mm網格下采樣。使用全局—局部的剛性方法來平衡配準速度和準確性,結合快速點特征直方圖(fast point feature histogram,FPFH)特征描述子[13],基于隨機抽樣一致(random sample consensus,RANSAC)實現對跨源體表點云PCS和PCT之間的全局配準,為局部優化提供初始變換矩陣并提高配準效率;局部優化基于點到面的迭代最近點(iterative closest point,ICP)算法[14-15]實現,其相比常規ICP算法更容易收斂。為計算點云配準相關空間平移矩陣RT和旋轉矩陣RR,該算法迭代優化跨源點云最近點匹配和變換估計步驟,直到目標函數達到預設閾值,如式(6)所示:
 |
其中,DS-T表示跨源點云平方距離,N是點的數量,nT表示目標點處的法向量。在Cacc中對于RT進行維度交換并獲得在垂直(Vrt)、進出(Lng)和左右(Lat)方向的三維平移床值,同時將矩陣RR轉換為歐拉角并獲得在冠狀位轉動(Rtn)、俯仰(Pitch)和橫滾(Roll)方向的三維旋轉床值,并最終得到6自由度的擺位校正床值。
1.4 系統精度評估
本研究分別基于剛性成人模體ATOM phantom和志愿者作為受試對象,在直線加速器機房中測試和評估所提出系統的可行性。
在剛性成人模體測試中,首先將剛性成人模體置于加速器治療床,基于所開發系統獲取6自由度擺位校正床值;其次,獲取模體CBCT圖像,并與定位CT圖像進行骨性配準,將配準結果作為量化擺位偏差的金標準。上述擺位過程對基于預設ROI實現分割的模體頭頸部、胸部和盆腔各重復20次。本文采取多項評價指標對系統精度進行綜合評估:① 采用兩組床值之間差異的絕對值量化系統精度;② 計算兩組床值之間的皮爾遜(Pearson)相關系數r;③ 采用受試者操作特征(receiver operating characteristic,ROC)分析方法,對系統在界定患者運動是否超出閾值方面的能力進行評估,其中所選閾值均勻分布于系統測試誤差范圍。
在志愿者測試中,本項工作共招募了4名志愿者,年齡在25~32歲,其中男性、女性各2位,所有志愿者均采取仰臥體位,擺位狀態均選用“呼氣末”。為便于實施,擺位部位分為頭頸部和胸腹部,且在4自由度(Vrt、Lng、Lat和Rtn)開展試驗。試驗設計及過程已通過山東第一醫科大學附屬腫瘤醫院倫理委員會批準(編號:SDTHEC2021012052),試驗前遵從受試者自愿參與的原則,對受試者及其家人詳細描述了試驗流程。本次研究采用體外測試,所采集數據僅用于科研研究,不作為診斷和治療依據,對受試者沒有風險,根據國家規定和赫爾辛基宣言的倫理學準則,經倫理委員會審查和批準后免于受試者的知情同意。試驗過程中,首先,采集初始位置體表點云作為參考點云;其次,以1 mm(或1°)為步長在1~6 mm(或1~6 °)范圍內平移(或旋轉)治療床,每個方向分別重復12次。采用系統的輸出結果與實際執行的平移(或旋轉)床值之間差異的絕對值量化系統精度。基于志愿者的測試分別在頭頸部和胸腹部進行。
2 結果
2.1 模體測試6自由度擺位結果
本文所提系統針對各部位的光學體表點云融合效果,及其與三維重建CT的跨源點云配準效果如圖2所示。其中,紅色/深藍色為不同結構光傳感器采集的光學體表點云融合效果,而黃色/淺藍色分別為結構光傳感器和重建CT的跨源點云配準。在共計60次擺位測試中,用于配準的頭頸部、胸部和盆腔的光學體表點云數量平均值分別為1.1 × 105、1.7 × 105和1.3 × 105。以CBCT為金標準的系統擺位測試誤差如表3所示,其中最大平移誤差為(1.5 ± 0.9) mm,出現在胸部擺位的Vrt方向;最大旋轉誤差為(0.7 ± 0.3)°,出現在頭頸部擺位的Pitch方向;最小平移誤差分別為(0.7 ± 0.5) mm,出現在頭頸部擺位的Lng方向,最小旋轉誤差為(0.2 ± 0.2)°,出現在頭頸部擺位的Rtn方向。總體上,所提出系統在Lat、Vrt和Lng方向的擺位平移誤差分別為(1.0 ± 0.7)mm、(1.4 ± 0.9)mm和(0.8 ± 0.6)mm;在Rtn、Pitch和Roll方向的擺位旋轉誤差分別為(0.2 ± 0.1)°、(0.6 ± 0.3)°和(0.4 ± 0.3)°。
 圖2
模體擺位系統測試中光學體表點云融合及其與重建CT點云配準效果
Figure2.
Optical surface point cloud fusion and registration with reconstructed CT point cloud in phantom-based system test
圖2
模體擺位系統測試中光學體表點云融合及其與重建CT點云配準效果
Figure2.
Optical surface point cloud fusion and registration with reconstructed CT point cloud in phantom-based system test
2.2 模體測試Pearson相關性分析結果
本文對于頭頸部、胸部和盆腔的總體擺位系統測試結果顯示,在各平移和旋轉方向上的Pearson相關系數r分布在 [0.80, 0.84] 的區間內。平移方向上,r值分別為0.80(Vrt方向)、0.83(Lng方向)和0.82(Lat方向);旋轉方向上,r值分別為0.84(Rtn方向)、0.80(Pitch方向)和0.81(Roll方向)。誤差分布及其與CBCT驗證結果的相關性分析如圖3所示。
 圖3
系統測試6自由度整體擺位誤差與CBCT驗證誤差分布和相關性分析
Figure3.
Distribution and correlation analysis of the system positioning errors and CBCT verification errors in 6 degrees of freedom
圖3
系統測試6自由度整體擺位誤差與CBCT驗證誤差分布和相關性分析
Figure3.
Distribution and correlation analysis of the system positioning errors and CBCT verification errors in 6 degrees of freedom
2.3 模體測試ROC分析結果
本文對采用均勻分布于系統測試誤差范圍的閾值進行ROC分析,對三個部位的整體擺位平移和旋轉結果如圖4所示,其中ROC曲線下區域面積 (area under curve,AUC) 值分別為0.82和0.85。
 圖4
本系統對于模體放療擺位在平移和旋轉方向的ROC曲線
Figure4.
ROC curve of the system for phantom radiotherapy positioning in translation and rotation directions
圖4
本系統對于模體放療擺位在平移和旋轉方向的ROC曲線
Figure4.
ROC curve of the system for phantom radiotherapy positioning in translation and rotation directions
2.4 志愿者人體4自由度精度測試結果
本文基于志愿者人體的精度測試結果如表4所示,用于配準的志愿者人體頭頸部和胸腹部光學體表點云數量分別為1.19 × 105和1.94 × 105。與加速器治療床平移(旋轉)值的對比結果顯示,最大平移誤差為(2.6 ± 1.1)mm,出現在胸腹部擺位的Vrt方向,最小平移誤差為(1.4 ± 0.9)mm,出現在頭頸部擺位的Lng方向;在Rtn方向上,兩種部位的擺位誤差均小于1°;在所有方向上,頭頸部擺位誤差和胸腹部擺位誤差均有差異。
3 討論
3.1 傳統放療擺位技術的局限性
擺位精度是放療發揮解剖學優勢的先決條件。傳統基于皮膚標記和射線成像的擺位方式可提供精確位置引導和驗證,但其產生的額外非治療性劑量對計劃劑量分布的影響不可忽略,會增加對正常組織的損傷并提高繼發性癌癥的發生率。放療擺位中CBCT成像劑量已被諸多研究詳盡評估[16-18],在不同X射線球管電流/電壓參數設定下,成像劑量可達20~70 mGy不等;Murphy等[5]在美國醫學物理學家協會(American association of physicists in medicine,AAPM)75號報告中回顧分析了多種影像引導放射治療技術的額外劑量,并認為臨床醫生有義務在放療中評估影像劑量的副作用,作者基于國際放射防護委員會第60號出版物(Publication 60 of International Commission on Radiological Protection,ICRP-60)[19]中的參數對輻射誘發癌癥的概率進行估計,結果表明在30分次的宮頸癌放療中,室內CT產生的額外有效劑量為246 mSv并使得輻射誘發的風險癌癥提高1.2%。此外,傳統方法的固有局限性還體現在單時態成像無法實時提供分次內位置跟蹤和監測,以及易損體表標記對療程連續性的影響等。
3.2 新擺位技術的臨床應用
雖然傳統方式仍為最廣泛應用的擺位手段,但新的替代方案也已逐步開發以滿足放療的安全性和智能化發展趨勢。例如,磁共振成像(magnetic resonance imaging,MRI)引導放療是潛在手段之一,但受限于硬件耦合、磁場影響和設備成本等因素,影響該技術的普及[20]。而SGRT作為應用日益廣泛的臨床放療擺位技術,其無輻射、無標記引導的方式主要基于激光掃描、雙目立體視覺、結構光和ToF等光學成像原理。本文總結了現有文獻中前述幾種技術的商用系統評估或實驗測試結果,如表5所示。已有研究對基于雙目立體視覺和基于結構光的商業系統進行評估,研究表明它們在臨床擺位引導、實時監測和門控治療方面具有卓越性能,其準確度已達到臨床可接受的標準,且工作效率較傳統方法而言更高[21-24]。雙目立體視覺技術功耗和成本低,但其對光照變化敏感,對紋理單調或缺乏紋理的場景精度較低;而ToF傳感器作為發展較快的深度傳感設備,研究者們現已開展多項研究探索其應用于SGRT的可行性[9-11]。相比前述兩種技術,該技術在幀率方面優勢突出,且不需依托于硬件裝配的復雜參數設定,但其準確性和穩定性仍需進一步提高和測試。
3.3 本系統的臨床應用可行性
結構光成像技術的缺陷在于易受鏡面反射和極強光影響,但在放療場景中可完全規避,因此作為一種廣泛應用于醫療和工業領域的立體視覺技術,其在精度、幀率和抗環境光干擾等方面擁有優越的整體性能。本研究自主搭建基于結構光原理的放療患者擺位引導系統,并基于剛性成人模體和志愿者人體對其可行性進行評估。對于不同的擺位目標區域,兩臺傳感器共提供約1 × 105~2 × 105個光學空間幾何點用于身體表面定位和重建。本文基于剛性成人模體的測試結果表明,系統平移和旋轉的最大誤差值分別為(1.5 ± 0.9)mm和(0.7 ± 0.3)°,在臨床可接受范圍(≤ 2 mm/1°)之內;且不同部位在同一方向以及相同部位在不同方向的擺位誤差均存在差異,例如在Vrt方向,頭頸部、胸部和盆腔擺位誤差分別為(1.2 ± 0.8)mm,(1.5 ± 0.9)mm和(1.4 ± 0.8)mm;在頭頸部擺位測試中,Rtn、Pitch、Roll方向的擺位誤差分別為(0.2 ± 0.2)°,(0.7 ± 0.3)°和(0.4 ± 0.3)°。當前分析認為,影響點云提取、重建精度的因素至少包含以下幾個方面:一是不同體表區域表面曲率、重建面片數量及法向角度構成存在差異;二是表面面片缺失,例如頭頸部測試中頜骨周圍區域遮擋會造成的空間點缺失;三是傳感器相對于表面的距離,以及角度對曝光性能、光柵信號反饋和噪聲強度的影響。另外,在志愿者人體測試中,所有方向上頭頸部擺位誤差均小于胸腹部擺位誤差,對比差異明顯,初步判斷其可能與重復測試中患者每次呼氣末狀態體表幅度偏差有關;其他潛在因素以及各項因素的具體影響程度還需進一步測定。此外,剛性成人模體測試中,各方向整體Pearson相關系數不低于0.80,這反映了本開發系統測試和CBCT驗證結果之間的相關性,并且進一步證實了多自由度擺位誤差測試結果的有效性。ROC分析結果表明,本文所提系統可較好界定患者(模體)運動閾值,這表明結構光傳感器具備在放療分次內監測和門控的潛在效用,本課題組將在今后工作中進一步研發驗證相關功能。
3.4 本研究的不足與改進策略
本系統開發和測試工作仍存在多項待改進之處。其一,提升結構光傳感器的光學標定和姿態估計;由于標定板制造精度和像素檢測算法可能為多坐標系點云坐標變換引入亞毫米或毫米級偏差,故定制更為精密的標定板以及研究亞像素檢測算法可提高相關精度。其二,實現跨源點云配準;這在6自由度變換中是較難解決的不適定問題,下一步將考慮采用彈性配準方法來提高準確性,或嘗試基于深度學習的點云配準網絡架構[25-26]。其三,擴大測試評估范圍;本研究基于剛性成人模體和志愿者人體測試系統精度,由于志愿者人體為非腫瘤患者,暫未考慮對其進行射線類成像以避免造成劑量損傷。因此,下一步可嘗試提高系統的集成度和在機房內的裝配完整性,以在不影響患者治療的情況下進行患者人體測試,包括結合深吸氣屏氣(deep inspiration breath-hold,DIBH)、實時腫瘤追蹤(real-time tumor tracking,RTTT)等技術,以評估呼吸運動等對系統精度的影響。其四,完善內部解剖結構;建立皮膚表面和內部解剖結構之間的運動相關性是SGRT當前普遍面臨的挑戰之一,這限制了該技術在盆腔、消化道等深部位腫瘤的應用,故參照立體定位射波手術系統(Cyber knife,Accuray,美國)的定位追蹤原理,充分利用SGRT的實時表面成像優勢,引入低使用次數的間隔輻射成像設備,建立光學—輻射成像之間的關聯模型,可能提供解決方案。其五,減少結構光傳感器數量;現階段商業化SGRT系統一般采用3臺傳感器以保證體表點云采集完整性。但傳感器數量的減少,將導致有限視場角和有限點云規模,因此存在配準錯誤和效率降低的風險,具體體現在:一方面,需要對視場角區域外體表進行準確估計,以盡可能地排除患者局部區域異常變形所帶來的誤差;另一方面,傳感器三維位置和方向的選擇將變得困難,例如頭頸腫瘤、乳腺腫瘤、盆腔腫瘤和四肢腫瘤患者可能需要不同的成像區域。而本研究在確保全景點云覆蓋的前提下采用了2臺傳感器,這在一定程度上節約了成本,并節省了機房空間。在未來工作中,將進一步評估有限視場角對SGRT系統臨床應用可行性、系統精度和治療安全性的影響,以為單傳感器系統可行性提供依據。其六,完善信息管理和質量控制;Al-Hallaq等[27]認為SGRT在提高放療整體工作流的安全性、質量控制和提高工作效率等方面具備潛在效用但未被有效開發,未來工作中將借助增強/混合現實(augmented/mixed reality,AR/MR)技術優越的多維信息擴充和人機交互手段[28],或者集成人臉識別、射頻識別和生物特征識別等技術,探究SGRT在無紙化放療信息管理、器具核對、病例關聯和團隊協作等方面的作用。此外,放療擺位的最終配準對象是腫瘤,而在實際臨床應用中,無論是傳統激光十字和皮膚標記擺位還是SGRT,擺位對象都局限于體表。因此,必須承認SGRT雖然是對基于標記的擺位技術的迭代,但射線成像驗證仍是必要的。
重要聲明
利益沖突聲明:本文全體作者均聲明不存在利益沖突。
作者貢獻聲明:王云剛、張功森負責技術研發、實驗測試、數據分析和論文撰寫;王琳琳、朱健負責收集方案設計、技術指導及論文修訂審閱;閆先瑞、楊光杰、王尉參與具體研究和數據分析。
倫理聲明:本研究通過了山東第一醫科大學附屬腫瘤醫院倫理委員會的審批(批文編號:SDTHEC2021012052)。