微針是一種具有廣闊發展前景的新型局部給藥系統,因具有能夠迅速穿透組織屏障、實現局部定點和靶向給藥等優點,其應用也逐步擴展到非透皮的給藥領域,可以為組織或器官的疾病或損傷提供快速、有效的治療手段。經過文獻檢索發現醫用高分子微針在非透皮給藥的最新應用進展還缺乏歸納和總結,本文首先闡述了相關微針的制備材料及制造技術,接著對微針在非透皮給藥領域中的典型應用進行了綜述,主要涉及口腔、眼部、血管和心臟等組織或器官疾病的治療及修復,最后總結現階段微針在非透皮給藥中存在的問題,對其發展進行了展望,以供相關領域的研究者借鑒與參考。
引用本文: 李海艷, 韓宏娟, 王璐, 姚婧芝, 肖文謙, 李波. 醫用高分子微針在非透皮局部給藥中的研究進展. 生物醫學工程學雜志, 2024, 41(2): 406-412, 420. doi: 10.7507/1001-5515.202307038 復制
版權信息: ?四川大學華西醫院華西期刊社《生物醫學工程學雜志》版權所有,未經授權不得轉載、改編
0 引言
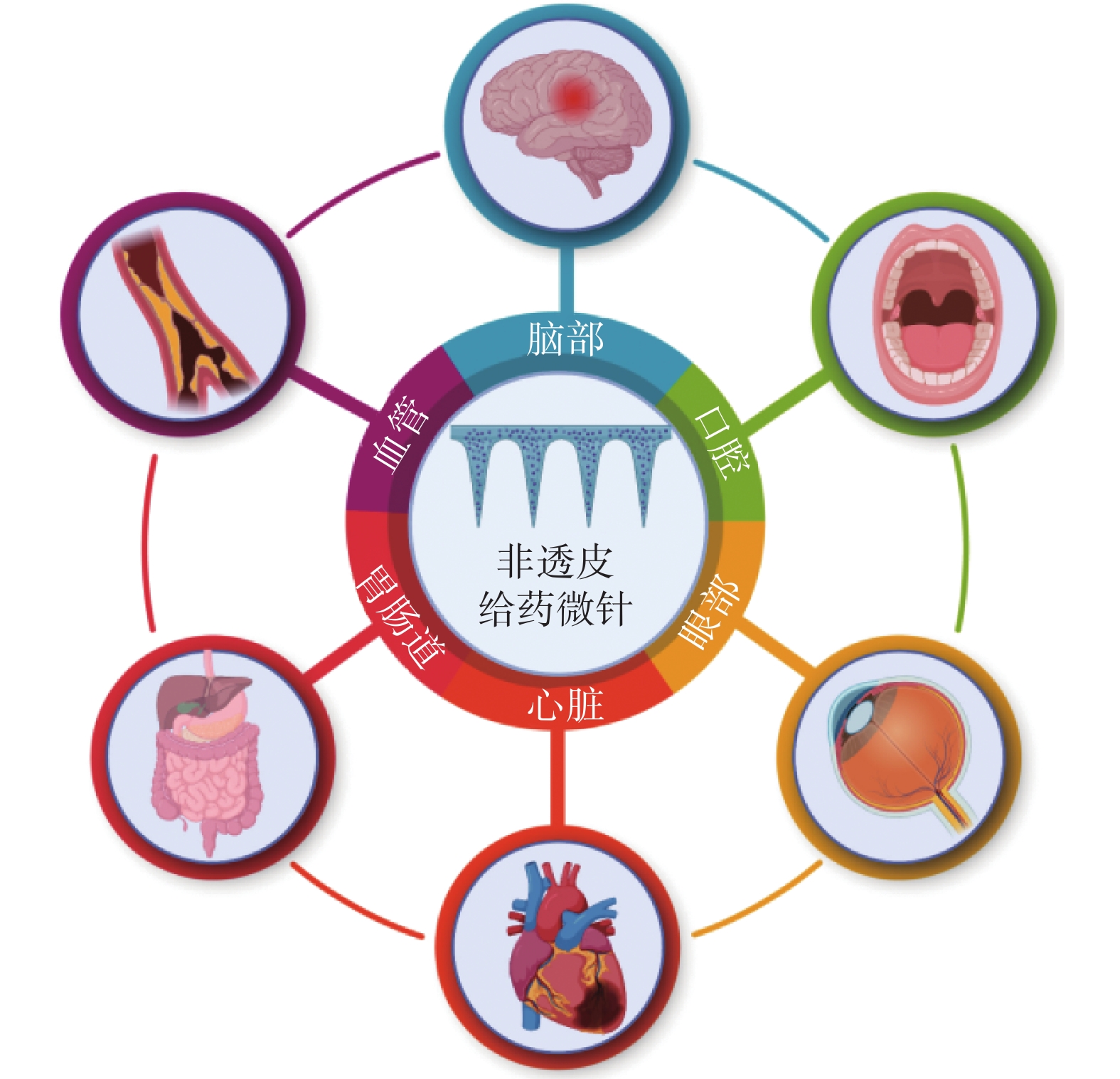
微針(microneedles,MN)是一種由微加工技術制造得到的微小的針狀裝置,是一種潛力巨大的經皮給藥工具。它能快速穿透表皮層,形成藥物通過的孔道,將藥物輸送至真皮層或皮下,同時又避免與毛細血管和神經接觸,具有藥物輸送效率高、操作簡便、患者依從性高等多重優勢[1-2]。除此之外,由于微針結構具有很強的穿透力,能微創地穿透多種組織屏障,使藥物直達病灶,避免肝臟首過效應,可大幅度提高藥物的生物利用度;此外微針還能裝載多種藥物,例如大小分子、核酸、納米顆粒、細胞外囊泡以及治療細胞等,為相關疾病的治療開發出多樣化的方法[3]。近年來,微針的應用范圍也逐步擴大到非透皮局部給藥治療領域(見圖1),展現出廣闊的應用前景和價值[4-5]。
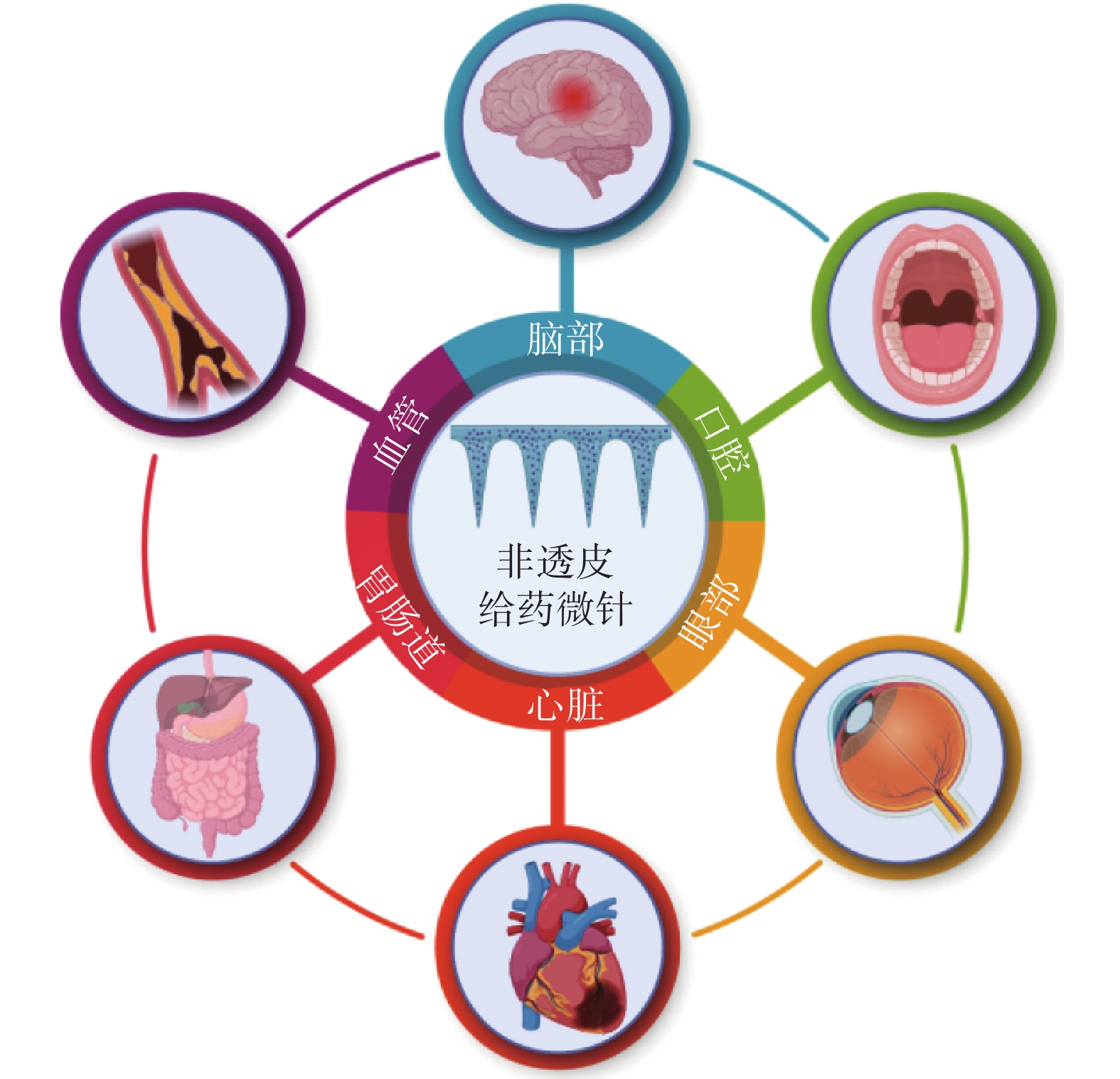 圖1
微針在非透皮局部給藥中的應用
Figure1.
Application of microneedles for non-transdermal local administration
圖1
微針在非透皮局部給藥中的應用
Figure1.
Application of microneedles for non-transdermal local administration
1 非透皮給藥微針的材料及制造工藝
隨著材料學及制造技術的進步,已有多種材料被用來制備微針。硅是最早被用作制造微針的材料,但存在制造成本高、質地脆易造成組織殘留形成肉芽腫等缺點。一些金屬材料,如不銹鋼、鈦、鈀和鈀鈷合金等,也普遍存在藥物載量較低、不能降解等問題[6]。與傳統經皮給藥不同,大多非透皮給藥微針需要在體內植入,制備材料應具有優良的生物相容性、生物可降解性、適宜的力學強度及可黏附性等特點。除了滿足以上特點外,聚合物還具有制造成本低、藥物載量高以及能實現智能藥物輸送等優點,是非透皮給藥微針制備的首選材料[7]。常用的聚合物主要包括人工合成高分子如聚乙烯醇(polyvinyl alcohol,PVA)、聚乙烯吡咯烷酮(polyvinyl pyrrolidone,PVP)、聚乳酸(polylactic acid,PLA)、聚己內酯(poly(ε-caprolactone),PCL)、聚乙二醇雙丙烯酸酯(poly(ethylene glycol) diacrylate,PEGDA)以及聚乳酸-羥基乙酸共聚物(poly(lactic-co-glycolic acid),PLGA)等以及多糖、蛋白質等天然高分子,例如明膠、透明質酸(hyaluronic acid,HA)以及絲素蛋白(silk fibroin,SF)等[8-9]。
為適應大規模、個性化制造的需要,大量微針制造方法不斷被開發出來[10]。當前應用最廣泛的當屬微模塑法,微模塑工藝過程由母版制作、陰模制作、預聚物填充、聚合成型及脫模分離五個步驟組成[11]。該方法操作簡便,重復性高,還能實現具有復雜釋放動力學和復雜結構的微針制備。微模塑法的一個主要問題是模具填充不足,由于表面張力在微尺度水平上占主要作用,使得預聚物溶液在微模腔中的填充不足,可通過真空、離心和旋涂等辦法來促進溶液的填充。此外,微模塑法還存在制造方法不靈活、藥物浪費嚴重和脫模時易破壞結構等缺點。近年來,許多非模具制造技術亦被應用于微針的制造,例如拉延光刻法、激光加工法、三維打印等[12],這些特種加工技術擺脫了對模具的依賴,因其特有的靈活性和便捷性而備受關注[13]。
2 微針的非透皮給藥應用
隨著微針技術在生物醫學領域中的關注度逐漸提升,其應用范圍也從傳統的經皮給藥擴展到組織或器官的非透皮局部給藥,尤其在口腔、眼科、血管、心臟、顱內以及胃腸道等領域的應用非常突出[14],本文將重點綜述高分子微針在非透皮給藥方面的最新應用研究進展(見表1),并就存在的問題和未來的發展方向進行總結及展望。
2.1 口腔給藥
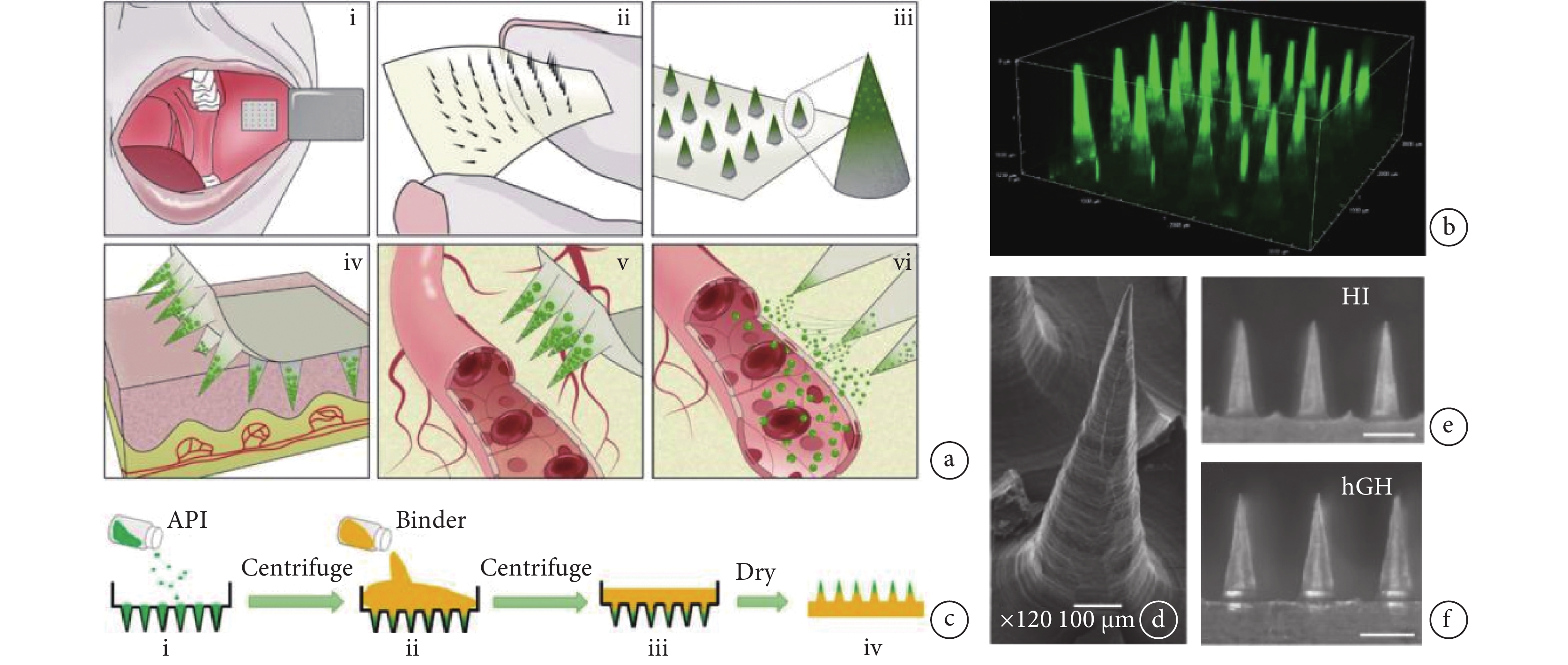
口腔黏膜給藥是一種新型的全身給藥方式[15]。口腔黏膜給藥有效避免了胃腸道降解和首過代謝的問題,但唾液的沖刷效應和酶降解等因素常影響其療效。微針可突破口腔黏膜上皮層屏障從而提升藥物的生物利用度,還能通過材料和結構的優化設計增強對組織的黏附。Caffarel-Salvador等[16]制備出一種可用于口腔頰黏膜給藥的微針貼片,用以遞送胰島素等藥物,該微針的藥物載量高,藥物起效快、使用方便,受試者的痛感反饋表明能有效提升特殊人群用藥的依從性(見圖2)。口腔黏膜給藥的一個突出問題是制劑在濕潤表面上的黏附不牢,Zhu等[17]受到藍環章魚觸手的啟發,采用SF、普朗尼克F127(pluronic F127,PF127)和聚(N-異丙基丙烯酰胺)(poly(N-isopropyl acrylamide),PNIPAm)開發了一種在濕潤環境中實現可控局部給藥的微針貼片,其表面的仿生柔性吸盤賦予微針穩定的黏附力以保證長時間作用于濕潤環境中,并能穿透組織表面的黏液層或屏障,感應體溫實現主動注射,實現藥物的局部按需釋放。
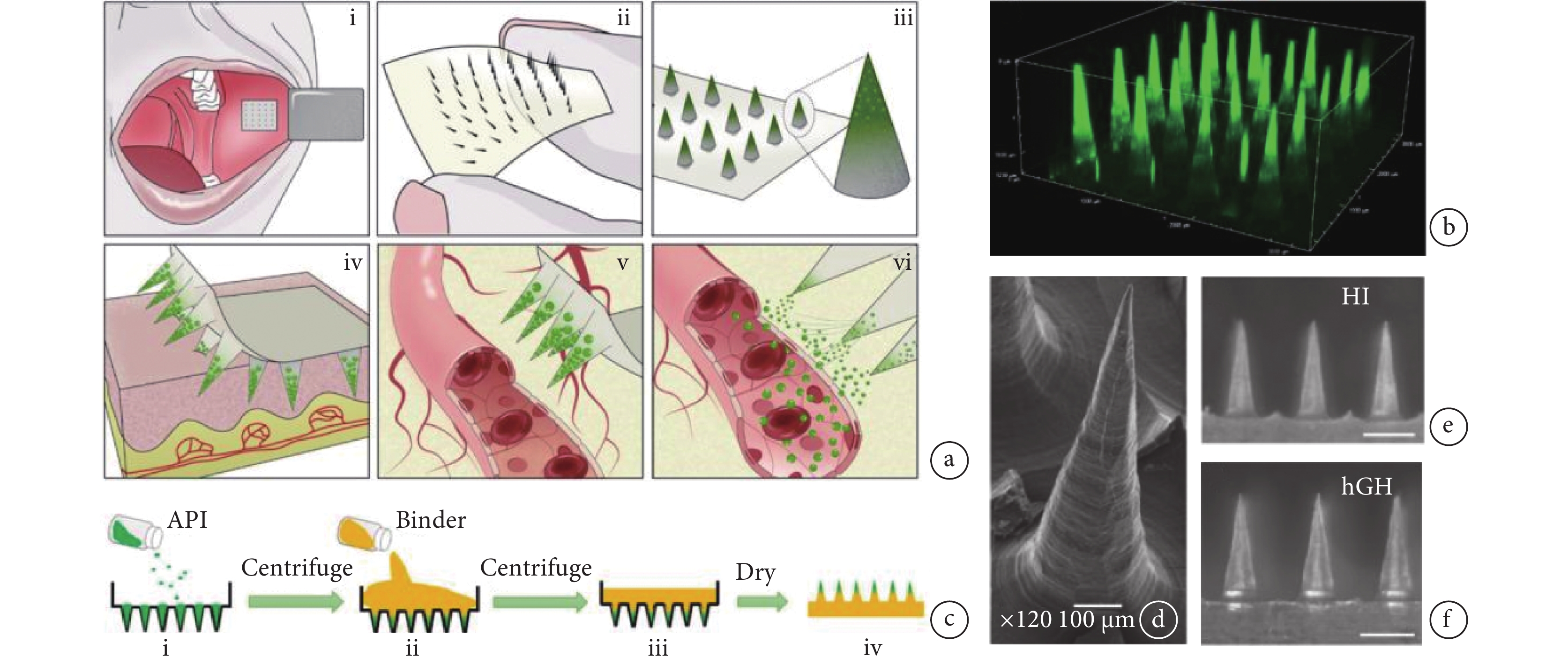 圖2
一種口腔黏膜給藥微針貼片的示意圖及應用
圖2
一種口腔黏膜給藥微針貼片的示意圖及應用
a. 微針貼片的應用示意圖;b. 微針的激光共聚焦顯微鏡照片;c. 微針的制備流程示意圖;d. 微針的掃描電鏡圖像;裝載有胰島素的微針(e)和裝載有人生長激素微針(f)的光學顯微鏡照片[16]
Figure2. Schematic diagram and application of Buccal microneedle patcha. schematic diagram for the application of the microneedle patches; b. confocal image of the microneedle patches; c. illustration of the process of preparing microneedle patches; d. SEM image of the microneedle patches; optical microscope images of the microneedle patches loaded with human insulin (e) and human growth hormone (f). Reprinted with permission from ref.[16] (Caffarel-Salvador et al. 2021). Copyright 2021 American Association for the Advancement of Science
除此之外,微針也可應用于牙科領域。牙周炎是一種造成牙周組織持續性損傷的炎癥性疾病,由于受損的牙周組織無法進行自我修復,亟需開發先進的再生療法來恢復其結構和功能[18]。Zhang等[19]開發了一種模塊化微針,通過對口腔免疫的調節來實現牙周組織的再生。該微針由能夠迅速釋放四環素的黏性底座以及甲基丙烯酸酐改性明膠(gelatin methacryloyl,GelMA)的凝膠針尖組成,針尖則裝載了負載四環素PLGA納米顆粒和負載細胞因子白細胞介素4(interleukin-4,IL-4)與轉化生長因子β(transforming growth factor β,TGF-β)的二氧化硅微米顆粒。當植入牙齦時,微針底座能迅速釋放抗生素,針尖則可實現抗生素、細胞因子的持續釋放,發揮抑制細菌生長、誘導抗炎巨噬細胞的復極化和調節性T細胞生成的作用,同時促進了牙周細胞的成骨活性和膠原基質合成。其次,微針也可用于牙科麻醉劑的遞送,Seeni等[20]采用生物相容導電聚合物聚(3,4-乙烯基二氧噻吩)∶聚(苯乙烯磺酸鹽)(PEDOT∶PSS)和HA制備了一種微針貼片,能與離子電滲技術相結合,協助麻醉劑利多卡因迅速滲入口腔黏膜及下層骨組織,避免注射給藥產生的不適,達到快速局部麻醉的效果。
當前微針在口腔給藥的研究中還存在以下不足:一是微針的療效會極大地受到口腔唾液流動因素的影響,需要建立準確的體外滲透模型,模擬唾液流速和液膜厚度,以便更好地預測體內藥代動力學;二是口腔黏膜中存在大量微生物,通過受損的黏膜給藥易增加全身感染的風險,需進一步評估口腔給藥微針的安全性。
2.2 血管給藥
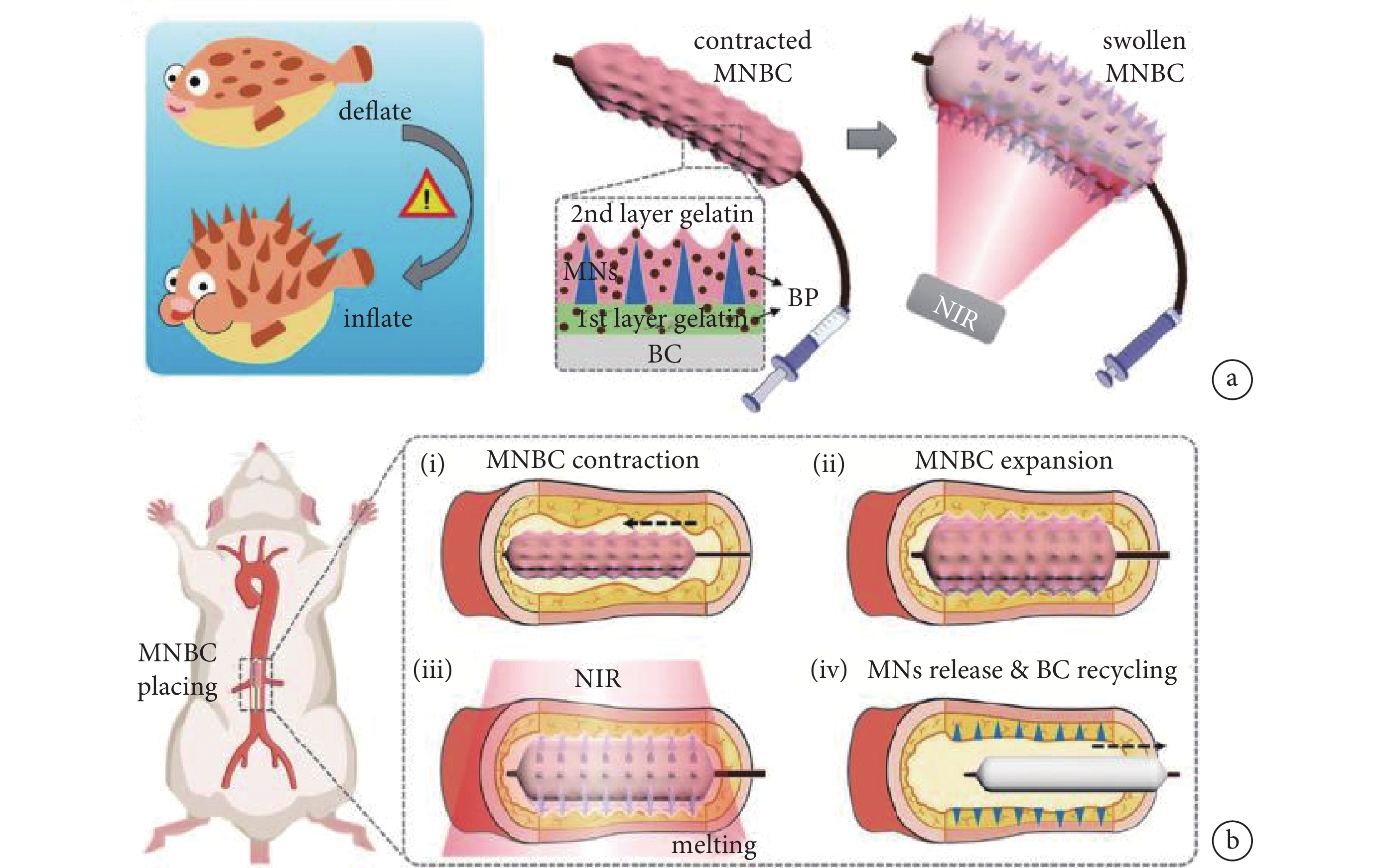
動脈粥樣硬化(atherosclerosis,AS)是常見的血管病變,是導致冠心病、心肌梗死等疾病的主要原因。血管平滑肌細胞的異常增殖與AS疾病風險密切相關,但通過血管管內或管周給藥時,由于血管內皮和外膜的物理屏障作用,使得抗增殖藥物難以在病變部位保持較高濃度。由于微針具有較強的組織穿透能力,能實現血管管內或管周的局部精準給藥以抑制平滑肌細胞的過度增殖[21]。藥物洗脫球囊(drug eluting balloon,DEB)是一種治療AS的充氣裝置,DEB表面可覆蓋一層抗平滑肌細胞增殖藥物并輸送至血管壁,但傳統DEB的藥物輸送效率普遍較低,近年來出現的微針球囊(microneedle drug eluting balloon,MNDEB)可以顯著提升其治療效果[22]。為了避免MNDEB治療時間短的問題,Zhang等[23]受到河豚的啟發,設計了一款隱形微針修飾的智能球囊導管(microneedle balloon catheter,MNBC),通過浸漬和滾動輔助的模板法在導管上形成三層結構的涂層,攜帶藥物的微針被夾在摻雜有黑磷(black phosphorus,BP)的明膠涂層之間。在植入過程中,MNBC在最外層明膠的保護下,可以在血管中平滑運動且不發生藥物損耗,到達病灶點后,BP將近紅外線轉化為熱量,融化表面的明膠層,使得微針暴露并實現血管穿刺以釋放藥物,隨著內層的明膠逐漸被融化,微針還可從球囊導管完全脫離并駐留在血管內以便長期持續釋放藥物(見圖3)。
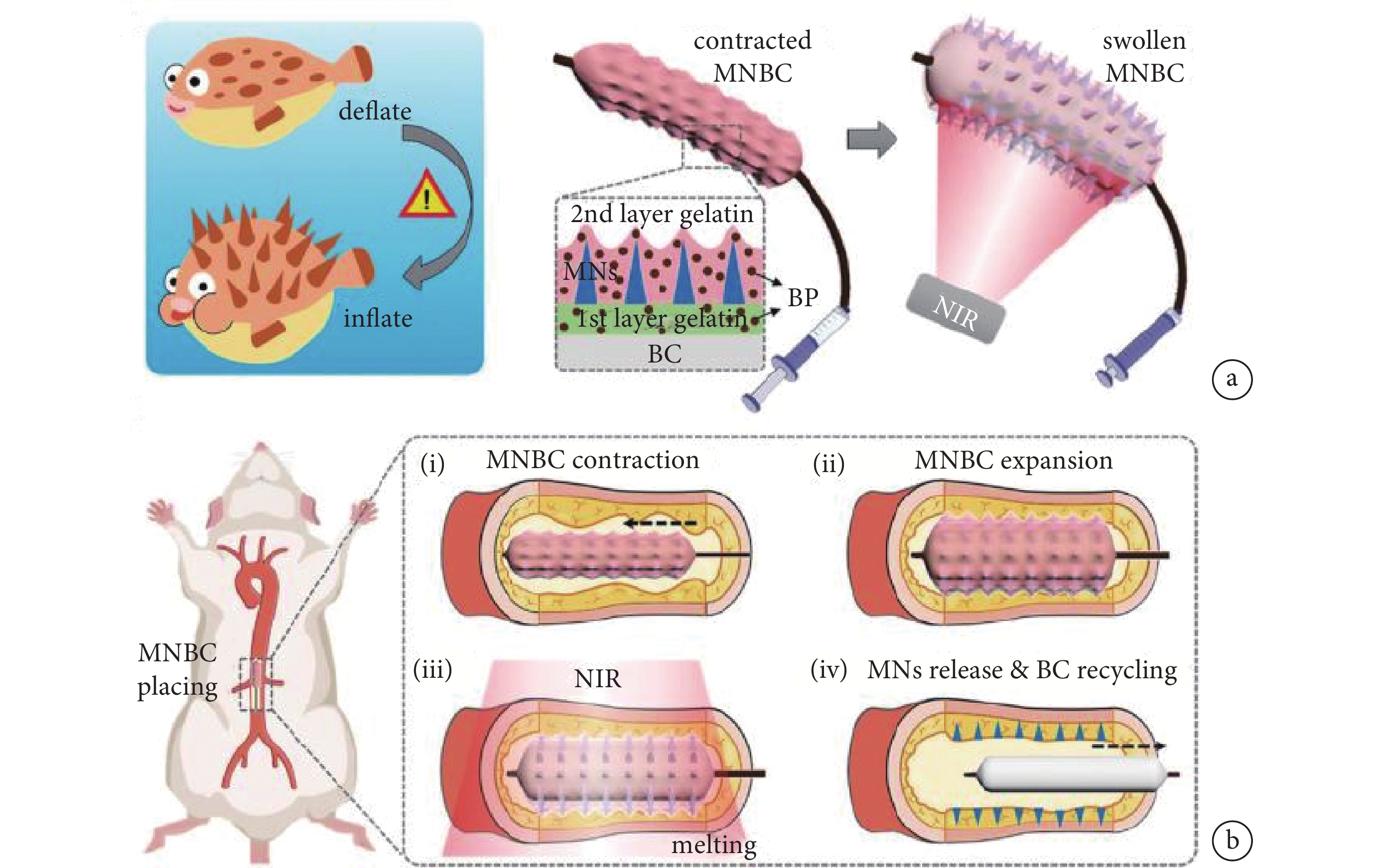 圖3
一種用于血管內給藥的智能微針涂層球囊導管的示意圖及其應用
圖3
一種用于血管內給藥的智能微針涂層球囊導管的示意圖及其應用
a. 受河豚啟發的微針球囊導管示意圖;b. 微針球囊導管置于大鼠腹主動脈內的過程示意圖[23]
Figure3. Schematic diagram and application of balloon catheter with intelligent microneedle coating for endovascular drug deliverya. schematic of globefish-inspired microneedle balloon catheter and its application; b. procedure of placing the microneedle balloon catheter in the abdominal aorta of rats. Reprinted with permission from ref.[23] (Zhang et al. 2022). Copyright 2022 Wiley-VCH GmbH
為了避免球囊管內給藥對內皮層的損傷,研究者也嘗試利用微針貼片從血管的管周進行給藥,然而管周給藥裝置的機械應力容易引起血流動力學改變,同時限制血管與周圍組織的交互作用,造成更嚴重的內膜增生[24]。Lee等[25]制備了一種柔性且多孔的SF載藥微針貼片,能實現吻合部位血管的管周給藥以抑制內膜增生,柔性的微針貼片能很好地貼合血管壁,維持血管的擴張性,其多孔結構還有助于血管與周圍環境的交互作用。但微針介導的血管管周給藥技術仍然存在著很大的局限性,例如管周給藥微針通常需要靠縫合固定在血管的外部,不能靠自身變形來主動貼合血管;其次,由于微針的載藥量有限,很難在病灶區長期持續釋放藥物;最后,管周給藥微針系統大多經由外膜或者內膜穿透至中膜給藥,難以實現對不同血管層的局部定點給藥。
2.3 心臟給藥
近年來,微針在心臟給藥領域中備受矚目,具有以下顯著優勢:① 卓越的定位和穿透心臟組織屏障的能力,使藥物能夠快速、均勻地到達受損的心肌組織,維持局部藥物濃度,提高藥物遞送效率;② 可以搭載治療細胞及藥物等實現心臟疾病的靶向治療;③ 在釋放藥物的同時,可作為心肌貼片,為心臟提供力學支撐,以減輕心肌應激并抑制不良的心室重塑[8, 21]。
微針可以攜帶干細胞,在心臟病變部位發揮修復和再生的功能。Tang等[26]報道了一種裝載有心臟基質細胞(cardiac stromal cells,CSCs)的聚合物微針貼片,其基底由包裹有CSCs的纖維蛋白凝膠組成,PVA錐形微針則作為移植的CSCs與心肌組織之間的通信通道,這種貼片能實現CSCs旁分泌因子的定位和精準釋放,實現受損心肌的修復和再生。其次,理想的心臟貼片需要具備導電性以實現植入細胞與宿主心肌細胞的同步收縮。Sun等[27]制備了一種裝載由多能干細胞誘導的心肌細胞的導電微針貼片。整個貼片由裝載促血管生成和抗炎藥物的微針陣列層、裝載有心肌細胞的平行排列的碳納米管層和GelMA凝膠基底層組成。微針的錐形結構能夠使得貼片與心臟組織良好貼合,通過碳納米管層誘導心肌細胞定向生長并協助細胞間電信號的傳導,使得心肌細胞與宿主心肌細胞的收縮保持一致。
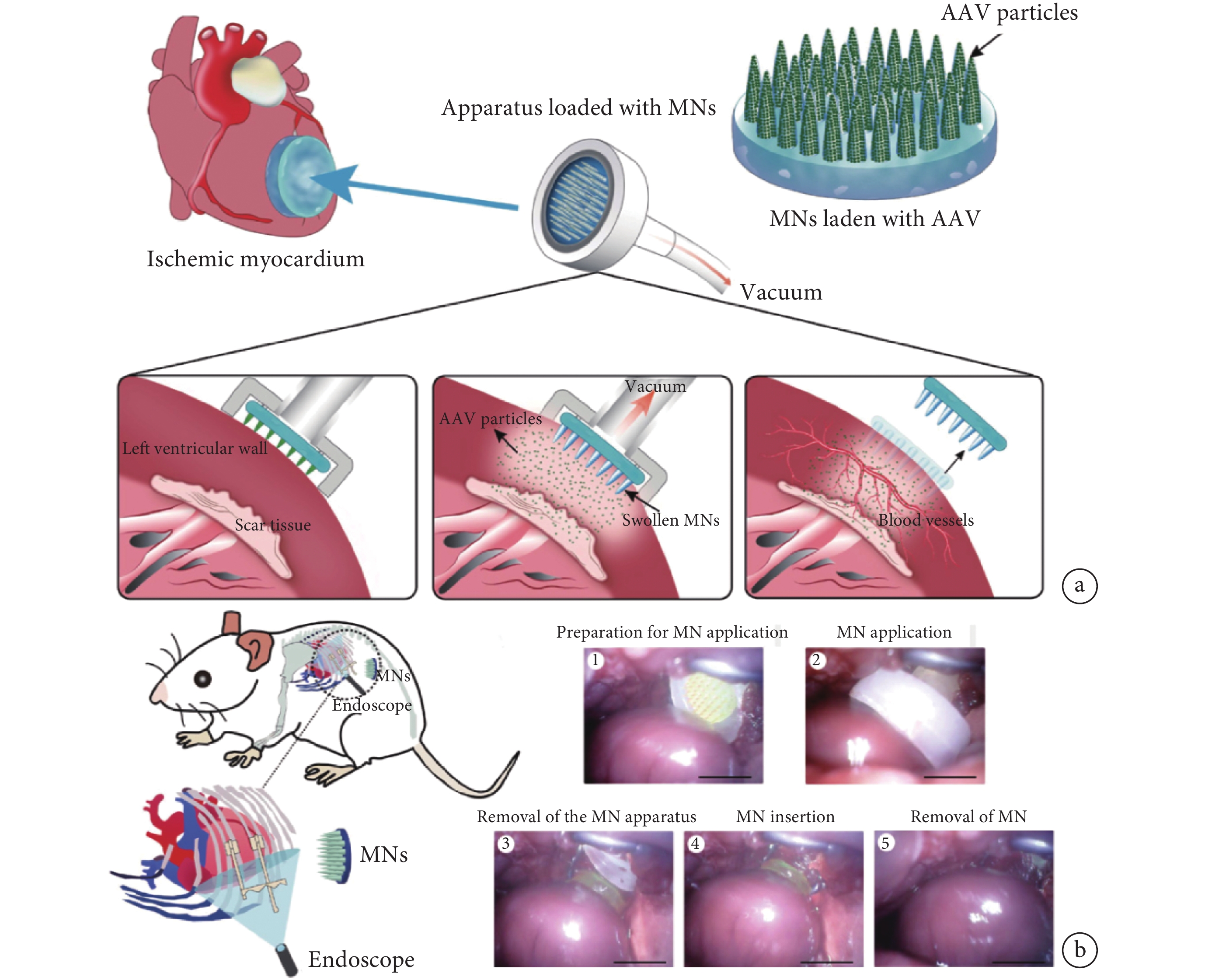
此外,微針也可使腺相關病毒(adeno-associated virus,AAV)等基因治療載體精準可控地釋放于心臟病變部位,顯著提升基因治療的效果。Shi等[28]用PVA制備了一種裝載有增強血管內皮生長因子(vasular endothelial growth factor,VEGF)基因表達功能的AAV微針貼片,可通過內窺鏡輔助手術應用于心臟缺血區域,實現了病毒載體在病變部位的均勻分布和持久高效的細胞轉染,促進了功能性血管的生成并顯著改善了心臟功能(見圖4)。但AAV載體普遍存在免疫原性及穩定性差等問題,外泌體是一種具有低毒性和高穩定性的天然基因載體,微針可以顯著增強外泌體在心臟部位的滯留率[29]。Yuan等[30]制備負載抗纖維化活性的microRNA-29b的外泌體微針貼片,能提高外泌體在心梗部位的滯留能力,并在疾病部位實現持續釋放,顯著抑制心梗后的心肌纖維化,降低梗死面積并最終提高心臟功能。
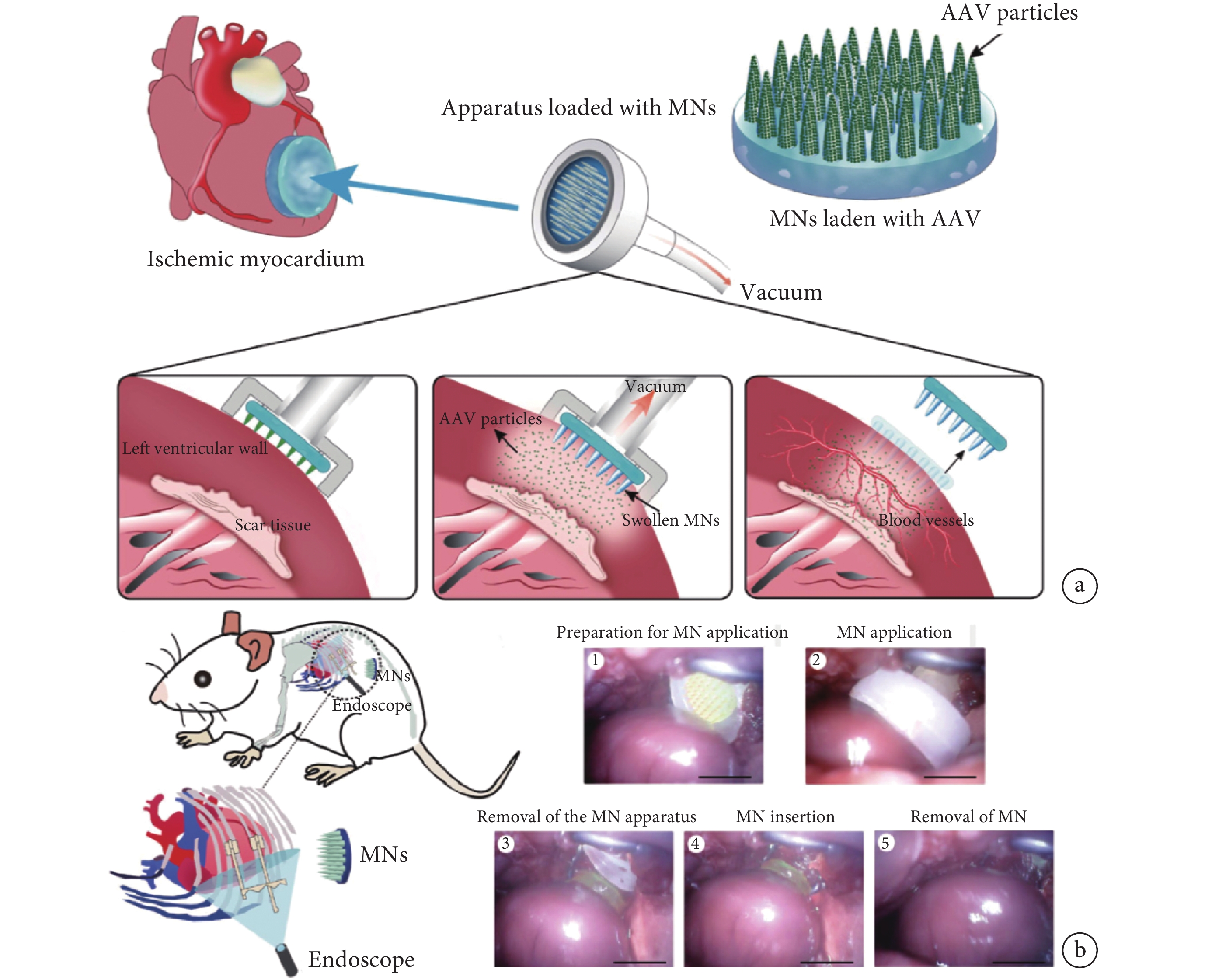 圖4
一種裝載有AAV的心肌微針貼片的示意圖及其應用
圖4
一種裝載有AAV的心肌微針貼片的示意圖及其應用
a. AAV微針心肌貼片總體研究設計示意圖;b. 微針貼片通過內窺鏡輔助微開胸手術應用于心臟缺血區域的示意圖及圖像[28]
Figure4. Schematic diagram and application of AAV microneedle myocardial patcha. the schematic diagram of AAV microneedle myocardial patch implanted in ischemic heart region; b. schematic diagram and endoscopic images of the application the patch to the rat ischemic heart by endoscopic-assisted microthoracotomy. Reprinted with permission from ref.[28] (Shi et al. 2020). Copyright 2020 American Association for the Advancement of Science
由此可見,微針為心臟疾病的治療帶來了曙光,后續的研究需致力于以下問題:首先,為了避免開胸手術帶來的創傷和風險,需開發與微創手術兼容的微針系統;其次,需要賦予微針更好的黏附性和柔性以配合心臟的自然搏動;此外還要開發出根據心臟組織修復的動態環境變化從而調控釋放的智能微針體系。
2.4 其他給藥
對眼部疾病的治療常通過注射給藥或滴眼液進行,注射給藥會帶來不適、感染和眼損傷等問題;而滴眼液又因沖洗效應使得給藥效率低下。由于微針能以極小穿刺尺寸將藥物高效、可控地遞送至眼部,提高了治療效果和依從性,已在多種眼科疾病的應用中得到驗證[31-32]。Shi等[33]制備了一種對真菌性角膜炎治療的PLA-HA可溶性微針,該微針裝載有抗真菌感染的藥物氟康唑,實現了對角膜上皮層的高效穿刺,在提升藥物生物利用度的同時有利于角膜的快速修復。Than等[34]研制出一種用于治療角膜血管增生的眼部微針貼片,針尖由HA及甲基丙烯酸化透明質酸(methacrylated HA,MeHA)制備而成,具有雙相釋放動力學并能實現多種藥物的協同治療。該貼片能迅速釋放抗炎藥物(雙氯芬酸)和持續釋放抗VEGF受體的單克隆抗體(DC101),有效減少眼部的血管增生面積。后續眼部微針的研究需要關注以下幾個方面:首先,由于眼組織的代謝活動弱以及角膜曲率的影響,需使用分子量較低、柔軟及降解速度較快的聚合物來制備微針;其次,由于不會阻礙視力,開發單個可拆卸微針將成為眼部給藥的發展方向[35]。
由于血腦屏障的存在,大多數藥物很難遞送至腦部,因此也可將微針與手術治療相結合,以實現顱腦疾病的高效、精準治療。Wang等[36]開發了一種用于腦膠質瘤治療的SF載藥微針,能同時將凝血酶、替莫唑胺以及貝伐單抗精準遞送至腦腫瘤部位,達到止血、抗血管生成和誘導腫瘤細胞凋亡的目的,還可實現在不同治療時期的藥物按需釋放,有效避免了全身大劑量給藥的毒副作用。此外,Liu等[37]制備出裝載有AAV病毒載體的水凝膠微針,將過表達VEGF的AAV特異性地輸送到病變區,顯著增加了血管的面積、長度及新生內皮細胞數目,為腦卒中的治療提供了新的理論和轉化價值。未來顱內給藥微針的研究可以重點從材料選擇、聯合用藥、結構設計等方面入手,同時,鑒于開顱手術的高風險,還需進一步開發與微創手術兼容的顱內給藥微針技術。
胃腸給藥因操作簡便、患者依從度高等優點,是首選的給藥途徑。然而,胃腸道的消化環境和黏液屏障等因素會對藥物吸收產生影響。微針可無痛地刺入胃腸壁,形成微米尺度的傳輸通道,實現無痛、高效和安全的胃腸給藥。然而,胃腸道肌肉的蠕動以及消化液流動引起的剪切應力等因素會加速微針在胃腸道的脫落;此外,微針也容易被消化液侵蝕、破壞結構并失去功能。Zhang等[38]受到“樂高積木”的啟發,制備了一種口服的磁響應微針系統,該微針由磁性基板、可拆卸連接和微針尖端組成,由腸溶膠囊保護,口服后在小腸中釋放。在磁性基板的作用下,微針的尖端可以沿著指定的磁場方向移動,此外,隨著可拆卸連接的分解,微針尖端能夠分離并留在小腸組織內以持續輸送藥物,并能安全排出。該微針可以裝載胰島素并有效降低血糖,同時也可以口服給藥遞送多種大分子,實現高效胃腸道給藥。但是當前的胃腸道給藥微針系統設計普遍較為復雜,大多需要外部控制,且制造成本較高。
3 總結及展望
綜上所述,醫用高分子微針已從經皮給藥拓展至非透皮局部給藥,為相關疾病的治療提供了一種全新的思路和策略,但也面臨一些問題和挑戰:① 微針載藥率不高的問題依然突出,這在非透皮給藥中表現得尤為明顯,需要研究出先進的制造技術以及更高效的藥物裝載和釋放策略來滿足長期治療的需求;此外,要實現高效率、低成本的微針制造也是一大難題,精密化和個性化的制造技術也急需突破。② 應與生物傳感技術和智能響應材料相結合,開發出能夠主動靶向病灶部位,通過對內部或外界刺激的響應來達到按需給藥的診療一體化微針系統,也可以結合形狀記憶高分子材料制備與微創手術兼容的微針。③ 在關注材料性能及藥物釋放行為的同時,還需要對微針的幾何形狀、針尖高度及針尖密度等參數進行深入探討,考察在不同疾病或損傷的治療及修復過程中的作用;④ 為了順利實現其臨床轉化,對微針的安全性和有效性的評估至關重要,需要建立標準化和規范化的臨床試驗研究。相信隨著未來在制造技術、材料科學以及臨床試驗等方面的發展和進步,研究者們必將進一步拓展微針的應用領域,從而提高人類的生活質量和健康水平。
重要聲明
利益沖突聲明:本文全體作者均聲明不存在利益沖突。
作者貢獻聲明:李海艷負責文章整體構思、圖表設計、文章撰寫及修改;韓宏娟負責文獻整理和文章撰寫;王璐負責文獻搜集及文章修改;姚婧芝負責對整體格式及邏輯進行修改;肖文謙提供研究平臺和基金支持,以及文章的選題、指導和修改;李波負責文章撰寫的指導、修改和審校。
0 引言
微針(microneedles,MN)是一種由微加工技術制造得到的微小的針狀裝置,是一種潛力巨大的經皮給藥工具。它能快速穿透表皮層,形成藥物通過的孔道,將藥物輸送至真皮層或皮下,同時又避免與毛細血管和神經接觸,具有藥物輸送效率高、操作簡便、患者依從性高等多重優勢[1-2]。除此之外,由于微針結構具有很強的穿透力,能微創地穿透多種組織屏障,使藥物直達病灶,避免肝臟首過效應,可大幅度提高藥物的生物利用度;此外微針還能裝載多種藥物,例如大小分子、核酸、納米顆粒、細胞外囊泡以及治療細胞等,為相關疾病的治療開發出多樣化的方法[3]。近年來,微針的應用范圍也逐步擴大到非透皮局部給藥治療領域(見圖1),展現出廣闊的應用前景和價值[4-5]。
 圖1
微針在非透皮局部給藥中的應用
Figure1.
Application of microneedles for non-transdermal local administration
圖1
微針在非透皮局部給藥中的應用
Figure1.
Application of microneedles for non-transdermal local administration
1 非透皮給藥微針的材料及制造工藝
隨著材料學及制造技術的進步,已有多種材料被用來制備微針。硅是最早被用作制造微針的材料,但存在制造成本高、質地脆易造成組織殘留形成肉芽腫等缺點。一些金屬材料,如不銹鋼、鈦、鈀和鈀鈷合金等,也普遍存在藥物載量較低、不能降解等問題[6]。與傳統經皮給藥不同,大多非透皮給藥微針需要在體內植入,制備材料應具有優良的生物相容性、生物可降解性、適宜的力學強度及可黏附性等特點。除了滿足以上特點外,聚合物還具有制造成本低、藥物載量高以及能實現智能藥物輸送等優點,是非透皮給藥微針制備的首選材料[7]。常用的聚合物主要包括人工合成高分子如聚乙烯醇(polyvinyl alcohol,PVA)、聚乙烯吡咯烷酮(polyvinyl pyrrolidone,PVP)、聚乳酸(polylactic acid,PLA)、聚己內酯(poly(ε-caprolactone),PCL)、聚乙二醇雙丙烯酸酯(poly(ethylene glycol) diacrylate,PEGDA)以及聚乳酸-羥基乙酸共聚物(poly(lactic-co-glycolic acid),PLGA)等以及多糖、蛋白質等天然高分子,例如明膠、透明質酸(hyaluronic acid,HA)以及絲素蛋白(silk fibroin,SF)等[8-9]。
為適應大規模、個性化制造的需要,大量微針制造方法不斷被開發出來[10]。當前應用最廣泛的當屬微模塑法,微模塑工藝過程由母版制作、陰模制作、預聚物填充、聚合成型及脫模分離五個步驟組成[11]。該方法操作簡便,重復性高,還能實現具有復雜釋放動力學和復雜結構的微針制備。微模塑法的一個主要問題是模具填充不足,由于表面張力在微尺度水平上占主要作用,使得預聚物溶液在微模腔中的填充不足,可通過真空、離心和旋涂等辦法來促進溶液的填充。此外,微模塑法還存在制造方法不靈活、藥物浪費嚴重和脫模時易破壞結構等缺點。近年來,許多非模具制造技術亦被應用于微針的制造,例如拉延光刻法、激光加工法、三維打印等[12],這些特種加工技術擺脫了對模具的依賴,因其特有的靈活性和便捷性而備受關注[13]。
2 微針的非透皮給藥應用
隨著微針技術在生物醫學領域中的關注度逐漸提升,其應用范圍也從傳統的經皮給藥擴展到組織或器官的非透皮局部給藥,尤其在口腔、眼科、血管、心臟、顱內以及胃腸道等領域的應用非常突出[14],本文將重點綜述高分子微針在非透皮給藥方面的最新應用研究進展(見表1),并就存在的問題和未來的發展方向進行總結及展望。
2.1 口腔給藥
口腔黏膜給藥是一種新型的全身給藥方式[15]。口腔黏膜給藥有效避免了胃腸道降解和首過代謝的問題,但唾液的沖刷效應和酶降解等因素常影響其療效。微針可突破口腔黏膜上皮層屏障從而提升藥物的生物利用度,還能通過材料和結構的優化設計增強對組織的黏附。Caffarel-Salvador等[16]制備出一種可用于口腔頰黏膜給藥的微針貼片,用以遞送胰島素等藥物,該微針的藥物載量高,藥物起效快、使用方便,受試者的痛感反饋表明能有效提升特殊人群用藥的依從性(見圖2)。口腔黏膜給藥的一個突出問題是制劑在濕潤表面上的黏附不牢,Zhu等[17]受到藍環章魚觸手的啟發,采用SF、普朗尼克F127(pluronic F127,PF127)和聚(N-異丙基丙烯酰胺)(poly(N-isopropyl acrylamide),PNIPAm)開發了一種在濕潤環境中實現可控局部給藥的微針貼片,其表面的仿生柔性吸盤賦予微針穩定的黏附力以保證長時間作用于濕潤環境中,并能穿透組織表面的黏液層或屏障,感應體溫實現主動注射,實現藥物的局部按需釋放。
 圖2
一種口腔黏膜給藥微針貼片的示意圖及應用
圖2
一種口腔黏膜給藥微針貼片的示意圖及應用
a. 微針貼片的應用示意圖;b. 微針的激光共聚焦顯微鏡照片;c. 微針的制備流程示意圖;d. 微針的掃描電鏡圖像;裝載有胰島素的微針(e)和裝載有人生長激素微針(f)的光學顯微鏡照片[16]
Figure2. Schematic diagram and application of Buccal microneedle patcha. schematic diagram for the application of the microneedle patches; b. confocal image of the microneedle patches; c. illustration of the process of preparing microneedle patches; d. SEM image of the microneedle patches; optical microscope images of the microneedle patches loaded with human insulin (e) and human growth hormone (f). Reprinted with permission from ref.[16] (Caffarel-Salvador et al. 2021). Copyright 2021 American Association for the Advancement of Science
除此之外,微針也可應用于牙科領域。牙周炎是一種造成牙周組織持續性損傷的炎癥性疾病,由于受損的牙周組織無法進行自我修復,亟需開發先進的再生療法來恢復其結構和功能[18]。Zhang等[19]開發了一種模塊化微針,通過對口腔免疫的調節來實現牙周組織的再生。該微針由能夠迅速釋放四環素的黏性底座以及甲基丙烯酸酐改性明膠(gelatin methacryloyl,GelMA)的凝膠針尖組成,針尖則裝載了負載四環素PLGA納米顆粒和負載細胞因子白細胞介素4(interleukin-4,IL-4)與轉化生長因子β(transforming growth factor β,TGF-β)的二氧化硅微米顆粒。當植入牙齦時,微針底座能迅速釋放抗生素,針尖則可實現抗生素、細胞因子的持續釋放,發揮抑制細菌生長、誘導抗炎巨噬細胞的復極化和調節性T細胞生成的作用,同時促進了牙周細胞的成骨活性和膠原基質合成。其次,微針也可用于牙科麻醉劑的遞送,Seeni等[20]采用生物相容導電聚合物聚(3,4-乙烯基二氧噻吩)∶聚(苯乙烯磺酸鹽)(PEDOT∶PSS)和HA制備了一種微針貼片,能與離子電滲技術相結合,協助麻醉劑利多卡因迅速滲入口腔黏膜及下層骨組織,避免注射給藥產生的不適,達到快速局部麻醉的效果。
當前微針在口腔給藥的研究中還存在以下不足:一是微針的療效會極大地受到口腔唾液流動因素的影響,需要建立準確的體外滲透模型,模擬唾液流速和液膜厚度,以便更好地預測體內藥代動力學;二是口腔黏膜中存在大量微生物,通過受損的黏膜給藥易增加全身感染的風險,需進一步評估口腔給藥微針的安全性。
2.2 血管給藥
動脈粥樣硬化(atherosclerosis,AS)是常見的血管病變,是導致冠心病、心肌梗死等疾病的主要原因。血管平滑肌細胞的異常增殖與AS疾病風險密切相關,但通過血管管內或管周給藥時,由于血管內皮和外膜的物理屏障作用,使得抗增殖藥物難以在病變部位保持較高濃度。由于微針具有較強的組織穿透能力,能實現血管管內或管周的局部精準給藥以抑制平滑肌細胞的過度增殖[21]。藥物洗脫球囊(drug eluting balloon,DEB)是一種治療AS的充氣裝置,DEB表面可覆蓋一層抗平滑肌細胞增殖藥物并輸送至血管壁,但傳統DEB的藥物輸送效率普遍較低,近年來出現的微針球囊(microneedle drug eluting balloon,MNDEB)可以顯著提升其治療效果[22]。為了避免MNDEB治療時間短的問題,Zhang等[23]受到河豚的啟發,設計了一款隱形微針修飾的智能球囊導管(microneedle balloon catheter,MNBC),通過浸漬和滾動輔助的模板法在導管上形成三層結構的涂層,攜帶藥物的微針被夾在摻雜有黑磷(black phosphorus,BP)的明膠涂層之間。在植入過程中,MNBC在最外層明膠的保護下,可以在血管中平滑運動且不發生藥物損耗,到達病灶點后,BP將近紅外線轉化為熱量,融化表面的明膠層,使得微針暴露并實現血管穿刺以釋放藥物,隨著內層的明膠逐漸被融化,微針還可從球囊導管完全脫離并駐留在血管內以便長期持續釋放藥物(見圖3)。
 圖3
一種用于血管內給藥的智能微針涂層球囊導管的示意圖及其應用
圖3
一種用于血管內給藥的智能微針涂層球囊導管的示意圖及其應用
a. 受河豚啟發的微針球囊導管示意圖;b. 微針球囊導管置于大鼠腹主動脈內的過程示意圖[23]
Figure3. Schematic diagram and application of balloon catheter with intelligent microneedle coating for endovascular drug deliverya. schematic of globefish-inspired microneedle balloon catheter and its application; b. procedure of placing the microneedle balloon catheter in the abdominal aorta of rats. Reprinted with permission from ref.[23] (Zhang et al. 2022). Copyright 2022 Wiley-VCH GmbH
為了避免球囊管內給藥對內皮層的損傷,研究者也嘗試利用微針貼片從血管的管周進行給藥,然而管周給藥裝置的機械應力容易引起血流動力學改變,同時限制血管與周圍組織的交互作用,造成更嚴重的內膜增生[24]。Lee等[25]制備了一種柔性且多孔的SF載藥微針貼片,能實現吻合部位血管的管周給藥以抑制內膜增生,柔性的微針貼片能很好地貼合血管壁,維持血管的擴張性,其多孔結構還有助于血管與周圍環境的交互作用。但微針介導的血管管周給藥技術仍然存在著很大的局限性,例如管周給藥微針通常需要靠縫合固定在血管的外部,不能靠自身變形來主動貼合血管;其次,由于微針的載藥量有限,很難在病灶區長期持續釋放藥物;最后,管周給藥微針系統大多經由外膜或者內膜穿透至中膜給藥,難以實現對不同血管層的局部定點給藥。
2.3 心臟給藥
近年來,微針在心臟給藥領域中備受矚目,具有以下顯著優勢:① 卓越的定位和穿透心臟組織屏障的能力,使藥物能夠快速、均勻地到達受損的心肌組織,維持局部藥物濃度,提高藥物遞送效率;② 可以搭載治療細胞及藥物等實現心臟疾病的靶向治療;③ 在釋放藥物的同時,可作為心肌貼片,為心臟提供力學支撐,以減輕心肌應激并抑制不良的心室重塑[8, 21]。
微針可以攜帶干細胞,在心臟病變部位發揮修復和再生的功能。Tang等[26]報道了一種裝載有心臟基質細胞(cardiac stromal cells,CSCs)的聚合物微針貼片,其基底由包裹有CSCs的纖維蛋白凝膠組成,PVA錐形微針則作為移植的CSCs與心肌組織之間的通信通道,這種貼片能實現CSCs旁分泌因子的定位和精準釋放,實現受損心肌的修復和再生。其次,理想的心臟貼片需要具備導電性以實現植入細胞與宿主心肌細胞的同步收縮。Sun等[27]制備了一種裝載由多能干細胞誘導的心肌細胞的導電微針貼片。整個貼片由裝載促血管生成和抗炎藥物的微針陣列層、裝載有心肌細胞的平行排列的碳納米管層和GelMA凝膠基底層組成。微針的錐形結構能夠使得貼片與心臟組織良好貼合,通過碳納米管層誘導心肌細胞定向生長并協助細胞間電信號的傳導,使得心肌細胞與宿主心肌細胞的收縮保持一致。
此外,微針也可使腺相關病毒(adeno-associated virus,AAV)等基因治療載體精準可控地釋放于心臟病變部位,顯著提升基因治療的效果。Shi等[28]用PVA制備了一種裝載有增強血管內皮生長因子(vasular endothelial growth factor,VEGF)基因表達功能的AAV微針貼片,可通過內窺鏡輔助手術應用于心臟缺血區域,實現了病毒載體在病變部位的均勻分布和持久高效的細胞轉染,促進了功能性血管的生成并顯著改善了心臟功能(見圖4)。但AAV載體普遍存在免疫原性及穩定性差等問題,外泌體是一種具有低毒性和高穩定性的天然基因載體,微針可以顯著增強外泌體在心臟部位的滯留率[29]。Yuan等[30]制備負載抗纖維化活性的microRNA-29b的外泌體微針貼片,能提高外泌體在心梗部位的滯留能力,并在疾病部位實現持續釋放,顯著抑制心梗后的心肌纖維化,降低梗死面積并最終提高心臟功能。
 圖4
一種裝載有AAV的心肌微針貼片的示意圖及其應用
圖4
一種裝載有AAV的心肌微針貼片的示意圖及其應用
a. AAV微針心肌貼片總體研究設計示意圖;b. 微針貼片通過內窺鏡輔助微開胸手術應用于心臟缺血區域的示意圖及圖像[28]
Figure4. Schematic diagram and application of AAV microneedle myocardial patcha. the schematic diagram of AAV microneedle myocardial patch implanted in ischemic heart region; b. schematic diagram and endoscopic images of the application the patch to the rat ischemic heart by endoscopic-assisted microthoracotomy. Reprinted with permission from ref.[28] (Shi et al. 2020). Copyright 2020 American Association for the Advancement of Science
由此可見,微針為心臟疾病的治療帶來了曙光,后續的研究需致力于以下問題:首先,為了避免開胸手術帶來的創傷和風險,需開發與微創手術兼容的微針系統;其次,需要賦予微針更好的黏附性和柔性以配合心臟的自然搏動;此外還要開發出根據心臟組織修復的動態環境變化從而調控釋放的智能微針體系。
2.4 其他給藥
對眼部疾病的治療常通過注射給藥或滴眼液進行,注射給藥會帶來不適、感染和眼損傷等問題;而滴眼液又因沖洗效應使得給藥效率低下。由于微針能以極小穿刺尺寸將藥物高效、可控地遞送至眼部,提高了治療效果和依從性,已在多種眼科疾病的應用中得到驗證[31-32]。Shi等[33]制備了一種對真菌性角膜炎治療的PLA-HA可溶性微針,該微針裝載有抗真菌感染的藥物氟康唑,實現了對角膜上皮層的高效穿刺,在提升藥物生物利用度的同時有利于角膜的快速修復。Than等[34]研制出一種用于治療角膜血管增生的眼部微針貼片,針尖由HA及甲基丙烯酸化透明質酸(methacrylated HA,MeHA)制備而成,具有雙相釋放動力學并能實現多種藥物的協同治療。該貼片能迅速釋放抗炎藥物(雙氯芬酸)和持續釋放抗VEGF受體的單克隆抗體(DC101),有效減少眼部的血管增生面積。后續眼部微針的研究需要關注以下幾個方面:首先,由于眼組織的代謝活動弱以及角膜曲率的影響,需使用分子量較低、柔軟及降解速度較快的聚合物來制備微針;其次,由于不會阻礙視力,開發單個可拆卸微針將成為眼部給藥的發展方向[35]。
由于血腦屏障的存在,大多數藥物很難遞送至腦部,因此也可將微針與手術治療相結合,以實現顱腦疾病的高效、精準治療。Wang等[36]開發了一種用于腦膠質瘤治療的SF載藥微針,能同時將凝血酶、替莫唑胺以及貝伐單抗精準遞送至腦腫瘤部位,達到止血、抗血管生成和誘導腫瘤細胞凋亡的目的,還可實現在不同治療時期的藥物按需釋放,有效避免了全身大劑量給藥的毒副作用。此外,Liu等[37]制備出裝載有AAV病毒載體的水凝膠微針,將過表達VEGF的AAV特異性地輸送到病變區,顯著增加了血管的面積、長度及新生內皮細胞數目,為腦卒中的治療提供了新的理論和轉化價值。未來顱內給藥微針的研究可以重點從材料選擇、聯合用藥、結構設計等方面入手,同時,鑒于開顱手術的高風險,還需進一步開發與微創手術兼容的顱內給藥微針技術。
胃腸給藥因操作簡便、患者依從度高等優點,是首選的給藥途徑。然而,胃腸道的消化環境和黏液屏障等因素會對藥物吸收產生影響。微針可無痛地刺入胃腸壁,形成微米尺度的傳輸通道,實現無痛、高效和安全的胃腸給藥。然而,胃腸道肌肉的蠕動以及消化液流動引起的剪切應力等因素會加速微針在胃腸道的脫落;此外,微針也容易被消化液侵蝕、破壞結構并失去功能。Zhang等[38]受到“樂高積木”的啟發,制備了一種口服的磁響應微針系統,該微針由磁性基板、可拆卸連接和微針尖端組成,由腸溶膠囊保護,口服后在小腸中釋放。在磁性基板的作用下,微針的尖端可以沿著指定的磁場方向移動,此外,隨著可拆卸連接的分解,微針尖端能夠分離并留在小腸組織內以持續輸送藥物,并能安全排出。該微針可以裝載胰島素并有效降低血糖,同時也可以口服給藥遞送多種大分子,實現高效胃腸道給藥。但是當前的胃腸道給藥微針系統設計普遍較為復雜,大多需要外部控制,且制造成本較高。
3 總結及展望
綜上所述,醫用高分子微針已從經皮給藥拓展至非透皮局部給藥,為相關疾病的治療提供了一種全新的思路和策略,但也面臨一些問題和挑戰:① 微針載藥率不高的問題依然突出,這在非透皮給藥中表現得尤為明顯,需要研究出先進的制造技術以及更高效的藥物裝載和釋放策略來滿足長期治療的需求;此外,要實現高效率、低成本的微針制造也是一大難題,精密化和個性化的制造技術也急需突破。② 應與生物傳感技術和智能響應材料相結合,開發出能夠主動靶向病灶部位,通過對內部或外界刺激的響應來達到按需給藥的診療一體化微針系統,也可以結合形狀記憶高分子材料制備與微創手術兼容的微針。③ 在關注材料性能及藥物釋放行為的同時,還需要對微針的幾何形狀、針尖高度及針尖密度等參數進行深入探討,考察在不同疾病或損傷的治療及修復過程中的作用;④ 為了順利實現其臨床轉化,對微針的安全性和有效性的評估至關重要,需要建立標準化和規范化的臨床試驗研究。相信隨著未來在制造技術、材料科學以及臨床試驗等方面的發展和進步,研究者們必將進一步拓展微針的應用領域,從而提高人類的生活質量和健康水平。
重要聲明
利益沖突聲明:本文全體作者均聲明不存在利益沖突。
作者貢獻聲明:李海艷負責文章整體構思、圖表設計、文章撰寫及修改;韓宏娟負責文獻整理和文章撰寫;王璐負責文獻搜集及文章修改;姚婧芝負責對整體格式及邏輯進行修改;肖文謙提供研究平臺和基金支持,以及文章的選題、指導和修改;李波負責文章撰寫的指導、修改和審校。