近紅外熒光成像技術具有實時快速、高時空分辨率、深組織穿透等突出優勢,在腫瘤在體成像和治療方面顯示出巨大應用潛力。Ⅰ-Ⅲ-Ⅵ族量子點具有高亮度、寬激發、易于調節的發射波長,還具有優越的穩定性且不含鎘或鉛等高毒性重金屬元素,使其在生物醫學應用領域受到廣泛關注。本綜述總結了近年來Ⅰ-Ⅲ-Ⅵ族近紅外發光量子點的可控合成,及其在腫瘤在體成像治療應用中的研究進展。首先,介紹了Ⅰ-Ⅲ-Ⅵ族量子點的有機相和水相合成方法,以及對近紅外發光性能的調控策略;其次,重點探討了近紅外無鎘量子點在生物醫學領域的應用,包括腫瘤早期診斷、淋巴成像、藥物遞送、光熱和光動力治療等;最后,本文展望了未來量子點面向生物醫學領域應用的發展方向和面臨的挑戰,或可為無鎘量子點在腫瘤診療方面的進一步研究及臨床轉化提供指導和參考。
引用本文: 李曉琪, 孫曉, 林華, 張沛森, 焦明霞, 張霓. 基于近紅外無鎘量子點的腫瘤在體成像和治療. 生物醫學工程學雜志, 2024, 41(3): 620-626. doi: 10.7507/1001-5515.202404002 復制
版權信息: ?四川大學華西醫院華西期刊社《生物醫學工程學雜志》版權所有,未經授權不得轉載、改編
0 引言
目前,癌癥依然是危害人類健康的重大疾病之一。根據世界衛生組織國際癌癥研究機構數據顯示,2022年全球新增癌癥病例數達到2 000萬例,死亡970萬病例。盡管在過去的幾十年里,腫瘤的診斷和治療方法取得了一些進展,但總體治愈率的提高并不顯著[1]。基于上述現狀,應加大對癌癥篩查與早診早治工作的投入,在健康體檢方面對癌癥篩查重點關注,同時促進癌癥治療新技術、新方法的推廣應用[2]。為了滿足上述要求,現已發展了磁共振成像、計算機斷層掃描、超聲成像、正電子發射斷層掃描、單光子發射計算機斷層掃描等多種成像技術并應用于腫瘤診斷以及治療評估。其中,磁共振成像和計算機斷層掃描具有較高的時空分辨率,但是靈敏度較低;超聲成像具有無創、無輻射和實時動態等優點,但組織分辨率較低;正電子發射斷層掃描和單光子發射計算機斷層掃描可以高靈敏監測和定量分析生命代謝活動,但它們仍然存在低空間分辨率的問題,且昂貴的檢查費用限制了其在臨床醫學成像應用中的普及[3]。除了這些傳統的成像方式外,熒光成像技術因具有實時反饋、多信號采集、高靈敏度以及無電離輻射等特性而備受關注。然而,在可見光區(400~700 nm)的熒光成像,只有幾毫米的組織穿透深度,極大地影響了其在動物研究和臨床實踐中的應用。近十年來,近紅外光區(近紅外一區:700~1 000 nm、近紅外二區:1 000~1 700 nm)熒光成像由于光吸收和散射的顯著降低以及可忽略不計的組織自身熒光,大大提高了組織穿透性和時空分辨率[4],因此有望成為下一代在體成像技術。這種成像技術與生物醫學應用之間的結合,將為癌癥的早期診斷和治療提供新的技術支持。
量子點,是一類極具應用前景的新型納米材料,為醫學診斷和治療研究帶來了新的思路[5]。量子點也被稱為半導體納米晶,具有獨特的光學和電學特性[6-7]。與傳統的有機染料相比,量子點由于其高穩定性、可調的光學性質而受到了廣泛關注[8]。當量子點的尺寸小于或與激子玻爾半徑相當時,就會發生量子限域。少量原子的增加或減少引起量子點尺寸的變化,從而改變帶隙,因此量子點的發光可覆蓋可見光區至近紅外光區[9];且尺寸相關的光學特性使其在生物成像、成像引導的疾病治療、太陽能電池和發光二極管等方面得到了廣泛應用。目前,二元量子點發展相對成熟,包括:Ⅱ-Ⅵ族硒化鎘(CdSe)和硫化鎘(CdS)、III-V族砷化銦(InAs)和磷化銦(InP)、Ⅳ-Ⅵ族硫化鉛(PbS)和碲化鉛(PbTe)等,具有較好的發光性能[10]。例如,孫靜文等[11]采用陽離子交換法合成了硫化鎘包覆硫化鉛(PbS@CdS)的核殼型量子點,通過在量子點表面進行聚乙二醇修飾,提高了其在水溶液中的穩定性,熒光發射峰為1 550 nm,熒光量子產率為7.2%。房詩玉等[12]制備了單分散的碲化鎘(CdTe)量子點,通過汞離子(Hg2+)交換實現了碲鎘汞(HgxCd1-xTe)量子點的發射光譜在可見光區至近紅外光區可調。然而,上述量子點材料本身或其殼層材料通常含有鎘和鉛等高毒性重金屬元素,限制了它們在生物醫學領域的應用,因此有必要開發不含高毒性重金屬元素的生物相容性量子點。
Ⅰ-Ⅲ-Ⅵ族量子點與傳統的Ⅱ-Ⅵ族和Ⅳ-Ⅵ族量子點相比,不含鎘、鉛和汞等高毒性重金屬元素。此外,Ⅰ-Ⅲ-Ⅵ族量子點的光學性質可以通過改變化學組成來調節,使其發射峰位在可見光區到近紅外光區可調。例如,Li等[13]使用熱注射法合成了發射峰位在956~1 224 nm的銅銦硒(CuInSe2)量子點,在荷瘤小鼠的近紅外二區在體成像中,能夠清晰地描繪微小腫瘤邊界。Liu等[14]通過改變鋅(Zn)和銅的摩爾比,合成了發射峰位在630~800 nm可調的鋅銅銦硒(Zn-Cu-In-Se)量子點,并以此構建了靶向多種腫瘤標志物的納米探針,成功應用于腫瘤標志物的高通量檢測。此外,該量子點還具有較寬的激發光譜,為生物成像激發光源的選擇提供了很大的靈活性。由此可見,Ⅰ-Ⅲ-Ⅵ族量子點優異的近紅外光學特性和較好的生物相容性,使其在腫瘤成像和治療方面具有極大的應用潛力。
1 近紅外無鎘量子點的合成及發光調控
Ⅰ-Ⅲ-Ⅵ族量子點,不含高毒性重金屬元素,已經成為傳統Ⅱ-Ⅵ族和Ⅳ-Ⅵ族量子點的有效替代品[15]。二元量子點的光學性質依賴于顆粒尺寸,而三元量子點的光學性質不僅依賴于顆粒尺寸,還與化學組成密切相關,可以通過改變化學組成為量子點熒光發射范圍的調節提供靈活性[16]。高亮的光致發光和較高的生物安全性是將量子點應用于生物醫學領域所必需的條件。因此,本文綜述了近年來通過有機相和水相方法合成高性能Ⅰ-Ⅲ-Ⅵ族無鎘量子點的研究進展,對比討論了兩種方法的優缺點,并介紹了近紅外發光性能的調控策略,以期為實現無鎘量子點的生物醫學應用奠定基礎。
1.1 Ⅰ-Ⅲ-Ⅵ 族量子點的有機相合成
高熒光量子產率是量子點實際應用的關鍵,可實現高靈敏的生物成像。但是,在近紅外光區,Ⅰ-Ⅲ-Ⅵ族量子點的熒光量子產率遠遠落后于Ⅱ-Ⅵ和Ⅳ-Ⅵ族量子點,大多數近紅外發光CuInSe2量子點的熒光量子產率不到10%。通過有機相方法合成量子點,高溫反應有利于提高納米晶體結晶度,并利用元素Zn合金化或外延生長寬帶隙硫化鋅(ZnS)殼層,可以提高CuInSe2量子點的熒光量子產率[17]。例如,McHugh等[18]以1-十八烯和1-十二烷基硫醇為共溶劑,在CuInSe2量子點表面外延生長ZnS殼層(CuInSe2@ZnS)過程中,其熒光量子產率從16.2%增長至43.6%,發射峰位從964 nm藍移至891 nm。Li等[13]開發了一種磁性錳(Mn)元素摻雜的ZnS包覆CuInSe2(CuInSe2@ZnS:Mn)的核殼型量子點,通過對生長動力學控制,最終得到了發射峰位在956~1 224 nm可調的量子點,最高熒光量子產率達到31.2%。Langevin等[19]通過陰離子交換得到了球形、金字塔形或棱柱形銀銦硒(AgInSe2)量子點,熒光發射范圍覆蓋800~1 300 nm,熒光量子產率最高可達21%。Ning等[20]通過在CuInSe2量子點上生長多層銅銦鋅硫硒(CuInZnS2-xSex)殼層,得到了熒光發射峰位在834~1 028 nm可調的量子點,且發光峰位在920 nm的量子點其熒光量子產率可以達到20%。廉緯等[21]采用離子交換法合成了近紅外發光AgInSe2量子點。通過調節Ag/In投料比控制離子交換程度,可實現量子點發射峰位在650~791 nm可調,最高熒光量子產率高達42.5%,實現了基于近紅外發光量子點探針的腫瘤細胞靶向成像,展示出AgInSe2量子點在生物成像方面的應用潛力。
大多數有機相合成的Ⅰ-Ⅲ-Ⅵ族量子點通過調控化學組成和構筑核殼結構,可在近紅外光區實現高亮的光致發光。但是,有機相合成中通常需要使用昂貴或有害的有機試劑,且大多數反應需要苛刻的反應條件(如惰性氣氛和高溫)[22],因此成本高、環境不友好且反應不易于控制。此外,在生物應用中,有機相制備的量子點需要通過相轉移或表面修飾來改變其疏水性,才能進一步應用于生物體系中。然而,相轉移不可避免地導致量子點的熒光量子產率和穩定性下降,同時繁瑣的配體交換過程不利于大規模低成本制備量子點,因此面向生物醫學應用,需開發可直接獲得生物相容性材料的有效途徑。
1.2 Ⅰ-Ⅲ-Ⅵ族量子點的水相合成
水相合成是獲得生物相容性納米材料的直接途徑。目前,已經有通過水相合成法成功制備CuInSe2量子點的報道。然而,這些量子點的熒光量子產率較低(< 5%),并且熒光發射峰位很難達到近紅外光區[23]。與有機相合成相比,水相合成所使用的反應溫度大大降低,因此,在量子點表面和晶格內引入了更多的缺陷,這將嚴重限制輻射復合,從而導致熒光量子產率的降低。由于多種金屬前驅體(陽離子)對陰離子的親和力不同,必須通過多種配體與金屬離子的配位來精確控制其反應活性、化學組成和光學性質。例如,Liu等[14]開發了一種簡單的水相合成法,以谷胱甘肽和檸檬酸鈉為雙配體分別平衡金屬離子的反應活性,直接制備了水溶性的合金化Zn-Cu-In-Se量子點,通過改變Zn和Cu的摩爾比,并通過激子復合動力學控制,實現了量子點熒光發射波長在630~800 nm范圍內的連續可調變,通過外延生長ZnS殼層,熒光量子產率達到25.8%;并且基于近紅外發光可調、發光效率高且生物相容性優異的量子點,結合表面耦聯核酸適配體分子構建了靶向兩種腫瘤標志物的雙色量子點探針,實現了對腫瘤細胞內不同靶標的選擇性識別和高通量熒光標記。Yang等[23]發展了一種簡便、綠色的水相合成方法,通過在Zn-Cu-In-Se量子點表面外延生長ZnS殼層的過程中原位摻雜順磁性錳離子(Mn2+),降低了磁性摻雜對量子點發光中心的影響,有效平衡了光學和磁學性能,得到了核殼型量子點(Zn-Cu-In-Se@ZnS:Mn);其所制備的水相順磁性量子點(發光峰位約780 nm)的熒光量子產率可達18.9%,同時摻雜的Mn2+有利于提高量子點與周圍水分子的自旋—質子偶極相互作用,從而賦予其優異的T1/T2雙模態磁共振對比增強效應,摩爾縱向弛豫率r1和橫向弛豫率r2分別為4.7、57.6 mM-1·s-1;基于此,實現了在體腫瘤的多通道近紅外光學成像以及小鼠腦的多參數磁共振成像。
總而言之,利用綠色、簡便的水相合成法可以直接獲得具有較高生物相容性的量子點,但熒光量子產率相比于有機相合成的量子點較低,且直接水相合成近紅外二區發光的Ⅰ-Ⅲ-Ⅵ族量子點還尚未報道。因此,利用水相合成法得到高質量的近紅外發光Ⅰ-Ⅲ-Ⅵ族量子點仍然具有挑戰性。
2 近紅外無鎘量子點用于腫瘤在體成像和治療
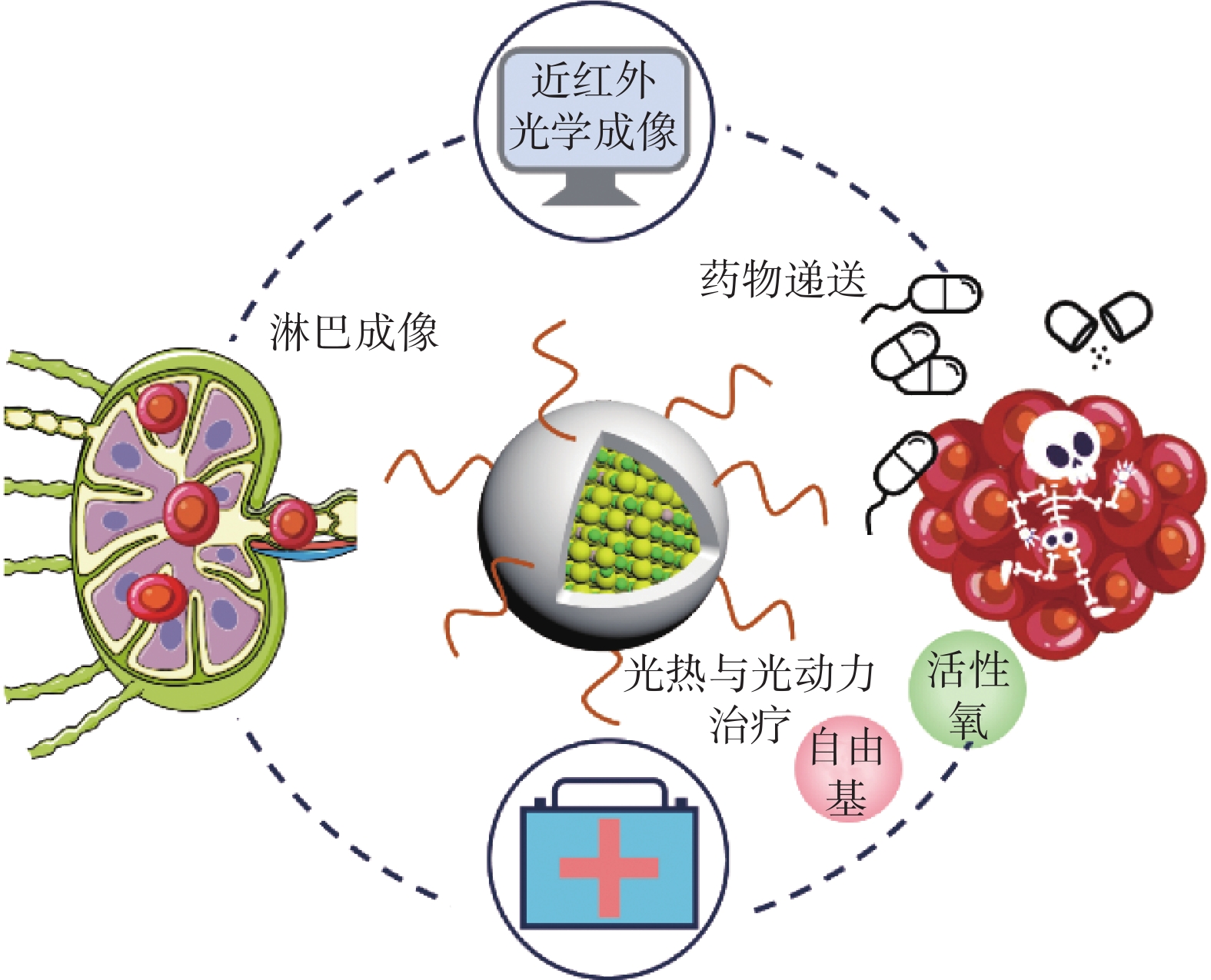
迄今為止,癌癥仍然是對人類健康最具威脅性的疾病之一。近年來,基于納米材料的熒光成像技術作為癌癥診斷和成像引導治療的有力手段,引起了廣泛關注[24]。由于Ⅰ-Ⅲ-Ⅵ族量子點具有較好的生物相容性、發射范圍在近紅外光區可調、近紅外光區吸收范圍廣等優勢,使其在腫瘤成像和治療研究中具有極大前景[25]。在此,本文綜述了Ⅰ-Ⅲ-Ⅵ族量子點在腫瘤早期診斷、淋巴成像、藥物遞送、光熱和光動力治療方面的代表性研究,如圖1所示;并對代表性Ⅰ-Ⅲ-Ⅵ族量子點的合成策略、光學性質及其醫學應用進行總結,如表1所示。
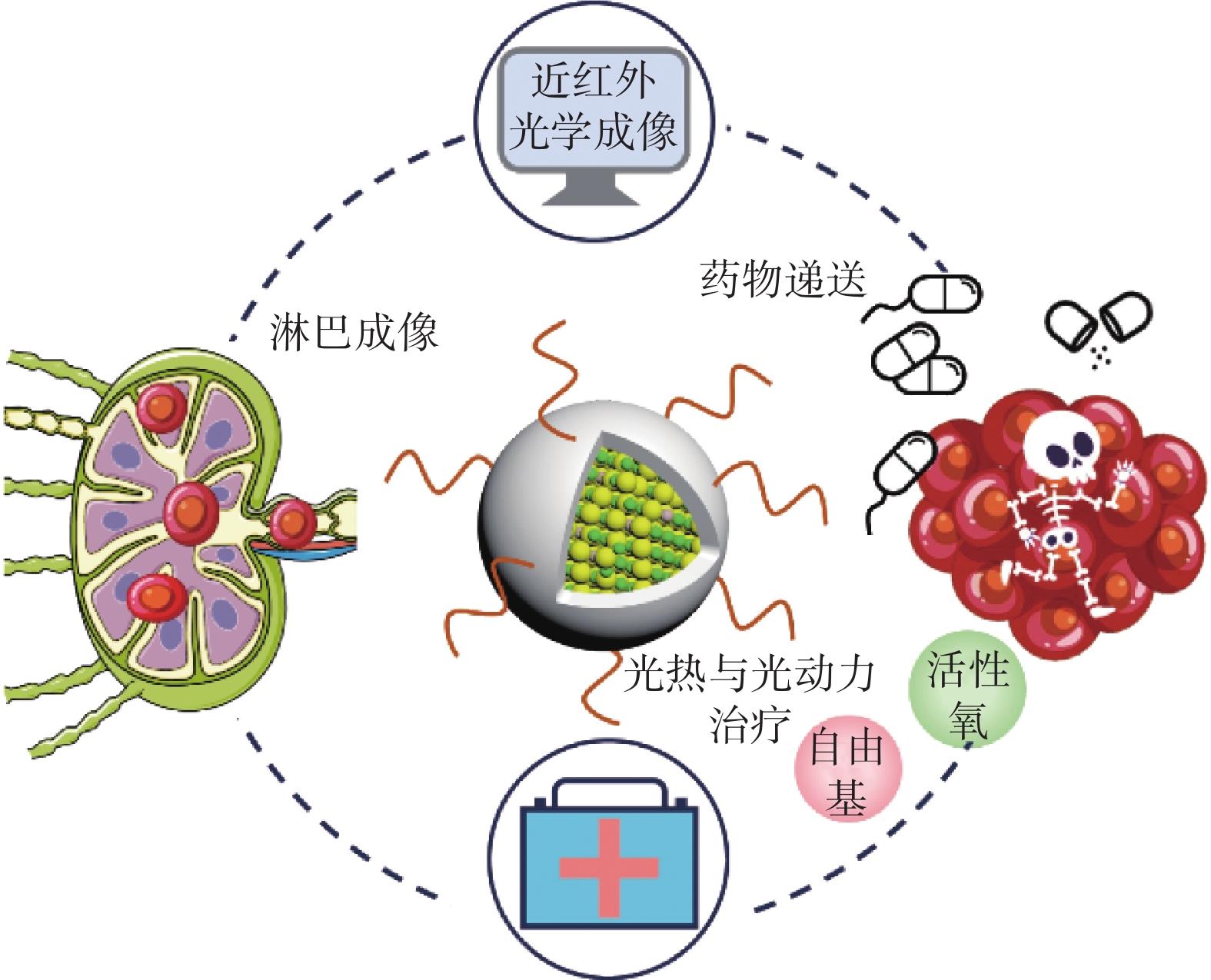 圖1
近紅外無鎘量子點在腫瘤在體成像和治療中的應用
Figure1.
Near-infrared cadmium-free quantum dots for tumor imaging in vivo and therapy
圖1
近紅外無鎘量子點在腫瘤在體成像和治療中的應用
Figure1.
Near-infrared cadmium-free quantum dots for tumor imaging in vivo and therapy
2.1 近紅外無鎘量子點用于腫瘤早期診斷
惡性腫瘤的早期診斷是臨床的迫切需求。傳統的影像學方法,如計算機斷層掃描和磁共振成像,受制于成像靈敏度,在微小腫瘤的早期鑒別診斷方面,仍然存在重大挑戰[26-28]。近年來發展的近紅外光學成像技術,可為生物學和醫學研究提供精確的生理和病理過程相關影像信息。在這種情況下,銅或銀基量子點具有高熒光量子產率、低生物毒性、耐光漂白和豐富的表面化學成分,使其在腫瘤近紅外光學成像方面顯示出巨大潛力。例如,Lian等[28]通過改變硒和銦元素比例得到了發射峰位在920~1 224 nm可調的CuInSe2量子點,通過外延生長ZnS殼層,獲得了發光峰位在1 070 nm處的量子點,其熒光量子產率高達21.8%,并將量子點用于荷瘤小鼠的腫瘤成像,經統計,成像信噪比為5.8,顯示了近紅外二區發光的CuInSe2量子點在癌癥診斷和成像引導手術治療領域的巨大潛力。Lee等[29]開發了一種ZnS包覆CuInS2(CuInS2@ZnS)的核殼型近紅外發光量子點。將其與聚乙二醇混合后,在含有人血清白蛋白的水溶液中乳化,并進一步修飾葉酸分子,最終成功得到包含CuInS2量子點的腫瘤靶向納米膠囊。在體成像實驗表明,納米膠囊經裸鼠尾靜脈注射后,可以成功實現腫瘤的靶向成像。該項研究有力地證實了使用不含重金屬的CuInS2@ZnS量子點進行全身腫瘤成像是一種很有前景的在體腫瘤診斷方法。
由此可見,與可見光區相比,基于Ⅰ-Ⅲ-Ⅵ族量子點的近紅外成像由于大大減少了自身熒光和光散射,具有更深的組織穿透和更高的時空分辨率,為癌癥的早期診斷提供了有效的生物信息,有望在未來生物醫學的發展中發揮至關重要的作用,但基于近紅外二區的成像靈敏度尚需進一步提高。
2.2 近紅外無鎘量子點用于淋巴成像
除了對實體瘤本身成像,腫瘤前哨淋巴結的熒光標記對于監測癌癥的病情發展具有十分重要的作用。通過腫瘤前哨淋巴的成像,可以有效獲知腫瘤轉移的相關信息,為癌癥的診斷、治療和預后提供重要指導[30-32]。
腫瘤細胞隨淋巴管遷移是腫瘤轉移的主要途徑,表面帶負電荷的納米材料能夠迅速聚集在淋巴結中并保持良好的穩定性。例如,Pons等[33]制備了CuInS2@ZnS核殼型量子點,并利用聚乙二醇進行表面修飾使其具有較好的生物相容性,將量子點皮下注射到小鼠體內15 min后,清晰顯示出小鼠右側腋窩淋巴結對應的近紅外圖像,且該量子點在淋巴區域熒光信號保持長達7 d,可進一步用于小鼠轉移性乳腺癌前哨淋巴結成像。Sun等[34]報道了ZnS包覆AgInS2(AgInS2@ZnS)量子點,在小鼠皮下注射AgInS2@ZnS量子點10 min后,AgInS2@ZnS量子點快速有效地遷移到腫瘤引流淋巴結,完成腫瘤引流淋巴結顯像,成為在體腫瘤引流淋巴結的高性能造影劑。
前期研究工作表明,Ⅰ-Ⅲ-Ⅵ族量子點具有腫瘤引流淋巴結成像的巨大潛力,腫瘤引流淋巴結成像對于腫瘤外科手術至關重要,前哨淋巴結的完整切除可以在很大程度上預防和延遲病情的復發。但目前基于近紅外發光量子點的相關報道較少,希望在未來的研究工作中能夠開發更多用于淋巴成像的高質量量子點熒光探針。
2.3 近紅外無鎘量子點用于藥物遞送
如何實現抗癌藥物的生物利用率并降低其副作用,一直是臨床癌癥治療的一大挑戰[35-38]。量子點具有豐富的表面化學性質,能夠連接不同功能的治療劑;此外,量子點的高穩定性會延長其在生物體內的循環時間,并且通過耦聯靶向分子(如核酸適體、抗體和葉酸)可以使量子點具有特異性結合癌細胞的能力;因此,基于熒光量子點能夠實現藥物的可視化遞送。例如,Wu等[39]報道了一種由量子點和抗癌藥物組成的雙功能納米材料,通過表面修飾兩親性聚合物獲得了具有生物相容性的AgInS2@ZnS量子點,并將抗癌藥物甲氨蝶呤共價耦聯到量子點表面。激光共聚焦熒光顯微成像結果顯示,與甲氨蝶呤共軛的AgInS2@ZnS量子點能被宮頸癌細胞有效內吞。此外,這種納米材料對癌細胞具有劑量依賴性的抗增殖作用。因此,與甲氨蝶呤共軛的AgInS2@ZnS量子點可能是未來癌癥診斷和治療的新型候選材料。Akbarzadeh等[40]開發了一種可以用于熒光/磁共振雙模態成像的ZnS包覆釓鋅銅銦硒(Gd-Zn-Cu-In-S@ZnS)量子點,將阿霉素負載至量子點表面修飾的二氧化硅孔中,并將上皮細胞黏附分子(epithelial cell adhesion molecule,EpCAM)耦聯在納米顆粒的表面使其具有腫瘤靶向性。經尾靜脈注射,上述載藥量子點可成功實現乳腺癌荷瘤小鼠的可視化治療,有效抑制腫瘤的生長。
上述研究工作表明,量子點與治療藥物的聯合使用能夠實現在生物體內特定部位遞送和釋放藥物。在此基礎上,應進一步探索更有效的給藥方式、保持藥物生物活性的方法以及增強疾病靶向效率的策略,實現在提高藥物療效的同時降低用藥劑量,減少副作用。
2.4 近紅外無鎘量子點用于光熱和光動力治療
光熱和光動力治療具有無創和副作用少等優點。光熱治療是在外部光源(一般是近紅外光)的照射下將光能轉化為熱能來殺死癌細胞的一種治療方法;光動力治療是利用進入組織中的光敏劑,在特定波長的激發下,可以將三線態氧分子轉變為活性氧(如單線態氧、羥基自由基、過氧化物),從而導致惡性腫瘤細胞死亡的一種治療方法[41-44]。
量子點在光激發后,其激發態電子的輻射躍遷可以用于腫瘤成像,而非輻射躍遷可以產生熱或活性氧,用于腫瘤的光熱/光動力治療。例如,Lv等[45]開發了一種可以用于診療一體化的CuInS2量子點,使用單波長激光照射,可同時實現腫瘤的光學成像及光熱/光動力協同治療。Li等[13]成功開發了近紅外二區發光的Mn摻雜CuInSe2@ZnS量子點,并在其表面修飾葉酸,構建腫瘤靶向探針。該探針不僅可以實現微小腫瘤的光學/磁共振雙模態診斷,還可以在近紅外光的照射下產生熱量及自由基,實現腫瘤的光熱/光動力/免疫聯合治療。
綜上所述,通過合理的設計,近紅外發光Ⅰ-Ⅲ-Ⅵ族量子點可同時具備腫瘤的成像及光熱/光動力治療能力,從而實現腫瘤的可視化治療。在這種情況下,應最大程度利用量子點對腫瘤的成像能力,深入研究治療中給藥劑量和光照時間對治療效果的影響,盡量降低光熱/光動力治療過程中對正常組織的損傷,從而獲得更好的治療效果。
3 總結與展望
在過去的十幾年中,新型近紅外熒光成像技術快速發展。各種新型近紅外熒光團已經被開發用于生物醫學研究,特別是癌癥的診斷與治療。Ⅰ-Ⅲ-Ⅵ族量子點由于生物毒性低、尺寸及化學組成依賴的近紅外發光特性,在腫瘤成像與治療方面具有廣闊的應用前景。針對在體應用,近紅外二區熒光具有深組織穿透、高時空分辨的特點而更有優勢。目前已有報道通過有機相方法合成了近紅外二區發光的Ⅰ-Ⅲ-Ⅵ族量子點,但普遍存在的問題是發光效率太低(通常在10%以下),因此仍需發展提高近紅外二區發光效率的新策略,例如構建界面應力小的核殼結構或者利用元素摻雜來增強發光,以實現高靈敏的在體成像。針對高通量可視化應用,Ⅰ-Ⅲ-Ⅵ族量子點普遍存在的問題是熒光峰展寬(通常>0.2 eV),因此基于多元量子點實現高通量檢測成像,窄化發光線寬是必須要解決的問題,可通過進一步研究量子點尺寸均一的控制方法和探索多元量子點的發光機制,來獲得窄發射的近紅外發光Ⅰ-Ⅲ-Ⅵ族量子點。在光學性能優化的基礎上,近紅外無鎘量子點最終可能實現高時空分辨成像和優越的成像深度,從而有希望在臨床上提供無創熒光成像診斷及成像引導的腫瘤治療。為了賦予量子點高特異性,利用靶向片段對量子點進行表面功能化,有可能為微小腫瘤的早期診斷或腫瘤微環境的分子診斷開辟新機遇,從而改善癌癥治療效果及預后。綜上所述,基于近紅外無鎘量子點發展先進的診療技術必將有利于腫瘤的無創早期診斷和后續治療效果的實時可視化監測。
重要聲明
利益沖突聲明:本文全體作者均聲明不存在利益沖突。
作者貢獻聲明:李曉琪負責提出論文主題及文章內容撰寫;孫曉和林華負責文獻查閱、研讀;張沛森負責為文章提供批判性修訂;焦明霞和張霓負責提出文章的設計思路及文章的審閱和修改工作。
0 引言
目前,癌癥依然是危害人類健康的重大疾病之一。根據世界衛生組織國際癌癥研究機構數據顯示,2022年全球新增癌癥病例數達到2 000萬例,死亡970萬病例。盡管在過去的幾十年里,腫瘤的診斷和治療方法取得了一些進展,但總體治愈率的提高并不顯著[1]。基于上述現狀,應加大對癌癥篩查與早診早治工作的投入,在健康體檢方面對癌癥篩查重點關注,同時促進癌癥治療新技術、新方法的推廣應用[2]。為了滿足上述要求,現已發展了磁共振成像、計算機斷層掃描、超聲成像、正電子發射斷層掃描、單光子發射計算機斷層掃描等多種成像技術并應用于腫瘤診斷以及治療評估。其中,磁共振成像和計算機斷層掃描具有較高的時空分辨率,但是靈敏度較低;超聲成像具有無創、無輻射和實時動態等優點,但組織分辨率較低;正電子發射斷層掃描和單光子發射計算機斷層掃描可以高靈敏監測和定量分析生命代謝活動,但它們仍然存在低空間分辨率的問題,且昂貴的檢查費用限制了其在臨床醫學成像應用中的普及[3]。除了這些傳統的成像方式外,熒光成像技術因具有實時反饋、多信號采集、高靈敏度以及無電離輻射等特性而備受關注。然而,在可見光區(400~700 nm)的熒光成像,只有幾毫米的組織穿透深度,極大地影響了其在動物研究和臨床實踐中的應用。近十年來,近紅外光區(近紅外一區:700~1 000 nm、近紅外二區:1 000~1 700 nm)熒光成像由于光吸收和散射的顯著降低以及可忽略不計的組織自身熒光,大大提高了組織穿透性和時空分辨率[4],因此有望成為下一代在體成像技術。這種成像技術與生物醫學應用之間的結合,將為癌癥的早期診斷和治療提供新的技術支持。
量子點,是一類極具應用前景的新型納米材料,為醫學診斷和治療研究帶來了新的思路[5]。量子點也被稱為半導體納米晶,具有獨特的光學和電學特性[6-7]。與傳統的有機染料相比,量子點由于其高穩定性、可調的光學性質而受到了廣泛關注[8]。當量子點的尺寸小于或與激子玻爾半徑相當時,就會發生量子限域。少量原子的增加或減少引起量子點尺寸的變化,從而改變帶隙,因此量子點的發光可覆蓋可見光區至近紅外光區[9];且尺寸相關的光學特性使其在生物成像、成像引導的疾病治療、太陽能電池和發光二極管等方面得到了廣泛應用。目前,二元量子點發展相對成熟,包括:Ⅱ-Ⅵ族硒化鎘(CdSe)和硫化鎘(CdS)、III-V族砷化銦(InAs)和磷化銦(InP)、Ⅳ-Ⅵ族硫化鉛(PbS)和碲化鉛(PbTe)等,具有較好的發光性能[10]。例如,孫靜文等[11]采用陽離子交換法合成了硫化鎘包覆硫化鉛(PbS@CdS)的核殼型量子點,通過在量子點表面進行聚乙二醇修飾,提高了其在水溶液中的穩定性,熒光發射峰為1 550 nm,熒光量子產率為7.2%。房詩玉等[12]制備了單分散的碲化鎘(CdTe)量子點,通過汞離子(Hg2+)交換實現了碲鎘汞(HgxCd1-xTe)量子點的發射光譜在可見光區至近紅外光區可調。然而,上述量子點材料本身或其殼層材料通常含有鎘和鉛等高毒性重金屬元素,限制了它們在生物醫學領域的應用,因此有必要開發不含高毒性重金屬元素的生物相容性量子點。
Ⅰ-Ⅲ-Ⅵ族量子點與傳統的Ⅱ-Ⅵ族和Ⅳ-Ⅵ族量子點相比,不含鎘、鉛和汞等高毒性重金屬元素。此外,Ⅰ-Ⅲ-Ⅵ族量子點的光學性質可以通過改變化學組成來調節,使其發射峰位在可見光區到近紅外光區可調。例如,Li等[13]使用熱注射法合成了發射峰位在956~1 224 nm的銅銦硒(CuInSe2)量子點,在荷瘤小鼠的近紅外二區在體成像中,能夠清晰地描繪微小腫瘤邊界。Liu等[14]通過改變鋅(Zn)和銅的摩爾比,合成了發射峰位在630~800 nm可調的鋅銅銦硒(Zn-Cu-In-Se)量子點,并以此構建了靶向多種腫瘤標志物的納米探針,成功應用于腫瘤標志物的高通量檢測。此外,該量子點還具有較寬的激發光譜,為生物成像激發光源的選擇提供了很大的靈活性。由此可見,Ⅰ-Ⅲ-Ⅵ族量子點優異的近紅外光學特性和較好的生物相容性,使其在腫瘤成像和治療方面具有極大的應用潛力。
1 近紅外無鎘量子點的合成及發光調控
Ⅰ-Ⅲ-Ⅵ族量子點,不含高毒性重金屬元素,已經成為傳統Ⅱ-Ⅵ族和Ⅳ-Ⅵ族量子點的有效替代品[15]。二元量子點的光學性質依賴于顆粒尺寸,而三元量子點的光學性質不僅依賴于顆粒尺寸,還與化學組成密切相關,可以通過改變化學組成為量子點熒光發射范圍的調節提供靈活性[16]。高亮的光致發光和較高的生物安全性是將量子點應用于生物醫學領域所必需的條件。因此,本文綜述了近年來通過有機相和水相方法合成高性能Ⅰ-Ⅲ-Ⅵ族無鎘量子點的研究進展,對比討論了兩種方法的優缺點,并介紹了近紅外發光性能的調控策略,以期為實現無鎘量子點的生物醫學應用奠定基礎。
1.1 Ⅰ-Ⅲ-Ⅵ 族量子點的有機相合成
高熒光量子產率是量子點實際應用的關鍵,可實現高靈敏的生物成像。但是,在近紅外光區,Ⅰ-Ⅲ-Ⅵ族量子點的熒光量子產率遠遠落后于Ⅱ-Ⅵ和Ⅳ-Ⅵ族量子點,大多數近紅外發光CuInSe2量子點的熒光量子產率不到10%。通過有機相方法合成量子點,高溫反應有利于提高納米晶體結晶度,并利用元素Zn合金化或外延生長寬帶隙硫化鋅(ZnS)殼層,可以提高CuInSe2量子點的熒光量子產率[17]。例如,McHugh等[18]以1-十八烯和1-十二烷基硫醇為共溶劑,在CuInSe2量子點表面外延生長ZnS殼層(CuInSe2@ZnS)過程中,其熒光量子產率從16.2%增長至43.6%,發射峰位從964 nm藍移至891 nm。Li等[13]開發了一種磁性錳(Mn)元素摻雜的ZnS包覆CuInSe2(CuInSe2@ZnS:Mn)的核殼型量子點,通過對生長動力學控制,最終得到了發射峰位在956~1 224 nm可調的量子點,最高熒光量子產率達到31.2%。Langevin等[19]通過陰離子交換得到了球形、金字塔形或棱柱形銀銦硒(AgInSe2)量子點,熒光發射范圍覆蓋800~1 300 nm,熒光量子產率最高可達21%。Ning等[20]通過在CuInSe2量子點上生長多層銅銦鋅硫硒(CuInZnS2-xSex)殼層,得到了熒光發射峰位在834~1 028 nm可調的量子點,且發光峰位在920 nm的量子點其熒光量子產率可以達到20%。廉緯等[21]采用離子交換法合成了近紅外發光AgInSe2量子點。通過調節Ag/In投料比控制離子交換程度,可實現量子點發射峰位在650~791 nm可調,最高熒光量子產率高達42.5%,實現了基于近紅外發光量子點探針的腫瘤細胞靶向成像,展示出AgInSe2量子點在生物成像方面的應用潛力。
大多數有機相合成的Ⅰ-Ⅲ-Ⅵ族量子點通過調控化學組成和構筑核殼結構,可在近紅外光區實現高亮的光致發光。但是,有機相合成中通常需要使用昂貴或有害的有機試劑,且大多數反應需要苛刻的反應條件(如惰性氣氛和高溫)[22],因此成本高、環境不友好且反應不易于控制。此外,在生物應用中,有機相制備的量子點需要通過相轉移或表面修飾來改變其疏水性,才能進一步應用于生物體系中。然而,相轉移不可避免地導致量子點的熒光量子產率和穩定性下降,同時繁瑣的配體交換過程不利于大規模低成本制備量子點,因此面向生物醫學應用,需開發可直接獲得生物相容性材料的有效途徑。
1.2 Ⅰ-Ⅲ-Ⅵ族量子點的水相合成
水相合成是獲得生物相容性納米材料的直接途徑。目前,已經有通過水相合成法成功制備CuInSe2量子點的報道。然而,這些量子點的熒光量子產率較低(< 5%),并且熒光發射峰位很難達到近紅外光區[23]。與有機相合成相比,水相合成所使用的反應溫度大大降低,因此,在量子點表面和晶格內引入了更多的缺陷,這將嚴重限制輻射復合,從而導致熒光量子產率的降低。由于多種金屬前驅體(陽離子)對陰離子的親和力不同,必須通過多種配體與金屬離子的配位來精確控制其反應活性、化學組成和光學性質。例如,Liu等[14]開發了一種簡單的水相合成法,以谷胱甘肽和檸檬酸鈉為雙配體分別平衡金屬離子的反應活性,直接制備了水溶性的合金化Zn-Cu-In-Se量子點,通過改變Zn和Cu的摩爾比,并通過激子復合動力學控制,實現了量子點熒光發射波長在630~800 nm范圍內的連續可調變,通過外延生長ZnS殼層,熒光量子產率達到25.8%;并且基于近紅外發光可調、發光效率高且生物相容性優異的量子點,結合表面耦聯核酸適配體分子構建了靶向兩種腫瘤標志物的雙色量子點探針,實現了對腫瘤細胞內不同靶標的選擇性識別和高通量熒光標記。Yang等[23]發展了一種簡便、綠色的水相合成方法,通過在Zn-Cu-In-Se量子點表面外延生長ZnS殼層的過程中原位摻雜順磁性錳離子(Mn2+),降低了磁性摻雜對量子點發光中心的影響,有效平衡了光學和磁學性能,得到了核殼型量子點(Zn-Cu-In-Se@ZnS:Mn);其所制備的水相順磁性量子點(發光峰位約780 nm)的熒光量子產率可達18.9%,同時摻雜的Mn2+有利于提高量子點與周圍水分子的自旋—質子偶極相互作用,從而賦予其優異的T1/T2雙模態磁共振對比增強效應,摩爾縱向弛豫率r1和橫向弛豫率r2分別為4.7、57.6 mM-1·s-1;基于此,實現了在體腫瘤的多通道近紅外光學成像以及小鼠腦的多參數磁共振成像。
總而言之,利用綠色、簡便的水相合成法可以直接獲得具有較高生物相容性的量子點,但熒光量子產率相比于有機相合成的量子點較低,且直接水相合成近紅外二區發光的Ⅰ-Ⅲ-Ⅵ族量子點還尚未報道。因此,利用水相合成法得到高質量的近紅外發光Ⅰ-Ⅲ-Ⅵ族量子點仍然具有挑戰性。
2 近紅外無鎘量子點用于腫瘤在體成像和治療
迄今為止,癌癥仍然是對人類健康最具威脅性的疾病之一。近年來,基于納米材料的熒光成像技術作為癌癥診斷和成像引導治療的有力手段,引起了廣泛關注[24]。由于Ⅰ-Ⅲ-Ⅵ族量子點具有較好的生物相容性、發射范圍在近紅外光區可調、近紅外光區吸收范圍廣等優勢,使其在腫瘤成像和治療研究中具有極大前景[25]。在此,本文綜述了Ⅰ-Ⅲ-Ⅵ族量子點在腫瘤早期診斷、淋巴成像、藥物遞送、光熱和光動力治療方面的代表性研究,如圖1所示;并對代表性Ⅰ-Ⅲ-Ⅵ族量子點的合成策略、光學性質及其醫學應用進行總結,如表1所示。
 圖1
近紅外無鎘量子點在腫瘤在體成像和治療中的應用
Figure1.
Near-infrared cadmium-free quantum dots for tumor imaging in vivo and therapy
圖1
近紅外無鎘量子點在腫瘤在體成像和治療中的應用
Figure1.
Near-infrared cadmium-free quantum dots for tumor imaging in vivo and therapy
2.1 近紅外無鎘量子點用于腫瘤早期診斷
惡性腫瘤的早期診斷是臨床的迫切需求。傳統的影像學方法,如計算機斷層掃描和磁共振成像,受制于成像靈敏度,在微小腫瘤的早期鑒別診斷方面,仍然存在重大挑戰[26-28]。近年來發展的近紅外光學成像技術,可為生物學和醫學研究提供精確的生理和病理過程相關影像信息。在這種情況下,銅或銀基量子點具有高熒光量子產率、低生物毒性、耐光漂白和豐富的表面化學成分,使其在腫瘤近紅外光學成像方面顯示出巨大潛力。例如,Lian等[28]通過改變硒和銦元素比例得到了發射峰位在920~1 224 nm可調的CuInSe2量子點,通過外延生長ZnS殼層,獲得了發光峰位在1 070 nm處的量子點,其熒光量子產率高達21.8%,并將量子點用于荷瘤小鼠的腫瘤成像,經統計,成像信噪比為5.8,顯示了近紅外二區發光的CuInSe2量子點在癌癥診斷和成像引導手術治療領域的巨大潛力。Lee等[29]開發了一種ZnS包覆CuInS2(CuInS2@ZnS)的核殼型近紅外發光量子點。將其與聚乙二醇混合后,在含有人血清白蛋白的水溶液中乳化,并進一步修飾葉酸分子,最終成功得到包含CuInS2量子點的腫瘤靶向納米膠囊。在體成像實驗表明,納米膠囊經裸鼠尾靜脈注射后,可以成功實現腫瘤的靶向成像。該項研究有力地證實了使用不含重金屬的CuInS2@ZnS量子點進行全身腫瘤成像是一種很有前景的在體腫瘤診斷方法。
由此可見,與可見光區相比,基于Ⅰ-Ⅲ-Ⅵ族量子點的近紅外成像由于大大減少了自身熒光和光散射,具有更深的組織穿透和更高的時空分辨率,為癌癥的早期診斷提供了有效的生物信息,有望在未來生物醫學的發展中發揮至關重要的作用,但基于近紅外二區的成像靈敏度尚需進一步提高。
2.2 近紅外無鎘量子點用于淋巴成像
除了對實體瘤本身成像,腫瘤前哨淋巴結的熒光標記對于監測癌癥的病情發展具有十分重要的作用。通過腫瘤前哨淋巴的成像,可以有效獲知腫瘤轉移的相關信息,為癌癥的診斷、治療和預后提供重要指導[30-32]。
腫瘤細胞隨淋巴管遷移是腫瘤轉移的主要途徑,表面帶負電荷的納米材料能夠迅速聚集在淋巴結中并保持良好的穩定性。例如,Pons等[33]制備了CuInS2@ZnS核殼型量子點,并利用聚乙二醇進行表面修飾使其具有較好的生物相容性,將量子點皮下注射到小鼠體內15 min后,清晰顯示出小鼠右側腋窩淋巴結對應的近紅外圖像,且該量子點在淋巴區域熒光信號保持長達7 d,可進一步用于小鼠轉移性乳腺癌前哨淋巴結成像。Sun等[34]報道了ZnS包覆AgInS2(AgInS2@ZnS)量子點,在小鼠皮下注射AgInS2@ZnS量子點10 min后,AgInS2@ZnS量子點快速有效地遷移到腫瘤引流淋巴結,完成腫瘤引流淋巴結顯像,成為在體腫瘤引流淋巴結的高性能造影劑。
前期研究工作表明,Ⅰ-Ⅲ-Ⅵ族量子點具有腫瘤引流淋巴結成像的巨大潛力,腫瘤引流淋巴結成像對于腫瘤外科手術至關重要,前哨淋巴結的完整切除可以在很大程度上預防和延遲病情的復發。但目前基于近紅外發光量子點的相關報道較少,希望在未來的研究工作中能夠開發更多用于淋巴成像的高質量量子點熒光探針。
2.3 近紅外無鎘量子點用于藥物遞送
如何實現抗癌藥物的生物利用率并降低其副作用,一直是臨床癌癥治療的一大挑戰[35-38]。量子點具有豐富的表面化學性質,能夠連接不同功能的治療劑;此外,量子點的高穩定性會延長其在生物體內的循環時間,并且通過耦聯靶向分子(如核酸適體、抗體和葉酸)可以使量子點具有特異性結合癌細胞的能力;因此,基于熒光量子點能夠實現藥物的可視化遞送。例如,Wu等[39]報道了一種由量子點和抗癌藥物組成的雙功能納米材料,通過表面修飾兩親性聚合物獲得了具有生物相容性的AgInS2@ZnS量子點,并將抗癌藥物甲氨蝶呤共價耦聯到量子點表面。激光共聚焦熒光顯微成像結果顯示,與甲氨蝶呤共軛的AgInS2@ZnS量子點能被宮頸癌細胞有效內吞。此外,這種納米材料對癌細胞具有劑量依賴性的抗增殖作用。因此,與甲氨蝶呤共軛的AgInS2@ZnS量子點可能是未來癌癥診斷和治療的新型候選材料。Akbarzadeh等[40]開發了一種可以用于熒光/磁共振雙模態成像的ZnS包覆釓鋅銅銦硒(Gd-Zn-Cu-In-S@ZnS)量子點,將阿霉素負載至量子點表面修飾的二氧化硅孔中,并將上皮細胞黏附分子(epithelial cell adhesion molecule,EpCAM)耦聯在納米顆粒的表面使其具有腫瘤靶向性。經尾靜脈注射,上述載藥量子點可成功實現乳腺癌荷瘤小鼠的可視化治療,有效抑制腫瘤的生長。
上述研究工作表明,量子點與治療藥物的聯合使用能夠實現在生物體內特定部位遞送和釋放藥物。在此基礎上,應進一步探索更有效的給藥方式、保持藥物生物活性的方法以及增強疾病靶向效率的策略,實現在提高藥物療效的同時降低用藥劑量,減少副作用。
2.4 近紅外無鎘量子點用于光熱和光動力治療
光熱和光動力治療具有無創和副作用少等優點。光熱治療是在外部光源(一般是近紅外光)的照射下將光能轉化為熱能來殺死癌細胞的一種治療方法;光動力治療是利用進入組織中的光敏劑,在特定波長的激發下,可以將三線態氧分子轉變為活性氧(如單線態氧、羥基自由基、過氧化物),從而導致惡性腫瘤細胞死亡的一種治療方法[41-44]。
量子點在光激發后,其激發態電子的輻射躍遷可以用于腫瘤成像,而非輻射躍遷可以產生熱或活性氧,用于腫瘤的光熱/光動力治療。例如,Lv等[45]開發了一種可以用于診療一體化的CuInS2量子點,使用單波長激光照射,可同時實現腫瘤的光學成像及光熱/光動力協同治療。Li等[13]成功開發了近紅外二區發光的Mn摻雜CuInSe2@ZnS量子點,并在其表面修飾葉酸,構建腫瘤靶向探針。該探針不僅可以實現微小腫瘤的光學/磁共振雙模態診斷,還可以在近紅外光的照射下產生熱量及自由基,實現腫瘤的光熱/光動力/免疫聯合治療。
綜上所述,通過合理的設計,近紅外發光Ⅰ-Ⅲ-Ⅵ族量子點可同時具備腫瘤的成像及光熱/光動力治療能力,從而實現腫瘤的可視化治療。在這種情況下,應最大程度利用量子點對腫瘤的成像能力,深入研究治療中給藥劑量和光照時間對治療效果的影響,盡量降低光熱/光動力治療過程中對正常組織的損傷,從而獲得更好的治療效果。
3 總結與展望
在過去的十幾年中,新型近紅外熒光成像技術快速發展。各種新型近紅外熒光團已經被開發用于生物醫學研究,特別是癌癥的診斷與治療。Ⅰ-Ⅲ-Ⅵ族量子點由于生物毒性低、尺寸及化學組成依賴的近紅外發光特性,在腫瘤成像與治療方面具有廣闊的應用前景。針對在體應用,近紅外二區熒光具有深組織穿透、高時空分辨的特點而更有優勢。目前已有報道通過有機相方法合成了近紅外二區發光的Ⅰ-Ⅲ-Ⅵ族量子點,但普遍存在的問題是發光效率太低(通常在10%以下),因此仍需發展提高近紅外二區發光效率的新策略,例如構建界面應力小的核殼結構或者利用元素摻雜來增強發光,以實現高靈敏的在體成像。針對高通量可視化應用,Ⅰ-Ⅲ-Ⅵ族量子點普遍存在的問題是熒光峰展寬(通常>0.2 eV),因此基于多元量子點實現高通量檢測成像,窄化發光線寬是必須要解決的問題,可通過進一步研究量子點尺寸均一的控制方法和探索多元量子點的發光機制,來獲得窄發射的近紅外發光Ⅰ-Ⅲ-Ⅵ族量子點。在光學性能優化的基礎上,近紅外無鎘量子點最終可能實現高時空分辨成像和優越的成像深度,從而有希望在臨床上提供無創熒光成像診斷及成像引導的腫瘤治療。為了賦予量子點高特異性,利用靶向片段對量子點進行表面功能化,有可能為微小腫瘤的早期診斷或腫瘤微環境的分子診斷開辟新機遇,從而改善癌癥治療效果及預后。綜上所述,基于近紅外無鎘量子點發展先進的診療技術必將有利于腫瘤的無創早期診斷和后續治療效果的實時可視化監測。
重要聲明
利益沖突聲明:本文全體作者均聲明不存在利益沖突。
作者貢獻聲明:李曉琪負責提出論文主題及文章內容撰寫;孫曉和林華負責文獻查閱、研讀;張沛森負責為文章提供批判性修訂;焦明霞和張霓負責提出文章的設計思路及文章的審閱和修改工作。