嗅球是編碼和處理嗅覺信號的關鍵部位,具有非常復雜的加工和處理嗅覺信號的神經投射和神經網絡。來自嗅皮質和其他高級腦區的下行神經投射可直接或間接調控嗅球輸出神經元的興奮性,進而影響嗅覺分辨、學習等能力。隨著近年光遺傳技術的應用,操控神經元在神經環路的研究中應用廣泛,大大推進了嗅覺機制的研究進展。本文總結了來自嗅皮質、基底前腦、中縫核以及藍斑的神經投射對嗅球功能的調控作用的最新研究進展,評述了光遺傳技術在嗅覺機制研究中的重要作用,并對當前研究中存在的問題以及未來的發展趨勢進行了初步闡述,本文可為嗅覺神經調控機制的研究及光遺傳技術的應用提供新的視角,對于推動嗅覺機制的研究和光遺傳技術的應用具有重要意義。
引用本文: 周彤, 吳祎凡, 胡蒙, 唐欣, 朱平, 杜立萍, 吳春生. 光遺傳技術應用于高級腦區對嗅球的神經投射調控嗅覺信號處理的研究進展. 生物醫學工程學雜志, 2024, 41(6): 1265-1270. doi: 10.7507/1001-5515.202404009 復制
版權信息: ?四川大學華西醫院華西期刊社《生物醫學工程學雜志》版權所有,未經授權不得轉載、改編
0 引言
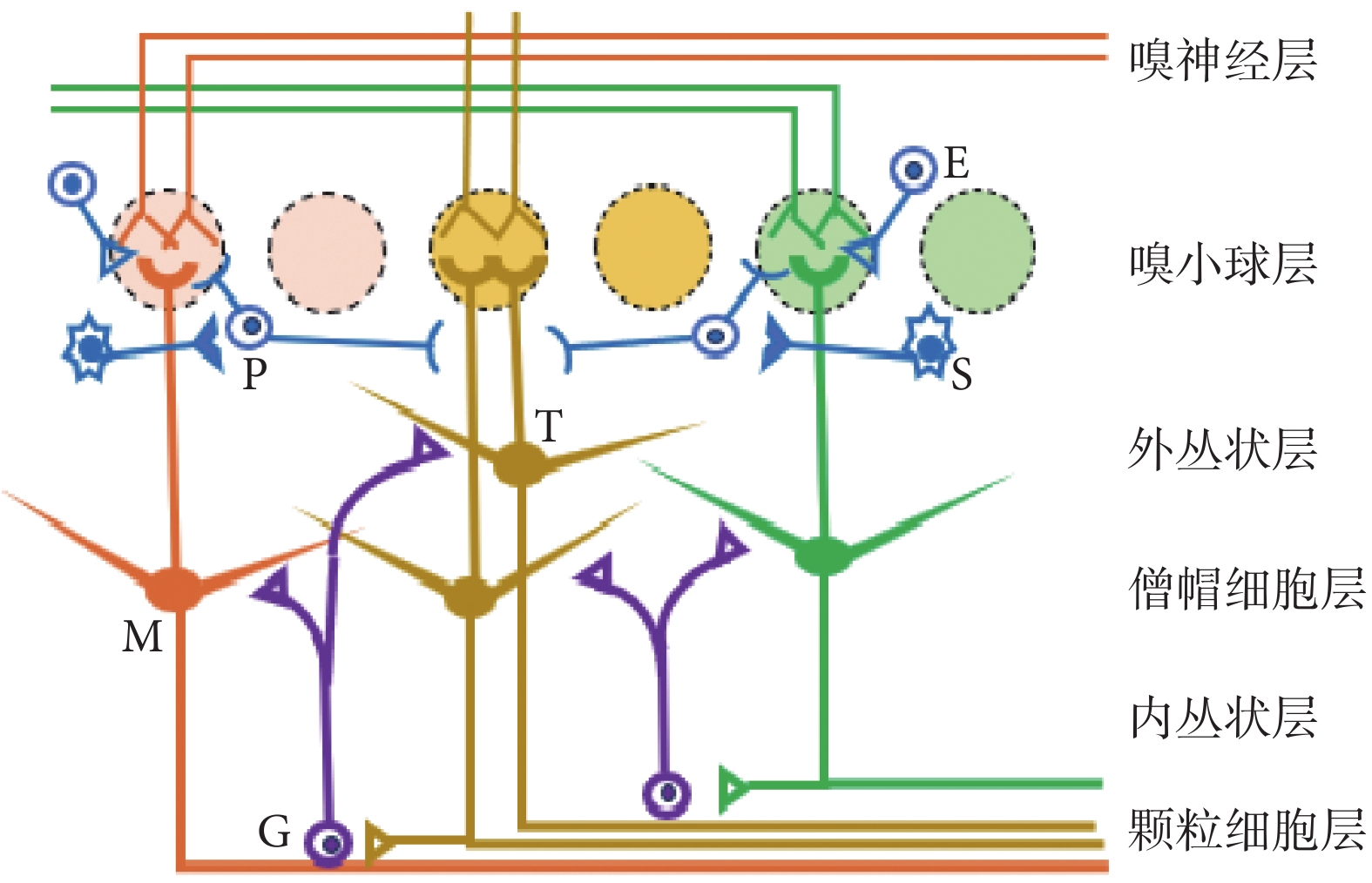
嗅覺是最基礎的生理感覺之一,是生物感知外界環境,進行覓食、交配、躲避天敵等多項生命活動的基礎。自然界中的氣味分子與嗅黏膜上皮中嗅感覺神經元纖毛上的嗅覺受體結合,該受體是一種G蛋白偶聯受體,與氣味分子結合后可以激活G蛋白,進而引發一系列的細胞內生物化學級聯反應,通過細胞內信號轉導通路,使神經元興奮并產生氣味響應信號[1]。嗅球是嗅覺通路的初級中樞和嗅覺信息處理的中轉站,呈層狀結構,如圖1所示。嗅球從外向內可分為6層,分別由嗅神經層 (olfactory nerve layer,ONL)、嗅小球層(glomerular layer,GL)、外叢狀層(external plexiform layer,EPL)、僧帽細胞層 (mitral cell layer,MCL)、內叢狀層(internal plexiform layer,IPL)和顆粒細胞層(granule cell layer,GCL)組成。不同顏色的嗅小球接受表達不同氣味受體的嗅感覺神經元的輸入。不同顏色的僧帽細胞和簇狀細胞與相應的嗅小球連接,其軸突投射向嗅皮層。圖1中,M代表僧帽細胞,T代表簇狀細胞,S代表短軸突細胞,E代表外側簇狀細胞,P代表球旁細胞,G代表顆粒細胞。嗅感覺神經元通過神經脈沖將嗅覺信息傳遞至嗅球,于嗅小球層與僧帽細胞和簇狀細胞形成突觸聯系,并由這些嗅球輸出神經元的軸突繼續傳遞至前嗅核、嗅結節、梨狀皮質等高級嗅覺中樞進行進一步整合,從而形成嗅覺感知。
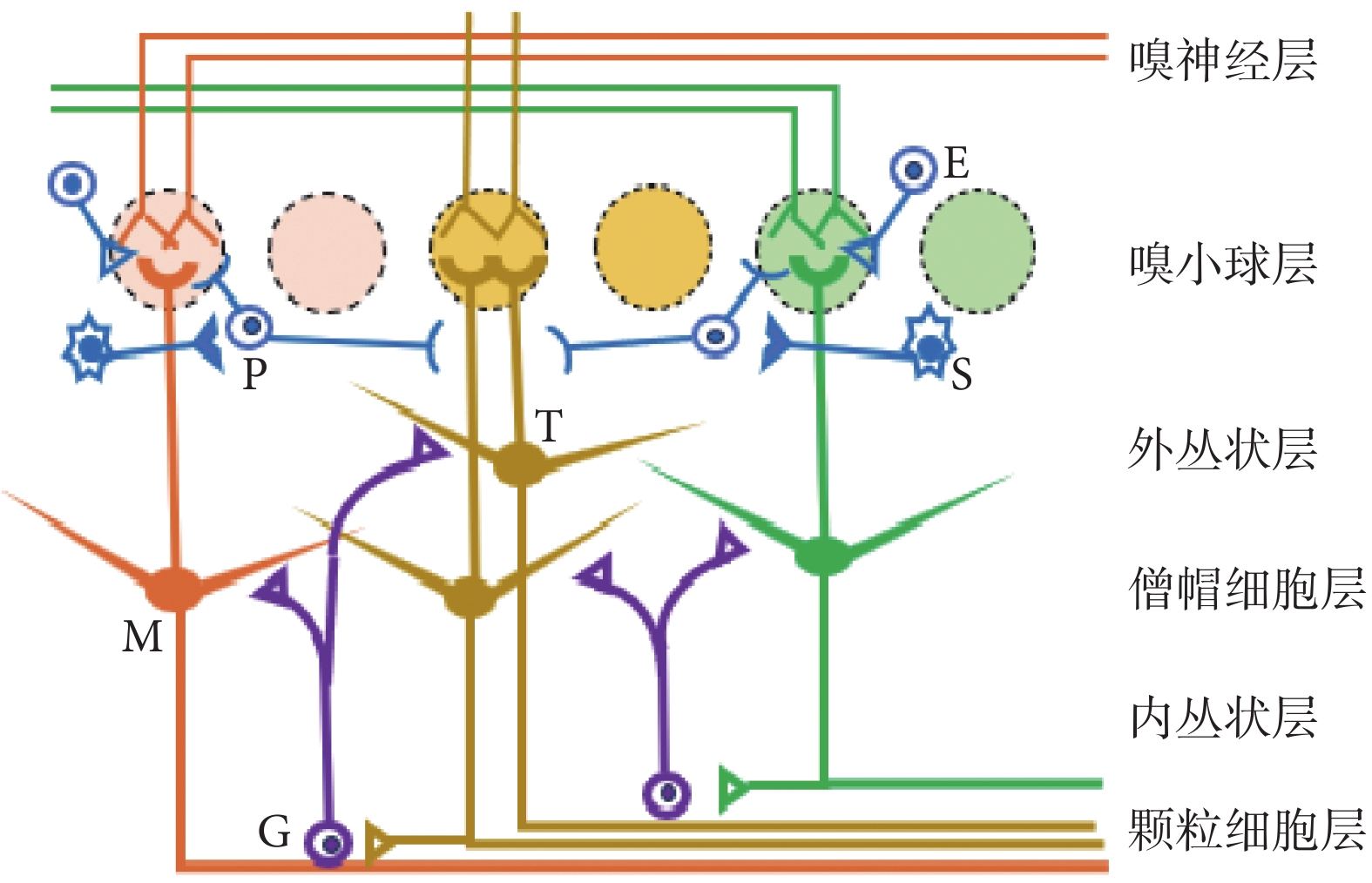 圖1
嗅球層狀結構示意圖
Figure1.
The layer structure of olfactory bulb
圖1
嗅球層狀結構示意圖
Figure1.
The layer structure of olfactory bulb
嗅覺信號在傳遞過程中受到嗅球中多種神經微環路的調控,其中最常見的是顆粒細胞,其通常可直接與嗅球輸出神經元的胞體或樹突等形成突觸,發揮調控作用。除此之外,在嗅小球層,還分布著外側簇狀細胞、球旁細胞和短軸突細胞等近球神經元,這些近球神經元可直接影響嗅感覺神經元與僧帽/簇狀細胞間的突觸傳遞,從而構成嗅球的基本功能單位嗅小球。
嗅覺的形成機制復雜,這不僅僅是由下向上的逐級形成過程,也受到來自高級腦區自上向下的神經投射的調控作用。嗅球在初步處理加工嗅覺信息的過程中也受到大量來自高級中樞神經投射的調節,主要包括嗅皮質區域的下行神經投射,以及來自基底前腦、中縫背核和藍斑等處的神經投射。這些神經投射在嗅球中與嗅感覺神經、僧帽細胞和簇狀細胞以及多種中間神經元之間形成廣泛復雜的突觸聯系,進而能反饋性地對嗅覺信息的處理起調控作用[2]。最新的研究表明,下丘腦外側到嗅球也存在神經元投射[3]。
光遺傳技術是當前神經科學領域中一種快速發展的新工具,正被越來越多地應用于神經環路的研究中。正是由于光遺傳技術的強特異性、高精確性和可調控性,嗅覺發生及調控過程中的多個環節均有該技術方法的應用[4-6]。目前,已有相當多的研究選擇光刺激高級腦區至嗅球的下行神經元,觀察嗅球中各種類型細胞的電生理活動變化情況,從而分析其對嗅球處理加工氣味信息的潛在調控機制[7-8]。
1 嗅皮質對嗅球的神經投射
1.1 嗅皮質概述
嗅皮質是嗅覺形成的高級中樞,主要為由嗅球中僧帽細胞和簇狀細胞軸突所投射到的腦區[9]。這些輸出神經元的軸突離開嗅球后逐漸匯聚為嗅束,其背側、外側和內側皆覆蓋有薄層灰質[10]。前嗅核(the anterior olfactory nucleus,AON)由散在分布于嗅球尾端、嗅束間(內)、外側嗅回的細胞團組成,是接受嗅球輸出信息的第一站[11-13]。前嗅核神經元組成復雜,提示其能參與處理復雜的嗅覺等信息[11]。梨狀皮質接收來自外側嗅束的主要輸入,是最重要的嗅覺中樞。梨狀皮質是位于大腦腹外側的舊皮質區域,由3層結構組成:淺層神經元分布稀疏,主要可見外側嗅束的輸入纖維;中間層集中分布了大量谷氨酸能主要神經元;深層則有分布密度較低的主神經元;同時,少量γ-氨基丁酸(γ-aminobutyric acid,GABA)能神經元較為均勻地分布各層中。梨狀皮質與外側嗅束間的突觸聯系主要集中于淺層,而皮質內部連接以及來自其他區域的神經元則分布于較深層[14]。梨狀皮質分為前區和后區兩部分,前區主要接受來自嗅球和前嗅核的神經輸入,提示其與處理嗅覺信息密切相關;而后區功能復雜,有研究表明其在嗅覺學習過程中與相應氣味信息回憶的形成密切相關[12]。梨狀皮質中存在部分神經元可廣泛投射至多個腦區,包括嗅結節、眶額葉皮質以及外側內嗅皮質等,此類輸出神經元被稱為離皮質神經元,它們參與形成了復雜的嗅覺信息處理網絡,產生特定電信號參與生物體情緒、行為等調節[4, 15-16]。
1.2 離皮質神經投射對嗅球輸出神經元的調制效應
嗅皮質至嗅球的離皮質投射主要來自前嗅核和梨狀皮質。其中,前嗅核是嗅球所接受的反饋投射的最主要來源,且這類神經投射在嗅覺信號傳遞的早期過程中發揮負性調節作用。然而,來自前嗅核的神經投射對嗅球輸出神經元的抑制作用并非單一調制的結果,而是基于多種神經環路共同調制的綜合效應。一方面,此類投射神經元可以和僧帽細胞直接形成突觸并使后者短期內發生快速去極化;另一方面,此類投射神經元也通過“前嗅核神經元→顆粒細胞/嗅小球層中間神經元→僧帽細胞”途徑間接使僧帽細胞發生長期超極化,從而表現出對嗅球輸出神經元以抑制作用為主的雙重效應。
1.3 離皮質神經投射在嗅球中的作用靶點
離皮質神經反饋主要投射至同側和對側嗅球的顆粒細胞層和嗅小球層底部,但嗅小球層中的具體作用靶點尚不明確。目前在體和離體實驗均表明,這類投射主要作用于顆粒細胞[17],進而影響僧帽細胞和簇狀細胞。Mazo等[18-19]研究了前嗅皮質的下行投射神經元中GABA受體B型(GABA type-B receptor,GABABR)的特異性作用,光遺傳刺激配合其他電生理刺激記錄表明,GABABR的激活能抑制嗅皮質反饋投射對嗅球顆粒細胞的興奮性信號傳遞,進而減少其對僧帽細胞和簇狀細胞的抑制,但幾乎不影響神經投射對它們的直接興奮作用;且激活GABABR會抑制嗅球的自發β振蕩,但對θ振蕩無影響。由于來自嗅皮質的神經投射多為谷氨酸能神經元,傳統方法難以對其中其他類型的投射神經元(如GABA能神經投射)進行深入研究,而光遺傳學工具使得人們能精準操縱此類神經元,有利于深入理解嗅覺形成過程中的反饋調節。
1.4 離皮質神經投射參與嗅覺相關行為的調控
嗅覺等生理感覺與動物各種行為之間有緊密的聯系,其中涉及非常復雜的神經體液調節機制,也是目前研究的熱點之一。內源性大麻素系統涉及神經遞質傳遞、炎癥反應、學習與記憶等多種生理過程[20],在體實驗表明,來自嗅皮質的神經反饋對嗅球輸出神經元有抑制作用,但當光激活投射神經軸突末稍的Ⅰ型大麻素受體時,這種抑制效應會被減弱,進一步揭示饑餓狀態下內源性大麻素通過調節嗅覺通路來影響動物的攝食行為[21]。嗅皮質到嗅球的神經投射也會受到來自其他腦區神經元的調節,如海馬腹側區域、延髓等[22],體現了調制嗅覺形成的復雜性。此外,光遺傳技術也被應用于學習與突觸可塑性的研究。Lepousez等[23]在嗅皮質處轉染病毒,使自上而下的投射神經纖維表達光敏感通道蛋白(channelrhodopsin-2,ChR2),并用470 nm激光刺激其軸突末梢,結果表明嗅覺學習不僅可以使來自嗅皮質的興奮性投射在嗅球的顆粒細胞層中選擇性增加,并且可以促進嗅皮質投射與成年時期嗅球中新生顆粒細胞之間形成興奮性突觸。
1.5 副嗅系統
副嗅系統在嚙齒類動物感知周圍環境氣味的過程中發揮重要作用,由犁鼻器中的感覺神經元識別特定氣味,并傳遞至副嗅球進行信號加工;與梨狀皮質在主嗅覺系統中發揮的功能類似,杏仁體后內側皮質核(posteromedial cortical amgydala nucleus,PmCo)是副嗅系統中處理氣味信息的主要高級中樞,直接接受來自副嗅球中輸出神經元軸突的大量輸入,并形成反饋投射至副嗅球,并與其中的抑制性環路形成突觸聯系,從而調控僧帽細胞的輸出反應。Oboti等[24]應用光遺傳技術在這一領域進行了深入研究。他們通過轉基因技術在小鼠副嗅球僧帽細胞中特異性表達ChR2,并將其光激活,證實從杏仁體后內側皮質核到副嗅球的反饋投射的電反應性也會隨著副嗅球中僧帽細胞的激活而增強,且這一表現主要在小鼠出生后2~5周發生,進而揭示了該投射與副嗅球輸出神經元之間的相互作用。
2 其他高級腦區對嗅球的神經投射
2.1 基底前腦對嗅球的神經投射
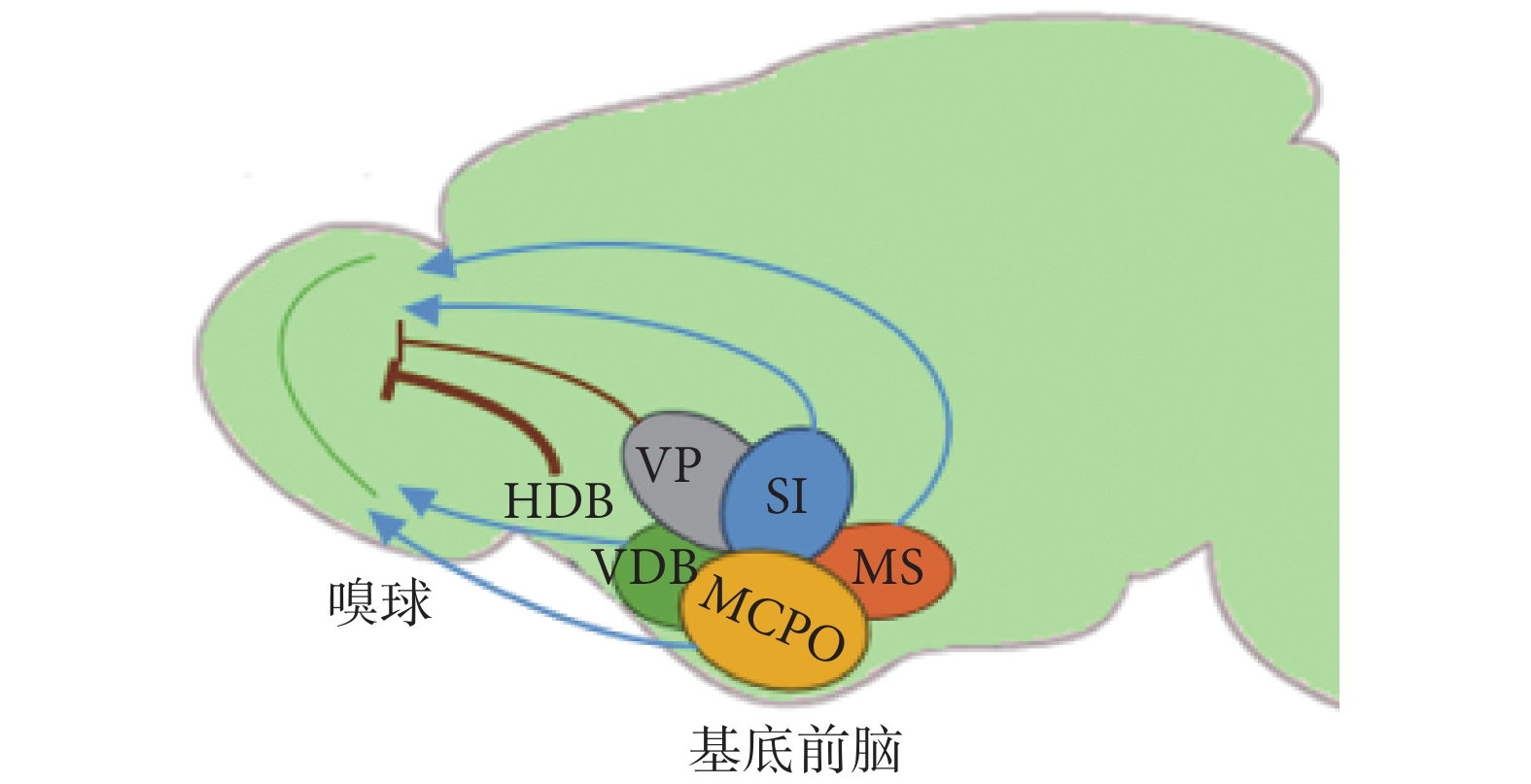
基底前腦位于大腦半球前端腹內側,是由布羅卡(Broca)斜角帶、視前大細胞核、內側隔核等共同組成的區域,其中有多種類型的神經元廣泛投射至多個腦區,與個體認知、注意力、睡眠/覺醒等密切相關。如圖2所示,從基底前腦到嗅球的投射主要包括膽堿能(藍色表示)和GABA能神經元(棕色表示),它們對嗅球加工處理氣味信息有明顯的調制作用[25]。圖2中基底前腦諸核團包括Broca斜角帶水平支(horizontal diagonal band of Broca,HDB)、Broca斜角帶垂直支(vertical diagonal band of Broca,VDB)、視前大細胞核(magnocellular preoptic nucleus,MCPO)、內側隔核(medial septum,MS)、無名質(innominate substance,SI)、腹側蒼白球(ventral pallidum,VP)。在靜息和氣味刺激狀態下,分別采用光激活膽堿能和GABA能神經投射,結果對僧帽細胞和簇狀細胞的電生理活性表現出不同的影響。近些年,光遺傳技術的發展使人們能選擇性分別刺激這兩類神經元,進而研究它們各自在嗅覺早期發生階段中的功能。
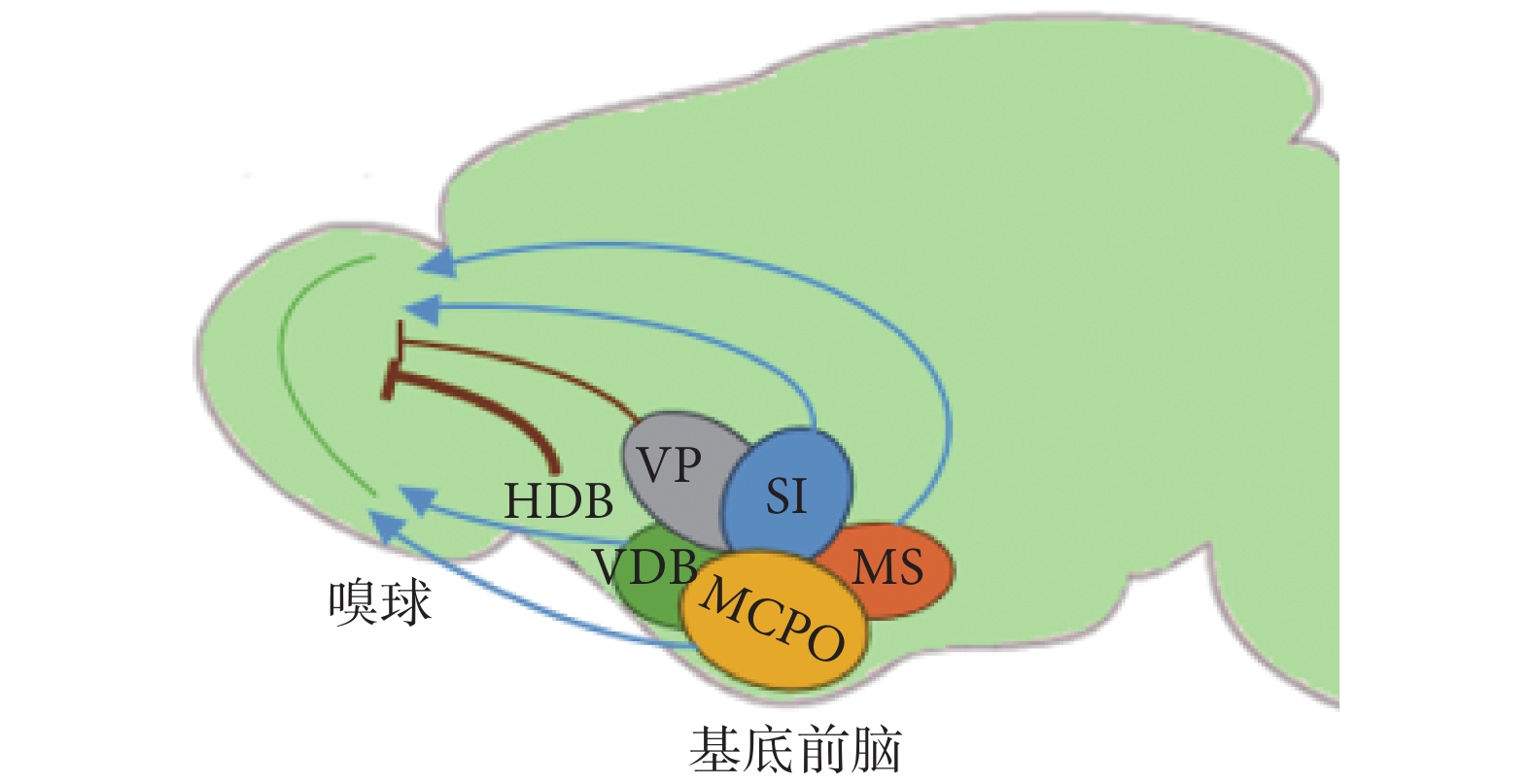 圖2
基底前腦諸核團至嗅球的神經投射
Figure2.
The neural projection from the basal forebrain nuclei to the olfactory bulb
圖2
基底前腦諸核團至嗅球的神經投射
Figure2.
The neural projection from the basal forebrain nuclei to the olfactory bulb
光激活膽堿能神經投射在氣味誘導的條件下能增強嗅球對某一特定氣味的敏感性,提高動物的嗅覺分辨、學習能力。眾所周知,動物對某種氣味的辨別能力會隨著這種氣味在空氣中濃度的增加而增強,而光刺激相關ChR2轉基因小鼠的膽堿能神經纖維能引發類似的效果,提示膽堿能神經元能促進嗅覺學習。以基底前腦HDB的膽堿能神經投射為光刺激對象,其激活能明顯抑制嗅球輸出神經元和多數中間神經元的自發放電活動[26]。然而,也有部分研究表明,光遺傳激活此類投射能增強僧帽細胞和簇狀細胞自發以及氣味誘導條件下的放電活動[27],這與之前的結果相矛盾。Rothermel等[27]發現,光刺激該神經投射的不同位置,即分別于基底前腦處和嗅球中的神經末梢處施加光刺激,對嗅球輸出神經元興奮性的影響也并不完全一致,這可能是由于在基底前腦處激活的膽堿能神經也廣泛投射到梨狀皮質、前嗅核和邊緣系統等其他腦區,而這些腦區也會反饋投射至嗅球進行調制。基底前腦膽堿能神經元參與了嗅覺有關的獎勵行為,但在體內以高時間分辨率監測乙酰膽堿水平的動態變化一直較為困難,使得深入研究膽堿能神經元調控嗅覺形成與動物獎勵行為之間的聯系難以深入,而Hanson等[28]巧妙地將乙酰膽堿熒光傳感器與植入光纖結合,實現了對基底前腦乙酰膽堿水平的實時監測,相較傳統電生理監測和藥理學實驗,光遺傳學能在在體水平更便捷地對特定神經元實現精準操控,且能更靈活地與其他研究工具進行配合。除此之外,最近也有研究表明,光激活基底前腦的膽堿能神經有利于改善某些疾病的嗅覺障礙癥狀,提示二者之間存在重要聯系[29]。
GABA能神經元在基底前腦中數量多,但研究較少,隨著近些年光遺傳技術在神經科學領域的應用,該類神經投射也成為關注的熱點。GABA能投射纖維會影響嗅球輸出神經元的興奮性,且該過程受到氣味輸入強度的影響,故此類投射可能在嗅球向更高級腦區傳遞嗅覺信號時起到濾過作用。選擇性光激活基底前腦中一類特殊的長程GABA能神經元,表明其對嗅球中的顆粒細胞和球旁細胞等抑制性中間神經元有明顯的抑制作用,利于僧帽細胞發生去極化;同時,此類GABA能投射也能通過減少側抑制、降低僧帽細胞放電精度等方式,分別從空間和時間維度調控僧帽細胞的電生理活性[30]。綜上,來自基底前腦的GABA能神經元可以與嗅球中的神經元形成抑制性突觸聯系,從而調制嗅覺信號的編碼。
基底前腦神經投射對嗅球的復雜調控也可歸因于其在嗅球中存在多種靶點。基底前腦的膽堿能神經元投射至嗅球各層,但其靶點主要集中于嗅小球層和內叢狀層。Case等[31]研究了膽堿能神經投射在嗅球中的某一具體環路:光激活囊泡谷氨酸轉運蛋白3(vesicular glutamate transporter 3,VGLUT 3)陽性的膽堿能神經元,促進其釋放乙酰膽堿和GABA,然后作用于內叢狀層的深短軸突細胞,進而抑制簇狀細胞的興奮性。球旁細胞是基底前腦神經投射在嗅球中的常見靶點之一,有人在嗅球腦片中分別光激活膽堿能投射纖維和GABA能投射纖維,不僅能區分兩者對球旁細胞電生理活性的不同影響,也能根據球旁細胞對神經投射反應的差異性進行亞型分類[32]。以上結果提示,基底前腦神經投射在嗅球中的作用靶點復雜多樣,對嗅球輸出神經元的影響是各靶點所在神經回路調節的綜合表現,故光遺傳學的應用使人們對嗅球神經網絡和嗅覺加工早期機制有了更加深入的理解。
2.2 中縫核對嗅球的神經投射
中縫核位于腦干中線附近,以5-羥色胺能神經元為主要神經元成分。中縫核的5-羥色胺能神經元參與運動系統、軀體感覺、邊緣系統等多個功能系統的調節,且與多種神經和精神類疾病的發生有關。
嗅球是中縫核5-羥色胺能神經元密集投射的區域之一,表明其受到后者較強的調控作用。中縫核5-羥色胺能神經元對嗅球各層和各類細胞的調控作用極為復雜,作為嗅球中的基本功能結構,嗅小球中間神經元與5-羥色胺能神經元之間形成密集的突觸聯系,是后者的主要調控靶點。
來自中縫核的神經投射如何影響嗅球輸出神經元,其中具體的神經調節回路尚不清楚,光遺傳技術的應用使得這一領域的研究更為深入。在小鼠5-羥色胺能神經元中特異性表達ChR2,在體和離體腦片實驗均表明,藍光選擇性激活中縫核投射神經纖維能引起簇狀細胞快速興奮,但對僧帽細胞卻表現出興奮或抑制的復雜雙重效應。結合藥理學實驗發現,中縫核5-羥色胺能神經投射纖維可同時釋放5-羥色胺和谷氨酸這兩種神經遞質,可能通過增強嗅小球層的外側簇狀細胞的興奮性來精準調制嗅球輸出神經元的電生理活性,從而影響氣味信息的編碼[33]。目前也有研究表明,光刺激引起的中縫核激活也能通過影響其他腦區(如梨狀皮質)來調制氣味信息的編碼過程[34],但還不清楚中縫核5-羥色胺能神經元能否通過影響這些腦區到嗅球的神經投射來調控嗅覺形成的早期階段。
2.3 藍斑核對嗅球的神經投射
藍斑核位于腦橋前背部,近第四腦室下壁喙部末端,是大腦內合成去甲腎上腺素的主要部位,介導壓力應激反應,與注意、喚醒、記憶等生理功能密切相關[35]。藍斑包含中樞神經系統中最大的去甲腎上腺素能神經元群[36],而去甲腎上腺素在嗅覺學習中發揮重要作用。有研究報導,用光沉默嗅球中已表達增強型嗜鹽細菌視紫紅質蛋白3.0(enhanced natronomonas halorhodopsin 3.0,eNpHR3.0)的去甲腎上腺素能纖維軸突,可以改變氣味誘導的特定帶寬下嗅球局部場電位的變化[37]。Linster等[38]通過光遺傳沉默和藥理學方法,發現嗅球中去甲腎上腺素的存在使嗅覺記憶更加穩定。目前,關于藍斑去甲腎上腺素能神經投射在嗅球中與哪些神經元形成突觸進而影響嗅球編碼嗅覺信息的研究中,光遺傳技術應用較少,未來可考慮配合藥理學、膜片鉗等方法進一步探索。
3 總結與展望
嗅皮質等多個腦區中有大量神經纖維廣泛、密集地投射至嗅球。這些投射神經有的可以直接與僧帽細胞和簇狀細胞形成突觸聯系,實現對這些嗅球輸出神經元放電活動的快速調制;有的可以與嗅球各類型中間神經元先形成突觸連接,從而間接影響僧帽細胞和簇狀細胞的電生理活性,此類型中最為經典的神經環路可概括為“投射神經→顆粒細胞或嗅小球層中間神經元→嗅球輸出神經元”。與傳統電刺激相比,光遺傳技術的應用讓人們能以某一特定類型神經投射為研究對象,具有較強的選擇性,從而明確此類投射神經對嗅球的調制作用。在突觸連接水平上,光遺傳學結合相關藥理學方法,有利于探索某些神經遞質或神經調質、特異性受體等對突觸間信號傳導的作用,如光激活中縫核5-羥色胺能神經投射對嗅球輸出神經元的興奮性影響差異大,結合藥理學實驗提示這與該類神經元對兩種不同遞質共釋放有關[33]。在神經環路水平上,通過光遺傳技術激活或沉默某種投射神經,用膜片鉗、電壓鉗等電生理記錄方法在體或離體記錄嗅球中主要神經元的電生理活動變化,是目前探索該類神經投射功能的最主要研究思路,在此基礎上提出投射神經影響嗅球輸出神經元,會經過多種興奮性或抑制性神經微環路的介導,從而解釋了神經投射對嗅球復雜的調控機制。雖然目前人們對嗅球的層狀結構和細胞類型有相當深入的了解,但有實驗表明,光激活基底前腦GABA能神經投射所引起的嗅小球球旁細胞的電生理活動變化之間有差異,進而據此可對球旁細胞做進一步研究和分型[32]。在個體水平上,光遺傳學也被用于研究某類投射神經在動物嗅覺學習過程中的作用。目前,人們雖已在多個層次對嗅覺的形成和調控機制進行研究,但仍很難對嗅覺神經環路進行完全的解釋,未來還需要進一步從氣味信號傳遞、反饋調節以及相關行為等角度,綜合分析嗅覺神經環路的作用機制,從而為仿生工程的相關設計提供充分的理論基礎,在災害預防、疾病診治等需要對特殊氣味進行監測的場景中有很大的發展潛力。
光遺傳技術雖然能以毫秒級精度操縱神經元,但也存在諸多問題。比如,光纖植入的位置會影響觀察結果,由于光敏感蛋白在投射神經中的表達以及光刺激本身的不均勻,可能導致結果的不準確[39]。其次,用光遺傳操縱某一神經投射時,很難將其同時應用于其他神經的控制中。
綜上,光遺傳技術使人們對嗅球與其他腦區之間的聯系有了更清晰的認識,未來光遺傳技術可通過開發選擇性更高、作用更穩定的光敏感蛋白,效率更好的表達方法以及更合適的刺激光源來實現改良,進而推進人們對嗅覺形成潛在機制的研究和認識不斷深入。
重要聲明
利益沖突聲明:本文全體作者均聲明不存在利益沖突。
作者貢獻聲明:周彤,負責文章整體構思和論文撰寫;吳祎凡、胡蒙、唐欣、朱平,負責論文思路分析和論文修改;杜立萍,負責論文指導、修改和最終版修訂;吳春生,參與論文修改指導并負責論文審校。
0 引言
嗅覺是最基礎的生理感覺之一,是生物感知外界環境,進行覓食、交配、躲避天敵等多項生命活動的基礎。自然界中的氣味分子與嗅黏膜上皮中嗅感覺神經元纖毛上的嗅覺受體結合,該受體是一種G蛋白偶聯受體,與氣味分子結合后可以激活G蛋白,進而引發一系列的細胞內生物化學級聯反應,通過細胞內信號轉導通路,使神經元興奮并產生氣味響應信號[1]。嗅球是嗅覺通路的初級中樞和嗅覺信息處理的中轉站,呈層狀結構,如圖1所示。嗅球從外向內可分為6層,分別由嗅神經層 (olfactory nerve layer,ONL)、嗅小球層(glomerular layer,GL)、外叢狀層(external plexiform layer,EPL)、僧帽細胞層 (mitral cell layer,MCL)、內叢狀層(internal plexiform layer,IPL)和顆粒細胞層(granule cell layer,GCL)組成。不同顏色的嗅小球接受表達不同氣味受體的嗅感覺神經元的輸入。不同顏色的僧帽細胞和簇狀細胞與相應的嗅小球連接,其軸突投射向嗅皮層。圖1中,M代表僧帽細胞,T代表簇狀細胞,S代表短軸突細胞,E代表外側簇狀細胞,P代表球旁細胞,G代表顆粒細胞。嗅感覺神經元通過神經脈沖將嗅覺信息傳遞至嗅球,于嗅小球層與僧帽細胞和簇狀細胞形成突觸聯系,并由這些嗅球輸出神經元的軸突繼續傳遞至前嗅核、嗅結節、梨狀皮質等高級嗅覺中樞進行進一步整合,從而形成嗅覺感知。
 圖1
嗅球層狀結構示意圖
Figure1.
The layer structure of olfactory bulb
圖1
嗅球層狀結構示意圖
Figure1.
The layer structure of olfactory bulb
嗅覺信號在傳遞過程中受到嗅球中多種神經微環路的調控,其中最常見的是顆粒細胞,其通常可直接與嗅球輸出神經元的胞體或樹突等形成突觸,發揮調控作用。除此之外,在嗅小球層,還分布著外側簇狀細胞、球旁細胞和短軸突細胞等近球神經元,這些近球神經元可直接影響嗅感覺神經元與僧帽/簇狀細胞間的突觸傳遞,從而構成嗅球的基本功能單位嗅小球。
嗅覺的形成機制復雜,這不僅僅是由下向上的逐級形成過程,也受到來自高級腦區自上向下的神經投射的調控作用。嗅球在初步處理加工嗅覺信息的過程中也受到大量來自高級中樞神經投射的調節,主要包括嗅皮質區域的下行神經投射,以及來自基底前腦、中縫背核和藍斑等處的神經投射。這些神經投射在嗅球中與嗅感覺神經、僧帽細胞和簇狀細胞以及多種中間神經元之間形成廣泛復雜的突觸聯系,進而能反饋性地對嗅覺信息的處理起調控作用[2]。最新的研究表明,下丘腦外側到嗅球也存在神經元投射[3]。
光遺傳技術是當前神經科學領域中一種快速發展的新工具,正被越來越多地應用于神經環路的研究中。正是由于光遺傳技術的強特異性、高精確性和可調控性,嗅覺發生及調控過程中的多個環節均有該技術方法的應用[4-6]。目前,已有相當多的研究選擇光刺激高級腦區至嗅球的下行神經元,觀察嗅球中各種類型細胞的電生理活動變化情況,從而分析其對嗅球處理加工氣味信息的潛在調控機制[7-8]。
1 嗅皮質對嗅球的神經投射
1.1 嗅皮質概述
嗅皮質是嗅覺形成的高級中樞,主要為由嗅球中僧帽細胞和簇狀細胞軸突所投射到的腦區[9]。這些輸出神經元的軸突離開嗅球后逐漸匯聚為嗅束,其背側、外側和內側皆覆蓋有薄層灰質[10]。前嗅核(the anterior olfactory nucleus,AON)由散在分布于嗅球尾端、嗅束間(內)、外側嗅回的細胞團組成,是接受嗅球輸出信息的第一站[11-13]。前嗅核神經元組成復雜,提示其能參與處理復雜的嗅覺等信息[11]。梨狀皮質接收來自外側嗅束的主要輸入,是最重要的嗅覺中樞。梨狀皮質是位于大腦腹外側的舊皮質區域,由3層結構組成:淺層神經元分布稀疏,主要可見外側嗅束的輸入纖維;中間層集中分布了大量谷氨酸能主要神經元;深層則有分布密度較低的主神經元;同時,少量γ-氨基丁酸(γ-aminobutyric acid,GABA)能神經元較為均勻地分布各層中。梨狀皮質與外側嗅束間的突觸聯系主要集中于淺層,而皮質內部連接以及來自其他區域的神經元則分布于較深層[14]。梨狀皮質分為前區和后區兩部分,前區主要接受來自嗅球和前嗅核的神經輸入,提示其與處理嗅覺信息密切相關;而后區功能復雜,有研究表明其在嗅覺學習過程中與相應氣味信息回憶的形成密切相關[12]。梨狀皮質中存在部分神經元可廣泛投射至多個腦區,包括嗅結節、眶額葉皮質以及外側內嗅皮質等,此類輸出神經元被稱為離皮質神經元,它們參與形成了復雜的嗅覺信息處理網絡,產生特定電信號參與生物體情緒、行為等調節[4, 15-16]。
1.2 離皮質神經投射對嗅球輸出神經元的調制效應
嗅皮質至嗅球的離皮質投射主要來自前嗅核和梨狀皮質。其中,前嗅核是嗅球所接受的反饋投射的最主要來源,且這類神經投射在嗅覺信號傳遞的早期過程中發揮負性調節作用。然而,來自前嗅核的神經投射對嗅球輸出神經元的抑制作用并非單一調制的結果,而是基于多種神經環路共同調制的綜合效應。一方面,此類投射神經元可以和僧帽細胞直接形成突觸并使后者短期內發生快速去極化;另一方面,此類投射神經元也通過“前嗅核神經元→顆粒細胞/嗅小球層中間神經元→僧帽細胞”途徑間接使僧帽細胞發生長期超極化,從而表現出對嗅球輸出神經元以抑制作用為主的雙重效應。
1.3 離皮質神經投射在嗅球中的作用靶點
離皮質神經反饋主要投射至同側和對側嗅球的顆粒細胞層和嗅小球層底部,但嗅小球層中的具體作用靶點尚不明確。目前在體和離體實驗均表明,這類投射主要作用于顆粒細胞[17],進而影響僧帽細胞和簇狀細胞。Mazo等[18-19]研究了前嗅皮質的下行投射神經元中GABA受體B型(GABA type-B receptor,GABABR)的特異性作用,光遺傳刺激配合其他電生理刺激記錄表明,GABABR的激活能抑制嗅皮質反饋投射對嗅球顆粒細胞的興奮性信號傳遞,進而減少其對僧帽細胞和簇狀細胞的抑制,但幾乎不影響神經投射對它們的直接興奮作用;且激活GABABR會抑制嗅球的自發β振蕩,但對θ振蕩無影響。由于來自嗅皮質的神經投射多為谷氨酸能神經元,傳統方法難以對其中其他類型的投射神經元(如GABA能神經投射)進行深入研究,而光遺傳學工具使得人們能精準操縱此類神經元,有利于深入理解嗅覺形成過程中的反饋調節。
1.4 離皮質神經投射參與嗅覺相關行為的調控
嗅覺等生理感覺與動物各種行為之間有緊密的聯系,其中涉及非常復雜的神經體液調節機制,也是目前研究的熱點之一。內源性大麻素系統涉及神經遞質傳遞、炎癥反應、學習與記憶等多種生理過程[20],在體實驗表明,來自嗅皮質的神經反饋對嗅球輸出神經元有抑制作用,但當光激活投射神經軸突末稍的Ⅰ型大麻素受體時,這種抑制效應會被減弱,進一步揭示饑餓狀態下內源性大麻素通過調節嗅覺通路來影響動物的攝食行為[21]。嗅皮質到嗅球的神經投射也會受到來自其他腦區神經元的調節,如海馬腹側區域、延髓等[22],體現了調制嗅覺形成的復雜性。此外,光遺傳技術也被應用于學習與突觸可塑性的研究。Lepousez等[23]在嗅皮質處轉染病毒,使自上而下的投射神經纖維表達光敏感通道蛋白(channelrhodopsin-2,ChR2),并用470 nm激光刺激其軸突末梢,結果表明嗅覺學習不僅可以使來自嗅皮質的興奮性投射在嗅球的顆粒細胞層中選擇性增加,并且可以促進嗅皮質投射與成年時期嗅球中新生顆粒細胞之間形成興奮性突觸。
1.5 副嗅系統
副嗅系統在嚙齒類動物感知周圍環境氣味的過程中發揮重要作用,由犁鼻器中的感覺神經元識別特定氣味,并傳遞至副嗅球進行信號加工;與梨狀皮質在主嗅覺系統中發揮的功能類似,杏仁體后內側皮質核(posteromedial cortical amgydala nucleus,PmCo)是副嗅系統中處理氣味信息的主要高級中樞,直接接受來自副嗅球中輸出神經元軸突的大量輸入,并形成反饋投射至副嗅球,并與其中的抑制性環路形成突觸聯系,從而調控僧帽細胞的輸出反應。Oboti等[24]應用光遺傳技術在這一領域進行了深入研究。他們通過轉基因技術在小鼠副嗅球僧帽細胞中特異性表達ChR2,并將其光激活,證實從杏仁體后內側皮質核到副嗅球的反饋投射的電反應性也會隨著副嗅球中僧帽細胞的激活而增強,且這一表現主要在小鼠出生后2~5周發生,進而揭示了該投射與副嗅球輸出神經元之間的相互作用。
2 其他高級腦區對嗅球的神經投射
2.1 基底前腦對嗅球的神經投射
基底前腦位于大腦半球前端腹內側,是由布羅卡(Broca)斜角帶、視前大細胞核、內側隔核等共同組成的區域,其中有多種類型的神經元廣泛投射至多個腦區,與個體認知、注意力、睡眠/覺醒等密切相關。如圖2所示,從基底前腦到嗅球的投射主要包括膽堿能(藍色表示)和GABA能神經元(棕色表示),它們對嗅球加工處理氣味信息有明顯的調制作用[25]。圖2中基底前腦諸核團包括Broca斜角帶水平支(horizontal diagonal band of Broca,HDB)、Broca斜角帶垂直支(vertical diagonal band of Broca,VDB)、視前大細胞核(magnocellular preoptic nucleus,MCPO)、內側隔核(medial septum,MS)、無名質(innominate substance,SI)、腹側蒼白球(ventral pallidum,VP)。在靜息和氣味刺激狀態下,分別采用光激活膽堿能和GABA能神經投射,結果對僧帽細胞和簇狀細胞的電生理活性表現出不同的影響。近些年,光遺傳技術的發展使人們能選擇性分別刺激這兩類神經元,進而研究它們各自在嗅覺早期發生階段中的功能。
 圖2
基底前腦諸核團至嗅球的神經投射
Figure2.
The neural projection from the basal forebrain nuclei to the olfactory bulb
圖2
基底前腦諸核團至嗅球的神經投射
Figure2.
The neural projection from the basal forebrain nuclei to the olfactory bulb
光激活膽堿能神經投射在氣味誘導的條件下能增強嗅球對某一特定氣味的敏感性,提高動物的嗅覺分辨、學習能力。眾所周知,動物對某種氣味的辨別能力會隨著這種氣味在空氣中濃度的增加而增強,而光刺激相關ChR2轉基因小鼠的膽堿能神經纖維能引發類似的效果,提示膽堿能神經元能促進嗅覺學習。以基底前腦HDB的膽堿能神經投射為光刺激對象,其激活能明顯抑制嗅球輸出神經元和多數中間神經元的自發放電活動[26]。然而,也有部分研究表明,光遺傳激活此類投射能增強僧帽細胞和簇狀細胞自發以及氣味誘導條件下的放電活動[27],這與之前的結果相矛盾。Rothermel等[27]發現,光刺激該神經投射的不同位置,即分別于基底前腦處和嗅球中的神經末梢處施加光刺激,對嗅球輸出神經元興奮性的影響也并不完全一致,這可能是由于在基底前腦處激活的膽堿能神經也廣泛投射到梨狀皮質、前嗅核和邊緣系統等其他腦區,而這些腦區也會反饋投射至嗅球進行調制。基底前腦膽堿能神經元參與了嗅覺有關的獎勵行為,但在體內以高時間分辨率監測乙酰膽堿水平的動態變化一直較為困難,使得深入研究膽堿能神經元調控嗅覺形成與動物獎勵行為之間的聯系難以深入,而Hanson等[28]巧妙地將乙酰膽堿熒光傳感器與植入光纖結合,實現了對基底前腦乙酰膽堿水平的實時監測,相較傳統電生理監測和藥理學實驗,光遺傳學能在在體水平更便捷地對特定神經元實現精準操控,且能更靈活地與其他研究工具進行配合。除此之外,最近也有研究表明,光激活基底前腦的膽堿能神經有利于改善某些疾病的嗅覺障礙癥狀,提示二者之間存在重要聯系[29]。
GABA能神經元在基底前腦中數量多,但研究較少,隨著近些年光遺傳技術在神經科學領域的應用,該類神經投射也成為關注的熱點。GABA能投射纖維會影響嗅球輸出神經元的興奮性,且該過程受到氣味輸入強度的影響,故此類投射可能在嗅球向更高級腦區傳遞嗅覺信號時起到濾過作用。選擇性光激活基底前腦中一類特殊的長程GABA能神經元,表明其對嗅球中的顆粒細胞和球旁細胞等抑制性中間神經元有明顯的抑制作用,利于僧帽細胞發生去極化;同時,此類GABA能投射也能通過減少側抑制、降低僧帽細胞放電精度等方式,分別從空間和時間維度調控僧帽細胞的電生理活性[30]。綜上,來自基底前腦的GABA能神經元可以與嗅球中的神經元形成抑制性突觸聯系,從而調制嗅覺信號的編碼。
基底前腦神經投射對嗅球的復雜調控也可歸因于其在嗅球中存在多種靶點。基底前腦的膽堿能神經元投射至嗅球各層,但其靶點主要集中于嗅小球層和內叢狀層。Case等[31]研究了膽堿能神經投射在嗅球中的某一具體環路:光激活囊泡谷氨酸轉運蛋白3(vesicular glutamate transporter 3,VGLUT 3)陽性的膽堿能神經元,促進其釋放乙酰膽堿和GABA,然后作用于內叢狀層的深短軸突細胞,進而抑制簇狀細胞的興奮性。球旁細胞是基底前腦神經投射在嗅球中的常見靶點之一,有人在嗅球腦片中分別光激活膽堿能投射纖維和GABA能投射纖維,不僅能區分兩者對球旁細胞電生理活性的不同影響,也能根據球旁細胞對神經投射反應的差異性進行亞型分類[32]。以上結果提示,基底前腦神經投射在嗅球中的作用靶點復雜多樣,對嗅球輸出神經元的影響是各靶點所在神經回路調節的綜合表現,故光遺傳學的應用使人們對嗅球神經網絡和嗅覺加工早期機制有了更加深入的理解。
2.2 中縫核對嗅球的神經投射
中縫核位于腦干中線附近,以5-羥色胺能神經元為主要神經元成分。中縫核的5-羥色胺能神經元參與運動系統、軀體感覺、邊緣系統等多個功能系統的調節,且與多種神經和精神類疾病的發生有關。
嗅球是中縫核5-羥色胺能神經元密集投射的區域之一,表明其受到后者較強的調控作用。中縫核5-羥色胺能神經元對嗅球各層和各類細胞的調控作用極為復雜,作為嗅球中的基本功能結構,嗅小球中間神經元與5-羥色胺能神經元之間形成密集的突觸聯系,是后者的主要調控靶點。
來自中縫核的神經投射如何影響嗅球輸出神經元,其中具體的神經調節回路尚不清楚,光遺傳技術的應用使得這一領域的研究更為深入。在小鼠5-羥色胺能神經元中特異性表達ChR2,在體和離體腦片實驗均表明,藍光選擇性激活中縫核投射神經纖維能引起簇狀細胞快速興奮,但對僧帽細胞卻表現出興奮或抑制的復雜雙重效應。結合藥理學實驗發現,中縫核5-羥色胺能神經投射纖維可同時釋放5-羥色胺和谷氨酸這兩種神經遞質,可能通過增強嗅小球層的外側簇狀細胞的興奮性來精準調制嗅球輸出神經元的電生理活性,從而影響氣味信息的編碼[33]。目前也有研究表明,光刺激引起的中縫核激活也能通過影響其他腦區(如梨狀皮質)來調制氣味信息的編碼過程[34],但還不清楚中縫核5-羥色胺能神經元能否通過影響這些腦區到嗅球的神經投射來調控嗅覺形成的早期階段。
2.3 藍斑核對嗅球的神經投射
藍斑核位于腦橋前背部,近第四腦室下壁喙部末端,是大腦內合成去甲腎上腺素的主要部位,介導壓力應激反應,與注意、喚醒、記憶等生理功能密切相關[35]。藍斑包含中樞神經系統中最大的去甲腎上腺素能神經元群[36],而去甲腎上腺素在嗅覺學習中發揮重要作用。有研究報導,用光沉默嗅球中已表達增強型嗜鹽細菌視紫紅質蛋白3.0(enhanced natronomonas halorhodopsin 3.0,eNpHR3.0)的去甲腎上腺素能纖維軸突,可以改變氣味誘導的特定帶寬下嗅球局部場電位的變化[37]。Linster等[38]通過光遺傳沉默和藥理學方法,發現嗅球中去甲腎上腺素的存在使嗅覺記憶更加穩定。目前,關于藍斑去甲腎上腺素能神經投射在嗅球中與哪些神經元形成突觸進而影響嗅球編碼嗅覺信息的研究中,光遺傳技術應用較少,未來可考慮配合藥理學、膜片鉗等方法進一步探索。
3 總結與展望
嗅皮質等多個腦區中有大量神經纖維廣泛、密集地投射至嗅球。這些投射神經有的可以直接與僧帽細胞和簇狀細胞形成突觸聯系,實現對這些嗅球輸出神經元放電活動的快速調制;有的可以與嗅球各類型中間神經元先形成突觸連接,從而間接影響僧帽細胞和簇狀細胞的電生理活性,此類型中最為經典的神經環路可概括為“投射神經→顆粒細胞或嗅小球層中間神經元→嗅球輸出神經元”。與傳統電刺激相比,光遺傳技術的應用讓人們能以某一特定類型神經投射為研究對象,具有較強的選擇性,從而明確此類投射神經對嗅球的調制作用。在突觸連接水平上,光遺傳學結合相關藥理學方法,有利于探索某些神經遞質或神經調質、特異性受體等對突觸間信號傳導的作用,如光激活中縫核5-羥色胺能神經投射對嗅球輸出神經元的興奮性影響差異大,結合藥理學實驗提示這與該類神經元對兩種不同遞質共釋放有關[33]。在神經環路水平上,通過光遺傳技術激活或沉默某種投射神經,用膜片鉗、電壓鉗等電生理記錄方法在體或離體記錄嗅球中主要神經元的電生理活動變化,是目前探索該類神經投射功能的最主要研究思路,在此基礎上提出投射神經影響嗅球輸出神經元,會經過多種興奮性或抑制性神經微環路的介導,從而解釋了神經投射對嗅球復雜的調控機制。雖然目前人們對嗅球的層狀結構和細胞類型有相當深入的了解,但有實驗表明,光激活基底前腦GABA能神經投射所引起的嗅小球球旁細胞的電生理活動變化之間有差異,進而據此可對球旁細胞做進一步研究和分型[32]。在個體水平上,光遺傳學也被用于研究某類投射神經在動物嗅覺學習過程中的作用。目前,人們雖已在多個層次對嗅覺的形成和調控機制進行研究,但仍很難對嗅覺神經環路進行完全的解釋,未來還需要進一步從氣味信號傳遞、反饋調節以及相關行為等角度,綜合分析嗅覺神經環路的作用機制,從而為仿生工程的相關設計提供充分的理論基礎,在災害預防、疾病診治等需要對特殊氣味進行監測的場景中有很大的發展潛力。
光遺傳技術雖然能以毫秒級精度操縱神經元,但也存在諸多問題。比如,光纖植入的位置會影響觀察結果,由于光敏感蛋白在投射神經中的表達以及光刺激本身的不均勻,可能導致結果的不準確[39]。其次,用光遺傳操縱某一神經投射時,很難將其同時應用于其他神經的控制中。
綜上,光遺傳技術使人們對嗅球與其他腦區之間的聯系有了更清晰的認識,未來光遺傳技術可通過開發選擇性更高、作用更穩定的光敏感蛋白,效率更好的表達方法以及更合適的刺激光源來實現改良,進而推進人們對嗅覺形成潛在機制的研究和認識不斷深入。
重要聲明
利益沖突聲明:本文全體作者均聲明不存在利益沖突。
作者貢獻聲明:周彤,負責文章整體構思和論文撰寫;吳祎凡、胡蒙、唐欣、朱平,負責論文思路分析和論文修改;杜立萍,負責論文指導、修改和最終版修訂;吳春生,參與論文修改指導并負責論文審校。