重復經顱磁刺激(rTMS)是目前常用的腦刺激技術之一。為探究rTMS對不同類型神經元興奮性的影響,本研究從電生理角度開展rTMS對小鼠認知功能和海馬谷氨酸能神經元、γ-氨基丁酸能神經元興奮性影響的研究。本研究將小鼠隨機分為谷氨酸能對照組、谷氨酸能磁刺激組、γ-氨基丁酸能對照組、γ-氨基丁酸能磁刺激組,對四組小鼠注射腺相關病毒標記兩類神經元并植入光纖。刺激組接受14天刺激,對照組接受14天偽刺激。光纖記錄小鼠鈣離子熒光強度變化。行為學實驗探究小鼠認知功能變化。腦片膜片鉗系統檢測神經元動作電位特性變化。結果發現rTMS可顯著提高小鼠的認知功能,提高海馬腦區谷氨酸能神經元、γ-氨基丁酸能神經元集群的鈣離子熒光變化幅度,以及增強谷氨酸能神經元、γ-氨基丁酸能神經元動作電位相關指標。結果提示,rTMS可通過提高海馬谷氨酸能神經元和γ-氨基丁酸能神經元的興奮性來提高小鼠的認知能力。
版權信息: ?四川大學華西醫院華西期刊社《生物醫學工程學雜志》版權所有,未經授權不得轉載、改編
0 引言
重復經顱磁刺激(repeated transcranial magnetic stimulation,rTMS)是一種非侵入性神經調控技術,具有安全性高、操作簡便和副作用小等特點[1]。rTMS作用原理是在刺激線圈中產生一個強烈且短暫的電流脈沖,產生脈沖磁場。磁場作用于大腦,改變腦內神經元的電生理環境,誘導皮層興奮性的變化[2]。目前,rTMS在認知功能損傷的臨床治療中顯示出療效[3-5]。其中,20 Hz高頻rTMS可以顯著改善神經精神類疾病患者認知功能,提高皮質神經元的興奮性,改善患者的認知功能和記憶能力[6-7]。動物離體實驗中,Chameh等[8]的研究發現,rTMS刺激后的大鼠CA1錐體神經元的達峰時間低于對照組,神經元興奮性增強。同樣,朱海軍等[9]研究發現,rTMS在對老年小鼠進行為期15天20 Hz的刺激可以降低神經元的閾值,提高神經元的興奮性。
海馬腦區與記憶處理存儲、認知能力、學習能力等多個方面有關[10]。Hermiller等[11]發現經顱磁刺激通過作用于海馬腦區增強被試人員的記憶能力。神經元根據功能主要分為興奮性神經元和抑制性神經元[12]。其中谷氨酸能神經元(glutamatergic neurons)是海馬內最主要的興奮性神經元,約占海馬神經元總數的78%[13];γ-氨基丁酸能神經元(GABAergic neurons)是海馬內最主要的抑制性神經元,約占海馬神經元總數的15%[14]。谷氨酸能神經元釋放谷氨酸神經遞質到突觸間隙中激活鈉、鉀和鈣通道,引起突觸后神經元興奮[15]。γ-氨基丁酸能神經元釋放γ-氨基丁酸神經遞質與突觸后神經元上受體結合,激活氯離子通道,抑制突觸后神經元放電[16]。目前生物實驗中區分谷氨酸能神經元和γ-氨基丁酸能神經元需要借助基因編輯技術、DNA重組技術、細胞培養技術等[17-19]。其中,使用基因編碼鈣指示劑(genetically encoded calcium indicators)標記神經元,測量神經元活動已成為神經科學中廣泛使用的方法。
當神經元受到足夠的刺激時,細胞膜上的離子通道打開,細胞內外的電荷分布發生變化從而形成動作電位。動作電位是表征神經元興奮性的重要指標[20],研究顯示,長期施加rTMS可改變海馬神經元的興奮性,改變神經元靜息膜電位和動作電位閾值[21]。目前已有研究從認知功能、電生理、分子等多個層面對rTMS的作用機制進行探索[22],但是rTMS對海馬兩類主要神經元的影響目前尚不明確。本研究通過rTMS對小鼠認知功能與兩類主要神經興奮性的影響,探究rTMS對認知功能的改變和內在作用機制。
1 材料與方法
1.1 實驗動物
本實驗采用野生型昆明雌性小鼠,8周齡,體重(32 ± 3)g。小鼠購自河南斯克貝斯生物科技股份有限公司。實驗動物許可證號:SCXK(豫)2020-0005。動物實驗遵守河北工業大學倫理委員會的準則,完全符合實驗動物使用標準。
1.2 實驗設備
本研究所用實驗設備包括:重復經顱磁刺激儀(武漢依瑞德醫療設備新技術有限公司),新物體識別實驗箱(賽昂斯生物科技有限公司),水迷宮實驗設備(賽昂斯生物科技有限公司),光纖記錄設備(千奧星科南京生物科技有限公司),數顯恒溫水浴鍋(邦西儀器科技有限公司),P-97玻璃電極拉制儀(Sutter,美國),Milli-Q純水儀(Millipore,美國),滲透壓儀(雅森國際集團有限公司),EPC雙通道膜片鉗放大器(HEKA,德國)。
1.3 實驗設計
小鼠在適應性喂養一周后,進行光纖植入手術,分別注射腺相關病毒標記小鼠海馬腦區谷氨酸能神經元和γ-氨基丁酸能神經元,之后植入光纖。休養兩周后剔除無信號小鼠,將16只注射VGAT1病毒標記γ-氨基丁酸能神經元神經元小鼠隨機分為γ-氨基丁酸能刺激組(GABA rTMS,n = 8)和γ-氨基丁酸能對照組(GABA sham,n = 8);16只注射CaMKIIa病毒標記谷氨酸能神經元小鼠,隨機分為谷氨酸能刺激組(Glu rTMS,n = 8)和谷氨酸能對照組(Glu sham,n = 8)。各組小鼠進行rTMS刺激或假刺激,連續刺激14天。rTMS刺激結束后對小鼠進行在體光纖記錄,記錄小鼠海馬齒狀回(dentate gyrus,DG)區谷氨酸能神經元和γ-氨基丁酸能神經元的的鈣離子濃度變化。之后進行新物體識別和莫里斯水迷宮行為學實驗探究小鼠學習記憶能力的改變。行為學實驗結束后,對四組小鼠進行膜片鉗電生理實驗。
1.4 病毒注射及光纖植入手術
實驗使用rAAV-CaMKIIa-GCaMp6m-WPRE-hGH polyA重組腺相關病毒(武漢樞密腦科學技術有限公司,中國)特異性標記谷氨酸能神經元,PFD-rAAV-VGAT1-GCaMp6m-WPRE-hGH polyA重組腺相關病毒(武漢樞密腦科學技術有限公司,中國)特異性標記γ-氨基丁酸能神經元。病毒標記區域為小鼠海馬腦區DG區,病毒標記位置為中縫右側1.2 mm,前囟向后1.7 mm,腦區深度2 mm,病毒注射200 nL。注射病毒結束后在同一位置顱骨平面向下1.98 mm埋置光纖陶瓷插芯。光纖陶瓷插芯規格:長度3 mm,直徑1.25 mm。小鼠在光纖植入手術結束后被放入籠中休養兩周,之后對小鼠進行rTMS刺激,刺激結束后對小鼠進行鈣離子光纖信號記錄。
1.5 重復經顱磁刺激
實驗采用依瑞德CCY-IA型高性能磁場刺激儀,線圈采用Y064號動物標準圓型線圈,外型尺寸為64 mm × 30 mm,內線圈外徑56 mm,內徑14 mm,高23 mm。最大磁場強度為3.6 T。本實驗中對小鼠進行運動閾值測定時,刺激器放于動物腦部正上方緊貼頭皮,采用單脈沖刺激方式,強度從刺激儀最低刺激強度開始逐步上升刺激小鼠,當動物前肢開始抽動時,記錄此時的磁刺激強度。對所有動物進行上述步驟發現所有動物刺激閾值均為刺激儀最大強度的11%,約為0.396 T。測試小鼠運動閾值為最大強度的11%,刺激強度設置為閾值的80%,約為0.32 T。刺激頻率采用高頻20 Hz,每天刺激1 000個脈沖,連續刺激14天。線圈平行于小鼠頂骨,放置于頭皮表面之上2~3 mm處。刺激時間為上午8:00―12:00。對照組小鼠均接受假刺激,將線圈垂直于小鼠頭頂放置約50 cm,小鼠聽到刺激聲音而不接受刺激。
1.6 光纖記錄實驗
本實驗所用的光纖記錄設備來自千奧星科南京生物科技有限公司。信號采集軟件為CamFiberPhotometry,在小鼠休養2周病毒完全表達后進行信號檢測,將光纖與小鼠頭部的陶瓷插芯相連,剔除無信號的失敗小鼠。對各組小鼠的鈣離子信號變化進行記錄并分析,計算各組小鼠信號的信號峰值和上升時間。結合Matlab軟件制作鈣信號的熱度圖和事件相關線圖,并分析四組雌性昆明小鼠原始鈣信號的熒光強度的變化率和上升時間。
1.7 行為學實驗
1.7.1 新物體識別實驗
新物體識別實驗包括適應期、熟悉期、測試Ⅰ期、測試Ⅱ期四個階段。適應期小鼠被放置在實驗箱中探索30 min適應箱內環境。24 h后進行熟悉期,熟悉期箱內同側放置兩個大小形狀完全一樣的物體。將動物背對兩個方塊放入實驗箱,小鼠自由活動10 min。小鼠放回鼠籠1 h,期間將兩個相同的物體取出一個,放入一個尺寸相當但顏色形狀不同的新物體進行代替,1 h計時結束后進入測試Ⅰ期。測試Ⅰ期小鼠自由探索5 min,期間記錄小鼠探索新物體的時間T1(1 h)和舊物體的時間T2(1 h)。小鼠放回鼠籠,清理新物體箱并將之前的舊物體換成另一個新物體。24 h后進入測試Ⅱ期,小鼠放入新物體識別箱內自由探索5 min,期間記錄小鼠探索新物體的時間T1(24 h)和舊物體的時間T2(24 h)。流程圖參見附件1。在所有的實驗階段,每只小鼠測試結束后,用70%的酒精對箱體內進行擦拭,避免動物殘留氣味影響實驗。認知指數(cognitive index,CI)計算公式為CI = T1/(T1 + T2)。
1.7.2 Morris水迷宮實驗
本研究進行的Morris水迷宮實驗共分為訓練期和測試期兩個階段。訓練期在水中放入平臺,水略微沒過平臺。訓練期將動物頭朝池壁放入水中,放入位置依次為東、西、南、北四個起始位置。記錄60 s內找到平臺所需時間即為逃避潛伏期,若60 s內小鼠未能找到平臺,則逃避潛伏期記為60 s,訓練期時間為4天,每天記錄動物找到水下平臺的逃避潛伏期(s)和運動軌跡。訓練期實驗結束24 h后進行測試期實驗,測試期去掉平臺。所有小鼠統一放置在平臺對側起始位置,記錄小鼠在平臺區域所在象限停留的時間占總時間的百分比和穿越平臺次數。
1.8 膜片鉗電生理實驗
1.8.1 溶液配制
腦片膜片鉗中用到的人工腦脊液、切片液、電極內液如表1所示。
1.8.2 急性分離腦片的制備
將麻醉機的前置誘導盒中持續通入濃度為3.5 %、流量0.5 L/min的異氟烷氣體,將小鼠放入前置誘導盒中,當小鼠完全麻醉后,迅速斷頭取腦,取出全腦后將大腦完全浸入冰水混合狀態且氧氣飽和的切片液中。之后用型號為VT1200S的徠卡振動切片機對小鼠大腦進行切片,切片厚度為300 μm。之后將腦片放入28 ℃恒溫的人工腦脊液中孵育1 h。
1.8.3 全細胞腦片膜片鉗
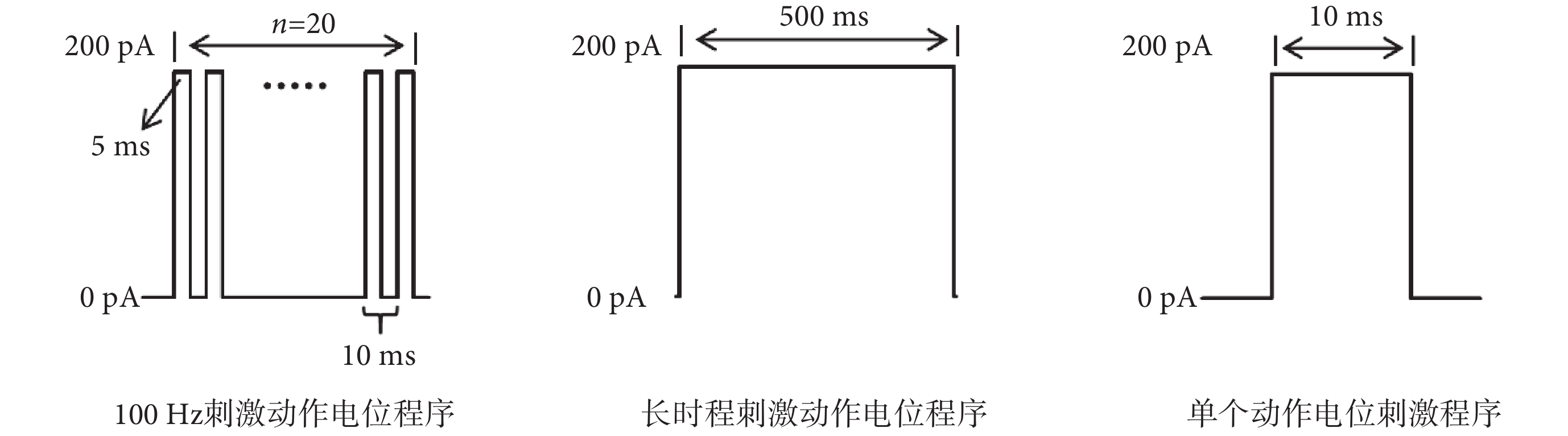
將孵育1 h之后的腦片放入膜片鉗腦片記錄槽內,在低倍鏡下找到DG區,換到高倍水鏡。調整焦距到細胞清晰飽滿,易于觀察。之后打開汞燈,切換460~550 nm帶通濾光片尋找發光細胞。確定目標細胞后,再調至明場(如圖1所示)。玻璃電極沖灌電極內液并安裝于電極夾持器上。之后對目標細胞封接破膜,進行全細胞膜片鉗記錄。每只小鼠記錄4個神經元。各組小鼠統一樣本量為32。根據之前的研究[23]顯示,γ-氨基丁酸能神經元相較于谷氨酸能神經元顯示出較高的頻率適應性,即在100 Hz頻率下對γ-氨基丁酸能神經元和谷氨酸能神經元進行20個動作電位的誘發,γ-氨基丁酸能神經元誘發動作電位的成功率在80%以上(誘發16個及以上的動作電位),谷氨酸能神經元誘發動作電位的成功率在80%以下。因此本實驗采用全細胞電流鉗記錄模式,記錄海馬DG區谷氨酸能神經元和γ-氨基丁酸能神經元的靜息膜電位,在100 Hz頻率、刺激電流為200 pA電流刺激下誘發的20個動作電位,200 pA刺激500 ms的去極化電流下的動作電位發放個數和發放頻率,以及200 pA刺激10 ms的去極化電流下的單個誘發動作電位(刺激程序如圖2所示)。分析100 Hz頻率下誘發20個動作電位的成功率、神經元的靜息膜電位、500 ms長時程刺激下動作電位的發放個數,以及單個動作電位的閾值、峰值、半波寬、達峰時間、最大上升斜率和最大下降斜率。膜片鉗實驗所有信號數據均由德國HEKA公司的PatchMaster軟件采集記錄。
 圖1
膜片鉗顯微鏡鉗制細胞圖
Figure1.
Diagram of cells under microscope with patch clamp
圖1
膜片鉗顯微鏡鉗制細胞圖
Figure1.
Diagram of cells under microscope with patch clamp
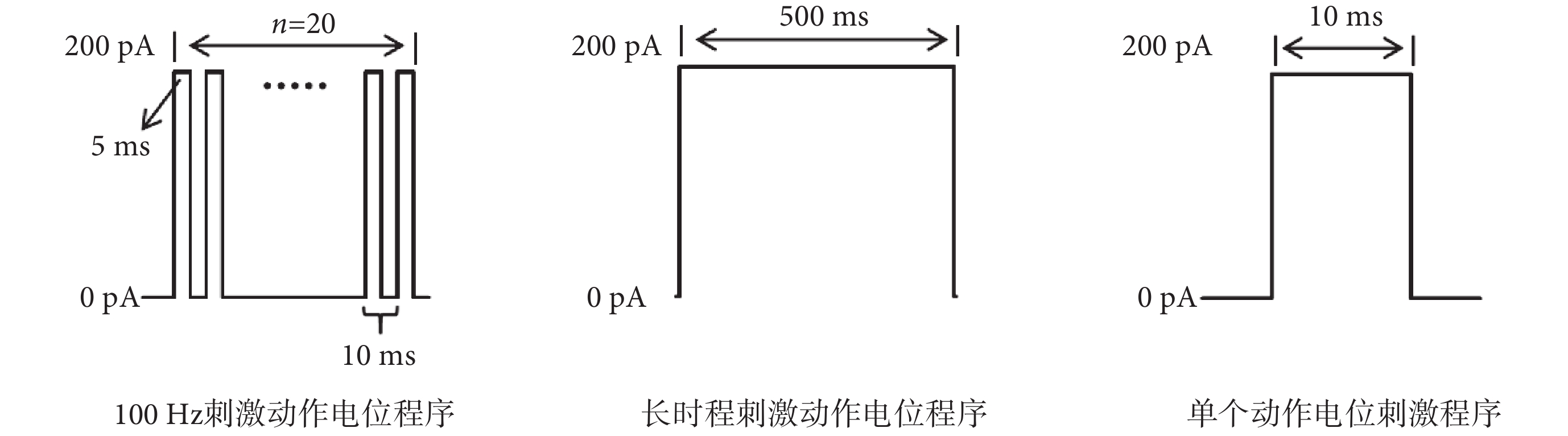 圖2
腦片膜片鉗刺激程序
Figure2.
Brain patch clamp stimulation procedure
圖2
腦片膜片鉗刺激程序
Figure2.
Brain patch clamp stimulation procedure
1.9 數據統計分析
統計學分析使用GraphPad Prism8.0和Origin 2018統計學軟件對數據進行處理和制作統計圖,統計結果以均值±標準誤差表示,組間比較用Student’s t-test進行分析,相關性分析使用Pearson相關性分析方法進行分析。檢驗水準為0.05。
2 結果
2.1 光纖記錄實驗結果
光纖記錄實驗結果如圖3所示,為了更好的將各實驗組進行對比,將每組鈣信號中截取相同時間范圍內的數據并對應同樣范圍的色度標尺,繪制鈣熒光變化的事件相關熱度圖與線圖(如圖3a~b所示)。四組雌性昆明小鼠原始鈣信號的熒光強度的變化率和上升時間顯示(如圖3c所示),Glu rTMS組鈣信號熒光強度變化率顯著高于Glu sham組,GABA rTMS組鈣信號熒光強度變化率顯著高于GABA sham組。Glu rTMS和Glu sham組鈣信號上升時間無顯著差異,GABA rTMS和GABA sham組鈣信號上升時間無顯著差異。上述結果表明,rTMS可以顯著提高昆明雌性小鼠海馬DG區谷氨酸能神經元集群和γ-氨基丁酸能神經元集群鈣信號熒光強度變化率。
 圖3
光纖記錄實驗結果
圖3
光纖記錄實驗結果
a. 鈣熒光事件相關線圖;b. 鈣熒光事件相關熱度圖;c. 鈣信號上升時間及信號變化率
Figure3. The result of of fiber photometrya. Ca2 + fluorescence intensity change event correlation; Ca2 + fluorescence intensity change heat map; c. the change amplitude and rise time of fluorescence intensity of fiber Ca2 + signal
2.2 行為學實驗結果
2.2.1 新物體實驗結果
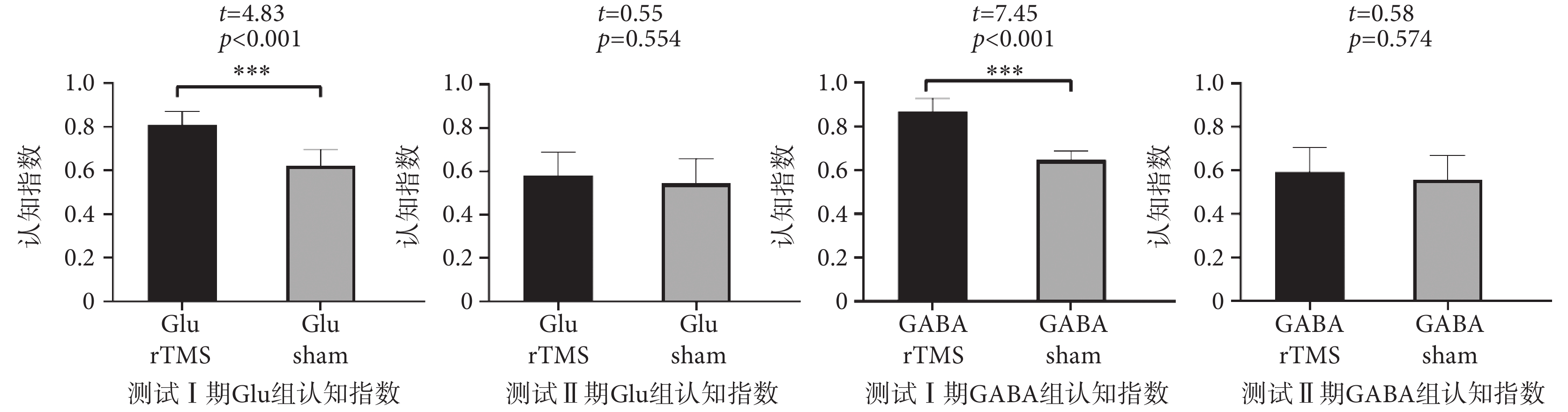
新物體實驗結果如圖4所示,Glu rTMS組測試Ⅰ期認知指數顯著高于Glu sham組;Glu rTMS組測試Ⅱ期認知指數與Glu sham組差異無統計學意義。GABA rTMS組測試Ⅰ期認知指數顯著高于GABA sham組;GABA rTMS組測試Ⅱ期認知指數與GABA sham組差異無統計學意義。新物體識別測試Ⅰ期數據分析的結果表明,rTMS可以顯著提升小鼠與空間記憶相關的短期記憶能力。
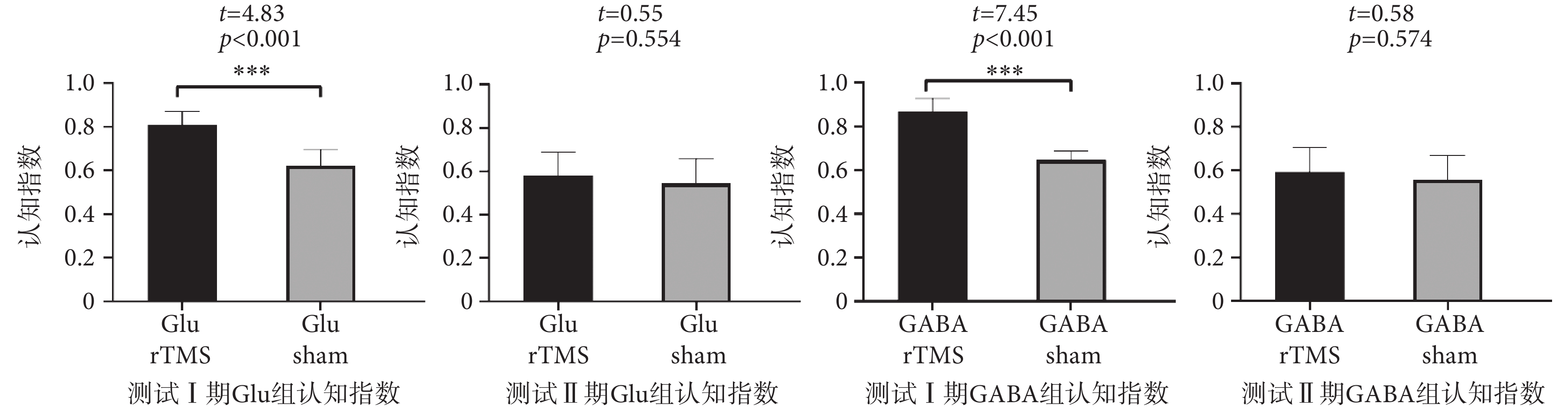 圖4
新物體識別實驗測試期認知指數
Figure4.
The cognitive index of novel object recognition test
圖4
新物體識別實驗測試期認知指數
Figure4.
The cognitive index of novel object recognition test
2.2.2 Morris水迷宮實驗結果
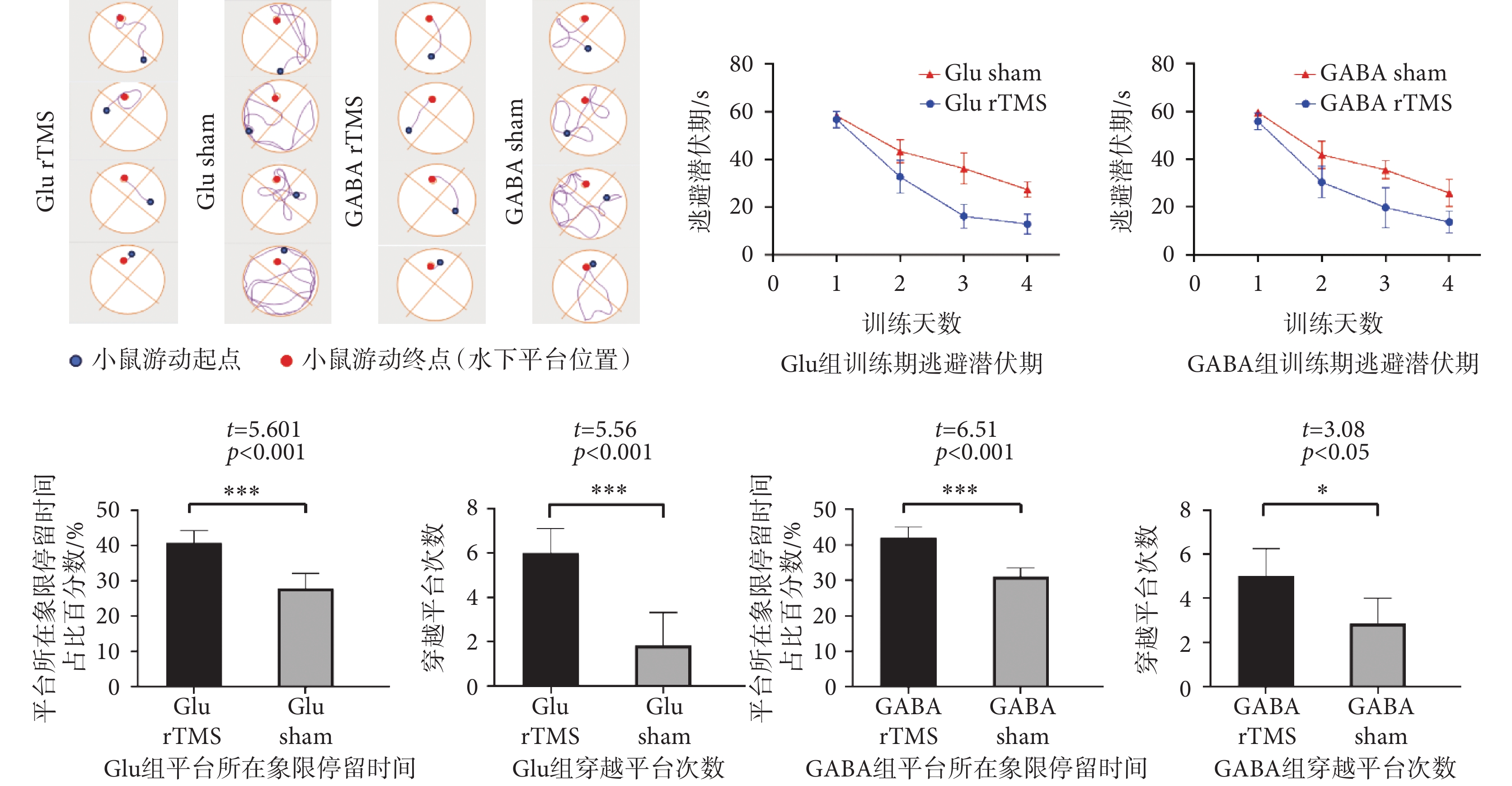
Morris水迷宮實驗結果如圖5所示,四組昆明雌性小鼠在訓練四天后都能找到隱藏平臺位置。與Glu sham組、GABA sham組小鼠相比,Glu rTMS、GABA rTMS組尋找隱藏平臺位置的路線較為簡單直接。四組小鼠的逃避潛伏期均隨訓練天數的增加而減少,而且在同樣訓練條件下,Glu rTMS組小鼠和GABA rTMS組小鼠的潛伏期顯著低于Glu sham和GABA sham組小鼠。測試期結果顯示,Glu rTMS、GABA rTMS組小鼠測試期在平臺所在象限停留時間百分比顯著高于Glu sham組、GABA sham組。Glu rTMS、GABA rTMS組小鼠測試期穿越平臺的次數顯著高于Glu sham組、GABA sham組。上述結果表明,rTMS可以顯著提高小鼠的空間導航能力。
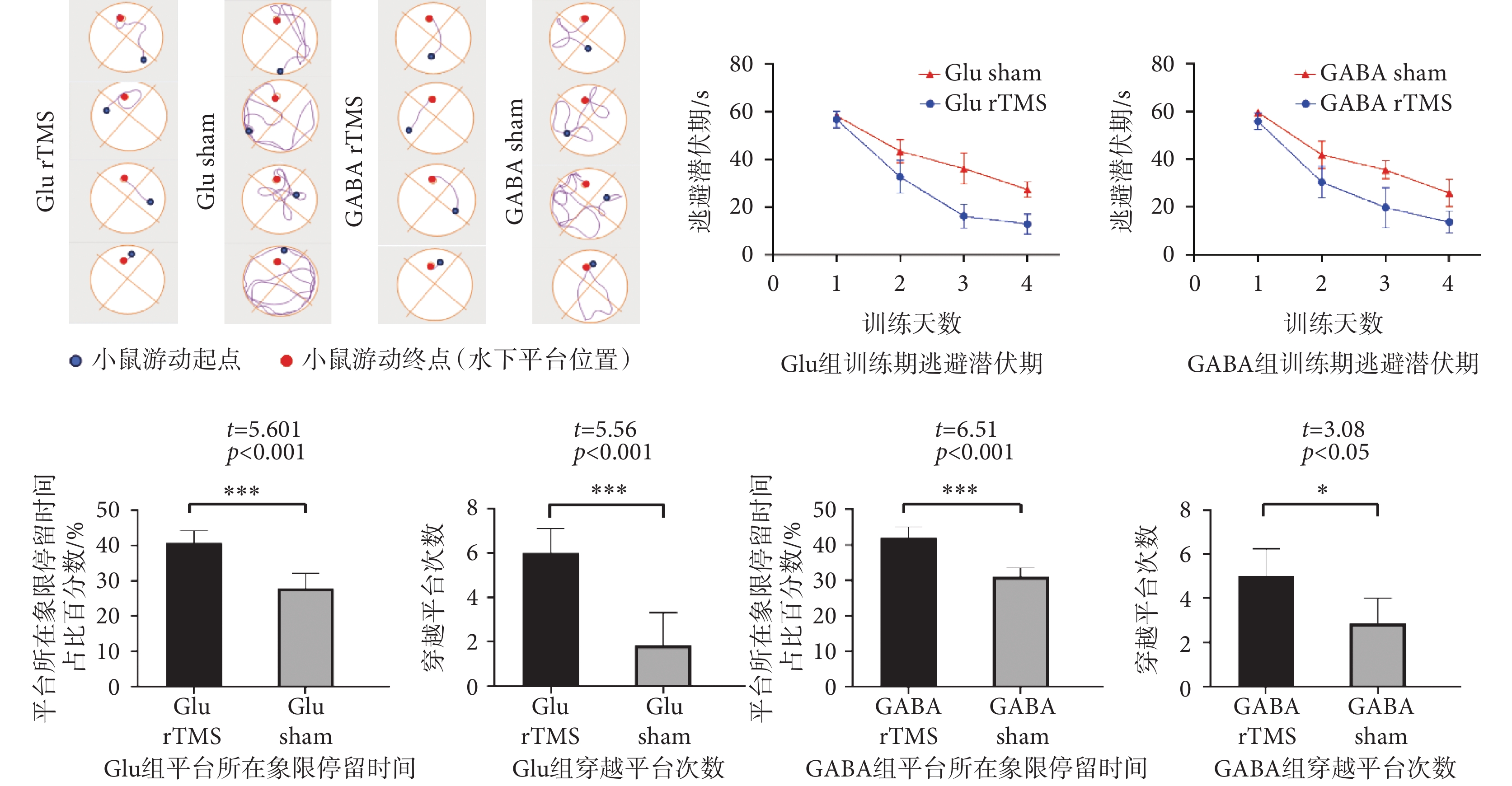 圖5
水迷宮實驗結果
Figure5.
The result of Morris water maze experiment
圖5
水迷宮實驗結果
Figure5.
The result of Morris water maze experiment
2.3 腦片膜片鉗實驗結果
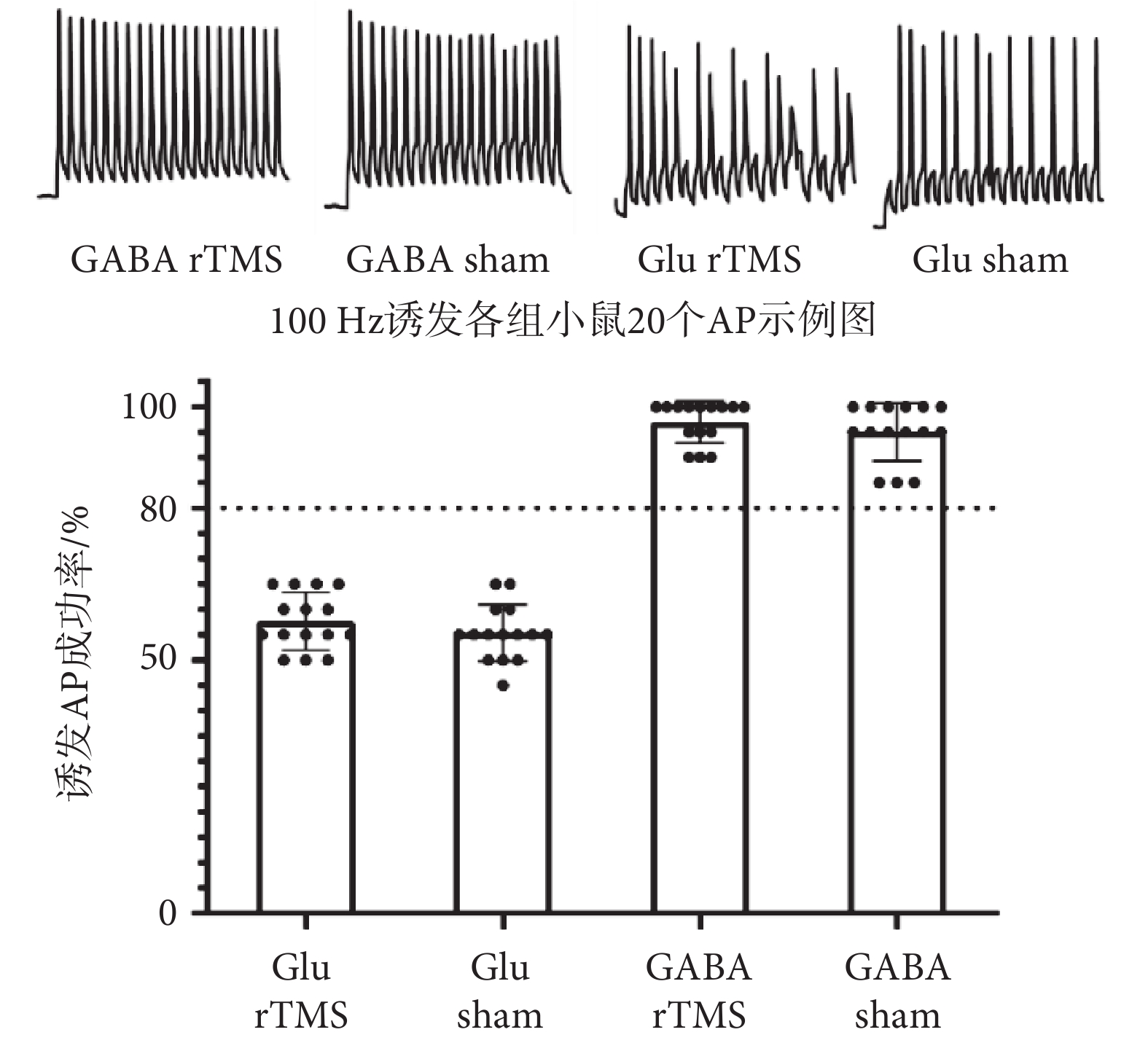
為了進一步確定鉗制細胞類型,本研究在對發光細胞進行動作電位特征記錄之前對鉗制細胞進行100 Hz、200 pA電流刺激,記錄誘發出的20個動作電位的成功率(如圖6所示)。Glu rTMS組誘發動作電位的成功率為(57.67 ± 1.453)%,Glu sham組誘發動作電位的成功率為(55.33 ± 1.420)%,GABA rTMS組誘發動作電位的成功率為(97.00 ± 1.069)%,GABA sham組誘發動作電位的成功率為(95.00 ± 1.464)%。Glu sham組和Glu rTMS組鉗制細胞20個動作電位誘發成功率均在80%以下,而GABA sham組和GABA rTMS組鉗制細胞20個動作電位誘發成功率均在80%以上。
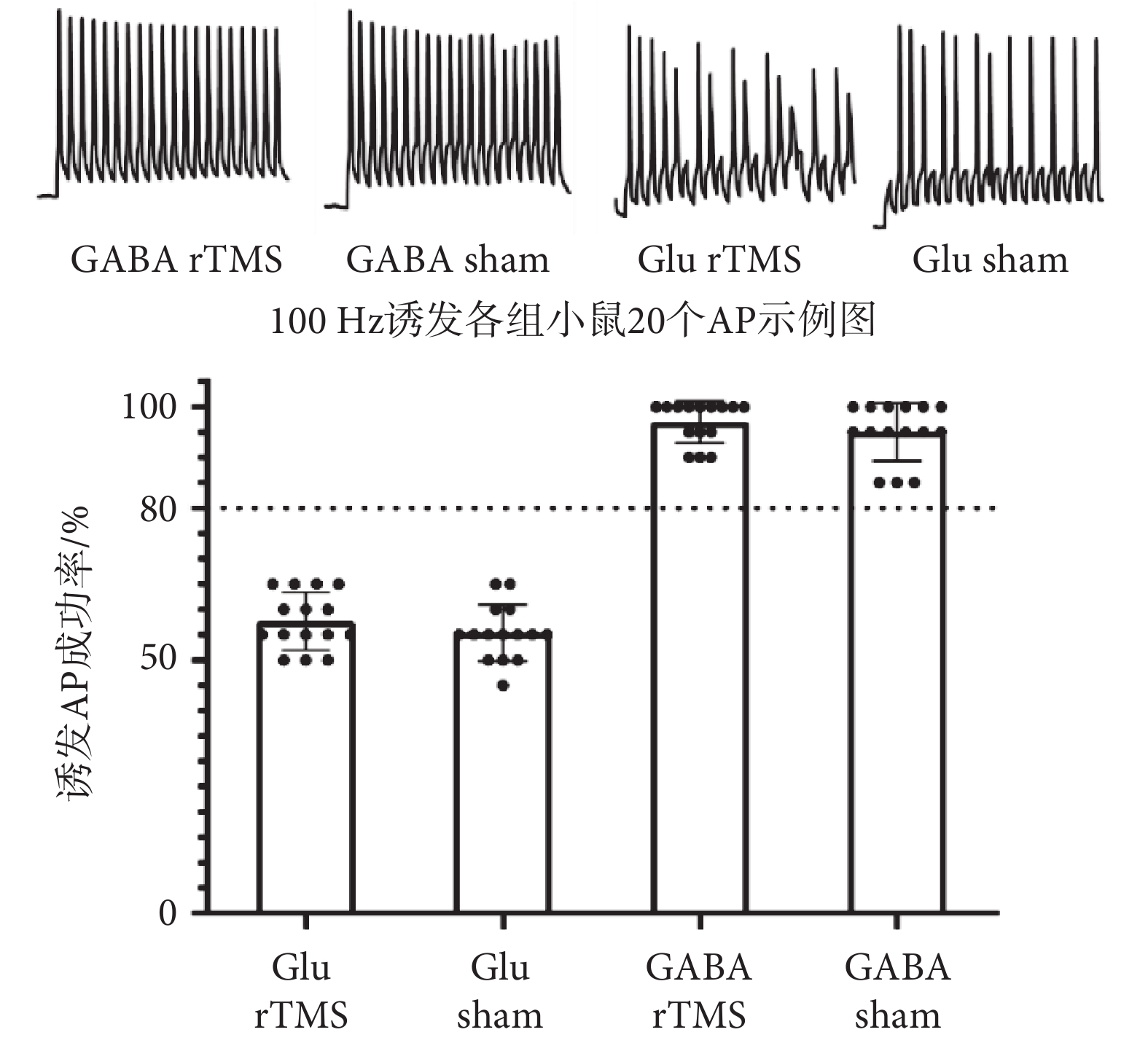 圖6
100 Hz電流誘發20個動作電位成功率
Figure6.
The success rate of 20 action potentials induced by 100 Hz current
圖6
100 Hz電流誘發20個動作電位成功率
Figure6.
The success rate of 20 action potentials induced by 100 Hz current
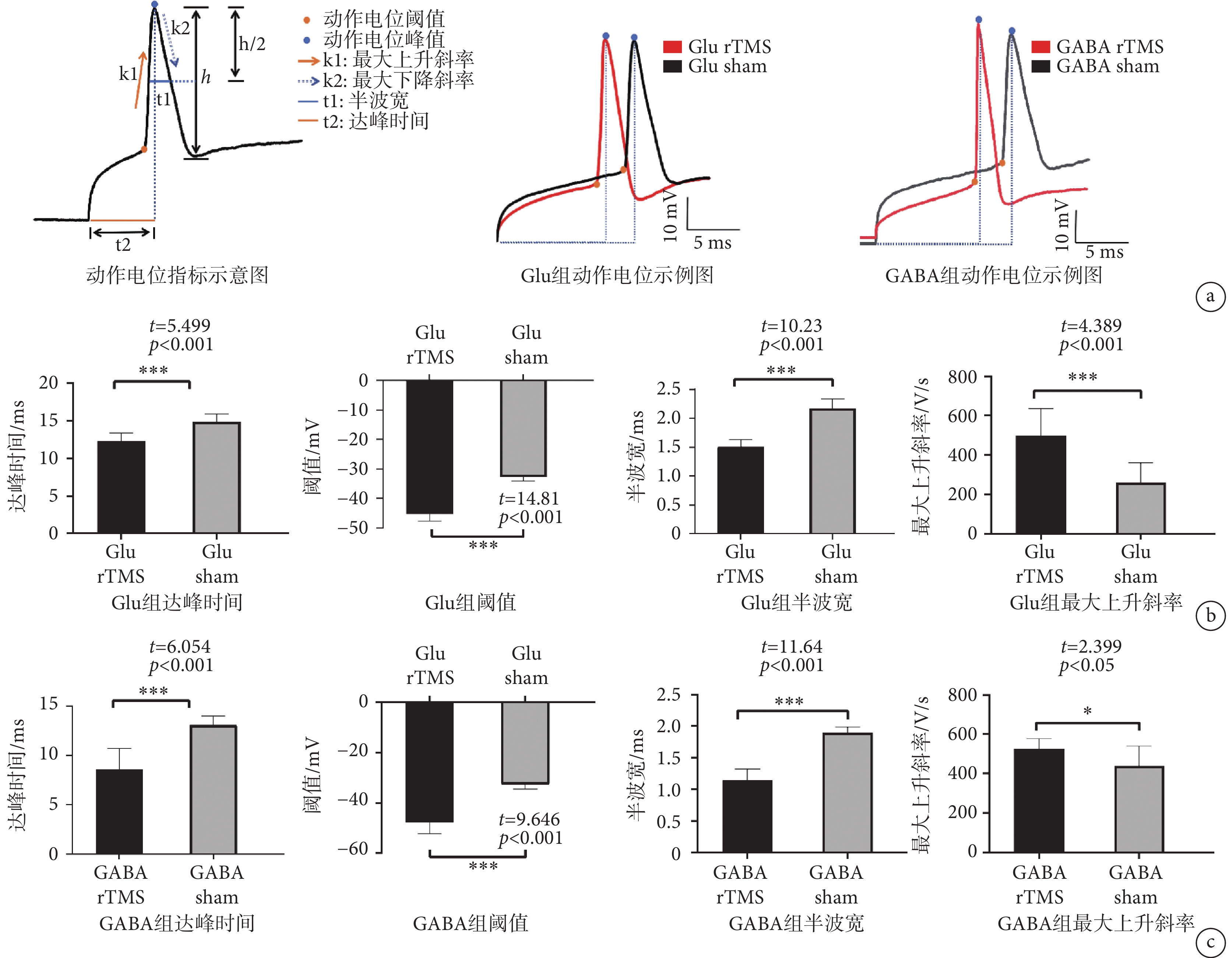
長時程刺激誘發動作電位頻數結果顯示,Glu rTMS組放電頻數與Glu sham組差異無統計學意義,GABA rTMS組放電頻數與GABA sham組差異亦無統計學意義(具體數據參見附件2)。單個動作電位實驗結果如圖7所示,其中單個動作電位誘發特征示意圖如圖7a所示。統計學數據顯示,Glu rTMS組和Glu sham組靜息膜電位、峰值差異無統計學意義,GABA rTMS組和GABA sham組靜息膜電位、峰值差異無統計學意義(具體數據參見附件3)。Glu rTMS組動作電位達峰時間顯著小于Glu sham組,Glu rTMS組閾值顯著小于Glu sham組,Glu rTMS組動作電位半波寬顯著小于Glu sham組,Glu rTMS組最大上升斜率顯著高于Glu sham組(見圖7b)。GABA rTMS組動作電位達峰時間顯著小于GABA sham組,GABA rTMS組閾值顯著小于GABA sham組,GABA rTMS組動作電位半波寬顯著小于GABA sham組,GABA rTMS組最大上升斜率顯著高于GABA sham組(見圖7c)。單個動作電位數據參見附件4。
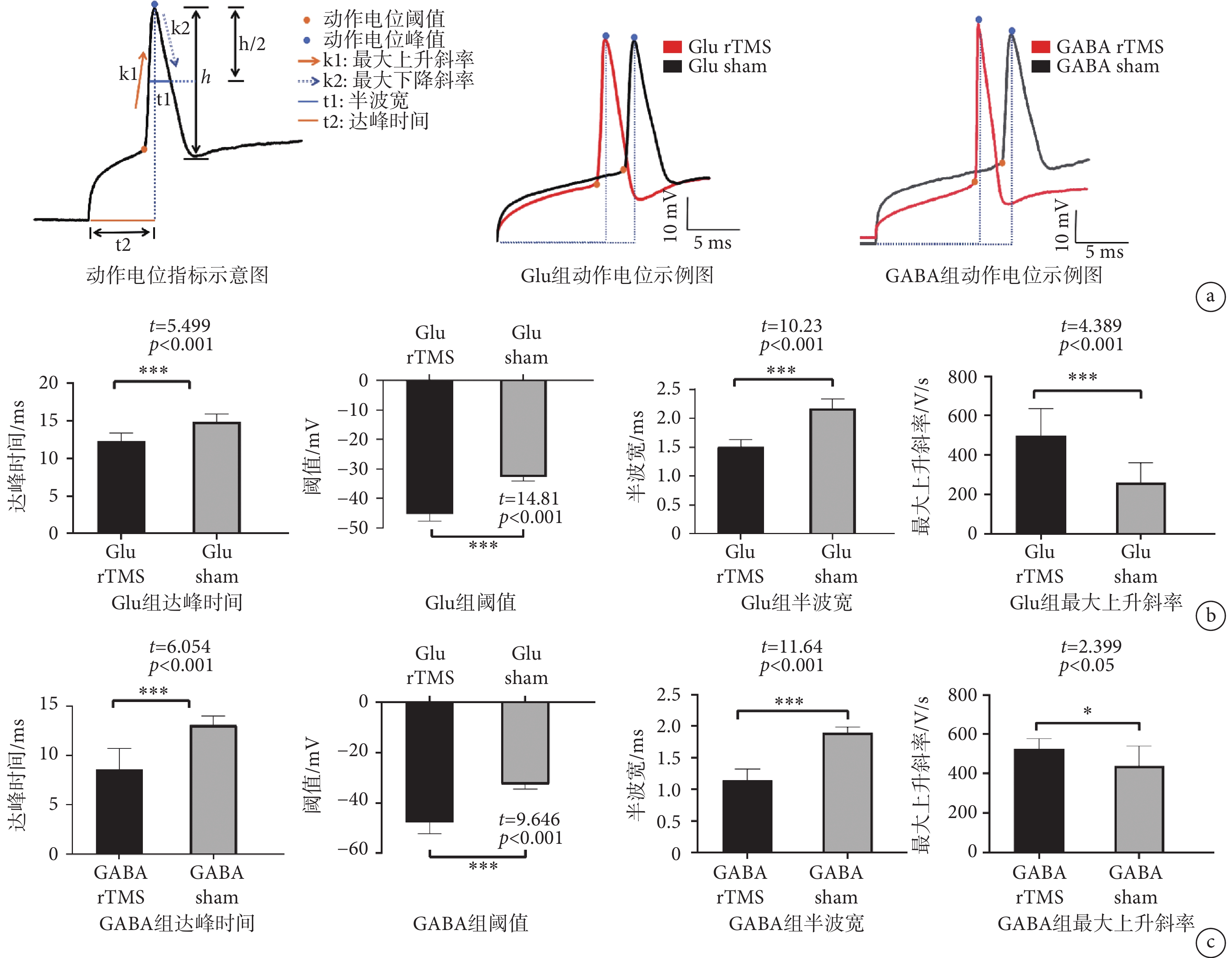 圖7
膜片鉗實驗結果
圖7
膜片鉗實驗結果
a. 單個動作電位;b. Glu rTMS和Glu sham組膜電位相關指標分析 c. GABA rTMS和GABA sham組膜電位相關指標分析
Figure7. The result of patch clampa. single AP; b. Glu rTMS and Glu sham analysis of related indexes of membrane potential; c. GABA rTMS and GABA sham analysis of related indexes of membrane potential
2.4 Pearson相關性分析結果
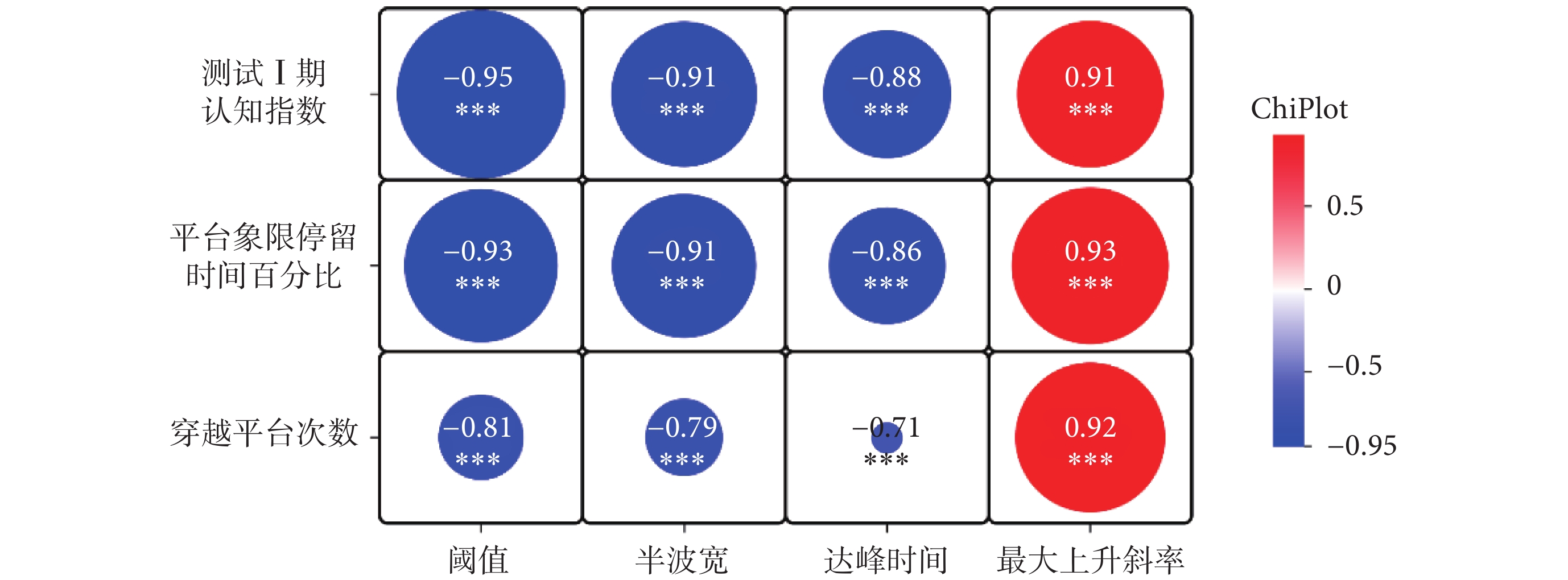
為了進一步確定認知功能與神經元興奮性之間的關系,本研究對行為學結果與神經元動作電位指標之間進行相關性分析(如圖8所示)。相關性結果顯示測試Ⅰ期認知指數與神經元動作電位指標閾值(r = –0.95,P < 0.001)、半波寬(r = –0.91,P < 0.001)、達峰時間(r = –0.88,P < 0.001)、最大上升斜率(r = 0.95,P < 0.001)均有相關性,平臺象限停留時間百分比與神經元動作電位指標閾值( r = –0.93,P < 0.001)、半波寬(r = –0.91,P < 0.001)、達峰時間(r = –0.86,P < 0.001)、最大上升斜率均(r = 0.93,P < 0.001)均有相關性,穿越平臺次數與神經元動作電位指標閾值(r = –0.81,P < 0.001)、半波寬(r = –0.79,P< 0.001)、達峰時間(r = –0.71,P < 0.001)、最大上升斜率(r = 0.92,P < 0.001)也均呈相關性。Pearson相關性分析結果表明,rTMS對小鼠短期記憶能力和空間導航能力的提高與rTMS對小鼠海馬區神經元動作電位指標的增強有關。
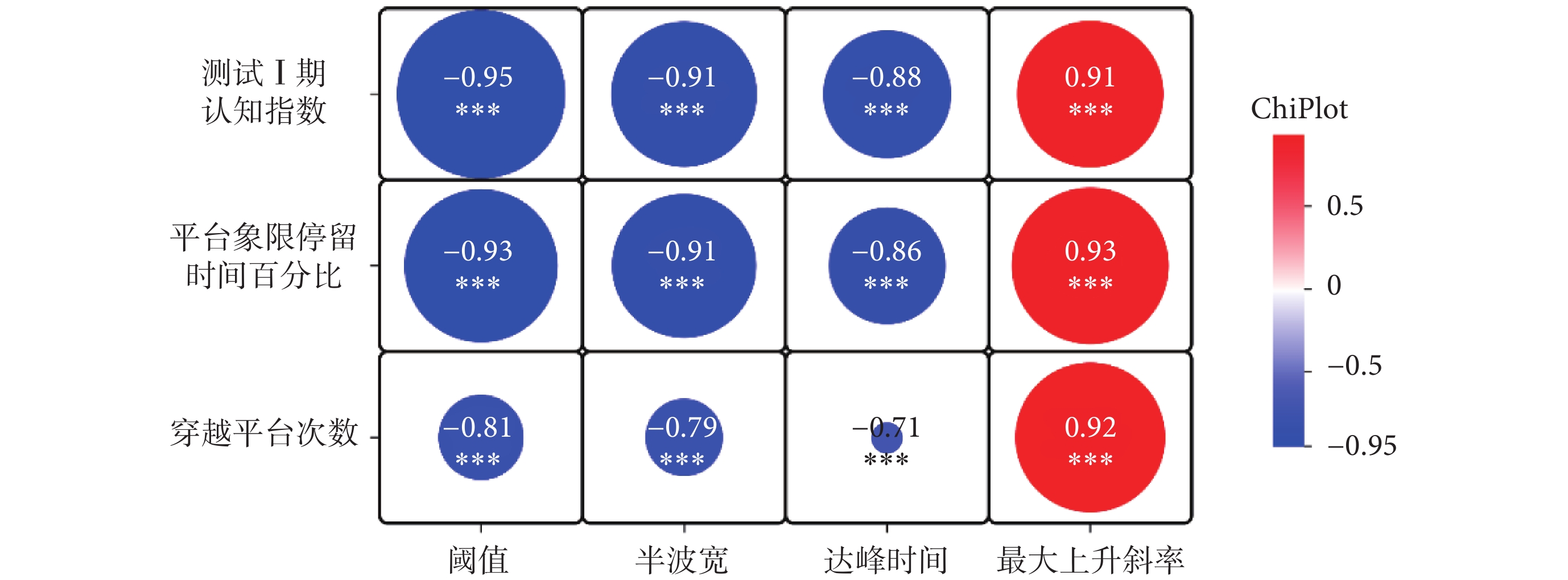 圖8
相關性分析結果
Figure8.
The result of correlation analysis
圖8
相關性分析結果
Figure8.
The result of correlation analysis
3 討論
本研究使用新物體識別、水迷宮、在體光纖記錄、腦片膜片鉗等實驗技術,探究rTMS對小鼠認知能力和海馬DG區谷氨酸能神經元、γ-氨基丁酸能神經元的影響。并且提出假設:rTMS影響小鼠的認知功能,并且小鼠認知功能的改變與海馬區谷氨酸能神經元和γ-氨基丁酸能神經元興奮性的改變有關。實驗結果表明,rTMS可以提高小鼠的學習記憶能力,提高海馬谷氨酸能神經元和γ-氨基丁酸能神經元的興奮性。
新物體識別實驗通過新物體(形狀、大小等)的靈活變換,可為動物長期或短期記憶機制的形成以及刺激或藥物在記憶形成特定階段的療效提供判定依據[24]。本研究明小鼠測試Ⅰ期rTMS組認知指數顯著高于sham組,而測試Ⅱ期rTMS組和sham組之間沒有明顯差異,或可提示20 Hz的rTMS可以提高昆明小鼠的短期記憶而無法改善長期記憶能力。莫里斯水迷宮實驗通過記錄動物找到水下平臺來評價動物空間導航能力和學習記憶能力[25]。本研究的結果顯示,20 Hz的rTMS可以有效提高小鼠的空間探索能力和記憶能力。這與之前的研究中rTMS可以增強被試人員的記憶能力結論相似[9]。同樣,本實驗室之前對C57老年小鼠的行為學探究也顯示出相似的結論[26]。
基因編碼鈣指示劑可以在在體水平清楚地檢測到神經元中單個動作電位引發的Ca2+熒光信號并借助于光纖記錄系統高效反映細胞Ca2+濃度改變,從而反映神經元的興奮性。本研究結果顯示,rTMS使海馬DG區谷氨酸能神經元和γ-氨基丁酸能神經元鈣信號熒光強度變化率均有提高,表明rTMS可以顯著提高海馬腦區谷氨酸能神經元集群和γ-氨基丁酸能神經元集群的興奮性。
神經元動作電位是衡量單個神經元興奮性的標準。本研究中施加20 Hz磁刺激小鼠的谷氨酸能神經元和γ-氨基丁酸能神經元動作電位閾值明顯降低,半波寬時間跨度減小,達峰時間減小,最大上升斜率升高。動作電位閾值是膜去極化的臨界點。谷氨酸能神經元和γ-氨基丁酸能神經元動作電位閾值的降低代表神經元對于觸發動作電位的刺激更為敏感,兩類主要神經元更容易被激活。半波寬時間跨度減小、達峰時間減小、最大上升斜率升高表明rTMS提高了細胞膜去極化速度。已有研究表明高頻rTMS可顯著影響海馬腦區神經元鈉通道電流,提高細胞去極化速率,從而提高神經元興奮性[27]。這與本研究的結論一致。Pearson相關性分析結果顯示測試Ⅰ期認知指數、穿越平臺次數、平臺象限停留時間與神經元動作電位指標閾值、半波寬、達峰時間、最大上升斜率均呈相關性表明rTMS對小鼠谷氨酸能神經元和γ-氨基丁酸能神經元興奮性的提高與rTMS對小鼠認知功能的提高有關。
上述結果表明,rTMS提高了小鼠海馬DG區兩類主要神經元的興奮性,進而提高了小鼠的學習記憶能力。本研究探究了rTMS對不同類型神經元興奮性的影響,為研究rTMS作用機制提供新的方法和支持。
4 結論
20Hz的rTMS可以有效提高小鼠的學習記憶能力和認知水平,提高小鼠海馬DG區谷氨酸能神經元集群和γ-氨基丁酸能神經元集群的光纖鈣信號熒光強度變化率,提高谷氨酸能神經元和γ-氨基丁酸能神經元的興奮性。研究結果提示,20 Hz的rTMS通過提高海馬DG區谷氨酸能神經元和γ-氨基丁酸能神經元興奮性從而提高學習記憶能力,可能是rTMS提高學習記憶能力和認知水平的機制之一{Zong, 2022 #2}。
重要聲明
利益沖突聲明:本文全體作者均聲明不存在利益沖突。
作者貢獻聲明:丁沖負責實驗的整體安排和最終論文的修改,王佳樂是實驗的主要完成者和論文的主要撰稿人,付蕊、張澤、趙峻嶠在實驗過程中提供了幫助,朱海軍為實驗規劃上提供理論方面的支持。所有作者都閱讀并通過了最終草案。
倫理聲明:本研究通過了河北工業大學倫理委員會的審批(批文編號:HEBUTacuc2022028)。
本文附件見本刊網站的電子版本(
0 引言
重復經顱磁刺激(repeated transcranial magnetic stimulation,rTMS)是一種非侵入性神經調控技術,具有安全性高、操作簡便和副作用小等特點[1]。rTMS作用原理是在刺激線圈中產生一個強烈且短暫的電流脈沖,產生脈沖磁場。磁場作用于大腦,改變腦內神經元的電生理環境,誘導皮層興奮性的變化[2]。目前,rTMS在認知功能損傷的臨床治療中顯示出療效[3-5]。其中,20 Hz高頻rTMS可以顯著改善神經精神類疾病患者認知功能,提高皮質神經元的興奮性,改善患者的認知功能和記憶能力[6-7]。動物離體實驗中,Chameh等[8]的研究發現,rTMS刺激后的大鼠CA1錐體神經元的達峰時間低于對照組,神經元興奮性增強。同樣,朱海軍等[9]研究發現,rTMS在對老年小鼠進行為期15天20 Hz的刺激可以降低神經元的閾值,提高神經元的興奮性。
海馬腦區與記憶處理存儲、認知能力、學習能力等多個方面有關[10]。Hermiller等[11]發現經顱磁刺激通過作用于海馬腦區增強被試人員的記憶能力。神經元根據功能主要分為興奮性神經元和抑制性神經元[12]。其中谷氨酸能神經元(glutamatergic neurons)是海馬內最主要的興奮性神經元,約占海馬神經元總數的78%[13];γ-氨基丁酸能神經元(GABAergic neurons)是海馬內最主要的抑制性神經元,約占海馬神經元總數的15%[14]。谷氨酸能神經元釋放谷氨酸神經遞質到突觸間隙中激活鈉、鉀和鈣通道,引起突觸后神經元興奮[15]。γ-氨基丁酸能神經元釋放γ-氨基丁酸神經遞質與突觸后神經元上受體結合,激活氯離子通道,抑制突觸后神經元放電[16]。目前生物實驗中區分谷氨酸能神經元和γ-氨基丁酸能神經元需要借助基因編輯技術、DNA重組技術、細胞培養技術等[17-19]。其中,使用基因編碼鈣指示劑(genetically encoded calcium indicators)標記神經元,測量神經元活動已成為神經科學中廣泛使用的方法。
當神經元受到足夠的刺激時,細胞膜上的離子通道打開,細胞內外的電荷分布發生變化從而形成動作電位。動作電位是表征神經元興奮性的重要指標[20],研究顯示,長期施加rTMS可改變海馬神經元的興奮性,改變神經元靜息膜電位和動作電位閾值[21]。目前已有研究從認知功能、電生理、分子等多個層面對rTMS的作用機制進行探索[22],但是rTMS對海馬兩類主要神經元的影響目前尚不明確。本研究通過rTMS對小鼠認知功能與兩類主要神經興奮性的影響,探究rTMS對認知功能的改變和內在作用機制。
1 材料與方法
1.1 實驗動物
本實驗采用野生型昆明雌性小鼠,8周齡,體重(32 ± 3)g。小鼠購自河南斯克貝斯生物科技股份有限公司。實驗動物許可證號:SCXK(豫)2020-0005。動物實驗遵守河北工業大學倫理委員會的準則,完全符合實驗動物使用標準。
1.2 實驗設備
本研究所用實驗設備包括:重復經顱磁刺激儀(武漢依瑞德醫療設備新技術有限公司),新物體識別實驗箱(賽昂斯生物科技有限公司),水迷宮實驗設備(賽昂斯生物科技有限公司),光纖記錄設備(千奧星科南京生物科技有限公司),數顯恒溫水浴鍋(邦西儀器科技有限公司),P-97玻璃電極拉制儀(Sutter,美國),Milli-Q純水儀(Millipore,美國),滲透壓儀(雅森國際集團有限公司),EPC雙通道膜片鉗放大器(HEKA,德國)。
1.3 實驗設計
小鼠在適應性喂養一周后,進行光纖植入手術,分別注射腺相關病毒標記小鼠海馬腦區谷氨酸能神經元和γ-氨基丁酸能神經元,之后植入光纖。休養兩周后剔除無信號小鼠,將16只注射VGAT1病毒標記γ-氨基丁酸能神經元神經元小鼠隨機分為γ-氨基丁酸能刺激組(GABA rTMS,n = 8)和γ-氨基丁酸能對照組(GABA sham,n = 8);16只注射CaMKIIa病毒標記谷氨酸能神經元小鼠,隨機分為谷氨酸能刺激組(Glu rTMS,n = 8)和谷氨酸能對照組(Glu sham,n = 8)。各組小鼠進行rTMS刺激或假刺激,連續刺激14天。rTMS刺激結束后對小鼠進行在體光纖記錄,記錄小鼠海馬齒狀回(dentate gyrus,DG)區谷氨酸能神經元和γ-氨基丁酸能神經元的的鈣離子濃度變化。之后進行新物體識別和莫里斯水迷宮行為學實驗探究小鼠學習記憶能力的改變。行為學實驗結束后,對四組小鼠進行膜片鉗電生理實驗。
1.4 病毒注射及光纖植入手術
實驗使用rAAV-CaMKIIa-GCaMp6m-WPRE-hGH polyA重組腺相關病毒(武漢樞密腦科學技術有限公司,中國)特異性標記谷氨酸能神經元,PFD-rAAV-VGAT1-GCaMp6m-WPRE-hGH polyA重組腺相關病毒(武漢樞密腦科學技術有限公司,中國)特異性標記γ-氨基丁酸能神經元。病毒標記區域為小鼠海馬腦區DG區,病毒標記位置為中縫右側1.2 mm,前囟向后1.7 mm,腦區深度2 mm,病毒注射200 nL。注射病毒結束后在同一位置顱骨平面向下1.98 mm埋置光纖陶瓷插芯。光纖陶瓷插芯規格:長度3 mm,直徑1.25 mm。小鼠在光纖植入手術結束后被放入籠中休養兩周,之后對小鼠進行rTMS刺激,刺激結束后對小鼠進行鈣離子光纖信號記錄。
1.5 重復經顱磁刺激
實驗采用依瑞德CCY-IA型高性能磁場刺激儀,線圈采用Y064號動物標準圓型線圈,外型尺寸為64 mm × 30 mm,內線圈外徑56 mm,內徑14 mm,高23 mm。最大磁場強度為3.6 T。本實驗中對小鼠進行運動閾值測定時,刺激器放于動物腦部正上方緊貼頭皮,采用單脈沖刺激方式,強度從刺激儀最低刺激強度開始逐步上升刺激小鼠,當動物前肢開始抽動時,記錄此時的磁刺激強度。對所有動物進行上述步驟發現所有動物刺激閾值均為刺激儀最大強度的11%,約為0.396 T。測試小鼠運動閾值為最大強度的11%,刺激強度設置為閾值的80%,約為0.32 T。刺激頻率采用高頻20 Hz,每天刺激1 000個脈沖,連續刺激14天。線圈平行于小鼠頂骨,放置于頭皮表面之上2~3 mm處。刺激時間為上午8:00―12:00。對照組小鼠均接受假刺激,將線圈垂直于小鼠頭頂放置約50 cm,小鼠聽到刺激聲音而不接受刺激。
1.6 光纖記錄實驗
本實驗所用的光纖記錄設備來自千奧星科南京生物科技有限公司。信號采集軟件為CamFiberPhotometry,在小鼠休養2周病毒完全表達后進行信號檢測,將光纖與小鼠頭部的陶瓷插芯相連,剔除無信號的失敗小鼠。對各組小鼠的鈣離子信號變化進行記錄并分析,計算各組小鼠信號的信號峰值和上升時間。結合Matlab軟件制作鈣信號的熱度圖和事件相關線圖,并分析四組雌性昆明小鼠原始鈣信號的熒光強度的變化率和上升時間。
1.7 行為學實驗
1.7.1 新物體識別實驗
新物體識別實驗包括適應期、熟悉期、測試Ⅰ期、測試Ⅱ期四個階段。適應期小鼠被放置在實驗箱中探索30 min適應箱內環境。24 h后進行熟悉期,熟悉期箱內同側放置兩個大小形狀完全一樣的物體。將動物背對兩個方塊放入實驗箱,小鼠自由活動10 min。小鼠放回鼠籠1 h,期間將兩個相同的物體取出一個,放入一個尺寸相當但顏色形狀不同的新物體進行代替,1 h計時結束后進入測試Ⅰ期。測試Ⅰ期小鼠自由探索5 min,期間記錄小鼠探索新物體的時間T1(1 h)和舊物體的時間T2(1 h)。小鼠放回鼠籠,清理新物體箱并將之前的舊物體換成另一個新物體。24 h后進入測試Ⅱ期,小鼠放入新物體識別箱內自由探索5 min,期間記錄小鼠探索新物體的時間T1(24 h)和舊物體的時間T2(24 h)。流程圖參見附件1。在所有的實驗階段,每只小鼠測試結束后,用70%的酒精對箱體內進行擦拭,避免動物殘留氣味影響實驗。認知指數(cognitive index,CI)計算公式為CI = T1/(T1 + T2)。
1.7.2 Morris水迷宮實驗
本研究進行的Morris水迷宮實驗共分為訓練期和測試期兩個階段。訓練期在水中放入平臺,水略微沒過平臺。訓練期將動物頭朝池壁放入水中,放入位置依次為東、西、南、北四個起始位置。記錄60 s內找到平臺所需時間即為逃避潛伏期,若60 s內小鼠未能找到平臺,則逃避潛伏期記為60 s,訓練期時間為4天,每天記錄動物找到水下平臺的逃避潛伏期(s)和運動軌跡。訓練期實驗結束24 h后進行測試期實驗,測試期去掉平臺。所有小鼠統一放置在平臺對側起始位置,記錄小鼠在平臺區域所在象限停留的時間占總時間的百分比和穿越平臺次數。
1.8 膜片鉗電生理實驗
1.8.1 溶液配制
腦片膜片鉗中用到的人工腦脊液、切片液、電極內液如表1所示。
1.8.2 急性分離腦片的制備
將麻醉機的前置誘導盒中持續通入濃度為3.5 %、流量0.5 L/min的異氟烷氣體,將小鼠放入前置誘導盒中,當小鼠完全麻醉后,迅速斷頭取腦,取出全腦后將大腦完全浸入冰水混合狀態且氧氣飽和的切片液中。之后用型號為VT1200S的徠卡振動切片機對小鼠大腦進行切片,切片厚度為300 μm。之后將腦片放入28 ℃恒溫的人工腦脊液中孵育1 h。
1.8.3 全細胞腦片膜片鉗
將孵育1 h之后的腦片放入膜片鉗腦片記錄槽內,在低倍鏡下找到DG區,換到高倍水鏡。調整焦距到細胞清晰飽滿,易于觀察。之后打開汞燈,切換460~550 nm帶通濾光片尋找發光細胞。確定目標細胞后,再調至明場(如圖1所示)。玻璃電極沖灌電極內液并安裝于電極夾持器上。之后對目標細胞封接破膜,進行全細胞膜片鉗記錄。每只小鼠記錄4個神經元。各組小鼠統一樣本量為32。根據之前的研究[23]顯示,γ-氨基丁酸能神經元相較于谷氨酸能神經元顯示出較高的頻率適應性,即在100 Hz頻率下對γ-氨基丁酸能神經元和谷氨酸能神經元進行20個動作電位的誘發,γ-氨基丁酸能神經元誘發動作電位的成功率在80%以上(誘發16個及以上的動作電位),谷氨酸能神經元誘發動作電位的成功率在80%以下。因此本實驗采用全細胞電流鉗記錄模式,記錄海馬DG區谷氨酸能神經元和γ-氨基丁酸能神經元的靜息膜電位,在100 Hz頻率、刺激電流為200 pA電流刺激下誘發的20個動作電位,200 pA刺激500 ms的去極化電流下的動作電位發放個數和發放頻率,以及200 pA刺激10 ms的去極化電流下的單個誘發動作電位(刺激程序如圖2所示)。分析100 Hz頻率下誘發20個動作電位的成功率、神經元的靜息膜電位、500 ms長時程刺激下動作電位的發放個數,以及單個動作電位的閾值、峰值、半波寬、達峰時間、最大上升斜率和最大下降斜率。膜片鉗實驗所有信號數據均由德國HEKA公司的PatchMaster軟件采集記錄。
 圖1
膜片鉗顯微鏡鉗制細胞圖
Figure1.
Diagram of cells under microscope with patch clamp
圖1
膜片鉗顯微鏡鉗制細胞圖
Figure1.
Diagram of cells under microscope with patch clamp
 圖2
腦片膜片鉗刺激程序
Figure2.
Brain patch clamp stimulation procedure
圖2
腦片膜片鉗刺激程序
Figure2.
Brain patch clamp stimulation procedure
1.9 數據統計分析
統計學分析使用GraphPad Prism8.0和Origin 2018統計學軟件對數據進行處理和制作統計圖,統計結果以均值±標準誤差表示,組間比較用Student’s t-test進行分析,相關性分析使用Pearson相關性分析方法進行分析。檢驗水準為0.05。
2 結果
2.1 光纖記錄實驗結果
光纖記錄實驗結果如圖3所示,為了更好的將各實驗組進行對比,將每組鈣信號中截取相同時間范圍內的數據并對應同樣范圍的色度標尺,繪制鈣熒光變化的事件相關熱度圖與線圖(如圖3a~b所示)。四組雌性昆明小鼠原始鈣信號的熒光強度的變化率和上升時間顯示(如圖3c所示),Glu rTMS組鈣信號熒光強度變化率顯著高于Glu sham組,GABA rTMS組鈣信號熒光強度變化率顯著高于GABA sham組。Glu rTMS和Glu sham組鈣信號上升時間無顯著差異,GABA rTMS和GABA sham組鈣信號上升時間無顯著差異。上述結果表明,rTMS可以顯著提高昆明雌性小鼠海馬DG區谷氨酸能神經元集群和γ-氨基丁酸能神經元集群鈣信號熒光強度變化率。
 圖3
光纖記錄實驗結果
圖3
光纖記錄實驗結果
a. 鈣熒光事件相關線圖;b. 鈣熒光事件相關熱度圖;c. 鈣信號上升時間及信號變化率
Figure3. The result of of fiber photometrya. Ca2 + fluorescence intensity change event correlation; Ca2 + fluorescence intensity change heat map; c. the change amplitude and rise time of fluorescence intensity of fiber Ca2 + signal
2.2 行為學實驗結果
2.2.1 新物體實驗結果
新物體實驗結果如圖4所示,Glu rTMS組測試Ⅰ期認知指數顯著高于Glu sham組;Glu rTMS組測試Ⅱ期認知指數與Glu sham組差異無統計學意義。GABA rTMS組測試Ⅰ期認知指數顯著高于GABA sham組;GABA rTMS組測試Ⅱ期認知指數與GABA sham組差異無統計學意義。新物體識別測試Ⅰ期數據分析的結果表明,rTMS可以顯著提升小鼠與空間記憶相關的短期記憶能力。
 圖4
新物體識別實驗測試期認知指數
Figure4.
The cognitive index of novel object recognition test
圖4
新物體識別實驗測試期認知指數
Figure4.
The cognitive index of novel object recognition test
2.2.2 Morris水迷宮實驗結果
Morris水迷宮實驗結果如圖5所示,四組昆明雌性小鼠在訓練四天后都能找到隱藏平臺位置。與Glu sham組、GABA sham組小鼠相比,Glu rTMS、GABA rTMS組尋找隱藏平臺位置的路線較為簡單直接。四組小鼠的逃避潛伏期均隨訓練天數的增加而減少,而且在同樣訓練條件下,Glu rTMS組小鼠和GABA rTMS組小鼠的潛伏期顯著低于Glu sham和GABA sham組小鼠。測試期結果顯示,Glu rTMS、GABA rTMS組小鼠測試期在平臺所在象限停留時間百分比顯著高于Glu sham組、GABA sham組。Glu rTMS、GABA rTMS組小鼠測試期穿越平臺的次數顯著高于Glu sham組、GABA sham組。上述結果表明,rTMS可以顯著提高小鼠的空間導航能力。
 圖5
水迷宮實驗結果
Figure5.
The result of Morris water maze experiment
圖5
水迷宮實驗結果
Figure5.
The result of Morris water maze experiment
2.3 腦片膜片鉗實驗結果
為了進一步確定鉗制細胞類型,本研究在對發光細胞進行動作電位特征記錄之前對鉗制細胞進行100 Hz、200 pA電流刺激,記錄誘發出的20個動作電位的成功率(如圖6所示)。Glu rTMS組誘發動作電位的成功率為(57.67 ± 1.453)%,Glu sham組誘發動作電位的成功率為(55.33 ± 1.420)%,GABA rTMS組誘發動作電位的成功率為(97.00 ± 1.069)%,GABA sham組誘發動作電位的成功率為(95.00 ± 1.464)%。Glu sham組和Glu rTMS組鉗制細胞20個動作電位誘發成功率均在80%以下,而GABA sham組和GABA rTMS組鉗制細胞20個動作電位誘發成功率均在80%以上。
 圖6
100 Hz電流誘發20個動作電位成功率
Figure6.
The success rate of 20 action potentials induced by 100 Hz current
圖6
100 Hz電流誘發20個動作電位成功率
Figure6.
The success rate of 20 action potentials induced by 100 Hz current
長時程刺激誘發動作電位頻數結果顯示,Glu rTMS組放電頻數與Glu sham組差異無統計學意義,GABA rTMS組放電頻數與GABA sham組差異亦無統計學意義(具體數據參見附件2)。單個動作電位實驗結果如圖7所示,其中單個動作電位誘發特征示意圖如圖7a所示。統計學數據顯示,Glu rTMS組和Glu sham組靜息膜電位、峰值差異無統計學意義,GABA rTMS組和GABA sham組靜息膜電位、峰值差異無統計學意義(具體數據參見附件3)。Glu rTMS組動作電位達峰時間顯著小于Glu sham組,Glu rTMS組閾值顯著小于Glu sham組,Glu rTMS組動作電位半波寬顯著小于Glu sham組,Glu rTMS組最大上升斜率顯著高于Glu sham組(見圖7b)。GABA rTMS組動作電位達峰時間顯著小于GABA sham組,GABA rTMS組閾值顯著小于GABA sham組,GABA rTMS組動作電位半波寬顯著小于GABA sham組,GABA rTMS組最大上升斜率顯著高于GABA sham組(見圖7c)。單個動作電位數據參見附件4。
 圖7
膜片鉗實驗結果
圖7
膜片鉗實驗結果
a. 單個動作電位;b. Glu rTMS和Glu sham組膜電位相關指標分析 c. GABA rTMS和GABA sham組膜電位相關指標分析
Figure7. The result of patch clampa. single AP; b. Glu rTMS and Glu sham analysis of related indexes of membrane potential; c. GABA rTMS and GABA sham analysis of related indexes of membrane potential
2.4 Pearson相關性分析結果
為了進一步確定認知功能與神經元興奮性之間的關系,本研究對行為學結果與神經元動作電位指標之間進行相關性分析(如圖8所示)。相關性結果顯示測試Ⅰ期認知指數與神經元動作電位指標閾值(r = –0.95,P < 0.001)、半波寬(r = –0.91,P < 0.001)、達峰時間(r = –0.88,P < 0.001)、最大上升斜率(r = 0.95,P < 0.001)均有相關性,平臺象限停留時間百分比與神經元動作電位指標閾值( r = –0.93,P < 0.001)、半波寬(r = –0.91,P < 0.001)、達峰時間(r = –0.86,P < 0.001)、最大上升斜率均(r = 0.93,P < 0.001)均有相關性,穿越平臺次數與神經元動作電位指標閾值(r = –0.81,P < 0.001)、半波寬(r = –0.79,P< 0.001)、達峰時間(r = –0.71,P < 0.001)、最大上升斜率(r = 0.92,P < 0.001)也均呈相關性。Pearson相關性分析結果表明,rTMS對小鼠短期記憶能力和空間導航能力的提高與rTMS對小鼠海馬區神經元動作電位指標的增強有關。
 圖8
相關性分析結果
Figure8.
The result of correlation analysis
圖8
相關性分析結果
Figure8.
The result of correlation analysis
3 討論
本研究使用新物體識別、水迷宮、在體光纖記錄、腦片膜片鉗等實驗技術,探究rTMS對小鼠認知能力和海馬DG區谷氨酸能神經元、γ-氨基丁酸能神經元的影響。并且提出假設:rTMS影響小鼠的認知功能,并且小鼠認知功能的改變與海馬區谷氨酸能神經元和γ-氨基丁酸能神經元興奮性的改變有關。實驗結果表明,rTMS可以提高小鼠的學習記憶能力,提高海馬谷氨酸能神經元和γ-氨基丁酸能神經元的興奮性。
新物體識別實驗通過新物體(形狀、大小等)的靈活變換,可為動物長期或短期記憶機制的形成以及刺激或藥物在記憶形成特定階段的療效提供判定依據[24]。本研究明小鼠測試Ⅰ期rTMS組認知指數顯著高于sham組,而測試Ⅱ期rTMS組和sham組之間沒有明顯差異,或可提示20 Hz的rTMS可以提高昆明小鼠的短期記憶而無法改善長期記憶能力。莫里斯水迷宮實驗通過記錄動物找到水下平臺來評價動物空間導航能力和學習記憶能力[25]。本研究的結果顯示,20 Hz的rTMS可以有效提高小鼠的空間探索能力和記憶能力。這與之前的研究中rTMS可以增強被試人員的記憶能力結論相似[9]。同樣,本實驗室之前對C57老年小鼠的行為學探究也顯示出相似的結論[26]。
基因編碼鈣指示劑可以在在體水平清楚地檢測到神經元中單個動作電位引發的Ca2+熒光信號并借助于光纖記錄系統高效反映細胞Ca2+濃度改變,從而反映神經元的興奮性。本研究結果顯示,rTMS使海馬DG區谷氨酸能神經元和γ-氨基丁酸能神經元鈣信號熒光強度變化率均有提高,表明rTMS可以顯著提高海馬腦區谷氨酸能神經元集群和γ-氨基丁酸能神經元集群的興奮性。
神經元動作電位是衡量單個神經元興奮性的標準。本研究中施加20 Hz磁刺激小鼠的谷氨酸能神經元和γ-氨基丁酸能神經元動作電位閾值明顯降低,半波寬時間跨度減小,達峰時間減小,最大上升斜率升高。動作電位閾值是膜去極化的臨界點。谷氨酸能神經元和γ-氨基丁酸能神經元動作電位閾值的降低代表神經元對于觸發動作電位的刺激更為敏感,兩類主要神經元更容易被激活。半波寬時間跨度減小、達峰時間減小、最大上升斜率升高表明rTMS提高了細胞膜去極化速度。已有研究表明高頻rTMS可顯著影響海馬腦區神經元鈉通道電流,提高細胞去極化速率,從而提高神經元興奮性[27]。這與本研究的結論一致。Pearson相關性分析結果顯示測試Ⅰ期認知指數、穿越平臺次數、平臺象限停留時間與神經元動作電位指標閾值、半波寬、達峰時間、最大上升斜率均呈相關性表明rTMS對小鼠谷氨酸能神經元和γ-氨基丁酸能神經元興奮性的提高與rTMS對小鼠認知功能的提高有關。
上述結果表明,rTMS提高了小鼠海馬DG區兩類主要神經元的興奮性,進而提高了小鼠的學習記憶能力。本研究探究了rTMS對不同類型神經元興奮性的影響,為研究rTMS作用機制提供新的方法和支持。
4 結論
20Hz的rTMS可以有效提高小鼠的學習記憶能力和認知水平,提高小鼠海馬DG區谷氨酸能神經元集群和γ-氨基丁酸能神經元集群的光纖鈣信號熒光強度變化率,提高谷氨酸能神經元和γ-氨基丁酸能神經元的興奮性。研究結果提示,20 Hz的rTMS通過提高海馬DG區谷氨酸能神經元和γ-氨基丁酸能神經元興奮性從而提高學習記憶能力,可能是rTMS提高學習記憶能力和認知水平的機制之一{Zong, 2022 #2}。
重要聲明
利益沖突聲明:本文全體作者均聲明不存在利益沖突。
作者貢獻聲明:丁沖負責實驗的整體安排和最終論文的修改,王佳樂是實驗的主要完成者和論文的主要撰稿人,付蕊、張澤、趙峻嶠在實驗過程中提供了幫助,朱海軍為實驗規劃上提供理論方面的支持。所有作者都閱讀并通過了最終草案。
倫理聲明:本研究通過了河北工業大學倫理委員會的審批(批文編號:HEBUTacuc2022028)。
本文附件見本刊網站的電子版本(