引用本文: 陳蕎薇, 林衛. 多學科診療對卵巢交界性腫瘤患者生育力的保護價值探討. 華西醫學, 2024, 39(1): 11-16. doi: 10.7507/1002-0179.202310028 復制
版權信息: ?四川大學華西醫院華西期刊社《華西醫學》版權所有,未經授權不得轉載、改編
卵巢交界性腫瘤(borderline ovarian tumor, BOT)約占所有上皮性卵巢腫瘤的 15%[1],其中約有 1/3 的患者被診斷為 BOT 時年齡在 40 歲以下,尚未完成生育。系統評價顯示,BOT 保留生育功能手術(fertility-sparing surgery, FSS)的術后復發率高于根治性手術,但對總體生存率無顯著影響,且有理想的妊娠率,是安全可行的[2]。如果年輕女性希望保留生育力,那么應行 FSS,即保留患者的子宮和/或卵巢。根據指南,部分盆腔手術(如卵巢腫瘤切除術)可能會損傷卵巢功能,這意味著手術就有可能導致生育力受損[3]。目前很多醫生在手術時能有意識地保留患者的卵巢皮質,但可能缺乏對患者的生育力評估,未能為患者提供生育咨詢;同時患者作為非專業人員,常常無法認識到疾病和生育力之間的矛盾關系,以致于發生生育力不可逆的損傷。因此,生育咨詢和生育力評估應成為臨床管理的一個重要組成部分[4]。對于 BOT 患者,應充分告知手術可能導致卵巢儲備功能減退(diminished ovarian reserve, DOR)或盆腹腔粘連,術前應進行包括婦科手術醫生、生殖內分泌醫生、輔助生殖醫生、婦科腫瘤放化療醫生等在內的多學科診療(multi-disciplinary team, MDT),制定個體化的治療方案及計劃生育策略。本文通過研究四川大學華西第二醫院(以下簡稱“我院”)進行 MDT 的 BOT 患者的臨床病例資料和生育結局,探討 MDT 在其中的重要性和價值。
1 對象與方法
1.1 研究對象
納入標準:MDT 組:2020 年 1 月—2022 年 12 月在我院門診部進行 MDT 的經我院病理證實為 BOT 且要求行 FSS 的患者;對照組:以 1∶2 的組織學類型比例從醫院信息系統挑選出的同期行FSS 但未進行 MDT 的 BOT 患者。排除標準:合并其他惡性腫瘤、因其他原因死亡、資料不全。本研究已在我院醫學倫理委員會備案,備案號為醫學科研 2023 倫審批第(050)號。
1.2 資料收集
收集研究對象的病例資料:① 基本信息,包括發病年齡、婚姻狀況、MDT 時機、術前糖類抗原 125、術前糖類抗原 199、術前術后抗米勒管激素(anti-Müllerian hormone, AMH);② 手術記錄,包括手術路徑、腫瘤病變部位(單側或雙側附件)、國際婦產科聯盟(International Federation of Gynecology and Obstetrics, FIGO)分期、病理學特征(組織學類型)。病理分期依據 2014 年 FIGO 修訂的卵巢癌分期系統[5]。
1.3 方法
1.3.1 MDT 的學科設置依據
隨著年齡增長,女性卵母細胞的數量和質量下降,造成女性生育力下降,稱為 DOR[6]。DOR 的可能危險因素包括年齡、遺傳因素、醫源性因素、遺傳因素、自身免疫因素、感染因素、環境因素及社會心理因素。2022 年《卵巢儲備功能減退臨床診治專家共識》[7]推薦使用 AMH、竇卵泡數、基礎卵泡刺激素并結合患者年齡,對卵巢儲備功能進行綜合評估。目前認為 AMH 水平是反映卵巢儲備功能最可靠的指標之一[8]。因此,當臨床醫生遇到高度懷疑 BOT 的生育期女性患者時,因手術可能影響卵巢功能,推薦進行婦科、生殖及化療科 MDT,對患者的生育和疾病進行綜合評估,再決定手術時機、生育力保護時機及具體治療方案。
1.3.2 研究方法
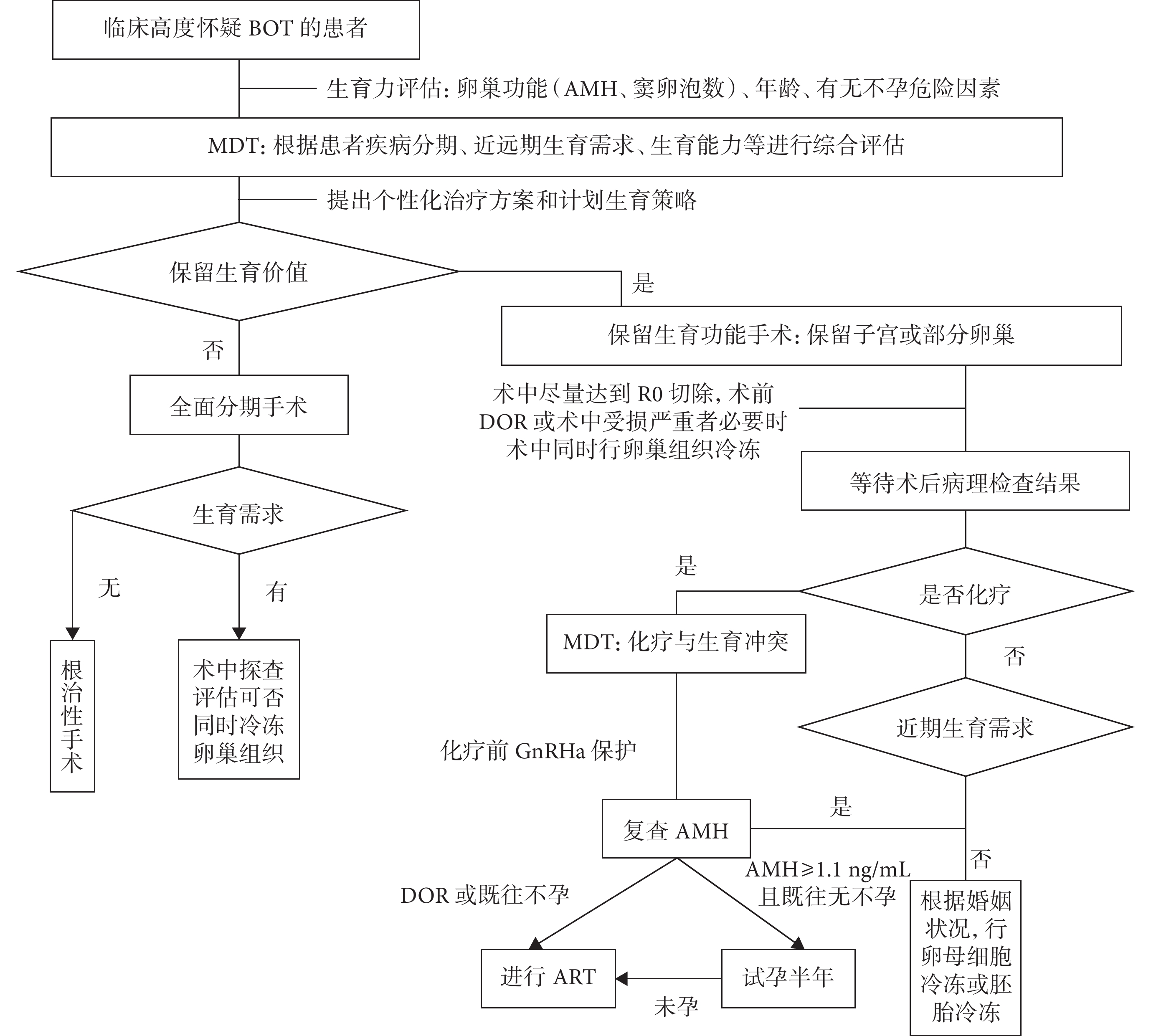
根據上述 MDT 的學科設置依據,本研究中 MDT 組的具體操作流程詳見圖1。對照組未進行 MDT,采用常規的診療流程。
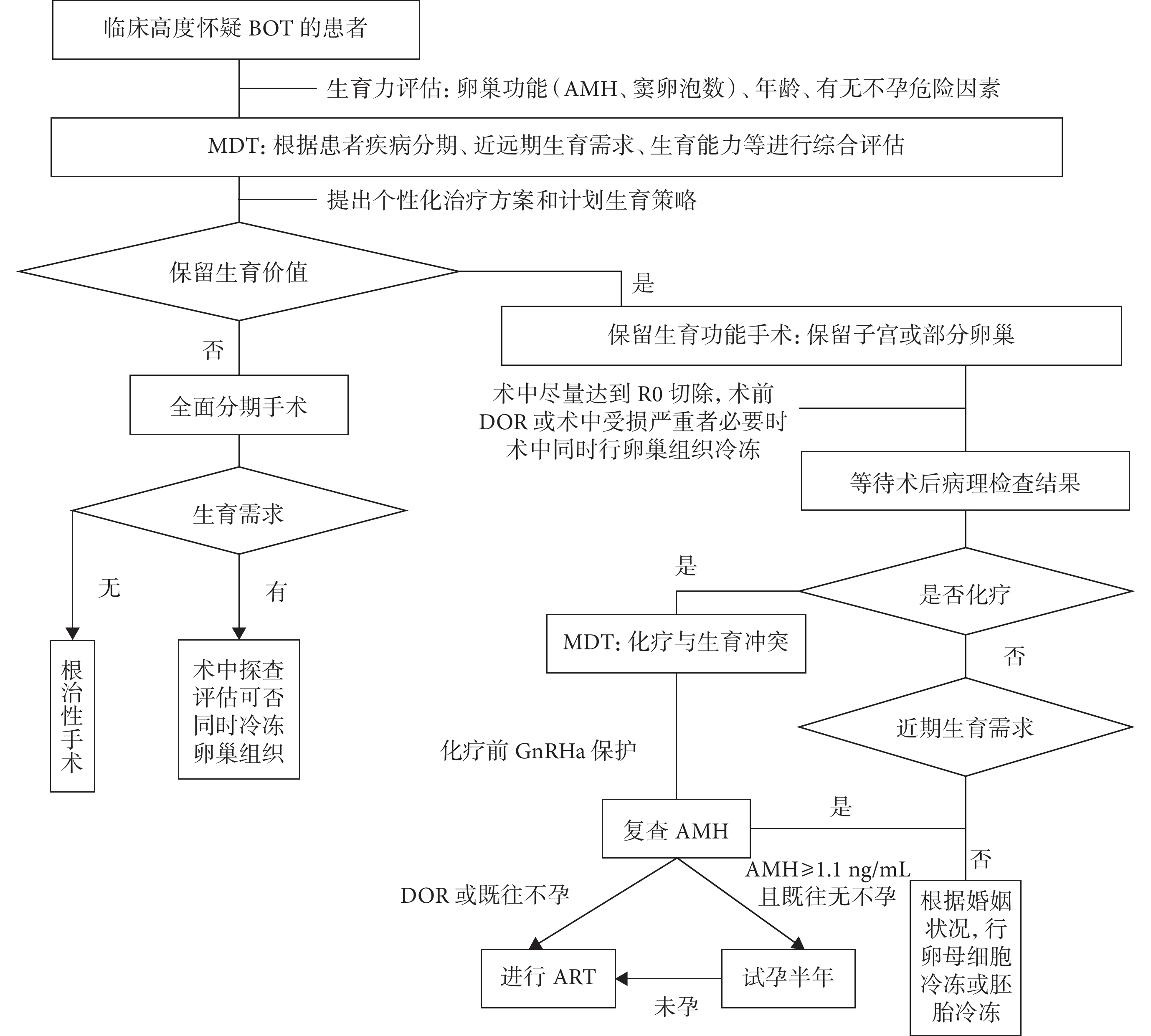 圖1
我院 BOT 患者的 MDT 流程
圖1
我院 BOT 患者的 MDT 流程
BOT:卵巢交界性腫瘤;AMH:抗米勒管激素;MDT:多學科診療;DOR:卵巢儲備功能減退;R0 切除:所有肉眼可見的病灶都完全切除;GnRHa:促性腺激素釋放激素類似物;ART:輔助生殖技術
1.3.3 研究指標
本研究使用 AMH 水平這一客觀指標來評估患者的生育力,AMH<1.1 ng/mL 提示 DOR[9]。測定了 AMH 水平表示進行了生育力評估。進行了排卵監測、卵母細胞冷凍、胚胎冷凍或卵巢組織冷凍其中之一者,視為采取了生育力保護措施。
1.3.4 隨訪
自患者第 1 次手術開始隨訪至 2023 年 3 月 1 日,隨訪內容包括:有無進行生育力評估及生育力保護措施實施情況,有無發生過妊娠(自然妊娠或輔助受孕)以及妊娠生育結局,隨訪主要通過電話或短信進行。
1.4 統計學方法
采用 SPSS 26.0 軟件進行數據分析。計數資料以例數和/或百分比表示,組間比較采用χ2 檢驗。符合正態分布的計量資料采用均數±標準差表示,組間比較采用方差分析。雙側檢驗水準α=0.05。
2 結果
2.1 兩組患者的一般情況
MDT 組共納入患者 24 例(漿液性 13 例,黏液性 6 例,漿黏液性 5 例),對照組共納入患者 48 例(漿液性 26 例,黏液性 12 例,漿黏液性 10 例)。兩組患者的發病年齡、婚姻狀態、術前糖類抗原 199、糖類抗原 125、手術路徑、FIGO 分期差異無統計學意義(P>0.05)。MDT 組第 1 次手術時腫瘤累及雙側的比例高于對照組(50.0% vs. 22.9%,P<0.05)。見表1。
2.2 兩組患者的生育力評估情況、生育力保護措施實施情況及生育結局
生育力評估情況方面,兩組術前測定 AMH 的患者比例差異無統計學意義(P>0.05),MDT 組術后測定 AMH 的患者比例高于對照組(100.0% vs. 37.5%,P<0.05)。MDT 組采取生育力保護措施的患者比例高于對照組(62.5% vs. 29.2%,P<0.05)。見表1。MDT 組 15 例采取生育力保護措施的患者中,5 例進行排卵監測,10 例進行卵子或胚胎冷凍;對照組 14 例采取生育力保護措施的患者中,6 例進行排卵監測,8 例進行卵子或胚胎冷凍。MDT 組 14 例已婚者中 4 例成功懷孕(3 例體外受精后現妊娠中,1 例自然妊娠但因宮外孕已行輸卵管切除),首次妊娠距離第 1 次手術的中位時間為 20(8,31)個月。對照組 27 例已婚者中 7 例成功懷孕(3 例體外受精后已分娩,4 例自然妊娠后已分娩)。兩組患者中已婚者成功懷孕的比例差異無統計學意義(28.6% vs. 25.9%,P=0.856)。31 例未婚者中,僅有 2 例 MDT 組患者采取卵母細胞冷凍保存生育力(因 DOR 而取卵失敗),而對照組沒有患者采取相關生育力保護措施。
3 討論
BOT 是一種上皮性卵巢腫瘤,有獨特的生物學特性,包括上皮增生、細胞異型成分>10%,但無破壞性浸潤生長[10]。2020 年,法國國家婦產科醫生協會指出:BOT 的總復發風險為 2%~24%,10 年總生存率為 94%[4]。鑒于 BOT 的流行病學及良好的腫瘤預后結局,保留子宮和/或卵巢的保守手術(例如FSS)已成為有生育要求的 BOT 患者的首選手術方案。FSS 無論對患者的生育力、心理預期還是生活質量都有著積極的影響[11]。但是,手術不可避免地可能造成卵巢功能受損和盆腹腔粘連。所以,在不造成腫瘤擴散和不影響生存結局的前提下,如何更好地保護和保存患者的生殖功能,是目前仍需要進一步探索的難題。
3.1 BOT 患者的生育力保護及妊娠結局
本研究發現對照組第 1 次行 FSS 后僅有 37.5%患者進行了生育力評估,即測定 AMH,而 MDT 組所有患者均測定了 AMH,MDT 組采取生育力保護措施的比例也高于對照組,提示進行 MDT 有利于提高生育力評估率,及時判斷婦女的生育力,積極采取相關措施,避免多次手術對卵巢功能造成損害。然而,本研究未發現兩組之間生育結局的差異,可能因為研究為回顧性研究,且隨訪時間不固定,這是本文的局限性,未來將繼續進行前瞻性研究探討更進一步的結果。對于擬行 FSS 的 BOT 患者,術前應常規進行生育咨詢和生育力評估[12]。生育咨詢應包括患者的年齡、婚姻狀況、孕產次、現存子女數、未來生育計劃、男方精液情況等,生育力評估包括個人生活習慣(有無吸煙喝酒、不良嗜好等)、既往史(有無結核、不孕、腹部手術史)、卵巢功能(包括 AMH、基礎竇卵泡數等)。術前還應告知患者 FSS 和根治性手術有相近的生存率,但有更高的復發率,育齡期 BOT 患者應向專業生殖醫生咨詢,建議向患者提供手術治療后卵巢儲備減少風險的充分信息[13]。這時就需要組織一個 MDT 團隊,為患者提供個體化治療和計劃生育策略。
3.2 MDT 在 BOT 中的作用
MDT 即通過固定時間和地點的會議,匯集各科室的最新發展動態,結合患者的疾病分期、家庭經濟狀況、身體狀況及心理承受能力,權衡利弊后,制訂出科學、合理、規范的診療方案[14]。《婦科惡性腫瘤多學科診療中國專家共識(2022 年版)》[15]指出:建議已確診并考慮進行治療的婦科惡性腫瘤且要求保留生育功能的患者必須納入 MDT 討論。鑒于大多數 BOT 被診斷時仍未完成生育,推薦術前進行婦科手術醫生、生殖內分泌科醫生、輔助生殖醫生的 MDT,術后和隨訪過程中若需要化療,必要時需要組織涉及腫瘤放療、化療、生殖助孕、生殖內分泌等專業醫生的再次 MDT,再次評估和選擇個體化方案,以達到在保證療效的基礎上實現最大程度保護生殖功能和生育力。
3.2.1 手術醫生
卵巢手術主要通過以下幾方面影響卵巢的功能:① 術中傷及子宮動脈卵巢支及卵巢動脈或兩者的分支,影響了卵巢的血供;② 分離粘連時損傷卵巢及其血管;③ 剔除囊腫時帶走部分正常卵巢組織;④ 電凝止血對卵巢組織的熱損傷。蘇德慧等[16]研究建議卵巢囊腫剝除術采用腹腔鏡,術中盡量縫合止血,最大程度保留卵巢組織和功能。Li 等[17]研究表明對于 FIGO Ⅰ期希望保留生育力的 BOT 患者,評估若顯示腫瘤破裂風險較低,建議使用腹腔鏡探查,術中應嚴格無瘤原則,避免腫瘤破裂,推薦使用密封取物袋。分期晚的患者根據病情綜合判斷選擇手術路徑。對于腫瘤局限于一側卵巢的患者,推薦行單側附件切除術,雙側 BOT 則推薦雙側腫瘤剝除術。單側 BOT 需仔細檢查對側卵巢,外觀無異常者不推薦活檢或部分切除,以免機械性損傷導致 DOR 和/或腹膜粘連[18]。2019 年龔子元[2]的系統評價顯示不全分期是 BOT 術后復發的危險因素,推薦全面探查盆腹腔,切除所有肉眼可疑病灶;推薦常規切除大網膜;腹腔假黏液性瘤必須切除闌尾,黏液性 BOT 根據術中情況可考慮切除闌尾,其他病理類型闌尾外觀未見明顯異常時可保留;不推薦常規行淋巴結清掃,僅在淋巴結增大時切除[11]。但對于良性腫瘤術后診斷 BOT 的患者,建議行影像學評估,若無特殊陽性表現,建議密切隨訪觀察,不推薦再次手術。另外,指南建議手術記錄應描述所有腹膜病變以及描述有無腫瘤殘留[19]。建議使用腹膜癌變評分來評估腫瘤負荷,如腹膜腫瘤指數。對于晚期 BOT,進行 MDT 且患者家屬充分知情同意后,可選保守治療,至少保留子宮和部分卵巢皮質,若確實無保存可能,術中可同時行卵巢組織冷凍。Falcone 等[20]報告了 13 例 FIGO Ⅱ~Ⅲ期的漿液性BOT,盡管復發率高,但 FSS 提供了良好的生殖成功機會,且對遠期生存無負面影響。對于復發性 BOT,大多仍為交界性[21],單側輸卵管卵巢切除術仍然是有生育要求患者的一種安全方法,并能達到較高的術后懷孕率和活產率[22]。總之,手術醫生在 BOT 患者的生育力保護中起到了至關重要的作用。
3.2.2 生殖醫生
Johansen 等[23]對瑞典 2008 年-2015 年 227 例 FIGO Ⅰ期采用 FSS 的 BOT 患者進行前瞻性隊列研究,結果顯示 FSS 治療后可維持自然生育力,只有 9%需要輔助生殖技術(assisted reproductive technology, ART)治療。2021 年,梁婷婷[24]報告 FSS 術后無需化療者應盡早嘗試妊娠,約 50%的 BOT 患者術后可自然妊娠,另一半需借助 ART 助孕。目前,最成熟的 ART 方法為促排卵-胚胎冷凍。理論上,雌激素誘發的控制性卵巢刺激可能會對 BOT 產生不利影響,術前應避免控制性卵巢刺激[12]。然而,對于控制性卵巢刺激是否增加 BOT 復發風險,尚無足夠的一致證據。朱躍蒙[25]的綜述顯示,早期 BOT 患者行 FSS 后,予以控制性超促排卵-胚胎移植,妊娠率 50%,活產率 50%,術后平均隨訪 29.6 個月無復發。Li 等[26]的回顧性分析也表明 ART 對 BOT 的預后沒有負面影響。但是,2021 年王霞等[27]對 1990 年-2020 年 6 月發表的研究的綜合分析顯示,多數研究(27/42,64.3%)均顯示 ART 并不增加 BOT 的致病風險,但也有部分研究(15/42,35.7%)顯示 ART 存在誘發 BOT 的潛在風險,尤其是近 5 年的研究(6/10,60%)對此結論多呈肯定態度。因此,對于 ART 與 BOT 之間的相關性,還需要長期、大樣本的研究進行隨訪和評估。另外,來曲唑是芳香化酶抑制劑、抗雌激素藥物,來曲唑較低劑量促性腺激素的微刺激方案被推薦用于 BOT 患者助孕[28]。因此,BOT 患者的生育力保護非常需要聽取生殖醫生的專業意見。
此外,關于 BOT 保守手術后不孕不育的管理沒有具體的指南。如果 BOT 保守治療后出現持續性不孕,也需要咨詢專業生殖醫生。由于 BOT 的高復發率和控制性卵巢刺激可能的潛在風險,有學者建議 2 年后再考慮 ART,但由于卵巢功能的下降,可縮短至 1 年[12]。目前已證實的生育力保存方法包括胚胎、卵母細胞或卵巢組織冷凍。胚胎冷凍保存技術適用于青春期后有配偶的 BOT 患者,卵巢組織及卵母細胞冷凍可作為未婚患者的選擇,但卵巢組織冷凍適用于所有青春期前的 BOT 患者[24]。卵巢組織冷凍目前仍存在顧慮,Masciangelo 等[29]對移植入小鼠體內 5 個月的 11 例 BOT 患者凍融卵巢組織進行組織學分析、免疫組織化學檢測和分子分析,9 例惡性細胞檢測陰性,1 例為 BOT,1 例檢測到子宮內膜異位癥,提示 BOT 凍存卵巢組織中可以發現 BOT 細胞,故植入前的分析必不可少,現仍無凍存卵巢組織的篩選標準,需進一步探討。
3.2.3 化療醫生
化療會破壞卵巢皮質,對女性生育力產生不利影響。化療藥物對卵巢功能損傷的機制尚不明確,損傷程度一般取決于化療藥物類型及對應的靶細胞種類。晚期 BOT 是否需要化療需咨詢婦科腫瘤化療醫生。《交界性卵巢腫瘤診治中國專家共識(2022 年版)》[18]推薦 BOT 伴浸潤性種植轉移患者參考卵巢上皮性癌方案進行化療,最常用的化療方案為 TC 方案(卡鉑+紫杉醇),卡鉑和紫杉醇可能引起閉經、生育力下降,其風險介于 25%~75%之間[30]。2018 年美國臨床腫瘤學會指南指出,在已證實的生育力保留方法不可行時,促性腺激素釋放激素激動劑可用于乳腺癌患者減少化療引起的毒性作用,而對于其他類型的腫瘤患者,仍不能使用促性腺激素釋放激素激動劑代替已證實的生育力保留方法[31]。懷孕期間懷疑 BOT 復發或者孕晚期首次懷疑 BOT 時,“期望管理”可能是一種安全的選擇[32]。
綜上,對于有生育要求的女性,當臨床懷疑 BOT 時,生育咨詢和生育力保存應成為臨床管理的一部分,系統地評估患者的卵巢功能以及保留患者的生育力是非常必要的。術前應由婦科腫瘤醫生、生殖內分泌醫生、輔助生殖醫生等共同制定個體化診療方案和生育計劃策略,根據術中情況,必要時同時進行卵巢細胞或卵巢組織的冷凍,術后在盡量保證腫瘤不擴散或復發的前提下,應由輔助生殖醫生與手術醫生或放化療醫生共同商議助孕時機。所以,我們建議 MDT 應貫穿有生育需求 BOT 患者的整個生殖周期,保證患者生命的同時為患者的生殖生育保駕護航。
利益沖突:所有作者聲明不存在利益沖突。
卵巢交界性腫瘤(borderline ovarian tumor, BOT)約占所有上皮性卵巢腫瘤的 15%[1],其中約有 1/3 的患者被診斷為 BOT 時年齡在 40 歲以下,尚未完成生育。系統評價顯示,BOT 保留生育功能手術(fertility-sparing surgery, FSS)的術后復發率高于根治性手術,但對總體生存率無顯著影響,且有理想的妊娠率,是安全可行的[2]。如果年輕女性希望保留生育力,那么應行 FSS,即保留患者的子宮和/或卵巢。根據指南,部分盆腔手術(如卵巢腫瘤切除術)可能會損傷卵巢功能,這意味著手術就有可能導致生育力受損[3]。目前很多醫生在手術時能有意識地保留患者的卵巢皮質,但可能缺乏對患者的生育力評估,未能為患者提供生育咨詢;同時患者作為非專業人員,常常無法認識到疾病和生育力之間的矛盾關系,以致于發生生育力不可逆的損傷。因此,生育咨詢和生育力評估應成為臨床管理的一個重要組成部分[4]。對于 BOT 患者,應充分告知手術可能導致卵巢儲備功能減退(diminished ovarian reserve, DOR)或盆腹腔粘連,術前應進行包括婦科手術醫生、生殖內分泌醫生、輔助生殖醫生、婦科腫瘤放化療醫生等在內的多學科診療(multi-disciplinary team, MDT),制定個體化的治療方案及計劃生育策略。本文通過研究四川大學華西第二醫院(以下簡稱“我院”)進行 MDT 的 BOT 患者的臨床病例資料和生育結局,探討 MDT 在其中的重要性和價值。
1 對象與方法
1.1 研究對象
納入標準:MDT 組:2020 年 1 月—2022 年 12 月在我院門診部進行 MDT 的經我院病理證實為 BOT 且要求行 FSS 的患者;對照組:以 1∶2 的組織學類型比例從醫院信息系統挑選出的同期行FSS 但未進行 MDT 的 BOT 患者。排除標準:合并其他惡性腫瘤、因其他原因死亡、資料不全。本研究已在我院醫學倫理委員會備案,備案號為醫學科研 2023 倫審批第(050)號。
1.2 資料收集
收集研究對象的病例資料:① 基本信息,包括發病年齡、婚姻狀況、MDT 時機、術前糖類抗原 125、術前糖類抗原 199、術前術后抗米勒管激素(anti-Müllerian hormone, AMH);② 手術記錄,包括手術路徑、腫瘤病變部位(單側或雙側附件)、國際婦產科聯盟(International Federation of Gynecology and Obstetrics, FIGO)分期、病理學特征(組織學類型)。病理分期依據 2014 年 FIGO 修訂的卵巢癌分期系統[5]。
1.3 方法
1.3.1 MDT 的學科設置依據
隨著年齡增長,女性卵母細胞的數量和質量下降,造成女性生育力下降,稱為 DOR[6]。DOR 的可能危險因素包括年齡、遺傳因素、醫源性因素、遺傳因素、自身免疫因素、感染因素、環境因素及社會心理因素。2022 年《卵巢儲備功能減退臨床診治專家共識》[7]推薦使用 AMH、竇卵泡數、基礎卵泡刺激素并結合患者年齡,對卵巢儲備功能進行綜合評估。目前認為 AMH 水平是反映卵巢儲備功能最可靠的指標之一[8]。因此,當臨床醫生遇到高度懷疑 BOT 的生育期女性患者時,因手術可能影響卵巢功能,推薦進行婦科、生殖及化療科 MDT,對患者的生育和疾病進行綜合評估,再決定手術時機、生育力保護時機及具體治療方案。
1.3.2 研究方法
根據上述 MDT 的學科設置依據,本研究中 MDT 組的具體操作流程詳見圖1。對照組未進行 MDT,采用常規的診療流程。
 圖1
我院 BOT 患者的 MDT 流程
圖1
我院 BOT 患者的 MDT 流程
BOT:卵巢交界性腫瘤;AMH:抗米勒管激素;MDT:多學科診療;DOR:卵巢儲備功能減退;R0 切除:所有肉眼可見的病灶都完全切除;GnRHa:促性腺激素釋放激素類似物;ART:輔助生殖技術
1.3.3 研究指標
本研究使用 AMH 水平這一客觀指標來評估患者的生育力,AMH<1.1 ng/mL 提示 DOR[9]。測定了 AMH 水平表示進行了生育力評估。進行了排卵監測、卵母細胞冷凍、胚胎冷凍或卵巢組織冷凍其中之一者,視為采取了生育力保護措施。
1.3.4 隨訪
自患者第 1 次手術開始隨訪至 2023 年 3 月 1 日,隨訪內容包括:有無進行生育力評估及生育力保護措施實施情況,有無發生過妊娠(自然妊娠或輔助受孕)以及妊娠生育結局,隨訪主要通過電話或短信進行。
1.4 統計學方法
采用 SPSS 26.0 軟件進行數據分析。計數資料以例數和/或百分比表示,組間比較采用χ2 檢驗。符合正態分布的計量資料采用均數±標準差表示,組間比較采用方差分析。雙側檢驗水準α=0.05。
2 結果
2.1 兩組患者的一般情況
MDT 組共納入患者 24 例(漿液性 13 例,黏液性 6 例,漿黏液性 5 例),對照組共納入患者 48 例(漿液性 26 例,黏液性 12 例,漿黏液性 10 例)。兩組患者的發病年齡、婚姻狀態、術前糖類抗原 199、糖類抗原 125、手術路徑、FIGO 分期差異無統計學意義(P>0.05)。MDT 組第 1 次手術時腫瘤累及雙側的比例高于對照組(50.0% vs. 22.9%,P<0.05)。見表1。
2.2 兩組患者的生育力評估情況、生育力保護措施實施情況及生育結局
生育力評估情況方面,兩組術前測定 AMH 的患者比例差異無統計學意義(P>0.05),MDT 組術后測定 AMH 的患者比例高于對照組(100.0% vs. 37.5%,P<0.05)。MDT 組采取生育力保護措施的患者比例高于對照組(62.5% vs. 29.2%,P<0.05)。見表1。MDT 組 15 例采取生育力保護措施的患者中,5 例進行排卵監測,10 例進行卵子或胚胎冷凍;對照組 14 例采取生育力保護措施的患者中,6 例進行排卵監測,8 例進行卵子或胚胎冷凍。MDT 組 14 例已婚者中 4 例成功懷孕(3 例體外受精后現妊娠中,1 例自然妊娠但因宮外孕已行輸卵管切除),首次妊娠距離第 1 次手術的中位時間為 20(8,31)個月。對照組 27 例已婚者中 7 例成功懷孕(3 例體外受精后已分娩,4 例自然妊娠后已分娩)。兩組患者中已婚者成功懷孕的比例差異無統計學意義(28.6% vs. 25.9%,P=0.856)。31 例未婚者中,僅有 2 例 MDT 組患者采取卵母細胞冷凍保存生育力(因 DOR 而取卵失敗),而對照組沒有患者采取相關生育力保護措施。
3 討論
BOT 是一種上皮性卵巢腫瘤,有獨特的生物學特性,包括上皮增生、細胞異型成分>10%,但無破壞性浸潤生長[10]。2020 年,法國國家婦產科醫生協會指出:BOT 的總復發風險為 2%~24%,10 年總生存率為 94%[4]。鑒于 BOT 的流行病學及良好的腫瘤預后結局,保留子宮和/或卵巢的保守手術(例如FSS)已成為有生育要求的 BOT 患者的首選手術方案。FSS 無論對患者的生育力、心理預期還是生活質量都有著積極的影響[11]。但是,手術不可避免地可能造成卵巢功能受損和盆腹腔粘連。所以,在不造成腫瘤擴散和不影響生存結局的前提下,如何更好地保護和保存患者的生殖功能,是目前仍需要進一步探索的難題。
3.1 BOT 患者的生育力保護及妊娠結局
本研究發現對照組第 1 次行 FSS 后僅有 37.5%患者進行了生育力評估,即測定 AMH,而 MDT 組所有患者均測定了 AMH,MDT 組采取生育力保護措施的比例也高于對照組,提示進行 MDT 有利于提高生育力評估率,及時判斷婦女的生育力,積極采取相關措施,避免多次手術對卵巢功能造成損害。然而,本研究未發現兩組之間生育結局的差異,可能因為研究為回顧性研究,且隨訪時間不固定,這是本文的局限性,未來將繼續進行前瞻性研究探討更進一步的結果。對于擬行 FSS 的 BOT 患者,術前應常規進行生育咨詢和生育力評估[12]。生育咨詢應包括患者的年齡、婚姻狀況、孕產次、現存子女數、未來生育計劃、男方精液情況等,生育力評估包括個人生活習慣(有無吸煙喝酒、不良嗜好等)、既往史(有無結核、不孕、腹部手術史)、卵巢功能(包括 AMH、基礎竇卵泡數等)。術前還應告知患者 FSS 和根治性手術有相近的生存率,但有更高的復發率,育齡期 BOT 患者應向專業生殖醫生咨詢,建議向患者提供手術治療后卵巢儲備減少風險的充分信息[13]。這時就需要組織一個 MDT 團隊,為患者提供個體化治療和計劃生育策略。
3.2 MDT 在 BOT 中的作用
MDT 即通過固定時間和地點的會議,匯集各科室的最新發展動態,結合患者的疾病分期、家庭經濟狀況、身體狀況及心理承受能力,權衡利弊后,制訂出科學、合理、規范的診療方案[14]。《婦科惡性腫瘤多學科診療中國專家共識(2022 年版)》[15]指出:建議已確診并考慮進行治療的婦科惡性腫瘤且要求保留生育功能的患者必須納入 MDT 討論。鑒于大多數 BOT 被診斷時仍未完成生育,推薦術前進行婦科手術醫生、生殖內分泌科醫生、輔助生殖醫生的 MDT,術后和隨訪過程中若需要化療,必要時需要組織涉及腫瘤放療、化療、生殖助孕、生殖內分泌等專業醫生的再次 MDT,再次評估和選擇個體化方案,以達到在保證療效的基礎上實現最大程度保護生殖功能和生育力。
3.2.1 手術醫生
卵巢手術主要通過以下幾方面影響卵巢的功能:① 術中傷及子宮動脈卵巢支及卵巢動脈或兩者的分支,影響了卵巢的血供;② 分離粘連時損傷卵巢及其血管;③ 剔除囊腫時帶走部分正常卵巢組織;④ 電凝止血對卵巢組織的熱損傷。蘇德慧等[16]研究建議卵巢囊腫剝除術采用腹腔鏡,術中盡量縫合止血,最大程度保留卵巢組織和功能。Li 等[17]研究表明對于 FIGO Ⅰ期希望保留生育力的 BOT 患者,評估若顯示腫瘤破裂風險較低,建議使用腹腔鏡探查,術中應嚴格無瘤原則,避免腫瘤破裂,推薦使用密封取物袋。分期晚的患者根據病情綜合判斷選擇手術路徑。對于腫瘤局限于一側卵巢的患者,推薦行單側附件切除術,雙側 BOT 則推薦雙側腫瘤剝除術。單側 BOT 需仔細檢查對側卵巢,外觀無異常者不推薦活檢或部分切除,以免機械性損傷導致 DOR 和/或腹膜粘連[18]。2019 年龔子元[2]的系統評價顯示不全分期是 BOT 術后復發的危險因素,推薦全面探查盆腹腔,切除所有肉眼可疑病灶;推薦常規切除大網膜;腹腔假黏液性瘤必須切除闌尾,黏液性 BOT 根據術中情況可考慮切除闌尾,其他病理類型闌尾外觀未見明顯異常時可保留;不推薦常規行淋巴結清掃,僅在淋巴結增大時切除[11]。但對于良性腫瘤術后診斷 BOT 的患者,建議行影像學評估,若無特殊陽性表現,建議密切隨訪觀察,不推薦再次手術。另外,指南建議手術記錄應描述所有腹膜病變以及描述有無腫瘤殘留[19]。建議使用腹膜癌變評分來評估腫瘤負荷,如腹膜腫瘤指數。對于晚期 BOT,進行 MDT 且患者家屬充分知情同意后,可選保守治療,至少保留子宮和部分卵巢皮質,若確實無保存可能,術中可同時行卵巢組織冷凍。Falcone 等[20]報告了 13 例 FIGO Ⅱ~Ⅲ期的漿液性BOT,盡管復發率高,但 FSS 提供了良好的生殖成功機會,且對遠期生存無負面影響。對于復發性 BOT,大多仍為交界性[21],單側輸卵管卵巢切除術仍然是有生育要求患者的一種安全方法,并能達到較高的術后懷孕率和活產率[22]。總之,手術醫生在 BOT 患者的生育力保護中起到了至關重要的作用。
3.2.2 生殖醫生
Johansen 等[23]對瑞典 2008 年-2015 年 227 例 FIGO Ⅰ期采用 FSS 的 BOT 患者進行前瞻性隊列研究,結果顯示 FSS 治療后可維持自然生育力,只有 9%需要輔助生殖技術(assisted reproductive technology, ART)治療。2021 年,梁婷婷[24]報告 FSS 術后無需化療者應盡早嘗試妊娠,約 50%的 BOT 患者術后可自然妊娠,另一半需借助 ART 助孕。目前,最成熟的 ART 方法為促排卵-胚胎冷凍。理論上,雌激素誘發的控制性卵巢刺激可能會對 BOT 產生不利影響,術前應避免控制性卵巢刺激[12]。然而,對于控制性卵巢刺激是否增加 BOT 復發風險,尚無足夠的一致證據。朱躍蒙[25]的綜述顯示,早期 BOT 患者行 FSS 后,予以控制性超促排卵-胚胎移植,妊娠率 50%,活產率 50%,術后平均隨訪 29.6 個月無復發。Li 等[26]的回顧性分析也表明 ART 對 BOT 的預后沒有負面影響。但是,2021 年王霞等[27]對 1990 年-2020 年 6 月發表的研究的綜合分析顯示,多數研究(27/42,64.3%)均顯示 ART 并不增加 BOT 的致病風險,但也有部分研究(15/42,35.7%)顯示 ART 存在誘發 BOT 的潛在風險,尤其是近 5 年的研究(6/10,60%)對此結論多呈肯定態度。因此,對于 ART 與 BOT 之間的相關性,還需要長期、大樣本的研究進行隨訪和評估。另外,來曲唑是芳香化酶抑制劑、抗雌激素藥物,來曲唑較低劑量促性腺激素的微刺激方案被推薦用于 BOT 患者助孕[28]。因此,BOT 患者的生育力保護非常需要聽取生殖醫生的專業意見。
此外,關于 BOT 保守手術后不孕不育的管理沒有具體的指南。如果 BOT 保守治療后出現持續性不孕,也需要咨詢專業生殖醫生。由于 BOT 的高復發率和控制性卵巢刺激可能的潛在風險,有學者建議 2 年后再考慮 ART,但由于卵巢功能的下降,可縮短至 1 年[12]。目前已證實的生育力保存方法包括胚胎、卵母細胞或卵巢組織冷凍。胚胎冷凍保存技術適用于青春期后有配偶的 BOT 患者,卵巢組織及卵母細胞冷凍可作為未婚患者的選擇,但卵巢組織冷凍適用于所有青春期前的 BOT 患者[24]。卵巢組織冷凍目前仍存在顧慮,Masciangelo 等[29]對移植入小鼠體內 5 個月的 11 例 BOT 患者凍融卵巢組織進行組織學分析、免疫組織化學檢測和分子分析,9 例惡性細胞檢測陰性,1 例為 BOT,1 例檢測到子宮內膜異位癥,提示 BOT 凍存卵巢組織中可以發現 BOT 細胞,故植入前的分析必不可少,現仍無凍存卵巢組織的篩選標準,需進一步探討。
3.2.3 化療醫生
化療會破壞卵巢皮質,對女性生育力產生不利影響。化療藥物對卵巢功能損傷的機制尚不明確,損傷程度一般取決于化療藥物類型及對應的靶細胞種類。晚期 BOT 是否需要化療需咨詢婦科腫瘤化療醫生。《交界性卵巢腫瘤診治中國專家共識(2022 年版)》[18]推薦 BOT 伴浸潤性種植轉移患者參考卵巢上皮性癌方案進行化療,最常用的化療方案為 TC 方案(卡鉑+紫杉醇),卡鉑和紫杉醇可能引起閉經、生育力下降,其風險介于 25%~75%之間[30]。2018 年美國臨床腫瘤學會指南指出,在已證實的生育力保留方法不可行時,促性腺激素釋放激素激動劑可用于乳腺癌患者減少化療引起的毒性作用,而對于其他類型的腫瘤患者,仍不能使用促性腺激素釋放激素激動劑代替已證實的生育力保留方法[31]。懷孕期間懷疑 BOT 復發或者孕晚期首次懷疑 BOT 時,“期望管理”可能是一種安全的選擇[32]。
綜上,對于有生育要求的女性,當臨床懷疑 BOT 時,生育咨詢和生育力保存應成為臨床管理的一部分,系統地評估患者的卵巢功能以及保留患者的生育力是非常必要的。術前應由婦科腫瘤醫生、生殖內分泌醫生、輔助生殖醫生等共同制定個體化診療方案和生育計劃策略,根據術中情況,必要時同時進行卵巢細胞或卵巢組織的冷凍,術后在盡量保證腫瘤不擴散或復發的前提下,應由輔助生殖醫生與手術醫生或放化療醫生共同商議助孕時機。所以,我們建議 MDT 應貫穿有生育需求 BOT 患者的整個生殖周期,保證患者生命的同時為患者的生殖生育保駕護航。
利益沖突:所有作者聲明不存在利益沖突。