引用本文: 焦雪峰, 黃永燦, 黃益洲, 吳誠光, 鄧力. 大鼠BMSCs自發鈣化過程中成骨相關基因表達譜的分析. 中國修復重建外科雜志, 2014, 28(2): 133-141. doi: 10.7507/1002-1892.20140032 復制
版權信息: ?四川大學華西醫院華西期刊社《中國修復重建外科雜志》版權所有,未經授權不得轉載、改編
BMSCs具有較強的自我更新能力和多向分化潛能,已成為組織工程和再生醫學領域重要的種子細胞來源,在心肌梗死、神經損傷、運動系統損傷等多種疾病的治療中具有廣闊應用前景。隨著臨床應用研究的深入,BMSCs的安全性也逐步受到重視。近年一些研究表明,BMSCs主要存在兩大安全隱患,即BMSCs的惡性轉化傾向或致瘤性以及自發鈣化/骨化傾向[1]。前者尚存在一些爭議,但BMSCs的自發鈣化現象目前已被證實。Yoon等[2]發現大鼠骨髓來源細胞心肌內移植后直接參與了急性梗死區鈣化組織的形成;Breitbach等[3]在小鼠急性心肌梗死模型上進一步明確了鈣化組織主要由BMSCs構成;Bi等[4]將小鼠 BMSCs移植至肌腱缺損部位,也發現BMSCs形成骨樣結構。本課題組既往研究也發現,大鼠BMSCs在不添加成骨誘導劑的條件下,經體外連續培養會發生自發鈣化,生成的鈣結節茜素紅染色陽性,免疫組織化學染色示Ⅰ型膠原和骨鈣素也呈陽性表達;并且于培養第7天細胞開始堆積,第14天開始形成典型的鈣結節樣結構[5]。目前關于BMSCs自發鈣化的分子機制及參與調控的信號通路尚罕見報道。基于此,本實驗利用基因芯片技術動態檢測大鼠BMSCs自發鈣化過程中基因表達譜的變化,初步探討BMSCs自發鈣化過程中的分子調控機制。
1 材料與方法
1.1 實驗動物及主要試劑、儀器
健康3日齡SD大鼠10只,雌雄不限,體重5.5~ 10.0 g,由四川大學實驗動物中心提供。H-DMEM、FBS、胰蛋白酶、EDTA(GIBCO公司,美國);基因芯片Rat Genome230 2.0 arrays(Affymetrix公司,美國);Trizol試劑(Invitrogen公司,美國);逆轉錄試劑盒、熒光定量試劑盒、引物序列(Takara公司,日本)。實時熒光定量PCR (real-time quantitative PCR,RT-qPCR)測試儀(Bio-Rad公司,美國);CO2培養箱(SANYO公司,日本);倒置相差顯微鏡(Olympus公司,日本);分子功能注釋系統v3.0(北京博奧生物有限公司)。
1.2 大鼠BMSCs的分離培養
參照本課題組既往研究方法[6],取5只SD大鼠斷頸處死,無菌條件下分離股骨和脛骨,用5 mL含10%FBS 的H-DMEM培養基沖洗骨髓腔,收集細胞懸液,接種于無菌培養瓶中。37℃、5%CO2及飽和濕度培養箱中培養,48 h后首次換液,之后每3天換液1 次。待貼壁細胞融合達80%左右時用0.25%胰蛋白酶-0.1%EDTA消化,以1∶2比例傳代,倒置相差顯微鏡觀察細胞形態學變化。
1.3 BMSCs體外自發鈣化模型建立及檢測
參照本課題組既往研究方法[5],取上述培養的第4 代生長良好的BMSCs,按1 × 104個/cm2密度接種于預先加入血蓋片的6孔板中,然后加入含10%FBS的H-DMEM培養基,在不添加任何誘導劑的條件下,置入37℃、5%CO2及飽和濕度培養箱中連續培養。于培養不同時間點觀察BMSCs自發鈣化的情況。
1.3.1 形態學觀察及茜素紅染色觀察
培養7、14 d,倒置相差顯微鏡觀察細胞生長狀況及自發鈣化進程;細胞用PBS輕洗3次,75%乙醇固定15 min,37℃恒溫箱中1%茜素紅染液染色1 h,水洗后封片,倒置相差顯微鏡下觀察。
1.3.2 RNA提取
分別于培養0、7、14 d收集細胞,用Trizol試劑提取細胞總RNA,用波長260 nm和280 nm處的吸光度(A)值比值(A260/A280)及瓊脂糖凝膠電泳實驗評估所提取RNA的純度及完整性。
1.3.3 基因芯片檢測及分析
使用基因芯片Rat Genome230 2.0 arrays對上述0、7、14 d的RNA樣品進行基因表達譜分析。RNA標記、芯片雜交、清洗、染色、掃描和數據分析均由北京博奧生物有限公司完成。各時間點的基因表達數據進行兩兩比較以得到基因表達變化的差異倍數。生物學重復為2,以2次差異倍數均值> 2倍或< 0.5倍來確定差異表達基因。芯片中共有約28 700個大鼠基因。
1.3.4 生物信息學分析
將各時間點的所有差異表達基因匯總,使用STEM算法[7]進行時間序列表達譜差異表達基因分類。使用分子功能注釋系統v3.0對差異表達基因進行基因本體(gene ontology,GO)分析和信號通路分析。其中GO分析包含生物學過程分析、分子功能分析和細胞成分分析三部分,信號通路分析依據KEGG數據庫[8-9]。使用STRING數據庫[10]對差異表達基因間的功能關聯性進行預測。
1.3.5 RT-qPCR驗證
選取用于基因芯片檢測的一組生物學重復的RNA樣品進行RT-qPCR驗證,每組3個復孔。先用逆轉錄試劑盒將RNA逆轉錄形成cDNA,再以cDNA為模板,采用RT-qPCR測試儀檢測分泌型磷酸蛋白1(secreted phosphoprotein 1,Spp1)、Mgp、基質金屬蛋白酶13(matrix metalloproteinase 13,Mmp13)、Wnt抑制因子1(Wnt inhibitory factor 1,Wif1)、Cxcl12和細胞周期素A2(cyclin A2,Ccna2)mRNA的定量表達。內參采用GAPDH基因。
2 結果
2.1 大鼠BMSCs形態學觀察
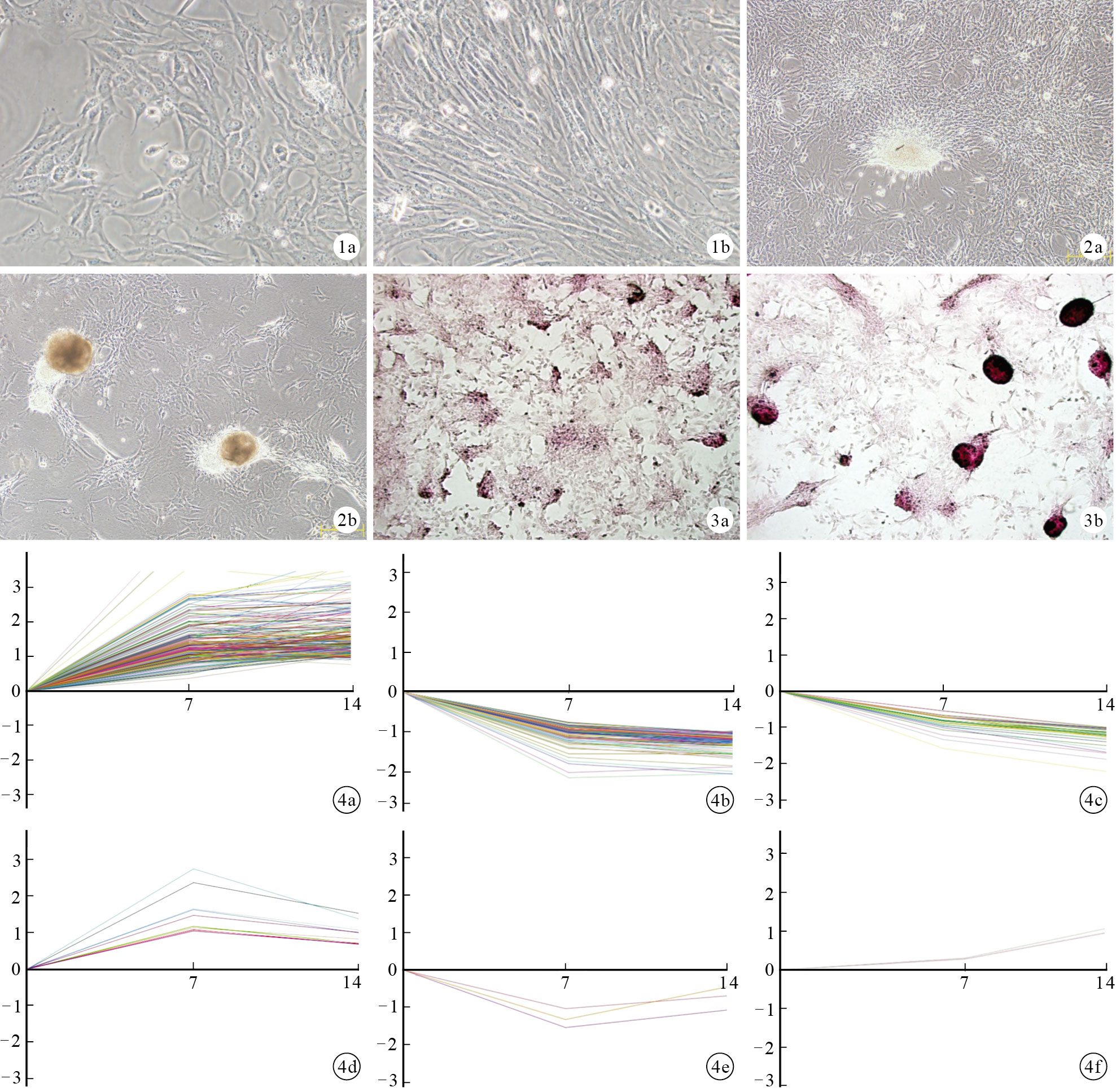
從骨髓分離而來的 BMSCs原代培養24 h后細胞開始貼壁;培養3~4 d 后,形成若干梭形和多角形的細胞集落;5 d 后細胞長至 80%趨于融合。第4代細胞呈現為較均一的長梭形。見圖 1。
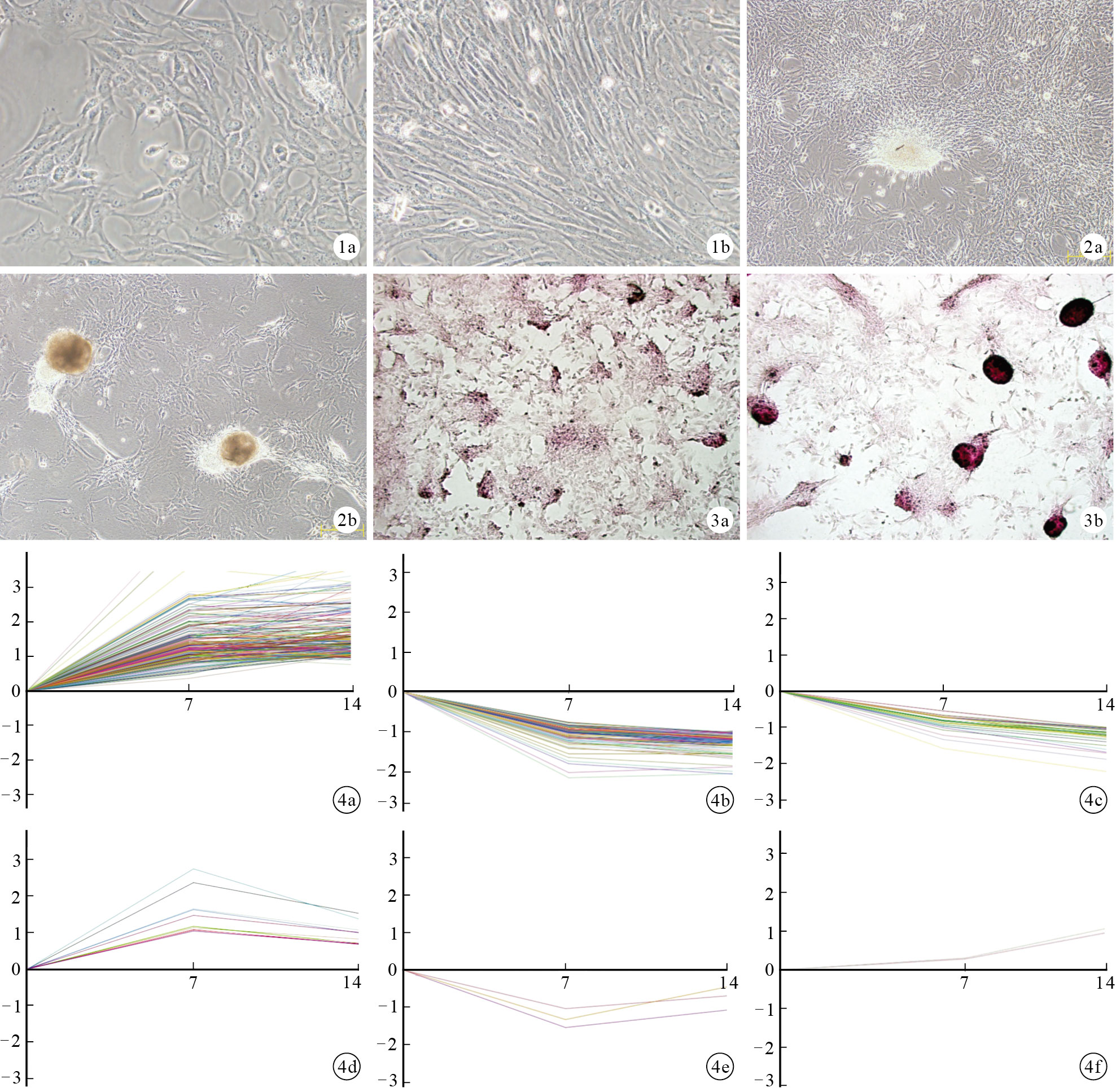 圖1
大鼠BMSCs形態學觀察(倒置相差顯微鏡× 200) ? 原代培養 3 d ? 第4代細胞培養2 d ? ?
圖1
大鼠BMSCs形態學觀察(倒置相差顯微鏡× 200) ? 原代培養 3 d ? 第4代細胞培養2 d ? ?2.2 大鼠BMSCs自發鈣化觀察
2.2.1 形態學觀察及茜素紅染色觀察
體外連續培養7 d后BMSCs開始堆集,茜素紅染色為弱陽性;培養14 d后BMSCs堆積明顯,并形成典型的茜素紅陽性鈣結節樣結構。見圖 2、3。
2.2.2 不同時間點差異表達基因的數目
培養0 d和7 d相比有359個差異表達的基因探針,0 d和14 d相比有530個差異表達的基因探針,而7 d和14 d相比只有13個差異表達的基因探針。上述3次比較共有576個差異表達的基因探針,對應378個大鼠基因。
2.2.3 差異表達基因表達模式分類
依據基因表達隨時間的變化模式,可將這378個差異表達基因分為6 類。其中222個基因屬于模式1,即基因表達在14 d中持續上調,且前7 d的增長速率明顯快于后7 d;模式2包含107個基因,即基因在前7 d表達下調,而在后7 d表達趨于穩定;模式3包含34個基因,即基因表達在14 d中持續下調;模式4、5、6包含的基因均較少,分別只有10、3、2個。見圖 4。
2.2.4 差異表達基因的功能學分類
對差異表達基因進行GO和信號通路分析。其中有14個生物學過程和9條信號通路與骨細胞的增殖、分化等生物學功能密切相關。根據生物功能的親和關系可將這些生物學過程和信號通路歸納為7大類,即血管生成、細胞凋亡、骨相關基因、細胞周期、發育、細胞通訊和成骨信號通路[11-14]。這些生物學過程和信號通路共包含95個差異表達基因,每個基因至少參與了1個生物學過程或1 條信號通路。見表 1。
模式1和模式2包含了絕大多數上述被選擇基因。模式1中大多數基因為細胞通訊類基因;此外,還包含了血管生成類基因、骨相關基因和成骨信號通路類基因。模式2主要包含細胞通訊類基因、骨相關基因、成骨信號通路類基因和大量細胞周期類基因。見表 2。
2.3 基因功能關聯性分析
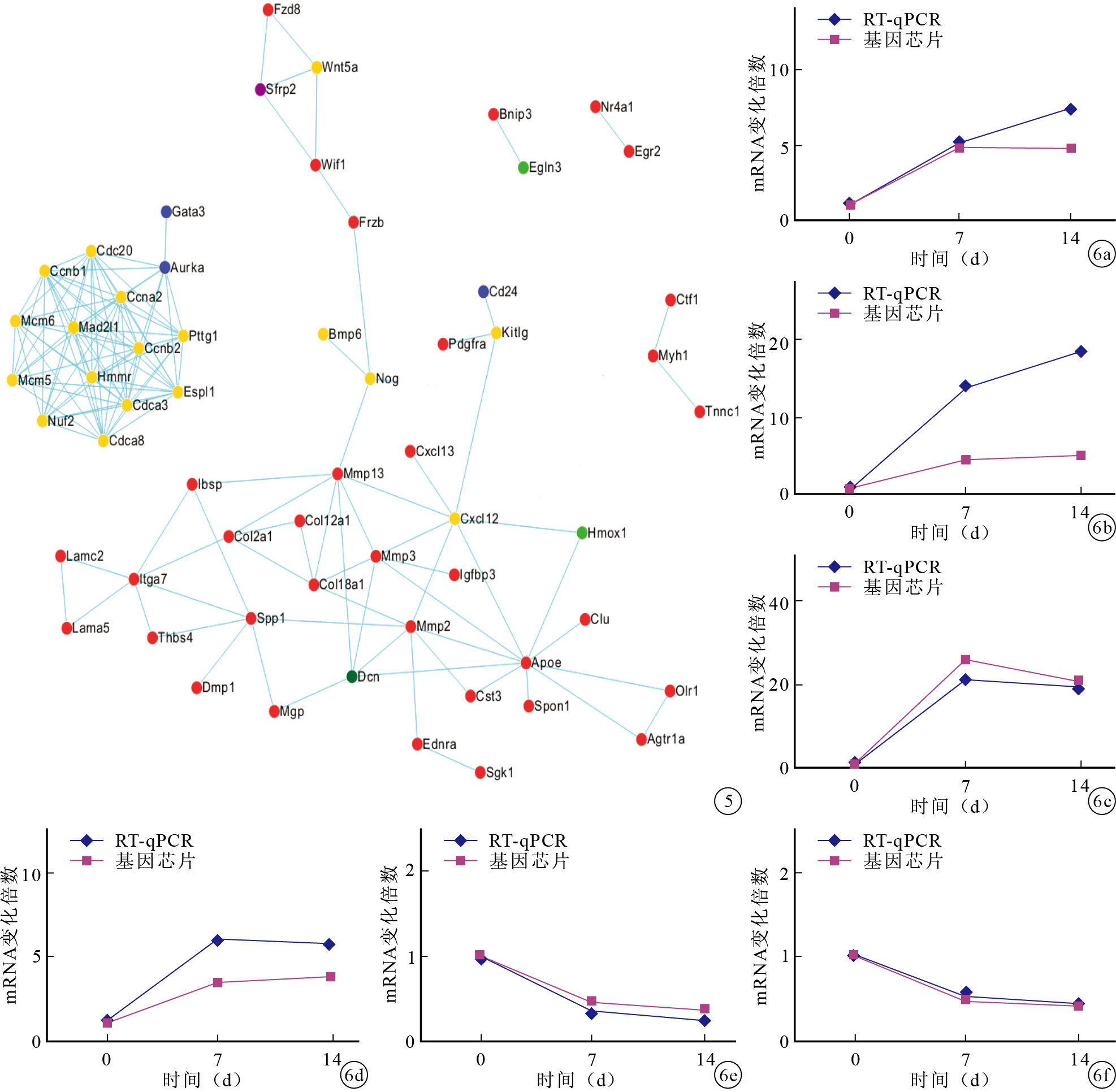
應用STRING數據庫對篩選出來的95個成骨相關差異表達基因進行功能關聯性分析。如圖 5所示,Pttg1、Cdc20、Cdca8、Cdca3、Ccna2、Nuf2、Ccnb2、Ccnb1、Mcm6、Mcm5、Espl1和Mad2l1組成了一個功能上密切聯系的基因球狀網絡,它們均為細胞周期類基因并均屬于模式2,即在自發鈣化過程中表達下調。此外,Mmp13、Spp1、Cxcl12、Mmp2、Mmp3、Apoe和Itga7在功能關聯性網絡圖中處于節點位置,相比其他基因,它們與更多基因存在功能上的聯系,這預示著它們在自發鈣化過程中發揮著核心調控作用。
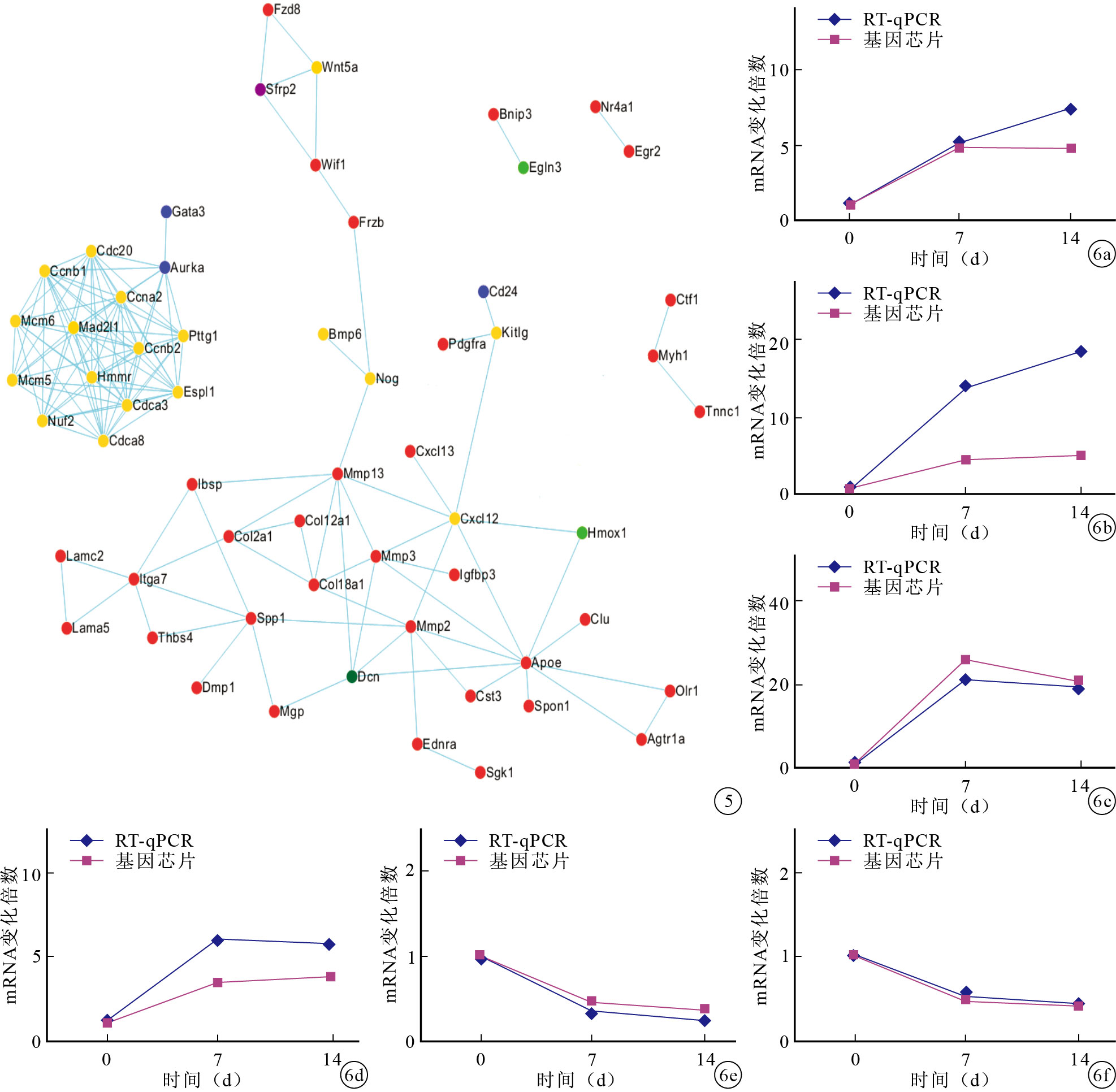 圖5
差異表達基因的功能關聯性分析 直線表示基因間有功能上的聯系 不同顏色圓點代表不同表達模式中的基因(紅色:模式1;黃色:模式2;藍色:模式3;淺綠色:模式4;深綠色:模式5;紫色:模式6) ? ?
圖5
差異表達基因的功能關聯性分析 直線表示基因間有功能上的聯系 不同顏色圓點代表不同表達模式中的基因(紅色:模式1;黃色:模式2;藍色:模式3;淺綠色:模式4;深綠色:模式5;紫色:模式6) ? ?2.4 RT-qPCR驗證
從模式1和模式2中選取Spp1、Mgp、Mmp13、Wif1、Cxcl12和Ccna2進行RT-qPCR驗證。結果顯示,這些基因的RT-qPCR結果與基因芯片結果的變化趨勢一致。見圖 6。
3 討論
本研究中我們觀察到大鼠BMSCs在不添加成骨誘導劑的條件下,經體外連續培養會發生自發鈣化,并且在培養7 d細胞開始堆積,14 d開始形成典型的鈣結節樣結構,這與本課題組既往研究結果一致[5]。然而,關于BMSCs自發鈣化的分子機制以及參與調控的信號通路尚罕見報道。基于此,本研究選取自發鈣化0 d(細胞接種時)、7 d(細胞開始堆積時)和14 d(鈣結節樣結構形成時)3個時間點,應用基因芯片技術對大鼠BMSCs自發鈣化過程中的基因表達譜進行分析,并對一些基因進行RT-qPCR驗證以確保基因芯片結果的準確性。我們的結果表明自發鈣化7 d和14 d比較只有極少數基因差異表達,其數目遠遠少于0 d與7 d比較的差異表達基因數目,說明細胞接種后的前7 d是決定大鼠BMSCs自發鈣化命運的關鍵期。這與體外誘導BMSCs成骨分化過程中的基因表達模式是有區別的,BMSCs成骨誘導分化過程可分為3個階段:細胞增殖期、基質成熟期和礦化形成期。在誘導第7天細胞通常處于基質成熟期,此階段細胞增殖抑制,ALP和Ⅰ型膠原表達達高峰;誘導第14天細胞通常進入礦化形成期,此階段ALP的表達水平回落,而骨橋蛋白、骨鈣素、骨唾液蛋白等與羥基磷灰石沉積密切相關的基因表達達高峰[14]。
為了進一步探討自發鈣化機制,本研究著重關注了與骨細胞生物學密切相關的生物學過程和信號通路。14個生物學過程和9條信號通路可歸納為7大類,即血管生成、細胞凋亡、骨相關基因、細胞周期、發育、細胞通訊和成骨信號通路。其中血管生成類基因可展示出自發鈣化與血管生成的關聯性;細胞凋亡、細胞周期和發育類基因則分別說明了BMSCs在自發鈣化過程中的存活情況、增殖情況和發育進展情況;細胞通訊類基因可提供細胞與細胞間、細胞與細胞外基質間以及細胞與信號分子間相互交流的信息。選擇TGF-β信號通路、MAPK信號通路和Wnt信號通路是因為它們均在MSCs成骨分化過程中發揮了重要調控作用。結合生物信息學知識,我們可以得到以下幾點啟示。
3.1 細胞通訊類基因在自發鈣化過程中發揮了重要作 用
細胞通訊類基因主要包含細胞黏附類基因和與細胞外基質形成及重塑相關的基因,本實驗中大多數被選擇基因為細胞通訊類基因。這與MSCs成骨誘導分化過程是相似的,Granchi等[13]研究發現BMSCs成骨誘導分化過程中大量細胞通訊類基因的表達發生了變化,尤其是與細胞外基質的沉積和重塑相關的基因。在這類基因中有5個基因處于功能關聯網絡圖中的節點位置,其中Apoe、Mmp2、Mmp3和Mmp13在自發鈣化過程中表達上調,而Cxcl12在自發鈣化過程中表達下調。它們的表達模式與文獻報道的其在成骨分化和骨生成過程中的表達模式相似。Apoe在成骨細胞礦化階段會高表達,它可以生理性地調節成骨細胞功能[15];Mmp13是成熟成骨細胞和肥大軟骨細胞的重要標志基因,它在成骨分化過程中會持續上調,并在骨的形成和重塑過程中發揮重要作用[16];Cxcl12在地塞米松和BMP-2誘導的MSCs成骨分化過程中均會表達下調,在成骨分化末期參與了調節骨結節的礦化過程[17]。以上研究結果均表明這些細胞通訊類基因參與了自發鈣化過程的調控。
3.2 骨相關基因在自發鈣化過程中變化顯著
一系列骨相關基因在自發鈣化過程中發生了差異表達,這進一步驗證了自發鈣化過程實質上是BMSCs自發地向成骨方向分化的過程。但這些骨相關基因的表達變化情況卻與MSCs成骨誘導分化過程中變化情況不盡相同,總體可分為3種情況:① Spp1、Ibsp和Dmp1在自發鈣化中表達上調,這與文獻報道的它們在成骨分化過程中的表達模式相似[18-19]。Spp1、Ibsp和Dmp1為SIBLING家族磷蛋白,它們均在羥基磷灰石的沉積和礦化基質形成過程中發揮重要的調控作用。自發鈣化過程中Spp1、Ibsp和Dmp1在7 d時已上調,既表明它們在鈣結節樣結構的形成和礦化過程中發揮著重要調控作用,又表明在自發鈣化7 d細胞已進入礦化基質的形成階段。② Bmp6在自發鈣化中表達下調,這與其在MSCs成骨誘導分化中的表達模式不同。Friedman等[20]研究發現Bmp6在MSCs成骨誘導分化過程中表達上調,它是BMP家族最強有力和持久的成骨分化調節基因。外源性Bmp6會促進MSCs表達Runx2、Osx、Ⅰ型膠原、骨鈣素和骨唾液蛋白等成骨相關基因,這些基因的表達又會促進細胞外基質的產生和隨后的羥基磷灰石沉積。本實驗中Bmp6的下調表明Bmp6信號在自發鈣化過程中受到了抑制,抑制原因還需進一步研究。③ Mgp在MSCs成骨分化過程中研究得很少,主要集中在血管鈣化領域。Mgp可調節骨化過程[21],其功能受Bmp2表達水平的影響,當Bmp2表達水平較高時Mgp促進鈣化,但當Bmp2表達水平較低時Mgp又可抑制鈣化[22]。本實驗中Mgp的上調可能通過與Bmp2作用促進鈣化,也可能會發揮反饋抑制作用以控制鈣化程度和保持礦化基質的平 衡。
3.3 TGF-β、MAPK和Wnt信號通路在自發鈣化過程中作用顯著
TGF-β、MAPK和Wnt信號通路是調控MSCs成骨分化的重要信號通路,我們的研究發現在自發鈣化過程中,這3種信號通路均有一系列重要靶基因的表達發生變化。如MAPK信號通路中的Fgf18在自發鈣化過程中表達上調,Fgf18可通過激活Fgfr1/Fgfr2介導的ERK1/2-MAPK信號通路從而促進MSCs成骨分化[23]。這與MSCs成骨誘導分化過程相似,Hamidouche等[23]研究發現,在地塞米松誘導的大鼠MSCs成骨分化過程中,Fgf18同樣會表達上調。Wnt信號通路中的Wnt5a、Wif1和Sfrp2在自發鈣化過程中也發生了差異表達。Wnt5a可通過激活β-catenin非依賴型信號通路從而促進MSCs成骨分化[24]。Wif1和Sfrp2均為Wnt拮抗劑。本實驗中Wnt5a的表達下調以及Wif1和Sfrp2的表達上調,均表明在自發鈣化過程中Wnt信號通路受到抑制。有研究表明Wnt5a在成骨分化早期表達上調,但在分化末期表達下調[25-27]。Wif1和Sfrp2在成骨分化末期表達,以對Wnt信號進行負性反饋調節,這對于控制成骨細胞的成熟是必要的[28]。這些預示著在自發鈣化7 d細胞已進入了成骨分化末期,并且已開始對Wnt信號通路進行負性反饋調節。以上信號通路中靶基因的表達變化表明TGF-β、MAPK和Wnt信號通路參與了自發鈣化過程的調控,但其具體調控機制還需要進一步研究。
3.4 細胞周期類基因參與自發鈣化的調控
MSCs的增殖和分化在功能上存在著對立關系:在分化前期細胞增殖會受到抑制,這是MSCs分化前的重要準備步驟;而當MSCs進入終末分化階段時,細胞則完全喪失增殖能力[29]。本實驗中我們觀察到12個功能上聯系密切的細胞周期類基因在自發鈣化中發生了下調,它們的下調表明細胞周期的停滯和細胞增殖的抑制。在自發鈣化過程中細胞周期的停滯會使MSCs保持在一個有利于分化的細胞周期階段。此外,礦化細胞外基質的產生也可能是導致細胞增殖抑制的原因[30]。
3.5 其他因素在自發鈣化過程中的作用
自發鈣化過程還伴隨了許多血管生成類、細胞凋亡類和發育類基因的表達變化。值得注意的是,自發鈣化過程中血管生成類基因的表達上調說明MSCs在成骨分化過程中同時會促進血管新生,這支持了新生血管的發展會促進骨形成和修復的觀點[31]。此外,在自發鈣化過程中還有大量缺乏文獻報道與骨細胞生物學存在關聯性的基因發生了差異表達,這為MSCs自發鈣化和成骨分化的研究提供了新的方向和靶點。
綜上述,細胞接種后的前7 d是決定大鼠BMSCs自發鈣化命運的關鍵期。在BMSCs自發鈣化過程中發生了多種基因表達的變化,此過程受細胞通訊類基因、骨相關基因、細胞周期類基因以及TGF-β、MAPK和Wnt信號通路等多方面的共同調控。然而,為深入研究MSCs自發鈣化的分子機制,還需進一步研究篩選出來的差異表達基因在蛋白水平的表達情況以及它們在體內的表達和功能。此外,還需采用基因沉默技術以探明哪些重要靶基因在自發鈣化過程中發揮著決定性作用。
BMSCs具有較強的自我更新能力和多向分化潛能,已成為組織工程和再生醫學領域重要的種子細胞來源,在心肌梗死、神經損傷、運動系統損傷等多種疾病的治療中具有廣闊應用前景。隨著臨床應用研究的深入,BMSCs的安全性也逐步受到重視。近年一些研究表明,BMSCs主要存在兩大安全隱患,即BMSCs的惡性轉化傾向或致瘤性以及自發鈣化/骨化傾向[1]。前者尚存在一些爭議,但BMSCs的自發鈣化現象目前已被證實。Yoon等[2]發現大鼠骨髓來源細胞心肌內移植后直接參與了急性梗死區鈣化組織的形成;Breitbach等[3]在小鼠急性心肌梗死模型上進一步明確了鈣化組織主要由BMSCs構成;Bi等[4]將小鼠 BMSCs移植至肌腱缺損部位,也發現BMSCs形成骨樣結構。本課題組既往研究也發現,大鼠BMSCs在不添加成骨誘導劑的條件下,經體外連續培養會發生自發鈣化,生成的鈣結節茜素紅染色陽性,免疫組織化學染色示Ⅰ型膠原和骨鈣素也呈陽性表達;并且于培養第7天細胞開始堆積,第14天開始形成典型的鈣結節樣結構[5]。目前關于BMSCs自發鈣化的分子機制及參與調控的信號通路尚罕見報道。基于此,本實驗利用基因芯片技術動態檢測大鼠BMSCs自發鈣化過程中基因表達譜的變化,初步探討BMSCs自發鈣化過程中的分子調控機制。
1 材料與方法
1.1 實驗動物及主要試劑、儀器
健康3日齡SD大鼠10只,雌雄不限,體重5.5~ 10.0 g,由四川大學實驗動物中心提供。H-DMEM、FBS、胰蛋白酶、EDTA(GIBCO公司,美國);基因芯片Rat Genome230 2.0 arrays(Affymetrix公司,美國);Trizol試劑(Invitrogen公司,美國);逆轉錄試劑盒、熒光定量試劑盒、引物序列(Takara公司,日本)。實時熒光定量PCR (real-time quantitative PCR,RT-qPCR)測試儀(Bio-Rad公司,美國);CO2培養箱(SANYO公司,日本);倒置相差顯微鏡(Olympus公司,日本);分子功能注釋系統v3.0(北京博奧生物有限公司)。
1.2 大鼠BMSCs的分離培養
參照本課題組既往研究方法[6],取5只SD大鼠斷頸處死,無菌條件下分離股骨和脛骨,用5 mL含10%FBS 的H-DMEM培養基沖洗骨髓腔,收集細胞懸液,接種于無菌培養瓶中。37℃、5%CO2及飽和濕度培養箱中培養,48 h后首次換液,之后每3天換液1 次。待貼壁細胞融合達80%左右時用0.25%胰蛋白酶-0.1%EDTA消化,以1∶2比例傳代,倒置相差顯微鏡觀察細胞形態學變化。
1.3 BMSCs體外自發鈣化模型建立及檢測
參照本課題組既往研究方法[5],取上述培養的第4 代生長良好的BMSCs,按1 × 104個/cm2密度接種于預先加入血蓋片的6孔板中,然后加入含10%FBS的H-DMEM培養基,在不添加任何誘導劑的條件下,置入37℃、5%CO2及飽和濕度培養箱中連續培養。于培養不同時間點觀察BMSCs自發鈣化的情況。
1.3.1 形態學觀察及茜素紅染色觀察
培養7、14 d,倒置相差顯微鏡觀察細胞生長狀況及自發鈣化進程;細胞用PBS輕洗3次,75%乙醇固定15 min,37℃恒溫箱中1%茜素紅染液染色1 h,水洗后封片,倒置相差顯微鏡下觀察。
1.3.2 RNA提取
分別于培養0、7、14 d收集細胞,用Trizol試劑提取細胞總RNA,用波長260 nm和280 nm處的吸光度(A)值比值(A260/A280)及瓊脂糖凝膠電泳實驗評估所提取RNA的純度及完整性。
1.3.3 基因芯片檢測及分析
使用基因芯片Rat Genome230 2.0 arrays對上述0、7、14 d的RNA樣品進行基因表達譜分析。RNA標記、芯片雜交、清洗、染色、掃描和數據分析均由北京博奧生物有限公司完成。各時間點的基因表達數據進行兩兩比較以得到基因表達變化的差異倍數。生物學重復為2,以2次差異倍數均值> 2倍或< 0.5倍來確定差異表達基因。芯片中共有約28 700個大鼠基因。
1.3.4 生物信息學分析
將各時間點的所有差異表達基因匯總,使用STEM算法[7]進行時間序列表達譜差異表達基因分類。使用分子功能注釋系統v3.0對差異表達基因進行基因本體(gene ontology,GO)分析和信號通路分析。其中GO分析包含生物學過程分析、分子功能分析和細胞成分分析三部分,信號通路分析依據KEGG數據庫[8-9]。使用STRING數據庫[10]對差異表達基因間的功能關聯性進行預測。
1.3.5 RT-qPCR驗證
選取用于基因芯片檢測的一組生物學重復的RNA樣品進行RT-qPCR驗證,每組3個復孔。先用逆轉錄試劑盒將RNA逆轉錄形成cDNA,再以cDNA為模板,采用RT-qPCR測試儀檢測分泌型磷酸蛋白1(secreted phosphoprotein 1,Spp1)、Mgp、基質金屬蛋白酶13(matrix metalloproteinase 13,Mmp13)、Wnt抑制因子1(Wnt inhibitory factor 1,Wif1)、Cxcl12和細胞周期素A2(cyclin A2,Ccna2)mRNA的定量表達。內參采用GAPDH基因。
2 結果
2.1 大鼠BMSCs形態學觀察
從骨髓分離而來的 BMSCs原代培養24 h后細胞開始貼壁;培養3~4 d 后,形成若干梭形和多角形的細胞集落;5 d 后細胞長至 80%趨于融合。第4代細胞呈現為較均一的長梭形。見圖 1。
 圖1
大鼠BMSCs形態學觀察(倒置相差顯微鏡× 200) ? 原代培養 3 d ? 第4代細胞培養2 d ? ?
圖1
大鼠BMSCs形態學觀察(倒置相差顯微鏡× 200) ? 原代培養 3 d ? 第4代細胞培養2 d ? ?2.2 大鼠BMSCs自發鈣化觀察
2.2.1 形態學觀察及茜素紅染色觀察
體外連續培養7 d后BMSCs開始堆集,茜素紅染色為弱陽性;培養14 d后BMSCs堆積明顯,并形成典型的茜素紅陽性鈣結節樣結構。見圖 2、3。
2.2.2 不同時間點差異表達基因的數目
培養0 d和7 d相比有359個差異表達的基因探針,0 d和14 d相比有530個差異表達的基因探針,而7 d和14 d相比只有13個差異表達的基因探針。上述3次比較共有576個差異表達的基因探針,對應378個大鼠基因。
2.2.3 差異表達基因表達模式分類
依據基因表達隨時間的變化模式,可將這378個差異表達基因分為6 類。其中222個基因屬于模式1,即基因表達在14 d中持續上調,且前7 d的增長速率明顯快于后7 d;模式2包含107個基因,即基因在前7 d表達下調,而在后7 d表達趨于穩定;模式3包含34個基因,即基因表達在14 d中持續下調;模式4、5、6包含的基因均較少,分別只有10、3、2個。見圖 4。
2.2.4 差異表達基因的功能學分類
對差異表達基因進行GO和信號通路分析。其中有14個生物學過程和9條信號通路與骨細胞的增殖、分化等生物學功能密切相關。根據生物功能的親和關系可將這些生物學過程和信號通路歸納為7大類,即血管生成、細胞凋亡、骨相關基因、細胞周期、發育、細胞通訊和成骨信號通路[11-14]。這些生物學過程和信號通路共包含95個差異表達基因,每個基因至少參與了1個生物學過程或1 條信號通路。見表 1。
模式1和模式2包含了絕大多數上述被選擇基因。模式1中大多數基因為細胞通訊類基因;此外,還包含了血管生成類基因、骨相關基因和成骨信號通路類基因。模式2主要包含細胞通訊類基因、骨相關基因、成骨信號通路類基因和大量細胞周期類基因。見表 2。
2.3 基因功能關聯性分析
應用STRING數據庫對篩選出來的95個成骨相關差異表達基因進行功能關聯性分析。如圖 5所示,Pttg1、Cdc20、Cdca8、Cdca3、Ccna2、Nuf2、Ccnb2、Ccnb1、Mcm6、Mcm5、Espl1和Mad2l1組成了一個功能上密切聯系的基因球狀網絡,它們均為細胞周期類基因并均屬于模式2,即在自發鈣化過程中表達下調。此外,Mmp13、Spp1、Cxcl12、Mmp2、Mmp3、Apoe和Itga7在功能關聯性網絡圖中處于節點位置,相比其他基因,它們與更多基因存在功能上的聯系,這預示著它們在自發鈣化過程中發揮著核心調控作用。
 圖5
差異表達基因的功能關聯性分析 直線表示基因間有功能上的聯系 不同顏色圓點代表不同表達模式中的基因(紅色:模式1;黃色:模式2;藍色:模式3;淺綠色:模式4;深綠色:模式5;紫色:模式6) ? ?
圖5
差異表達基因的功能關聯性分析 直線表示基因間有功能上的聯系 不同顏色圓點代表不同表達模式中的基因(紅色:模式1;黃色:模式2;藍色:模式3;淺綠色:模式4;深綠色:模式5;紫色:模式6) ? ?2.4 RT-qPCR驗證
從模式1和模式2中選取Spp1、Mgp、Mmp13、Wif1、Cxcl12和Ccna2進行RT-qPCR驗證。結果顯示,這些基因的RT-qPCR結果與基因芯片結果的變化趨勢一致。見圖 6。
3 討論
本研究中我們觀察到大鼠BMSCs在不添加成骨誘導劑的條件下,經體外連續培養會發生自發鈣化,并且在培養7 d細胞開始堆積,14 d開始形成典型的鈣結節樣結構,這與本課題組既往研究結果一致[5]。然而,關于BMSCs自發鈣化的分子機制以及參與調控的信號通路尚罕見報道。基于此,本研究選取自發鈣化0 d(細胞接種時)、7 d(細胞開始堆積時)和14 d(鈣結節樣結構形成時)3個時間點,應用基因芯片技術對大鼠BMSCs自發鈣化過程中的基因表達譜進行分析,并對一些基因進行RT-qPCR驗證以確保基因芯片結果的準確性。我們的結果表明自發鈣化7 d和14 d比較只有極少數基因差異表達,其數目遠遠少于0 d與7 d比較的差異表達基因數目,說明細胞接種后的前7 d是決定大鼠BMSCs自發鈣化命運的關鍵期。這與體外誘導BMSCs成骨分化過程中的基因表達模式是有區別的,BMSCs成骨誘導分化過程可分為3個階段:細胞增殖期、基質成熟期和礦化形成期。在誘導第7天細胞通常處于基質成熟期,此階段細胞增殖抑制,ALP和Ⅰ型膠原表達達高峰;誘導第14天細胞通常進入礦化形成期,此階段ALP的表達水平回落,而骨橋蛋白、骨鈣素、骨唾液蛋白等與羥基磷灰石沉積密切相關的基因表達達高峰[14]。
為了進一步探討自發鈣化機制,本研究著重關注了與骨細胞生物學密切相關的生物學過程和信號通路。14個生物學過程和9條信號通路可歸納為7大類,即血管生成、細胞凋亡、骨相關基因、細胞周期、發育、細胞通訊和成骨信號通路。其中血管生成類基因可展示出自發鈣化與血管生成的關聯性;細胞凋亡、細胞周期和發育類基因則分別說明了BMSCs在自發鈣化過程中的存活情況、增殖情況和發育進展情況;細胞通訊類基因可提供細胞與細胞間、細胞與細胞外基質間以及細胞與信號分子間相互交流的信息。選擇TGF-β信號通路、MAPK信號通路和Wnt信號通路是因為它們均在MSCs成骨分化過程中發揮了重要調控作用。結合生物信息學知識,我們可以得到以下幾點啟示。
3.1 細胞通訊類基因在自發鈣化過程中發揮了重要作 用
細胞通訊類基因主要包含細胞黏附類基因和與細胞外基質形成及重塑相關的基因,本實驗中大多數被選擇基因為細胞通訊類基因。這與MSCs成骨誘導分化過程是相似的,Granchi等[13]研究發現BMSCs成骨誘導分化過程中大量細胞通訊類基因的表達發生了變化,尤其是與細胞外基質的沉積和重塑相關的基因。在這類基因中有5個基因處于功能關聯網絡圖中的節點位置,其中Apoe、Mmp2、Mmp3和Mmp13在自發鈣化過程中表達上調,而Cxcl12在自發鈣化過程中表達下調。它們的表達模式與文獻報道的其在成骨分化和骨生成過程中的表達模式相似。Apoe在成骨細胞礦化階段會高表達,它可以生理性地調節成骨細胞功能[15];Mmp13是成熟成骨細胞和肥大軟骨細胞的重要標志基因,它在成骨分化過程中會持續上調,并在骨的形成和重塑過程中發揮重要作用[16];Cxcl12在地塞米松和BMP-2誘導的MSCs成骨分化過程中均會表達下調,在成骨分化末期參與了調節骨結節的礦化過程[17]。以上研究結果均表明這些細胞通訊類基因參與了自發鈣化過程的調控。
3.2 骨相關基因在自發鈣化過程中變化顯著
一系列骨相關基因在自發鈣化過程中發生了差異表達,這進一步驗證了自發鈣化過程實質上是BMSCs自發地向成骨方向分化的過程。但這些骨相關基因的表達變化情況卻與MSCs成骨誘導分化過程中變化情況不盡相同,總體可分為3種情況:① Spp1、Ibsp和Dmp1在自發鈣化中表達上調,這與文獻報道的它們在成骨分化過程中的表達模式相似[18-19]。Spp1、Ibsp和Dmp1為SIBLING家族磷蛋白,它們均在羥基磷灰石的沉積和礦化基質形成過程中發揮重要的調控作用。自發鈣化過程中Spp1、Ibsp和Dmp1在7 d時已上調,既表明它們在鈣結節樣結構的形成和礦化過程中發揮著重要調控作用,又表明在自發鈣化7 d細胞已進入礦化基質的形成階段。② Bmp6在自發鈣化中表達下調,這與其在MSCs成骨誘導分化中的表達模式不同。Friedman等[20]研究發現Bmp6在MSCs成骨誘導分化過程中表達上調,它是BMP家族最強有力和持久的成骨分化調節基因。外源性Bmp6會促進MSCs表達Runx2、Osx、Ⅰ型膠原、骨鈣素和骨唾液蛋白等成骨相關基因,這些基因的表達又會促進細胞外基質的產生和隨后的羥基磷灰石沉積。本實驗中Bmp6的下調表明Bmp6信號在自發鈣化過程中受到了抑制,抑制原因還需進一步研究。③ Mgp在MSCs成骨分化過程中研究得很少,主要集中在血管鈣化領域。Mgp可調節骨化過程[21],其功能受Bmp2表達水平的影響,當Bmp2表達水平較高時Mgp促進鈣化,但當Bmp2表達水平較低時Mgp又可抑制鈣化[22]。本實驗中Mgp的上調可能通過與Bmp2作用促進鈣化,也可能會發揮反饋抑制作用以控制鈣化程度和保持礦化基質的平 衡。
3.3 TGF-β、MAPK和Wnt信號通路在自發鈣化過程中作用顯著
TGF-β、MAPK和Wnt信號通路是調控MSCs成骨分化的重要信號通路,我們的研究發現在自發鈣化過程中,這3種信號通路均有一系列重要靶基因的表達發生變化。如MAPK信號通路中的Fgf18在自發鈣化過程中表達上調,Fgf18可通過激活Fgfr1/Fgfr2介導的ERK1/2-MAPK信號通路從而促進MSCs成骨分化[23]。這與MSCs成骨誘導分化過程相似,Hamidouche等[23]研究發現,在地塞米松誘導的大鼠MSCs成骨分化過程中,Fgf18同樣會表達上調。Wnt信號通路中的Wnt5a、Wif1和Sfrp2在自發鈣化過程中也發生了差異表達。Wnt5a可通過激活β-catenin非依賴型信號通路從而促進MSCs成骨分化[24]。Wif1和Sfrp2均為Wnt拮抗劑。本實驗中Wnt5a的表達下調以及Wif1和Sfrp2的表達上調,均表明在自發鈣化過程中Wnt信號通路受到抑制。有研究表明Wnt5a在成骨分化早期表達上調,但在分化末期表達下調[25-27]。Wif1和Sfrp2在成骨分化末期表達,以對Wnt信號進行負性反饋調節,這對于控制成骨細胞的成熟是必要的[28]。這些預示著在自發鈣化7 d細胞已進入了成骨分化末期,并且已開始對Wnt信號通路進行負性反饋調節。以上信號通路中靶基因的表達變化表明TGF-β、MAPK和Wnt信號通路參與了自發鈣化過程的調控,但其具體調控機制還需要進一步研究。
3.4 細胞周期類基因參與自發鈣化的調控
MSCs的增殖和分化在功能上存在著對立關系:在分化前期細胞增殖會受到抑制,這是MSCs分化前的重要準備步驟;而當MSCs進入終末分化階段時,細胞則完全喪失增殖能力[29]。本實驗中我們觀察到12個功能上聯系密切的細胞周期類基因在自發鈣化中發生了下調,它們的下調表明細胞周期的停滯和細胞增殖的抑制。在自發鈣化過程中細胞周期的停滯會使MSCs保持在一個有利于分化的細胞周期階段。此外,礦化細胞外基質的產生也可能是導致細胞增殖抑制的原因[30]。
3.5 其他因素在自發鈣化過程中的作用
自發鈣化過程還伴隨了許多血管生成類、細胞凋亡類和發育類基因的表達變化。值得注意的是,自發鈣化過程中血管生成類基因的表達上調說明MSCs在成骨分化過程中同時會促進血管新生,這支持了新生血管的發展會促進骨形成和修復的觀點[31]。此外,在自發鈣化過程中還有大量缺乏文獻報道與骨細胞生物學存在關聯性的基因發生了差異表達,這為MSCs自發鈣化和成骨分化的研究提供了新的方向和靶點。
綜上述,細胞接種后的前7 d是決定大鼠BMSCs自發鈣化命運的關鍵期。在BMSCs自發鈣化過程中發生了多種基因表達的變化,此過程受細胞通訊類基因、骨相關基因、細胞周期類基因以及TGF-β、MAPK和Wnt信號通路等多方面的共同調控。然而,為深入研究MSCs自發鈣化的分子機制,還需進一步研究篩選出來的差異表達基因在蛋白水平的表達情況以及它們在體內的表達和功能。此外,還需采用基因沉默技術以探明哪些重要靶基因在自發鈣化過程中發揮著決定性作用。