引用本文: 方易冰, 文智, 鄧明彬, 賴前成, 于風旭, 唐小軍, 伍長學, 牟光容, 廖斌. 微小RNA在小鼠竇房結與心房肌、心室肌表達差異性的研究. 中國修復重建外科雜志, 2014, 28(9): 1139-1144. doi: 10.7507/1002-1892.20140247 復制
版權信息: ?四川大學華西醫院華西期刊社《中國修復重建外科雜志》版權所有,未經授權不得轉載、改編
目前,心血管疾病已成為全球范圍內首要死亡原因[1]。隨著人口老齡化,竇房結相關性心律失常疾病發病率也呈增高趨勢[2]。電子心臟起搏器是治療心臟傳導系統疾病的主要方法,但存在諸多不足。近年來,人工生物起搏器的研究成為熱點,有望取代電子起搏器,成為治療心臟傳導系統疾病的有效方法[3]。獲得功能穩定的起搏細胞,是人工生物起搏器研制的第一步,也是最重要環節。誘導胚胎干細胞或成體干細胞分化成為具有竇房結細胞樣的起搏細胞,是目前獲得起搏細胞的主要策略。
細胞分化是一個十分復雜的生理過程,伴隨著化學物質、細胞形態和生理功能的變化。從分子水平看,蛋白質是實現細胞形態和功能的物質基礎,因此細胞分化意味著細胞內特定蛋白水平的差異,基因表達調控是決定細胞分化方向的核心機制。而微小RNA(microRNA,miRNA)在蛋白翻譯過程中起著極其重要的作用。miRNA是一類內源基因編碼的、長度為19~25個核苷酸的非編碼單鏈RNA分子,其中多數miRNA具有高度序列保守性、表達時序性和組織特異性,其廣泛參與生命活動的各個過程[4]。研究顯示,miRNA參與了心臟發育的每個環節,包括胚胎心肌干細胞向竇房結細胞和工作心肌細胞不同方向的分化[5]。但在干細胞分化發育過程中,心室肌、心房肌中無竇房結細胞以及竇房結中無工作心肌細胞的原因尚不清楚,是哪些miRNA起關鍵調控作用亦未明確。因此,本研究對小鼠竇房結、心房肌、心室肌的miRNA譜進行測定、對比,篩選可能對干細胞定向分化起關鍵調控作用的miRNA,為心臟干細胞定向誘導分化提供參考。
1 材料與方法
1.1 實驗動物及主要試劑、儀器
60~90日齡健康昆明小鼠190只,雌雄不限,體重35~45 g,由瀘州醫學院實驗動物中心提供。TRIzol試劑(Invitrogen公司,美國);miRNA提取試劑盒(Qiagen公司,德國);5×TBE液(上海生工生物工程股份有限公司);miRCURYTM Array Power標記試劑盒(Exiqon公司,丹麥)。芯片掃描儀、基因分析軟件(Axon公司,荷蘭);凝膠成像系統(Bio-Rad公司,美國);紫外/可見分光光度計(Nanodrop公司,美國)。
1.2 實驗標本制備
1.2.1 竇房結組織解剖定位
取10只小鼠脫頸處死,作胸部正中切口暴露心臟,于1×12.5倍解剖顯微鏡下,剪開心包,暴露上腔靜脈至肺動脈處。以界溝為縱軸線,于上腔靜脈與右心房交界處明顯搏動部位剪取大小為2.0 mm×1.5 mm×1.0 mm組織塊[6]。組織塊置于10%中性甲醛固定,乙醇逐級脫水,石蠟包埋,2 μm厚切片,HE染色,光鏡下觀察明確所取組織包含竇房結組織。另取左心耳(心房肌)及心尖處(心室肌)組織常規切片,HE染色觀察。
1.2.2 取材
取180只小鼠同1.2.1方法切取竇房結組織,同時分別于左心耳及心尖處剪取大小為2.0 mm×1.5 mm×1.0 mm心肌組織,3個部位組織總重量分別達200 mg以上。取材后迅速置于液氮中速凍30 min后,置于—80℃低溫冰箱保存備用。
1.3 miRNA芯片分析
1.3.1 總RNA提取及質量檢測
取樣品加入TRIzol試劑,組織勻漿,室溫孵育5 min,以完全解離核酸蛋白復合體。于TRIzol試劑勻漿樣品中按5:1(V/V)比例加入氯仿,振蕩15 s,室溫孵育10 min。4℃,以離心半徑13.5 cm,12 000 r/min離心15 min。離心后樣品分為3層,吸取含RNA的水相層,沉淀、清洗、復溶,采用紫外/可見分光光度計以及凝膠電泳分別檢測總RNA濃度和純度。
1.3.2 基因芯片檢測及分析
取1.3.1制備的組織總RNA行芯片雜交及清洗,由上海康成生物工程有限公司完成。使用芯片掃描儀掃描芯片熒光強度,掃描激發波長為635 nm,芯片上每個探針的綠色信號強度經去背景化(排除前景值與背景值之差 < 0的數據)處理。將實驗結果轉換成數字型數據,使用基因分析軟件對數據進行分析運算,用中位數標準化方法對數據進行標準化處理。采用t檢驗計算差異表達的miRNA,再用Fold change篩選出差異表達2倍以上(Fold change值≥2或≤0.5)的miRNA。
1.3.3 基因功能關聯性分析
選取與竇房結相比,心房肌、心室肌差異表達達2倍以上的miRNA。通過搜索Miranda等數據庫得到差異miRNA調控的靶基因。對差異miRNA對應的靶基因進行GO顯著性功能分析,得到具有顯著性、低誤判率、靶向性的GO功能集以及對應的靶基因。對差異miRNA對應的靶基因進行KEGG Pathway顯著性分析,得到具有顯著性、低誤判率、靶向性的KEGG Pathway以及對應的靶基因。將以上步驟得到的靶基因構建差異miRNA與靶基因的調控網絡,得到網絡中起核心調控作用的miRNA和被miRNA調控的關鍵靶基因。
2 結果
2.1 組織學觀察
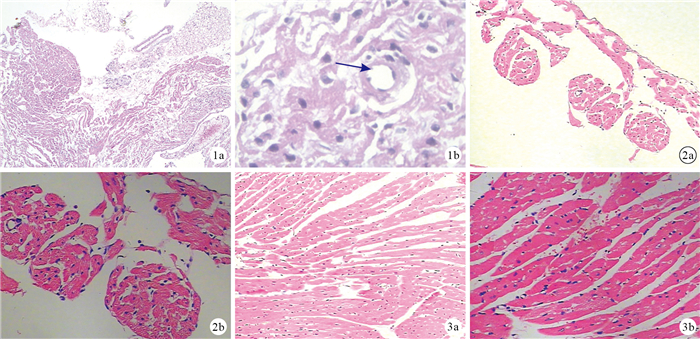
鏡下觀察示,竇房結組織細胞質淡染,少量細胞聚集,細胞核大而圓,呈中心性分布,與普通心肌相比幾乎無橫紋,周圍較多纖維結締組織包繞,其間可見竇房結動脈(圖 1)。心房肌較薄,肌纖維較細短,較少分支(圖 2)。心室肌較厚,肌纖維較粗長,可見分支,組織中脂肪、血管組織含量少(圖 3)。
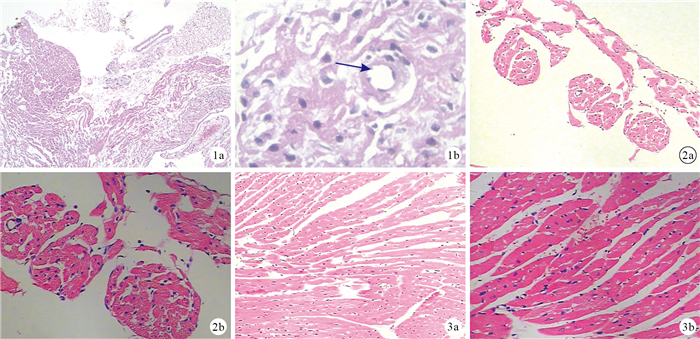 圖1
竇房結HE染色觀察?×40 ?×100箭頭示竇房結動脈??圖 2心房肌HE染色觀察?×100 ?×200 ??圖 3心室肌HE染色觀察?×100 ?×200
Figure1.
HE staining of sinus node ?×40 ?×100 Arrow indicated artery of sinus node ??Fig. 2 HE staining of the atrial myocardium ?×100 ?×200 ??Fig. 3 HE staining of the ventricular myocardium ?×100 ?×200
圖1
竇房結HE染色觀察?×40 ?×100箭頭示竇房結動脈??圖 2心房肌HE染色觀察?×100 ?×200 ??圖 3心室肌HE染色觀察?×100 ?×200
Figure1.
HE staining of sinus node ?×40 ?×100 Arrow indicated artery of sinus node ??Fig. 2 HE staining of the atrial myocardium ?×100 ?×200 ??Fig. 3 HE staining of the ventricular myocardium ?×100 ?×200
2.2 竇房結與心房肌、心室肌miRNA表達差異分析
2.2.1 總RNA濃度及純度檢測
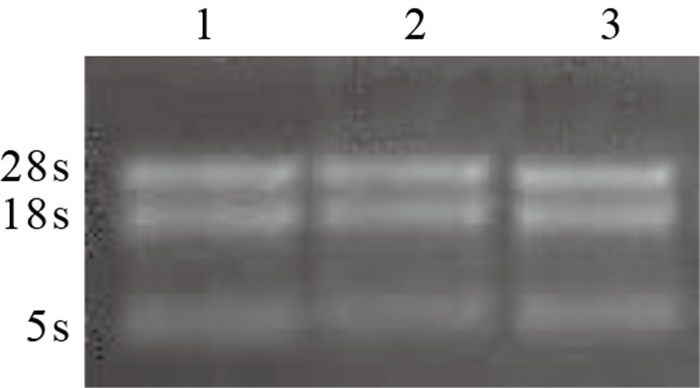
結果顯示,樣本提取的總RNA吸光度(A)值(A260/280)均接近2,其中竇房結1.97、心房肌1.99,心室肌2.04,提示污染較少;A260/230均大于1.8,其中竇房結2.35、心室肌2.41、心房肌2.36,提示總RNA純度較高。凝膠電泳可見3條清晰條帶,分別為28s、18s、5s,其中28s條帶亮度大于18s條帶,提取總RNA完整且無明顯降解(圖 4),可用于后續芯片實驗。
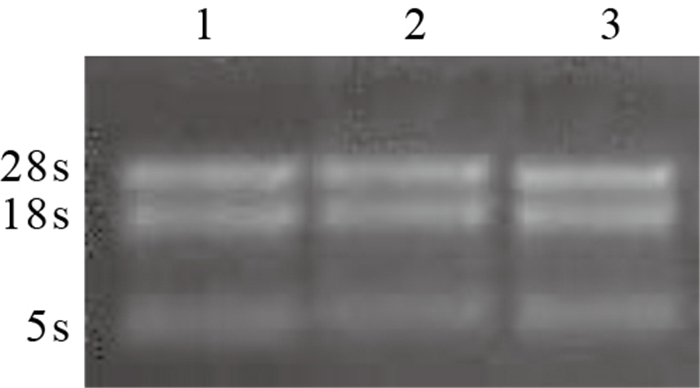 圖4
總RNA凝膠電泳圖 1:心房肌2:竇房結3:心室肌
Figure4.
Agarose gel electrophoresis of total RNA 1: Atrial myocardium 2: Sinus node 3: Ventricular myocardium
圖4
總RNA凝膠電泳圖 1:心房肌2:竇房結3:心室肌
Figure4.
Agarose gel electrophoresis of total RNA 1: Atrial myocardium 2: Sinus node 3: Ventricular myocardium
2.2.2 miRNA表達差異分析
竇房結與心室肌、心房肌相比,差異表達miRNA共39個,其中上調miRNA 12個,下調miRNA 27個。見表 1、2。
2.2.3 基因功能關聯性分析
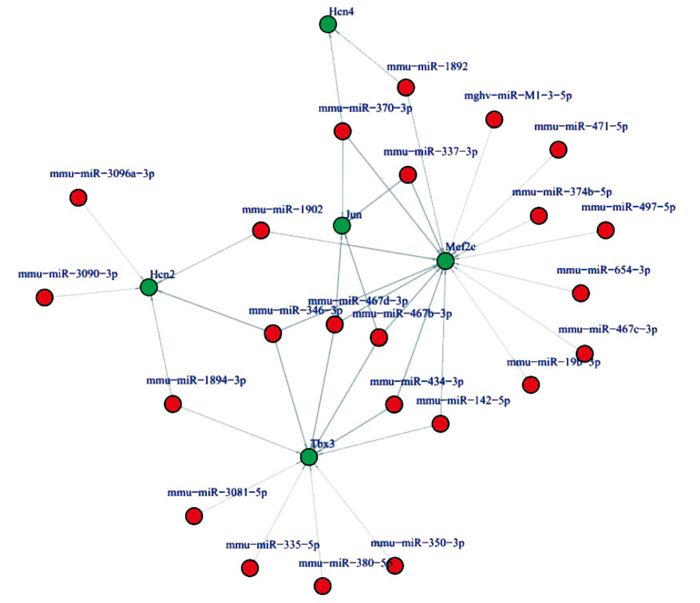
通過對差異miRNA對應的靶基因進行GO及KEGG Pathway顯著性分析,得到網絡中起核心調控作用的miRNA和被miRNA調控的關鍵靶基因。見圖 5。
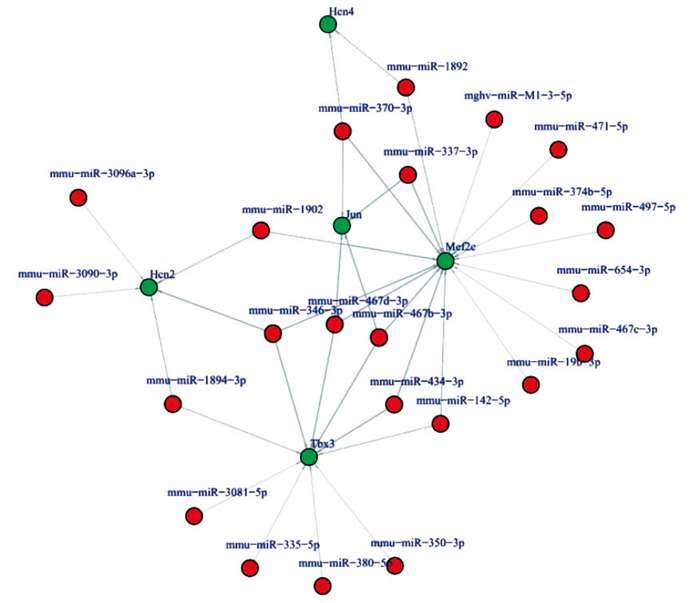 圖5
部分miRNA的靶基因
Figure5.
Target genes of some miRNAs
圖5
部分miRNA的靶基因
Figure5.
Target genes of some miRNAs
3 討論
miRNA作為蛋白質合成的關鍵調節因子,在細胞分化和疾病狀態中的差異表達可能成為臨床新的診斷指標和治療靶點。近年來許多實驗顯示miRNA在干細胞分化、心肌發育、應激等領域發揮多種生理學功能[6-10]。目前,有超過3%的人類基因編碼miRNA,而40%~90%的人體蛋白是受miRNA調節[11-12]。但對于調節心臟竇房結、工作心肌組織特異性的相關miRNA還不完全清楚。要研究這些miRNA在心臟組織中的功能,首先要篩選特異性的miRNA。各物種間的miRNA具有高度進化保守性,脊椎動物一半的miRNA與人具有同源性[7]。因此,本實驗采用昆明小鼠作為實驗動物,對其竇房結、心房肌、心室肌組織的miRNA表達譜進行檢測。
3.1 竇房結取材方法選擇
準確的竇房結取材是實驗結果可靠的重要前提。竇房結作為起搏發源點,是起搏細胞大量集聚形成的特殊結構。肉眼觀察竇房結與周圍組織無明顯界限,通過多導聯電生理記錄P波發動點來定位竇房結區域的方法較為準確[13]。但本實驗采用的昆明小鼠心臟小,采用多導聯電生理記錄儀定位起搏點操作困難。為此,我們參考大量相關研究中竇房結取材方法[6,7-9,14-17],采用解剖定位方法獲取竇房結組織,通過觀察心臟最早搏動和搏動頻率最高區域,發現以界溝為縱軸線,剪除上腔靜脈與右心房交接處2.0 mm×1.5 mm×1.0 mm組織塊后,心臟立即停止搏動,偶有心室低頻率自發性搏動,心臟停搏是由竇房結的起搏作用缺失所致,提示所取組織塊包含竇房結組織。HE染色示竇房結組織細胞內外結構與既往研究報道的小鼠竇房結組織學觀察結果[6-9, 15-16, 18]一致。為避免取材時混雜少量竇房結周圍心房肌組織影響測定結果,我們擴大了樣本量,共切取180只小鼠心臟組織進行觀察。
3.2 miRNA檢測方法選擇
檢測miRNA首先需提取RNA,采用TRIzol試劑能得到高純度、完整、高質量的總RNA[19]。本實驗也選擇該方法,RNA濃度及純度檢測結果顯示,樣本提取RNA純度較高,且完整無明顯降解,可用于后續芯片實驗。目前,miRNA表達的檢測手段主要有miRNA芯片、Northern blot、實時定量PCR等方法。其中Northern blot分析敏感性和特異性較低,不能區分具有細微差別的miRNA,且操作相對繁瑣,不適用于高通量miRNA檢測[20]。實時定量PCR是在PCR反應體系中加入熒光基團,利用熒光信號積累實時監測整個PCR進程,最后通過標準曲線對未知模板進行定量分析。該方法對樣品需求量較低,對于低豐度表達的miRNA尤為適用,其敏感性和特異性最高,但檢測miRNA的通量不如miRNA芯片,因此適于大樣本的驗證[20-21]。本實驗采用的miRNA芯片技術能同時檢測大量miRNA表達水平,其原理主要是將樣品RNA與芯片上相應miRNA檢測點雜交來進行檢測,具有以下優點:①靈敏度高,能探測普通DNA探針芯片難以檢出的微量miRNA;②特異性高,能分辨單個堿基差別的miRNA。本實驗所有miRNA雜交溫度相同,從而確保所有靶點有相同親和性;實驗采用一步法標記探針,無需純化,最大程度避免了信號失真。此外,本實驗保留了部分差異表達接近2倍的miRNAs進行分析。
3.3 差異miRNA分析
3.3.1 上調miRNA
本實驗結果顯示,與心房肌、心室肌比較,竇房結中12個miRNA表達上調。其中關于miR-187、miR-M1-2、miR-M1-11、miR-1247、miR-1934、miR-3085心臟方面的研究鮮有報道。miR-214在竇房結表達最多,在心房肌表達最少。Fleissner等[22]發現miR-214主要高表達于血管細胞,包括內皮祖細胞、人臍靜脈內皮細胞以及人冠狀動脈內皮細胞。van Mil等[23]檢測發現轉染下調miR-214的人微血管內皮細胞培養基中,血管因子VEGF、bFGF、PDGF、EGF和IGF-1表達增加,提示miR-214能夠調節血管生成。本實驗竇房結中的miR-214高表達可能為取材時混有上腔靜脈血管組織造成。van Mil等[23]對miR-214基因敲除小鼠研究發現,miR-214通過抑制相關蛋白如CaMKⅡδ、CypD和BIM表達減少鈣超載,減少缺血心肌細胞凋亡發生。miR-214生物學功能以及在組織分化中的特性有待更深入研究。
本實驗發現miR-147、miR-1900在竇房結表達最多,在心室肌表達最少。Liu等[24]研究顯示miR-147能抑制巨噬細胞炎性介質釋放,但關于其在心臟細胞分化方面的研究較少。miR-1900是近年來新發現的miRNA,Huppi等[25]認為miR-1900是調控細胞周期信號通道的關鍵調控點。miR-147和miR-1900表達量的差異與心臟電活動形成有關,是否參與心臟電活動相關蛋白調控有待進一步研究。
Redshaw等[26]在TGF-β/Smad2、3信號通路調節小鼠胚胎干細胞的miRNA轉錄中發現,miR-3072靶基因可能存在于Smad2、3蛋白,但其在分化為心臟細胞中的作用還不清楚。對人骨肉瘤轉染APE1的miRNA表達譜和靶基因調控網絡預測研究顯示,miR-324可能參與了腫瘤進展相關蛋白NF-kβ、p53、c-Myb、HIF-1a和AP-1的調控[27]。
3.3.2 下調miRNA
本實驗結果顯示,與心房肌、心室肌比較,竇房結中有27個miRNA表達顯著下調,其中心室肌組織中miR-654表達量最高。雖然有研究顯示miR-654可抑制病毒復制[28],但其調節的相關蛋白研究有限,相關生理功能尤其在心臟領域的作用有待探索。
Sun等[29]在胚胎干細胞研究中發現miR-467簇具有種屬差異,在人類是否具有相同的表達差異及其生理作用還有待證實。Bhattacharyya等[30]研究顯示miR-467能抑制血小板凝血酶敏感蛋白,是高血糖導致血管組織特異性并發癥的關鍵miRNA。
miR-142調控靶基因BMP-4和FGF-10參與調控脂肪組織形成[31-32],但本實驗竇房結中含量相對于心室肌更高,表達反而更少,提示miR-142可能還參與了調節其他生理功能。
Tsai等[33]在小鼠腦組織和p19細胞發現miR-346的靶蛋白,包括受體相互作用蛋白140(receptor-interacting protein 140,RIP140),而RIP140蛋白又是一種轉錄調節蛋白,參與多種激素和代謝相關基因表達。在對缺血預處理肝臟miRNA表達譜分析發現miR-346顯著下調,但其生理學功能還未闡明。
近年研究顯示,miR-19b在炎性反應中調節NF-κB信號通路,促炎性蛋白產生其關鍵調控作用[34],同時發現miR-19b可調控高齡小鼠心臟細胞外基質蛋白結締組織生長因子和凝血酶敏感素蛋白1的表達,調控心臟纖維化。現有研究顯示miR-29c在急、慢性小鼠哮喘模型中顯著低表達,抑制組織蛋白酶k的表達[35],這種蛋白維持肺基質動態平衡具有降解細胞外基質、防止基質過度沉積的作用。
目前關于本實驗發現的其余下調miRNA的研究報道較少,其生理功能需要進一步研究,可能這些miRNA對調控干細胞向竇房結細胞分化過程中的作用更關鍵。本實驗僅應用miRNA基因芯片對竇房結組織進行表達譜檢測,所篩選出的miRNA仍需要進一步實驗加以驗證。
目前,心血管疾病已成為全球范圍內首要死亡原因[1]。隨著人口老齡化,竇房結相關性心律失常疾病發病率也呈增高趨勢[2]。電子心臟起搏器是治療心臟傳導系統疾病的主要方法,但存在諸多不足。近年來,人工生物起搏器的研究成為熱點,有望取代電子起搏器,成為治療心臟傳導系統疾病的有效方法[3]。獲得功能穩定的起搏細胞,是人工生物起搏器研制的第一步,也是最重要環節。誘導胚胎干細胞或成體干細胞分化成為具有竇房結細胞樣的起搏細胞,是目前獲得起搏細胞的主要策略。
細胞分化是一個十分復雜的生理過程,伴隨著化學物質、細胞形態和生理功能的變化。從分子水平看,蛋白質是實現細胞形態和功能的物質基礎,因此細胞分化意味著細胞內特定蛋白水平的差異,基因表達調控是決定細胞分化方向的核心機制。而微小RNA(microRNA,miRNA)在蛋白翻譯過程中起著極其重要的作用。miRNA是一類內源基因編碼的、長度為19~25個核苷酸的非編碼單鏈RNA分子,其中多數miRNA具有高度序列保守性、表達時序性和組織特異性,其廣泛參與生命活動的各個過程[4]。研究顯示,miRNA參與了心臟發育的每個環節,包括胚胎心肌干細胞向竇房結細胞和工作心肌細胞不同方向的分化[5]。但在干細胞分化發育過程中,心室肌、心房肌中無竇房結細胞以及竇房結中無工作心肌細胞的原因尚不清楚,是哪些miRNA起關鍵調控作用亦未明確。因此,本研究對小鼠竇房結、心房肌、心室肌的miRNA譜進行測定、對比,篩選可能對干細胞定向分化起關鍵調控作用的miRNA,為心臟干細胞定向誘導分化提供參考。
1 材料與方法
1.1 實驗動物及主要試劑、儀器
60~90日齡健康昆明小鼠190只,雌雄不限,體重35~45 g,由瀘州醫學院實驗動物中心提供。TRIzol試劑(Invitrogen公司,美國);miRNA提取試劑盒(Qiagen公司,德國);5×TBE液(上海生工生物工程股份有限公司);miRCURYTM Array Power標記試劑盒(Exiqon公司,丹麥)。芯片掃描儀、基因分析軟件(Axon公司,荷蘭);凝膠成像系統(Bio-Rad公司,美國);紫外/可見分光光度計(Nanodrop公司,美國)。
1.2 實驗標本制備
1.2.1 竇房結組織解剖定位
取10只小鼠脫頸處死,作胸部正中切口暴露心臟,于1×12.5倍解剖顯微鏡下,剪開心包,暴露上腔靜脈至肺動脈處。以界溝為縱軸線,于上腔靜脈與右心房交界處明顯搏動部位剪取大小為2.0 mm×1.5 mm×1.0 mm組織塊[6]。組織塊置于10%中性甲醛固定,乙醇逐級脫水,石蠟包埋,2 μm厚切片,HE染色,光鏡下觀察明確所取組織包含竇房結組織。另取左心耳(心房肌)及心尖處(心室肌)組織常規切片,HE染色觀察。
1.2.2 取材
取180只小鼠同1.2.1方法切取竇房結組織,同時分別于左心耳及心尖處剪取大小為2.0 mm×1.5 mm×1.0 mm心肌組織,3個部位組織總重量分別達200 mg以上。取材后迅速置于液氮中速凍30 min后,置于—80℃低溫冰箱保存備用。
1.3 miRNA芯片分析
1.3.1 總RNA提取及質量檢測
取樣品加入TRIzol試劑,組織勻漿,室溫孵育5 min,以完全解離核酸蛋白復合體。于TRIzol試劑勻漿樣品中按5:1(V/V)比例加入氯仿,振蕩15 s,室溫孵育10 min。4℃,以離心半徑13.5 cm,12 000 r/min離心15 min。離心后樣品分為3層,吸取含RNA的水相層,沉淀、清洗、復溶,采用紫外/可見分光光度計以及凝膠電泳分別檢測總RNA濃度和純度。
1.3.2 基因芯片檢測及分析
取1.3.1制備的組織總RNA行芯片雜交及清洗,由上海康成生物工程有限公司完成。使用芯片掃描儀掃描芯片熒光強度,掃描激發波長為635 nm,芯片上每個探針的綠色信號強度經去背景化(排除前景值與背景值之差 < 0的數據)處理。將實驗結果轉換成數字型數據,使用基因分析軟件對數據進行分析運算,用中位數標準化方法對數據進行標準化處理。采用t檢驗計算差異表達的miRNA,再用Fold change篩選出差異表達2倍以上(Fold change值≥2或≤0.5)的miRNA。
1.3.3 基因功能關聯性分析
選取與竇房結相比,心房肌、心室肌差異表達達2倍以上的miRNA。通過搜索Miranda等數據庫得到差異miRNA調控的靶基因。對差異miRNA對應的靶基因進行GO顯著性功能分析,得到具有顯著性、低誤判率、靶向性的GO功能集以及對應的靶基因。對差異miRNA對應的靶基因進行KEGG Pathway顯著性分析,得到具有顯著性、低誤判率、靶向性的KEGG Pathway以及對應的靶基因。將以上步驟得到的靶基因構建差異miRNA與靶基因的調控網絡,得到網絡中起核心調控作用的miRNA和被miRNA調控的關鍵靶基因。
2 結果
2.1 組織學觀察
鏡下觀察示,竇房結組織細胞質淡染,少量細胞聚集,細胞核大而圓,呈中心性分布,與普通心肌相比幾乎無橫紋,周圍較多纖維結締組織包繞,其間可見竇房結動脈(圖 1)。心房肌較薄,肌纖維較細短,較少分支(圖 2)。心室肌較厚,肌纖維較粗長,可見分支,組織中脂肪、血管組織含量少(圖 3)。
 圖1
竇房結HE染色觀察?×40 ?×100箭頭示竇房結動脈??圖 2心房肌HE染色觀察?×100 ?×200 ??圖 3心室肌HE染色觀察?×100 ?×200
Figure1.
HE staining of sinus node ?×40 ?×100 Arrow indicated artery of sinus node ??Fig. 2 HE staining of the atrial myocardium ?×100 ?×200 ??Fig. 3 HE staining of the ventricular myocardium ?×100 ?×200
圖1
竇房結HE染色觀察?×40 ?×100箭頭示竇房結動脈??圖 2心房肌HE染色觀察?×100 ?×200 ??圖 3心室肌HE染色觀察?×100 ?×200
Figure1.
HE staining of sinus node ?×40 ?×100 Arrow indicated artery of sinus node ??Fig. 2 HE staining of the atrial myocardium ?×100 ?×200 ??Fig. 3 HE staining of the ventricular myocardium ?×100 ?×200
2.2 竇房結與心房肌、心室肌miRNA表達差異分析
2.2.1 總RNA濃度及純度檢測
結果顯示,樣本提取的總RNA吸光度(A)值(A260/280)均接近2,其中竇房結1.97、心房肌1.99,心室肌2.04,提示污染較少;A260/230均大于1.8,其中竇房結2.35、心室肌2.41、心房肌2.36,提示總RNA純度較高。凝膠電泳可見3條清晰條帶,分別為28s、18s、5s,其中28s條帶亮度大于18s條帶,提取總RNA完整且無明顯降解(圖 4),可用于后續芯片實驗。
 圖4
總RNA凝膠電泳圖 1:心房肌2:竇房結3:心室肌
Figure4.
Agarose gel electrophoresis of total RNA 1: Atrial myocardium 2: Sinus node 3: Ventricular myocardium
圖4
總RNA凝膠電泳圖 1:心房肌2:竇房結3:心室肌
Figure4.
Agarose gel electrophoresis of total RNA 1: Atrial myocardium 2: Sinus node 3: Ventricular myocardium
2.2.2 miRNA表達差異分析
竇房結與心室肌、心房肌相比,差異表達miRNA共39個,其中上調miRNA 12個,下調miRNA 27個。見表 1、2。
2.2.3 基因功能關聯性分析
通過對差異miRNA對應的靶基因進行GO及KEGG Pathway顯著性分析,得到網絡中起核心調控作用的miRNA和被miRNA調控的關鍵靶基因。見圖 5。
 圖5
部分miRNA的靶基因
Figure5.
Target genes of some miRNAs
圖5
部分miRNA的靶基因
Figure5.
Target genes of some miRNAs
3 討論
miRNA作為蛋白質合成的關鍵調節因子,在細胞分化和疾病狀態中的差異表達可能成為臨床新的診斷指標和治療靶點。近年來許多實驗顯示miRNA在干細胞分化、心肌發育、應激等領域發揮多種生理學功能[6-10]。目前,有超過3%的人類基因編碼miRNA,而40%~90%的人體蛋白是受miRNA調節[11-12]。但對于調節心臟竇房結、工作心肌組織特異性的相關miRNA還不完全清楚。要研究這些miRNA在心臟組織中的功能,首先要篩選特異性的miRNA。各物種間的miRNA具有高度進化保守性,脊椎動物一半的miRNA與人具有同源性[7]。因此,本實驗采用昆明小鼠作為實驗動物,對其竇房結、心房肌、心室肌組織的miRNA表達譜進行檢測。
3.1 竇房結取材方法選擇
準確的竇房結取材是實驗結果可靠的重要前提。竇房結作為起搏發源點,是起搏細胞大量集聚形成的特殊結構。肉眼觀察竇房結與周圍組織無明顯界限,通過多導聯電生理記錄P波發動點來定位竇房結區域的方法較為準確[13]。但本實驗采用的昆明小鼠心臟小,采用多導聯電生理記錄儀定位起搏點操作困難。為此,我們參考大量相關研究中竇房結取材方法[6,7-9,14-17],采用解剖定位方法獲取竇房結組織,通過觀察心臟最早搏動和搏動頻率最高區域,發現以界溝為縱軸線,剪除上腔靜脈與右心房交接處2.0 mm×1.5 mm×1.0 mm組織塊后,心臟立即停止搏動,偶有心室低頻率自發性搏動,心臟停搏是由竇房結的起搏作用缺失所致,提示所取組織塊包含竇房結組織。HE染色示竇房結組織細胞內外結構與既往研究報道的小鼠竇房結組織學觀察結果[6-9, 15-16, 18]一致。為避免取材時混雜少量竇房結周圍心房肌組織影響測定結果,我們擴大了樣本量,共切取180只小鼠心臟組織進行觀察。
3.2 miRNA檢測方法選擇
檢測miRNA首先需提取RNA,采用TRIzol試劑能得到高純度、完整、高質量的總RNA[19]。本實驗也選擇該方法,RNA濃度及純度檢測結果顯示,樣本提取RNA純度較高,且完整無明顯降解,可用于后續芯片實驗。目前,miRNA表達的檢測手段主要有miRNA芯片、Northern blot、實時定量PCR等方法。其中Northern blot分析敏感性和特異性較低,不能區分具有細微差別的miRNA,且操作相對繁瑣,不適用于高通量miRNA檢測[20]。實時定量PCR是在PCR反應體系中加入熒光基團,利用熒光信號積累實時監測整個PCR進程,最后通過標準曲線對未知模板進行定量分析。該方法對樣品需求量較低,對于低豐度表達的miRNA尤為適用,其敏感性和特異性最高,但檢測miRNA的通量不如miRNA芯片,因此適于大樣本的驗證[20-21]。本實驗采用的miRNA芯片技術能同時檢測大量miRNA表達水平,其原理主要是將樣品RNA與芯片上相應miRNA檢測點雜交來進行檢測,具有以下優點:①靈敏度高,能探測普通DNA探針芯片難以檢出的微量miRNA;②特異性高,能分辨單個堿基差別的miRNA。本實驗所有miRNA雜交溫度相同,從而確保所有靶點有相同親和性;實驗采用一步法標記探針,無需純化,最大程度避免了信號失真。此外,本實驗保留了部分差異表達接近2倍的miRNAs進行分析。
3.3 差異miRNA分析
3.3.1 上調miRNA
本實驗結果顯示,與心房肌、心室肌比較,竇房結中12個miRNA表達上調。其中關于miR-187、miR-M1-2、miR-M1-11、miR-1247、miR-1934、miR-3085心臟方面的研究鮮有報道。miR-214在竇房結表達最多,在心房肌表達最少。Fleissner等[22]發現miR-214主要高表達于血管細胞,包括內皮祖細胞、人臍靜脈內皮細胞以及人冠狀動脈內皮細胞。van Mil等[23]檢測發現轉染下調miR-214的人微血管內皮細胞培養基中,血管因子VEGF、bFGF、PDGF、EGF和IGF-1表達增加,提示miR-214能夠調節血管生成。本實驗竇房結中的miR-214高表達可能為取材時混有上腔靜脈血管組織造成。van Mil等[23]對miR-214基因敲除小鼠研究發現,miR-214通過抑制相關蛋白如CaMKⅡδ、CypD和BIM表達減少鈣超載,減少缺血心肌細胞凋亡發生。miR-214生物學功能以及在組織分化中的特性有待更深入研究。
本實驗發現miR-147、miR-1900在竇房結表達最多,在心室肌表達最少。Liu等[24]研究顯示miR-147能抑制巨噬細胞炎性介質釋放,但關于其在心臟細胞分化方面的研究較少。miR-1900是近年來新發現的miRNA,Huppi等[25]認為miR-1900是調控細胞周期信號通道的關鍵調控點。miR-147和miR-1900表達量的差異與心臟電活動形成有關,是否參與心臟電活動相關蛋白調控有待進一步研究。
Redshaw等[26]在TGF-β/Smad2、3信號通路調節小鼠胚胎干細胞的miRNA轉錄中發現,miR-3072靶基因可能存在于Smad2、3蛋白,但其在分化為心臟細胞中的作用還不清楚。對人骨肉瘤轉染APE1的miRNA表達譜和靶基因調控網絡預測研究顯示,miR-324可能參與了腫瘤進展相關蛋白NF-kβ、p53、c-Myb、HIF-1a和AP-1的調控[27]。
3.3.2 下調miRNA
本實驗結果顯示,與心房肌、心室肌比較,竇房結中有27個miRNA表達顯著下調,其中心室肌組織中miR-654表達量最高。雖然有研究顯示miR-654可抑制病毒復制[28],但其調節的相關蛋白研究有限,相關生理功能尤其在心臟領域的作用有待探索。
Sun等[29]在胚胎干細胞研究中發現miR-467簇具有種屬差異,在人類是否具有相同的表達差異及其生理作用還有待證實。Bhattacharyya等[30]研究顯示miR-467能抑制血小板凝血酶敏感蛋白,是高血糖導致血管組織特異性并發癥的關鍵miRNA。
miR-142調控靶基因BMP-4和FGF-10參與調控脂肪組織形成[31-32],但本實驗竇房結中含量相對于心室肌更高,表達反而更少,提示miR-142可能還參與了調節其他生理功能。
Tsai等[33]在小鼠腦組織和p19細胞發現miR-346的靶蛋白,包括受體相互作用蛋白140(receptor-interacting protein 140,RIP140),而RIP140蛋白又是一種轉錄調節蛋白,參與多種激素和代謝相關基因表達。在對缺血預處理肝臟miRNA表達譜分析發現miR-346顯著下調,但其生理學功能還未闡明。
近年研究顯示,miR-19b在炎性反應中調節NF-κB信號通路,促炎性蛋白產生其關鍵調控作用[34],同時發現miR-19b可調控高齡小鼠心臟細胞外基質蛋白結締組織生長因子和凝血酶敏感素蛋白1的表達,調控心臟纖維化。現有研究顯示miR-29c在急、慢性小鼠哮喘模型中顯著低表達,抑制組織蛋白酶k的表達[35],這種蛋白維持肺基質動態平衡具有降解細胞外基質、防止基質過度沉積的作用。
目前關于本實驗發現的其余下調miRNA的研究報道較少,其生理功能需要進一步研究,可能這些miRNA對調控干細胞向竇房結細胞分化過程中的作用更關鍵。本實驗僅應用miRNA基因芯片對竇房結組織進行表達譜檢測,所篩選出的miRNA仍需要進一步實驗加以驗證。