引用本文: 劉重, 徐虹, 張朝, 吳勐, 滕云升, 陶勝林. 分期治療下肢長段感染性骨缺損. 中國修復重建外科雜志, 2014, 28(10): 1212-1216. doi: 10.7507/1002-1892.20140263 復制
版權信息: ?四川大學華西醫院華西期刊社《中國修復重建外科雜志》版權所有,未經授權不得轉載、改編
由高能量創傷所致的下肢開放骨折臨床常見,早期處理不當會導致骨髓炎,骨髓炎遷延不愈、死骨流出或慢性骨髓炎經多次清創后將遺留感染性骨缺損,臨床治療棘手[1]。采用骨搬移技術治療周期長、需特殊復雜裝置,影響日常生活,且長段骨缺損行骨搬移治療后會導致足踝部畸形、皮膚切割等并發癥[2];經清創后一期行帶血管骨移植治療周期短、手術次數少,但術后可能復發感染、局部形成竇道等經久不愈,甚至演變為慢性骨髓炎,導致手術失敗。在關節假體置換術后感染治療中,一期清創、抗生素骨水泥占位,感染控制后二期再行關節翻修術已成為金標準[3]。受其啟發,2010年6月-2012年6月,我科應用一期清創、抗生素骨水泥占位,待感染控制后二期再行游離腓骨移植治療下肢長段感染性骨缺損12例,療效滿意。報告如下。
1 臨床資料
1.1 一般資料
本組男9例,女3例;年齡19~46歲,平均33歲。致傷原因:交通事故傷7例,壓砸傷3例,機器擠壓傷2例。左側7例,右側5例。均為開放性骨折術后,9例采用內固定,3例采用外固定。其中股骨缺損3例,脛骨缺損7例,跖骨缺損2例;骨缺損長度6~14 cm,平均8 cm。9例脛骨及跖骨缺損合并皮膚軟組織缺損,創面范圍為5.0 cm×3.0 cm~8.0 cm×4.0?cm;3例股骨缺損合并竇道形成。創面、竇道及骨折端經多次細菌培養證實存在感染,其中金黃色葡萄球菌6例,表皮葡萄球菌3例,大腸桿菌3例。2例術前存在跟腱攣縮,踝關節跖屈畸形。受傷至手術時間1~4個月,平均2個月。
1.2 手術方法
1.2.1 一期手術
術前常規行X線片及CT檢查,了解骨髓炎死骨及膿腔部位。患者于持續硬膜外麻醉下取仰臥位,有竇道者經竇道注入亞甲藍了解竇道范圍;合并皮膚軟組織缺損者經創面進入,于氣囊止血帶下由淺及深清創,切除創面邊緣炎性皮膚及貼骨瘢痕,摘除大塊死骨,切除死腔,必要時對感染骨進行整段切除。拆除外固定支架Schanz釘,行髓腔徹底清創,如有內固定則去除內固定鋼板和螺釘。松止血帶后見骨面點狀滲血,測量骨缺損長度及創面范圍,沖洗傷口,電凝徹底止血。
根據骨缺損長度將復合有去甲萬古霉素的骨水泥(抗生素濃度10%)在體外塑形成缺損骨形狀,待骨水泥于棉團期植入體內。將骨水泥塊包埋遠近端髓腔,脛骨應用時應盡量靠近腓骨,待骨水泥固化后去除骨水泥碎屑,于骨缺損遠近端分別植入2枚粗細合適的Schanz釘;如骨缺損靠近脛骨遠端,則分別于距骨和跟骨植釘,連接外固定支架,透視確保肢體長度恢復,力線良好。
本組9例脛骨及跖骨缺損合并皮膚軟組織缺損者均采用穿支皮瓣修復創面,皮瓣選擇根據小腿創面部位和傷肢血管穿支狀況而定。其中4例采用腓動脈穿支皮瓣,術前采用超聲多普勒血流探測儀沿腓骨后緣探查穿支點,以穿支點為旋轉點切取皮瓣,切取皮瓣時保留腓動脈穿支穿出深筋膜時的部分筋膜盤以增加皮瓣血供。3例采用脛后動脈穿支皮瓣,脛后動脈穿支走行較短,切取時應向深部游離穿支,以增加其旋轉靈活度。2例采用腓腸神經營養皮瓣,切取皮瓣時攜帶明確的腓動脈穿支,于進入皮瓣處結扎小隱靜脈,防止其倒灌增加皮瓣淤血幾率。皮瓣修復術后通暢引流,防止皮瓣下積血。術后抗凝、抗痙攣7 d,全身敏感抗生素應用約10 d。術后拆線后行主動功能鍛煉,預防廢用性肌萎縮、關節僵硬,加強外固定支架護理,防止針道感染。
1.2.2 二期手術
一期術后6周行二期手術,此時9?例創面均愈合,皮瓣周緣無膿性分泌物,患者復查紅細胞沉降率、C反應蛋白等均在正常范圍內,外固定針道無感染。入院后先拆除外固定支架,改為石膏托固定肢體,以使外固定架針道愈合(需3~7 d);期間行雙下肢動脈血管造影術,了解傷肢血管情況并了解對側肢體腓動脈類型,以便切取游離腓骨。術中先于皮瓣邊緣切開骨缺損處,取出骨水泥占位器,盡量保留骨水泥占位器外面的一層膜結構,測量骨缺損大小,注意徹底清除創面內的骨水泥碎屑。根據骨缺損部位插入鎖定鋼板固定骨缺損上、下端,透視確保肢體長度及力線恢復。
根據術前造影情況解剖受區血管,本組股骨缺損均以旋股外側動脈降支為供血動脈,脛骨骨缺損以脛前動脈為供血動脈5例、以脛后動脈為供血動脈2例,跖骨缺損均以足背動脈為供血動脈。解剖血管后先用血管夾夾閉血管并放松止血帶,觀察足部血運情況;足部血運良好后橡皮條標記血管備用,徹底止血,大量生理鹽水、雙氧水沖洗創面,生理鹽水紗布填塞創面并加壓包扎。
依據骨缺損大小切取游離腓骨,盡量向遠近端游離腓血管蒂以增加血管蒂長度,解剖時注意防止損傷腓靜脈壁,近端游離防止誤傷腓總神經分支。本組移植腓骨長度7~22 cm,平均14?cm。10例游離腓骨移植時均攜帶一腓動脈穿支皮瓣,皮瓣大小6.0 cm×4.0?cm~10.0 cm×5.0 cm,皮瓣有利于移植腓骨軟組織覆蓋,也可用來監測移植腓骨血運。本組2例股骨缺損、6例脛骨缺損采用雙折腓骨移植。雙折腓骨時于折斷處將血管蒂向兩側剝離,可防止血管蒂隨雙折腓骨呈銳角折疊。兩段腓骨用皮質骨螺釘固定,將腓骨瓣移植于骨缺損處。先將皮瓣與受區皮膚簡單縫合防止皮瓣移動時牽拉血管蒂,顯微鏡下縫合血管,重建組織瓣血運,在小腿因供血動脈為脛前或脛后動脈,術中用腓動脈串聯脛前及脛后動脈。腓骨瓣供區徹底止血后直接縫合。
1.3 術后處理
深部放置引流24~48 h,抗炎、抗凝、抗痙攣7 d;密切觀察皮瓣血運,包扎時充分暴露皮瓣周緣,注意觀察最初24 h內皮瓣周緣有無毛孔變大、青紫、瘀斑等。術后縫線拆除后供側肢體即刻在支具保護下負重,患側肢體6周后在支具保護下部分負重。臥床期間注意防止跟腱攣縮,雙側踝關節應加強主動背伸鍛煉,夜間用支具將踝關節固定于功能位。術后10 d,1、3、6、12個月復查X線片,了解移植腓骨與受區骨愈合情況。
2 結果
術后創面均Ⅰ期愈合,愈合時間12~18 d,平均14?d;無靜脈及動脈危象等并發癥發生。供區切口均Ⅰ期愈合。術后無竇道形成及創面流膿等感染復發跡象。12例均獲隨訪,隨訪時間12~36個月,平均17個月。骨愈合時間為4~6個月,平均5.5個月。移植腓骨攜帶皮瓣外形良好,均未行二期皮瓣整形。2例術前存在跟腱攣縮者,術后經功能康復鍛煉后遺留踝關節背伸受限、下蹲困難,行Ilizarov環式外固定支架牽伸術,術后踝關節恢復至中立位。本組術后供區功能滿意,無踝關節功能障礙及脛骨應力骨折發生。6例移植腓骨有明顯增粗;4例雙折腓骨移植末次隨訪時均有腓骨間融合表現;另2例移植腓骨雖已與股骨骨性融合,但無增粗表現。末次隨訪時采用Enneking下肢功能評分為20~28分,平均25分。見圖 1。
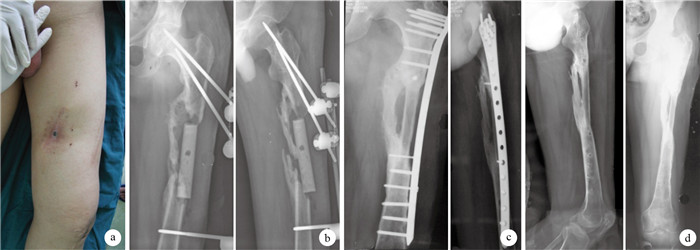
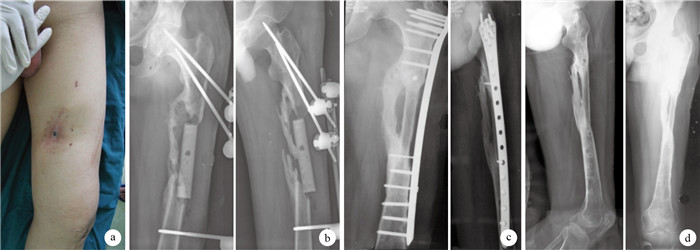 圖1
患者,男,26歲,交通事故傷致左股骨干開放性骨折,急診清創鋼板固定骨折后致骨髓炎,清創后形成骨缺損???術前外觀???一期清創術后正側位X線片示植入的抗生素骨水泥占位器???二期游離腓骨移植術后6個月正側位X線片示移植骨愈合良好,內固定物無松動、斷裂???二期術后14個月正側位X線片示移植腓骨與股骨已骨性愈合,并拆除內固定
Figure1.
A 26-year-old male patient with open femoral shaft fracture at left side caused by traffic accident, osteomyelities happend after emergency debridement and plate fixation, and bone defect occurred after debridement???Appearance at preoperation???Anteroposterior and lateral X-ray films after first stage operation, showing implanted antibiotic-loaded cement spacer???Anteroposterior and lateral X-ray films at 6 months after second stage operation, showing good bone healing without loosening or breakage of internal fixation???Anteroposterior and lateral X-ray films at 14 months after second operation, showing bone healing and removal of internal fixation
圖1
患者,男,26歲,交通事故傷致左股骨干開放性骨折,急診清創鋼板固定骨折后致骨髓炎,清創后形成骨缺損???術前外觀???一期清創術后正側位X線片示植入的抗生素骨水泥占位器???二期游離腓骨移植術后6個月正側位X線片示移植骨愈合良好,內固定物無松動、斷裂???二期術后14個月正側位X線片示移植腓骨與股骨已骨性愈合,并拆除內固定
Figure1.
A 26-year-old male patient with open femoral shaft fracture at left side caused by traffic accident, osteomyelities happend after emergency debridement and plate fixation, and bone defect occurred after debridement???Appearance at preoperation???Anteroposterior and lateral X-ray films after first stage operation, showing implanted antibiotic-loaded cement spacer???Anteroposterior and lateral X-ray films at 6 months after second stage operation, showing good bone healing without loosening or breakage of internal fixation???Anteroposterior and lateral X-ray films at 14 months after second operation, showing bone healing and removal of internal fixation
3 討論
3.1 本術式的適應證及優勢
長段感染性骨缺損行一期治療還是分期治療是創傷顯微外科關注焦點[4]。一期治療是指在對周圍感染組織、死骨、感染骨徹底清創后,一期應用游離骨移植或游離骨移植聯合皮瓣移植修復骨缺損和軟組織缺損;分期治療是指先徹底清創控制感染,利用肌瓣等填塞死腔,修復軟組織缺損,待感染控制3~6個月后再行骨缺損治療。一期治療周期短、手術次數少,可使復雜顯微外科重建過程一期完成,滕云升等[5]報道利用游離腓骨瓣聯合股前外側皮瓣一期修復小腿復合組織缺損,療效滿意。然而感染骨的范圍有時難以判斷,臨床上主要依靠術者個人經驗,因感染骨、死骨殘留可造成游離骨移植術后感染復發、創面不愈、竇道形成等,因此分期重建雖治療周期長,但感染治愈率高,手術成功率高,越來越受到研究者重視[6]。尤其適合于病程較長、感染嚴重、創面滲出較多、周圍瘢痕組織明顯的患者,因感染時間長,波及范圍廣,清創后殘留的無血運骨片或死骨及炎性瘢痕組織往往成為細菌的“保護傘”[7],這是一期行游離骨瓣移植治療長段感染性骨缺損術后感染復發的最重要原因。
本術式一期先治療感染,待感染治愈后再行游離腓骨移植有效防止了感染復發,提高了骨缺損治愈率。一期術后骨缺損周圍軟組織條件好,血管條件好,提高了二期游離腓骨移植的成功率[8]。二期手術固定腓骨時轉換為內固定,固定可靠,力學優勢明顯,避免了使用外固定支架所致的針道感染,有利于移植腓骨骨性愈合[9]。相比傳統的采用肌瓣移植填塞死腔治療感染的分期治療方法,骨水泥占位器既填塞了死腔,又無需切取肌瓣,減少了供區損傷。抗生素骨水泥占位器局部緩釋敏感抗生素,感染治愈率高。
3.2 自制抗生素骨水泥占位器的作用原理
Buchholz等[10]最早利用骨水泥作為抗生素的釋放載體翻修感染的人工髖關節,取得了77%的成功率。關節外科中,假體取出、抗生素骨水泥占位器植入、待感染控制后二期翻修是治療關節置換術后慢性感染的“金標準”。劉相成等[11]使用自制關節型抗生素骨水泥占位器治療人工髖關節置換術后感染,感染控制率為96.3%,患者滿意率為93.5%。骨髓炎周圍往往有硬化骨及炎性瘢痕組織,常規抗炎藥物難以到達患處;受人工關節外科啟發,我們也采用自制抗生素骨水泥占位器治療下肢長段感染性骨缺損。骨水泥中抗生素的釋放通過濃度梯度的彌散作用完成,可提高骨髓炎部位抗生素濃度,增加感染治愈率。
文獻報道大多數骨髓炎病灶感染菌株為葡萄球菌和大腸桿菌[12],本組與此一致。萬古霉素具有抗菌譜廣、耐熱、水溶性和穩定性好等優點,應用復合萬古霉素的骨水泥后,第1天引流液中萬古霉素濃度為其最小抑菌濃度的20~40倍,并且其有效濃度可釋放4?個月左右,植入受區后不會使萬古霉素的抗菌特性發生改變[13]。應用抗生素骨水泥后,在抗生素骨水泥周圍會形成一層生物膜,具有成骨作用,一定程度上有利于后期移植腓骨和受區的愈合[14]。占位器的使用為二期腓骨移植創造了空間。
3.3 腓骨移植的優勢
當骨缺損>6 cm時,由于骨吸收不可避免,即使有血供良好的軟組織覆蓋,自體松質骨移植填充骨缺損也不能獲得完全修復[15]。因為無血運的松質骨是細菌的良好宿主,可能導致治療失敗,因此對于感染性長段骨缺損更應避免常規骨移植。帶血管腓骨移植具有骨愈合快、機械強度高、能重塑骨皮質的優點[16],相比骨搬運治療,其治療周期短、并發癥少,減少了長期使用外固定的不便;且腓骨移植術后對供區影響較小。
3.4 手術注意事項
①清創是控制骨髓炎感染的重要手段,有時清創需多次進行,將炎性瘢痕及壞死骨徹底清除,直至清創后骨面點狀出血。②抗生素骨水泥占位器于體外塑形后再放于骨缺損處,便于二次手術取出,否則二期手術時骨水泥取出困難,殘留骨水泥會影響移植腓骨與受區的愈合[17]。③當合并有軟組織缺損時,一期手術行軟組織覆蓋時就近選擇皮瓣,以移位皮瓣為主,盡量保留血管供二期腓骨移植使用;如果軟組織缺損面積大需行游離皮瓣修復時,最好和腓骨移植同時進行,不適用此方法。④二期手術盡量保持骨水泥占位器周圍生物膜的完整性,其成骨作用有利于骨折愈合。⑤一期手術和二期手術時間間隔以6~8周為宜,以局部無炎性反應,復查血常規、紅細胞沉降率及C反應蛋白正常后手術;過早手術不利于炎癥控制,延遲手術可能繼發肌肉攣縮、關節僵硬,影響治療效果。⑥二期手術腓骨移植時盡量攜帶皮瓣,本組除1例未見可靠皮穿支、1例手術切取過程中損傷外,余均攜帶穿支皮瓣;皮瓣既可作為觀察窗觀察移植腓骨血運,又可在轉為鋼板內固定時增加受區軟組織覆蓋[18]。
由高能量創傷所致的下肢開放骨折臨床常見,早期處理不當會導致骨髓炎,骨髓炎遷延不愈、死骨流出或慢性骨髓炎經多次清創后將遺留感染性骨缺損,臨床治療棘手[1]。采用骨搬移技術治療周期長、需特殊復雜裝置,影響日常生活,且長段骨缺損行骨搬移治療后會導致足踝部畸形、皮膚切割等并發癥[2];經清創后一期行帶血管骨移植治療周期短、手術次數少,但術后可能復發感染、局部形成竇道等經久不愈,甚至演變為慢性骨髓炎,導致手術失敗。在關節假體置換術后感染治療中,一期清創、抗生素骨水泥占位,感染控制后二期再行關節翻修術已成為金標準[3]。受其啟發,2010年6月-2012年6月,我科應用一期清創、抗生素骨水泥占位,待感染控制后二期再行游離腓骨移植治療下肢長段感染性骨缺損12例,療效滿意。報告如下。
1 臨床資料
1.1 一般資料
本組男9例,女3例;年齡19~46歲,平均33歲。致傷原因:交通事故傷7例,壓砸傷3例,機器擠壓傷2例。左側7例,右側5例。均為開放性骨折術后,9例采用內固定,3例采用外固定。其中股骨缺損3例,脛骨缺損7例,跖骨缺損2例;骨缺損長度6~14 cm,平均8 cm。9例脛骨及跖骨缺損合并皮膚軟組織缺損,創面范圍為5.0 cm×3.0 cm~8.0 cm×4.0?cm;3例股骨缺損合并竇道形成。創面、竇道及骨折端經多次細菌培養證實存在感染,其中金黃色葡萄球菌6例,表皮葡萄球菌3例,大腸桿菌3例。2例術前存在跟腱攣縮,踝關節跖屈畸形。受傷至手術時間1~4個月,平均2個月。
1.2 手術方法
1.2.1 一期手術
術前常規行X線片及CT檢查,了解骨髓炎死骨及膿腔部位。患者于持續硬膜外麻醉下取仰臥位,有竇道者經竇道注入亞甲藍了解竇道范圍;合并皮膚軟組織缺損者經創面進入,于氣囊止血帶下由淺及深清創,切除創面邊緣炎性皮膚及貼骨瘢痕,摘除大塊死骨,切除死腔,必要時對感染骨進行整段切除。拆除外固定支架Schanz釘,行髓腔徹底清創,如有內固定則去除內固定鋼板和螺釘。松止血帶后見骨面點狀滲血,測量骨缺損長度及創面范圍,沖洗傷口,電凝徹底止血。
根據骨缺損長度將復合有去甲萬古霉素的骨水泥(抗生素濃度10%)在體外塑形成缺損骨形狀,待骨水泥于棉團期植入體內。將骨水泥塊包埋遠近端髓腔,脛骨應用時應盡量靠近腓骨,待骨水泥固化后去除骨水泥碎屑,于骨缺損遠近端分別植入2枚粗細合適的Schanz釘;如骨缺損靠近脛骨遠端,則分別于距骨和跟骨植釘,連接外固定支架,透視確保肢體長度恢復,力線良好。
本組9例脛骨及跖骨缺損合并皮膚軟組織缺損者均采用穿支皮瓣修復創面,皮瓣選擇根據小腿創面部位和傷肢血管穿支狀況而定。其中4例采用腓動脈穿支皮瓣,術前采用超聲多普勒血流探測儀沿腓骨后緣探查穿支點,以穿支點為旋轉點切取皮瓣,切取皮瓣時保留腓動脈穿支穿出深筋膜時的部分筋膜盤以增加皮瓣血供。3例采用脛后動脈穿支皮瓣,脛后動脈穿支走行較短,切取時應向深部游離穿支,以增加其旋轉靈活度。2例采用腓腸神經營養皮瓣,切取皮瓣時攜帶明確的腓動脈穿支,于進入皮瓣處結扎小隱靜脈,防止其倒灌增加皮瓣淤血幾率。皮瓣修復術后通暢引流,防止皮瓣下積血。術后抗凝、抗痙攣7 d,全身敏感抗生素應用約10 d。術后拆線后行主動功能鍛煉,預防廢用性肌萎縮、關節僵硬,加強外固定支架護理,防止針道感染。
1.2.2 二期手術
一期術后6周行二期手術,此時9?例創面均愈合,皮瓣周緣無膿性分泌物,患者復查紅細胞沉降率、C反應蛋白等均在正常范圍內,外固定針道無感染。入院后先拆除外固定支架,改為石膏托固定肢體,以使外固定架針道愈合(需3~7 d);期間行雙下肢動脈血管造影術,了解傷肢血管情況并了解對側肢體腓動脈類型,以便切取游離腓骨。術中先于皮瓣邊緣切開骨缺損處,取出骨水泥占位器,盡量保留骨水泥占位器外面的一層膜結構,測量骨缺損大小,注意徹底清除創面內的骨水泥碎屑。根據骨缺損部位插入鎖定鋼板固定骨缺損上、下端,透視確保肢體長度及力線恢復。
根據術前造影情況解剖受區血管,本組股骨缺損均以旋股外側動脈降支為供血動脈,脛骨骨缺損以脛前動脈為供血動脈5例、以脛后動脈為供血動脈2例,跖骨缺損均以足背動脈為供血動脈。解剖血管后先用血管夾夾閉血管并放松止血帶,觀察足部血運情況;足部血運良好后橡皮條標記血管備用,徹底止血,大量生理鹽水、雙氧水沖洗創面,生理鹽水紗布填塞創面并加壓包扎。
依據骨缺損大小切取游離腓骨,盡量向遠近端游離腓血管蒂以增加血管蒂長度,解剖時注意防止損傷腓靜脈壁,近端游離防止誤傷腓總神經分支。本組移植腓骨長度7~22 cm,平均14?cm。10例游離腓骨移植時均攜帶一腓動脈穿支皮瓣,皮瓣大小6.0 cm×4.0?cm~10.0 cm×5.0 cm,皮瓣有利于移植腓骨軟組織覆蓋,也可用來監測移植腓骨血運。本組2例股骨缺損、6例脛骨缺損采用雙折腓骨移植。雙折腓骨時于折斷處將血管蒂向兩側剝離,可防止血管蒂隨雙折腓骨呈銳角折疊。兩段腓骨用皮質骨螺釘固定,將腓骨瓣移植于骨缺損處。先將皮瓣與受區皮膚簡單縫合防止皮瓣移動時牽拉血管蒂,顯微鏡下縫合血管,重建組織瓣血運,在小腿因供血動脈為脛前或脛后動脈,術中用腓動脈串聯脛前及脛后動脈。腓骨瓣供區徹底止血后直接縫合。
1.3 術后處理
深部放置引流24~48 h,抗炎、抗凝、抗痙攣7 d;密切觀察皮瓣血運,包扎時充分暴露皮瓣周緣,注意觀察最初24 h內皮瓣周緣有無毛孔變大、青紫、瘀斑等。術后縫線拆除后供側肢體即刻在支具保護下負重,患側肢體6周后在支具保護下部分負重。臥床期間注意防止跟腱攣縮,雙側踝關節應加強主動背伸鍛煉,夜間用支具將踝關節固定于功能位。術后10 d,1、3、6、12個月復查X線片,了解移植腓骨與受區骨愈合情況。
2 結果
術后創面均Ⅰ期愈合,愈合時間12~18 d,平均14?d;無靜脈及動脈危象等并發癥發生。供區切口均Ⅰ期愈合。術后無竇道形成及創面流膿等感染復發跡象。12例均獲隨訪,隨訪時間12~36個月,平均17個月。骨愈合時間為4~6個月,平均5.5個月。移植腓骨攜帶皮瓣外形良好,均未行二期皮瓣整形。2例術前存在跟腱攣縮者,術后經功能康復鍛煉后遺留踝關節背伸受限、下蹲困難,行Ilizarov環式外固定支架牽伸術,術后踝關節恢復至中立位。本組術后供區功能滿意,無踝關節功能障礙及脛骨應力骨折發生。6例移植腓骨有明顯增粗;4例雙折腓骨移植末次隨訪時均有腓骨間融合表現;另2例移植腓骨雖已與股骨骨性融合,但無增粗表現。末次隨訪時采用Enneking下肢功能評分為20~28分,平均25分。見圖 1。
 圖1
患者,男,26歲,交通事故傷致左股骨干開放性骨折,急診清創鋼板固定骨折后致骨髓炎,清創后形成骨缺損???術前外觀???一期清創術后正側位X線片示植入的抗生素骨水泥占位器???二期游離腓骨移植術后6個月正側位X線片示移植骨愈合良好,內固定物無松動、斷裂???二期術后14個月正側位X線片示移植腓骨與股骨已骨性愈合,并拆除內固定
Figure1.
A 26-year-old male patient with open femoral shaft fracture at left side caused by traffic accident, osteomyelities happend after emergency debridement and plate fixation, and bone defect occurred after debridement???Appearance at preoperation???Anteroposterior and lateral X-ray films after first stage operation, showing implanted antibiotic-loaded cement spacer???Anteroposterior and lateral X-ray films at 6 months after second stage operation, showing good bone healing without loosening or breakage of internal fixation???Anteroposterior and lateral X-ray films at 14 months after second operation, showing bone healing and removal of internal fixation
圖1
患者,男,26歲,交通事故傷致左股骨干開放性骨折,急診清創鋼板固定骨折后致骨髓炎,清創后形成骨缺損???術前外觀???一期清創術后正側位X線片示植入的抗生素骨水泥占位器???二期游離腓骨移植術后6個月正側位X線片示移植骨愈合良好,內固定物無松動、斷裂???二期術后14個月正側位X線片示移植腓骨與股骨已骨性愈合,并拆除內固定
Figure1.
A 26-year-old male patient with open femoral shaft fracture at left side caused by traffic accident, osteomyelities happend after emergency debridement and plate fixation, and bone defect occurred after debridement???Appearance at preoperation???Anteroposterior and lateral X-ray films after first stage operation, showing implanted antibiotic-loaded cement spacer???Anteroposterior and lateral X-ray films at 6 months after second stage operation, showing good bone healing without loosening or breakage of internal fixation???Anteroposterior and lateral X-ray films at 14 months after second operation, showing bone healing and removal of internal fixation
3 討論
3.1 本術式的適應證及優勢
長段感染性骨缺損行一期治療還是分期治療是創傷顯微外科關注焦點[4]。一期治療是指在對周圍感染組織、死骨、感染骨徹底清創后,一期應用游離骨移植或游離骨移植聯合皮瓣移植修復骨缺損和軟組織缺損;分期治療是指先徹底清創控制感染,利用肌瓣等填塞死腔,修復軟組織缺損,待感染控制3~6個月后再行骨缺損治療。一期治療周期短、手術次數少,可使復雜顯微外科重建過程一期完成,滕云升等[5]報道利用游離腓骨瓣聯合股前外側皮瓣一期修復小腿復合組織缺損,療效滿意。然而感染骨的范圍有時難以判斷,臨床上主要依靠術者個人經驗,因感染骨、死骨殘留可造成游離骨移植術后感染復發、創面不愈、竇道形成等,因此分期重建雖治療周期長,但感染治愈率高,手術成功率高,越來越受到研究者重視[6]。尤其適合于病程較長、感染嚴重、創面滲出較多、周圍瘢痕組織明顯的患者,因感染時間長,波及范圍廣,清創后殘留的無血運骨片或死骨及炎性瘢痕組織往往成為細菌的“保護傘”[7],這是一期行游離骨瓣移植治療長段感染性骨缺損術后感染復發的最重要原因。
本術式一期先治療感染,待感染治愈后再行游離腓骨移植有效防止了感染復發,提高了骨缺損治愈率。一期術后骨缺損周圍軟組織條件好,血管條件好,提高了二期游離腓骨移植的成功率[8]。二期手術固定腓骨時轉換為內固定,固定可靠,力學優勢明顯,避免了使用外固定支架所致的針道感染,有利于移植腓骨骨性愈合[9]。相比傳統的采用肌瓣移植填塞死腔治療感染的分期治療方法,骨水泥占位器既填塞了死腔,又無需切取肌瓣,減少了供區損傷。抗生素骨水泥占位器局部緩釋敏感抗生素,感染治愈率高。
3.2 自制抗生素骨水泥占位器的作用原理
Buchholz等[10]最早利用骨水泥作為抗生素的釋放載體翻修感染的人工髖關節,取得了77%的成功率。關節外科中,假體取出、抗生素骨水泥占位器植入、待感染控制后二期翻修是治療關節置換術后慢性感染的“金標準”。劉相成等[11]使用自制關節型抗生素骨水泥占位器治療人工髖關節置換術后感染,感染控制率為96.3%,患者滿意率為93.5%。骨髓炎周圍往往有硬化骨及炎性瘢痕組織,常規抗炎藥物難以到達患處;受人工關節外科啟發,我們也采用自制抗生素骨水泥占位器治療下肢長段感染性骨缺損。骨水泥中抗生素的釋放通過濃度梯度的彌散作用完成,可提高骨髓炎部位抗生素濃度,增加感染治愈率。
文獻報道大多數骨髓炎病灶感染菌株為葡萄球菌和大腸桿菌[12],本組與此一致。萬古霉素具有抗菌譜廣、耐熱、水溶性和穩定性好等優點,應用復合萬古霉素的骨水泥后,第1天引流液中萬古霉素濃度為其最小抑菌濃度的20~40倍,并且其有效濃度可釋放4?個月左右,植入受區后不會使萬古霉素的抗菌特性發生改變[13]。應用抗生素骨水泥后,在抗生素骨水泥周圍會形成一層生物膜,具有成骨作用,一定程度上有利于后期移植腓骨和受區的愈合[14]。占位器的使用為二期腓骨移植創造了空間。
3.3 腓骨移植的優勢
當骨缺損>6 cm時,由于骨吸收不可避免,即使有血供良好的軟組織覆蓋,自體松質骨移植填充骨缺損也不能獲得完全修復[15]。因為無血運的松質骨是細菌的良好宿主,可能導致治療失敗,因此對于感染性長段骨缺損更應避免常規骨移植。帶血管腓骨移植具有骨愈合快、機械強度高、能重塑骨皮質的優點[16],相比骨搬運治療,其治療周期短、并發癥少,減少了長期使用外固定的不便;且腓骨移植術后對供區影響較小。
3.4 手術注意事項
①清創是控制骨髓炎感染的重要手段,有時清創需多次進行,將炎性瘢痕及壞死骨徹底清除,直至清創后骨面點狀出血。②抗生素骨水泥占位器于體外塑形后再放于骨缺損處,便于二次手術取出,否則二期手術時骨水泥取出困難,殘留骨水泥會影響移植腓骨與受區的愈合[17]。③當合并有軟組織缺損時,一期手術行軟組織覆蓋時就近選擇皮瓣,以移位皮瓣為主,盡量保留血管供二期腓骨移植使用;如果軟組織缺損面積大需行游離皮瓣修復時,最好和腓骨移植同時進行,不適用此方法。④二期手術盡量保持骨水泥占位器周圍生物膜的完整性,其成骨作用有利于骨折愈合。⑤一期手術和二期手術時間間隔以6~8周為宜,以局部無炎性反應,復查血常規、紅細胞沉降率及C反應蛋白正常后手術;過早手術不利于炎癥控制,延遲手術可能繼發肌肉攣縮、關節僵硬,影響治療效果。⑥二期手術腓骨移植時盡量攜帶皮瓣,本組除1例未見可靠皮穿支、1例手術切取過程中損傷外,余均攜帶穿支皮瓣;皮瓣既可作為觀察窗觀察移植腓骨血運,又可在轉為鋼板內固定時增加受區軟組織覆蓋[18]。