引用本文: 丁舒晨, 田臻, 馬超然, 方學偉, 虞榮斌, 邱裕生, 王麗莎, 尹戰海. 微創建立大鼠慢性肩袖損傷模型. 中國修復重建外科雜志, 2014, 28(10): 1225-1230. doi: 10.7507/1002-1892.20140266 復制
版權信息: ?四川大學華西醫院華西期刊社《中國修復重建外科雜志》版權所有,未經授權不得轉載、改編
肩袖損傷在老年人和運動員中發病率較高,是導致肩關節疼痛和運動障礙的主要原因之一[1]。有關肩袖損傷的原因及治療策略尚存在爭議,成為近年研究熱點[2-6]。臨床發現大部分肩袖損傷發生于無外傷史的老年人群,且多為岡上肌腱關節面部分斷裂[7-9]。目前,相關研究中采用的動物模型均不能很好模擬這種慢性肩袖損傷[10-15]。為此,本研究通過自制肩峰撞擊征大鼠模型植入物(專利號:201420041502.4),設計一種微創建立大鼠慢性肩袖損傷模型方法,并探討該方法可行性,為慢性肩袖損傷以及肩峰撞擊征的研究提供動物模型。
1 材料與方法
1.1 實驗動物及主要材料、儀器
清潔級成年雄性SD大鼠48只,體重(277.25?±22.03)g,由西安交通大學醫學部動物實驗中心提供。實驗大鼠的使用獲西安交通大學醫學部動物實驗管理委員會批準。硫酸卡那霉素注射液(0.5?g/支;南京金陵藥業股份有限公司)。Leica 1600型硬組織鋸式旋轉切片機(Leica公司,德國);Pro/E5.0軟件(PTC公司,美國);Geomagic Studio 11.0軟件(Geomagic公司,美國);Magics 9.55軟件(Materialise公司,比利時);EOSINT P800型3-D打印機(EOS公司,德國)。
1.2 肩峰撞擊征大鼠模型植入物的設計和制造
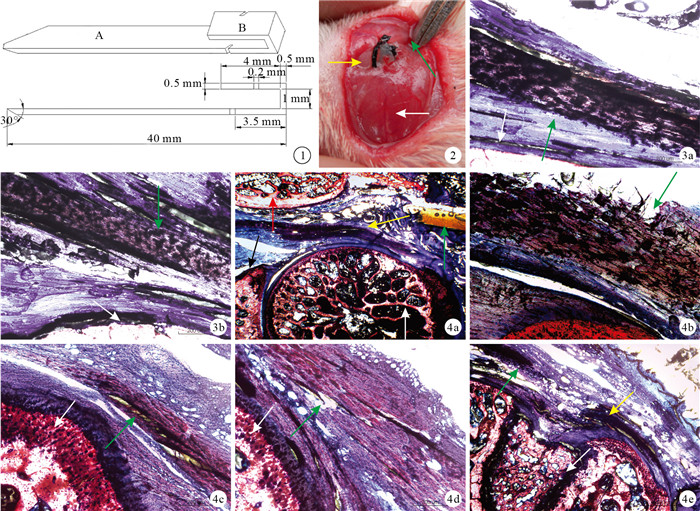
肩峰撞擊征大鼠模型植入物包括植入部和穿刺部,植入部包含平行設計的上作用片和下作用片;穿刺部為植入部下作用片的延伸結構,完成穿刺后剪去。植入物寬2 mm,上作用片長4 mm,等長的下作用片和穿刺部總長40 mm,其厚度均為0.5 mm。上、下作用片間的夾持部分高度為1 mm,用于夾持肩峰。下作用片用于模擬肩峰下骨贅或鉤狀肩峰,上作用片起固定作用。植入部的1對0.2 mm寬的斜向凹槽用于捆扎絲線,避免植入物沿自身長軸方向移位,上作用片凹槽與下作用片凹槽的開口處距離植入部邊緣分別為2 mm和3.5 mm。見圖 1。
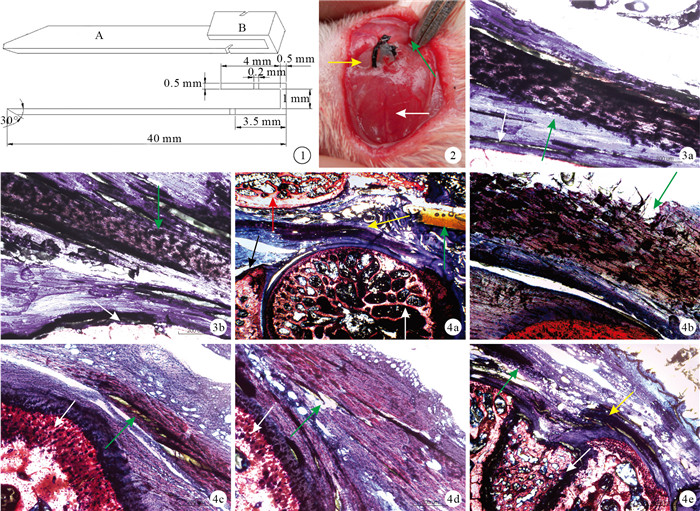 圖1
植入物設計圖A:穿刺部B:植入部圖 2實驗組植入物植入大鼠肩關節后黃箭頭示植入物,白箭頭示肩胛岡,綠箭頭示三角肌后緣??圖 3??術后8周正常對照組及假手術組Van Gieson染色觀察(×100)???綠箭頭示岡下肌腱,白箭頭示肱骨頭???正常對照組假手術組圖 4術后各時間點實驗組Van Gieson染色觀察???植入物定位(×20)紅箭頭示肩胛岡,黃箭頭示岡下肌腱,綠箭頭示植入物,黑箭頭示肩胛盂,白箭頭示肱骨頭???術后2周(×100)綠箭頭示岡下肌腱滑囊側磨損???術后4周(×100)綠箭頭示肌腱內部出現分層空隙,白箭頭示肱骨頭???術后6周(×100)綠箭頭示岡下肌腱關節面部分撕裂,白箭頭示肱骨頭術后8周(×40)???綠箭頭示岡下肌腱近側斷端,黃箭頭示岡下肌腱遠側斷端,白箭頭示肱骨頭
Figure1.
Design of implant A: Penetrating site B: Implanting site Fig.2 The picture after implant was pierced into shoulder joint in the experimental group Yellow arrow indicated implant, white arrow indicated scapular spine, green arrow indicated posterior edge of deltoid Fig.3 Van Gieson staining observation of control group and sham-operation group at 8 weeks after operation (×100) Green arrow indicated infraspinatus tendon, white arrow indicated humeral head ???Control group???Sham-operation group Fig.4 Van Gieson staining observation of experimental group at different time points???Implant was positioned accurately (×20) Red arrow indicated scapular spine, yellow arrow indicated infraspinatus tendon, green arrow indicated implant, black arrow indicated glenoid, white arrow indicated humeral head???At 2 weeks after operaton (×100) Green arrow indicated bursal side abrasions of infraspinatus tendon???At 4 weeks after operation (×100) Green arrow indicated gap within the infraspinatus tendon, white arrow indicated humeral head???At 6 weeks after operation (×100) Green arrow indicated the infraspinatus tendon partial-thickness tear on the articular side, white arrow indicated humeral head???At 8 weeks after operation (×40) Green arrow indicated the proximal end of tear infraspinatus tendon, yellow arrow indicated the distal end of tear infraspinatus tendon, white arrow indicated humeral head
圖1
植入物設計圖A:穿刺部B:植入部圖 2實驗組植入物植入大鼠肩關節后黃箭頭示植入物,白箭頭示肩胛岡,綠箭頭示三角肌后緣??圖 3??術后8周正常對照組及假手術組Van Gieson染色觀察(×100)???綠箭頭示岡下肌腱,白箭頭示肱骨頭???正常對照組假手術組圖 4術后各時間點實驗組Van Gieson染色觀察???植入物定位(×20)紅箭頭示肩胛岡,黃箭頭示岡下肌腱,綠箭頭示植入物,黑箭頭示肩胛盂,白箭頭示肱骨頭???術后2周(×100)綠箭頭示岡下肌腱滑囊側磨損???術后4周(×100)綠箭頭示肌腱內部出現分層空隙,白箭頭示肱骨頭???術后6周(×100)綠箭頭示岡下肌腱關節面部分撕裂,白箭頭示肱骨頭術后8周(×40)???綠箭頭示岡下肌腱近側斷端,黃箭頭示岡下肌腱遠側斷端,白箭頭示肱骨頭
Figure1.
Design of implant A: Penetrating site B: Implanting site Fig.2 The picture after implant was pierced into shoulder joint in the experimental group Yellow arrow indicated implant, white arrow indicated scapular spine, green arrow indicated posterior edge of deltoid Fig.3 Van Gieson staining observation of control group and sham-operation group at 8 weeks after operation (×100) Green arrow indicated infraspinatus tendon, white arrow indicated humeral head ???Control group???Sham-operation group Fig.4 Van Gieson staining observation of experimental group at different time points???Implant was positioned accurately (×20) Red arrow indicated scapular spine, yellow arrow indicated infraspinatus tendon, green arrow indicated implant, black arrow indicated glenoid, white arrow indicated humeral head???At 2 weeks after operaton (×100) Green arrow indicated bursal side abrasions of infraspinatus tendon???At 4 weeks after operation (×100) Green arrow indicated gap within the infraspinatus tendon, white arrow indicated humeral head???At 6 weeks after operation (×100) Green arrow indicated the infraspinatus tendon partial-thickness tear on the articular side, white arrow indicated humeral head???At 8 weeks after operation (×40) Green arrow indicated the proximal end of tear infraspinatus tendon, yellow arrow indicated the distal end of tear infraspinatus tendon, white arrow indicated humeral head
根據植入物的設計要求,在Pro/E5.0軟件中完成三維設計,數據以STL標準格式保存;導入Geomagic Studio 11.0軟件對植入物進行光滑、松弛等處理;再將處理好的STL模型導入至Magics 9.55軟件加支撐;最后采用3-D打印機,以聚醚醚酮(polyether-ether-ketone,PEEK)材料打印植入物。
1.3 實驗分組及方法
將48只大鼠經腹腔注射10%水合氯醛(0.3?mL/100 g)麻醉,俯臥位固定于特制三棱柱支架上,以抬高肩關節。隨機取一側肩關節作為手術側(實驗組),捫及肩峰后拉起該處皮膚,作一長約2.5 cm切口。緊貼肩峰內側刺入植入物,刺入后盡量緊貼肩峰下表面行進,并貼三角肌后緣從肩峰外側刺出,將大鼠肩峰夾持于植入物植入部的上、下作用片之間。用4?號蠶絲線嵌入植入物凹槽內并“8”字打結固定后,剪去植入物穿刺部(圖 2)。其中24只大鼠對側肩關節不作任何處理,作為正常對照組;余24只對側肩關節同上法刺入植入物后即刻取出,作為假手術組。手術當天預防性使用抗生素,腹腔注射硫酸卡那霉素(0.75?mg/100?g)。術后4 d開始采用實驗室仿制的平臺式動物跑步機驅趕大鼠(下傾13.5°、17 m/min)[16],每天1次,每次30 min。分別于術后2、4、6、8周同上法麻醉后脫頸處死12只大鼠,取雙側肩關節標本進行以下觀測。
1.4 觀測指標
1.4.1 一般情況
術后觀察大鼠存活、肢體活動以及切口愈合情況。
1.4.2 組織學觀察
將肩關節標本切割成約15?mm?×15?mm?×15 mm大小,標本底面與岡下肌腱走行方向平行,置于10%甲醛固定7 d,梯度乙醇脫水,包埋。使用硬組織鋸式旋轉切片機垂直于包埋塊長軸方向切片,片厚50μm。常規Van Gieson染色,光鏡下觀察岡下肌腱病理變化,同時觀察實驗組植入物位置情況。
1.5 統計學方法
采用SPSS17.0統計軟件進行分析。計數資料組間比較采用χ2檢驗或確切概率法;檢驗水準α=0.05。
2 結果
2.1 一般情況
術后大鼠均存活至實驗完成,切口無感染,未出現紅、腫、皮溫增高、皮下積液等局部炎性反應或全身感染。術后大鼠跛行2~3 d,4 d后基本恢復正常。
2.2 組織學觀察
各時間點正常對照組和假手術組岡下肌腱邊緣光滑,無內部分層及斷裂表現,膠原排列整齊、致密(圖 3)。
實驗組植入物準確定位于肩峰與岡下肌腱、肱骨頭間,各時間點均未發現植入物移位現象(圖 4 a)。術后2周,與植入物直接摩擦的岡下肌腱滑囊面部分斷裂,斷裂厚度占肌腱全層厚度的1/5~1/3,肌腱滑囊面膠原松散、磨損明顯,關節面膠原排列整齊且致密(圖 4 b);4周,肌腱內部分層,層間存在較大空隙,空隙被黏貼切片時使用的膠水填充,其內可見尚未完全撕裂的膠原纖維(圖 4c);6周,岡下肌腱關節面部分撕裂,斷裂處膠原變性,結構紊亂(圖 4d);8周,岡下肌腱全層撕裂,可見斷端回縮(圖 4e)。
實驗組各時間點共出現4種典型病理改變:岡下肌腱滑囊面部分斷裂、岡下肌腱內部分層撕裂、岡下肌腱關節面部分撕裂和岡下肌腱全層撕裂。其中岡下肌腱滑囊面部分斷裂僅出現于2、4周,兩時間點間發生率比較差異無統計學意義(P>0.05);岡下肌腱內部分層撕裂主要出現在4、6周,與2、8周比較差異有統計學意義(P<0.05);4、6周間以及2、8周間比較差異無統計學意義(P>0.05)。岡下肌腱關節面部分撕裂主要出現在6周,與其余各時間點比較差異均有統計學意義(P<0.05);2、4、8周間比較差異均無統計學意義(P>0.05)。岡下肌腱全層撕裂主要出現于8周,與其余各時間點比較差異均有統計學意義(P<0.05);2、4、6周間比較差異均無統計學意義(P>0.05)。見表 1。
3 討論
既往用于研究肩袖損傷的動物模型主要有羊、犬、兔和大鼠[10-15]。羊和犬生長發育周期長,飼養和管理成本較高,不適用于大樣本量實驗研究[10]。兔體型相對較大,利于手術操作,因此常應用于肩袖急性損傷及手術修復等方面研究,但急性創傷性肩袖損傷僅占有癥狀肩袖損傷的8%[17],臨床中大部分肩袖損傷屬于慢性損傷。大鼠肩袖結構發達,特別是岡下肌腱性部分很長,并穿過鎖骨、肩峰和連接這些骨性結構的韌帶共同形成的拱形結構,與人類十分相似[10, 15]。因此,價格低、繁殖快、便于飼養和管理的大鼠更適用于建立慢性肩袖損傷模型。
目前慢性肩袖損傷動物模型制備方法主要參照Schneeberger等于1998年提出的肩胛岡自體骨片移植大鼠模型[15]。其原理是從對側肩胛岡取骨片,穿孔并結扎固定于肩峰下,與大鼠岡下肌肌腱摩擦。但是該模型制備方法主要存在以下不足:①植入骨片過程中要求剝離三角肌起點,打開肩關節,創傷大,對肩關節生理構造影響大,恢復期較長;②造模手術需顯微操作,需行雙側手術,手術難度大、時間長,易發生感染(感染率3.6%);③植入物易移位,遠期造模失敗率高(失敗率46.4%);④所移植骨片的厚度難以精確定量;⑤未能模擬出肌腱內部和肌腱關節面撕裂,而是臨床相對少見的肌腱滑囊面撕裂和全層斷裂。
本研究建立的大鼠模型,造模后的早期表現是與植入物直接摩擦的肌腱滑囊面損傷,但是當肌腱出現滑囊面和關節面分離后,大部分肌腱斷裂首先從關節面開始,最終發展為全層撕裂,這與臨床觀察一致。臨床發現大部分肩袖損傷患者表現為肌腱關節面部分撕裂,而非發生在滑囊面[7-9]。Schneeberger等學者提出的慢性肩袖損傷模型制備方法未能模擬出肌腱內部和肌腱關節面撕裂,而本研究制備的模型中成功觀察到這兩種病理改變。原因可能是:植入的肩峰撞擊征大鼠模型植入物較薄,對肌腱滑囊面的損傷較輕,且造模后堅持每天30 min的驅趕,迫使肌腱與PEEK片反復摩擦。近年研究表明,長期的摩擦及機械牽拉刺激會促使肌腱細胞和肌腱干細胞分泌前列腺素E2(prostaglandin E2,PGE2)[18-19],PGE2可作用于肌腱干細胞膜外PGE2受體,通過上調BMP-2表達來抑制肌腱干細胞的自我復制,并誘導其向成骨細胞分化[2,20-21],分化而來的成骨細胞在肌腱中形成鈣化灶導致肌腱內部分層。肌腱的滑囊面富含血管,為肌腱輸送營養物質和氧氣,并帶走代謝廢物;而關節面富含致密膠原,是承受牽拉負荷的主要部位[22],其物質交換主要依靠營養層的彌散作用。當鈣化灶形成等原因使兩層分離后,將導致肌腱關節面的營養障礙,使其逐步變性,承受牽拉負荷的能力下降[22],斷裂發生率增高[2]。組織學觀察發現,造模4周時肌腱雖出現內部分層,但膠原尚致密整齊,而6周時可觀察到嚴重肌腱變性,膠原結構紊亂不清,為上述病因理論提供了直接證據。此外,經統計學分析發現,4種岡下肌腱典型病理改變的發生率與造模時長有關,即滑囊面部分斷裂好發于造模4周前,肌腱內部分層撕裂好發于造模4~6周間,關節面部分撕裂好發于造模6周時,而岡下肌腱全層撕裂好發于造模8周以后。根據這一規律,今后的相關研究可根據實驗目的不同,確定合適的造模時長。
本研究的另一改進之處在于微創化設計,模型構建不需要分離肌肉和暴露關節,只需通過穿刺操作植入一厚0.5 mm、寬2 mm的植入物,將手術操作本身對肩關節結構、功能的影響降至最低。我們在預實驗中嘗試了0.3、0.5、0.8 mm 3種厚度的植入物,結果顯示0.3?mm厚植入物在植入后8周未能引出大鼠岡下肌腱全層撕裂;而0.8 mm厚植入物基本填充了肩峰下間隙,限制了大鼠肩關節的活動;最后選定0.5 mm厚植入物進行實驗。模型中植入物采用的PEEK材料是一種強度高、耐磨性好、加工性能優異的全芳香族半結晶熱塑性特種工程塑料[23],細胞體外培養、動物體內植入等研究均表明該材料具有良好的生物相容性和穩定化學特性[24-26],是理想的骨科植入材料[27]。另一方面,PEEK材料的彈性模量與骨皮質接近[23-26],植入后與肩峰骨刺、鉤狀肩峰等導致肩袖損傷的危險因素相似度高,能夠很好地模擬肩峰撞擊征及肩袖損傷的病理過程。植入物的設計保證了在方便植入的同時也能方便取出,移除植入物后可模仿患者肩峰下減壓術后的狀態。
綜上述,通過刺入PEEK材料制備的植入物建立大鼠慢性肩袖損傷模型,無需暴露肩關節,創傷小,出血少,操作快,不破壞三角肌起點,對肩關節結構功能影響小,可減少術后關節粘連等并發癥,感染率和死亡率低,造模成功率高,且便于轉化為肩峰下減壓術后模型。但本研究僅進行了硬組織切片Van Gieson染色,未能很好地對肌腱中各型膠原和潛在的鈣化灶進行觀察。下一步研究中可將植入物移除后對標本進行脫鈣、石蠟包埋并行天狼星紅染色、免疫組織化學染色觀察各型膠原,或單獨分離肌腱后行茜素紅染色觀察鈣化灶。
肩袖損傷在老年人和運動員中發病率較高,是導致肩關節疼痛和運動障礙的主要原因之一[1]。有關肩袖損傷的原因及治療策略尚存在爭議,成為近年研究熱點[2-6]。臨床發現大部分肩袖損傷發生于無外傷史的老年人群,且多為岡上肌腱關節面部分斷裂[7-9]。目前,相關研究中采用的動物模型均不能很好模擬這種慢性肩袖損傷[10-15]。為此,本研究通過自制肩峰撞擊征大鼠模型植入物(專利號:201420041502.4),設計一種微創建立大鼠慢性肩袖損傷模型方法,并探討該方法可行性,為慢性肩袖損傷以及肩峰撞擊征的研究提供動物模型。
1 材料與方法
1.1 實驗動物及主要材料、儀器
清潔級成年雄性SD大鼠48只,體重(277.25?±22.03)g,由西安交通大學醫學部動物實驗中心提供。實驗大鼠的使用獲西安交通大學醫學部動物實驗管理委員會批準。硫酸卡那霉素注射液(0.5?g/支;南京金陵藥業股份有限公司)。Leica 1600型硬組織鋸式旋轉切片機(Leica公司,德國);Pro/E5.0軟件(PTC公司,美國);Geomagic Studio 11.0軟件(Geomagic公司,美國);Magics 9.55軟件(Materialise公司,比利時);EOSINT P800型3-D打印機(EOS公司,德國)。
1.2 肩峰撞擊征大鼠模型植入物的設計和制造
肩峰撞擊征大鼠模型植入物包括植入部和穿刺部,植入部包含平行設計的上作用片和下作用片;穿刺部為植入部下作用片的延伸結構,完成穿刺后剪去。植入物寬2 mm,上作用片長4 mm,等長的下作用片和穿刺部總長40 mm,其厚度均為0.5 mm。上、下作用片間的夾持部分高度為1 mm,用于夾持肩峰。下作用片用于模擬肩峰下骨贅或鉤狀肩峰,上作用片起固定作用。植入部的1對0.2 mm寬的斜向凹槽用于捆扎絲線,避免植入物沿自身長軸方向移位,上作用片凹槽與下作用片凹槽的開口處距離植入部邊緣分別為2 mm和3.5 mm。見圖 1。
 圖1
植入物設計圖A:穿刺部B:植入部圖 2實驗組植入物植入大鼠肩關節后黃箭頭示植入物,白箭頭示肩胛岡,綠箭頭示三角肌后緣??圖 3??術后8周正常對照組及假手術組Van Gieson染色觀察(×100)???綠箭頭示岡下肌腱,白箭頭示肱骨頭???正常對照組假手術組圖 4術后各時間點實驗組Van Gieson染色觀察???植入物定位(×20)紅箭頭示肩胛岡,黃箭頭示岡下肌腱,綠箭頭示植入物,黑箭頭示肩胛盂,白箭頭示肱骨頭???術后2周(×100)綠箭頭示岡下肌腱滑囊側磨損???術后4周(×100)綠箭頭示肌腱內部出現分層空隙,白箭頭示肱骨頭???術后6周(×100)綠箭頭示岡下肌腱關節面部分撕裂,白箭頭示肱骨頭術后8周(×40)???綠箭頭示岡下肌腱近側斷端,黃箭頭示岡下肌腱遠側斷端,白箭頭示肱骨頭
Figure1.
Design of implant A: Penetrating site B: Implanting site Fig.2 The picture after implant was pierced into shoulder joint in the experimental group Yellow arrow indicated implant, white arrow indicated scapular spine, green arrow indicated posterior edge of deltoid Fig.3 Van Gieson staining observation of control group and sham-operation group at 8 weeks after operation (×100) Green arrow indicated infraspinatus tendon, white arrow indicated humeral head ???Control group???Sham-operation group Fig.4 Van Gieson staining observation of experimental group at different time points???Implant was positioned accurately (×20) Red arrow indicated scapular spine, yellow arrow indicated infraspinatus tendon, green arrow indicated implant, black arrow indicated glenoid, white arrow indicated humeral head???At 2 weeks after operaton (×100) Green arrow indicated bursal side abrasions of infraspinatus tendon???At 4 weeks after operation (×100) Green arrow indicated gap within the infraspinatus tendon, white arrow indicated humeral head???At 6 weeks after operation (×100) Green arrow indicated the infraspinatus tendon partial-thickness tear on the articular side, white arrow indicated humeral head???At 8 weeks after operation (×40) Green arrow indicated the proximal end of tear infraspinatus tendon, yellow arrow indicated the distal end of tear infraspinatus tendon, white arrow indicated humeral head
圖1
植入物設計圖A:穿刺部B:植入部圖 2實驗組植入物植入大鼠肩關節后黃箭頭示植入物,白箭頭示肩胛岡,綠箭頭示三角肌后緣??圖 3??術后8周正常對照組及假手術組Van Gieson染色觀察(×100)???綠箭頭示岡下肌腱,白箭頭示肱骨頭???正常對照組假手術組圖 4術后各時間點實驗組Van Gieson染色觀察???植入物定位(×20)紅箭頭示肩胛岡,黃箭頭示岡下肌腱,綠箭頭示植入物,黑箭頭示肩胛盂,白箭頭示肱骨頭???術后2周(×100)綠箭頭示岡下肌腱滑囊側磨損???術后4周(×100)綠箭頭示肌腱內部出現分層空隙,白箭頭示肱骨頭???術后6周(×100)綠箭頭示岡下肌腱關節面部分撕裂,白箭頭示肱骨頭術后8周(×40)???綠箭頭示岡下肌腱近側斷端,黃箭頭示岡下肌腱遠側斷端,白箭頭示肱骨頭
Figure1.
Design of implant A: Penetrating site B: Implanting site Fig.2 The picture after implant was pierced into shoulder joint in the experimental group Yellow arrow indicated implant, white arrow indicated scapular spine, green arrow indicated posterior edge of deltoid Fig.3 Van Gieson staining observation of control group and sham-operation group at 8 weeks after operation (×100) Green arrow indicated infraspinatus tendon, white arrow indicated humeral head ???Control group???Sham-operation group Fig.4 Van Gieson staining observation of experimental group at different time points???Implant was positioned accurately (×20) Red arrow indicated scapular spine, yellow arrow indicated infraspinatus tendon, green arrow indicated implant, black arrow indicated glenoid, white arrow indicated humeral head???At 2 weeks after operaton (×100) Green arrow indicated bursal side abrasions of infraspinatus tendon???At 4 weeks after operation (×100) Green arrow indicated gap within the infraspinatus tendon, white arrow indicated humeral head???At 6 weeks after operation (×100) Green arrow indicated the infraspinatus tendon partial-thickness tear on the articular side, white arrow indicated humeral head???At 8 weeks after operation (×40) Green arrow indicated the proximal end of tear infraspinatus tendon, yellow arrow indicated the distal end of tear infraspinatus tendon, white arrow indicated humeral head
根據植入物的設計要求,在Pro/E5.0軟件中完成三維設計,數據以STL標準格式保存;導入Geomagic Studio 11.0軟件對植入物進行光滑、松弛等處理;再將處理好的STL模型導入至Magics 9.55軟件加支撐;最后采用3-D打印機,以聚醚醚酮(polyether-ether-ketone,PEEK)材料打印植入物。
1.3 實驗分組及方法
將48只大鼠經腹腔注射10%水合氯醛(0.3?mL/100 g)麻醉,俯臥位固定于特制三棱柱支架上,以抬高肩關節。隨機取一側肩關節作為手術側(實驗組),捫及肩峰后拉起該處皮膚,作一長約2.5 cm切口。緊貼肩峰內側刺入植入物,刺入后盡量緊貼肩峰下表面行進,并貼三角肌后緣從肩峰外側刺出,將大鼠肩峰夾持于植入物植入部的上、下作用片之間。用4?號蠶絲線嵌入植入物凹槽內并“8”字打結固定后,剪去植入物穿刺部(圖 2)。其中24只大鼠對側肩關節不作任何處理,作為正常對照組;余24只對側肩關節同上法刺入植入物后即刻取出,作為假手術組。手術當天預防性使用抗生素,腹腔注射硫酸卡那霉素(0.75?mg/100?g)。術后4 d開始采用實驗室仿制的平臺式動物跑步機驅趕大鼠(下傾13.5°、17 m/min)[16],每天1次,每次30 min。分別于術后2、4、6、8周同上法麻醉后脫頸處死12只大鼠,取雙側肩關節標本進行以下觀測。
1.4 觀測指標
1.4.1 一般情況
術后觀察大鼠存活、肢體活動以及切口愈合情況。
1.4.2 組織學觀察
將肩關節標本切割成約15?mm?×15?mm?×15 mm大小,標本底面與岡下肌腱走行方向平行,置于10%甲醛固定7 d,梯度乙醇脫水,包埋。使用硬組織鋸式旋轉切片機垂直于包埋塊長軸方向切片,片厚50μm。常規Van Gieson染色,光鏡下觀察岡下肌腱病理變化,同時觀察實驗組植入物位置情況。
1.5 統計學方法
采用SPSS17.0統計軟件進行分析。計數資料組間比較采用χ2檢驗或確切概率法;檢驗水準α=0.05。
2 結果
2.1 一般情況
術后大鼠均存活至實驗完成,切口無感染,未出現紅、腫、皮溫增高、皮下積液等局部炎性反應或全身感染。術后大鼠跛行2~3 d,4 d后基本恢復正常。
2.2 組織學觀察
各時間點正常對照組和假手術組岡下肌腱邊緣光滑,無內部分層及斷裂表現,膠原排列整齊、致密(圖 3)。
實驗組植入物準確定位于肩峰與岡下肌腱、肱骨頭間,各時間點均未發現植入物移位現象(圖 4 a)。術后2周,與植入物直接摩擦的岡下肌腱滑囊面部分斷裂,斷裂厚度占肌腱全層厚度的1/5~1/3,肌腱滑囊面膠原松散、磨損明顯,關節面膠原排列整齊且致密(圖 4 b);4周,肌腱內部分層,層間存在較大空隙,空隙被黏貼切片時使用的膠水填充,其內可見尚未完全撕裂的膠原纖維(圖 4c);6周,岡下肌腱關節面部分撕裂,斷裂處膠原變性,結構紊亂(圖 4d);8周,岡下肌腱全層撕裂,可見斷端回縮(圖 4e)。
實驗組各時間點共出現4種典型病理改變:岡下肌腱滑囊面部分斷裂、岡下肌腱內部分層撕裂、岡下肌腱關節面部分撕裂和岡下肌腱全層撕裂。其中岡下肌腱滑囊面部分斷裂僅出現于2、4周,兩時間點間發生率比較差異無統計學意義(P>0.05);岡下肌腱內部分層撕裂主要出現在4、6周,與2、8周比較差異有統計學意義(P<0.05);4、6周間以及2、8周間比較差異無統計學意義(P>0.05)。岡下肌腱關節面部分撕裂主要出現在6周,與其余各時間點比較差異均有統計學意義(P<0.05);2、4、8周間比較差異均無統計學意義(P>0.05)。岡下肌腱全層撕裂主要出現于8周,與其余各時間點比較差異均有統計學意義(P<0.05);2、4、6周間比較差異均無統計學意義(P>0.05)。見表 1。
3 討論
既往用于研究肩袖損傷的動物模型主要有羊、犬、兔和大鼠[10-15]。羊和犬生長發育周期長,飼養和管理成本較高,不適用于大樣本量實驗研究[10]。兔體型相對較大,利于手術操作,因此常應用于肩袖急性損傷及手術修復等方面研究,但急性創傷性肩袖損傷僅占有癥狀肩袖損傷的8%[17],臨床中大部分肩袖損傷屬于慢性損傷。大鼠肩袖結構發達,特別是岡下肌腱性部分很長,并穿過鎖骨、肩峰和連接這些骨性結構的韌帶共同形成的拱形結構,與人類十分相似[10, 15]。因此,價格低、繁殖快、便于飼養和管理的大鼠更適用于建立慢性肩袖損傷模型。
目前慢性肩袖損傷動物模型制備方法主要參照Schneeberger等于1998年提出的肩胛岡自體骨片移植大鼠模型[15]。其原理是從對側肩胛岡取骨片,穿孔并結扎固定于肩峰下,與大鼠岡下肌肌腱摩擦。但是該模型制備方法主要存在以下不足:①植入骨片過程中要求剝離三角肌起點,打開肩關節,創傷大,對肩關節生理構造影響大,恢復期較長;②造模手術需顯微操作,需行雙側手術,手術難度大、時間長,易發生感染(感染率3.6%);③植入物易移位,遠期造模失敗率高(失敗率46.4%);④所移植骨片的厚度難以精確定量;⑤未能模擬出肌腱內部和肌腱關節面撕裂,而是臨床相對少見的肌腱滑囊面撕裂和全層斷裂。
本研究建立的大鼠模型,造模后的早期表現是與植入物直接摩擦的肌腱滑囊面損傷,但是當肌腱出現滑囊面和關節面分離后,大部分肌腱斷裂首先從關節面開始,最終發展為全層撕裂,這與臨床觀察一致。臨床發現大部分肩袖損傷患者表現為肌腱關節面部分撕裂,而非發生在滑囊面[7-9]。Schneeberger等學者提出的慢性肩袖損傷模型制備方法未能模擬出肌腱內部和肌腱關節面撕裂,而本研究制備的模型中成功觀察到這兩種病理改變。原因可能是:植入的肩峰撞擊征大鼠模型植入物較薄,對肌腱滑囊面的損傷較輕,且造模后堅持每天30 min的驅趕,迫使肌腱與PEEK片反復摩擦。近年研究表明,長期的摩擦及機械牽拉刺激會促使肌腱細胞和肌腱干細胞分泌前列腺素E2(prostaglandin E2,PGE2)[18-19],PGE2可作用于肌腱干細胞膜外PGE2受體,通過上調BMP-2表達來抑制肌腱干細胞的自我復制,并誘導其向成骨細胞分化[2,20-21],分化而來的成骨細胞在肌腱中形成鈣化灶導致肌腱內部分層。肌腱的滑囊面富含血管,為肌腱輸送營養物質和氧氣,并帶走代謝廢物;而關節面富含致密膠原,是承受牽拉負荷的主要部位[22],其物質交換主要依靠營養層的彌散作用。當鈣化灶形成等原因使兩層分離后,將導致肌腱關節面的營養障礙,使其逐步變性,承受牽拉負荷的能力下降[22],斷裂發生率增高[2]。組織學觀察發現,造模4周時肌腱雖出現內部分層,但膠原尚致密整齊,而6周時可觀察到嚴重肌腱變性,膠原結構紊亂不清,為上述病因理論提供了直接證據。此外,經統計學分析發現,4種岡下肌腱典型病理改變的發生率與造模時長有關,即滑囊面部分斷裂好發于造模4周前,肌腱內部分層撕裂好發于造模4~6周間,關節面部分撕裂好發于造模6周時,而岡下肌腱全層撕裂好發于造模8周以后。根據這一規律,今后的相關研究可根據實驗目的不同,確定合適的造模時長。
本研究的另一改進之處在于微創化設計,模型構建不需要分離肌肉和暴露關節,只需通過穿刺操作植入一厚0.5 mm、寬2 mm的植入物,將手術操作本身對肩關節結構、功能的影響降至最低。我們在預實驗中嘗試了0.3、0.5、0.8 mm 3種厚度的植入物,結果顯示0.3?mm厚植入物在植入后8周未能引出大鼠岡下肌腱全層撕裂;而0.8 mm厚植入物基本填充了肩峰下間隙,限制了大鼠肩關節的活動;最后選定0.5 mm厚植入物進行實驗。模型中植入物采用的PEEK材料是一種強度高、耐磨性好、加工性能優異的全芳香族半結晶熱塑性特種工程塑料[23],細胞體外培養、動物體內植入等研究均表明該材料具有良好的生物相容性和穩定化學特性[24-26],是理想的骨科植入材料[27]。另一方面,PEEK材料的彈性模量與骨皮質接近[23-26],植入后與肩峰骨刺、鉤狀肩峰等導致肩袖損傷的危險因素相似度高,能夠很好地模擬肩峰撞擊征及肩袖損傷的病理過程。植入物的設計保證了在方便植入的同時也能方便取出,移除植入物后可模仿患者肩峰下減壓術后的狀態。
綜上述,通過刺入PEEK材料制備的植入物建立大鼠慢性肩袖損傷模型,無需暴露肩關節,創傷小,出血少,操作快,不破壞三角肌起點,對肩關節結構功能影響小,可減少術后關節粘連等并發癥,感染率和死亡率低,造模成功率高,且便于轉化為肩峰下減壓術后模型。但本研究僅進行了硬組織切片Van Gieson染色,未能很好地對肌腱中各型膠原和潛在的鈣化灶進行觀察。下一步研究中可將植入物移除后對標本進行脫鈣、石蠟包埋并行天狼星紅染色、免疫組織化學染色觀察各型膠原,或單獨分離肌腱后行茜素紅染色觀察鈣化灶。