引用本文: 金瑛, 李豫皖, 張承昊, 吳術紅, 陳代雄, 劉毅. 體外誘導人羊膜間充質干細胞向韌帶細胞分化的實驗研究. 中國修復重建外科雜志, 2016, 30(2): 237-244. doi: 10.7507/1002-1892.20160048 復制
版權信息: ?四川大學華西醫院華西期刊社《中國修復重建外科雜志》版權所有,未經授權不得轉載、改編
膝關節運動損傷是一種常見疾病,由于韌帶愈合能力差,多需要手術重建韌帶;韌帶重建的移植物中,與自體和同種異體肌腱相比,組織工程韌帶最有發展潛力。組織工程韌帶所攜帶的種子細胞在其植入人體后可不斷增殖并合成細胞外基質,進行再血管化和重塑。這類細胞的主要來源是成熟體細胞或干細胞,其中BMSCs是應用最廣泛的干細胞,其增殖能力強、具有多向分化潛能[1-2];但其獲取有創,有感染、出血風險,植入體內后可能發生免疫排斥反應,因此應用于臨床受到一定限制。近年來有研究關注于人羊膜間充質干細胞(human amniotic mesenchymal stem cells,hAMSCs),其取自廢棄的胎盤表面羊膜,通過酶消化法獲得,來源廣泛且對人體無額外損傷,也不存在倫理道德爭議。既往研究表明,hAMSCs不僅增殖能力較BMSCs強[3],而且具有高豐度、高活力、高純度等特點[4];hAMSCs可表達干細胞特性,具有低免疫原性和多向分化潛能[3-5],目前已廣泛用于骨損傷、神經性疾病、骨髓損傷等疾病的動物模型體內研究[6]。但hAMSCs應用于韌帶組織工程的研究較少。本研究采用生長因子TGF-β1、bFGF及透明質酸(hyaluronic acid,HA)聯合或單獨體外誘導的方法,探討hAMSCs是否具有干細胞特性及經誘導后在體外能否向韌帶細胞分化,以期為hAMSCs作為韌帶組織工程種子細胞的來源提供實驗基礎。
1 材料與方法
1.1 主要試劑及儀器
L-DMEM/F12培養液、FBS、胰蛋白酶、膠原酶(GIBCO公司,美國);TGF-β1、bFGF、HA、肌腱蛋白C(tenascin C,TNC)、兔抗人Ⅰ型膠原抗體、兔抗人Ⅲ型膠原抗體(Abcam公司,美國);通用二抗試劑盒、逆轉錄試劑盒、SYRB Premix Ex TaptTM試劑盒(大連Takara公司)。FACS Calibur流式細胞儀(Becton Dickinson公司,美國);逆轉錄儀(Eppendorf公司,德國);核酸蛋白測量ND-1000(Nanodrop公司,美國);實時熒光定量PCR儀(Bio-Rad公司,美國);倒置相差顯微鏡(Nikon公司,日本)。
1.2 hAMSCs分離、培養及鑒定
實驗所用胎盤均取自遵義醫學院附屬醫院產科,產婦知情同意。將羊膜從胎盤上剝離,D-Hank液反復沖洗3 次,剪成約1 mm×1 mm×1 mm大小的碎片,0.02%EDTA-0.05%胰蛋白酶消化3次,D-Hank液漂洗后,加入0.75 mg/mL膠原酶,于37℃水浴震蕩消化2.5~3.0 h,至肉眼看不到羊膜碎片,濾網過濾,收集細胞濾液,以25 000×g離心10 min。棄上清,用含10%FBS的L-DMEM/F12培養基重懸細胞,以1.25×105個/mL密度接種于培養瓶,置于37℃、5%CO2及飽和濕度培養箱培養。每3天更換1次培養基,倒置相差顯微鏡觀察細胞形態變化。采用流式細胞術檢測所培養細胞的CD44、CD29、CD73、CD90、CD105、CD14、CD34、CD45、HLA-DR表達。
1.3 實驗分組
hAMSCs培養至第2代后,待細胞融合約85%時消化傳代,以1×105個/mL密度接種于12孔板;在細胞融合約60%時,按實驗分組分別加入含不同誘導液的L-DMEM/F12培養基共1 mL:A組TGF-β1+bFGF,B組HA,C組TGF-β1+bFGF+HA,其中TGF-β1和bFGF終濃度均為10 ng/mL,HA終濃度為10 μg/mL;D組為空白對照組。
1.4 觀測指標
1.4.1 誘導后細胞形態學觀察
各組誘導培養21 d后,采用倒置相差顯微鏡觀察各組細胞形態學變化。
1.4.2 磺酰羅丹明B(sulforhodamine B,SRB)比色法檢測細胞生長活性
hAMSCs開始誘導后,取融合約85%的細胞,制成濃度為1×105個/mL的細胞懸液,取200 μL加入96孔板。A、B、C組分別用含對應的不同誘導液的L-DMEM/F12培養基換液,D組用無誘導液的L-DMEM/F12培養基換液。連續培養7 d,每組重復3孔,酶標儀檢測515 nm處的吸光度(A)值,繪制生長曲線,觀察各組細胞增殖活性。
1.4.3 免疫組織化學染色檢測韌帶特異性蛋白表達
取各組誘導7、14、21 d的細胞,制成濃度為1×105個/mL的細胞懸液,加入含細胞爬片的6孔板內,每孔2 mL,培養3 d后按SP法行免疫組織化學染色,檢測Ⅰ型膠原、Ⅲ型膠原、TNC的表達。
1.4.4 實時熒光定量PCR檢測韌帶細胞相關基因表達
取各組誘導7、14、21 d的細胞,PBS洗3 遍,采用Trizol試劑分別提取總RNA,逆轉錄獲得cDNA,按照設計的引物序列(表 1)及PCR試劑盒說明配置PCR反應體系;擴增條件:預變性95℃、30 s,變性95℃、5 s,退火60℃、30 s。以GAPDH為內參,通過2-ΔΔCt法計算目標基因相對表達量。引物在NCBI基因庫中對比后,由上海生工生物工程股份有限公司合成。
1.5 統計學方法
采用SPSS18.0統計軟件進行分析。數據以均數±標準差表示,組間比較采用單因素方差分析,兩兩比較采用LSD檢驗;檢驗水準α=0.05。
2 結果
2.1 hAMSCs形態學觀察及鑒定
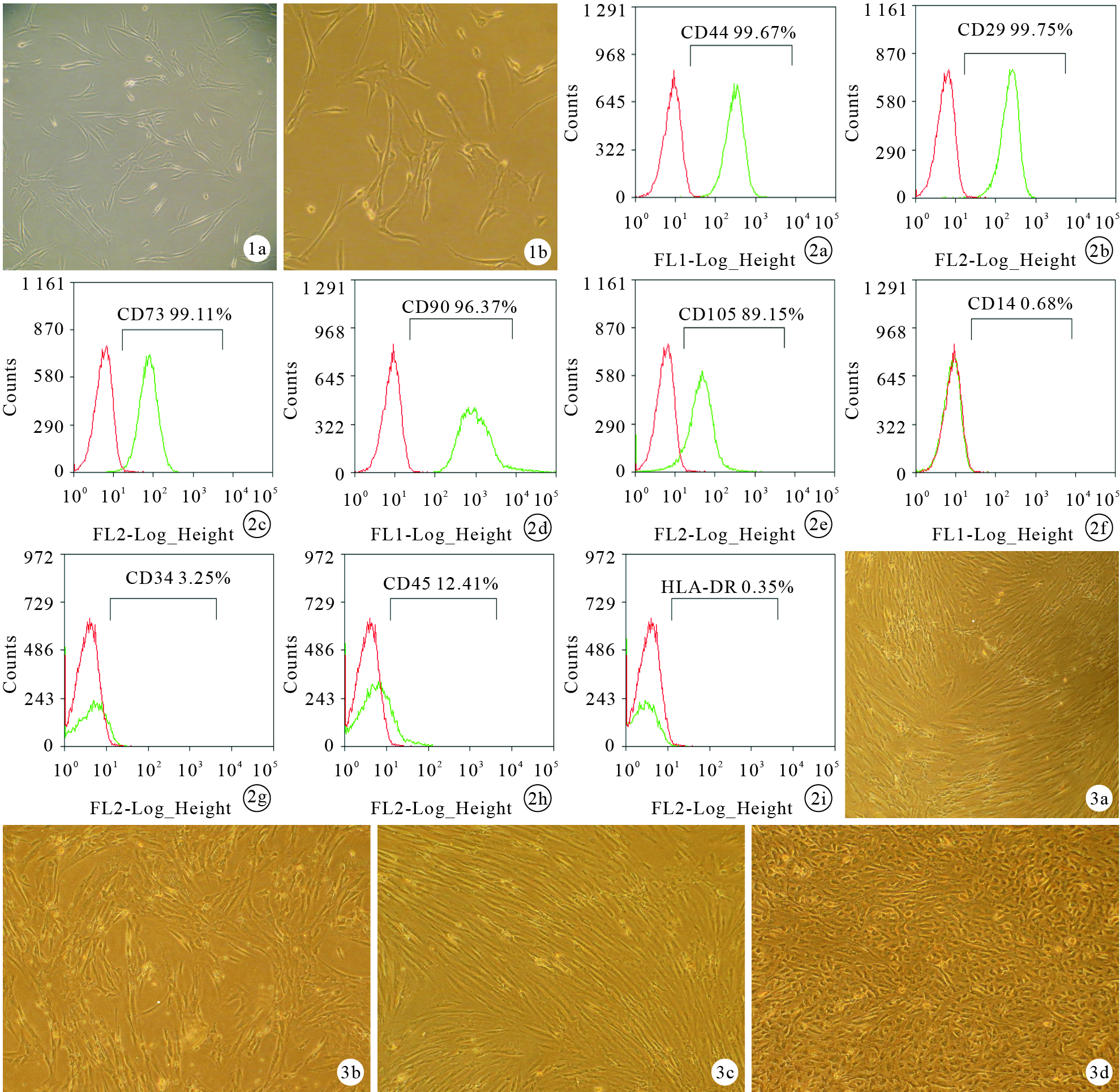
倒置相差顯微鏡觀察示,原代培養的hAMSCs呈橢圓形、長梭形或多角形,貼壁生長;傳代培養后細胞多呈長梭形,可見漩渦狀貼壁生長。見圖 1。hAMSCs增殖速度較快,接種后約4 d可達對數生長期,7 d即可傳代。第3代hAMSCs經流式細胞術檢測示,CD44、CD29、CD73、CD90、CD105表達陽性,CD14、CD34、CD45、HLA-DR表達陰性。見圖 2。
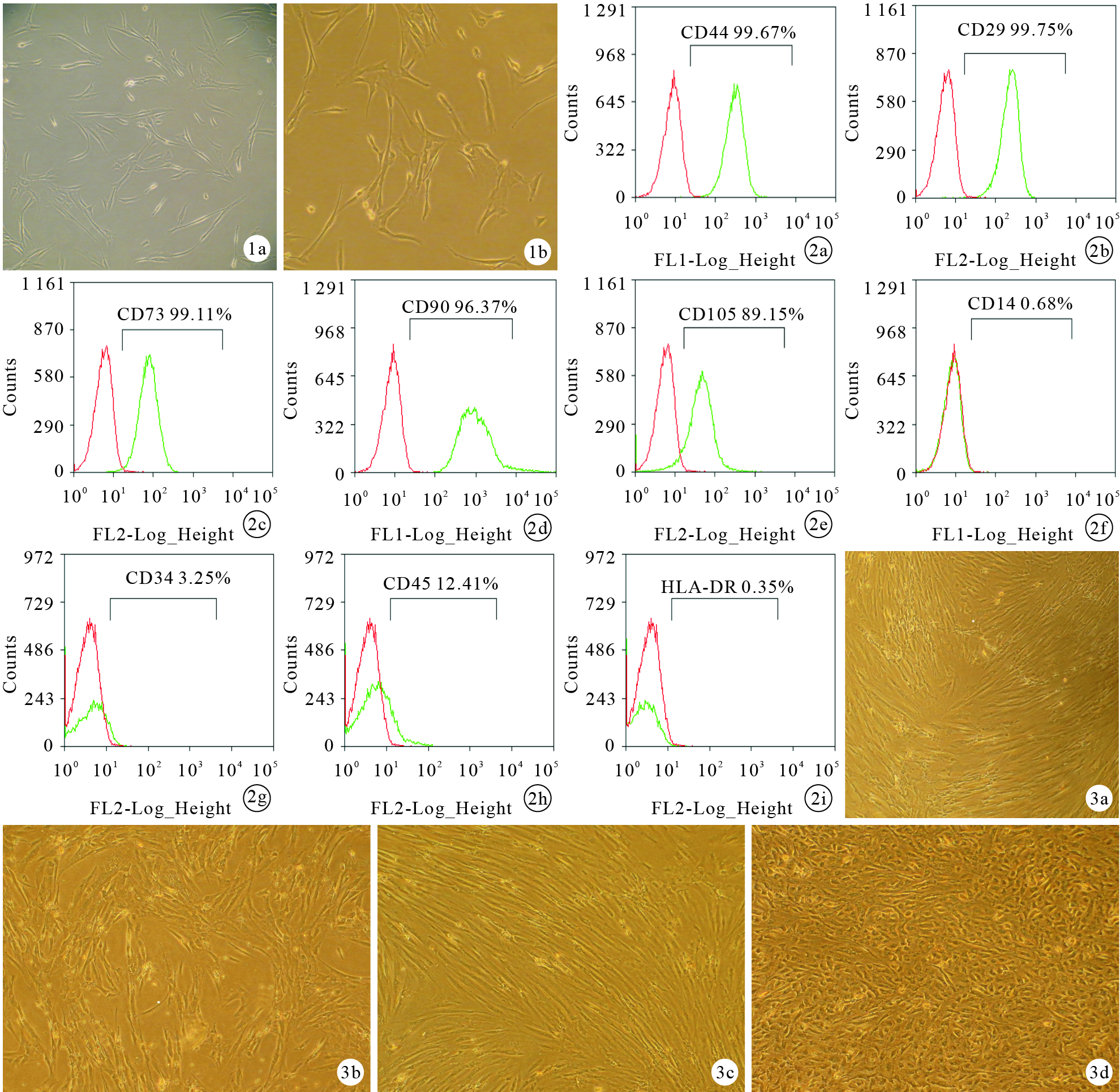 圖1
hAMSCs形態學觀察(倒置相差顯微鏡×100) ?原代hAMSCs ?第3代hAMSCs ? ?圖 2 流式細胞術檢測第3代hAMSCs表面抗原表達 ?CD44 ?CD29 ?CD73 ?CD90 ?CD105 ?CD14 ?CD34 ?CD45 ?HLA-DR ? ?圖 3 各組誘導培養21 d細胞形態學觀察(倒置相差顯微鏡×40) ?A組 ?B組 ?C組 ?D組
Figure1.
Morphology observation of hAMSCs (Inverted phase contrast microscope×100) ?Primary hAMSCs ?The 3rd generation of hAMSCs ? ?Fig. 2 Surface antigen expression of the 3rd generation of hAMSCs by flow cytometry ?CD44 ?CD29 ?CD73 ?CD90 ?CD105 ?CD14 ?CD34 ?CD45 ?HLA-DR ? ?Fig. 3 Morphology observation of hAMSCs at 21 days after induction in each group (Inverted phase contrast microscope×40) ?Group A ?Group B ?Group C ?Group D
圖1
hAMSCs形態學觀察(倒置相差顯微鏡×100) ?原代hAMSCs ?第3代hAMSCs ? ?圖 2 流式細胞術檢測第3代hAMSCs表面抗原表達 ?CD44 ?CD29 ?CD73 ?CD90 ?CD105 ?CD14 ?CD34 ?CD45 ?HLA-DR ? ?圖 3 各組誘導培養21 d細胞形態學觀察(倒置相差顯微鏡×40) ?A組 ?B組 ?C組 ?D組
Figure1.
Morphology observation of hAMSCs (Inverted phase contrast microscope×100) ?Primary hAMSCs ?The 3rd generation of hAMSCs ? ?Fig. 2 Surface antigen expression of the 3rd generation of hAMSCs by flow cytometry ?CD44 ?CD29 ?CD73 ?CD90 ?CD105 ?CD14 ?CD34 ?CD45 ?HLA-DR ? ?Fig. 3 Morphology observation of hAMSCs at 21 days after induction in each group (Inverted phase contrast microscope×40) ?Group A ?Group B ?Group C ?Group D
2.2 誘導后細胞形態學觀察
各組誘導培養21 d倒置相差顯微鏡觀察示,D組細胞多呈橢圓形或多角形,少許梭形細胞,排列無序而緊湊。A、B、C組細胞均呈長梭形成纖維細胞樣生長,其中B組細胞排列松散,缺乏方向性;A組細胞排列緊湊且具有明顯方向性;C組細胞形態更單一、有明顯方向性,且較A組排列更緊湊。見圖 3。
2.3 SRB比色法檢測細胞活性
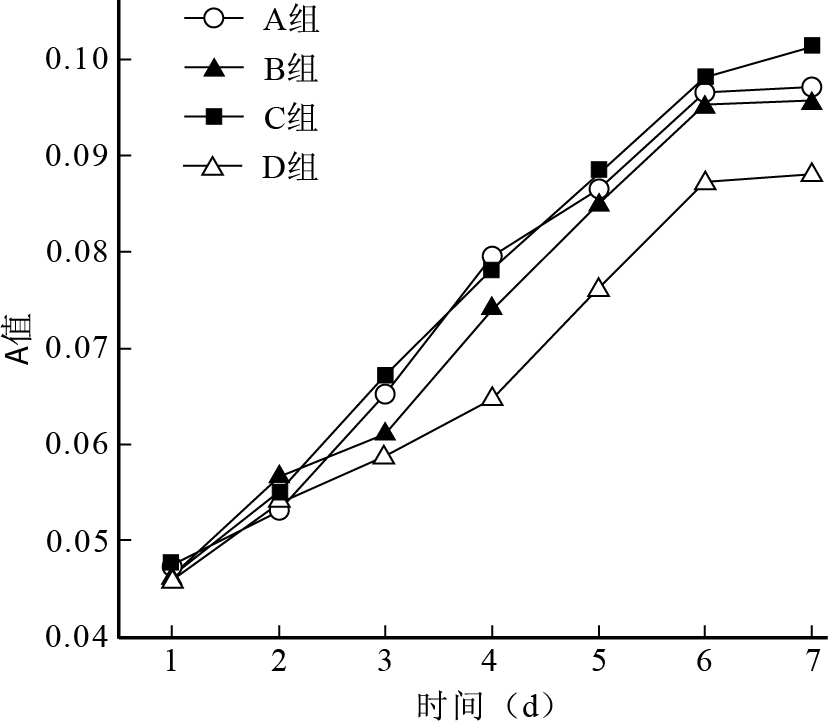
各組細胞于培養6 d左右達增殖高峰,此后保持增殖速度;培養6 d時,A、B、C組A值均顯著高于D組,C組高于A、B組。見圖 4。
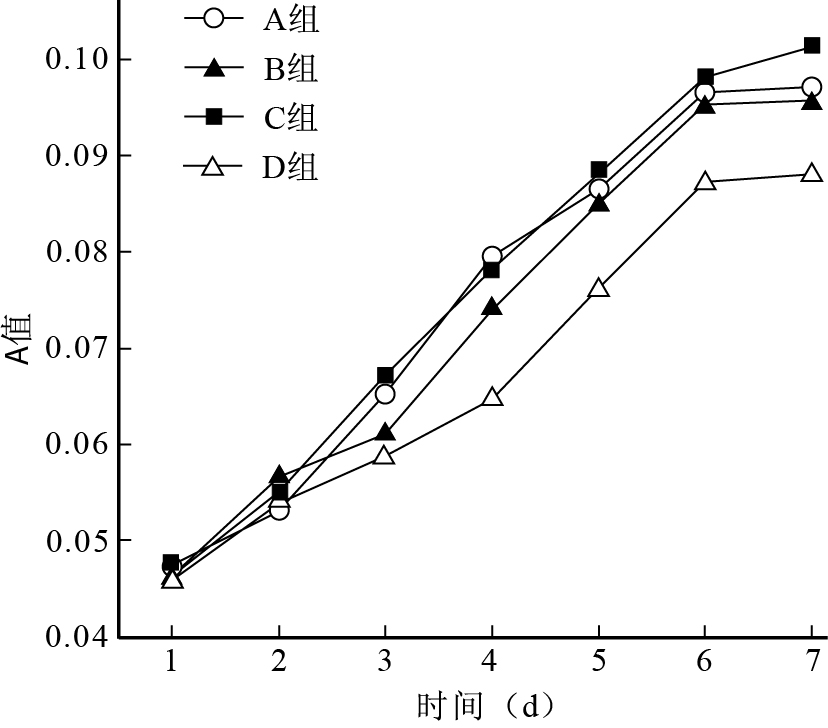 圖2
SRB比色法檢測各組細胞活性
Figure2.
Cell activity in each group by SRB colorimetric method
圖2
SRB比色法檢測各組細胞活性
Figure2.
Cell activity in each group by SRB colorimetric method
2.4 免疫組織化學染色檢測韌帶特異性蛋白表達
2.4.1 Ⅰ型膠原
組間比較:誘導培養7、14 d,A、B、C組Ⅰ型膠原表達顯著高于D組,A組高于B、C組且B組最低,差異均有統計學意義(P<0.001);21 d,A、B、C組Ⅰ型膠原表達顯著高于D組,差異均有統計學意義(P<0.001);A、B、C組間比較差異無統計學意義(P>0.05)。組內比較:A組14、21 d的Ⅰ型膠原表達顯著高于7 d,差異有統計學意義(P<0.05);14、21 d間差異無統計學意義(P>0.05)。B組Ⅰ型膠原表達隨時間增加呈逐漸增高趨勢,各時間點間比較差異均有統計學意義(P<0.05)。C組21 d的Ⅰ型膠原表達顯著高于7、14 d時,差異有統計學意義(P<0.05);7、14 d間差異有無統計學意義(P>0.05)。見表 2。
2.4.2 Ⅲ型膠原
組間比較:誘導培養7 d,A、C組Ⅲ型膠原表達顯著高于D組,差異有統計學意義(P<0.05);A、C組間以及B組和其他組間比較差異均無統計學意義(P>0.05)。14 d,A、B、C組Ⅲ型膠原表達顯著高于D組,C組Ⅲ型膠原表達顯著高于A、B組且B組最低,差異有統計學意義(P<0.001)。21 d,A、B、C組Ⅲ型膠原表達顯著高于D組,A組高于B、C組且B組最低,差異均有統計學意義(P<0.001)。組內比較:A、C組Ⅲ型膠原表達隨時間增加呈逐漸增高趨勢,各時間點間比較差異均有統計學意義(P<0.001)。B組21 d的Ⅲ型膠原表達顯著高于7、14 d,差異有統計學意義(P<0.001);7、14?d間差異無統計學意義(P>0.05)。見表 2。
2.4.3 TNC
組間比較:誘導培養7 d時各組均未檢測到TNC表達。14 d,D組未檢測到TNC表達,C組TNC表達高于A、B組,但差異無統計學意義(P>0.05)。21 d,D組未檢測到TNC表達,C組TNC表達高于A、B組且B組最低,差異有統計學意義(P<0.001)。組內比較:A、C組TNC表達隨時間增加呈逐漸增高趨勢,各時間點間比較差異均有統計學意義(P<0.05)。B組隨時間增加也呈逐漸增高趨勢,但各時間點間比較差異無統計學意義(P>0.05)。見表 2。
2.5 實時熒光定量PCR檢測韌帶細胞相關基因表達
2.5.1 Ⅰ型膠原
組間比較:誘導培養7 d,B、C組Ⅰ型膠原mRNA相對表達量顯著高于A組,C組高于B組,差異均有統計學意義(P<0.001)。14 d,B、C組Ⅰ型膠原mRNA相對表達量顯著高于A組,差異有統計學意義(P<0.001);B、C組間差異無統計學意義(P>0.05)。21 d,C組Ⅰ型膠原mRNA相對表達量顯著高于A、B組,差異有統計學意義(P<0.001);A、B組間差異無統計學意義(P>0.05)。組內比較:A、C組Ⅰ型膠原mRNA相對表達量隨時間增加呈逐漸上調趨勢,各時間點間比較差異均有統計學意義(P<0.001)。B組7、21 d的Ⅰ型膠原mRNA相對表達量均高于14 d時,差異有統計學意義(P<0.001);7、21 d間差異無統計學意義(P>0.05)。見表 3。
2.5.2 Ⅲ型膠原
組間比較:誘導培養7、21 d,B組Ⅲ型膠原mRNA相對表達量顯著高于A、C組且A組最低,差異均有統計學意義(P<0.001);14 d,B組Ⅲ型膠原mRNA相對表達量顯著高于A、C組且C組最低,差異均有統計學意義(P<0.001)。組內比較:A組14?d的Ⅲ型膠原mRNA相對表達量顯著高于7、21?d且7 d最低,差異均有統計學意義(P<0.001)。B組21?d的Ⅲ型膠原mRNA相對表達量高于7、14 d,差異均有統計學意義(P<0.001);7、14 d間差異無統計學意義(P>0.05)。C組Ⅲ型膠原mRNA相對表達量隨時間增加呈逐漸上調趨勢,各時間點間比較差異均有統計學意義(P<0.001)。見表 3。
2.5.3 TNC
組間比較:誘導培養7 d,B組TNC mRNA相對表達量顯著高于A、C組且A組最低,差異均有統計學意義(P<0.001)。14 d,C組TNC mRNA相對表達量顯著高于A、B組,差異均有統計學意義(P<0.001);A、B組間差異無統計學意義(P>0.05)。21 d,C組TNC mRNA相對表達量顯著高于B組,差異有統計學意義(P<0.05)。組內比較:A、C組TNC mRNA相對表達量隨時間增加呈逐漸上調趨勢,各時間點間比較差異均有統計學意義(P<0.001)。B組21 d的TNC mRNA相對表達量顯著高于7、14 d,差異均有統計學意義(P<0.05);7、14?d間差異無統計學意義(P>0.05)。見表 3。
3 討論
文獻報道,hAMSCs是有多向分化潛能的干細胞,增殖能力強,在一定條件下可向3個胚層來源的組織細胞分化[7]。本研究發現,通過酶消化法可得到數量較多、活性較好的hAMSCs;SRB比色法檢測示hAMSCs于培養6 d左右達增殖高峰,此后保持增殖速度,具有良好的增殖能力。流式細胞術檢測表明,hAMSCs表達CD44、CD29、CD73、CD90、CD105,不表達CD14、CD34、CD45、HLA-DR,其中CD73、CD90、CD105是MSCs表達的表面分子。此外,Parolini等[8]報道hAMSCs低表達主要組織相容性Ⅰ類抗原(HLA-A、HLA-B、HLA-C),同時也低表達共刺激分子(CD80、CD83、CD86、CD40L等);且本實驗表明hAMSCs低表達免疫因子CD14及主要組織相容性Ⅱ類抗原HLA-DR,說明hAMSCs具有低免疫原性,不引起同種或異種淋巴細胞增殖反應,作為組織工程細胞來源或用于組織、器官損傷修復時不會引起免疫排斥反應。
本研究結果顯示,hAMSCs在不同的定向誘導條件下均表現出了韌帶特異性增加。各誘導組韌帶特異性蛋白Ⅰ型膠原、Ⅲ型膠原、TNC表達較未誘導組顯著增高,差異有統計學意義(P<0.05)。誘導7、14 d時A組Ⅰ型膠原mRNA相對表達量最低(P<0.001);誘導14 d時C組Ⅲ型膠原mRNA相對表達量最低(P<0.001);14、21 d時C組TNC mRNA相對表達量最高(P<0.05)。A、C組Ⅰ型膠原、TNC及C組Ⅲ型膠原mRNA相對表達量隨時間增加呈逐漸上調趨勢(P<0.05)。SRB結果表明hAMSCs經誘導后細胞增殖能力不變。有文獻報道,TGF-β1可促進細胞增殖、分化,明顯提高膠原蛋白分泌能力[9-11]。Kondo等[12]的兔前交叉韌帶損傷修復實驗結果顯示,TGF-β1用于損傷的前交叉韌帶可促進韌帶愈合,明顯提高韌帶的生物力學性能。Kobayashi等[13]報道bFGF可通過增加血管分布提高前交叉韌帶愈合能力;周盛源等[14]研究表明轉染bFGF基因的BMSCs可顯著提高韌帶修復能力及修復強度。本課題組既往研究表明[15],經過TGF-β1和bFGF誘導后,BMSCs活性、增殖能力及韌帶特異性均顯著提高。本研究結果與該結論一致,說明hAMSCs具有MSCs的特性,可在TGF-β1和bFGF誘導下向韌帶細胞分化。
流式細胞術結果表明hAMSCs高表達CD44,CD44即HA受體。HA是細胞外基質的重要組成成分之一,可促進血管生成,減輕炎性反應,促進Ⅲ型膠原合成[16]。本實驗實時熒光定量PCR檢測結果顯示,誘導7 d時B組Ⅰ型膠原、Ⅲ型膠原、TNC基因表達高于A、C組(P<0.001),21 d時B組Ⅲ型膠原基因表達高于A、C組(P<0.05)。提示HA體外誘導hAMSCs 7 d時,韌帶特異性蛋白相關基因表達上調高于單獨應用TGF-β1、bFGF組及單純應用HA組。免疫組織化學染色結果表明,HA聯合TGF-β1、bFGF可促進hAMSCs表達韌帶特異性蛋白Ⅰ型膠原、Ⅲ型膠原、TNC,且優于HA和TGF-β1、bFGF單獨應用組。HA具有較強的吸水性和高度黏滯性,可防止生長因子過快地擴散和降解,使生長因子在局部保持一定濃度緩慢釋放[17],這可能是HA聯合TGF-β1、bFGF誘導后韌帶特異性蛋白表達量更高的原因。因此我們認為hAMSCs經過TGF-β1、bFGF和HA單獨或聯合誘導后,均可向韌帶細胞分化。在HA的作用下,TGF-β1、bFGF的誘導效果得到了一定程度提高。
綜上述,hAMSCs具有MSCs的表型和特點,具有良好的增殖潛能和低免疫原性,經過體外誘導后韌帶特異性蛋白分泌增加,相關基因表達上調,可作為韌帶組織工程種子細胞來源。但hAMSCs與支架復合的能力以及植入體內后分泌韌帶特異性蛋白的能力等,還有待進一步實驗研究。
膝關節運動損傷是一種常見疾病,由于韌帶愈合能力差,多需要手術重建韌帶;韌帶重建的移植物中,與自體和同種異體肌腱相比,組織工程韌帶最有發展潛力。組織工程韌帶所攜帶的種子細胞在其植入人體后可不斷增殖并合成細胞外基質,進行再血管化和重塑。這類細胞的主要來源是成熟體細胞或干細胞,其中BMSCs是應用最廣泛的干細胞,其增殖能力強、具有多向分化潛能[1-2];但其獲取有創,有感染、出血風險,植入體內后可能發生免疫排斥反應,因此應用于臨床受到一定限制。近年來有研究關注于人羊膜間充質干細胞(human amniotic mesenchymal stem cells,hAMSCs),其取自廢棄的胎盤表面羊膜,通過酶消化法獲得,來源廣泛且對人體無額外損傷,也不存在倫理道德爭議。既往研究表明,hAMSCs不僅增殖能力較BMSCs強[3],而且具有高豐度、高活力、高純度等特點[4];hAMSCs可表達干細胞特性,具有低免疫原性和多向分化潛能[3-5],目前已廣泛用于骨損傷、神經性疾病、骨髓損傷等疾病的動物模型體內研究[6]。但hAMSCs應用于韌帶組織工程的研究較少。本研究采用生長因子TGF-β1、bFGF及透明質酸(hyaluronic acid,HA)聯合或單獨體外誘導的方法,探討hAMSCs是否具有干細胞特性及經誘導后在體外能否向韌帶細胞分化,以期為hAMSCs作為韌帶組織工程種子細胞的來源提供實驗基礎。
1 材料與方法
1.1 主要試劑及儀器
L-DMEM/F12培養液、FBS、胰蛋白酶、膠原酶(GIBCO公司,美國);TGF-β1、bFGF、HA、肌腱蛋白C(tenascin C,TNC)、兔抗人Ⅰ型膠原抗體、兔抗人Ⅲ型膠原抗體(Abcam公司,美國);通用二抗試劑盒、逆轉錄試劑盒、SYRB Premix Ex TaptTM試劑盒(大連Takara公司)。FACS Calibur流式細胞儀(Becton Dickinson公司,美國);逆轉錄儀(Eppendorf公司,德國);核酸蛋白測量ND-1000(Nanodrop公司,美國);實時熒光定量PCR儀(Bio-Rad公司,美國);倒置相差顯微鏡(Nikon公司,日本)。
1.2 hAMSCs分離、培養及鑒定
實驗所用胎盤均取自遵義醫學院附屬醫院產科,產婦知情同意。將羊膜從胎盤上剝離,D-Hank液反復沖洗3 次,剪成約1 mm×1 mm×1 mm大小的碎片,0.02%EDTA-0.05%胰蛋白酶消化3次,D-Hank液漂洗后,加入0.75 mg/mL膠原酶,于37℃水浴震蕩消化2.5~3.0 h,至肉眼看不到羊膜碎片,濾網過濾,收集細胞濾液,以25 000×g離心10 min。棄上清,用含10%FBS的L-DMEM/F12培養基重懸細胞,以1.25×105個/mL密度接種于培養瓶,置于37℃、5%CO2及飽和濕度培養箱培養。每3天更換1次培養基,倒置相差顯微鏡觀察細胞形態變化。采用流式細胞術檢測所培養細胞的CD44、CD29、CD73、CD90、CD105、CD14、CD34、CD45、HLA-DR表達。
1.3 實驗分組
hAMSCs培養至第2代后,待細胞融合約85%時消化傳代,以1×105個/mL密度接種于12孔板;在細胞融合約60%時,按實驗分組分別加入含不同誘導液的L-DMEM/F12培養基共1 mL:A組TGF-β1+bFGF,B組HA,C組TGF-β1+bFGF+HA,其中TGF-β1和bFGF終濃度均為10 ng/mL,HA終濃度為10 μg/mL;D組為空白對照組。
1.4 觀測指標
1.4.1 誘導后細胞形態學觀察
各組誘導培養21 d后,采用倒置相差顯微鏡觀察各組細胞形態學變化。
1.4.2 磺酰羅丹明B(sulforhodamine B,SRB)比色法檢測細胞生長活性
hAMSCs開始誘導后,取融合約85%的細胞,制成濃度為1×105個/mL的細胞懸液,取200 μL加入96孔板。A、B、C組分別用含對應的不同誘導液的L-DMEM/F12培養基換液,D組用無誘導液的L-DMEM/F12培養基換液。連續培養7 d,每組重復3孔,酶標儀檢測515 nm處的吸光度(A)值,繪制生長曲線,觀察各組細胞增殖活性。
1.4.3 免疫組織化學染色檢測韌帶特異性蛋白表達
取各組誘導7、14、21 d的細胞,制成濃度為1×105個/mL的細胞懸液,加入含細胞爬片的6孔板內,每孔2 mL,培養3 d后按SP法行免疫組織化學染色,檢測Ⅰ型膠原、Ⅲ型膠原、TNC的表達。
1.4.4 實時熒光定量PCR檢測韌帶細胞相關基因表達
取各組誘導7、14、21 d的細胞,PBS洗3 遍,采用Trizol試劑分別提取總RNA,逆轉錄獲得cDNA,按照設計的引物序列(表 1)及PCR試劑盒說明配置PCR反應體系;擴增條件:預變性95℃、30 s,變性95℃、5 s,退火60℃、30 s。以GAPDH為內參,通過2-ΔΔCt法計算目標基因相對表達量。引物在NCBI基因庫中對比后,由上海生工生物工程股份有限公司合成。
1.5 統計學方法
采用SPSS18.0統計軟件進行分析。數據以均數±標準差表示,組間比較采用單因素方差分析,兩兩比較采用LSD檢驗;檢驗水準α=0.05。
2 結果
2.1 hAMSCs形態學觀察及鑒定
倒置相差顯微鏡觀察示,原代培養的hAMSCs呈橢圓形、長梭形或多角形,貼壁生長;傳代培養后細胞多呈長梭形,可見漩渦狀貼壁生長。見圖 1。hAMSCs增殖速度較快,接種后約4 d可達對數生長期,7 d即可傳代。第3代hAMSCs經流式細胞術檢測示,CD44、CD29、CD73、CD90、CD105表達陽性,CD14、CD34、CD45、HLA-DR表達陰性。見圖 2。
 圖1
hAMSCs形態學觀察(倒置相差顯微鏡×100) ?原代hAMSCs ?第3代hAMSCs ? ?圖 2 流式細胞術檢測第3代hAMSCs表面抗原表達 ?CD44 ?CD29 ?CD73 ?CD90 ?CD105 ?CD14 ?CD34 ?CD45 ?HLA-DR ? ?圖 3 各組誘導培養21 d細胞形態學觀察(倒置相差顯微鏡×40) ?A組 ?B組 ?C組 ?D組
Figure1.
Morphology observation of hAMSCs (Inverted phase contrast microscope×100) ?Primary hAMSCs ?The 3rd generation of hAMSCs ? ?Fig. 2 Surface antigen expression of the 3rd generation of hAMSCs by flow cytometry ?CD44 ?CD29 ?CD73 ?CD90 ?CD105 ?CD14 ?CD34 ?CD45 ?HLA-DR ? ?Fig. 3 Morphology observation of hAMSCs at 21 days after induction in each group (Inverted phase contrast microscope×40) ?Group A ?Group B ?Group C ?Group D
圖1
hAMSCs形態學觀察(倒置相差顯微鏡×100) ?原代hAMSCs ?第3代hAMSCs ? ?圖 2 流式細胞術檢測第3代hAMSCs表面抗原表達 ?CD44 ?CD29 ?CD73 ?CD90 ?CD105 ?CD14 ?CD34 ?CD45 ?HLA-DR ? ?圖 3 各組誘導培養21 d細胞形態學觀察(倒置相差顯微鏡×40) ?A組 ?B組 ?C組 ?D組
Figure1.
Morphology observation of hAMSCs (Inverted phase contrast microscope×100) ?Primary hAMSCs ?The 3rd generation of hAMSCs ? ?Fig. 2 Surface antigen expression of the 3rd generation of hAMSCs by flow cytometry ?CD44 ?CD29 ?CD73 ?CD90 ?CD105 ?CD14 ?CD34 ?CD45 ?HLA-DR ? ?Fig. 3 Morphology observation of hAMSCs at 21 days after induction in each group (Inverted phase contrast microscope×40) ?Group A ?Group B ?Group C ?Group D
2.2 誘導后細胞形態學觀察
各組誘導培養21 d倒置相差顯微鏡觀察示,D組細胞多呈橢圓形或多角形,少許梭形細胞,排列無序而緊湊。A、B、C組細胞均呈長梭形成纖維細胞樣生長,其中B組細胞排列松散,缺乏方向性;A組細胞排列緊湊且具有明顯方向性;C組細胞形態更單一、有明顯方向性,且較A組排列更緊湊。見圖 3。
2.3 SRB比色法檢測細胞活性
各組細胞于培養6 d左右達增殖高峰,此后保持增殖速度;培養6 d時,A、B、C組A值均顯著高于D組,C組高于A、B組。見圖 4。
 圖2
SRB比色法檢測各組細胞活性
Figure2.
Cell activity in each group by SRB colorimetric method
圖2
SRB比色法檢測各組細胞活性
Figure2.
Cell activity in each group by SRB colorimetric method
2.4 免疫組織化學染色檢測韌帶特異性蛋白表達
2.4.1 Ⅰ型膠原
組間比較:誘導培養7、14 d,A、B、C組Ⅰ型膠原表達顯著高于D組,A組高于B、C組且B組最低,差異均有統計學意義(P<0.001);21 d,A、B、C組Ⅰ型膠原表達顯著高于D組,差異均有統計學意義(P<0.001);A、B、C組間比較差異無統計學意義(P>0.05)。組內比較:A組14、21 d的Ⅰ型膠原表達顯著高于7 d,差異有統計學意義(P<0.05);14、21 d間差異無統計學意義(P>0.05)。B組Ⅰ型膠原表達隨時間增加呈逐漸增高趨勢,各時間點間比較差異均有統計學意義(P<0.05)。C組21 d的Ⅰ型膠原表達顯著高于7、14 d時,差異有統計學意義(P<0.05);7、14 d間差異有無統計學意義(P>0.05)。見表 2。
2.4.2 Ⅲ型膠原
組間比較:誘導培養7 d,A、C組Ⅲ型膠原表達顯著高于D組,差異有統計學意義(P<0.05);A、C組間以及B組和其他組間比較差異均無統計學意義(P>0.05)。14 d,A、B、C組Ⅲ型膠原表達顯著高于D組,C組Ⅲ型膠原表達顯著高于A、B組且B組最低,差異有統計學意義(P<0.001)。21 d,A、B、C組Ⅲ型膠原表達顯著高于D組,A組高于B、C組且B組最低,差異均有統計學意義(P<0.001)。組內比較:A、C組Ⅲ型膠原表達隨時間增加呈逐漸增高趨勢,各時間點間比較差異均有統計學意義(P<0.001)。B組21 d的Ⅲ型膠原表達顯著高于7、14 d,差異有統計學意義(P<0.001);7、14?d間差異無統計學意義(P>0.05)。見表 2。
2.4.3 TNC
組間比較:誘導培養7 d時各組均未檢測到TNC表達。14 d,D組未檢測到TNC表達,C組TNC表達高于A、B組,但差異無統計學意義(P>0.05)。21 d,D組未檢測到TNC表達,C組TNC表達高于A、B組且B組最低,差異有統計學意義(P<0.001)。組內比較:A、C組TNC表達隨時間增加呈逐漸增高趨勢,各時間點間比較差異均有統計學意義(P<0.05)。B組隨時間增加也呈逐漸增高趨勢,但各時間點間比較差異無統計學意義(P>0.05)。見表 2。
2.5 實時熒光定量PCR檢測韌帶細胞相關基因表達
2.5.1 Ⅰ型膠原
組間比較:誘導培養7 d,B、C組Ⅰ型膠原mRNA相對表達量顯著高于A組,C組高于B組,差異均有統計學意義(P<0.001)。14 d,B、C組Ⅰ型膠原mRNA相對表達量顯著高于A組,差異有統計學意義(P<0.001);B、C組間差異無統計學意義(P>0.05)。21 d,C組Ⅰ型膠原mRNA相對表達量顯著高于A、B組,差異有統計學意義(P<0.001);A、B組間差異無統計學意義(P>0.05)。組內比較:A、C組Ⅰ型膠原mRNA相對表達量隨時間增加呈逐漸上調趨勢,各時間點間比較差異均有統計學意義(P<0.001)。B組7、21 d的Ⅰ型膠原mRNA相對表達量均高于14 d時,差異有統計學意義(P<0.001);7、21 d間差異無統計學意義(P>0.05)。見表 3。
2.5.2 Ⅲ型膠原
組間比較:誘導培養7、21 d,B組Ⅲ型膠原mRNA相對表達量顯著高于A、C組且A組最低,差異均有統計學意義(P<0.001);14 d,B組Ⅲ型膠原mRNA相對表達量顯著高于A、C組且C組最低,差異均有統計學意義(P<0.001)。組內比較:A組14?d的Ⅲ型膠原mRNA相對表達量顯著高于7、21?d且7 d最低,差異均有統計學意義(P<0.001)。B組21?d的Ⅲ型膠原mRNA相對表達量高于7、14 d,差異均有統計學意義(P<0.001);7、14 d間差異無統計學意義(P>0.05)。C組Ⅲ型膠原mRNA相對表達量隨時間增加呈逐漸上調趨勢,各時間點間比較差異均有統計學意義(P<0.001)。見表 3。
2.5.3 TNC
組間比較:誘導培養7 d,B組TNC mRNA相對表達量顯著高于A、C組且A組最低,差異均有統計學意義(P<0.001)。14 d,C組TNC mRNA相對表達量顯著高于A、B組,差異均有統計學意義(P<0.001);A、B組間差異無統計學意義(P>0.05)。21 d,C組TNC mRNA相對表達量顯著高于B組,差異有統計學意義(P<0.05)。組內比較:A、C組TNC mRNA相對表達量隨時間增加呈逐漸上調趨勢,各時間點間比較差異均有統計學意義(P<0.001)。B組21 d的TNC mRNA相對表達量顯著高于7、14 d,差異均有統計學意義(P<0.05);7、14?d間差異無統計學意義(P>0.05)。見表 3。
3 討論
文獻報道,hAMSCs是有多向分化潛能的干細胞,增殖能力強,在一定條件下可向3個胚層來源的組織細胞分化[7]。本研究發現,通過酶消化法可得到數量較多、活性較好的hAMSCs;SRB比色法檢測示hAMSCs于培養6 d左右達增殖高峰,此后保持增殖速度,具有良好的增殖能力。流式細胞術檢測表明,hAMSCs表達CD44、CD29、CD73、CD90、CD105,不表達CD14、CD34、CD45、HLA-DR,其中CD73、CD90、CD105是MSCs表達的表面分子。此外,Parolini等[8]報道hAMSCs低表達主要組織相容性Ⅰ類抗原(HLA-A、HLA-B、HLA-C),同時也低表達共刺激分子(CD80、CD83、CD86、CD40L等);且本實驗表明hAMSCs低表達免疫因子CD14及主要組織相容性Ⅱ類抗原HLA-DR,說明hAMSCs具有低免疫原性,不引起同種或異種淋巴細胞增殖反應,作為組織工程細胞來源或用于組織、器官損傷修復時不會引起免疫排斥反應。
本研究結果顯示,hAMSCs在不同的定向誘導條件下均表現出了韌帶特異性增加。各誘導組韌帶特異性蛋白Ⅰ型膠原、Ⅲ型膠原、TNC表達較未誘導組顯著增高,差異有統計學意義(P<0.05)。誘導7、14 d時A組Ⅰ型膠原mRNA相對表達量最低(P<0.001);誘導14 d時C組Ⅲ型膠原mRNA相對表達量最低(P<0.001);14、21 d時C組TNC mRNA相對表達量最高(P<0.05)。A、C組Ⅰ型膠原、TNC及C組Ⅲ型膠原mRNA相對表達量隨時間增加呈逐漸上調趨勢(P<0.05)。SRB結果表明hAMSCs經誘導后細胞增殖能力不變。有文獻報道,TGF-β1可促進細胞增殖、分化,明顯提高膠原蛋白分泌能力[9-11]。Kondo等[12]的兔前交叉韌帶損傷修復實驗結果顯示,TGF-β1用于損傷的前交叉韌帶可促進韌帶愈合,明顯提高韌帶的生物力學性能。Kobayashi等[13]報道bFGF可通過增加血管分布提高前交叉韌帶愈合能力;周盛源等[14]研究表明轉染bFGF基因的BMSCs可顯著提高韌帶修復能力及修復強度。本課題組既往研究表明[15],經過TGF-β1和bFGF誘導后,BMSCs活性、增殖能力及韌帶特異性均顯著提高。本研究結果與該結論一致,說明hAMSCs具有MSCs的特性,可在TGF-β1和bFGF誘導下向韌帶細胞分化。
流式細胞術結果表明hAMSCs高表達CD44,CD44即HA受體。HA是細胞外基質的重要組成成分之一,可促進血管生成,減輕炎性反應,促進Ⅲ型膠原合成[16]。本實驗實時熒光定量PCR檢測結果顯示,誘導7 d時B組Ⅰ型膠原、Ⅲ型膠原、TNC基因表達高于A、C組(P<0.001),21 d時B組Ⅲ型膠原基因表達高于A、C組(P<0.05)。提示HA體外誘導hAMSCs 7 d時,韌帶特異性蛋白相關基因表達上調高于單獨應用TGF-β1、bFGF組及單純應用HA組。免疫組織化學染色結果表明,HA聯合TGF-β1、bFGF可促進hAMSCs表達韌帶特異性蛋白Ⅰ型膠原、Ⅲ型膠原、TNC,且優于HA和TGF-β1、bFGF單獨應用組。HA具有較強的吸水性和高度黏滯性,可防止生長因子過快地擴散和降解,使生長因子在局部保持一定濃度緩慢釋放[17],這可能是HA聯合TGF-β1、bFGF誘導后韌帶特異性蛋白表達量更高的原因。因此我們認為hAMSCs經過TGF-β1、bFGF和HA單獨或聯合誘導后,均可向韌帶細胞分化。在HA的作用下,TGF-β1、bFGF的誘導效果得到了一定程度提高。
綜上述,hAMSCs具有MSCs的表型和特點,具有良好的增殖潛能和低免疫原性,經過體外誘導后韌帶特異性蛋白分泌增加,相關基因表達上調,可作為韌帶組織工程種子細胞來源。但hAMSCs與支架復合的能力以及植入體內后分泌韌帶特異性蛋白的能力等,還有待進一步實驗研究。