引用本文: 方超, 徐祝軍, 楊民, 謝加兵, 李全輝. 不同時間點應用甲氨蝶呤對大鼠脊髓損傷后神經細胞凋亡的影響. 中國修復重建外科雜志, 2016, 30(4): 466-472. doi: 10.7507/1002-1892.20160094 復制
版權信息: ?四川大學華西醫院華西期刊社《中國修復重建外科雜志》版權所有,未經授權不得轉載、改編
隨著醫療手段的發展,脊柱手術技術得到了顯著提高,但醫源性脊髓損傷(spinal cord injury,SCI)仍可能發生。SCI后繼發性損傷引起的炎癥一般在傷后迅速發生,導致一系列組織水腫出血及壞死反應,其中涉及多種炎性細胞滲透浸潤,包括固有神經膠質細胞、中性粒細胞、樹突狀細胞等[1],最終導致以神經元和神經膠質細胞凋亡為主的病理改變。繼發性損傷引起的進行性級聯危害遠高于原發性損傷,因此提早干預繼發性損傷的發生與進展,有效調控細胞凋亡具有重要意義[2]。
甲氨喋呤(methotrexate,MTX)作為一種葉酸拮抗劑,是治療血液系統惡性腫瘤以及自身免疫性疾病的傳統藥物。其藥理機制呈現抗炎、細胞毒性、免疫調節等多樣性,且價格低廉、耐受性好、安全性高[3]。研究表明,與傳統甲潑尼龍治療SCI相比,低劑量MTX具有更穩定、有效的抗炎和抑制凋亡作用[4-7],但其最佳給藥時機及作用機制尚未明確。為此,本研究采用大鼠SCI模型,通過觀察不同時間點給予低劑量MTX干預后神經細胞凋亡的差異,探討合適給藥時機,為MTX臨床應用奠定理論基礎。
1 材料與方法
1.1 實驗動物及主要試劑、儀器
健康成年雄性SD大鼠120只,體質量247~286 g,由安徽省動物實驗中心提供,實驗開始前適應性飼養1周。注射用MTX(5 mg/支;江蘇恒瑞醫藥股份有限公司);一次性靜脈留置針(蘇州林華醫療器械有限公司)。半胱氨酸天冬氨酸蛋白酶3(Caspase-3)免疫組織化學檢測試劑盒、TUNEL細胞凋亡檢測試劑盒(武漢博士德生物工程有限公司)。CX31光學顯微鏡(Olympus公司,日本)。
1.2 實驗分組及方法
將120只SD大鼠按隨機數字表法分為4組,每組30只,分別為假手術組(A組)、對照組(B組)、MTX治療組(C組)和MTX預防組(D組)。各組大鼠經腹腔注射1%戊巴比妥鈉(0.45 mg/kg)麻醉,以T13棘突為中心,作后正中縱切口,逐層切開組織并顯露椎板。A組僅行椎板切除;B、C、D組切除椎板暴露T13頭端硬膜囊(腰膨大上端),放置墊片于硬膜囊表面,將重量為5 g的克氏針從60 mm高處垂直落下制備SCI模型。SCI造模成功標準:大鼠尾部出現痙攣性顫動,軀體回縮,雙下肢癱瘓。參照既往研究[2, 8-9],C組于術后1、6、12、18、24 h,D組 于術前30min及術后6、12、18、24 h通過一次性 靜脈 留置針經尾靜脈注射MTX(0.5 mg/kg)。A、B組 于術后1、6、12、18、24 h同上法注射等量生理鹽水。
術后大鼠分籠飼養,隔日更換墊料,標準飼料喂養,自由飲水,人工輔助排便、排尿,每天3次。
1.3 觀測指標
1.3.1 一般情況
術后觀察各組大鼠存活情況,包括切口愈合、后肢運動恢復以及排便、排尿等。
1.3.2 神經功能評估
術后1、3、7、14、21 d各組隨機取5只大鼠,于清晨、空腹、排空膀胱狀態下進行BBB評分[10],取均值。
1.3.3 組織學觀察
神經功能評估后,大鼠心臟以4%多聚甲醛灌注取材制作標本。原切口入路剝離脊柱,以造模打擊部位為中心,取上、下段共1.5cm長脊髓組織,置于甲醛溶液中固定72 h后,石蠟包埋,連續冠狀切片,片厚4 μm,每個標本連續切片9 張,取其中3張行HE染色,光鏡下觀察脊髓組織形態學變化。
1.3.4 免疫組織化學染色觀察
各時間點各組每個標本取3張切片,按照Caspase-3免疫組織化學檢測試劑盒說明書操作。具體方法:90℃烤片,脫蠟至水,3%H2O2滅活內源性酶,高溫修復,滴加5%牛血清白蛋白封閉液和一抗(Caspase-3抗體),以PBS代替一抗作對照,4℃孵育過夜,隔日滴加二抗,37℃溫箱封閉30 min,加入鏈霉卵白素+辣根過氧化物酶標記生物素,37℃溫箱孵育20 min,室溫DAB顯色。以上各步驟均置于保濕盒中用0.01mol/L PBS漂洗5 min×3次,蘇木素復染,蒸餾水沖洗,梯度乙醇逐級脫水,二甲苯透明,中性樹膠封片。光鏡下觀察脊髓組織變化,以細胞質和/或細胞核呈棕黃色著色為陽性細胞,每張切片分別于灰質、白質各取5個視野(×400),計數陽性細胞數,取均值。
1.3.5 TUNEL標記觀察
各時間點各組每個標本取3張切片,按照TUNEL細胞凋亡檢測試劑盒說明書進行標記,光鏡下觀察脊髓組織變化。TUNEL陽性細胞呈棕褐色或棕黃色,胞核固縮顆粒深染,且結構形態不規則,散在分布于脊髓灰質中。每張切片于灰質取5個視野(×400),計數陽性細胞數,取均值。
1.4 統計學方法
采用SPSS18.0統計軟件進行分析。數據以均數±標準差表示,組間比較采用單因素方差分析,兩兩比較采用LSD檢驗;采用直線相關分析對同組內各時間點Caspase-3及TUNEL陽性細胞數進行相關性分析;檢驗水準α=0.05。
2 結果
2.1 一般情況
實驗過程中共死亡10只大鼠,其中B組4只,C、D組各3只。造模過程中死亡4只(B組3只、D組1只),其余大鼠次日發生切口感染死亡。為保證各組樣本量以及術后各時間點取材樣本量相同,最終排除死亡大鼠后,將各組實際樣本量確定為25只。
B、C、D組大鼠造模后雙后肢無法自主活動;1~3 d 后12只大鼠出現排尿及排便困難,及時給予人工輔助排便、排尿;10 d后11只已恢復自主排泄,雙后肢功能良好,剩余1只大鼠未恢復。大鼠切口均在術后7 d內愈合。
2.2 神經功能評估
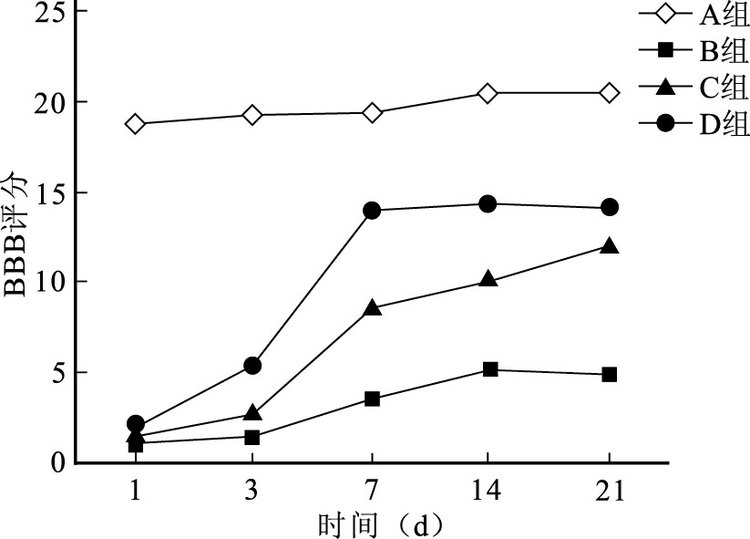
組內比較:A組各時間點BBB評分無明顯變化,差異無統計學意義(P>0.05)。B、C、D組評分隨時間延長呈總體增高趨勢;其中,B組各時間點比較差異無統計學意義(P>0.05);C組于21 d內持續升高,各時間點比較差異均有統計學意義(P<0.05);D組在7 d后維持高水平,除14、21 d外其他各時間點間比較差異均有統計學意義(P<0.05)。
組間比較:各時間點A組BBB評分均明顯高于B、C、D組,比較差異有統計學意義(P<0.05)。術后1 d,B、C、D組評分比較差異無統計學意義(P>0.05);從3 d開始C、D組BBB評分明顯高于B組,差異有統計學意義(P<0.05);而D組從3 d開始均高于C組,除21 d差異無統計學意義(P>0.05)外,其余各時間點比較差異均有統計學意義(P<0.05)。見圖 1。
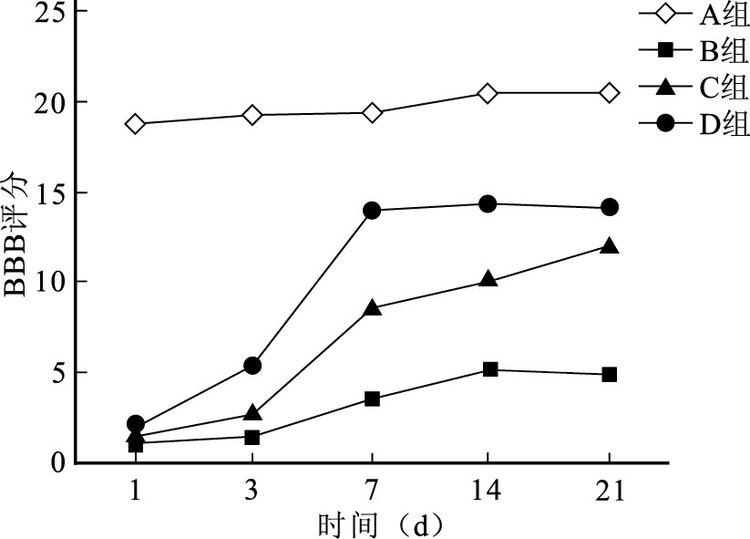 圖1
術后各時間點各組BBB評分比較
Figure1.
Comparison of BBB score among groups at different time points after injury
圖1
術后各時間點各組BBB評分比較
Figure1.
Comparison of BBB score among groups at different time points after injury
2.3 組織學觀察
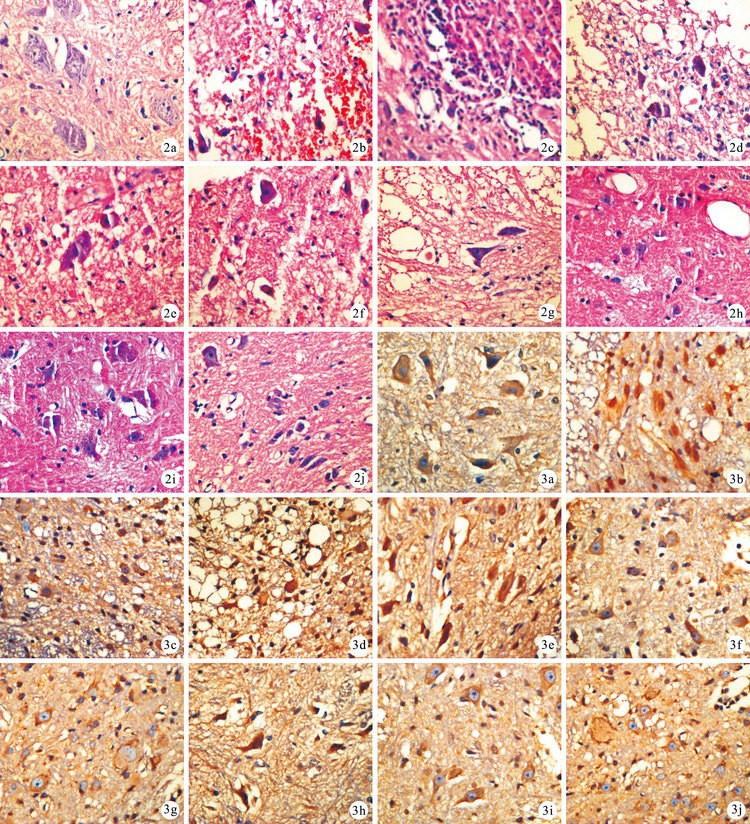
A組:術后各時間點表現基本相同,脊髓灰、白質界限清晰,質地均勻,神經元細胞豐富,體積大,核仁明顯,未見明顯出血水腫及壞死。B組:術后1d脊髓灰、白質界限消失,多處出血壞死,染色增強;3d出血壞死加重,灰、白質界限無法辨認,損傷中心炎性細胞浸潤,神經元核固縮、溶解進一步加重,數量明顯減少,小膠質細胞片狀增生;7 d仍有明顯局灶性出血,核濃聚深染,小膠質細胞浸潤;14、21 d出血范圍基本穩定,較7 d無加重。C組:各時間點脊髓損傷程度均較B組減輕;術后1 d脊髓灰、白質界限模糊,局灶性出血;3 d局灶性出血程度加重,少量炎性細胞及小膠質細胞增生,神經元細胞體積減小,核固縮,染色加深,有溶解改變;7 d出血程度較前減少;14、21 d出血趨于穩定,未見加重。D組:術后各時間點脊髓損傷程度均較B、C組減輕;術后1d有部分局灶性出血,小膠質細胞片狀浸潤;3 d脊髓灰、白質未見出血、壞死,神經元體積縮小,局部小膠質細胞浸潤; 7d開始出血范圍減小;14、21d,出血范圍基本穩定,神經元變性壞死程度無加重。見圖 2。
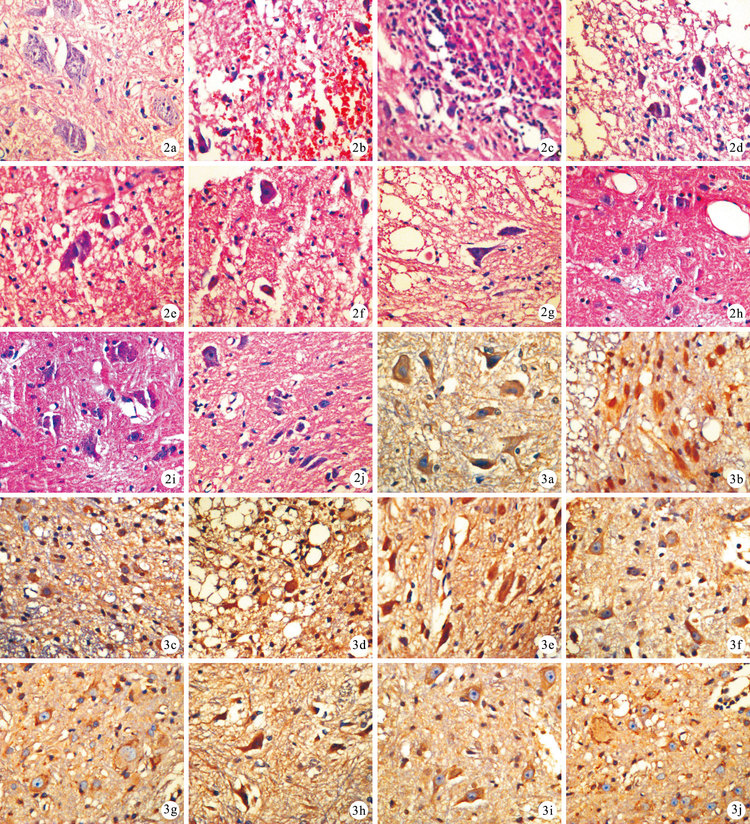 圖2
術后各時間點各組組織學觀察(HE×400) ? A組術后3 d ? B組術后1 d ? C組術后1 d ? D組術后1 d ? B組術后3d ? C組術后3 d ? D組術后3 d ? B組術后14 d ? C組術后14 d ? D組術后14 d 圖 3 術后各時間點各組免疫組織化學染色觀察Caspase-3的表達(×400) ? A組術后3 d ? B組術后1 d ? C組術后1 d ? D組術后1 d ? B組術后3 d ? C組術后3 d ? D組術后3 d ? B組術后14 d ? C組術后14 d ? D組術后14 d
Figure2.
Histological observation in each group at each time point after injury (HE×400) ? Group A at 3 days ? Group B at 1 day ? Group C at 1 day ? Group D at 1 day ? Group B at 3 days ? Group C at 3 days ? Group D at 3 days ? Group B at 14 days ? Group C at 14 days ? Group D at 14 days Fig. 3 Immunohistochemical staining observation for the Caspase-3 expression in each group at each time point after injury (×400) ? Group A at 3 days ? Group B at 1 day ? Group C at 1 day ? Group D at 1 day ? Group B at 3 days ? Group C at 3 days ? Group D at 3 days ? Group B at 14 days ? Group C at 14 days ? Group D at 14 days
圖2
術后各時間點各組組織學觀察(HE×400) ? A組術后3 d ? B組術后1 d ? C組術后1 d ? D組術后1 d ? B組術后3d ? C組術后3 d ? D組術后3 d ? B組術后14 d ? C組術后14 d ? D組術后14 d 圖 3 術后各時間點各組免疫組織化學染色觀察Caspase-3的表達(×400) ? A組術后3 d ? B組術后1 d ? C組術后1 d ? D組術后1 d ? B組術后3 d ? C組術后3 d ? D組術后3 d ? B組術后14 d ? C組術后14 d ? D組術后14 d
Figure2.
Histological observation in each group at each time point after injury (HE×400) ? Group A at 3 days ? Group B at 1 day ? Group C at 1 day ? Group D at 1 day ? Group B at 3 days ? Group C at 3 days ? Group D at 3 days ? Group B at 14 days ? Group C at 14 days ? Group D at 14 days Fig. 3 Immunohistochemical staining observation for the Caspase-3 expression in each group at each time point after injury (×400) ? Group A at 3 days ? Group B at 1 day ? Group C at 1 day ? Group D at 1 day ? Group B at 3 days ? Group C at 3 days ? Group D at 3 days ? Group B at 14 days ? Group C at 14 days ? Group D at 14 days
2.4 Caspase-3免疫組織化學染色及TUNEL標記觀察
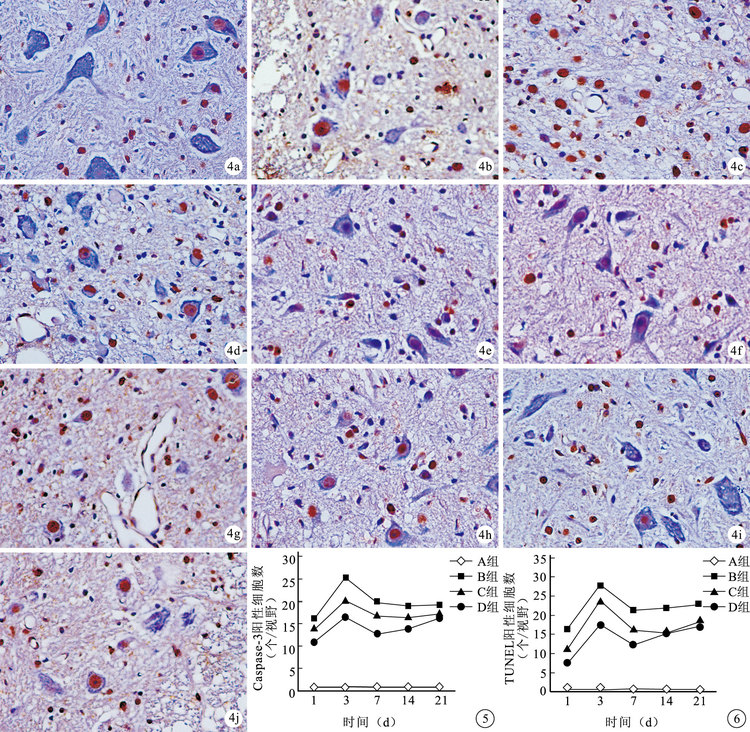
組內比較:鏡下觀察,A組各時間點少見Caspase-3及TUNEL陽性細胞,差異無統計學意義(P>0.05)。B、C、D組各時間點均可見Caspase-3及TUNEL陽性細胞,主要分布于脊髓灰質。術后1d陽性細胞數逐漸增加,至3 d達峰值后下降,7 d后呈緩慢上升趨勢。B、C組除14、21 d間比較差異無統計學意義(P>0.05)外,其余各時間點間比較差異均有統計學意義(P<0.05)。D組各時間點間比較差異均有統計學意義(P<0.05)。
組間比較:各時間點B、C、D組Caspase-3及TUNEL陽性細胞數均顯著多于A組,B組多于C、D組,比較差異有統計學意義(P<0.05)。C組Caspase-3陽性細胞數均多于D組,其中3、7、14 d比較差異有統計學意義(P<0.05);而C組TUNEL陽性細胞數僅3、7 d顯著多于D組,差異有統計學意義(P<0.05)。見圖 3~6。
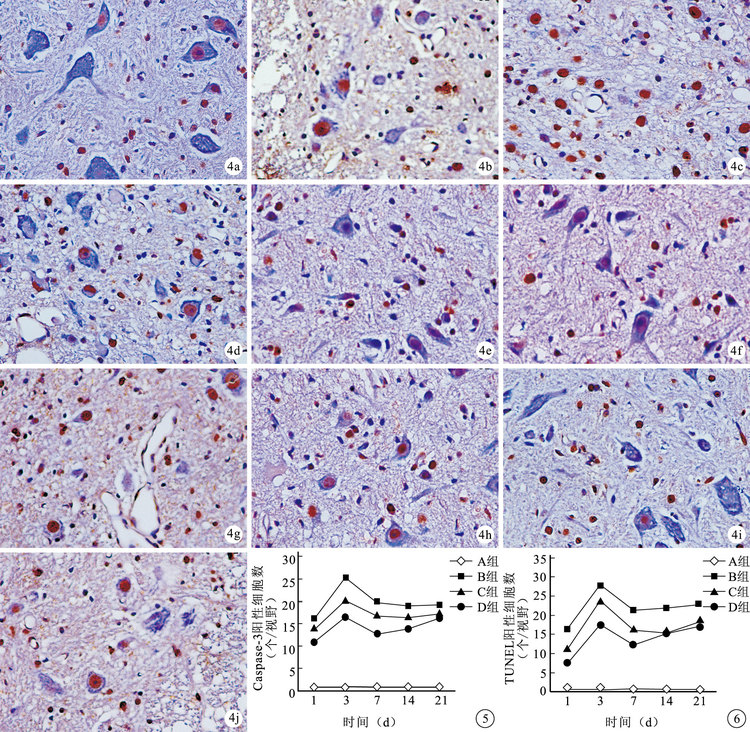 圖4
術后各時間點各組TUNEL標記觀察(×400) ? A組術后3 d ? B組術后1 d ? C組術后1 d ? D組術后1 d ? B組術后3d ? C組術后3 d ? D組術后3 d ? B組術后14 d ? C組術后14 d ? D組術后14 d 圖 5 術后各時間點各組Caspase-3陽性細胞數比較 圖 6 術后各時間點各組TUNEL陽性細胞數比較
Figure4.
TUNEL staining observation in each group at each time point after injury (×400) ? Group A at 3 days ? Group B at 1 day ? Group C at 1 day ? Group D at 1 day ? Group B at 3 days ? Group C at 3 days ? Group D at 3 days ? Group B at 14 days ? Group C at 14 days ? Group D at 14 days Fig. 5 The number of Caspase-3 positive cells in each group at different time points Fig. 6 The number of TUNEL positive cells in each group at different time points
圖4
術后各時間點各組TUNEL標記觀察(×400) ? A組術后3 d ? B組術后1 d ? C組術后1 d ? D組術后1 d ? B組術后3d ? C組術后3 d ? D組術后3 d ? B組術后14 d ? C組術后14 d ? D組術后14 d 圖 5 術后各時間點各組Caspase-3陽性細胞數比較 圖 6 術后各時間點各組TUNEL陽性細胞數比較
Figure4.
TUNEL staining observation in each group at each time point after injury (×400) ? Group A at 3 days ? Group B at 1 day ? Group C at 1 day ? Group D at 1 day ? Group B at 3 days ? Group C at 3 days ? Group D at 3 days ? Group B at 14 days ? Group C at 14 days ? Group D at 14 days Fig. 5 The number of Caspase-3 positive cells in each group at different time points Fig. 6 The number of TUNEL positive cells in each group at different time points
術后1、3、7、14、21 d,B、C、D組組內Caspase-3、TUNEL陽性細胞數均成正相關。見表 1。
3 討論
SCI后繼發性損傷引起的神經細胞凋亡主要由Caspase家族成員介導的蛋白酶級聯反應完成,其中Caspase-3是一種IL轉換酶,它是多種凋亡途徑的共同下游效應部分,被認為是細胞凋亡過程中最重要的蛋白酶,在凋亡和炎癥通路中起主導作用[11-12]。Yilmaz等[13]研究證實Caspase-3是一種在組織缺血再灌注損傷過程中反映細胞凋亡的可靠標記物,并且其表達水平隨著缺血再灌注損傷的加重而增高。Kertmen等[14]發現無論在血漿還是在SCI組織中,低劑量MTX均能夠降低Caspase-3的表達水平,從而證實其有效的抗凋亡作用。
本研究發現術后不同時間點Caspase-3和TUNEL陽性細胞均成正相關,二者在造模術后表達迅速增多,3 d達峰值,7 d后基本維持平穩水平,并且在21d仍有表達,提示細胞凋亡過程伴隨Caspase-3表達,與既往文獻報道[12, 15]結論一致,說明大鼠SCI后持續存在Caspase-3介導的神經細胞凋亡現象。細胞凋亡是一個主動而有序的過程,Caspase-3不僅參與凋亡啟動,而且在凋亡的執行階段,對全部或部分關鍵蛋白負責酶切[15]。從SCI至Caspase-3活化這段時間是SCI干預細胞凋亡、減輕繼發性損傷的時間窗,基于Caspase-3表達與凋亡的同步性,可以認為選擇性阻止Caspase-3 表達是防治脊髓繼發損傷的有效環節。D組在術前30 min給藥1 次,術后1~7 d內細胞凋亡程度均較C組明顯減輕,提示SCI前預防性應用低劑量MTX效果優于損傷后的治療性應用。其機制可能是預防使用MTX能使藥物更早作用于損傷部位,增加脊髓組織的藥物預濃度,提前形成藥物保護屏障,更及時地抑制和清除氧自由基所介導的脂質過氧化反應[16],穩定細胞膜結構,減輕炎性壞死,抑制細胞凋亡等,從而有效阻斷SCI繼發性損傷進展,改善神經運動功能。但14~21 d時C、D組凋亡程度逐漸趨于穩定水平,兩組比較差異無統計學意義。其機制可能是由于本研究選擇低劑量MTX給藥,加之術前僅1次給藥難以在術后長時間維持預防藥物濃度,隨著藥物濃度從峰值減退,屏障作用逐漸消失,抑制凋亡作用趨于同一水平。
此外,低劑量MTX抑制了各種炎性反應中淋巴細胞的增殖和中性粒細胞的滲透浸潤。有研究表明,低劑量MTX對繼發性SCI的保護機制主要是通過抑制嘌呤/嘧啶合成或促炎性細胞因子如IL-1、IL-4、一氧化氮、TNF-α表達,從而促進腺苷的釋放,提高了炎性部位腺苷的聚集,腺苷與相應受體結合能夠抑制淋巴細胞增殖、中性粒細胞趨化黏附、降低血漿中的免疫球蛋白水平[17];并且激動T細胞凋亡其代謝產物,抑制或減少神經細胞凋亡[18];腺苷還可通過促進神經元突起生長和神經再生而對SCI起到保護作用,早期應用腺苷受體激動劑可通過調節抗炎和抗凋亡通路使得脊髓免受缺血再灌注損傷[19]。
綜上述,本研究通過觀察不同時間點應用低劑量MTX對大鼠SCI后神經細胞凋亡的影響,結果顯示MTX預防性給藥在術后7 d內藥物效應相對于治療性給藥呈持續升高趨勢,提示其在防治SCI方面具有良好的神經保護效應和安全性。
隨著醫療手段的發展,脊柱手術技術得到了顯著提高,但醫源性脊髓損傷(spinal cord injury,SCI)仍可能發生。SCI后繼發性損傷引起的炎癥一般在傷后迅速發生,導致一系列組織水腫出血及壞死反應,其中涉及多種炎性細胞滲透浸潤,包括固有神經膠質細胞、中性粒細胞、樹突狀細胞等[1],最終導致以神經元和神經膠質細胞凋亡為主的病理改變。繼發性損傷引起的進行性級聯危害遠高于原發性損傷,因此提早干預繼發性損傷的發生與進展,有效調控細胞凋亡具有重要意義[2]。
甲氨喋呤(methotrexate,MTX)作為一種葉酸拮抗劑,是治療血液系統惡性腫瘤以及自身免疫性疾病的傳統藥物。其藥理機制呈現抗炎、細胞毒性、免疫調節等多樣性,且價格低廉、耐受性好、安全性高[3]。研究表明,與傳統甲潑尼龍治療SCI相比,低劑量MTX具有更穩定、有效的抗炎和抑制凋亡作用[4-7],但其最佳給藥時機及作用機制尚未明確。為此,本研究采用大鼠SCI模型,通過觀察不同時間點給予低劑量MTX干預后神經細胞凋亡的差異,探討合適給藥時機,為MTX臨床應用奠定理論基礎。
1 材料與方法
1.1 實驗動物及主要試劑、儀器
健康成年雄性SD大鼠120只,體質量247~286 g,由安徽省動物實驗中心提供,實驗開始前適應性飼養1周。注射用MTX(5 mg/支;江蘇恒瑞醫藥股份有限公司);一次性靜脈留置針(蘇州林華醫療器械有限公司)。半胱氨酸天冬氨酸蛋白酶3(Caspase-3)免疫組織化學檢測試劑盒、TUNEL細胞凋亡檢測試劑盒(武漢博士德生物工程有限公司)。CX31光學顯微鏡(Olympus公司,日本)。
1.2 實驗分組及方法
將120只SD大鼠按隨機數字表法分為4組,每組30只,分別為假手術組(A組)、對照組(B組)、MTX治療組(C組)和MTX預防組(D組)。各組大鼠經腹腔注射1%戊巴比妥鈉(0.45 mg/kg)麻醉,以T13棘突為中心,作后正中縱切口,逐層切開組織并顯露椎板。A組僅行椎板切除;B、C、D組切除椎板暴露T13頭端硬膜囊(腰膨大上端),放置墊片于硬膜囊表面,將重量為5 g的克氏針從60 mm高處垂直落下制備SCI模型。SCI造模成功標準:大鼠尾部出現痙攣性顫動,軀體回縮,雙下肢癱瘓。參照既往研究[2, 8-9],C組于術后1、6、12、18、24 h,D組 于術前30min及術后6、12、18、24 h通過一次性 靜脈 留置針經尾靜脈注射MTX(0.5 mg/kg)。A、B組 于術后1、6、12、18、24 h同上法注射等量生理鹽水。
術后大鼠分籠飼養,隔日更換墊料,標準飼料喂養,自由飲水,人工輔助排便、排尿,每天3次。
1.3 觀測指標
1.3.1 一般情況
術后觀察各組大鼠存活情況,包括切口愈合、后肢運動恢復以及排便、排尿等。
1.3.2 神經功能評估
術后1、3、7、14、21 d各組隨機取5只大鼠,于清晨、空腹、排空膀胱狀態下進行BBB評分[10],取均值。
1.3.3 組織學觀察
神經功能評估后,大鼠心臟以4%多聚甲醛灌注取材制作標本。原切口入路剝離脊柱,以造模打擊部位為中心,取上、下段共1.5cm長脊髓組織,置于甲醛溶液中固定72 h后,石蠟包埋,連續冠狀切片,片厚4 μm,每個標本連續切片9 張,取其中3張行HE染色,光鏡下觀察脊髓組織形態學變化。
1.3.4 免疫組織化學染色觀察
各時間點各組每個標本取3張切片,按照Caspase-3免疫組織化學檢測試劑盒說明書操作。具體方法:90℃烤片,脫蠟至水,3%H2O2滅活內源性酶,高溫修復,滴加5%牛血清白蛋白封閉液和一抗(Caspase-3抗體),以PBS代替一抗作對照,4℃孵育過夜,隔日滴加二抗,37℃溫箱封閉30 min,加入鏈霉卵白素+辣根過氧化物酶標記生物素,37℃溫箱孵育20 min,室溫DAB顯色。以上各步驟均置于保濕盒中用0.01mol/L PBS漂洗5 min×3次,蘇木素復染,蒸餾水沖洗,梯度乙醇逐級脫水,二甲苯透明,中性樹膠封片。光鏡下觀察脊髓組織變化,以細胞質和/或細胞核呈棕黃色著色為陽性細胞,每張切片分別于灰質、白質各取5個視野(×400),計數陽性細胞數,取均值。
1.3.5 TUNEL標記觀察
各時間點各組每個標本取3張切片,按照TUNEL細胞凋亡檢測試劑盒說明書進行標記,光鏡下觀察脊髓組織變化。TUNEL陽性細胞呈棕褐色或棕黃色,胞核固縮顆粒深染,且結構形態不規則,散在分布于脊髓灰質中。每張切片于灰質取5個視野(×400),計數陽性細胞數,取均值。
1.4 統計學方法
采用SPSS18.0統計軟件進行分析。數據以均數±標準差表示,組間比較采用單因素方差分析,兩兩比較采用LSD檢驗;采用直線相關分析對同組內各時間點Caspase-3及TUNEL陽性細胞數進行相關性分析;檢驗水準α=0.05。
2 結果
2.1 一般情況
實驗過程中共死亡10只大鼠,其中B組4只,C、D組各3只。造模過程中死亡4只(B組3只、D組1只),其余大鼠次日發生切口感染死亡。為保證各組樣本量以及術后各時間點取材樣本量相同,最終排除死亡大鼠后,將各組實際樣本量確定為25只。
B、C、D組大鼠造模后雙后肢無法自主活動;1~3 d 后12只大鼠出現排尿及排便困難,及時給予人工輔助排便、排尿;10 d后11只已恢復自主排泄,雙后肢功能良好,剩余1只大鼠未恢復。大鼠切口均在術后7 d內愈合。
2.2 神經功能評估
組內比較:A組各時間點BBB評分無明顯變化,差異無統計學意義(P>0.05)。B、C、D組評分隨時間延長呈總體增高趨勢;其中,B組各時間點比較差異無統計學意義(P>0.05);C組于21 d內持續升高,各時間點比較差異均有統計學意義(P<0.05);D組在7 d后維持高水平,除14、21 d外其他各時間點間比較差異均有統計學意義(P<0.05)。
組間比較:各時間點A組BBB評分均明顯高于B、C、D組,比較差異有統計學意義(P<0.05)。術后1 d,B、C、D組評分比較差異無統計學意義(P>0.05);從3 d開始C、D組BBB評分明顯高于B組,差異有統計學意義(P<0.05);而D組從3 d開始均高于C組,除21 d差異無統計學意義(P>0.05)外,其余各時間點比較差異均有統計學意義(P<0.05)。見圖 1。
 圖1
術后各時間點各組BBB評分比較
Figure1.
Comparison of BBB score among groups at different time points after injury
圖1
術后各時間點各組BBB評分比較
Figure1.
Comparison of BBB score among groups at different time points after injury
2.3 組織學觀察
A組:術后各時間點表現基本相同,脊髓灰、白質界限清晰,質地均勻,神經元細胞豐富,體積大,核仁明顯,未見明顯出血水腫及壞死。B組:術后1d脊髓灰、白質界限消失,多處出血壞死,染色增強;3d出血壞死加重,灰、白質界限無法辨認,損傷中心炎性細胞浸潤,神經元核固縮、溶解進一步加重,數量明顯減少,小膠質細胞片狀增生;7 d仍有明顯局灶性出血,核濃聚深染,小膠質細胞浸潤;14、21 d出血范圍基本穩定,較7 d無加重。C組:各時間點脊髓損傷程度均較B組減輕;術后1 d脊髓灰、白質界限模糊,局灶性出血;3 d局灶性出血程度加重,少量炎性細胞及小膠質細胞增生,神經元細胞體積減小,核固縮,染色加深,有溶解改變;7 d出血程度較前減少;14、21 d出血趨于穩定,未見加重。D組:術后各時間點脊髓損傷程度均較B、C組減輕;術后1d有部分局灶性出血,小膠質細胞片狀浸潤;3 d脊髓灰、白質未見出血、壞死,神經元體積縮小,局部小膠質細胞浸潤; 7d開始出血范圍減小;14、21d,出血范圍基本穩定,神經元變性壞死程度無加重。見圖 2。
 圖2
術后各時間點各組組織學觀察(HE×400) ? A組術后3 d ? B組術后1 d ? C組術后1 d ? D組術后1 d ? B組術后3d ? C組術后3 d ? D組術后3 d ? B組術后14 d ? C組術后14 d ? D組術后14 d 圖 3 術后各時間點各組免疫組織化學染色觀察Caspase-3的表達(×400) ? A組術后3 d ? B組術后1 d ? C組術后1 d ? D組術后1 d ? B組術后3 d ? C組術后3 d ? D組術后3 d ? B組術后14 d ? C組術后14 d ? D組術后14 d
Figure2.
Histological observation in each group at each time point after injury (HE×400) ? Group A at 3 days ? Group B at 1 day ? Group C at 1 day ? Group D at 1 day ? Group B at 3 days ? Group C at 3 days ? Group D at 3 days ? Group B at 14 days ? Group C at 14 days ? Group D at 14 days Fig. 3 Immunohistochemical staining observation for the Caspase-3 expression in each group at each time point after injury (×400) ? Group A at 3 days ? Group B at 1 day ? Group C at 1 day ? Group D at 1 day ? Group B at 3 days ? Group C at 3 days ? Group D at 3 days ? Group B at 14 days ? Group C at 14 days ? Group D at 14 days
圖2
術后各時間點各組組織學觀察(HE×400) ? A組術后3 d ? B組術后1 d ? C組術后1 d ? D組術后1 d ? B組術后3d ? C組術后3 d ? D組術后3 d ? B組術后14 d ? C組術后14 d ? D組術后14 d 圖 3 術后各時間點各組免疫組織化學染色觀察Caspase-3的表達(×400) ? A組術后3 d ? B組術后1 d ? C組術后1 d ? D組術后1 d ? B組術后3 d ? C組術后3 d ? D組術后3 d ? B組術后14 d ? C組術后14 d ? D組術后14 d
Figure2.
Histological observation in each group at each time point after injury (HE×400) ? Group A at 3 days ? Group B at 1 day ? Group C at 1 day ? Group D at 1 day ? Group B at 3 days ? Group C at 3 days ? Group D at 3 days ? Group B at 14 days ? Group C at 14 days ? Group D at 14 days Fig. 3 Immunohistochemical staining observation for the Caspase-3 expression in each group at each time point after injury (×400) ? Group A at 3 days ? Group B at 1 day ? Group C at 1 day ? Group D at 1 day ? Group B at 3 days ? Group C at 3 days ? Group D at 3 days ? Group B at 14 days ? Group C at 14 days ? Group D at 14 days
2.4 Caspase-3免疫組織化學染色及TUNEL標記觀察
組內比較:鏡下觀察,A組各時間點少見Caspase-3及TUNEL陽性細胞,差異無統計學意義(P>0.05)。B、C、D組各時間點均可見Caspase-3及TUNEL陽性細胞,主要分布于脊髓灰質。術后1d陽性細胞數逐漸增加,至3 d達峰值后下降,7 d后呈緩慢上升趨勢。B、C組除14、21 d間比較差異無統計學意義(P>0.05)外,其余各時間點間比較差異均有統計學意義(P<0.05)。D組各時間點間比較差異均有統計學意義(P<0.05)。
組間比較:各時間點B、C、D組Caspase-3及TUNEL陽性細胞數均顯著多于A組,B組多于C、D組,比較差異有統計學意義(P<0.05)。C組Caspase-3陽性細胞數均多于D組,其中3、7、14 d比較差異有統計學意義(P<0.05);而C組TUNEL陽性細胞數僅3、7 d顯著多于D組,差異有統計學意義(P<0.05)。見圖 3~6。
 圖4
術后各時間點各組TUNEL標記觀察(×400) ? A組術后3 d ? B組術后1 d ? C組術后1 d ? D組術后1 d ? B組術后3d ? C組術后3 d ? D組術后3 d ? B組術后14 d ? C組術后14 d ? D組術后14 d 圖 5 術后各時間點各組Caspase-3陽性細胞數比較 圖 6 術后各時間點各組TUNEL陽性細胞數比較
Figure4.
TUNEL staining observation in each group at each time point after injury (×400) ? Group A at 3 days ? Group B at 1 day ? Group C at 1 day ? Group D at 1 day ? Group B at 3 days ? Group C at 3 days ? Group D at 3 days ? Group B at 14 days ? Group C at 14 days ? Group D at 14 days Fig. 5 The number of Caspase-3 positive cells in each group at different time points Fig. 6 The number of TUNEL positive cells in each group at different time points
圖4
術后各時間點各組TUNEL標記觀察(×400) ? A組術后3 d ? B組術后1 d ? C組術后1 d ? D組術后1 d ? B組術后3d ? C組術后3 d ? D組術后3 d ? B組術后14 d ? C組術后14 d ? D組術后14 d 圖 5 術后各時間點各組Caspase-3陽性細胞數比較 圖 6 術后各時間點各組TUNEL陽性細胞數比較
Figure4.
TUNEL staining observation in each group at each time point after injury (×400) ? Group A at 3 days ? Group B at 1 day ? Group C at 1 day ? Group D at 1 day ? Group B at 3 days ? Group C at 3 days ? Group D at 3 days ? Group B at 14 days ? Group C at 14 days ? Group D at 14 days Fig. 5 The number of Caspase-3 positive cells in each group at different time points Fig. 6 The number of TUNEL positive cells in each group at different time points
術后1、3、7、14、21 d,B、C、D組組內Caspase-3、TUNEL陽性細胞數均成正相關。見表 1。
3 討論
SCI后繼發性損傷引起的神經細胞凋亡主要由Caspase家族成員介導的蛋白酶級聯反應完成,其中Caspase-3是一種IL轉換酶,它是多種凋亡途徑的共同下游效應部分,被認為是細胞凋亡過程中最重要的蛋白酶,在凋亡和炎癥通路中起主導作用[11-12]。Yilmaz等[13]研究證實Caspase-3是一種在組織缺血再灌注損傷過程中反映細胞凋亡的可靠標記物,并且其表達水平隨著缺血再灌注損傷的加重而增高。Kertmen等[14]發現無論在血漿還是在SCI組織中,低劑量MTX均能夠降低Caspase-3的表達水平,從而證實其有效的抗凋亡作用。
本研究發現術后不同時間點Caspase-3和TUNEL陽性細胞均成正相關,二者在造模術后表達迅速增多,3 d達峰值,7 d后基本維持平穩水平,并且在21d仍有表達,提示細胞凋亡過程伴隨Caspase-3表達,與既往文獻報道[12, 15]結論一致,說明大鼠SCI后持續存在Caspase-3介導的神經細胞凋亡現象。細胞凋亡是一個主動而有序的過程,Caspase-3不僅參與凋亡啟動,而且在凋亡的執行階段,對全部或部分關鍵蛋白負責酶切[15]。從SCI至Caspase-3活化這段時間是SCI干預細胞凋亡、減輕繼發性損傷的時間窗,基于Caspase-3表達與凋亡的同步性,可以認為選擇性阻止Caspase-3 表達是防治脊髓繼發損傷的有效環節。D組在術前30 min給藥1 次,術后1~7 d內細胞凋亡程度均較C組明顯減輕,提示SCI前預防性應用低劑量MTX效果優于損傷后的治療性應用。其機制可能是預防使用MTX能使藥物更早作用于損傷部位,增加脊髓組織的藥物預濃度,提前形成藥物保護屏障,更及時地抑制和清除氧自由基所介導的脂質過氧化反應[16],穩定細胞膜結構,減輕炎性壞死,抑制細胞凋亡等,從而有效阻斷SCI繼發性損傷進展,改善神經運動功能。但14~21 d時C、D組凋亡程度逐漸趨于穩定水平,兩組比較差異無統計學意義。其機制可能是由于本研究選擇低劑量MTX給藥,加之術前僅1次給藥難以在術后長時間維持預防藥物濃度,隨著藥物濃度從峰值減退,屏障作用逐漸消失,抑制凋亡作用趨于同一水平。
此外,低劑量MTX抑制了各種炎性反應中淋巴細胞的增殖和中性粒細胞的滲透浸潤。有研究表明,低劑量MTX對繼發性SCI的保護機制主要是通過抑制嘌呤/嘧啶合成或促炎性細胞因子如IL-1、IL-4、一氧化氮、TNF-α表達,從而促進腺苷的釋放,提高了炎性部位腺苷的聚集,腺苷與相應受體結合能夠抑制淋巴細胞增殖、中性粒細胞趨化黏附、降低血漿中的免疫球蛋白水平[17];并且激動T細胞凋亡其代謝產物,抑制或減少神經細胞凋亡[18];腺苷還可通過促進神經元突起生長和神經再生而對SCI起到保護作用,早期應用腺苷受體激動劑可通過調節抗炎和抗凋亡通路使得脊髓免受缺血再灌注損傷[19]。
綜上述,本研究通過觀察不同時間點應用低劑量MTX對大鼠SCI后神經細胞凋亡的影響,結果顯示MTX預防性給藥在術后7 d內藥物效應相對于治療性給藥呈持續升高趨勢,提示其在防治SCI方面具有良好的神經保護效應和安全性。