引用本文: 林耀發, 宗海洋, 胡顯騰, 于榮華, 邵彎彎, 侯春林, 林浩東. 大鼠坐骨神經損傷后 Spastin 表達變化的實驗研究. 中國修復重建外科雜志, 2017, 31(1): 80-84. doi: 10.7507/1002-1892.201610093 復制
版權信息: ?四川大學華西醫院華西期刊社《中國修復重建外科雜志》版權所有,未經授權不得轉載、改編
周圍神經損傷在臨床上極為常見,其損傷后再生速度非常緩慢(約 1 mm/d),由于神經損傷修復的機制非常復雜,其治療一直是臨床上待解決的醫學難題之一[1-2]。目前,周圍神經損傷修復的主要方法包括顯微吻合、黏合劑、神經移植等[3-5],其目的都是引導再生的神經纖維長入遠端,與靶器官重新建立突觸聯系。但這種模式存在諸多弊端,如再生速度緩慢以至靶肌肉永久性失神經支配等[6]。有學者研究發現,在淡水鰲蝦、水蛭、線蟲中都存在一種新的神經軸突再生機制,這種軸突再生機制與傳統模式完全不同,是一種軸突融合的過程[7-8]。近年來有學者通過軸突融合的方法進行動物實驗修復周圍神經損傷,取得了比較滿意的即時修復效果,避免了瓦勒變性,取得了比傳統顯微外科縫合更好的治療效果[9-14]。但這些學者同時也指出,這種修復方法僅有 10%~15% 的遠端軸突避免了瓦勒變性,其原因可能是未修復細胞骨架[11-12]。而及時修復細胞骨架,使遠側斷端獲得胞體的物質運輸,是避免神經損傷的關鍵因素。因此,重建微管通道可能是軸突吻合成功的關鍵步驟。
Spastin 是目前已知的一種微管重塑蛋白,在軸突發育和芽突生成中扮演著重要角色,被認為可能是周圍神經損傷后軸突吻合中修復細胞骨架的關鍵分子[15-16]。本實驗觀察內源性 Spastin 在神經軸突損傷后再生過程中的表達變化,并探討其可能的作用機制,為后續采用軸突吻合途徑修復周圍神經損傷提供新的思路。
1 材料與方法
1.1 實驗動物及主要試劑、儀器
成年雄性 SD 大鼠 36 只,體質量(200±20)g,由上海西普爾-必凱動物實驗有限公司提供。
RNAiso Plus、RNA 逆轉錄試劑盒(Takara 公司,日本);SYBR Green Kit(ABI 公司,美國);RT-PCR 引物(蘇州金唯智生物科技有限公司);RIPA 裂解液Ⅲ(上海生工生物工程股份有限公司);BCA 蛋白定量試劑盒(Pierce 公司,美國);SDS-PAGE 上樣緩沖液(上海碧云天生物技術有限公司);兔抗鼠 Spastin 單克隆抗體(Bioss 公司,美國);兔抗鼠 GAPDH 單克隆抗體、山羊抗兔 IgG-辣根過氧化物酶二抗(Proteintech 公司,美國);聚偏氟乙烯膜、ECL 試劑盒(Millpore 公司,美國);顯影定影試劑盒(Beyotime 公司,美國)。顯微外科器械(寧波成和顯微外科器械公司);手術顯微鏡(上海精密儀器儀表有限公司);實時熒光定量 PCR 儀(ABI 公司,美國);蛋白電泳槽、凝膠成像分析儀(化學發光)、轉膜槽(Bio-Rad 公司,美國);JEM-1230 透射電鏡(JEOL 公司,日本)。
1.2 實驗分組
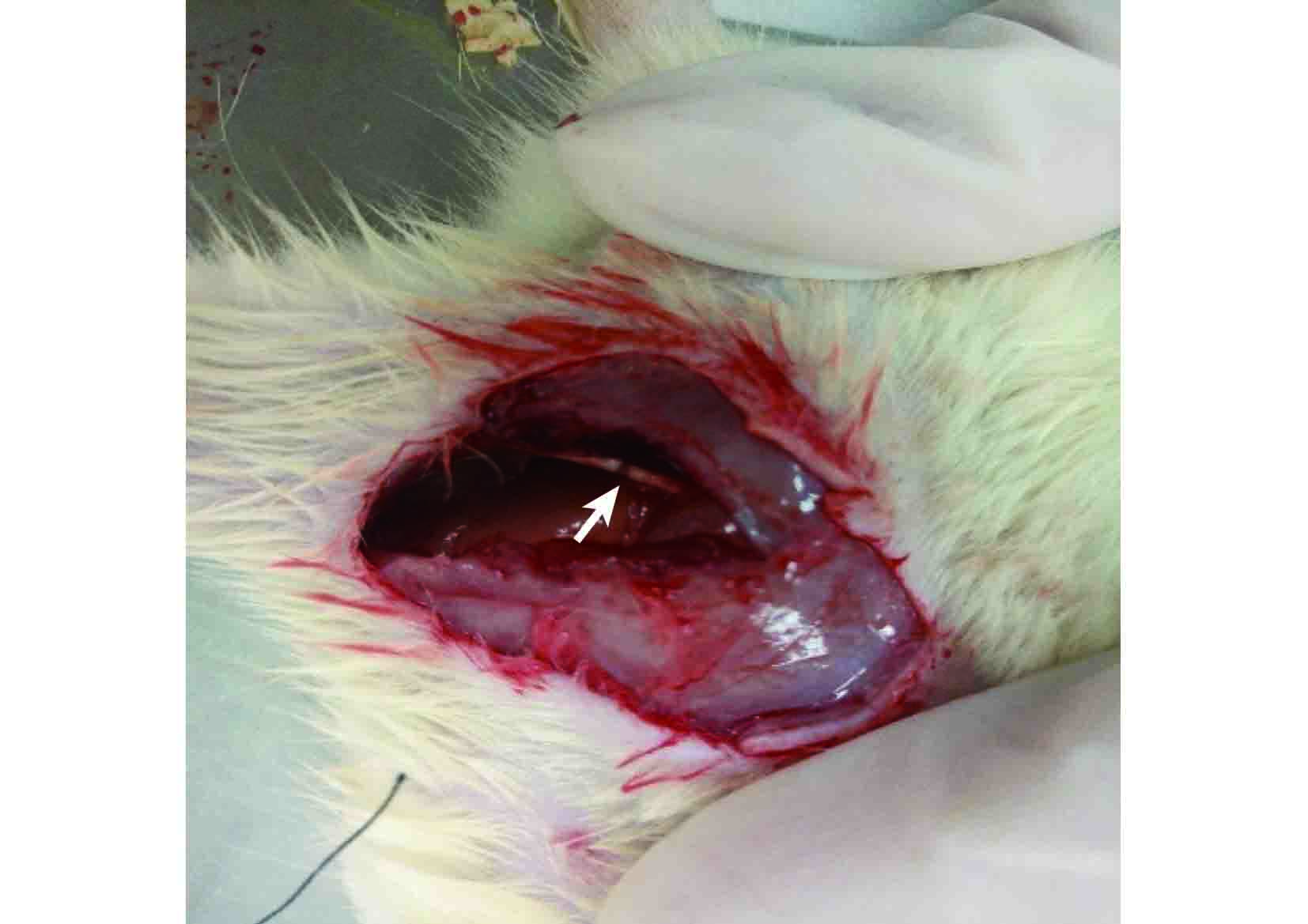
將 36 只 SD 大鼠隨機分成兩組:假手術對照組 6 只,實驗組 30 只。實驗動物以 2.5% 戊巴比妥鈉(30 mg/kg)腹腔內注射麻醉。實驗組取右側股后正中切口,暴露坐骨神經,于梨狀肌下 6 mm 處用微血管止血鉗夾持坐骨神經,鎖至第 4 齒維持 30 s,直至神經變透明膜狀,造成約 3 mm 長的神經擠壓傷,在擠壓處神經遠端用 11-0 尼龍線縫合神經外膜 1 針作標記。假手術對照組僅暴露右側坐骨神經,不行鉗夾。見圖 1。實驗組分別于術后 1、3、7、14、28 d 處死 6 只動物,假手術對照組于術后 7 d 處死動物;無菌條件下取 L4~6 節段脊髓組織,迅速置于液氮中保存。
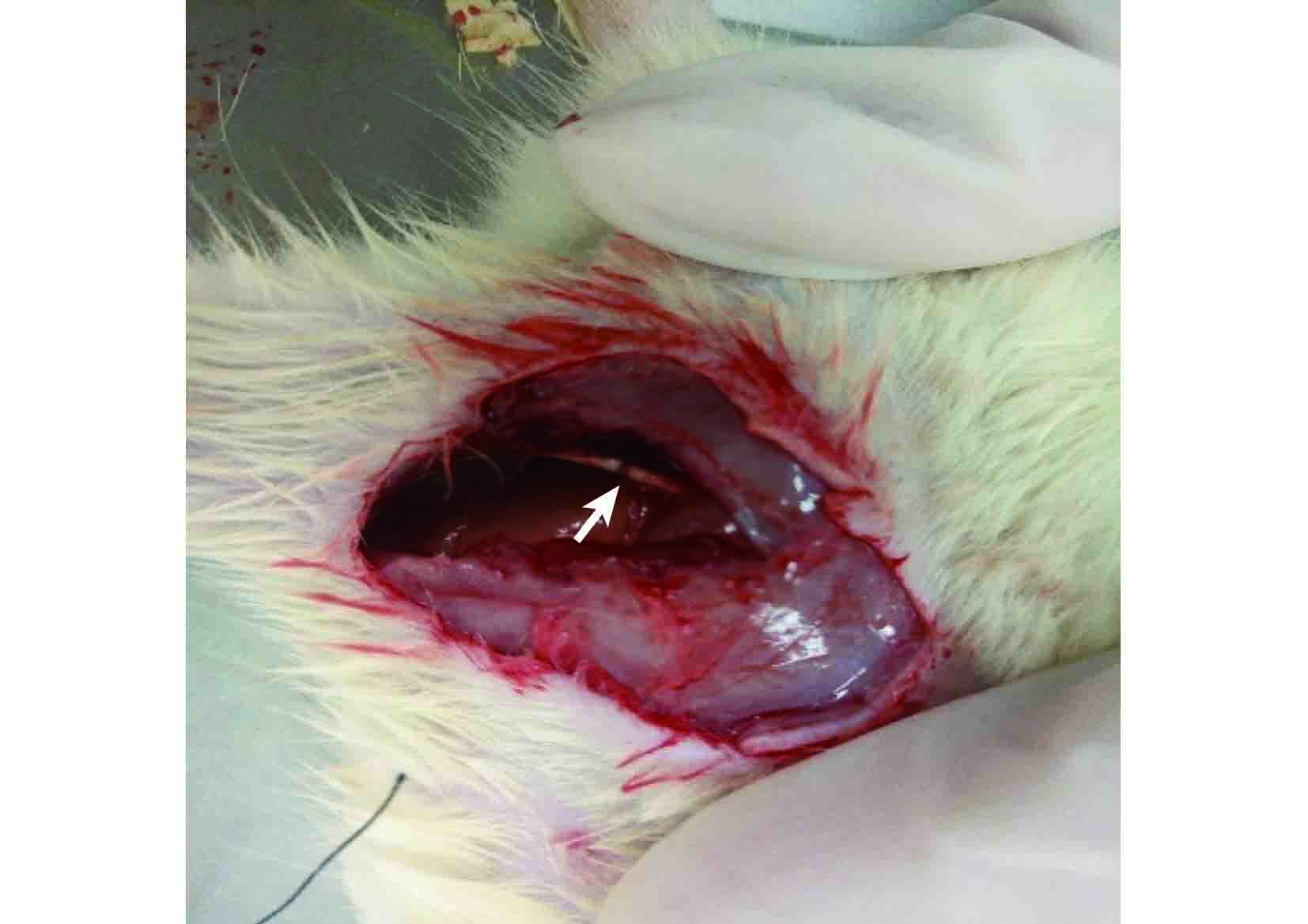 圖1
實驗組坐骨神經擠壓損傷模型建立 箭頭示擠壓部位
Figure1.
Establishment of compressed sciatic nerve injury model in rats Arrow indicated extrusion parts
圖1
實驗組坐骨神經擠壓損傷模型建立 箭頭示擠壓部位
Figure1.
Establishment of compressed sciatic nerve injury model in rats Arrow indicated extrusion parts
1.3 觀測指標
1.3.1 實時熒光定量 PCR 檢測 Spastin 基因表達 取液氮中保存的 L4~6 節段脊髓組織,用 RNAiso Plus 試劑盒提取 RNA,利用逆轉錄試劑盒進行逆轉錄,所得 cDNA 進行實時熒光定量 PCR 擴增,以 GAPDH 為內參基因對照,各組 Spastin 基因與 GAPDH 基因表達的比值即 Spastin 基因相對表達量。引物由蘇州金唯智生物科技有限公司提供。引物序列:Spastin 上游 5'-TACCCAATGAGG-AGACACGACT-3',下游 5'-CATTCTCGCCAG-TTGAGCAAG-3';GAPDH 上游 5'-AGAC-AGCCGCATCTTCTTGT-3',GAPDH 下游 5'-CTTGCCGTGGGTAGAGTCAT-3'。
1.3.2 Western blot 檢測 Spastin 蛋白表達 取出液氮中保存的組織,于冰上解凍后按 1 mg 組織∶20 μL RIPA 裂解液進行裂解,4℃ 冰浴勻漿,12 000 ×g 離心 15 min 后取上清液即為所需蛋白液。以 BCA 法檢測細胞裂解液的蛋白濃度。將測完濃度的上清液行 10%SDS-PAGE 電泳,將分離后的蛋白條帶轉移至聚偏氟乙烯膜上,浸入含 5% 脫脂奶粉的封閉液中室溫封閉 1 h;加入兔抗鼠 Spastin 單克隆抗體(1∶100)和兔抗鼠 GAPDH 單克隆抗體(1∶10 000),4℃ 孵育過夜;PBST 洗膜,加入羊抗兔 IgG-辣根過氧化物酶二抗(1∶5 000),室溫孵育 2 h。在暗室內用化學發光劑 ECL 反應,凝膠成像分析儀取像并測定條帶灰度值。以 Spastin 蛋白條帶和 GAPDH 內參條帶灰度值的比值作為目的蛋白的相對表達量。
1.3.3 透射電鏡觀察 于鉗夾標記處遠端取 5 mm 神經組織,制作厚 70 nm 超薄切片(縱切面),以 2.5% 戊二醛固定,經醋酸雙氧鈾及醋酸鉛雙染色,透射電鏡下觀察軸突超微結構。
1.4 統計學方法
采用 SPSS17.0 統計軟件進行分析。數據以均數 ± 標準差表示,實驗組內各時間點間比較采用單因素方差分析,兩兩比較采用 Bonferroni 法;實驗組與假手術對照組比較采用 Dunnettt 檢驗;檢驗水準α=0.05。
2 結果
2.1 實時熒光定量 PCR 檢測 Spastin 基因表達
實驗組術后大鼠 L4~6 節段脊髓組織中 Spastin mRNA 相對表達量與假手術對照組相比呈先下降后逐漸上升的趨勢,于術后 7 d 降至最低,28 d 時達初始水平。假手術對照組及實驗組術后 1、3、7、14、28 d 大鼠 L4~6 節段脊髓組織中 Spastin mRNA 相對表達量分別為 1.001±0.047、0.956±0.167、0.734±0.128、0.721±0.226、0.605±0.070、1.016±0.202,其中實驗組術后 3、7、14 d Spastin mRNA 相對表達量顯著低于假手術對照組,差異有統計學意義(P<0.05);術后 1、28 d 與假手術對照組比較差異無統計學意義(P>0.05)。實驗組術后 3、7、14 d Spastin mRNA 相對表達量與術后 1 d 和 28 d 相比顯著降低,差異有統計學意義(P<0.05),術后 1 d 和 28 d 比較差異無統計學意義(P>0.05)。
2.2 Western blot 檢測 Spastin 蛋白表達
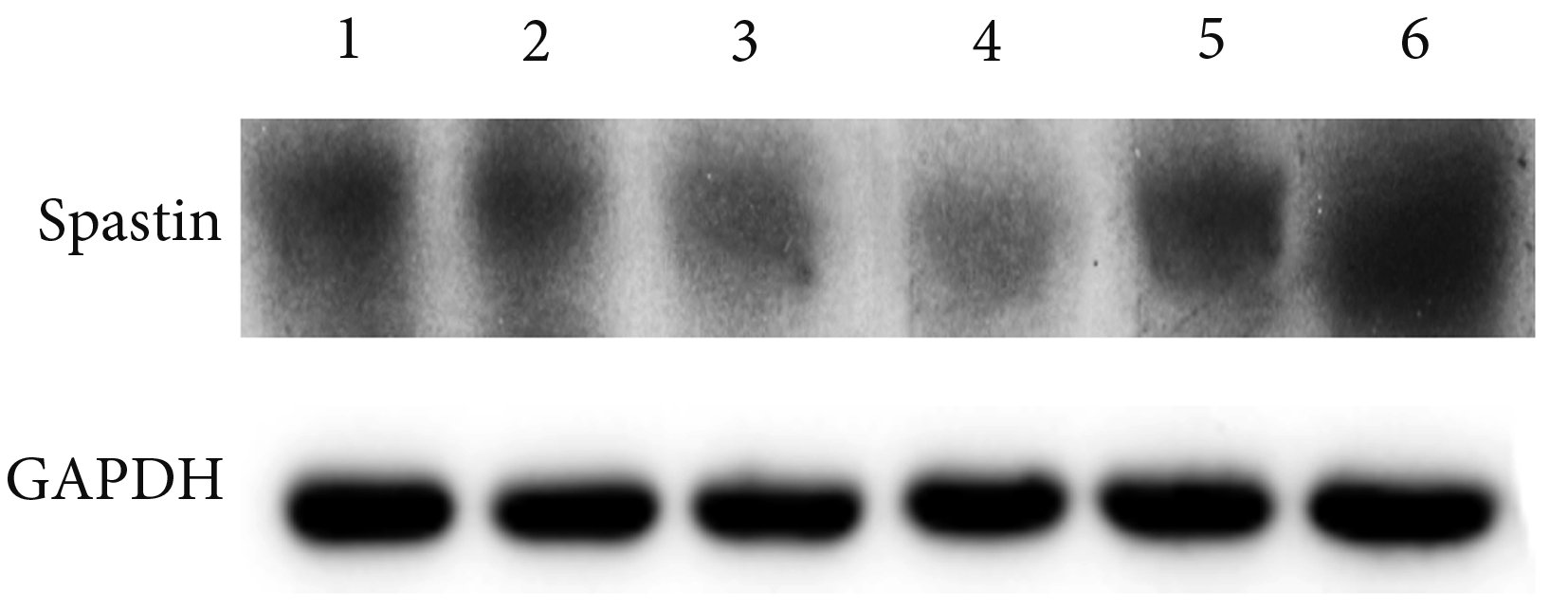
兩組大鼠 L4~6 節段脊髓組織中 Spastin 蛋白表達和基因表達變化趨勢基本一致。實驗組 Spastin 蛋白相對表達量呈先下降后逐漸上升的趨勢,于術后 7 d 降至最低,28 d 時達初始水平。假手術對照組及實驗組術后 1、3、7、14、28 d 大鼠 L4~6 節段脊髓組織中 Spastin 蛋白表達量分別為 6.210±0.152、5.352±0.143、4.631±0.146、4.532±0.149、5.373±0.142、6.231±0.151,其中實驗組術后 3、7、14 d Spastin 蛋白表達量顯著低于假手術對照組,差異有統計學意義(P<0.05);術后 1、28 d 與假手術對照組比較差異無統計學意義(P>0.05)。實驗組術后 3、7、14 d Spastin 蛋白相對表達量與術后 1 d 和 28 d 相比顯著降低,差異有統計學意義(P<0.05),術后 1 d 和 28 d 相比差異無統計學意義(P>0.05)。見圖 2。
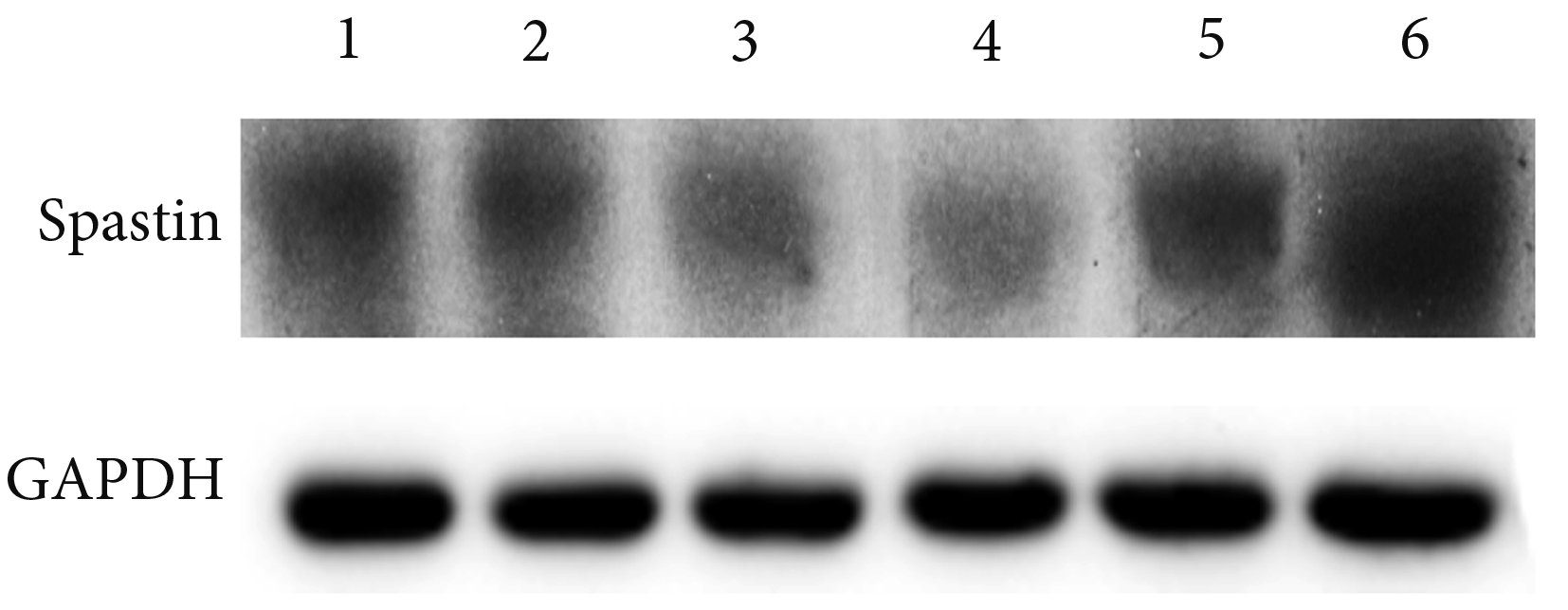 圖2
Western blot 檢測各組 Spastin 蛋白表達 1: 假手術對照組 2: 實驗組術后 1 d 3: 實驗組術后 3 d 4: 實驗組術后 7 d 5: 實驗組術后 14 d 6:實驗組術后 28 d
Figure2.
Spastin protein expression in each group by Western blot 1: Control group 2: Experimental group at 1 day after operation 3: Experimental group at 3 days after operation 4: Experimental group at 7 days after operation 5: Experimental group at 14 days after operation 6: Experimental group at 28 days after operation
圖2
Western blot 檢測各組 Spastin 蛋白表達 1: 假手術對照組 2: 實驗組術后 1 d 3: 實驗組術后 3 d 4: 實驗組術后 7 d 5: 實驗組術后 14 d 6:實驗組術后 28 d
Figure2.
Spastin protein expression in each group by Western blot 1: Control group 2: Experimental group at 1 day after operation 3: Experimental group at 3 days after operation 4: Experimental group at 7 days after operation 5: Experimental group at 14 days after operation 6: Experimental group at 28 days after operation
2.3 透射電鏡觀察
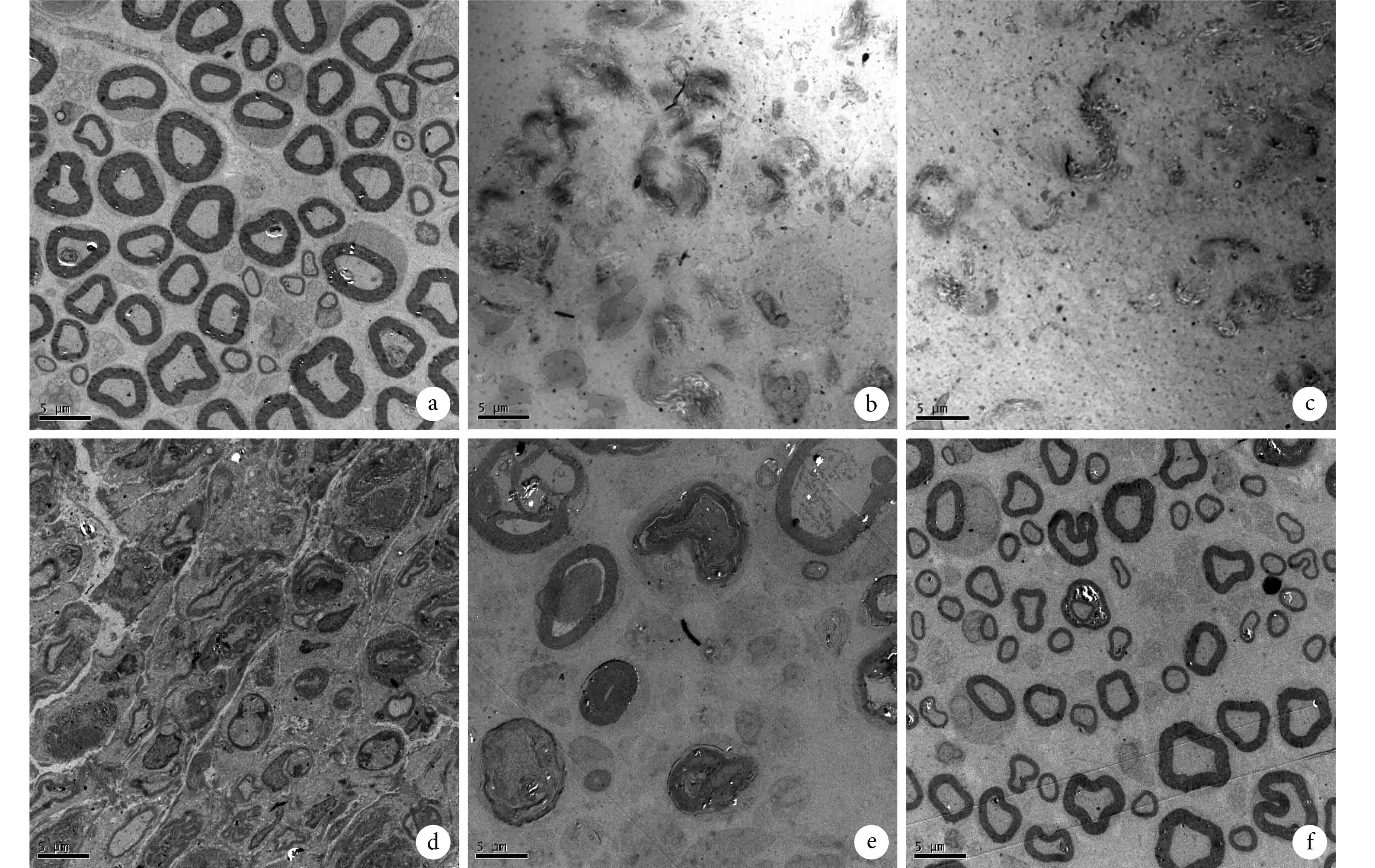
假手術對照組軸突超微結構正常。實驗組術后 7 d 內可見微管及微絲崩解,線粒體腫脹,髓鞘破壞嚴重,髓鞘內板層結構模糊,間隙增寬、松散,形態不規則,其中術后 3 d 破壞最為嚴重;術后 14 d 可見新生的神經纖維,髓鞘較小,板層結構較清晰,微管及微絲清晰可見,雪旺細胞增生;術后 28 d 增生的神經纖維數量明顯增多,髓鞘及神經纖維形態、大小均接近正常軸突。見圖 3。
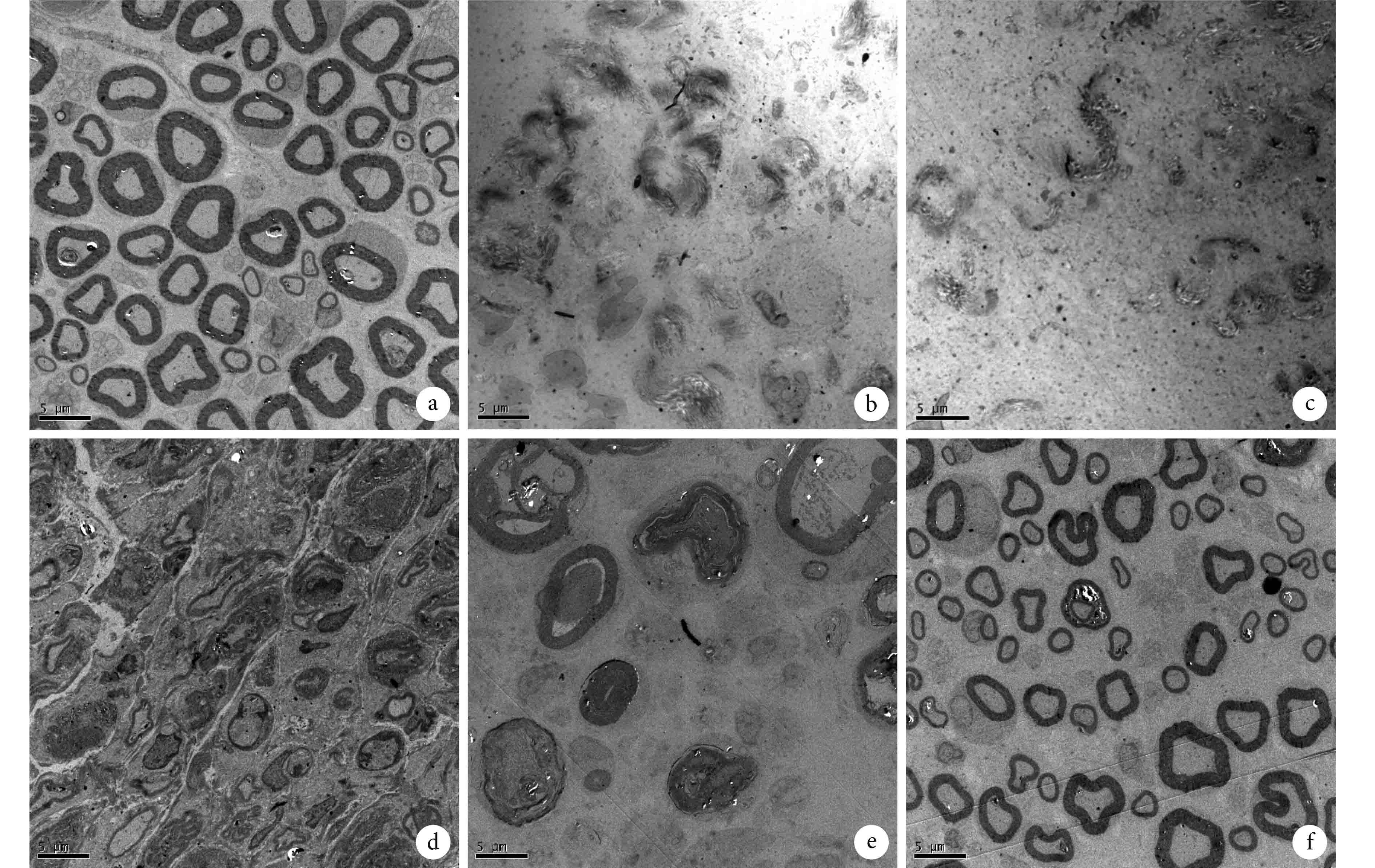 圖3
透射電鏡觀察各組軸突超微結構變化(×2 000) a. 假手術對照組; b. 實驗組術后 1 d; c. 實驗組術后 3 d; d. 實驗組術后 7 d; e. 實驗組術后 14 d; f. 實驗組術后 28 d
Figure3.
Ultrastructure of the distal axon by TEM(×2 000) a. Control group; b: Experimental group at 1 day after operation; c: Experimental group at 3 days after operation; d: Experimental group at 7 days after operation; e: Experimental group at 14 days after operation; f: Experimental group at 28 days after operation
圖3
透射電鏡觀察各組軸突超微結構變化(×2 000) a. 假手術對照組; b. 實驗組術后 1 d; c. 實驗組術后 3 d; d. 實驗組術后 7 d; e. 實驗組術后 14 d; f. 實驗組術后 28 d
Figure3.
Ultrastructure of the distal axon by TEM(×2 000) a. Control group; b: Experimental group at 1 day after operation; c: Experimental group at 3 days after operation; d: Experimental group at 7 days after operation; e: Experimental group at 14 days after operation; f: Experimental group at 28 days after operation
3 討論
周圍神經損傷后經典的修復過程是遠側斷端發生瓦勒變性溶解消失后,重新由近側斷端向遠處生長出整個遠側神經[17]。這種修復模式存在諸多弊端,比如周圍神經雖然具有再生能力,但其再生是不定向的,即再生的神經纖維會發生錯長。此外,周圍神經生長速度緩慢,僅有 1 mm/d,在其生長至靶器官之前,長期失神經支配會引起肌纖維和感覺小體的萎縮、纖維化,運動終板發生變性、消失。
現代醫學雖然在神經損傷修復上有了長足進步,但無論是顯微外科的準確縫合,還是采用神經營養物質促進其再生,或應用新型的神經導管材料修復大段神經缺損[18-19],都遵循著上述經典修復途徑,也不可避免地存在上述問題。Eddleman 等[9] 在研究魚類神經軸突軸膜洞穿性損傷時,發現存在質膜修復現象,即軸漿內的膜性細胞器可以融合封閉洞穿性軸膜缺損,避免瓦勒變性,而不能通過質膜修復的受損神經細胞則通常很快消亡。Spaeth 等[11] 在大鼠離體 B104 海馬細胞中證實了使用聚乙二醇可有效封閉軸膜,重連切斷的軸突。Bittner 等[12] 用同樣方法修復周圍神經損傷,獲得了較滿意的即時修復效果。但這些研究同時也指出,質膜修復方法僅有 10%~15% 的遠端軸突避免了瓦勒變性,究其原因可能是由于未修復細胞骨架。及時修復細胞骨架可以盡快溝通斷裂神經軸突的遠近端,遠側斷端獲得胞體的物質傳輸是其避免損傷的關鍵。在神經細胞軸突和樹突中,微管束沿長軸排列,起支撐作用,在胚胎發育階段微管幫助軸突生長,在成熟的軸突中,微管是物質運輸的路軌。故重建微管通道可能是軸突吻合成功的關鍵步驟。
Spastin、Katanin 和 Fidgetin 都是目前已知的微管重塑蛋白,研究發現 Spastin 優先在微管缺陷處進行重塑,引導新的微管形成,故 Spastin 可能是周圍神經損傷后軸突吻合中修復軸突細胞骨架的關鍵分子[16]。在果蠅中,Spastin 可以增強突觸終板內微管的形成和增加神經元軸突分支的形成[20]。在體外培養的大鼠神經元中,Spastin 選擇性地促進側支芽突的形成而調節軸突形態[21]。在新側支芽突的形成處發現了 Spastin 的聚集,人們猜測它可能負責將微管修飾為短段的可移動碎片,參與新生芽突內微管的形成。Spastin 剪切后的微管碎片是新生軸突及分支形成的必要步驟,這一過程在動物成年后神經系統的重塑中尤為重要[22]。
本研究通過透射電鏡觀察發現,實驗組術后 7 d 內可見微管及微絲崩解,線粒體腫脹,髓鞘破壞嚴重,這一階段為周圍神經損傷后的早期,處于瓦勒變性期。術后 14 d 可見新生的神經纖維,髓鞘較小,板層結構較清晰,微管及微絲清晰可見,雪旺細胞增生。至術后 28 d 增生的神經纖維數量明顯增多,髓鞘及神經纖維形態、大小均接近正常;這一時期為神經的再生恢復期。利用實時熒光定量 PCR 和 Westernblot 檢測發現,Spastin 基因及蛋白表達在神經損傷早期(1、3、7 d)明顯下降,至術后 7 d 降至最低;隨后在神經再生恢復期(14 d)表達逐漸增加,至術后 28 d 基本接近正常。這一結果提示 Spastin 在周圍神經損傷再生過程中發揮了一定作用。
此外,從本研究結果我們可以推測,在周圍神經損傷早期,由于組織破壞等原因,引起了 Spastin 蛋白表達減少;隨著時間延長,機體自身通過某種機制調控,使 Spastin 蛋白表達明顯增加,增強了突觸終板內微管重塑,促進神經元軸突分支形成,最終有利于神經再生。同時我們猜想在周圍神經損傷早期,加入外源性 Spastin 蛋白,可能有助于增強神經軸突微管重塑,從而促進神經修復再生。但是神經損傷后 Spastin 表達變化的真正原因及其在神經再生過程中的具體作用仍有待進一步研究。
周圍神經損傷在臨床上極為常見,其損傷后再生速度非常緩慢(約 1 mm/d),由于神經損傷修復的機制非常復雜,其治療一直是臨床上待解決的醫學難題之一[1-2]。目前,周圍神經損傷修復的主要方法包括顯微吻合、黏合劑、神經移植等[3-5],其目的都是引導再生的神經纖維長入遠端,與靶器官重新建立突觸聯系。但這種模式存在諸多弊端,如再生速度緩慢以至靶肌肉永久性失神經支配等[6]。有學者研究發現,在淡水鰲蝦、水蛭、線蟲中都存在一種新的神經軸突再生機制,這種軸突再生機制與傳統模式完全不同,是一種軸突融合的過程[7-8]。近年來有學者通過軸突融合的方法進行動物實驗修復周圍神經損傷,取得了比較滿意的即時修復效果,避免了瓦勒變性,取得了比傳統顯微外科縫合更好的治療效果[9-14]。但這些學者同時也指出,這種修復方法僅有 10%~15% 的遠端軸突避免了瓦勒變性,其原因可能是未修復細胞骨架[11-12]。而及時修復細胞骨架,使遠側斷端獲得胞體的物質運輸,是避免神經損傷的關鍵因素。因此,重建微管通道可能是軸突吻合成功的關鍵步驟。
Spastin 是目前已知的一種微管重塑蛋白,在軸突發育和芽突生成中扮演著重要角色,被認為可能是周圍神經損傷后軸突吻合中修復細胞骨架的關鍵分子[15-16]。本實驗觀察內源性 Spastin 在神經軸突損傷后再生過程中的表達變化,并探討其可能的作用機制,為后續采用軸突吻合途徑修復周圍神經損傷提供新的思路。
1 材料與方法
1.1 實驗動物及主要試劑、儀器
成年雄性 SD 大鼠 36 只,體質量(200±20)g,由上海西普爾-必凱動物實驗有限公司提供。
RNAiso Plus、RNA 逆轉錄試劑盒(Takara 公司,日本);SYBR Green Kit(ABI 公司,美國);RT-PCR 引物(蘇州金唯智生物科技有限公司);RIPA 裂解液Ⅲ(上海生工生物工程股份有限公司);BCA 蛋白定量試劑盒(Pierce 公司,美國);SDS-PAGE 上樣緩沖液(上海碧云天生物技術有限公司);兔抗鼠 Spastin 單克隆抗體(Bioss 公司,美國);兔抗鼠 GAPDH 單克隆抗體、山羊抗兔 IgG-辣根過氧化物酶二抗(Proteintech 公司,美國);聚偏氟乙烯膜、ECL 試劑盒(Millpore 公司,美國);顯影定影試劑盒(Beyotime 公司,美國)。顯微外科器械(寧波成和顯微外科器械公司);手術顯微鏡(上海精密儀器儀表有限公司);實時熒光定量 PCR 儀(ABI 公司,美國);蛋白電泳槽、凝膠成像分析儀(化學發光)、轉膜槽(Bio-Rad 公司,美國);JEM-1230 透射電鏡(JEOL 公司,日本)。
1.2 實驗分組
將 36 只 SD 大鼠隨機分成兩組:假手術對照組 6 只,實驗組 30 只。實驗動物以 2.5% 戊巴比妥鈉(30 mg/kg)腹腔內注射麻醉。實驗組取右側股后正中切口,暴露坐骨神經,于梨狀肌下 6 mm 處用微血管止血鉗夾持坐骨神經,鎖至第 4 齒維持 30 s,直至神經變透明膜狀,造成約 3 mm 長的神經擠壓傷,在擠壓處神經遠端用 11-0 尼龍線縫合神經外膜 1 針作標記。假手術對照組僅暴露右側坐骨神經,不行鉗夾。見圖 1。實驗組分別于術后 1、3、7、14、28 d 處死 6 只動物,假手術對照組于術后 7 d 處死動物;無菌條件下取 L4~6 節段脊髓組織,迅速置于液氮中保存。
 圖1
實驗組坐骨神經擠壓損傷模型建立 箭頭示擠壓部位
Figure1.
Establishment of compressed sciatic nerve injury model in rats Arrow indicated extrusion parts
圖1
實驗組坐骨神經擠壓損傷模型建立 箭頭示擠壓部位
Figure1.
Establishment of compressed sciatic nerve injury model in rats Arrow indicated extrusion parts
1.3 觀測指標
1.3.1 實時熒光定量 PCR 檢測 Spastin 基因表達 取液氮中保存的 L4~6 節段脊髓組織,用 RNAiso Plus 試劑盒提取 RNA,利用逆轉錄試劑盒進行逆轉錄,所得 cDNA 進行實時熒光定量 PCR 擴增,以 GAPDH 為內參基因對照,各組 Spastin 基因與 GAPDH 基因表達的比值即 Spastin 基因相對表達量。引物由蘇州金唯智生物科技有限公司提供。引物序列:Spastin 上游 5'-TACCCAATGAGG-AGACACGACT-3',下游 5'-CATTCTCGCCAG-TTGAGCAAG-3';GAPDH 上游 5'-AGAC-AGCCGCATCTTCTTGT-3',GAPDH 下游 5'-CTTGCCGTGGGTAGAGTCAT-3'。
1.3.2 Western blot 檢測 Spastin 蛋白表達 取出液氮中保存的組織,于冰上解凍后按 1 mg 組織∶20 μL RIPA 裂解液進行裂解,4℃ 冰浴勻漿,12 000 ×g 離心 15 min 后取上清液即為所需蛋白液。以 BCA 法檢測細胞裂解液的蛋白濃度。將測完濃度的上清液行 10%SDS-PAGE 電泳,將分離后的蛋白條帶轉移至聚偏氟乙烯膜上,浸入含 5% 脫脂奶粉的封閉液中室溫封閉 1 h;加入兔抗鼠 Spastin 單克隆抗體(1∶100)和兔抗鼠 GAPDH 單克隆抗體(1∶10 000),4℃ 孵育過夜;PBST 洗膜,加入羊抗兔 IgG-辣根過氧化物酶二抗(1∶5 000),室溫孵育 2 h。在暗室內用化學發光劑 ECL 反應,凝膠成像分析儀取像并測定條帶灰度值。以 Spastin 蛋白條帶和 GAPDH 內參條帶灰度值的比值作為目的蛋白的相對表達量。
1.3.3 透射電鏡觀察 于鉗夾標記處遠端取 5 mm 神經組織,制作厚 70 nm 超薄切片(縱切面),以 2.5% 戊二醛固定,經醋酸雙氧鈾及醋酸鉛雙染色,透射電鏡下觀察軸突超微結構。
1.4 統計學方法
采用 SPSS17.0 統計軟件進行分析。數據以均數 ± 標準差表示,實驗組內各時間點間比較采用單因素方差分析,兩兩比較采用 Bonferroni 法;實驗組與假手術對照組比較采用 Dunnettt 檢驗;檢驗水準α=0.05。
2 結果
2.1 實時熒光定量 PCR 檢測 Spastin 基因表達
實驗組術后大鼠 L4~6 節段脊髓組織中 Spastin mRNA 相對表達量與假手術對照組相比呈先下降后逐漸上升的趨勢,于術后 7 d 降至最低,28 d 時達初始水平。假手術對照組及實驗組術后 1、3、7、14、28 d 大鼠 L4~6 節段脊髓組織中 Spastin mRNA 相對表達量分別為 1.001±0.047、0.956±0.167、0.734±0.128、0.721±0.226、0.605±0.070、1.016±0.202,其中實驗組術后 3、7、14 d Spastin mRNA 相對表達量顯著低于假手術對照組,差異有統計學意義(P<0.05);術后 1、28 d 與假手術對照組比較差異無統計學意義(P>0.05)。實驗組術后 3、7、14 d Spastin mRNA 相對表達量與術后 1 d 和 28 d 相比顯著降低,差異有統計學意義(P<0.05),術后 1 d 和 28 d 比較差異無統計學意義(P>0.05)。
2.2 Western blot 檢測 Spastin 蛋白表達
兩組大鼠 L4~6 節段脊髓組織中 Spastin 蛋白表達和基因表達變化趨勢基本一致。實驗組 Spastin 蛋白相對表達量呈先下降后逐漸上升的趨勢,于術后 7 d 降至最低,28 d 時達初始水平。假手術對照組及實驗組術后 1、3、7、14、28 d 大鼠 L4~6 節段脊髓組織中 Spastin 蛋白表達量分別為 6.210±0.152、5.352±0.143、4.631±0.146、4.532±0.149、5.373±0.142、6.231±0.151,其中實驗組術后 3、7、14 d Spastin 蛋白表達量顯著低于假手術對照組,差異有統計學意義(P<0.05);術后 1、28 d 與假手術對照組比較差異無統計學意義(P>0.05)。實驗組術后 3、7、14 d Spastin 蛋白相對表達量與術后 1 d 和 28 d 相比顯著降低,差異有統計學意義(P<0.05),術后 1 d 和 28 d 相比差異無統計學意義(P>0.05)。見圖 2。
 圖2
Western blot 檢測各組 Spastin 蛋白表達 1: 假手術對照組 2: 實驗組術后 1 d 3: 實驗組術后 3 d 4: 實驗組術后 7 d 5: 實驗組術后 14 d 6:實驗組術后 28 d
Figure2.
Spastin protein expression in each group by Western blot 1: Control group 2: Experimental group at 1 day after operation 3: Experimental group at 3 days after operation 4: Experimental group at 7 days after operation 5: Experimental group at 14 days after operation 6: Experimental group at 28 days after operation
圖2
Western blot 檢測各組 Spastin 蛋白表達 1: 假手術對照組 2: 實驗組術后 1 d 3: 實驗組術后 3 d 4: 實驗組術后 7 d 5: 實驗組術后 14 d 6:實驗組術后 28 d
Figure2.
Spastin protein expression in each group by Western blot 1: Control group 2: Experimental group at 1 day after operation 3: Experimental group at 3 days after operation 4: Experimental group at 7 days after operation 5: Experimental group at 14 days after operation 6: Experimental group at 28 days after operation
2.3 透射電鏡觀察
假手術對照組軸突超微結構正常。實驗組術后 7 d 內可見微管及微絲崩解,線粒體腫脹,髓鞘破壞嚴重,髓鞘內板層結構模糊,間隙增寬、松散,形態不規則,其中術后 3 d 破壞最為嚴重;術后 14 d 可見新生的神經纖維,髓鞘較小,板層結構較清晰,微管及微絲清晰可見,雪旺細胞增生;術后 28 d 增生的神經纖維數量明顯增多,髓鞘及神經纖維形態、大小均接近正常軸突。見圖 3。
 圖3
透射電鏡觀察各組軸突超微結構變化(×2 000) a. 假手術對照組; b. 實驗組術后 1 d; c. 實驗組術后 3 d; d. 實驗組術后 7 d; e. 實驗組術后 14 d; f. 實驗組術后 28 d
Figure3.
Ultrastructure of the distal axon by TEM(×2 000) a. Control group; b: Experimental group at 1 day after operation; c: Experimental group at 3 days after operation; d: Experimental group at 7 days after operation; e: Experimental group at 14 days after operation; f: Experimental group at 28 days after operation
圖3
透射電鏡觀察各組軸突超微結構變化(×2 000) a. 假手術對照組; b. 實驗組術后 1 d; c. 實驗組術后 3 d; d. 實驗組術后 7 d; e. 實驗組術后 14 d; f. 實驗組術后 28 d
Figure3.
Ultrastructure of the distal axon by TEM(×2 000) a. Control group; b: Experimental group at 1 day after operation; c: Experimental group at 3 days after operation; d: Experimental group at 7 days after operation; e: Experimental group at 14 days after operation; f: Experimental group at 28 days after operation
3 討論
周圍神經損傷后經典的修復過程是遠側斷端發生瓦勒變性溶解消失后,重新由近側斷端向遠處生長出整個遠側神經[17]。這種修復模式存在諸多弊端,比如周圍神經雖然具有再生能力,但其再生是不定向的,即再生的神經纖維會發生錯長。此外,周圍神經生長速度緩慢,僅有 1 mm/d,在其生長至靶器官之前,長期失神經支配會引起肌纖維和感覺小體的萎縮、纖維化,運動終板發生變性、消失。
現代醫學雖然在神經損傷修復上有了長足進步,但無論是顯微外科的準確縫合,還是采用神經營養物質促進其再生,或應用新型的神經導管材料修復大段神經缺損[18-19],都遵循著上述經典修復途徑,也不可避免地存在上述問題。Eddleman 等[9] 在研究魚類神經軸突軸膜洞穿性損傷時,發現存在質膜修復現象,即軸漿內的膜性細胞器可以融合封閉洞穿性軸膜缺損,避免瓦勒變性,而不能通過質膜修復的受損神經細胞則通常很快消亡。Spaeth 等[11] 在大鼠離體 B104 海馬細胞中證實了使用聚乙二醇可有效封閉軸膜,重連切斷的軸突。Bittner 等[12] 用同樣方法修復周圍神經損傷,獲得了較滿意的即時修復效果。但這些研究同時也指出,質膜修復方法僅有 10%~15% 的遠端軸突避免了瓦勒變性,究其原因可能是由于未修復細胞骨架。及時修復細胞骨架可以盡快溝通斷裂神經軸突的遠近端,遠側斷端獲得胞體的物質傳輸是其避免損傷的關鍵。在神經細胞軸突和樹突中,微管束沿長軸排列,起支撐作用,在胚胎發育階段微管幫助軸突生長,在成熟的軸突中,微管是物質運輸的路軌。故重建微管通道可能是軸突吻合成功的關鍵步驟。
Spastin、Katanin 和 Fidgetin 都是目前已知的微管重塑蛋白,研究發現 Spastin 優先在微管缺陷處進行重塑,引導新的微管形成,故 Spastin 可能是周圍神經損傷后軸突吻合中修復軸突細胞骨架的關鍵分子[16]。在果蠅中,Spastin 可以增強突觸終板內微管的形成和增加神經元軸突分支的形成[20]。在體外培養的大鼠神經元中,Spastin 選擇性地促進側支芽突的形成而調節軸突形態[21]。在新側支芽突的形成處發現了 Spastin 的聚集,人們猜測它可能負責將微管修飾為短段的可移動碎片,參與新生芽突內微管的形成。Spastin 剪切后的微管碎片是新生軸突及分支形成的必要步驟,這一過程在動物成年后神經系統的重塑中尤為重要[22]。
本研究通過透射電鏡觀察發現,實驗組術后 7 d 內可見微管及微絲崩解,線粒體腫脹,髓鞘破壞嚴重,這一階段為周圍神經損傷后的早期,處于瓦勒變性期。術后 14 d 可見新生的神經纖維,髓鞘較小,板層結構較清晰,微管及微絲清晰可見,雪旺細胞增生。至術后 28 d 增生的神經纖維數量明顯增多,髓鞘及神經纖維形態、大小均接近正常;這一時期為神經的再生恢復期。利用實時熒光定量 PCR 和 Westernblot 檢測發現,Spastin 基因及蛋白表達在神經損傷早期(1、3、7 d)明顯下降,至術后 7 d 降至最低;隨后在神經再生恢復期(14 d)表達逐漸增加,至術后 28 d 基本接近正常。這一結果提示 Spastin 在周圍神經損傷再生過程中發揮了一定作用。
此外,從本研究結果我們可以推測,在周圍神經損傷早期,由于組織破壞等原因,引起了 Spastin 蛋白表達減少;隨著時間延長,機體自身通過某種機制調控,使 Spastin 蛋白表達明顯增加,增強了突觸終板內微管重塑,促進神經元軸突分支形成,最終有利于神經再生。同時我們猜想在周圍神經損傷早期,加入外源性 Spastin 蛋白,可能有助于增強神經軸突微管重塑,從而促進神經修復再生。但是神經損傷后 Spastin 表達變化的真正原因及其在神經再生過程中的具體作用仍有待進一步研究。