引用本文: 李跑, 高尚, 周梅, 唐紅, 穆米多, 張吉強, 唐康來. 不同機械牽伸條件對大鼠肌腱干細胞分化的影響. 中國修復重建外科雜志, 2017, 31(4): 481-488. doi: 10.7507/1002-1892.201611102 復制
版權信息: ?四川大學華西醫院華西期刊社《中國修復重建外科雜志》版權所有,未經授權不得轉載、改編
肌腱病是臨床常見的慢性運動損傷性疾病之一,以疼痛、局部腫脹、病變區域肌張力減低、功能障礙為主要表現。肌腱病發病率高,危害大且不易治愈,嚴重影響患者的生活質量[1-5]。然而,其發病機制至今尚未完全闡明,主要有“炎癥學說”、“退變性學說”、“過度使用學說”等多種理論,目前大多數學者認為肌腱病是由于過度使用引起肌腱微損傷而修復失敗導致[4,6-7]。進一步有研究顯示,肌腱干細胞(tendon stem cells,TSCs)作為肌腱細胞的重要前體細胞,對于肌腱病的發生具有重要作用[8-10]。文獻報道,機械應力刺激會引起骨細胞、成骨細胞、平滑肌細胞、成纖維細胞、MSCs 等多種力敏感性細胞增殖以及分化[11-14],同樣有研究報道力學刺激可促進 TSCs 分化[15-17],但具體機械牽伸載荷參數(牽拉強度、牽拉頻率及牽拉時間)與 TSCs 不同分化之間的相關性未見相關報道,對于不同分化的最佳牽拉載荷尚未闡明。本研究通過對大鼠 TSCs 體外加載不同機械牽伸,觀察 TSCs 不同分化相關基因變化情況,以期尋求特定分化的牽拉最佳方案。
1 材料與方法
1.1 實驗動物及主要試劑、儀器
8 周齡雄性 SD 大鼠 6 只,體質量 200~250 g,由第三軍醫大學實驗動物中心提供。
L-DMEM 培養基、胰蛋白酶(HyClone 公司,美國);FBS(GIBCO 公司,美國);纖維連接蛋白、分散酶 DispaseⅡ、Ⅰ 型膠原酶(Sigma 公司,美國);Trizol 試劑盒(Invitrogen 公司,美國);SYBR?Premix Ex TaqTM RT-PCR 逆轉錄試劑盒(Takara 公司,日本);Western blot 相關試劑盒、ECL 試劑盒、BCA 試劑盒(北京康為世紀生物科技有限公司);抗 β-actin抗體、抗細胞黏合素 C(Tenascin C,TNC)抗體、抗 CCAAT/增強子結合蛋白-α(CCAAT-enhancer-binding protein-α,CEBPα)抗體、抗 RUNX2 抗體(Abcam 公司,英國)。倒置相差顯微鏡(Olympus 公司,日本);激光共聚焦顯微鏡及照相系統 Nikon A1(Nikon 公司,日本);Nano-Drop2000 超微量分光光度計(Thermo 公司,美國);硅樹脂細胞牽拉皿(B-Bridge International公司,美國);iCycler 熒光定量 PCR 儀、Quantity One 軟件(Bio-Rad 公司,美國)。
1.2 大鼠 TSCs 分離及培養及鑒定
細胞培養:參考文獻[8,18]方法,取 8 周齡雄性 SD 大鼠 6 只,以高濃度 CO2 處死,75% 乙醇浸泡 5 min 消毒,于超凈工作臺提取兩側跟腱;去除腱周脂肪及腱膜等組織,PBS 沖洗 3 次;肌腱組織剪成 1 mm×1 mm 大小的組織碎塊,將組織碎塊轉入 15 mL 離心管中;加入 4 mg/mL DispaseⅡ 和 3 mg/mL Ⅰ 型膠原酶混合液 2 mL,室溫消化 2 h 后,500×g 離心 5 min,獲得細胞沉淀物;用含 20% FBS 的 DMEM 培養基重懸后,接種于細胞培養瓶中,37℃、5%CO2 細胞培養箱內靜置原代培養;以后每 3~4 天換液 1 次,4~7 d 后形成細胞克隆;待細胞融合 70%~80% 時進行細胞傳代,倒置相差顯微鏡下觀察細胞形態變化。
細胞鑒定:取 100 μL 第 3 代 TSCs 細胞懸液(密度為 5×105 個/mL)加入 1 μg PE 或 FITC 標記的 CD31、CD34、CD44、CD90 抗體,室溫避光孵育 45 min,PBS 沖洗 2 次;以 12 000×g 離心 5 min,棄上清;每個 EP 管中加入 300 μL 預冷的 Buffer 液重懸,流式細胞器儀檢測 TSCs 表面標記物表達情況。以 PE 或 FITC 標記的同型匹配的 IgG1 作為陰性對照,計算細胞各標記物陽性表達百分率。
1.3 實驗分組及方法
將大鼠第 3 代 TSCs 胰蛋白酶消化后制備成細胞懸液,按 1×105 個/cm2 密度接種于經 Fibronectin 預處理的硅膠牽拉培養皿,于 37℃、5%CO2 培養箱靜置培養 12 h 使細胞完全貼壁。將細胞隨機分為不同牽拉條件組(實驗組 A~D 組)及靜態培養組(對照組 E 組)。其中 A 組牽拉強度 4%、頻率 1 Hz,B 組牽拉強度 4%、頻率 2 Hz,C 組牽拉強度 8%、頻率 1 Hz,D 組牽拉強度 8%、頻率 2 Hz;利用本課題組自行研發的體外細胞單軸循環牽拉設備[19],沿培養皿長軸對 A~D 組細胞進行單軸循環機械牽伸。對照組E組采用靜態培養,未進行牽拉。分別處理 12、24、48 h 后收集各組細胞進行以下觀測。
1.4 觀測指標
1.4.1 實時熒光定量 PCR 檢測分化相關基因 mRNA 表達 按照 Trizol 試劑盒說明書,提取各組 TSCs 總 RNA,測定濃度后根據 SYBR?Premix Ex TaqTM RT-PCR 逆轉錄試劑盒說明書合成 cDNA。cDNA 合成條件為 37℃、15 min,85℃、5 s。然后按 20 μL 反應體系對 cDNA 進行 SYBR 熒光定量擴增檢測各基因[成腱分化相關基因 Scleraxis(SCX)、TNC,成脂肪分化相關基因 CEBPα、脂蛋白脂肪酶(lipo-prteinlipase,LPL)及成骨分化相關基因 RUNX2、遠端缺失基因 5(distal-less homeobox 5,DLX5)]表達情況。基因引物由上海英駿生物技術有限公司合成,引物序列見表 1。擴增條件:95℃ 變性 5 min;95℃ 變性 20 s,60℃ 退火 20 s,72℃ 延伸 30 s,40 個循環;最后溶解曲線分析以 0.5℃/s 加熱速率從 55℃ 至 95℃。以 2–ΔΔCt 法計算目的基因相對表達量,實驗重復 3 次,取均值。
1.4.2 Western blot 檢測分化相關蛋白表達 參照蛋白裂解液說明書提取各組細胞蛋白,用 BCA 法測量蛋白濃度,取 10 μg 蛋白行 SDS-PAGE 凝膠電泳,聚偏二氟乙烯膜轉膜,5 g/L 脫脂奶粉封閉 1 h;加入 β-actin一抗(1∶1 000)、RUNX2一抗(1∶1 000)、CEBPα一抗(1∶500)、TNC一抗(1∶1 000)4℃ 孵育過夜,二抗(1∶3 000)室溫孵育 2 h,TBST 洗膜 3 次,用 ECL 試劑盒顯影,應用 QuantityOne 軟件分析蛋白表達水平。實驗重復 3 次,取均值。
1.5 統計學方法
采用 SPSS18.0 統計軟件進行分析。數據以均數±標準差表示,組間比較采用多因素方差分析,兩兩比較采用 LSD 法檢驗;檢驗水準α=0.05。
2 結果
2.1 大鼠 TSCs 形態學觀察及鑒定
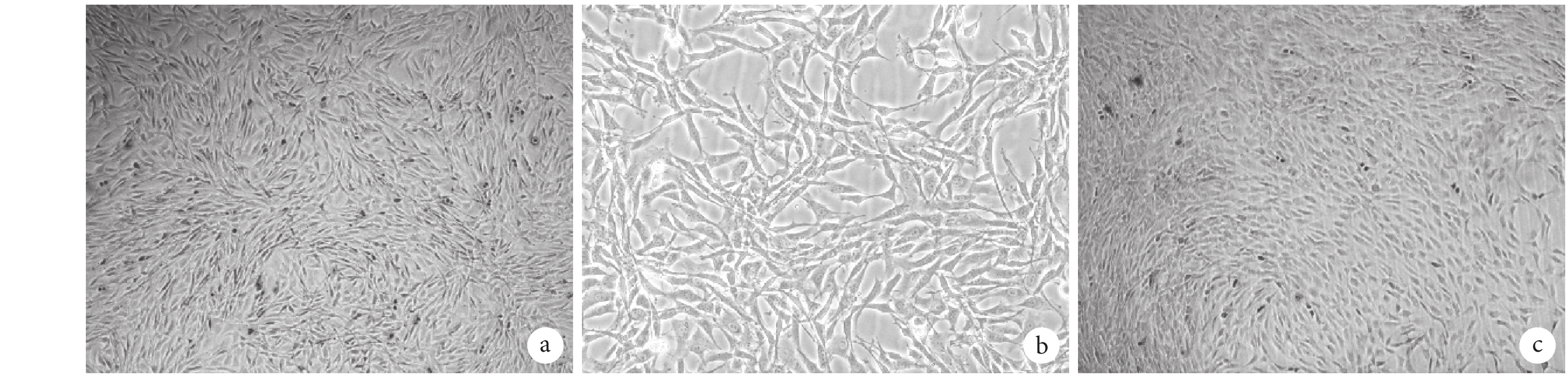
倒置相差顯微鏡觀察示,大鼠跟腱來源 TSCs 貼壁生長,呈鋪路石樣,第 1 代細胞貼壁后呈梭形生長。見圖 1。
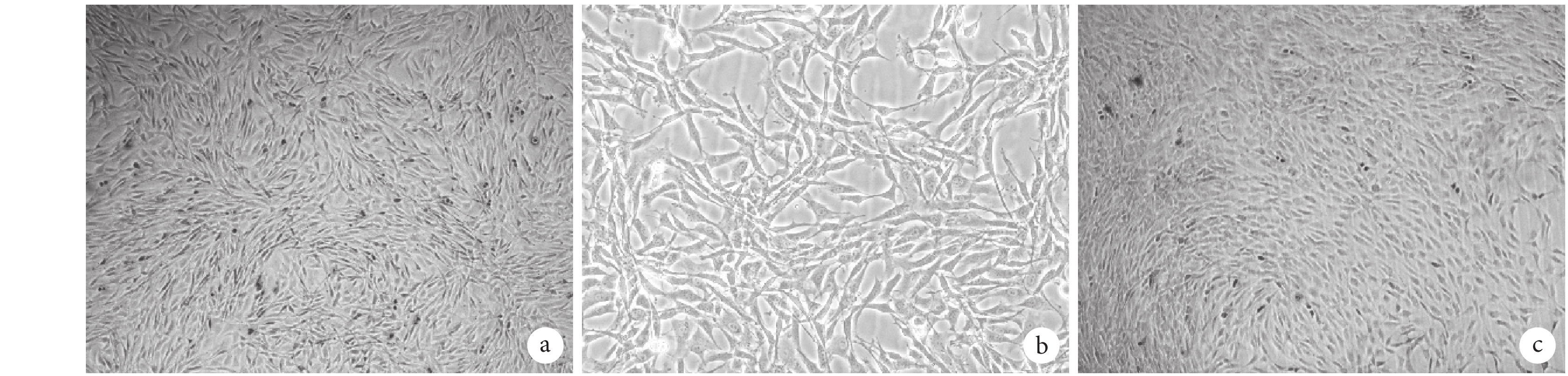 圖1
倒置相差顯微鏡觀察大鼠 TSCs 形態變化 a. 原代細胞培養 6 d(×40);b. 原代細胞培養 6 d(×100);c. 第 1 代細胞培養 4 d(×40)
Figure1.
The morphology observation of rat TSCs by inverted phase contrast microscope a. Primary TSCs cultured for 6 days (×40); b. Primary TSCs cultured for 6 days (×100); c. TSCs at passage 1 cultured for 4 days (×40)
圖1
倒置相差顯微鏡觀察大鼠 TSCs 形態變化 a. 原代細胞培養 6 d(×40);b. 原代細胞培養 6 d(×100);c. 第 1 代細胞培養 4 d(×40)
Figure1.
The morphology observation of rat TSCs by inverted phase contrast microscope a. Primary TSCs cultured for 6 days (×40); b. Primary TSCs cultured for 6 days (×100); c. TSCs at passage 1 cultured for 4 days (×40)
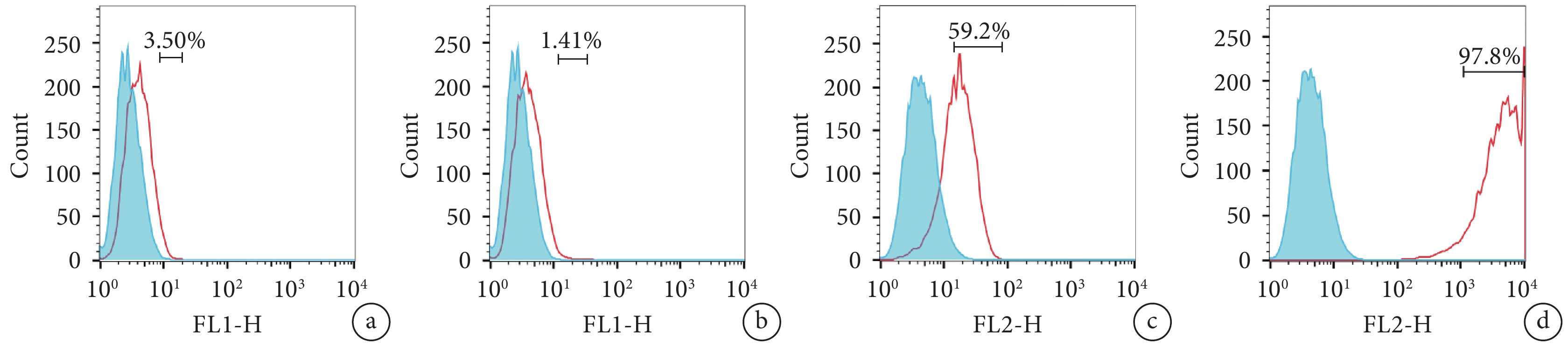
流式細胞術檢測示,大鼠 TSCs CD44、CD90 表達陽性,CD31、CD34 表達陰性。見圖 2。
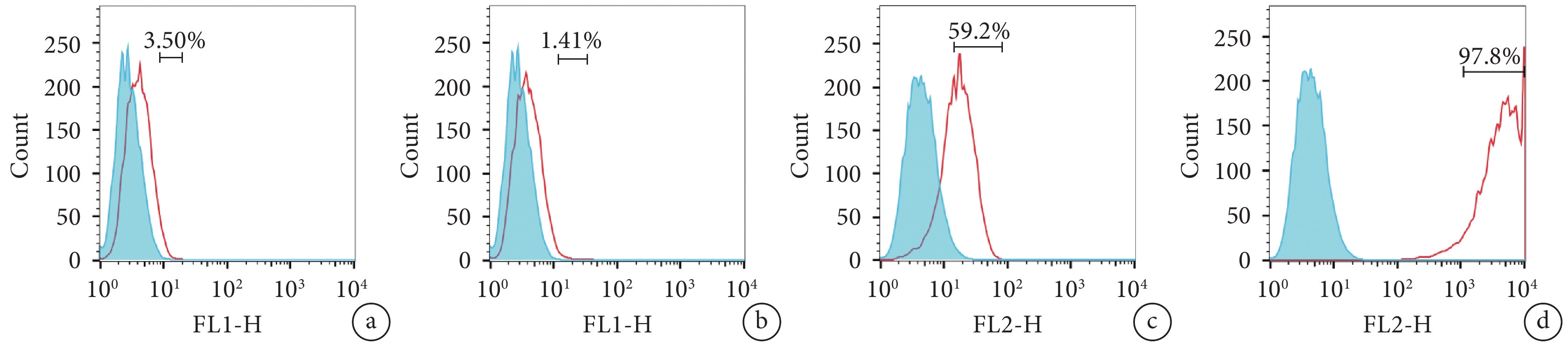 圖2
流式細胞儀檢測大鼠第 3 代 TSCs 表面標志物 a. CD31;b. CD34;c. CD44;d. CD90
Figure2.
The surface markers of TSCs at passage 3 by flow cytometric assay a. CD31; b. CD34; c. CD44; d. CD90
圖2
流式細胞儀檢測大鼠第 3 代 TSCs 表面標志物 a. CD31;b. CD34;c. CD44;d. CD90
Figure2.
The surface markers of TSCs at passage 3 by flow cytometric assay a. CD31; b. CD34; c. CD44; d. CD90
2.2 實時熒光定量 PCR 檢測分化相關基因 mRNA 表達
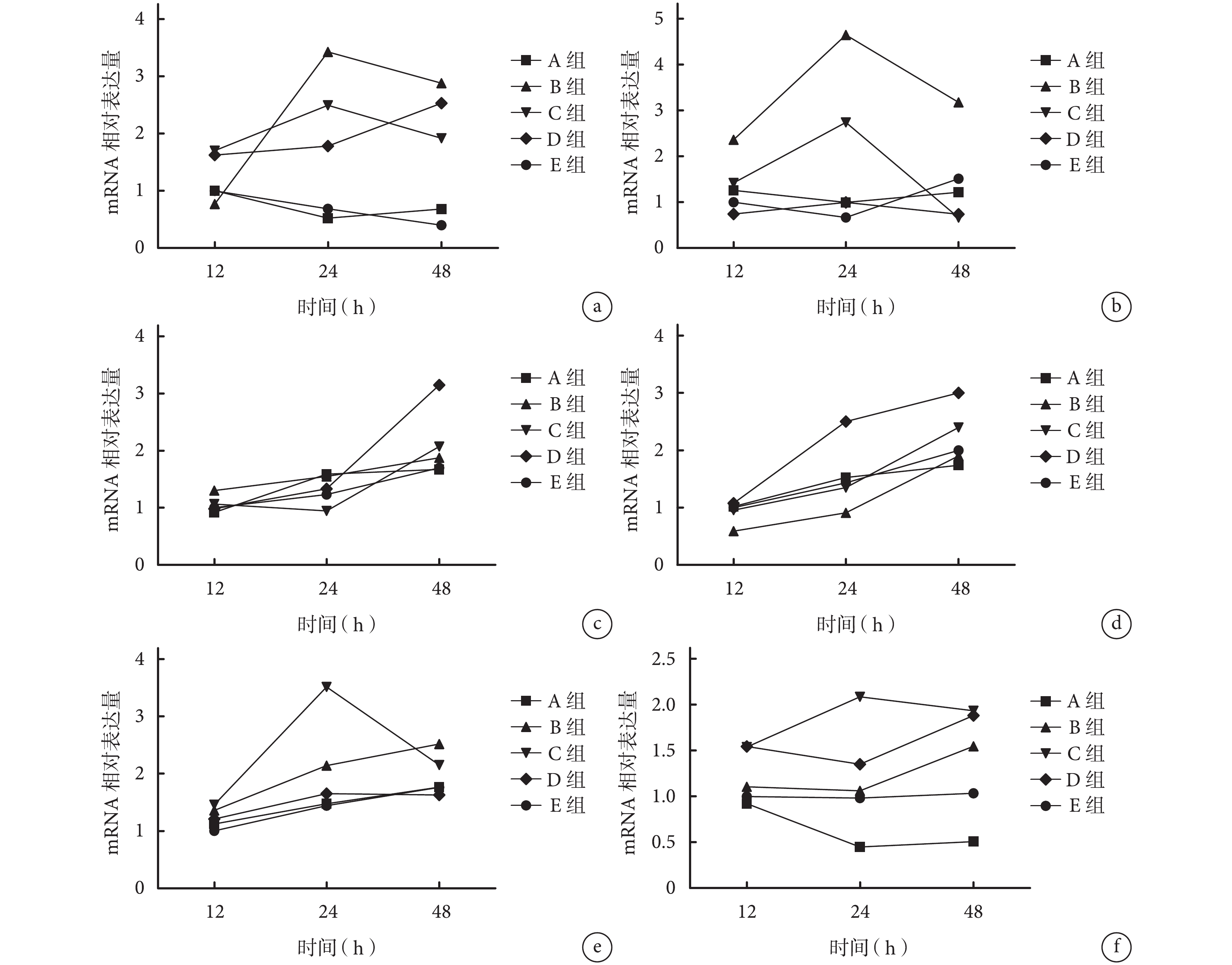
2.2.1 成腱分化相關基因 牽拉12 h,除B組SCX mRNA相對表達量及C、D組TNC mRNA相對表達量顯著高于其余各組,以及D組SCX mRNA相對表達量顯著低于其余各組,差異有統計學意義(P<0.05)外,其余各組間比較TNC和SCX mRNA相對表達量差異均無統計學意義(P>0.05)。
牽拉24 h,B、C、D組TNC mRNA相對表達量及B、C組SCX mRNA相對表達量顯著高于A、E組,差異有統計學意義(P<0.05);B、C、D組組間比較TNC及SCX mRNA相對表達量差異均有統計學意義(P<0.05);其余各組間比較差異均無統計學意義(P>0.05)。
牽拉48 h,除B組TNC和SCX mRNA相對表達量顯著高于其余各組,C、D組TNC mRNA相對表達量顯著高于A、E組,以及C、D組SCX mRNA相對表達量顯著低于其余各組,差異有統計學意義(P<0.05)外,其余各組間比較TNC和SCX mRNA相對表達量差異均無統計學意義(P>0.05)。見圖3a、b。
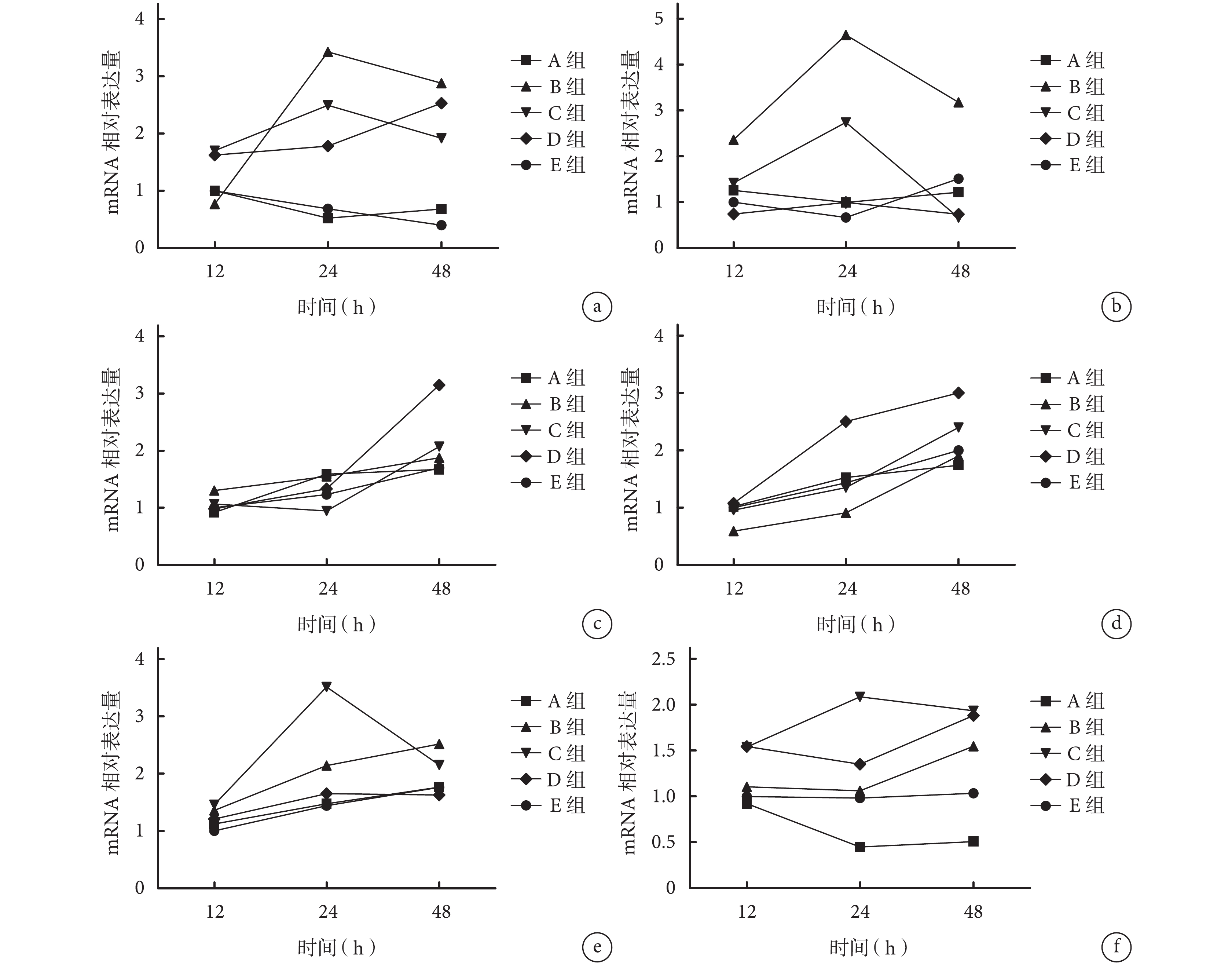 圖3
實時熒光定量 PCR 檢測各組各時間點分化相關基因 mRNA 表達 a. TNC;b. SCX;c. CEBPα;d. LPL;e. RUNX2;f. DLX5
Figure3.
The mRNA expressions of differentiation related genes in each group at different time points after mechanical stretch by real-time fluorescent quantitative PCR a. TNC; b. SCX; c. CEBPα; d. LPL; e. RUNX2; f. DLX5
圖3
實時熒光定量 PCR 檢測各組各時間點分化相關基因 mRNA 表達 a. TNC;b. SCX;c. CEBPα;d. LPL;e. RUNX2;f. DLX5
Figure3.
The mRNA expressions of differentiation related genes in each group at different time points after mechanical stretch by real-time fluorescent quantitative PCR a. TNC; b. SCX; c. CEBPα; d. LPL; e. RUNX2; f. DLX5
2.2.2 成脂分化相關基因 牽拉 12 h,除 B 組 LPL mRNA 相對表達量顯著低于其余各組(P<0.05)外,其余各組間比較 CEBPα 及 LPL mRNA 相對表達量差異均無統計學意義(P>0.05)。
牽拉 24 h,除 B 組 LPL mRNA 相對表達量顯著低于其余各組,D 組 LPL mRNA 相對表達量顯著高于其余各組(P<0.05)外,其余各組間比較 CEBPα 及 LPL mRNA 相對表達量差異均無統計學意義(P>0.05)。
牽拉 48 h,D 組 CEBPα 及 LPL mRNA 相對表達量均顯著高于其余各組,差異有統計學意義(P<0.05);其余各組間比較差異均無統計學意義(P>0.05)。見圖 3c、d。
2.2.3 成骨分化相關基因 牽拉 12 h,各組 RUNX2 mRNA 相對表達量比較差異均無統計學意義(P>0.05);C、D 組 DLX5 mRNA 相對表達量顯著高于其余各組(P<0.05),C、D 組間比較差異無統計學意義(P>0.05)。
牽拉 24 h,除 C 組 RUNX2 及 DLX5 mRNA 相對表達量顯著高于其余各組,A 組 DLX5 mRNA 相對表達量顯著低于其余各組(P<0.05)外,其余各組間比較 RUNX2 及 DLX5 mRNA 相對表達量差異均無統計學意義(P>0.05)。
牽拉 48 h,B 組 RUNX2 mRNA 相對表達量顯著高于其余各組(P<0.05),其余各組間比較差異無統計學意義(P>0.05)。A 組 DLX5 mRNA 相對表達量顯著低于其余各組(P<0.05);B、C、D 組顯著高于 E 組,C、D 組高于 B 組,差異均有統計學意義(P<0.05);C、D 組間比較差異無統計學意義(P>0.05)。見圖 3e、f。
2.3 Western blot 檢測分化相關蛋白表達
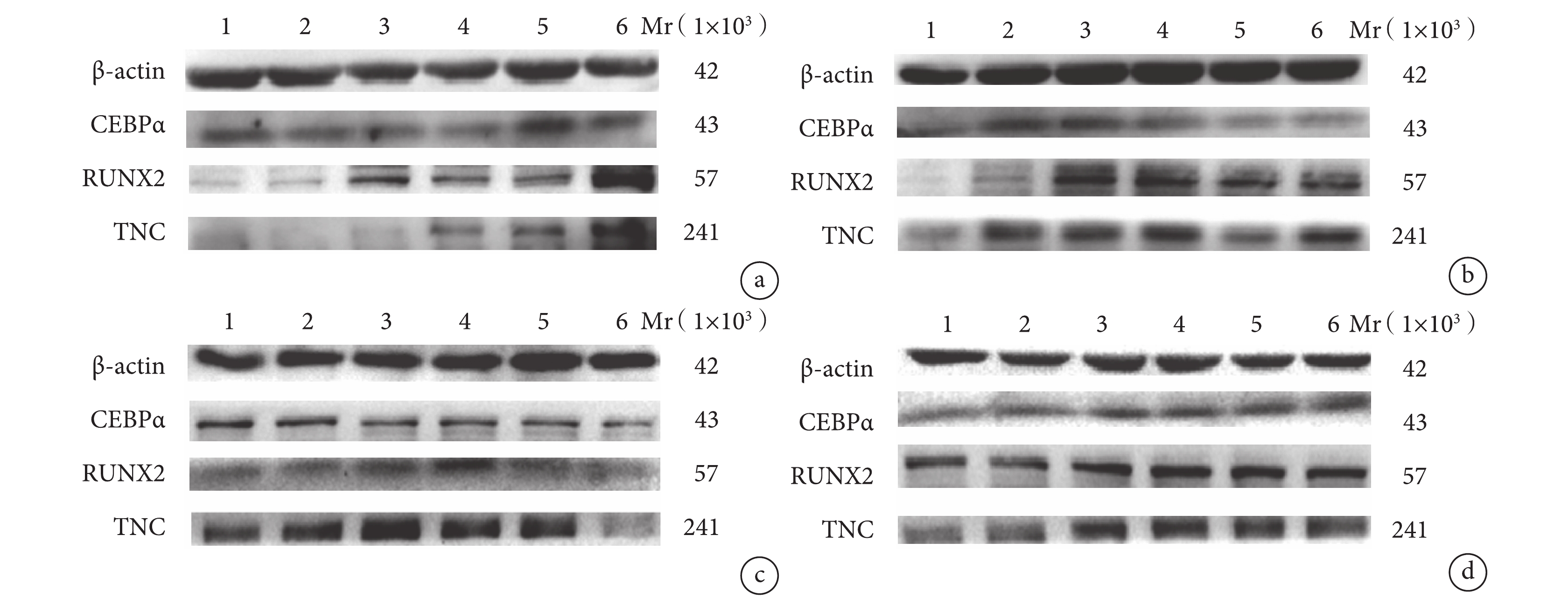
A 組:牽拉 12 h 成脂肪分化相關蛋白 CEBPα 相對表達量與 E 組比較差異無統計學意義(P>0.05);24、48 h 顯著低于 E 組,差異有統計學意義(P<0.05)。牽拉 12、24 h 成骨分化相關蛋白 RUNX2 相對表達量與 E 組比較差異無統計學意義(P>0.05);48 h 顯著高于 E 組,差異有統計學意義(P<0.05)。牽拉 12 h 成腱分化相關蛋白 TNC 相對表達量與 E 組比較差異無統計學意義(P>0.05);24、48 h 顯著高于 E 組,差異有統計學意義(P<0.05)。
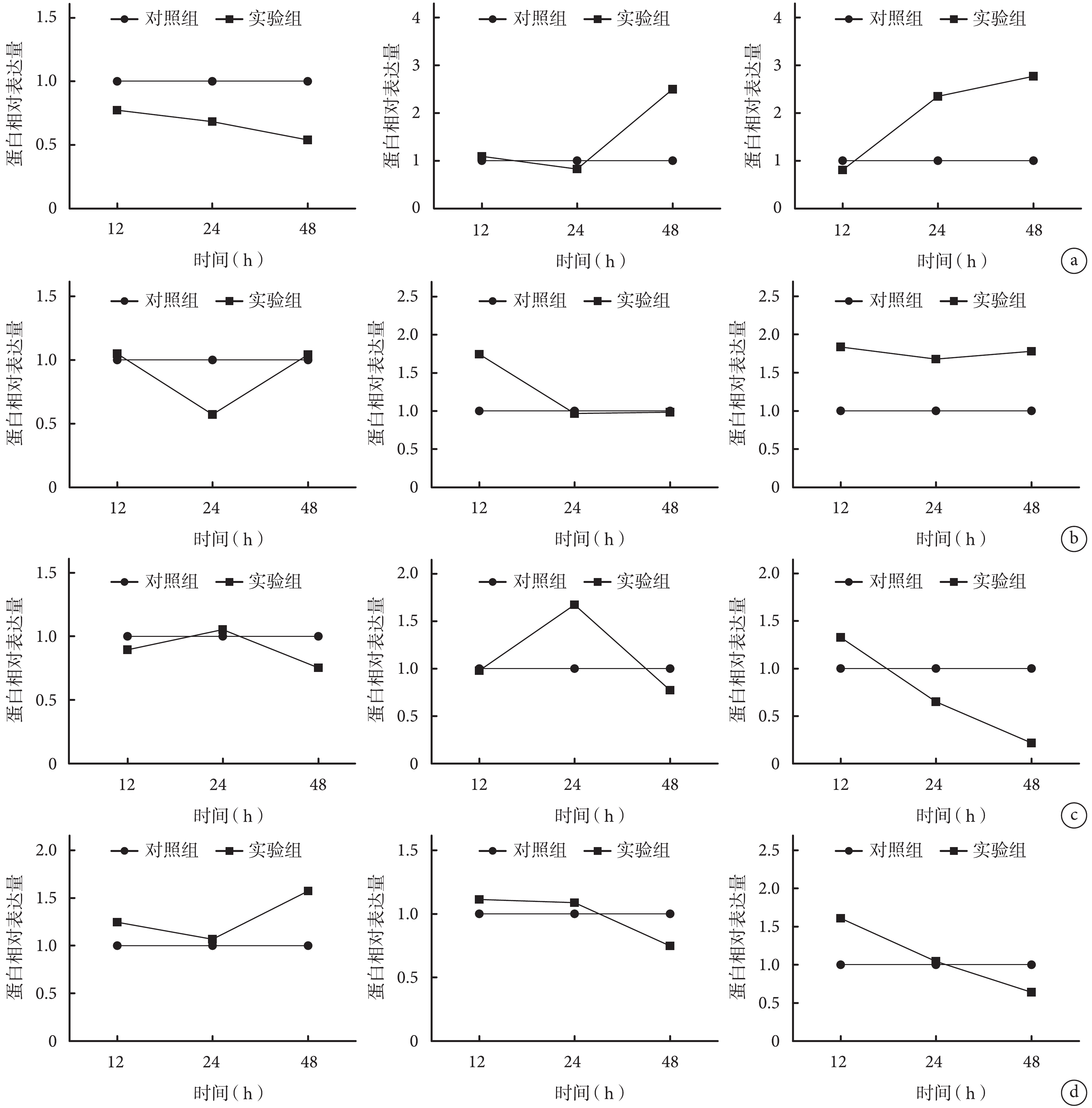
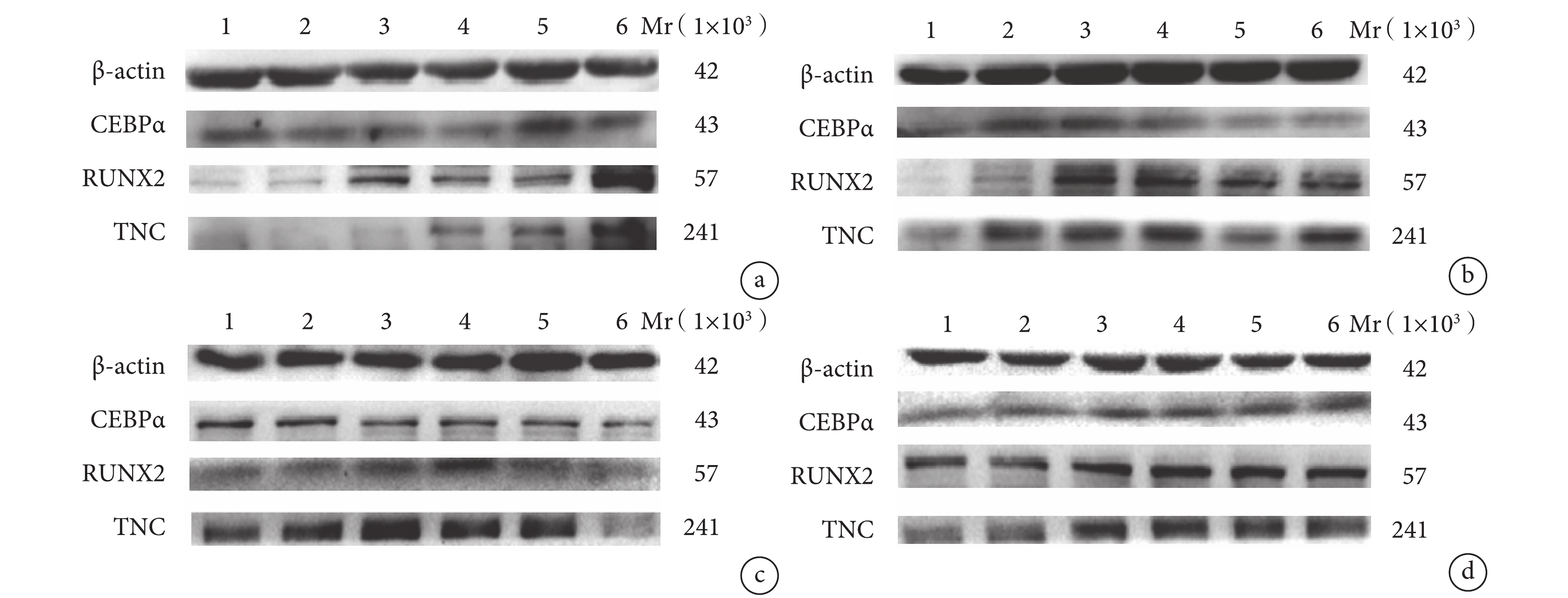 圖4
Western blot 檢測各組各時間點分化相關蛋白表達 1:E 組 12 h 2:實驗組 12 h 3:E 組 24 h 4:實驗組 24 h 5:E 組 48 h 6:實驗組 48 h a. A 組和 E 組;b. B 組和 E 組;c. C 組和 E 組;d. D 組和 E 組
Figure4.
The protein expressions of differentiation related proteins in each group at different time points after mechanical stretch by Western blot 1: Group E at 12 hours 2: Experiment group at 12 hours 3: Group E at 24 hours 4: Experimental group at 24 hours 5: Group E at 48 hours 6: Experimental group at 48 hours a. Group A and group E; b. Group B and group E; c. Group C and group E; d. Group D and group E
圖4
Western blot 檢測各組各時間點分化相關蛋白表達 1:E 組 12 h 2:實驗組 12 h 3:E 組 24 h 4:實驗組 24 h 5:E 組 48 h 6:實驗組 48 h a. A 組和 E 組;b. B 組和 E 組;c. C 組和 E 組;d. D 組和 E 組
Figure4.
The protein expressions of differentiation related proteins in each group at different time points after mechanical stretch by Western blot 1: Group E at 12 hours 2: Experiment group at 12 hours 3: Group E at 24 hours 4: Experimental group at 24 hours 5: Group E at 48 hours 6: Experimental group at 48 hours a. Group A and group E; b. Group B and group E; c. Group C and group E; d. Group D and group E
B 組:牽拉 12、48 h 成脂肪分化相關蛋白 CEBPα 相對表達量與E組比較差異無統計學意義(P>0.05);24 h 顯著低于E組,差異有統計學意義(P<0.05)。牽拉 24、48 h 成骨分化相關蛋白 RUNX2 相對表達量與 E 組比較差異無統計學意義(P>0.05);12 h 顯著高于 E 組,差異有統計學意義(P<0.05)。牽拉各時間點成腱分化相關蛋白 TNC 相對表達量均顯著高于 E 組,差異有統計學意義(P<0.05)。
C 組:牽拉各時間點成脂肪分化相關蛋白 CEBPα 相對表達量與 E 組比較差異均無統計學意義(P>0.05)。牽拉 12、48 h 成骨分化相關蛋白 RUNX2 相對表達量與 E 組比較差異無統計學意義(P>0.05);24 h 顯著高于 E 組,差異有統計學意義(P<0.05)。牽拉 12 h 成腱分化相關蛋白 TNC 相對表達量與 E 組比較差異無統計學意義(P>0.05);24、48 h 顯著低于E組,差異有統計學意義(P<0.05)。
D 組:牽拉 12、24 h 成脂肪分化相關蛋白 CEBPα 相對表達量與 E 組比較差異無統計學意義(P>0.05);48 h 顯著高于 E 組,差異有統計學意義(P<0.05)。牽拉各時間點成骨分化相關蛋白 RUNX2 相對表達量與 E 組比較差異均無統計學意義(P>0.05)。牽拉 12 h 成腱分化相關蛋白 TNC 相對表達量顯著高于 E 組,48 h 顯著低于 E 組,差異均有統計學意義(P<0.05);24 h 與對照組比較差異無統計學意義(P>0.05)。見圖 4、5。
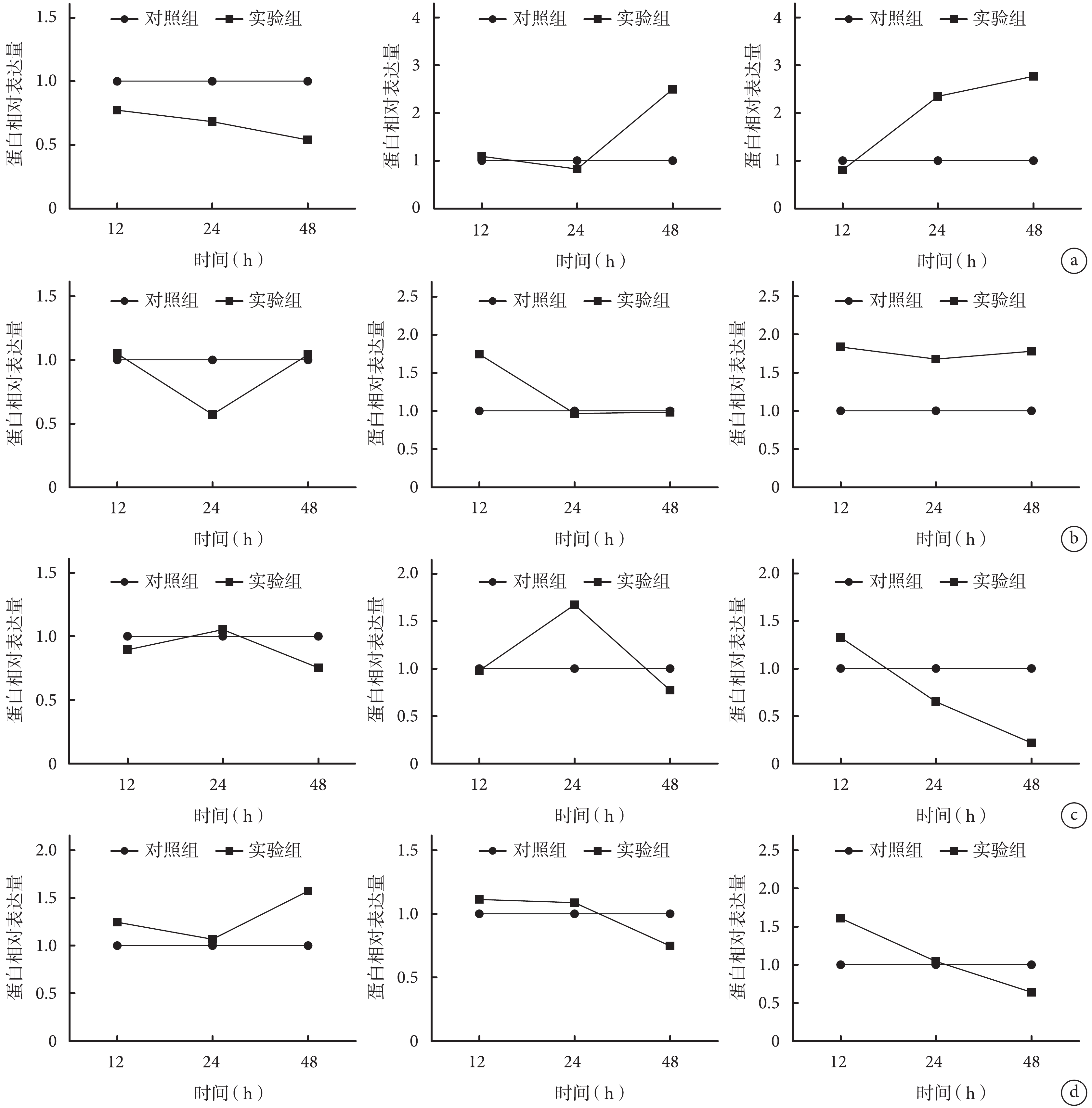 圖5
Western blot 檢測各組各時間點分化相關蛋白相對表達量 從左至右依次為 CEBPα、RUNX2、TNC a. A組;b. B組;c. C組;d. D組
Figure5.
The relative expressions of differentiation related proteins in each group at different time points after mechanical stretch by Western blot From left to right for CEBPα, RUNX2, TNC respectively a. Group A; b. Group B; c. Group C; d. Group D
圖5
Western blot 檢測各組各時間點分化相關蛋白相對表達量 從左至右依次為 CEBPα、RUNX2、TNC a. A組;b. B組;c. C組;d. D組
Figure5.
The relative expressions of differentiation related proteins in each group at different time points after mechanical stretch by Western blot From left to right for CEBPα, RUNX2, TNC respectively a. Group A; b. Group B; c. Group C; d. Group D
3 討論
肌腱病是一種臨床常見的慢性運動損傷性疾病,嚴重影響患者生活質量,其治療方法雖多,但由于其病因及發病機制尚未完全闡明,療效都不甚理想。肌腱是連接骨與骨骼肌的致密結締組織,主要功能是將力從肌肉傳遞到骨,從而引起運動[7,20-23]。臨床研究發現肌腱病最好發的部位正是受力學刺激最大的肌腱,如跟腱、肩袖及髕腱等,由此推斷機械力學刺激對于肌腱的代謝及病理生理功能具有至關重要的調節功能,因而目前大多數學者認為肌腱病的發生與過度使用引起肌腱微損傷有著直接聯系。
近年來隨著對肌腱病發病機制和治療策略的研究日益深入,TSCs逐漸走進國內外學者的視線。TSCs是 2007 年由 Bi 等[8]首次從小鼠和人中分離出的一種來源于肌腱組織的MSCs,其具有自我更新和多向分化潛能。文獻報道TSCs數量很少,僅占肌腱細胞的 3%~4%。雖然 TSCs 所占比例不高,但由于 TSCs 是肌腱細胞的唯一前體細胞,具有分化為肌腱細胞的潛能,因此 TSCs 對于肌腱生理功能的維持以及肌腱損傷修復具有重要作用。研究顯示 TSCs 同其他力學敏感性細胞(如成骨細胞、角膜細胞、BMSCs等)一樣,都能對外界機械刺激作出應答反應,同時機械應力刺激的強度、頻率及作用時間均會對細胞產生不同影響[24-25]。James H-C Wang 和本課題組前期研究發現,4%“適度”應力刺激會促進 TSCs 向成肌腱分化,而 8%“過度”應力刺激會促使 TSCs 向成骨和成脂肪異常分化[16,26]。該項發現同樣在大鼠跑臺訓練中得以驗證,“適度”跑臺訓練會促進體內 TSCs 向成肌腱分化,而“過度”跑臺訓練會使大鼠體內 TSCs 成骨、成脂肪異常分化[27],同時長期“過度”跑臺訓練還會使受訓大鼠出現肌腱病表現[28-29]。Sharma 等[30]發現當肌腱纖維應變量在 2%~4%時,彎曲的膠原纖維逐漸被拉直,排列更緊密,但仍處于彈性可復狀態,未見微觀的損傷;但應變量>4%時,便可見肌腱纖維微斷裂;當應變量超過 8%~10%,肌腱纖維就會迅速發生完全斷裂損傷。Shi 等[31]研究報道長時間單軸循環牽拉會引起 TSCs 成骨分化明顯增強。本課題組前期研究證實高頻率高強度機械牽伸會使 TSCs 增殖能力下降,同時成肌腱方向分化降低、向成骨方向分化增加[16]。然而,盡管機械刺激對 TSCs 分化的影響已有部分研究,但究竟何種牽拉條件才是適度牽拉,何種牽拉條件才是過度牽拉,以及誘導 TSCs 成骨、成脂肪及成肌腱特定分化的具體牽拉載荷參數并未見相關報道。針對上述問題,本課題組做了進一步研究。
本研究利用課題組自行研發設計的體外細胞單軸循環牽伸系統,對 TSCs 施加不同的單軸機械牽伸處理,觀察其對 TSCs 不同分化的影響,尋求不同分化的最佳機械牽伸條件。結果顯示 A 組牽拉 48 h 成腱分化相關基因 TNC 及成骨分化相關基因 RUNX2 較對照組均顯著升高(P<0.05),因而不作為牽拉誘導分化的最佳條件。B 組各牽拉時間點成腱分化相關基因 TNC 相對表達量較對照組均明顯升高(P<0.05),同時牽拉 24 h 時較對照組成脂分化相關基因 CEBPα 有顯著抑制作用(P<0.05),牽拉 24 h 時成骨分化相關蛋白 RUNX2 相對表達量較對照組無明顯差異(P>0.05),故選擇 4%、2 Hz、24 h 為成腱分化最佳牽拉條件。C 組牽拉 24 h 成骨分化相關基因 RUNX2 蛋白表達水平均顯著高于對照組(P<0.05),同時牽拉 24 h 時成腱及成脂肪分化相關蛋白表達與對照組無顯著升高(P>0.05),故選擇 8%、1 Hz、24 h 為成骨分化最佳牽拉條件;D 組牽拉 48 h 成脂肪分化相關基因 CEBPα 蛋白表達水平顯著高于對照組(P<0.05),同時牽拉 48 h 時成骨分化相關基因 RUNX2 較對照組相對表達量無明顯差異(P>0.05),成腱分化相關基因蛋白 TNC 表達較對照組顯著降低(P<0.05),故選擇 8%、2 Hz、48 h 為成脂肪分化最佳牽拉條件。
綜上述,該結果與文獻報道基本一致,4% 為 TSCs 成肌腱分化適度牽伸強度,8% 為過度牽伸強度,但機械牽拉最終效果必須結合牽拉頻率以及牽拉時間的作用綜合考慮。本研究為后期進一步對機械牽拉引起 TSCs 特定分化的機制研究提供了理論依據,但體外細胞適度牽拉條件如何與動物實驗的適度訓練條件進行匹配仍需進一步研究明確。
肌腱病是臨床常見的慢性運動損傷性疾病之一,以疼痛、局部腫脹、病變區域肌張力減低、功能障礙為主要表現。肌腱病發病率高,危害大且不易治愈,嚴重影響患者的生活質量[1-5]。然而,其發病機制至今尚未完全闡明,主要有“炎癥學說”、“退變性學說”、“過度使用學說”等多種理論,目前大多數學者認為肌腱病是由于過度使用引起肌腱微損傷而修復失敗導致[4,6-7]。進一步有研究顯示,肌腱干細胞(tendon stem cells,TSCs)作為肌腱細胞的重要前體細胞,對于肌腱病的發生具有重要作用[8-10]。文獻報道,機械應力刺激會引起骨細胞、成骨細胞、平滑肌細胞、成纖維細胞、MSCs 等多種力敏感性細胞增殖以及分化[11-14],同樣有研究報道力學刺激可促進 TSCs 分化[15-17],但具體機械牽伸載荷參數(牽拉強度、牽拉頻率及牽拉時間)與 TSCs 不同分化之間的相關性未見相關報道,對于不同分化的最佳牽拉載荷尚未闡明。本研究通過對大鼠 TSCs 體外加載不同機械牽伸,觀察 TSCs 不同分化相關基因變化情況,以期尋求特定分化的牽拉最佳方案。
1 材料與方法
1.1 實驗動物及主要試劑、儀器
8 周齡雄性 SD 大鼠 6 只,體質量 200~250 g,由第三軍醫大學實驗動物中心提供。
L-DMEM 培養基、胰蛋白酶(HyClone 公司,美國);FBS(GIBCO 公司,美國);纖維連接蛋白、分散酶 DispaseⅡ、Ⅰ 型膠原酶(Sigma 公司,美國);Trizol 試劑盒(Invitrogen 公司,美國);SYBR?Premix Ex TaqTM RT-PCR 逆轉錄試劑盒(Takara 公司,日本);Western blot 相關試劑盒、ECL 試劑盒、BCA 試劑盒(北京康為世紀生物科技有限公司);抗 β-actin抗體、抗細胞黏合素 C(Tenascin C,TNC)抗體、抗 CCAAT/增強子結合蛋白-α(CCAAT-enhancer-binding protein-α,CEBPα)抗體、抗 RUNX2 抗體(Abcam 公司,英國)。倒置相差顯微鏡(Olympus 公司,日本);激光共聚焦顯微鏡及照相系統 Nikon A1(Nikon 公司,日本);Nano-Drop2000 超微量分光光度計(Thermo 公司,美國);硅樹脂細胞牽拉皿(B-Bridge International公司,美國);iCycler 熒光定量 PCR 儀、Quantity One 軟件(Bio-Rad 公司,美國)。
1.2 大鼠 TSCs 分離及培養及鑒定
細胞培養:參考文獻[8,18]方法,取 8 周齡雄性 SD 大鼠 6 只,以高濃度 CO2 處死,75% 乙醇浸泡 5 min 消毒,于超凈工作臺提取兩側跟腱;去除腱周脂肪及腱膜等組織,PBS 沖洗 3 次;肌腱組織剪成 1 mm×1 mm 大小的組織碎塊,將組織碎塊轉入 15 mL 離心管中;加入 4 mg/mL DispaseⅡ 和 3 mg/mL Ⅰ 型膠原酶混合液 2 mL,室溫消化 2 h 后,500×g 離心 5 min,獲得細胞沉淀物;用含 20% FBS 的 DMEM 培養基重懸后,接種于細胞培養瓶中,37℃、5%CO2 細胞培養箱內靜置原代培養;以后每 3~4 天換液 1 次,4~7 d 后形成細胞克隆;待細胞融合 70%~80% 時進行細胞傳代,倒置相差顯微鏡下觀察細胞形態變化。
細胞鑒定:取 100 μL 第 3 代 TSCs 細胞懸液(密度為 5×105 個/mL)加入 1 μg PE 或 FITC 標記的 CD31、CD34、CD44、CD90 抗體,室溫避光孵育 45 min,PBS 沖洗 2 次;以 12 000×g 離心 5 min,棄上清;每個 EP 管中加入 300 μL 預冷的 Buffer 液重懸,流式細胞器儀檢測 TSCs 表面標記物表達情況。以 PE 或 FITC 標記的同型匹配的 IgG1 作為陰性對照,計算細胞各標記物陽性表達百分率。
1.3 實驗分組及方法
將大鼠第 3 代 TSCs 胰蛋白酶消化后制備成細胞懸液,按 1×105 個/cm2 密度接種于經 Fibronectin 預處理的硅膠牽拉培養皿,于 37℃、5%CO2 培養箱靜置培養 12 h 使細胞完全貼壁。將細胞隨機分為不同牽拉條件組(實驗組 A~D 組)及靜態培養組(對照組 E 組)。其中 A 組牽拉強度 4%、頻率 1 Hz,B 組牽拉強度 4%、頻率 2 Hz,C 組牽拉強度 8%、頻率 1 Hz,D 組牽拉強度 8%、頻率 2 Hz;利用本課題組自行研發的體外細胞單軸循環牽拉設備[19],沿培養皿長軸對 A~D 組細胞進行單軸循環機械牽伸。對照組E組采用靜態培養,未進行牽拉。分別處理 12、24、48 h 后收集各組細胞進行以下觀測。
1.4 觀測指標
1.4.1 實時熒光定量 PCR 檢測分化相關基因 mRNA 表達 按照 Trizol 試劑盒說明書,提取各組 TSCs 總 RNA,測定濃度后根據 SYBR?Premix Ex TaqTM RT-PCR 逆轉錄試劑盒說明書合成 cDNA。cDNA 合成條件為 37℃、15 min,85℃、5 s。然后按 20 μL 反應體系對 cDNA 進行 SYBR 熒光定量擴增檢測各基因[成腱分化相關基因 Scleraxis(SCX)、TNC,成脂肪分化相關基因 CEBPα、脂蛋白脂肪酶(lipo-prteinlipase,LPL)及成骨分化相關基因 RUNX2、遠端缺失基因 5(distal-less homeobox 5,DLX5)]表達情況。基因引物由上海英駿生物技術有限公司合成,引物序列見表 1。擴增條件:95℃ 變性 5 min;95℃ 變性 20 s,60℃ 退火 20 s,72℃ 延伸 30 s,40 個循環;最后溶解曲線分析以 0.5℃/s 加熱速率從 55℃ 至 95℃。以 2–ΔΔCt 法計算目的基因相對表達量,實驗重復 3 次,取均值。
1.4.2 Western blot 檢測分化相關蛋白表達 參照蛋白裂解液說明書提取各組細胞蛋白,用 BCA 法測量蛋白濃度,取 10 μg 蛋白行 SDS-PAGE 凝膠電泳,聚偏二氟乙烯膜轉膜,5 g/L 脫脂奶粉封閉 1 h;加入 β-actin一抗(1∶1 000)、RUNX2一抗(1∶1 000)、CEBPα一抗(1∶500)、TNC一抗(1∶1 000)4℃ 孵育過夜,二抗(1∶3 000)室溫孵育 2 h,TBST 洗膜 3 次,用 ECL 試劑盒顯影,應用 QuantityOne 軟件分析蛋白表達水平。實驗重復 3 次,取均值。
1.5 統計學方法
采用 SPSS18.0 統計軟件進行分析。數據以均數±標準差表示,組間比較采用多因素方差分析,兩兩比較采用 LSD 法檢驗;檢驗水準α=0.05。
2 結果
2.1 大鼠 TSCs 形態學觀察及鑒定
倒置相差顯微鏡觀察示,大鼠跟腱來源 TSCs 貼壁生長,呈鋪路石樣,第 1 代細胞貼壁后呈梭形生長。見圖 1。
 圖1
倒置相差顯微鏡觀察大鼠 TSCs 形態變化 a. 原代細胞培養 6 d(×40);b. 原代細胞培養 6 d(×100);c. 第 1 代細胞培養 4 d(×40)
Figure1.
The morphology observation of rat TSCs by inverted phase contrast microscope a. Primary TSCs cultured for 6 days (×40); b. Primary TSCs cultured for 6 days (×100); c. TSCs at passage 1 cultured for 4 days (×40)
圖1
倒置相差顯微鏡觀察大鼠 TSCs 形態變化 a. 原代細胞培養 6 d(×40);b. 原代細胞培養 6 d(×100);c. 第 1 代細胞培養 4 d(×40)
Figure1.
The morphology observation of rat TSCs by inverted phase contrast microscope a. Primary TSCs cultured for 6 days (×40); b. Primary TSCs cultured for 6 days (×100); c. TSCs at passage 1 cultured for 4 days (×40)
流式細胞術檢測示,大鼠 TSCs CD44、CD90 表達陽性,CD31、CD34 表達陰性。見圖 2。
 圖2
流式細胞儀檢測大鼠第 3 代 TSCs 表面標志物 a. CD31;b. CD34;c. CD44;d. CD90
Figure2.
The surface markers of TSCs at passage 3 by flow cytometric assay a. CD31; b. CD34; c. CD44; d. CD90
圖2
流式細胞儀檢測大鼠第 3 代 TSCs 表面標志物 a. CD31;b. CD34;c. CD44;d. CD90
Figure2.
The surface markers of TSCs at passage 3 by flow cytometric assay a. CD31; b. CD34; c. CD44; d. CD90
2.2 實時熒光定量 PCR 檢測分化相關基因 mRNA 表達
2.2.1 成腱分化相關基因 牽拉12 h,除B組SCX mRNA相對表達量及C、D組TNC mRNA相對表達量顯著高于其余各組,以及D組SCX mRNA相對表達量顯著低于其余各組,差異有統計學意義(P<0.05)外,其余各組間比較TNC和SCX mRNA相對表達量差異均無統計學意義(P>0.05)。
牽拉24 h,B、C、D組TNC mRNA相對表達量及B、C組SCX mRNA相對表達量顯著高于A、E組,差異有統計學意義(P<0.05);B、C、D組組間比較TNC及SCX mRNA相對表達量差異均有統計學意義(P<0.05);其余各組間比較差異均無統計學意義(P>0.05)。
牽拉48 h,除B組TNC和SCX mRNA相對表達量顯著高于其余各組,C、D組TNC mRNA相對表達量顯著高于A、E組,以及C、D組SCX mRNA相對表達量顯著低于其余各組,差異有統計學意義(P<0.05)外,其余各組間比較TNC和SCX mRNA相對表達量差異均無統計學意義(P>0.05)。見圖3a、b。
 圖3
實時熒光定量 PCR 檢測各組各時間點分化相關基因 mRNA 表達 a. TNC;b. SCX;c. CEBPα;d. LPL;e. RUNX2;f. DLX5
Figure3.
The mRNA expressions of differentiation related genes in each group at different time points after mechanical stretch by real-time fluorescent quantitative PCR a. TNC; b. SCX; c. CEBPα; d. LPL; e. RUNX2; f. DLX5
圖3
實時熒光定量 PCR 檢測各組各時間點分化相關基因 mRNA 表達 a. TNC;b. SCX;c. CEBPα;d. LPL;e. RUNX2;f. DLX5
Figure3.
The mRNA expressions of differentiation related genes in each group at different time points after mechanical stretch by real-time fluorescent quantitative PCR a. TNC; b. SCX; c. CEBPα; d. LPL; e. RUNX2; f. DLX5
2.2.2 成脂分化相關基因 牽拉 12 h,除 B 組 LPL mRNA 相對表達量顯著低于其余各組(P<0.05)外,其余各組間比較 CEBPα 及 LPL mRNA 相對表達量差異均無統計學意義(P>0.05)。
牽拉 24 h,除 B 組 LPL mRNA 相對表達量顯著低于其余各組,D 組 LPL mRNA 相對表達量顯著高于其余各組(P<0.05)外,其余各組間比較 CEBPα 及 LPL mRNA 相對表達量差異均無統計學意義(P>0.05)。
牽拉 48 h,D 組 CEBPα 及 LPL mRNA 相對表達量均顯著高于其余各組,差異有統計學意義(P<0.05);其余各組間比較差異均無統計學意義(P>0.05)。見圖 3c、d。
2.2.3 成骨分化相關基因 牽拉 12 h,各組 RUNX2 mRNA 相對表達量比較差異均無統計學意義(P>0.05);C、D 組 DLX5 mRNA 相對表達量顯著高于其余各組(P<0.05),C、D 組間比較差異無統計學意義(P>0.05)。
牽拉 24 h,除 C 組 RUNX2 及 DLX5 mRNA 相對表達量顯著高于其余各組,A 組 DLX5 mRNA 相對表達量顯著低于其余各組(P<0.05)外,其余各組間比較 RUNX2 及 DLX5 mRNA 相對表達量差異均無統計學意義(P>0.05)。
牽拉 48 h,B 組 RUNX2 mRNA 相對表達量顯著高于其余各組(P<0.05),其余各組間比較差異無統計學意義(P>0.05)。A 組 DLX5 mRNA 相對表達量顯著低于其余各組(P<0.05);B、C、D 組顯著高于 E 組,C、D 組高于 B 組,差異均有統計學意義(P<0.05);C、D 組間比較差異無統計學意義(P>0.05)。見圖 3e、f。
2.3 Western blot 檢測分化相關蛋白表達
A 組:牽拉 12 h 成脂肪分化相關蛋白 CEBPα 相對表達量與 E 組比較差異無統計學意義(P>0.05);24、48 h 顯著低于 E 組,差異有統計學意義(P<0.05)。牽拉 12、24 h 成骨分化相關蛋白 RUNX2 相對表達量與 E 組比較差異無統計學意義(P>0.05);48 h 顯著高于 E 組,差異有統計學意義(P<0.05)。牽拉 12 h 成腱分化相關蛋白 TNC 相對表達量與 E 組比較差異無統計學意義(P>0.05);24、48 h 顯著高于 E 組,差異有統計學意義(P<0.05)。
 圖4
Western blot 檢測各組各時間點分化相關蛋白表達 1:E 組 12 h 2:實驗組 12 h 3:E 組 24 h 4:實驗組 24 h 5:E 組 48 h 6:實驗組 48 h a. A 組和 E 組;b. B 組和 E 組;c. C 組和 E 組;d. D 組和 E 組
Figure4.
The protein expressions of differentiation related proteins in each group at different time points after mechanical stretch by Western blot 1: Group E at 12 hours 2: Experiment group at 12 hours 3: Group E at 24 hours 4: Experimental group at 24 hours 5: Group E at 48 hours 6: Experimental group at 48 hours a. Group A and group E; b. Group B and group E; c. Group C and group E; d. Group D and group E
圖4
Western blot 檢測各組各時間點分化相關蛋白表達 1:E 組 12 h 2:實驗組 12 h 3:E 組 24 h 4:實驗組 24 h 5:E 組 48 h 6:實驗組 48 h a. A 組和 E 組;b. B 組和 E 組;c. C 組和 E 組;d. D 組和 E 組
Figure4.
The protein expressions of differentiation related proteins in each group at different time points after mechanical stretch by Western blot 1: Group E at 12 hours 2: Experiment group at 12 hours 3: Group E at 24 hours 4: Experimental group at 24 hours 5: Group E at 48 hours 6: Experimental group at 48 hours a. Group A and group E; b. Group B and group E; c. Group C and group E; d. Group D and group E
B 組:牽拉 12、48 h 成脂肪分化相關蛋白 CEBPα 相對表達量與E組比較差異無統計學意義(P>0.05);24 h 顯著低于E組,差異有統計學意義(P<0.05)。牽拉 24、48 h 成骨分化相關蛋白 RUNX2 相對表達量與 E 組比較差異無統計學意義(P>0.05);12 h 顯著高于 E 組,差異有統計學意義(P<0.05)。牽拉各時間點成腱分化相關蛋白 TNC 相對表達量均顯著高于 E 組,差異有統計學意義(P<0.05)。
C 組:牽拉各時間點成脂肪分化相關蛋白 CEBPα 相對表達量與 E 組比較差異均無統計學意義(P>0.05)。牽拉 12、48 h 成骨分化相關蛋白 RUNX2 相對表達量與 E 組比較差異無統計學意義(P>0.05);24 h 顯著高于 E 組,差異有統計學意義(P<0.05)。牽拉 12 h 成腱分化相關蛋白 TNC 相對表達量與 E 組比較差異無統計學意義(P>0.05);24、48 h 顯著低于E組,差異有統計學意義(P<0.05)。
D 組:牽拉 12、24 h 成脂肪分化相關蛋白 CEBPα 相對表達量與 E 組比較差異無統計學意義(P>0.05);48 h 顯著高于 E 組,差異有統計學意義(P<0.05)。牽拉各時間點成骨分化相關蛋白 RUNX2 相對表達量與 E 組比較差異均無統計學意義(P>0.05)。牽拉 12 h 成腱分化相關蛋白 TNC 相對表達量顯著高于 E 組,48 h 顯著低于 E 組,差異均有統計學意義(P<0.05);24 h 與對照組比較差異無統計學意義(P>0.05)。見圖 4、5。
 圖5
Western blot 檢測各組各時間點分化相關蛋白相對表達量 從左至右依次為 CEBPα、RUNX2、TNC a. A組;b. B組;c. C組;d. D組
Figure5.
The relative expressions of differentiation related proteins in each group at different time points after mechanical stretch by Western blot From left to right for CEBPα, RUNX2, TNC respectively a. Group A; b. Group B; c. Group C; d. Group D
圖5
Western blot 檢測各組各時間點分化相關蛋白相對表達量 從左至右依次為 CEBPα、RUNX2、TNC a. A組;b. B組;c. C組;d. D組
Figure5.
The relative expressions of differentiation related proteins in each group at different time points after mechanical stretch by Western blot From left to right for CEBPα, RUNX2, TNC respectively a. Group A; b. Group B; c. Group C; d. Group D
3 討論
肌腱病是一種臨床常見的慢性運動損傷性疾病,嚴重影響患者生活質量,其治療方法雖多,但由于其病因及發病機制尚未完全闡明,療效都不甚理想。肌腱是連接骨與骨骼肌的致密結締組織,主要功能是將力從肌肉傳遞到骨,從而引起運動[7,20-23]。臨床研究發現肌腱病最好發的部位正是受力學刺激最大的肌腱,如跟腱、肩袖及髕腱等,由此推斷機械力學刺激對于肌腱的代謝及病理生理功能具有至關重要的調節功能,因而目前大多數學者認為肌腱病的發生與過度使用引起肌腱微損傷有著直接聯系。
近年來隨著對肌腱病發病機制和治療策略的研究日益深入,TSCs逐漸走進國內外學者的視線。TSCs是 2007 年由 Bi 等[8]首次從小鼠和人中分離出的一種來源于肌腱組織的MSCs,其具有自我更新和多向分化潛能。文獻報道TSCs數量很少,僅占肌腱細胞的 3%~4%。雖然 TSCs 所占比例不高,但由于 TSCs 是肌腱細胞的唯一前體細胞,具有分化為肌腱細胞的潛能,因此 TSCs 對于肌腱生理功能的維持以及肌腱損傷修復具有重要作用。研究顯示 TSCs 同其他力學敏感性細胞(如成骨細胞、角膜細胞、BMSCs等)一樣,都能對外界機械刺激作出應答反應,同時機械應力刺激的強度、頻率及作用時間均會對細胞產生不同影響[24-25]。James H-C Wang 和本課題組前期研究發現,4%“適度”應力刺激會促進 TSCs 向成肌腱分化,而 8%“過度”應力刺激會促使 TSCs 向成骨和成脂肪異常分化[16,26]。該項發現同樣在大鼠跑臺訓練中得以驗證,“適度”跑臺訓練會促進體內 TSCs 向成肌腱分化,而“過度”跑臺訓練會使大鼠體內 TSCs 成骨、成脂肪異常分化[27],同時長期“過度”跑臺訓練還會使受訓大鼠出現肌腱病表現[28-29]。Sharma 等[30]發現當肌腱纖維應變量在 2%~4%時,彎曲的膠原纖維逐漸被拉直,排列更緊密,但仍處于彈性可復狀態,未見微觀的損傷;但應變量>4%時,便可見肌腱纖維微斷裂;當應變量超過 8%~10%,肌腱纖維就會迅速發生完全斷裂損傷。Shi 等[31]研究報道長時間單軸循環牽拉會引起 TSCs 成骨分化明顯增強。本課題組前期研究證實高頻率高強度機械牽伸會使 TSCs 增殖能力下降,同時成肌腱方向分化降低、向成骨方向分化增加[16]。然而,盡管機械刺激對 TSCs 分化的影響已有部分研究,但究竟何種牽拉條件才是適度牽拉,何種牽拉條件才是過度牽拉,以及誘導 TSCs 成骨、成脂肪及成肌腱特定分化的具體牽拉載荷參數并未見相關報道。針對上述問題,本課題組做了進一步研究。
本研究利用課題組自行研發設計的體外細胞單軸循環牽伸系統,對 TSCs 施加不同的單軸機械牽伸處理,觀察其對 TSCs 不同分化的影響,尋求不同分化的最佳機械牽伸條件。結果顯示 A 組牽拉 48 h 成腱分化相關基因 TNC 及成骨分化相關基因 RUNX2 較對照組均顯著升高(P<0.05),因而不作為牽拉誘導分化的最佳條件。B 組各牽拉時間點成腱分化相關基因 TNC 相對表達量較對照組均明顯升高(P<0.05),同時牽拉 24 h 時較對照組成脂分化相關基因 CEBPα 有顯著抑制作用(P<0.05),牽拉 24 h 時成骨分化相關蛋白 RUNX2 相對表達量較對照組無明顯差異(P>0.05),故選擇 4%、2 Hz、24 h 為成腱分化最佳牽拉條件。C 組牽拉 24 h 成骨分化相關基因 RUNX2 蛋白表達水平均顯著高于對照組(P<0.05),同時牽拉 24 h 時成腱及成脂肪分化相關蛋白表達與對照組無顯著升高(P>0.05),故選擇 8%、1 Hz、24 h 為成骨分化最佳牽拉條件;D 組牽拉 48 h 成脂肪分化相關基因 CEBPα 蛋白表達水平顯著高于對照組(P<0.05),同時牽拉 48 h 時成骨分化相關基因 RUNX2 較對照組相對表達量無明顯差異(P>0.05),成腱分化相關基因蛋白 TNC 表達較對照組顯著降低(P<0.05),故選擇 8%、2 Hz、48 h 為成脂肪分化最佳牽拉條件。
綜上述,該結果與文獻報道基本一致,4% 為 TSCs 成肌腱分化適度牽伸強度,8% 為過度牽伸強度,但機械牽拉最終效果必須結合牽拉頻率以及牽拉時間的作用綜合考慮。本研究為后期進一步對機械牽拉引起 TSCs 特定分化的機制研究提供了理論依據,但體外細胞適度牽拉條件如何與動物實驗的適度訓練條件進行匹配仍需進一步研究明確。