引用本文: 朱雙龍, 段會全, 劉英富, 李光宗, 劉迎節, 黃夢強, 陳旭義, 徐云強. 柴胡皂苷 a 對大鼠急性脊髓損傷的神經保護作用與機制研究. 中國修復重建外科雜志, 2017, 31(7): 825-829. doi: 10.7507/1002-1892.201702106 復制
版權信息: ?四川大學華西醫院華西期刊社《中國修復重建外科雜志》版權所有,未經授權不得轉載、改編
近年來,脊髓損傷發病率不斷增加,臨床上對脊髓損傷病理機制的理解和早期治療等方面取得了一些進展,但成果均不理想[1]。目前觀點認為,脊髓損傷后引起的繼發性損傷導致的組織出血、水腫、細胞凋亡、免疫炎癥等級聯反應對脊髓神經組織的破壞具有重要作用并影響預后,其中炎性反應在脊髓繼發性損傷中扮演了重要角色[2]。脊髓損傷后組織水腫、血管-脊髓屏障損傷和神經元壞死與炎性反應密切相關,神經再生被抑制[3]。炎性反應刺激以及微血管破壞激發了水通道蛋白 4(aqua-porin 4,AQP4)高表達,加重了神經細胞水腫,加速細胞凋亡[4]。
隨著我國傳統中醫學的發展,中醫藥對脊髓損傷治療的作用越來越被重視[5-7]。柴胡皂苷 a(saiko-saponin a,SSa)是源自柴胡的主要活性成分,分子式為 C42H68O13,相對分子質量為 780.98,其藥理學作用廣泛,具有抗炎、免疫調節及抗菌等作用[8]。近年研究發現,SSa 在顱腦創傷后能顯著降低腦組織水腫蛋白 AQP4 表達,具有抗氧化應激反應和抗炎性反應,從而促進神經功能恢復,但相關作用機制仍未明確[9]。
本實驗通過建立大鼠脊髓損傷模型,腹腔注射 SSa,觀察比較損傷脊髓組織形態結構變化以及水腫蛋白 AQP4、蛋白 NF-κB P65、蛋白 NF-κB P-P65、炎性因子表達情況,探討 SSa 對大鼠脊髓損傷后的保護作用機制,為預防和治療脊髓損傷提供新的思路。
1 材料與方法
1.1 實驗動物及主要試劑、儀器
健康成年雌性 SD 大鼠 72 只,體質量 220~250 g,由中國人民解放軍軍事醫學科學院衛生學環境醫學研究所提供。
一抗大鼠 NF-κB P65、NF-κB P-P65、AQP4 抗體(Abcam 公司,美國);SSa(上海源葉生物科技有限公司);TNF-α ELISA、IL-6 ELISA 抗體和相關試劑盒(武漢六合生物技術有限公司)。4℃ 低溫離心機(Eppendorf 公司,德國);酶標儀(Thermo Fisher Scientific 公司,芬蘭);CO2 細胞培養箱(Forma Scientifis 公司,美國);高壓滅菌箱(山東新華醫療器械有限公司);快速組織細胞破碎儀(上海凈信科技有限公司);倒置相差顯微鏡(Nikon 公司,日本)。
1.2 實驗分組及方法
將 SD 大鼠隨機分為 3 組:假手術組(A 組)、脊髓損傷組(B 組)和 SSa 處理組(C 組),每組 24 只。A 組大鼠以 5% 水合氯醛(0.6 mL/100 g)腹腔注射麻醉后,僅切除 T9~T11 椎板,不作其他處理。B、C 組參考文獻[2,6]方法,利用改良 Allen 重物打擊法制作大鼠脊髓損傷模型:同上法麻醉大鼠后,沿肩胛骨向下逐個計數直至定位 T10;以 T10 為中心逐層分離,暴露 T9~T11 節段,使用微型咬骨鉗咬除 1/2(T9~T11)棘突及其兩側椎板暴露脊髓。將重 10 g、直徑 2.5 mm 打擊錘定位打擊位置于 T10 節段,高度調整為 5 cm 后打擊;打擊后見大鼠雙后肢抽動、甩尾,隨后完全松弛,提示造模成功。C 組于造模后即刻用 5 mL 無菌注射器經腹部表皮斜刺進針,之后垂直入針,回抽判斷是否回血,無回血則給予大鼠腹腔注射 SSa(10 mg/kg)1 次(根據文獻[9],本實驗選擇 5、10、20 mg/kg 藥物濃度進行比較,確定 10 mg/kg 為最優藥物濃度選擇);BBB 評分和斜板實驗大鼠每天腹腔注射 1 次,連續 1 周。B 組注入等量生理鹽水。術后大鼠單籠飼養,防止感染。術后 24 h 各組分別取 18 只大鼠同上法麻醉后,取損傷節段脊髓組織保存待測;每組其余 6 只大鼠采用 BBB 評分和斜板實驗評價雙下肢運動恢復情況。
1.3 觀測指標
1.3.1 BBB 評分 術后 1、3、7、14、21、28 d 采用 BBB 評分評價各組大鼠后肢運動功能,取每只大鼠左右側肢體評分均值作為最終評分。
1.3.2 斜板實驗 術后 1、3、7、14、21、28 d 進行斜板實驗,在斜板上將鼠頭朝向上、下、左、右,記錄其保持 5 s 的最大角度。
1.3.3 ELISA 檢測 取出保存的各組脊髓組織,加入 PBS 溶液后,在組織細胞破碎儀中以 900×g 勻漿 6 min,低溫條件下(4℃)以 450×g 離心 20 min;取上清液,按照 TNF-α、IL-6 ELISA 試劑盒說明書進行操作,加終止液后混勻,酶標儀進行檢測,測量脊髓組織中炎性因子 TNF-α、IL-6 表達濃度。
1.3.4 Western blot 檢測 取出保存的各組脊髓組織,稱重后加入一定量蛋白裂解液,放置于組織細胞破碎儀中研磨,充分裂解;以 12 000×g 離心 15 min,取出上清,BCA 法測定總蛋白濃度。經過加樣、電泳、轉膜、封閉、一抗 1∶5 000 孵育過夜,二抗 1∶10 000 孵育 1 h,加入顯色劑顯色,以 GAPDH 作為內參。顯影儀顯影,Image J 軟件測算蛋白灰度值,計算目的蛋白 NF-κB P65、NF-κB P-P65 和 AQP4 蛋白與 GAPDH 灰度值的比值,作為其相對表達量。
1.3.5 HE 染色觀察 術后 24 h 采用多聚甲醛灌注,取出各實驗組脊髓組織,置于 4% 多聚甲醛固定 48 h,石蠟包埋,從損傷脊髓中心部位連續切片,片厚 5 μm,行 HE 染色,倒置相差顯微鏡下觀察脊髓損傷處灰質區的形態學改變。
1.4 統計學方法
采用 SPSS22.0 統計軟件進行分析。數據以均數±標準差表示,組間比較采用單因素方差分析,兩兩比較采用 LSD 檢驗;檢驗水準 α=0.05。
2 結果
2.1 BBB 評分和斜板實驗
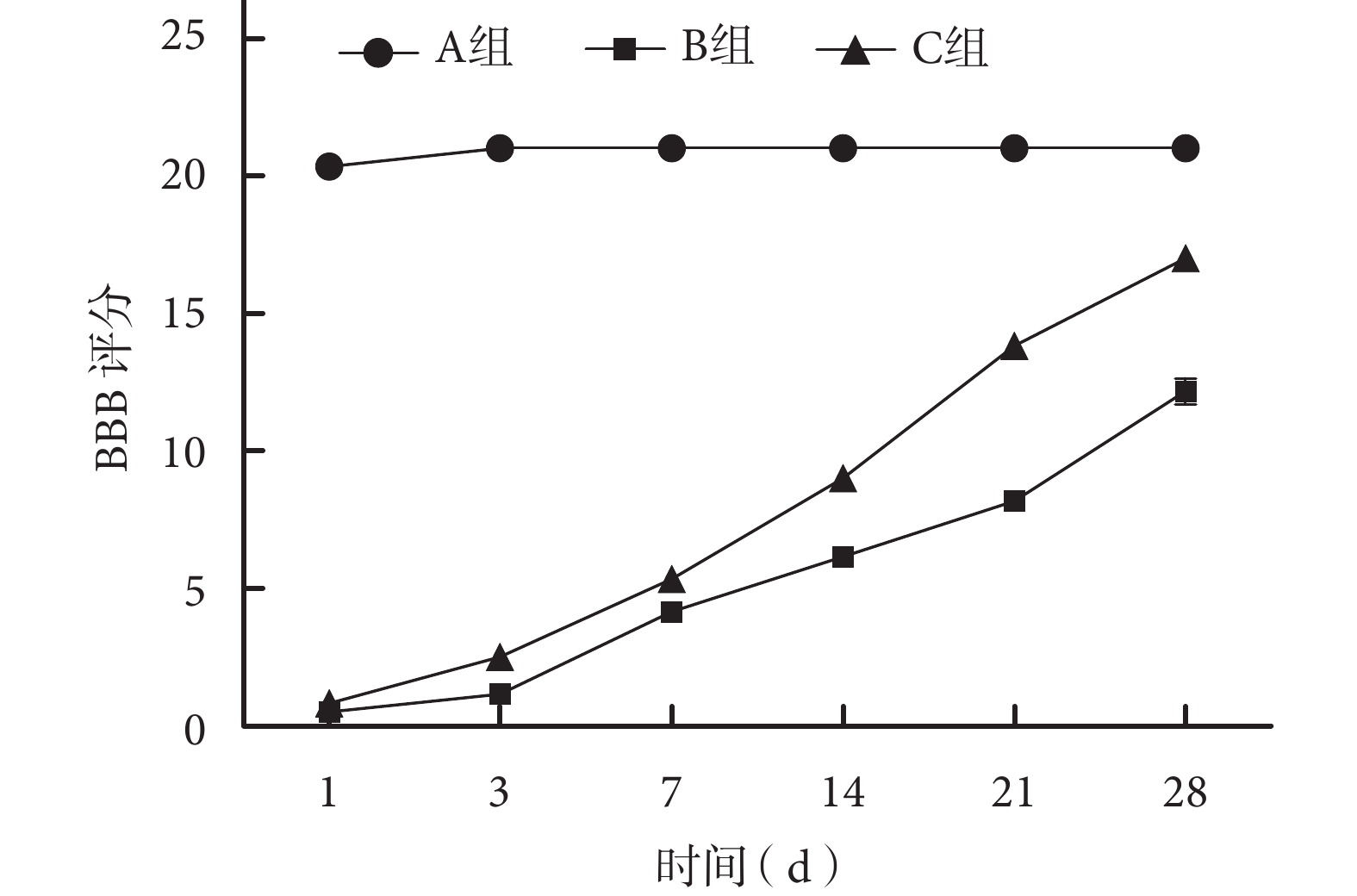
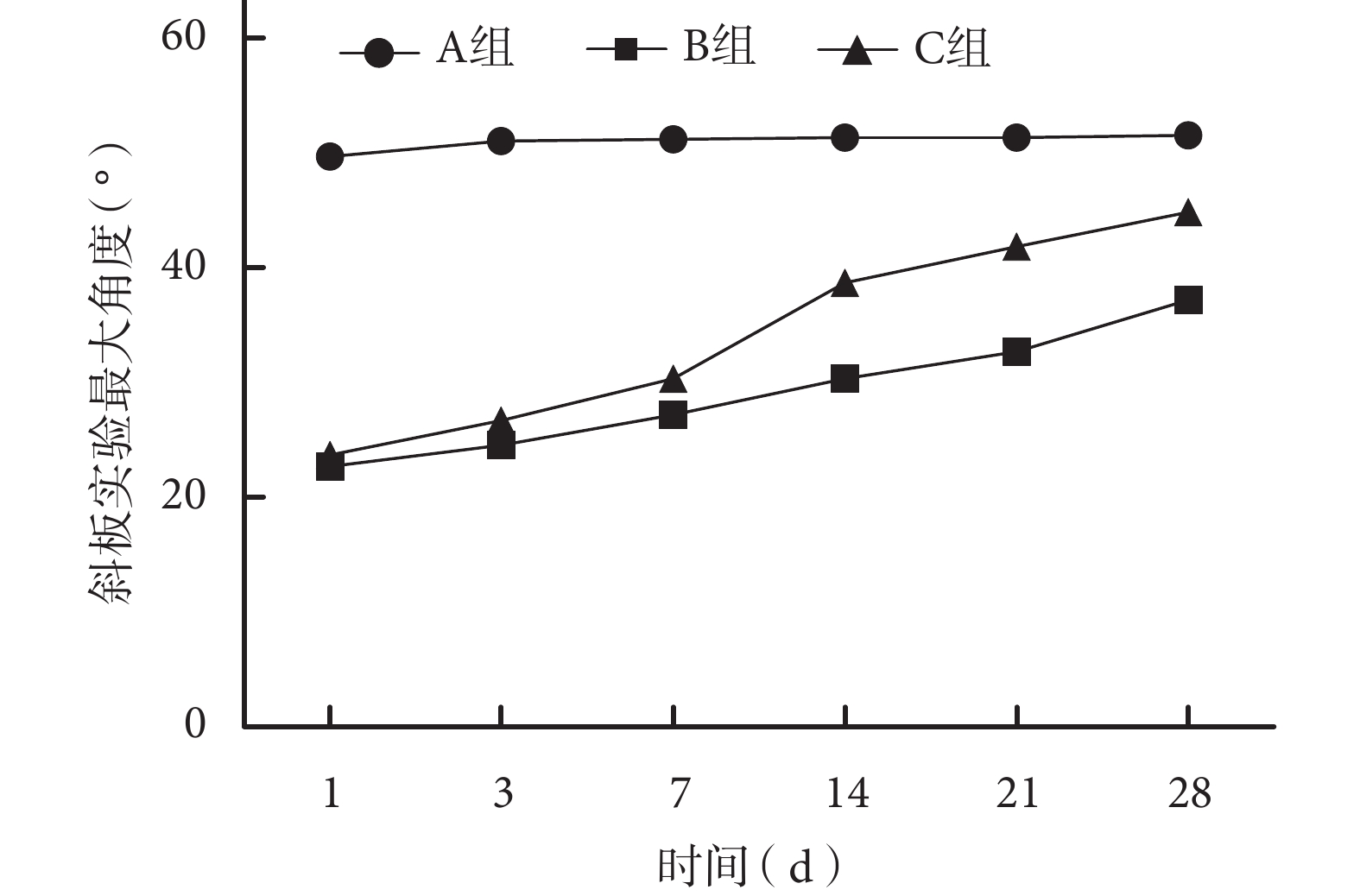
術后各組大鼠均順利存活至實驗完成,切口無紅腫等感染表現。術后各時間點 A 組 BBB 評分和斜板實驗最大角度均顯著高于 B、C 組,差異有統計學意義(P<0.05);術后 14、21、28 d C 組上述指標顯著高于 B 組,差異有統計學意義(P<0.05)。見圖 1、2。
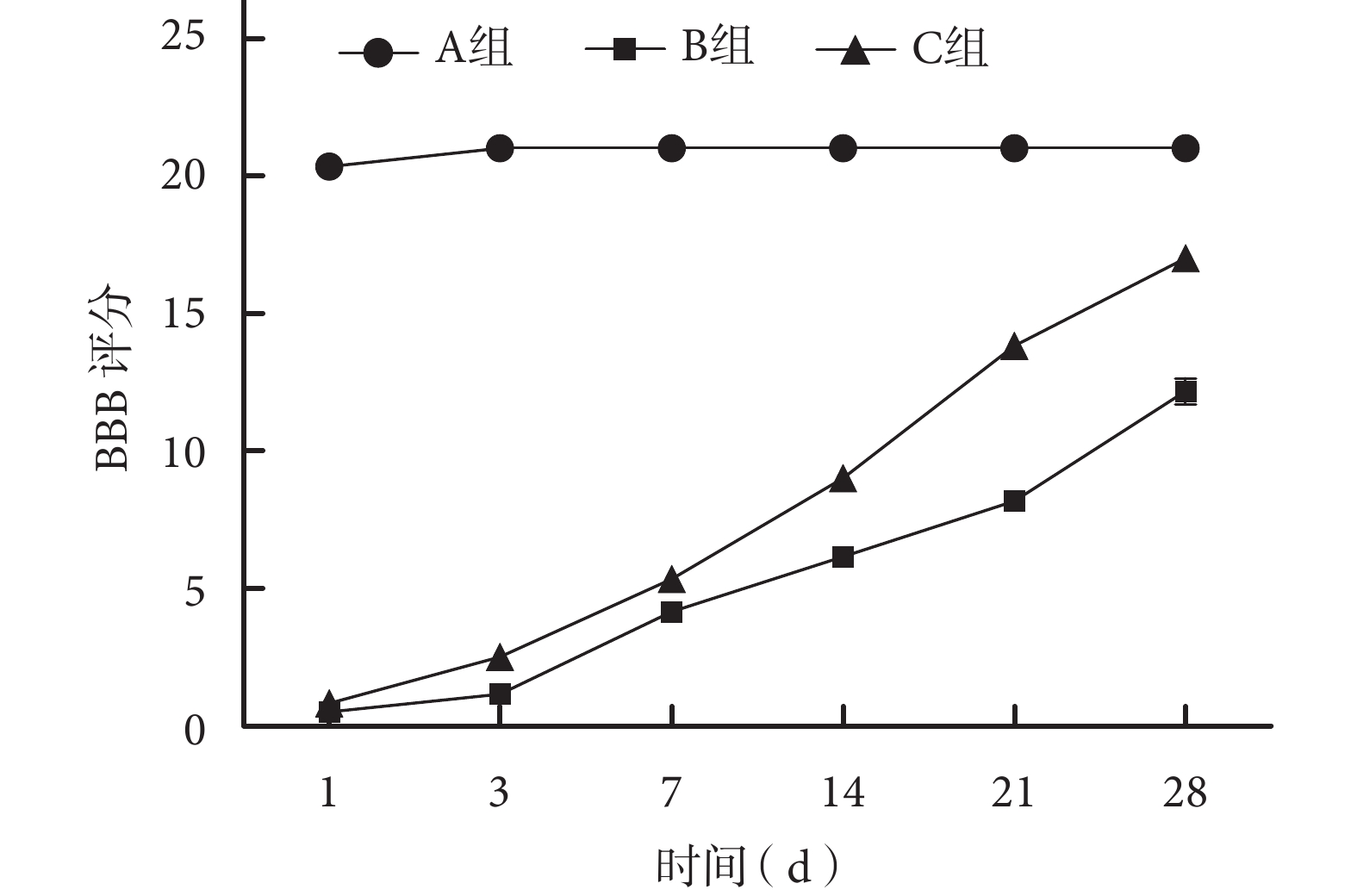 圖1
術后各時間點各組大鼠后肢運動功能 BBB 評分
Figure1.
BBB scores of rats hindlimb motor function at each time point after operation in each group
圖1
術后各時間點各組大鼠后肢運動功能 BBB 評分
Figure1.
BBB scores of rats hindlimb motor function at each time point after operation in each group
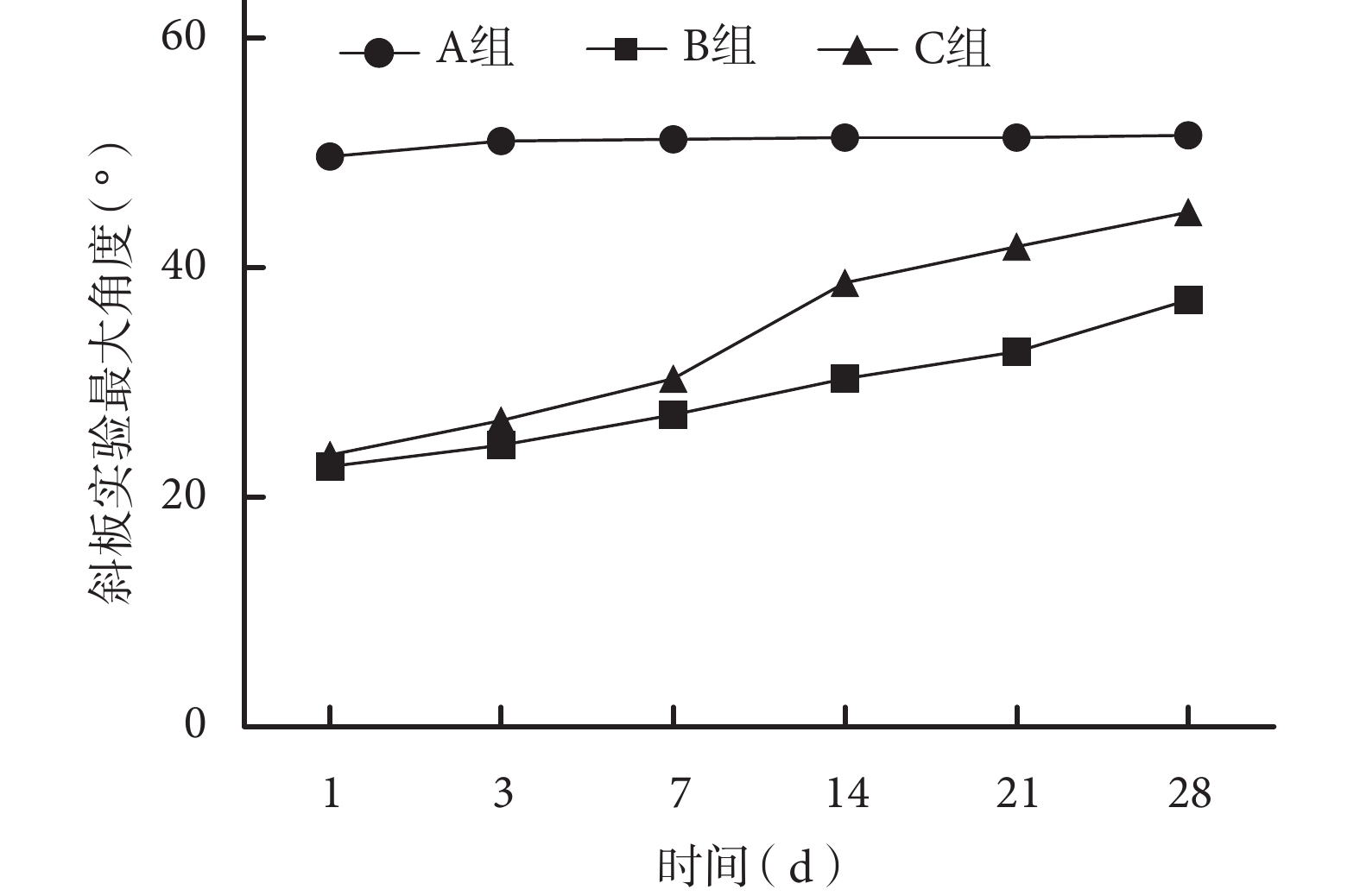 圖2
術后各時間點各組大鼠斜板實驗最大角度
Figure2.
The maximum angle of tiltboard experiment in rats of each group at each time point after operation
圖2
術后各時間點各組大鼠斜板實驗最大角度
Figure2.
The maximum angle of tiltboard experiment in rats of each group at each time point after operation
2.2 ELISA 檢測
A、B、C 組 TNF-α 濃度分別為(124.90±16.16)、(622.30±21.61)、(384.50±16.22)pg/mL,IL-6 濃度分別為(77.30±16.41)、(197.50±4.59)、(127.10±10.69)pg/mL。A 組 TNF-α、IL-6 濃度顯著低于 B、C 組,C 組顯著低于 B 組,差異均有統計學意義(P<0.05)。
2.3 Western blot 檢測
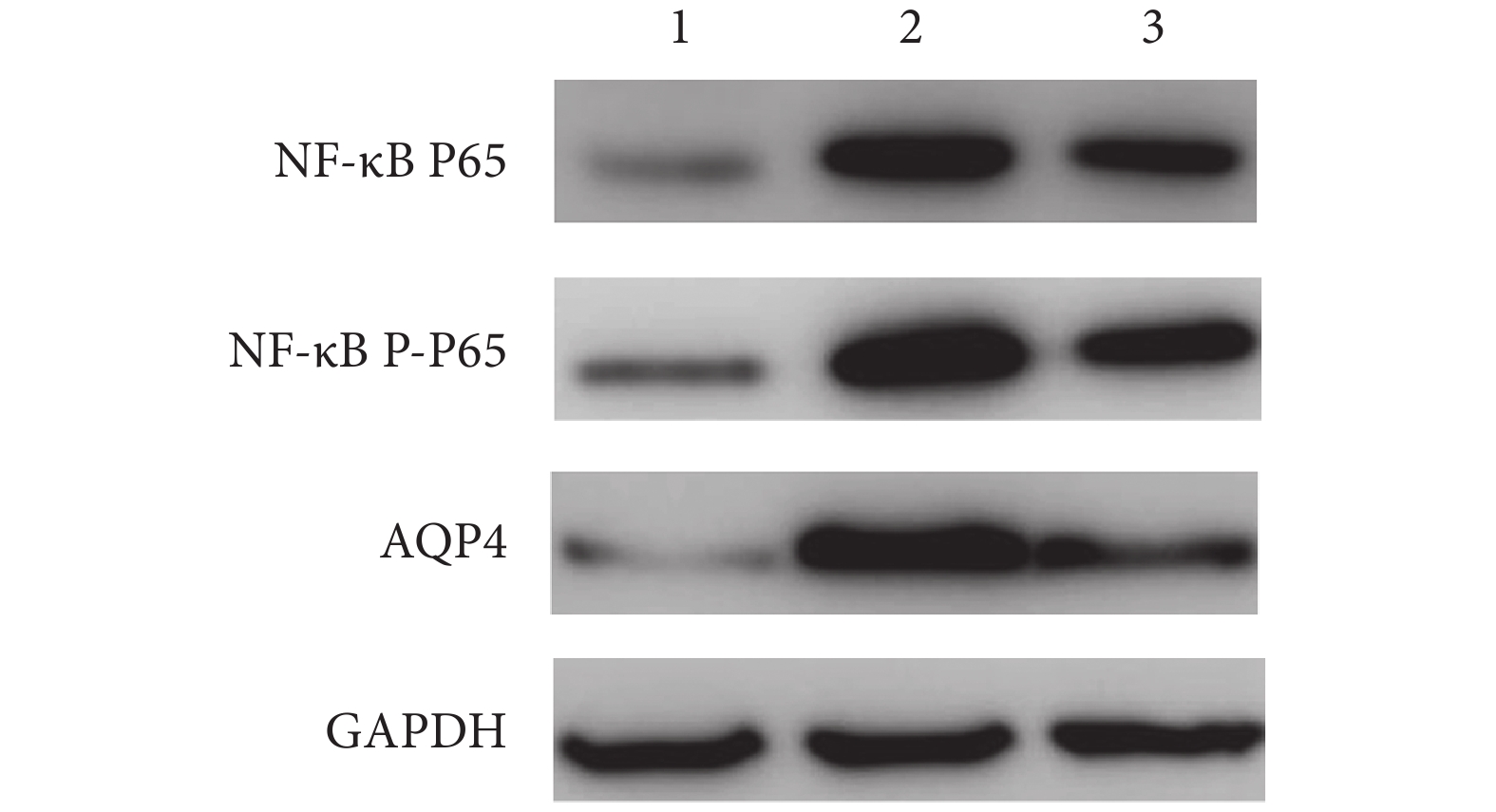
A 組 NF-κB P65、NF-κB P-P65 和 AQP4 蛋白相對表達量均顯著低于 B、C 組,C 組均顯著低于 B 組,差異均有統計學意義(P<0.05)。見圖 3、表 1。
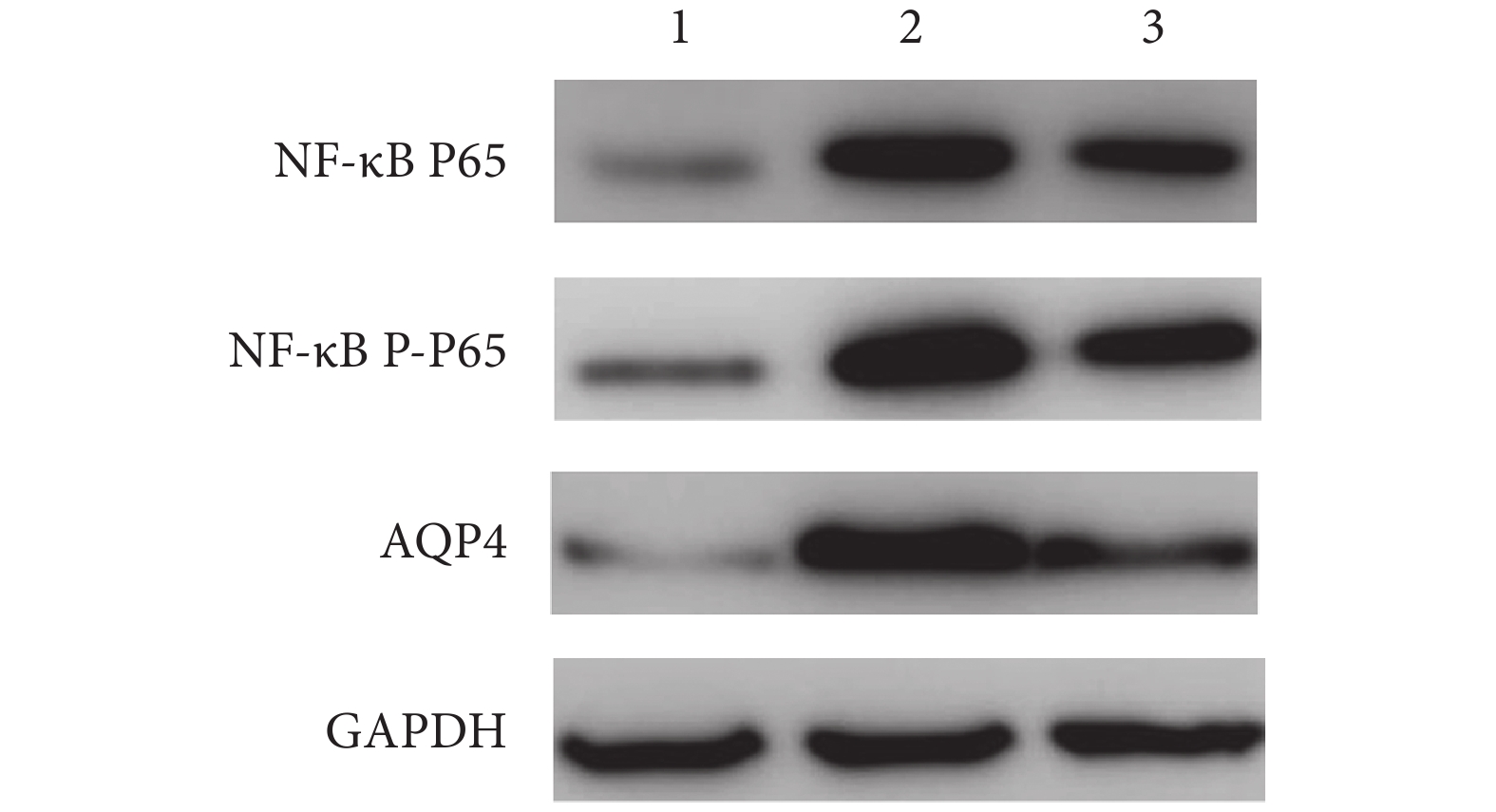 圖3
Western blot 檢測術后 24 h 各組各蛋白表達
圖3
Western blot 檢測術后 24 h 各組各蛋白表達
1: A 組 2: B 組 3: C 組
Figure3. The expressions of proteins at 24 hours after operation in each group by Western blot1: Group A 2: Group B 3: Group C
2.4 HE 染色觀察
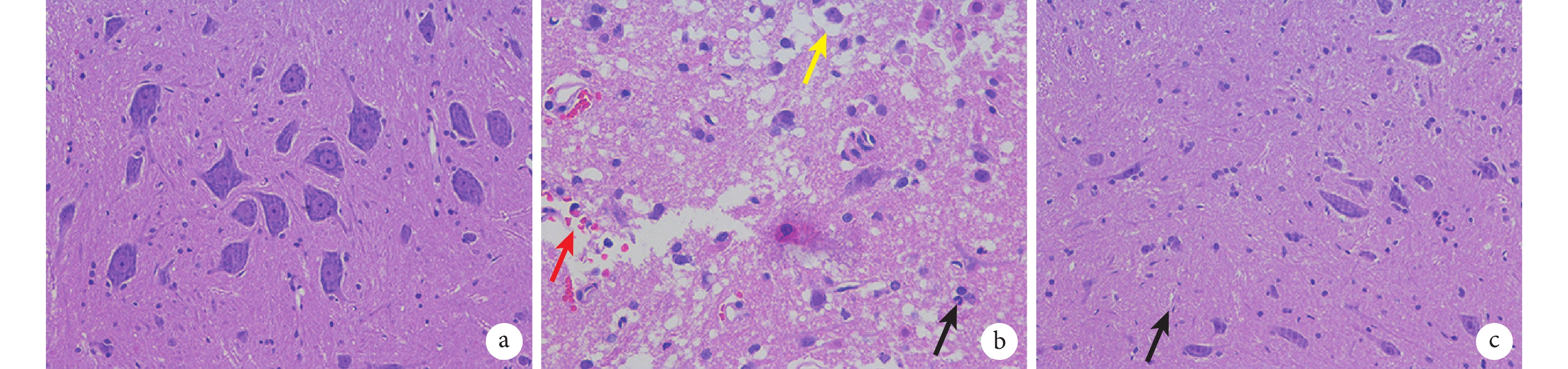
A 組脊髓中神經細胞正常,無明顯病變;B 組脊髓中損傷部位可見神經元細胞,損傷處有出血、中性粒細胞浸潤、神經細胞水腫;C 組脊髓中可見神經元細胞,小膠質細胞輕度增生,病變較 B 組好轉。見圖 4。
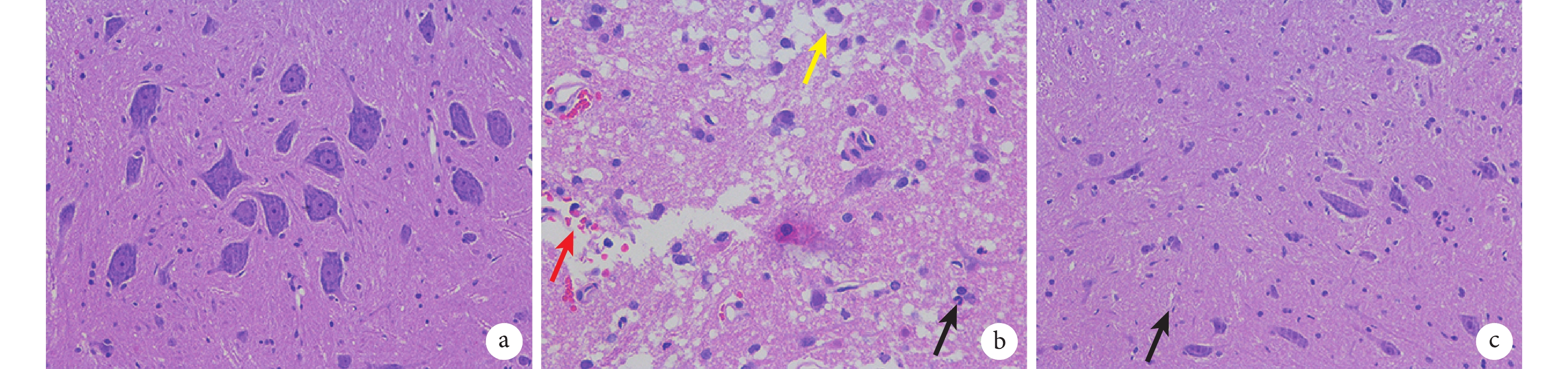 圖4
術后 24 h 各組 HE 染色觀察(倒置相差顯微鏡×200)
圖4
術后 24 h 各組 HE 染色觀察(倒置相差顯微鏡×200)
紅箭頭示出血,黑箭頭示中性粒細胞浸潤,黃箭頭示神經細胞水腫a. A 組;b. B 組;c. C 組
Figure4. HE staining observation at 24 hours after operation in each group (Inverted phase contrast miroscope×200)Red arrow for hemorrhage, black arrow for neutrophil infiltration, and yellow arrow for nerve cell edema a. Group A; b. Group B; c. Group C
3 討論
脊髓受損后一定程度的炎性反應對機體可起到一定的防御保護作用[10]。然而,包括脊髓在內的中樞神經系統軸突再生及受損神經元的補充能力有限;因此脊髓損傷后炎癥所產生的不利影響比其他組織更明顯[11]。有研究指出,TNF-α 和 IL-6 是重要的促炎因子,其中 TNF-α 是一個關鍵性因子,介導上游下游多種炎癥信號通路[12-13]。徐玉生等[14]研究表明,脊髓損傷后 1 h,TNF-α 表達顯著增強,損傷后 12 h 表達最高。TNF-α、IL-6 等炎性因子大量表達后,進一步加重局部炎性反應,導致細胞凋亡[2, 15]。本研究發現,與 A 組相比較,B 組 TNF-α、IL-6 表達水平明顯升高(P<0.05),說明脊髓損傷后發生炎性反應。進行 SSa 治療后,C 組 TNF-α、IL-6 表達水平較 B 組降低(P<0.05),說明 SSa 可抑制脊髓損傷后炎性反應,從而改善機體炎性反應,發揮神經保護作用。
由同源和異源二聚體組成的 NF-κB 是一種參與調節炎癥和細胞存活反應相關基因表達的轉錄因子[16]。正常情況下,NF-κB 普遍存在于真核細胞,經一定刺激后可迅速對有害細胞作出反應,參與炎性反應,上調包括 TNF-α、IL-1、IL-6、IL-8 及氧自由基等一系列炎性介質[15, 17]。有文獻報道,在脊髓損傷中 NF-κB 信號通路是調控炎性反應的主要影響信號途徑,從而影響炎性反應的進程[2]。Bethea 等[18]發現在脊髓損傷后 30 min NF-κB 開始異常活化,24 h 達高峰,并且在神經元中發現了 NF-κB 和其目標基因產物誘導型 NO 合成酶的共定位染色。因此,抑制 NF-κB 信號通路蛋白基因表達可減輕脊髓損傷后炎性反應,從而改善脊髓損傷后的功能恢復[19]。本實驗研究發現,B 組 NF-κB 信號通路蛋白 P65 和 P-P65 表達水平較A組明顯提高(P<0.05);對 C 組進行 SSa 治療后,NF-κB 信號通路蛋白 P65 和 P-P65 表達水平較 B 組降低(P<0.05)。綜上,實驗結果提示 SSa 可通過抑制 NF-κB 炎性信號通路減輕脊髓損傷后炎性反應,從而發揮保護神經作用。
AQP4 是中樞神經系統調節水通透性的主要分子途徑,主要分布于星形膠質細胞的終足和血管內皮細胞,目前已成為脊髓損傷的研究熱點[20]。無論是腦還是脊髓損傷后,AQP4 的表達都會發生明顯變化,從而影響組織中的血管源性水腫和細胞毒性水腫的發生、發展[21]。Ito 等[22]等研究表明,NF-κB 作為重要的核轉錄因子,阻斷其信號通路能明顯抑制 IL-1β 誘導的腦 AQP4 蛋白及其 mRNA 的表達,說明 NF-κB 活性的改變參與了 AQP4 的表達調控。此外,李野[23]在大鼠脊髓損傷實驗研究中證明,NF-κB 信號通路參與了脊髓損傷后 AQP4 的表達調節以及脊髓水腫的形成。本實驗 AQP4 的表達結果與上述文獻一致,與 A 組正常脊髓組織比較,脊髓損傷后 B 組 AQP4 表達水平明顯提高(P<0.05);給予 SSa 治療后,C 組 AQP4 表達水平較 B 組下降(P<0.05),說明該藥物可減輕脊髓損傷后組織水腫,從而發揮神經保護作用。
綜上述,本研究發現 SSa 對脊髓損傷后的脊髓具有一定神經保護作用。其可能作用機制是通過抑制 NF-κB 信號通路和 AQP4 蛋白的表達,降低脊髓損傷后早期機體炎性因子的水平,從而減輕機體炎性反應和組織水腫。本研究結果能夠對脊髓損傷的治療提供一定思路和依據。
近年來,脊髓損傷發病率不斷增加,臨床上對脊髓損傷病理機制的理解和早期治療等方面取得了一些進展,但成果均不理想[1]。目前觀點認為,脊髓損傷后引起的繼發性損傷導致的組織出血、水腫、細胞凋亡、免疫炎癥等級聯反應對脊髓神經組織的破壞具有重要作用并影響預后,其中炎性反應在脊髓繼發性損傷中扮演了重要角色[2]。脊髓損傷后組織水腫、血管-脊髓屏障損傷和神經元壞死與炎性反應密切相關,神經再生被抑制[3]。炎性反應刺激以及微血管破壞激發了水通道蛋白 4(aqua-porin 4,AQP4)高表達,加重了神經細胞水腫,加速細胞凋亡[4]。
隨著我國傳統中醫學的發展,中醫藥對脊髓損傷治療的作用越來越被重視[5-7]。柴胡皂苷 a(saiko-saponin a,SSa)是源自柴胡的主要活性成分,分子式為 C42H68O13,相對分子質量為 780.98,其藥理學作用廣泛,具有抗炎、免疫調節及抗菌等作用[8]。近年研究發現,SSa 在顱腦創傷后能顯著降低腦組織水腫蛋白 AQP4 表達,具有抗氧化應激反應和抗炎性反應,從而促進神經功能恢復,但相關作用機制仍未明確[9]。
本實驗通過建立大鼠脊髓損傷模型,腹腔注射 SSa,觀察比較損傷脊髓組織形態結構變化以及水腫蛋白 AQP4、蛋白 NF-κB P65、蛋白 NF-κB P-P65、炎性因子表達情況,探討 SSa 對大鼠脊髓損傷后的保護作用機制,為預防和治療脊髓損傷提供新的思路。
1 材料與方法
1.1 實驗動物及主要試劑、儀器
健康成年雌性 SD 大鼠 72 只,體質量 220~250 g,由中國人民解放軍軍事醫學科學院衛生學環境醫學研究所提供。
一抗大鼠 NF-κB P65、NF-κB P-P65、AQP4 抗體(Abcam 公司,美國);SSa(上海源葉生物科技有限公司);TNF-α ELISA、IL-6 ELISA 抗體和相關試劑盒(武漢六合生物技術有限公司)。4℃ 低溫離心機(Eppendorf 公司,德國);酶標儀(Thermo Fisher Scientific 公司,芬蘭);CO2 細胞培養箱(Forma Scientifis 公司,美國);高壓滅菌箱(山東新華醫療器械有限公司);快速組織細胞破碎儀(上海凈信科技有限公司);倒置相差顯微鏡(Nikon 公司,日本)。
1.2 實驗分組及方法
將 SD 大鼠隨機分為 3 組:假手術組(A 組)、脊髓損傷組(B 組)和 SSa 處理組(C 組),每組 24 只。A 組大鼠以 5% 水合氯醛(0.6 mL/100 g)腹腔注射麻醉后,僅切除 T9~T11 椎板,不作其他處理。B、C 組參考文獻[2,6]方法,利用改良 Allen 重物打擊法制作大鼠脊髓損傷模型:同上法麻醉大鼠后,沿肩胛骨向下逐個計數直至定位 T10;以 T10 為中心逐層分離,暴露 T9~T11 節段,使用微型咬骨鉗咬除 1/2(T9~T11)棘突及其兩側椎板暴露脊髓。將重 10 g、直徑 2.5 mm 打擊錘定位打擊位置于 T10 節段,高度調整為 5 cm 后打擊;打擊后見大鼠雙后肢抽動、甩尾,隨后完全松弛,提示造模成功。C 組于造模后即刻用 5 mL 無菌注射器經腹部表皮斜刺進針,之后垂直入針,回抽判斷是否回血,無回血則給予大鼠腹腔注射 SSa(10 mg/kg)1 次(根據文獻[9],本實驗選擇 5、10、20 mg/kg 藥物濃度進行比較,確定 10 mg/kg 為最優藥物濃度選擇);BBB 評分和斜板實驗大鼠每天腹腔注射 1 次,連續 1 周。B 組注入等量生理鹽水。術后大鼠單籠飼養,防止感染。術后 24 h 各組分別取 18 只大鼠同上法麻醉后,取損傷節段脊髓組織保存待測;每組其余 6 只大鼠采用 BBB 評分和斜板實驗評價雙下肢運動恢復情況。
1.3 觀測指標
1.3.1 BBB 評分 術后 1、3、7、14、21、28 d 采用 BBB 評分評價各組大鼠后肢運動功能,取每只大鼠左右側肢體評分均值作為最終評分。
1.3.2 斜板實驗 術后 1、3、7、14、21、28 d 進行斜板實驗,在斜板上將鼠頭朝向上、下、左、右,記錄其保持 5 s 的最大角度。
1.3.3 ELISA 檢測 取出保存的各組脊髓組織,加入 PBS 溶液后,在組織細胞破碎儀中以 900×g 勻漿 6 min,低溫條件下(4℃)以 450×g 離心 20 min;取上清液,按照 TNF-α、IL-6 ELISA 試劑盒說明書進行操作,加終止液后混勻,酶標儀進行檢測,測量脊髓組織中炎性因子 TNF-α、IL-6 表達濃度。
1.3.4 Western blot 檢測 取出保存的各組脊髓組織,稱重后加入一定量蛋白裂解液,放置于組織細胞破碎儀中研磨,充分裂解;以 12 000×g 離心 15 min,取出上清,BCA 法測定總蛋白濃度。經過加樣、電泳、轉膜、封閉、一抗 1∶5 000 孵育過夜,二抗 1∶10 000 孵育 1 h,加入顯色劑顯色,以 GAPDH 作為內參。顯影儀顯影,Image J 軟件測算蛋白灰度值,計算目的蛋白 NF-κB P65、NF-κB P-P65 和 AQP4 蛋白與 GAPDH 灰度值的比值,作為其相對表達量。
1.3.5 HE 染色觀察 術后 24 h 采用多聚甲醛灌注,取出各實驗組脊髓組織,置于 4% 多聚甲醛固定 48 h,石蠟包埋,從損傷脊髓中心部位連續切片,片厚 5 μm,行 HE 染色,倒置相差顯微鏡下觀察脊髓損傷處灰質區的形態學改變。
1.4 統計學方法
采用 SPSS22.0 統計軟件進行分析。數據以均數±標準差表示,組間比較采用單因素方差分析,兩兩比較采用 LSD 檢驗;檢驗水準 α=0.05。
2 結果
2.1 BBB 評分和斜板實驗
術后各組大鼠均順利存活至實驗完成,切口無紅腫等感染表現。術后各時間點 A 組 BBB 評分和斜板實驗最大角度均顯著高于 B、C 組,差異有統計學意義(P<0.05);術后 14、21、28 d C 組上述指標顯著高于 B 組,差異有統計學意義(P<0.05)。見圖 1、2。
 圖1
術后各時間點各組大鼠后肢運動功能 BBB 評分
Figure1.
BBB scores of rats hindlimb motor function at each time point after operation in each group
圖1
術后各時間點各組大鼠后肢運動功能 BBB 評分
Figure1.
BBB scores of rats hindlimb motor function at each time point after operation in each group
 圖2
術后各時間點各組大鼠斜板實驗最大角度
Figure2.
The maximum angle of tiltboard experiment in rats of each group at each time point after operation
圖2
術后各時間點各組大鼠斜板實驗最大角度
Figure2.
The maximum angle of tiltboard experiment in rats of each group at each time point after operation
2.2 ELISA 檢測
A、B、C 組 TNF-α 濃度分別為(124.90±16.16)、(622.30±21.61)、(384.50±16.22)pg/mL,IL-6 濃度分別為(77.30±16.41)、(197.50±4.59)、(127.10±10.69)pg/mL。A 組 TNF-α、IL-6 濃度顯著低于 B、C 組,C 組顯著低于 B 組,差異均有統計學意義(P<0.05)。
2.3 Western blot 檢測
A 組 NF-κB P65、NF-κB P-P65 和 AQP4 蛋白相對表達量均顯著低于 B、C 組,C 組均顯著低于 B 組,差異均有統計學意義(P<0.05)。見圖 3、表 1。
 圖3
Western blot 檢測術后 24 h 各組各蛋白表達
圖3
Western blot 檢測術后 24 h 各組各蛋白表達
1: A 組 2: B 組 3: C 組
Figure3. The expressions of proteins at 24 hours after operation in each group by Western blot1: Group A 2: Group B 3: Group C
2.4 HE 染色觀察
A 組脊髓中神經細胞正常,無明顯病變;B 組脊髓中損傷部位可見神經元細胞,損傷處有出血、中性粒細胞浸潤、神經細胞水腫;C 組脊髓中可見神經元細胞,小膠質細胞輕度增生,病變較 B 組好轉。見圖 4。
 圖4
術后 24 h 各組 HE 染色觀察(倒置相差顯微鏡×200)
圖4
術后 24 h 各組 HE 染色觀察(倒置相差顯微鏡×200)
紅箭頭示出血,黑箭頭示中性粒細胞浸潤,黃箭頭示神經細胞水腫a. A 組;b. B 組;c. C 組
Figure4. HE staining observation at 24 hours after operation in each group (Inverted phase contrast miroscope×200)Red arrow for hemorrhage, black arrow for neutrophil infiltration, and yellow arrow for nerve cell edema a. Group A; b. Group B; c. Group C
3 討論
脊髓受損后一定程度的炎性反應對機體可起到一定的防御保護作用[10]。然而,包括脊髓在內的中樞神經系統軸突再生及受損神經元的補充能力有限;因此脊髓損傷后炎癥所產生的不利影響比其他組織更明顯[11]。有研究指出,TNF-α 和 IL-6 是重要的促炎因子,其中 TNF-α 是一個關鍵性因子,介導上游下游多種炎癥信號通路[12-13]。徐玉生等[14]研究表明,脊髓損傷后 1 h,TNF-α 表達顯著增強,損傷后 12 h 表達最高。TNF-α、IL-6 等炎性因子大量表達后,進一步加重局部炎性反應,導致細胞凋亡[2, 15]。本研究發現,與 A 組相比較,B 組 TNF-α、IL-6 表達水平明顯升高(P<0.05),說明脊髓損傷后發生炎性反應。進行 SSa 治療后,C 組 TNF-α、IL-6 表達水平較 B 組降低(P<0.05),說明 SSa 可抑制脊髓損傷后炎性反應,從而改善機體炎性反應,發揮神經保護作用。
由同源和異源二聚體組成的 NF-κB 是一種參與調節炎癥和細胞存活反應相關基因表達的轉錄因子[16]。正常情況下,NF-κB 普遍存在于真核細胞,經一定刺激后可迅速對有害細胞作出反應,參與炎性反應,上調包括 TNF-α、IL-1、IL-6、IL-8 及氧自由基等一系列炎性介質[15, 17]。有文獻報道,在脊髓損傷中 NF-κB 信號通路是調控炎性反應的主要影響信號途徑,從而影響炎性反應的進程[2]。Bethea 等[18]發現在脊髓損傷后 30 min NF-κB 開始異常活化,24 h 達高峰,并且在神經元中發現了 NF-κB 和其目標基因產物誘導型 NO 合成酶的共定位染色。因此,抑制 NF-κB 信號通路蛋白基因表達可減輕脊髓損傷后炎性反應,從而改善脊髓損傷后的功能恢復[19]。本實驗研究發現,B 組 NF-κB 信號通路蛋白 P65 和 P-P65 表達水平較A組明顯提高(P<0.05);對 C 組進行 SSa 治療后,NF-κB 信號通路蛋白 P65 和 P-P65 表達水平較 B 組降低(P<0.05)。綜上,實驗結果提示 SSa 可通過抑制 NF-κB 炎性信號通路減輕脊髓損傷后炎性反應,從而發揮保護神經作用。
AQP4 是中樞神經系統調節水通透性的主要分子途徑,主要分布于星形膠質細胞的終足和血管內皮細胞,目前已成為脊髓損傷的研究熱點[20]。無論是腦還是脊髓損傷后,AQP4 的表達都會發生明顯變化,從而影響組織中的血管源性水腫和細胞毒性水腫的發生、發展[21]。Ito 等[22]等研究表明,NF-κB 作為重要的核轉錄因子,阻斷其信號通路能明顯抑制 IL-1β 誘導的腦 AQP4 蛋白及其 mRNA 的表達,說明 NF-κB 活性的改變參與了 AQP4 的表達調控。此外,李野[23]在大鼠脊髓損傷實驗研究中證明,NF-κB 信號通路參與了脊髓損傷后 AQP4 的表達調節以及脊髓水腫的形成。本實驗 AQP4 的表達結果與上述文獻一致,與 A 組正常脊髓組織比較,脊髓損傷后 B 組 AQP4 表達水平明顯提高(P<0.05);給予 SSa 治療后,C 組 AQP4 表達水平較 B 組下降(P<0.05),說明該藥物可減輕脊髓損傷后組織水腫,從而發揮神經保護作用。
綜上述,本研究發現 SSa 對脊髓損傷后的脊髓具有一定神經保護作用。其可能作用機制是通過抑制 NF-κB 信號通路和 AQP4 蛋白的表達,降低脊髓損傷后早期機體炎性因子的水平,從而減輕機體炎性反應和組織水腫。本研究結果能夠對脊髓損傷的治療提供一定思路和依據。