引用本文: 鐘澤祥, 周亦楠, 馮思思, 黃宇, 陳宣維. 慢病毒介導小干擾 RNA 干擾促分裂原和應激激活的蛋白激酶 1 對大鼠脊髓損傷的修復作用. 中國修復重建外科雜志, 2018, 32(7): 941-950. doi: 10.7507/1002-1892.201801093 復制
版權信息: ?四川大學華西醫院華西期刊社《中國修復重建外科雜志》版權所有,未經授權不得轉載、改編
脊髓損傷是脊柱損傷最嚴重的并發癥,往往導致損傷節段以下肢體嚴重的功能障礙。然而脊髓損傷的治療一直是臨床難題,迄今未取得有意義的突破,其原因是對脊髓損傷后病理改變缺乏有效的干預手段。脊髓損傷后的病理變化包括原發性損傷和繼發性損傷[1-2]。繼發性損傷包括原發性損傷所引起的局部缺血缺氧、細胞凋亡、免疫炎性反應、興奮性毒性、自由基損傷、脂質過氧化、星形膠質瘢痕形成等,是加重神經功能障礙的主要原因,具有可逆性且可被調控[3]。其中,反應性星形膠質細胞的過度增殖和炎性反應起著重要作用,涉及多個信號通路如絲裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)信號傳導途徑,誘發并級聯放大炎性反應,最終導致神經細胞壞死。
促分裂原和應激激活的蛋白激酶 1(mitogen- and stress-activated protein kinase 1,MSK1)和 MSK2 是核內絲氨酸/蘇氨酸蛋白激酶,在 MAPK 靶點中,MSK1 在 p38 和 ERK1/2 的下游被激活[4]。研究表明 MSK1 磷酸化多種底物,包括 cAMP 反應元件結合蛋白[5]、NF-κB 的 p65 亞基[6]、組蛋白 H3[7]、轉錄因子 1[8],廣泛參與免疫和炎癥應答,在調控細胞增殖和轉化、調節突觸可塑性、神經元存活、神經元成熟和發育可塑性中起重要作用。MSK1 在急性中樞神經系統的損傷修復中起著重要作用。本實驗通過檢測 MSK1 在大鼠脊髓損傷后表達的時空變化規律,并應用 RNA 干擾構建 MSK1 小干擾 RNA(small interfering RNA,siRNA)重組慢病毒注射入大鼠脊髓損傷部位,通過調控 MSK1 在脊髓的表達,進一步探索 MSK1 在脊髓損傷中的作用及意義。
1 材料與方法
1.1 實驗動物及主要材料、儀器
健康成年清潔級雄性 SD 大鼠 120 只,體質量 220~250 g,由上海斯萊克實驗動物公司提供;實驗前適應性喂養 1 周。
MSK1 siRNA 重組慢病毒、陰性對照慢病毒 LV3NC(上海吉瑪制藥技術有限公司)。慢病毒液滴度為 0.9×109 TU/mL,收集后用無菌生理鹽水稀釋至滴度為 0.5×109 TU/mL,置于–80℃ 備用,防止反復凍融,以免病毒顆粒失活。
兔抗 MSK1 多克隆抗體(Novus 公司,美國);兔抗增殖細胞核抗原(proliferating cell nuclear antigen,PCNA)多克隆抗體、兔抗 GAPDH 多克隆抗體(CST 公司,美國);小鼠抗神經元核抗原(neuronal nuclei,NeuN)抗體、小鼠抗神經膠質酸性蛋白(glial fibrillary acidic protein,GFAP)抗體(Abcam 公司,美國);辣根過氧化物酶標記山羊抗兔 IgG(北京中杉金橋生物技術有限公司);熒光二抗(Cy3 標記山羊抗兔 IgG、Alexa Fluor 488 標記山羊抗小鼠 IgG)、4’,6-二脒基-2-苯基吲哚(4’,6-diamidino-2-phenylindole,DAPI;湖北谷歌生物有限公司);SDS-PAGE 凝膠快速配制試劑盒、BeyoColor 彩色預染蛋白分子量標準[(6.5~270)×103]、RIPA 裂解液、BCA 蛋白濃度測定試劑盒、ECL 化學發光試劑盒(上海碧云天生物技術有限公司)。
NYU Impactor-Ⅲ打擊器(W.M.Keck 公司,美國);–80℃ 冰箱(Thermo 公司,美國);CX21FSI 電子顯微鏡(Olympus 公司,日本);凝膠電泳成像系統(Syngene 公司,英國);聚偏氟乙烯(Polyvinylidene fluoride,PVDF)膜(Millipore 公司,美國);酶標儀、電泳儀、轉膜儀(Bio-Rad 公司,美國);化學發光成像儀、HM525 冰凍切片機(Thermo Fisher Scientific 公司,美國);倒置熒光顯微鏡(Nikon 公司,日本);石蠟切片機(Leica 公司,德國)。
1.2 脊髓損傷后 MSK1 及 PCNA 蛋白的表達變化
1.2.1 實驗分組及方法
取 70 只 SD 大鼠隨機分為脊髓損傷組和假手術組,每組 35 只。所有大鼠以 10% 水合氯醛(0.3 mL/100 g)腹腔注射麻醉,俯臥位固定,常規消毒、備皮。以 T10 為中心作一長約 4 cm 的縱切口,逐層切開皮膚、皮下組織、剪開深筋膜,暴露棘突及椎旁肌肉,銳性分離椎旁肌肉并用微型自動拉鉤撐開,充分暴露 T9~T11 椎板,用咬骨鉗小心咬除 T9~T11 椎體棘突,咬除 T10 全椎板及上下關節突,充分暴露脊髓,顯露脊髓長約 1.0 cm。假手術組即行逐層縫合,不損傷脊髓。脊髓損傷組置于 NYU Impactor-Ⅲ 打擊器上,采用 Allen 法以 10 g×2.5 cm 自由落體打擊制作大鼠脊髓損傷模型。大鼠尾巴痙攣性擺動并持續數秒,雙下肢回縮撲動數秒,硬脊膜下充血,蘇醒后雙下肢呈完全癱瘓,則提示造模成功。打擊后充分止血,逐層縫合,并于一側下肢注射約 0.5 mL 慶大霉素,保溫至麻醉蘇醒。術后行人工排尿,每日早晚各 1 次,直至膀胱排尿功能恢復。
1.2.2 Western blot 檢測 MSK1 及 PCNA 蛋白表達
兩組分別于造模后 8、12 h 及 1、2、3、5、7 d 各取 5 只大鼠,深度麻醉后,經心臟灌注生理鹽水約 200 mL,然后在冰上迅速取出損傷部位脊髓,長約 1 cm,裝入 EP 管放入 –80℃ 冰箱保存備用。各脊髓組織加入適量 RAPI 裂解液冰上裂解,提取組織總蛋白上清液,采用 BCA 蛋白濃度測定試劑盒測定蛋白濃度。每組取等量蛋白上樣,進行 10%SDS-PAGE 電泳,電轉移到 PVDF 膜上,5% 脫脂牛奶室溫封閉 1 h。分別用一抗兔抗 MSK1 多克隆抗體(1∶1 000)、兔抗 PCNA 多克隆抗體(1∶1 000)和內參兔抗 GAPDH 多克隆抗體(1∶1 000)于 4℃ 冰箱中孵育過夜,TBST 沖洗后,用二抗辣根過氧化物酶標記羊抗兔 IgG(1∶2 500)室溫孵育 1 h。TBST 沖洗后根據試劑盒說明采用 ECL 發光法進行膠片曝光,用圖像分析軟件 Photoshop 進行灰度值測定,作為蛋白表達量。
1.3 最佳病毒轉染時間確定
取 20 只 SD 大鼠隨機分為脊髓損傷組和假手術組,每組 10 只,同上法制備動物模型。使用 10 μL 微量注射器,參照 Tan 等[9]和 Hu 等[10]局部椎管內注射法,在每只大鼠距背側脊髓打擊中心約 2 mm 的頭尾兩端,深約 0.8 mm 處,分別注入 3 μL 陰性對照慢病毒 LV3NC 稀釋液,共約 6 μL。注射完成后 1、3、5、7、14 d,每組各取 2 只大鼠,深入麻醉后使用生理鹽水及 4% 多聚甲醛經心臟灌注處死動物,然后取注射部位脊髓組織樣本,放入 4% 多聚甲醛于 4℃ 冰箱中固定 8 h 后置于 30% 蔗糖沉底,然后置于 O.C.T 包埋劑中,低溫恒冷冰凍切片機連續切取厚約 20 μm 的脊髓組織切片,倒置熒光顯微鏡下觀察慢病毒攜帶的綠色熒光表達情況,以綠色熒光的強弱來確定最佳病毒轉染時間點。
1.4 MSK1 慢病毒干擾載體對脊髓損傷后大鼠運動功能及 MSK1、PCNA 表達的影響
1.4.1 實驗分組及方法
取剩余 30 只 SD 大鼠隨機分為 3 組,每組 10 只。所有大鼠均同上法制備脊髓損傷模型,A 組為單純脊髓損傷組;B、C 組同上法分別轉染陰性對照慢病毒 LV3NC 和 MSK1 siRNA 重組慢病毒。
1.4.2 大鼠后肢運動功能 BBB 評分
3 組大鼠分別于造模后 1、3、5、7、14 d,采用 BBB 評分法[11]進行后肢運動功能評價,觀察各組大鼠后肢運動功能。實驗采用雙盲、雙人獨立評估,取均值。
1.4.3 Western blot 檢測 MSK1 及 PCNA 蛋白表達
每組于病毒轉染最佳時間點各取 5 只動物處死,取材采用 Western blot 檢測 MSK1 及 PCNA 蛋白表達。
1.4.4 免疫熒光雙標染色檢測 MSK1 及 PCNA 定位表達
B、C 組于病毒轉染最佳時間點取注射部位脊髓組織樣本,經 4% 多聚甲醛固定后進行組織脫水,石蠟包埋,制備 5 μm 厚石蠟切片;脫蠟至水,檸檬酸鈉高壓修復抗原,組化筆在組織周圍畫圈,在圈內加入自發熒光淬滅劑,牛血清白蛋白封閉 30 min。其中免疫熒光雙標染色,滴加一抗兔抗 MSK1 多克隆抗體(1∶1 00)或兔抗 PCNA 多克隆抗體(1∶1 00),同時滴加小鼠抗 NeuN 單克隆抗體(1∶100)或小鼠抗 GFAP 單克隆抗體(1∶3 000)于濕盒內 4°C 孵育過夜;PBS 洗滌 3 次,滴加與一抗相應種屬的二抗 Cy3 標記山羊抗兔 IgG(1∶300)和 Alexa Fluor 488 標記山羊抗小鼠 IgG(1∶400)覆蓋組織;避光室溫孵育 50 min;PBS 洗滌 3 次,滴加 DAPI 染液,避光室溫孵育 10 min 后用抗熒光淬滅封片劑封片。對于需要同時觀察慢病毒轉染后脊髓中綠色熒光蛋白(green fluorescent protein,GFP)的表達情況,則不加入自發熒光淬滅劑,滴加一抗兔抗 MSK1 多克隆抗體(1∶1 00)及 Cy3 標記山羊抗兔 IgG(1∶300),按上述方法處理后,與其他切片一起于倒置熒光顯微鏡下觀察熒光表達情況。采集圖像,用 Image J 圖像分析軟件對圖像中表達 MSK1、PCNA、GFAP 的陽性細胞相對表達面積進行半定量分析。
1.5 統計學方法
采用 SPSS19.0 統計軟件進行分析。數據以均數±標準差表示,兩組間比較采用獨立樣本 t 檢驗;多組間比較采用單因素方差分析,兩兩比較采用 SNK 檢驗;檢驗水準取雙側 α=0.05。
2 結果
2.1 脊髓損傷后 MSK1 及 PCNA 蛋白表達
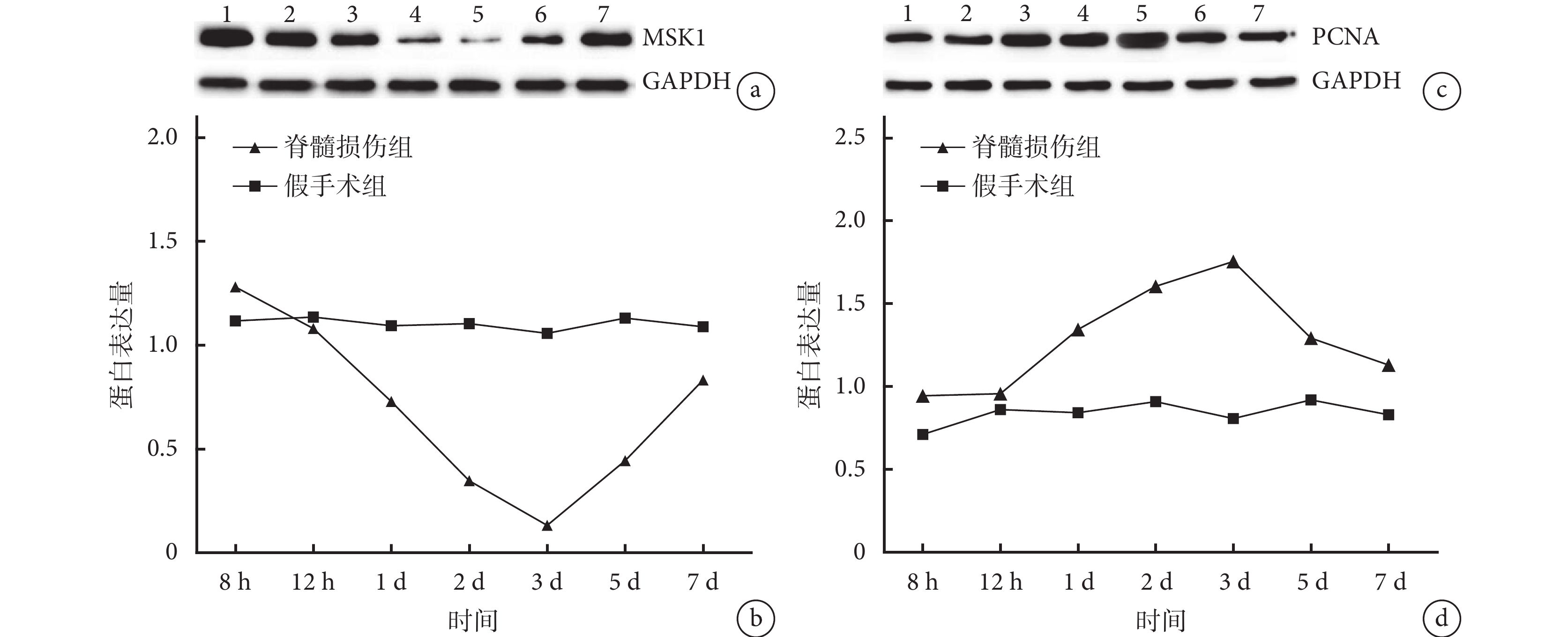
Western blot 檢測示,假手術組各時間點脊髓組織中的 MSK1 及 PCNA 蛋白表達無明顯變化。脊髓損傷組 MSK1 蛋白表達于傷后 8 h 開始呈逐漸下降趨勢,至傷后 3 d 降至最低,而后呈逐漸上升趨勢;PCNA 蛋白表達于傷后 8 h 開始呈逐漸增加趨勢,傷后 3 d 達最高值,而后呈逐漸下降趨勢。脊髓損傷組傷后 1、2、3、5 d MSK1 蛋白表達量顯著低于假手術組,傷后 8 h 及 1、2、3、5、7 d PCNA 蛋白表達量顯著高于假手術組,差異均有統計學意義(P<0.05)。見圖 1。
2.2 最佳病毒轉染時間確定
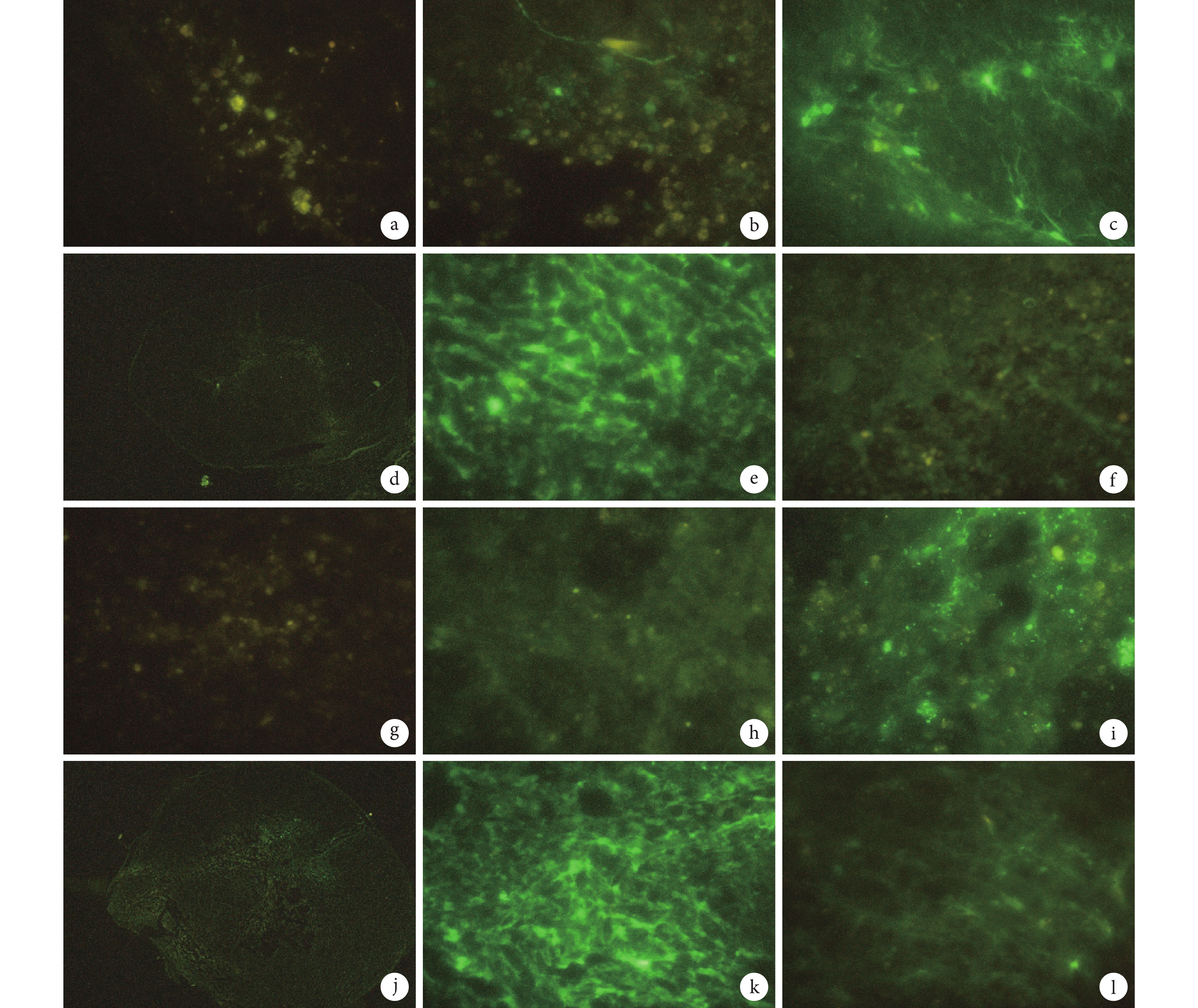
倒置熒光顯微鏡觀察示,注射后 1 d 兩組大鼠脊髓組織即可見綠色熒光表達,但強度較弱;3、5 d 時熒光逐漸增強,由中心向周圍擴散;7 d 時熒光強度達到高峰,脊髓組織中可見大量綠色熒光表達;14 d 時熒光表達逐漸減弱,熒光濃聚程度降低。因此確定最佳病毒轉染時間為注射后 7 d。見圖 2。
2.3 MSK1 慢病毒干擾載體對脊髓損傷后大鼠運動功能及 MSK1、PCNA 表達的影響
2.3.1 大鼠后肢運動功能 BBB 評分
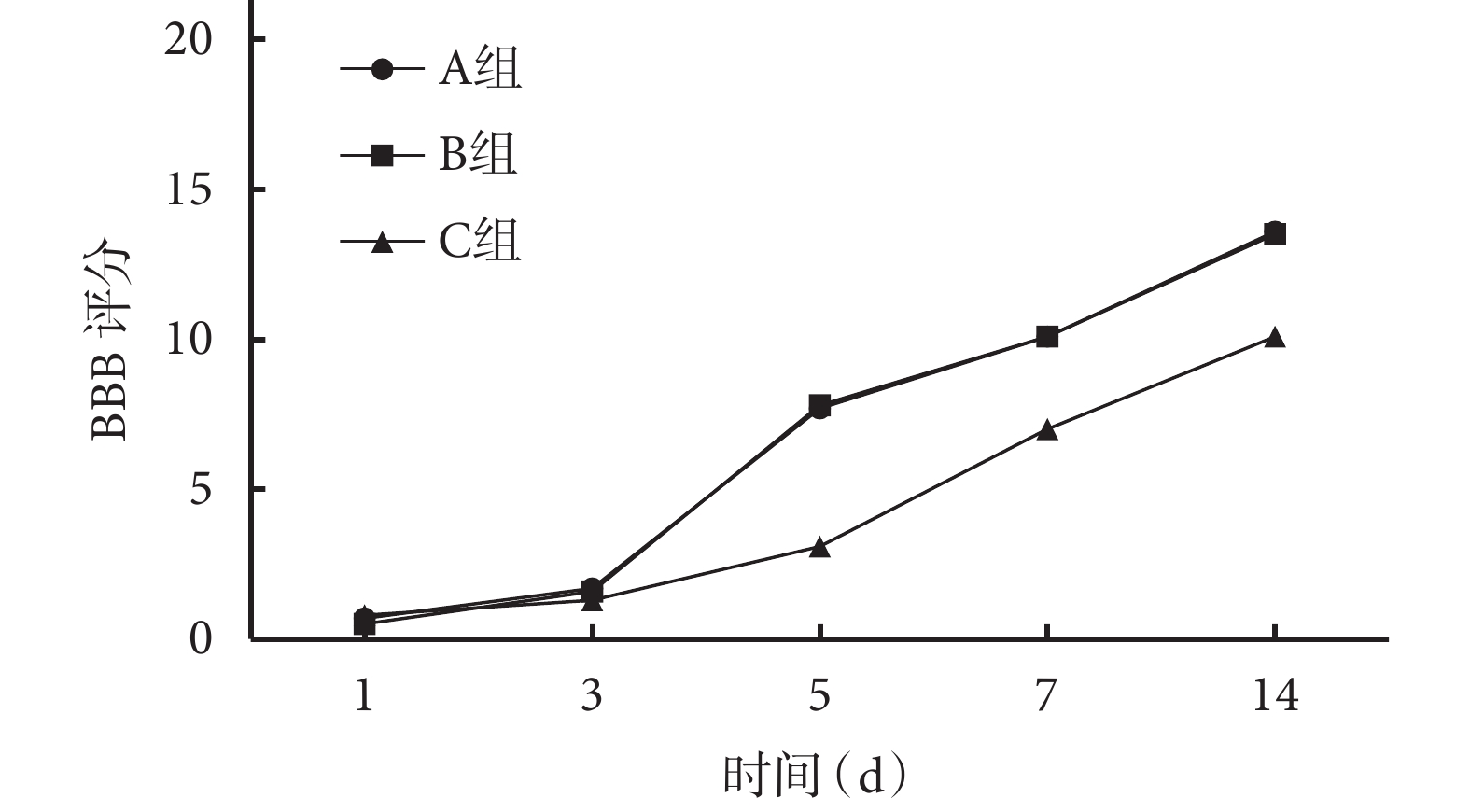
隨術后時間延長,各組 BBB 評分均呈逐漸上升趨勢。術后 5、7、14 d C 組 BBB 評分顯著低于 A、B 組,差異有統計學意義(P<0.05);術后各時間點 A、B 組間 BBB 評分比較,差異均無統計學意義(P>0.05)。見圖 3。
2.3.2 Western blot 檢測 MSK1 及 PCNA 蛋白表達
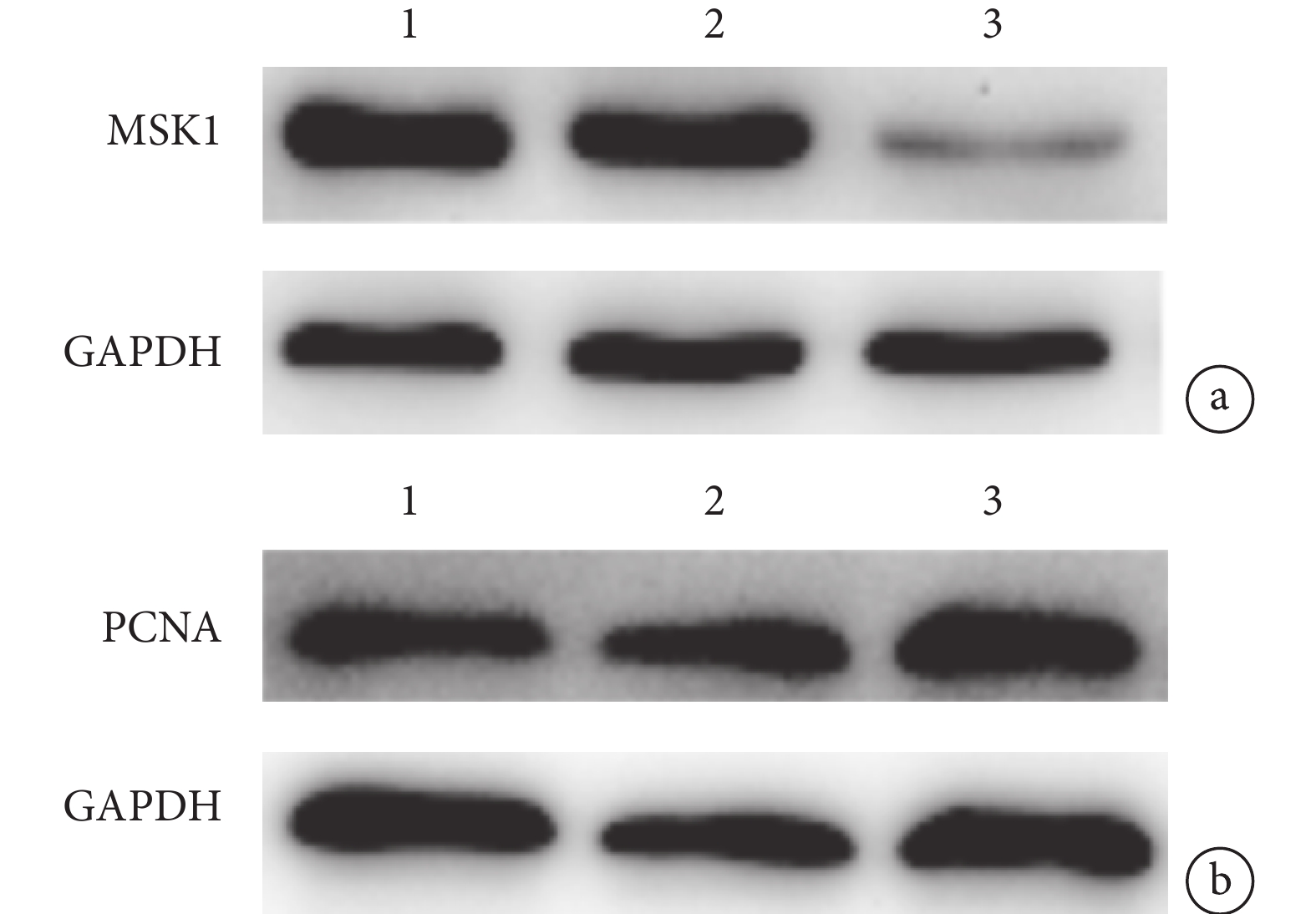
轉染 7 d 后,A、B、C 組 MSK1 蛋白表達量分別為 0.90±0.11、0.98±0.11、0.17±0.03,PCNA 蛋白表達量分別為 0.96±0.09、1.01±0.06、1.40±0.07。C 組 MSK1 蛋白表達量顯著低于 A、B 組,PCNA 蛋白表達量顯著高于 A、B 組,差異均有統計學意義(P<0.05);A、B 組間兩種蛋白表達量比較,差異均無統計學意義(P>0.05)。見圖 4。
2.3.3 免疫熒光雙標染色檢測 MSK1 及 PCNA 定位表達
免疫熒光雙標染色示,MSK1 在脊髓表達并存在于細胞核中,并與 GFP、NeuN 及 GFAP 共定位。此外,PCNA 也在脊髓表達并與 GFAP 存在共定位。見圖 5 ~ 8。B 組 MSK1、PCNA、GFAP 陽性細胞相對表達面積分別為 0.046%±0.007%、0.030%±0.003%、0.036%±0.003%,C 組分別為 0.026%±0.002%、0.046%±0.008%、0.052%±0.003%。C 組 MSK1 陽性細胞相對表達面積顯著高于 B 組,PCNA、GFAP 陽性細胞相對表達面積顯著低于 B 組,差異均有統計學意義(P<0.05)。
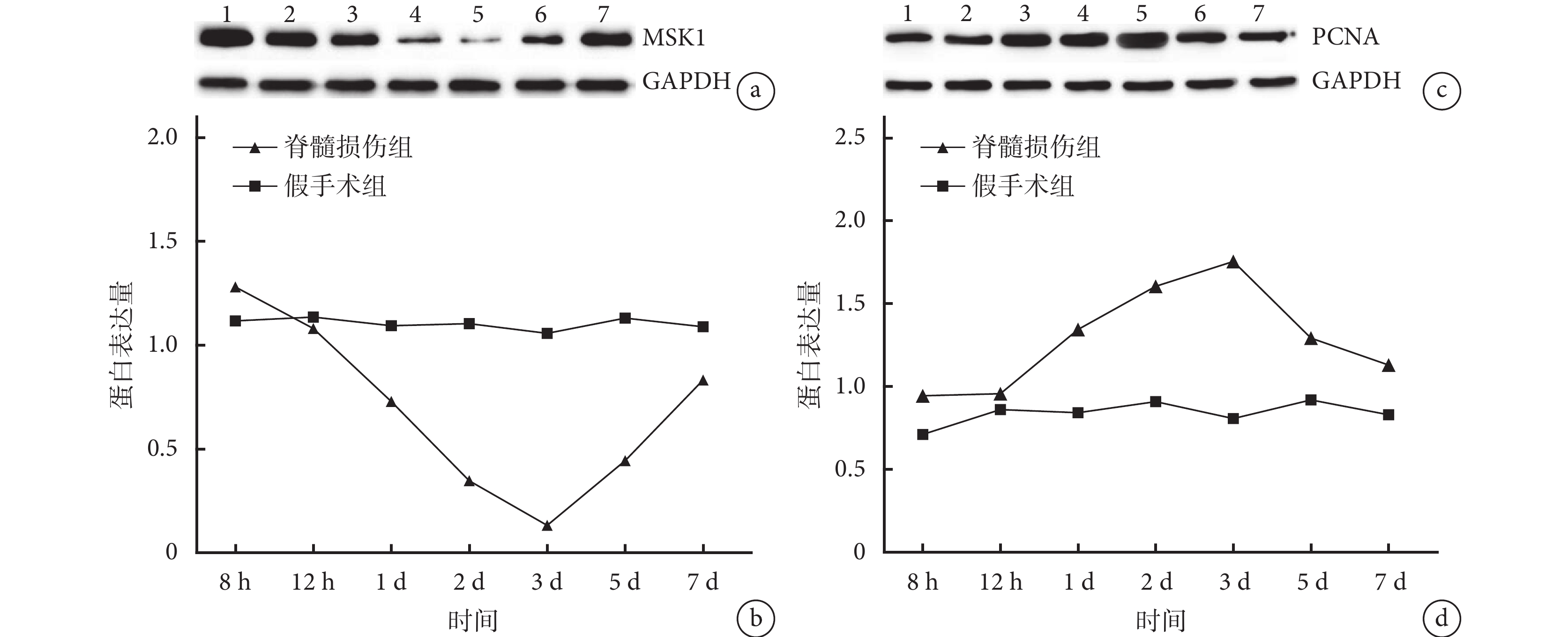 圖1
Western blot 檢測各時間點假手術組及脊髓損傷組 MSK1、PCNA 蛋白表達
圖1
Western blot 檢測各時間點假手術組及脊髓損傷組 MSK1、PCNA 蛋白表達
a. 脊髓損傷組 MSK1 蛋白表達電泳圖 1:8 h 2:12 h 3:1 d 4:2 d 5:3 d 6:5 d 7:7 d;b. MSK1 蛋白表達量;c. 脊髓損傷組 PCNA 蛋白表達電泳圖 1:8 h 2:12 h 3:1 d4:2 d 5:3 d 6:5 d 7:7 d;d. PCNA 蛋白表達量
Figure1. The expressions of MSK1 and PCNA protein in sham-operation group and spinal cord injury group at different time points by Western blot analysisa. Electrophoretic diagram of MSK1 protein expression in spinal cord injury group 1: 8 hours 2: 12 hours 3: 1 day 4: 2 days 5: 3 days 6: 5 days 7: 7 days; b. Expression of MSK1 protein; c. Electrophoretic diagram of PCNA protein expression in spinal cord injury group 1: 8 hours 2: 12 hours 3: 1 day 4: 2 days 5: 3 days 6: 5 days 7: 7 days; d. Expression of PCNA protein
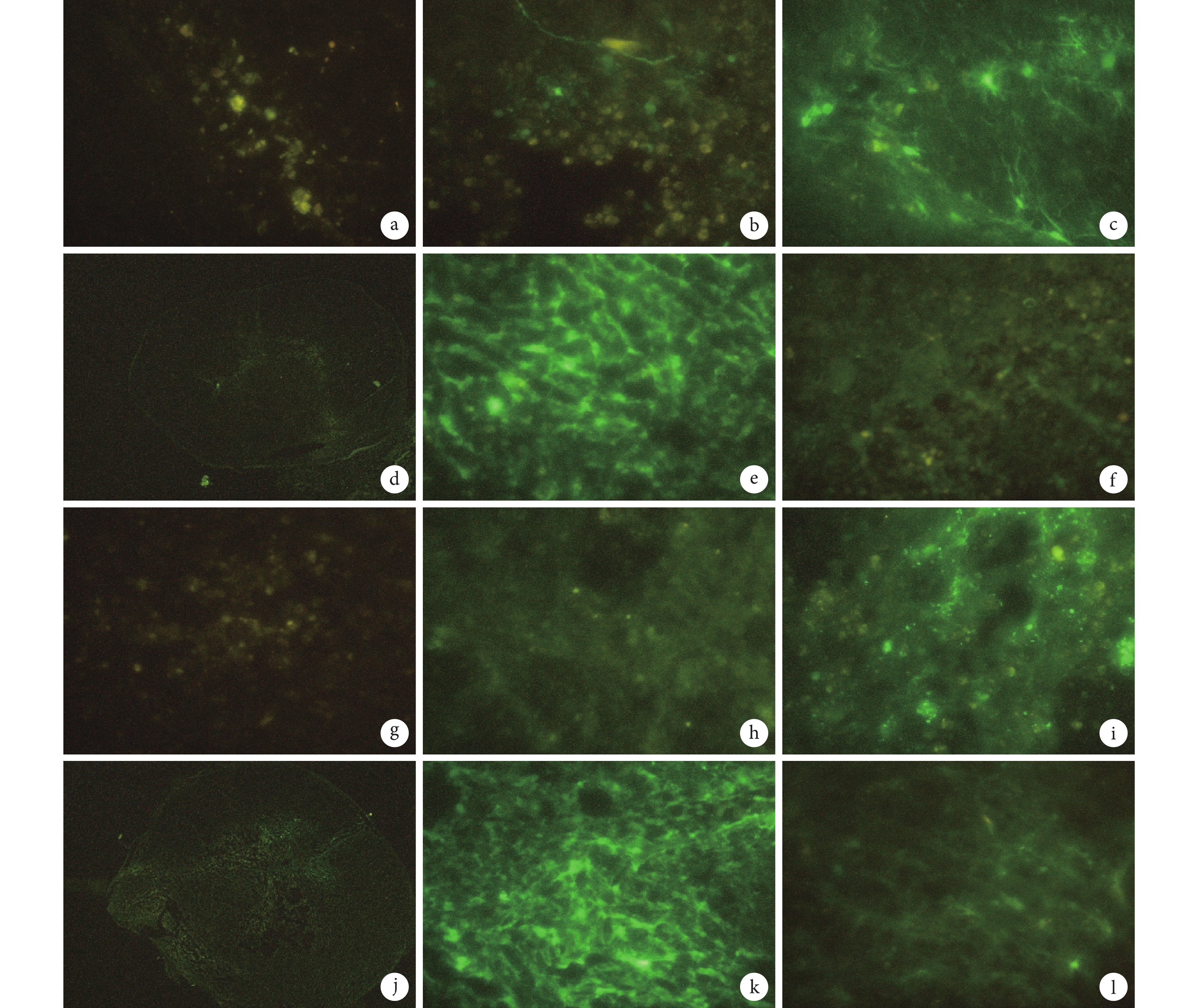 圖2
陰性對照慢病毒轉染各時間點兩組大鼠脊髓組織熒光顯微鏡觀察
圖2
陰性對照慢病毒轉染各時間點兩組大鼠脊髓組織熒光顯微鏡觀察
a. 假手術組 1 d(×400);b. 假手術組 3 d(×400);c. 假手術組 5 d(×400);d. 假手術組 7 d(×40);e. 假手術組 7 d(×400);f. 假手術組 14 d(×400); g. 脊髓損傷組 1 d(×400);h. 脊髓損傷組 3 d(×400);i. 脊髓損傷組 5 d(×400);j. 脊髓損傷組 7 d(×40);k. 脊髓損傷組 7 d(×400);l. 脊髓損傷組 14 d(×400)
Figure2. Fluorescence microscopy observation of spinal cord tissue in two groups of rats transfected with negative control lentivirus at different time pointsa. The sham-operation group at 1 day (×400); b. The sham-operation group at 3 days (×400); c. The sham-operation group at 5 days (×400); d. The sham-operation group at 7 days (×40); e. The sham-operation group at 7 days (×400); f. The sham-operation group at 14 days (×400); g. The spinal cord injury group at 1 day (×400); h. The spinal cord injury group at 3 days (×400); i. The spinal cord injury group at 5 days (×400); j. The spinal cord injury group at 7 days (×40); k. The spinal cord injury group at 7 days (×400); l. The spinal cord injury group at 14 days (×400)
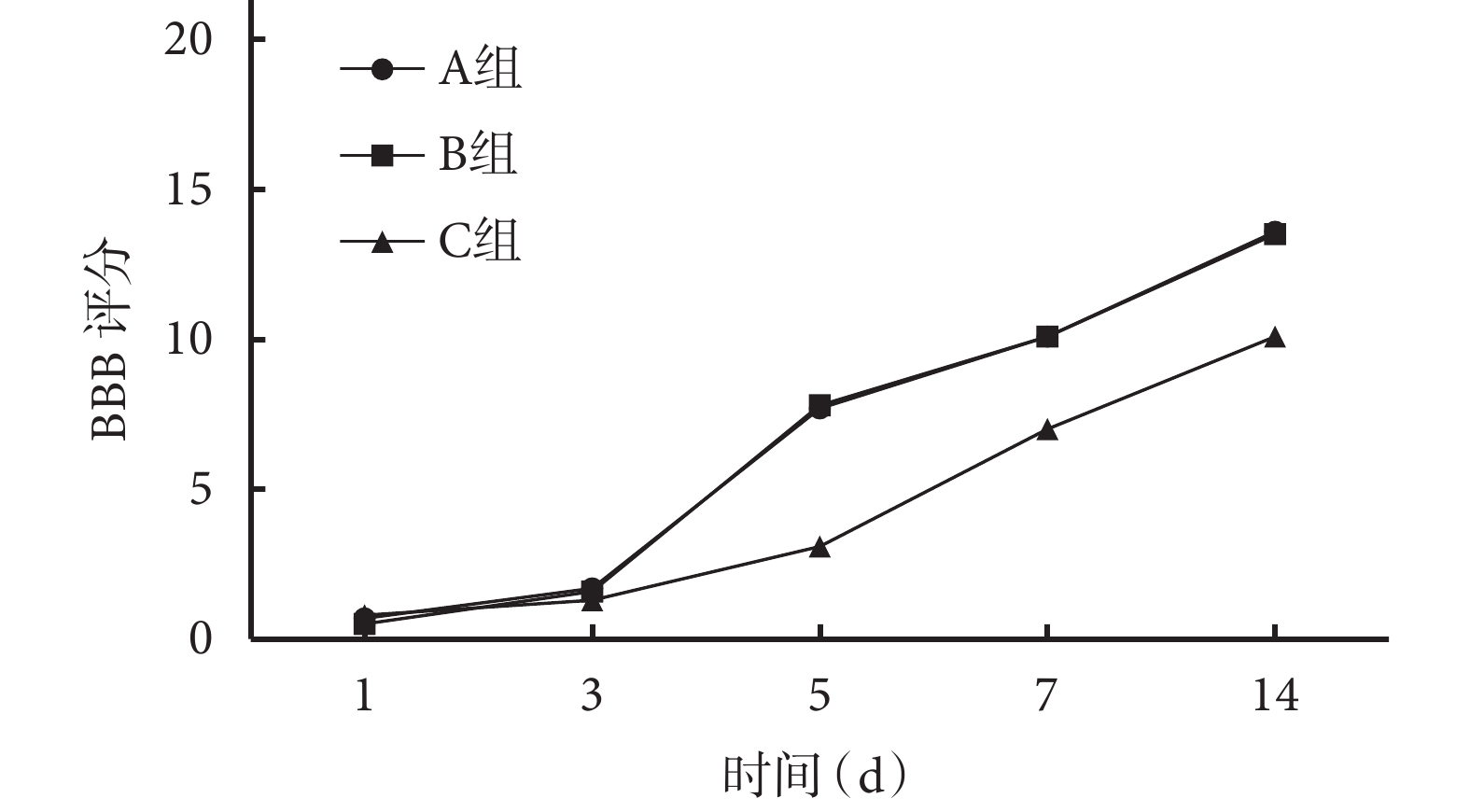 圖3
轉染后各時間點各組大鼠 BBB 評分
Figure3.
BBB scores of rats in each group at different time points after lentivirus transfection
圖3
轉染后各時間點各組大鼠 BBB 評分
Figure3.
BBB scores of rats in each group at different time points after lentivirus transfection
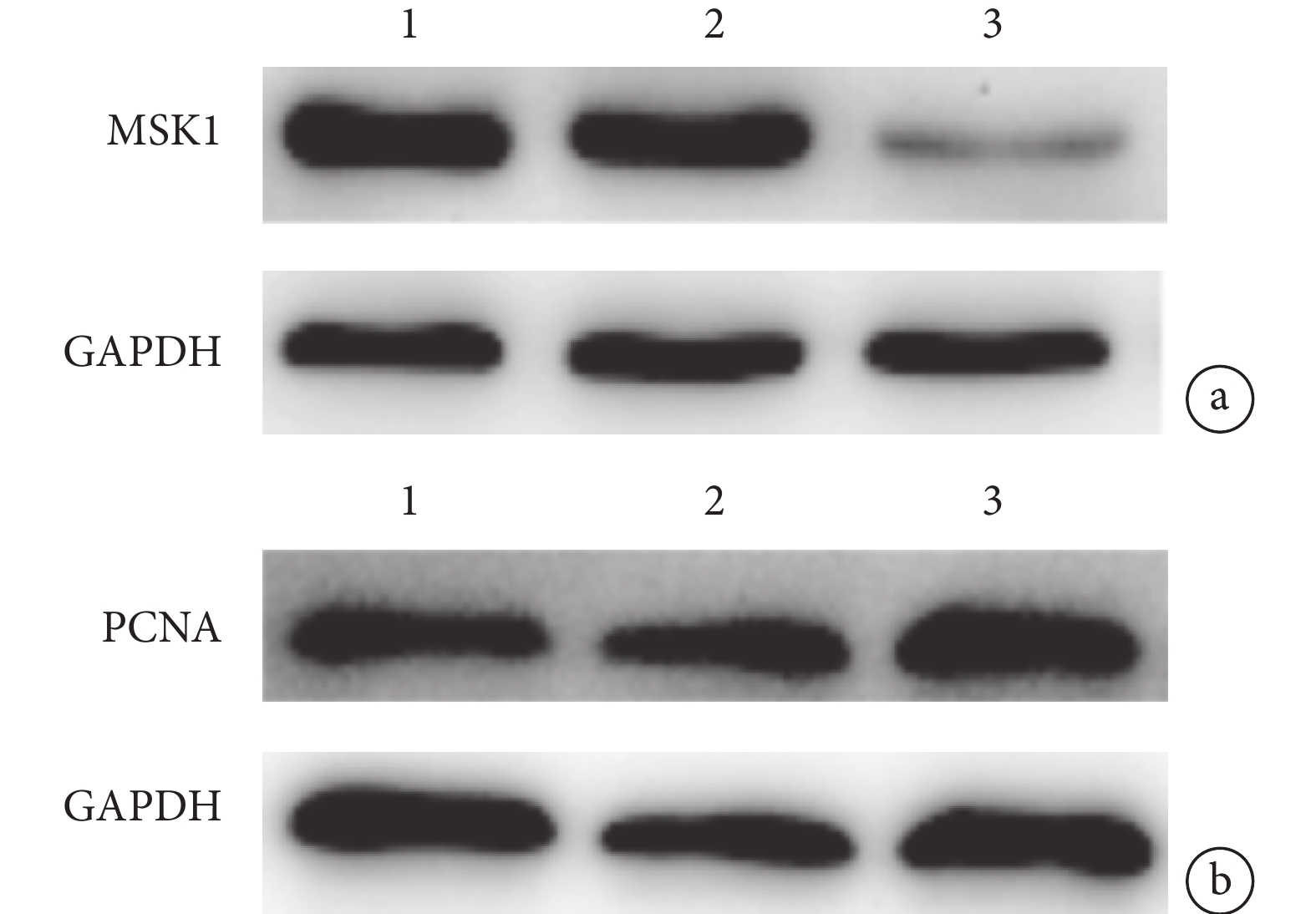 圖4
Western blot 檢測轉染 7 d 后各組 MSK1 及 PCNA 蛋白表達
圖4
Western blot 檢測轉染 7 d 后各組 MSK1 及 PCNA 蛋白表達
1:A 組 2:B 組 3:C 組 a. MSK1;b. PCNA
Figure4. The expressions of MSK1 and PCNA protein in spinal cord tissues of rats in each group at 7 days after transfection with lentivirus by Western blot analysis1: Group A 2: Group B 3: Group C a. MSK1; b. PCNA
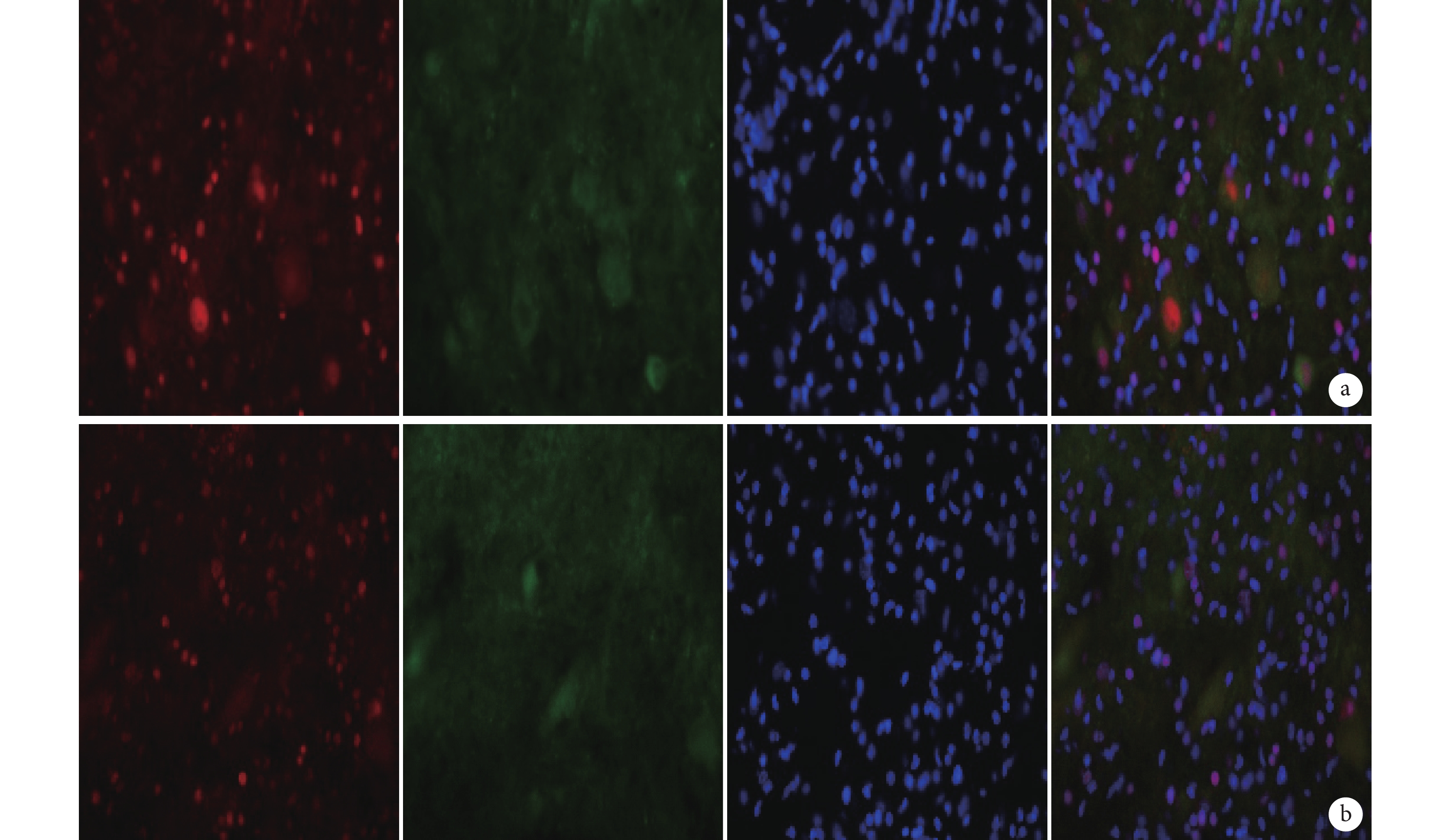
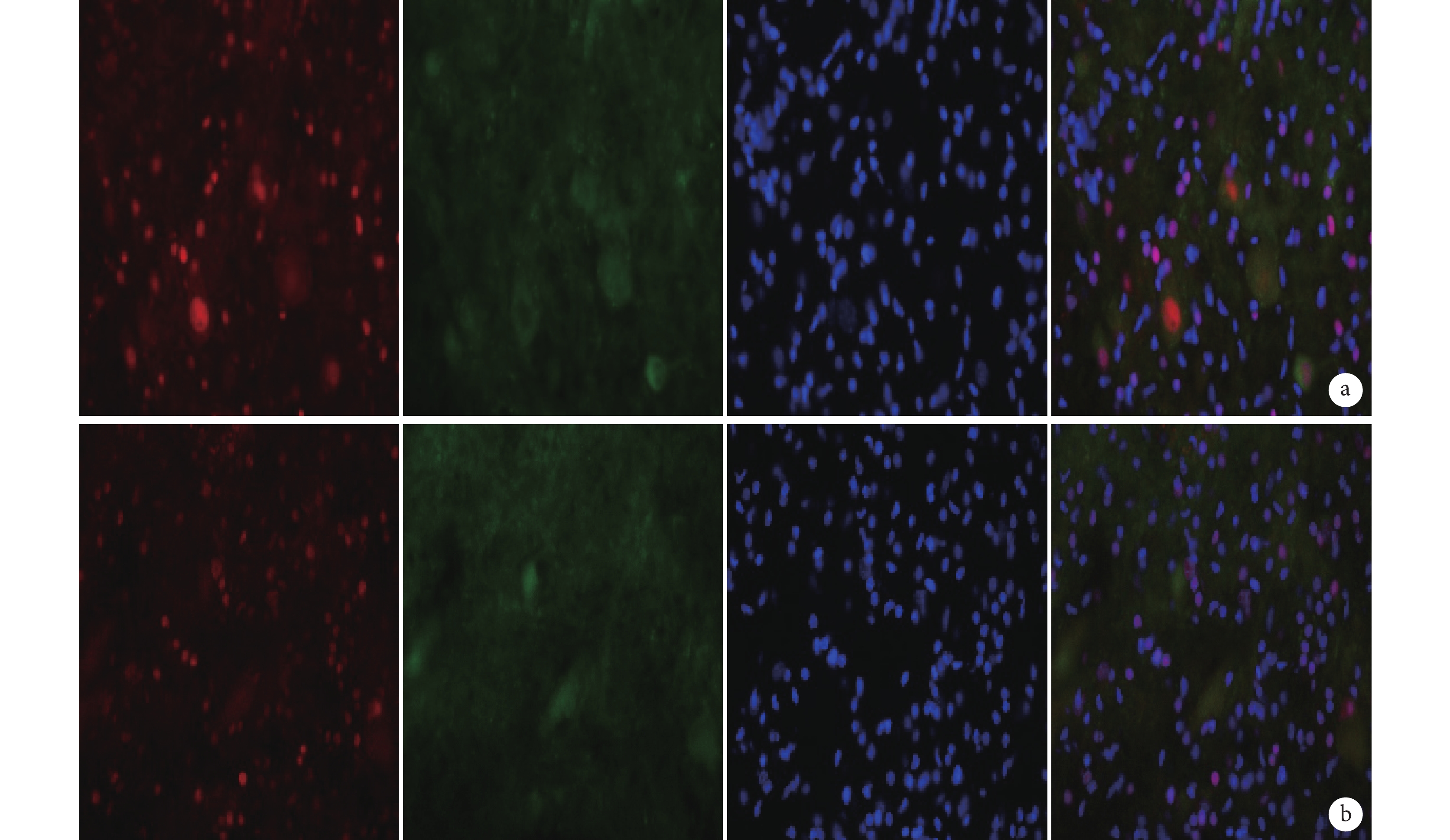 圖5
免疫熒光染色檢測 MSK1 與 GFP 雙標染色(倒置熒光顯微鏡×400)
圖5
免疫熒光染色檢測 MSK1 與 GFP 雙標染色(倒置熒光顯微鏡×400)
從左至右依次為 MSK1、GFP、DAPI 以及三者重疊 a. B 組;b. C 組
Figure5. Immunofluorescence staining for double staining of MSK1 and GFP (Inverted fluorescence microscope×400)From left to right for MSK1, GFP, DAPI, and merge a. Group B; b. Group C
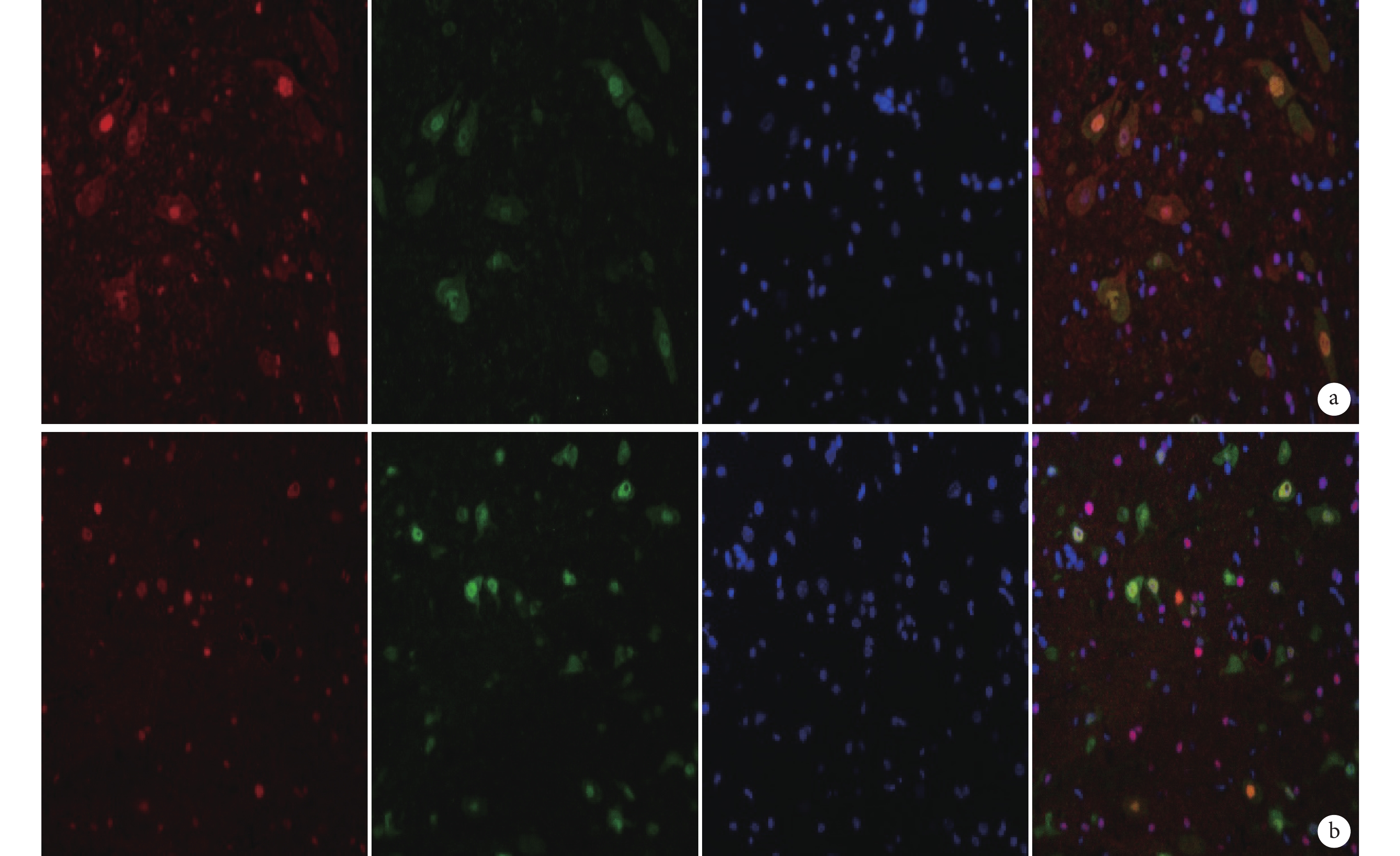
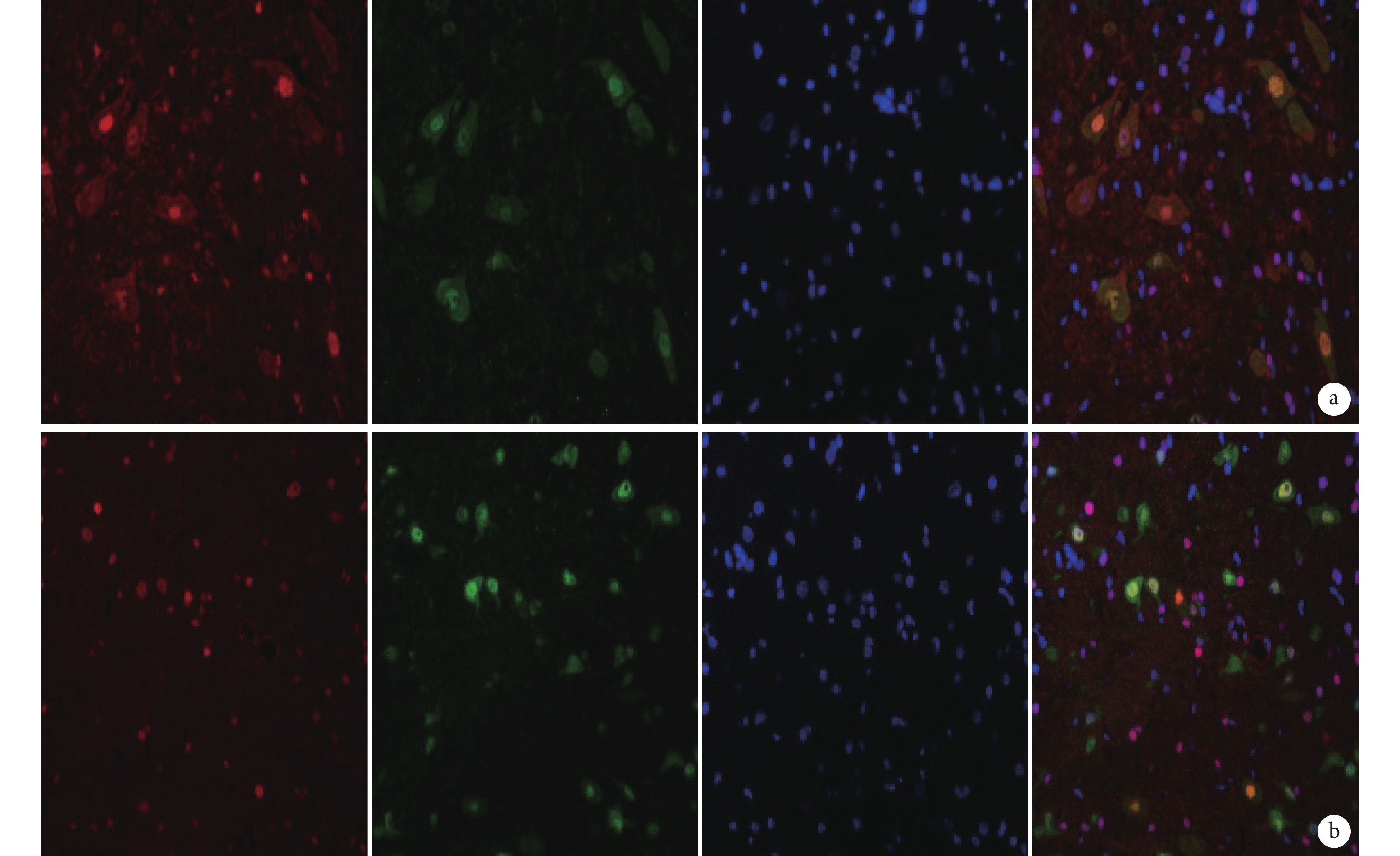 圖6
免疫熒光染色檢測 MSK1 與 NeuN 雙標染色(×400)
圖6
免疫熒光染色檢測 MSK1 與 NeuN 雙標染色(×400)
從左至右依次為 MSK1、NeuN、DAPI 以及三者重疊 a. B 組;b. C 組
Figure6. Immunofluorescence staining for double staining of MSK1 and NeuN (Inverted fluorescence microscope×400)From left to right for MSK1, NeuN, DAPI, and merge a. Group B; b. Group C
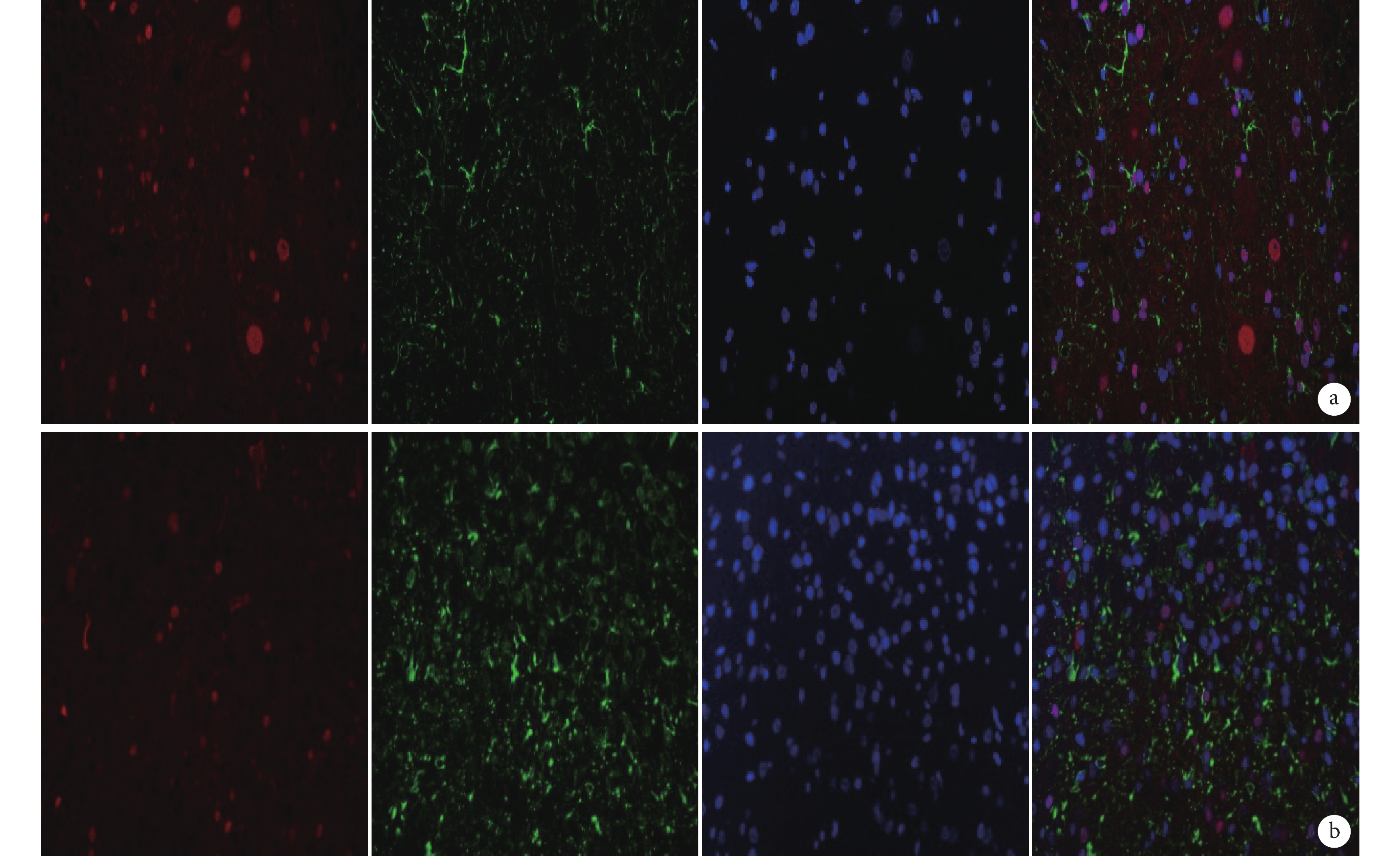
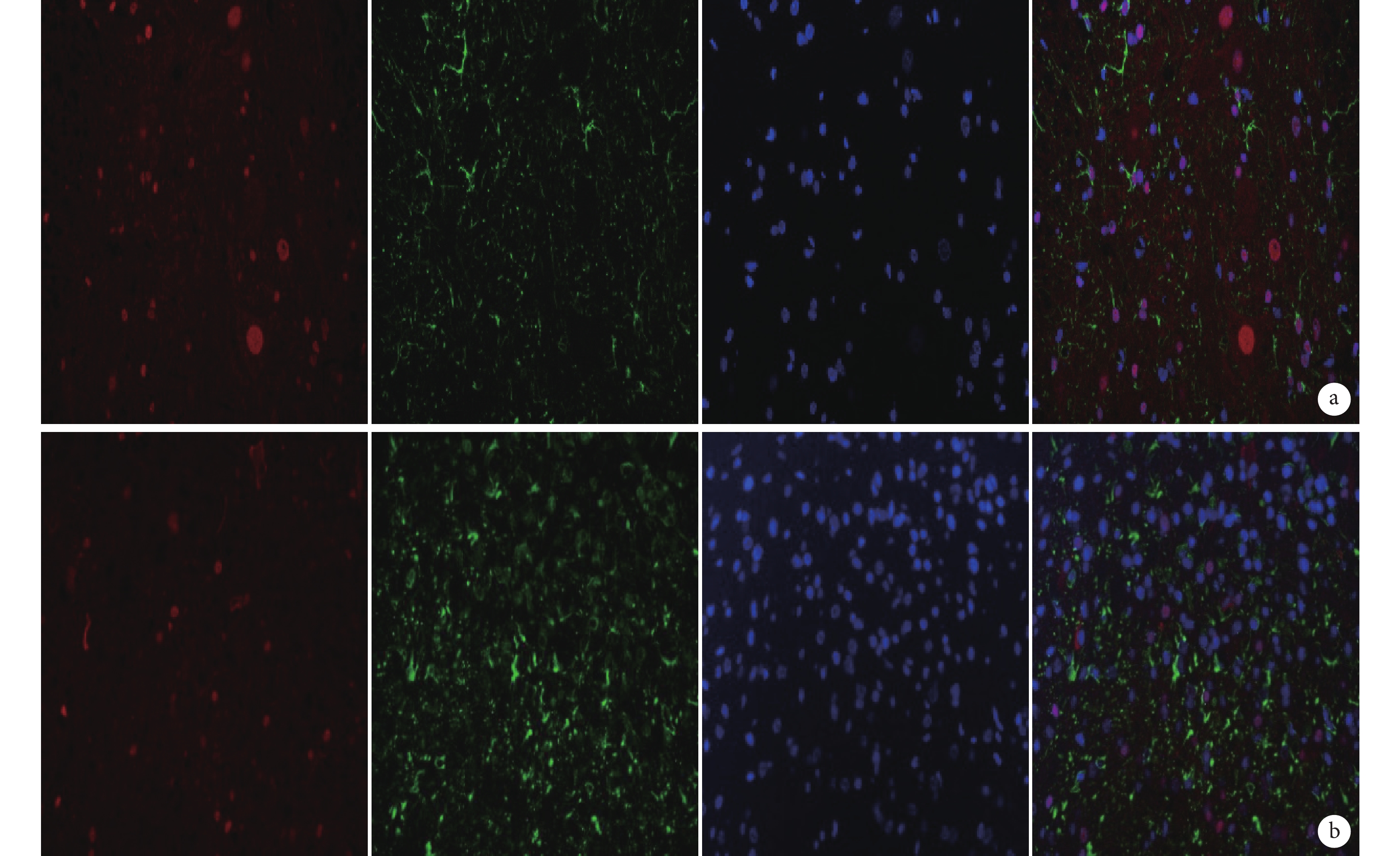 圖7
免疫熒光染色檢測 MSK1 與 GFAP 雙標染色(×400)
圖7
免疫熒光染色檢測 MSK1 與 GFAP 雙標染色(×400)
從左至右依次為 MSK1、GFAP、DAPI 以及三者重疊 a. B 組;b. C 組
Figure7. Immunofluorescence staining for double staining of MSK1 and GFAP (Inverted fluorescence microscope×400)From left to right for MSK1, GFAP, DAPI, and merge a. Group B; b. Group C
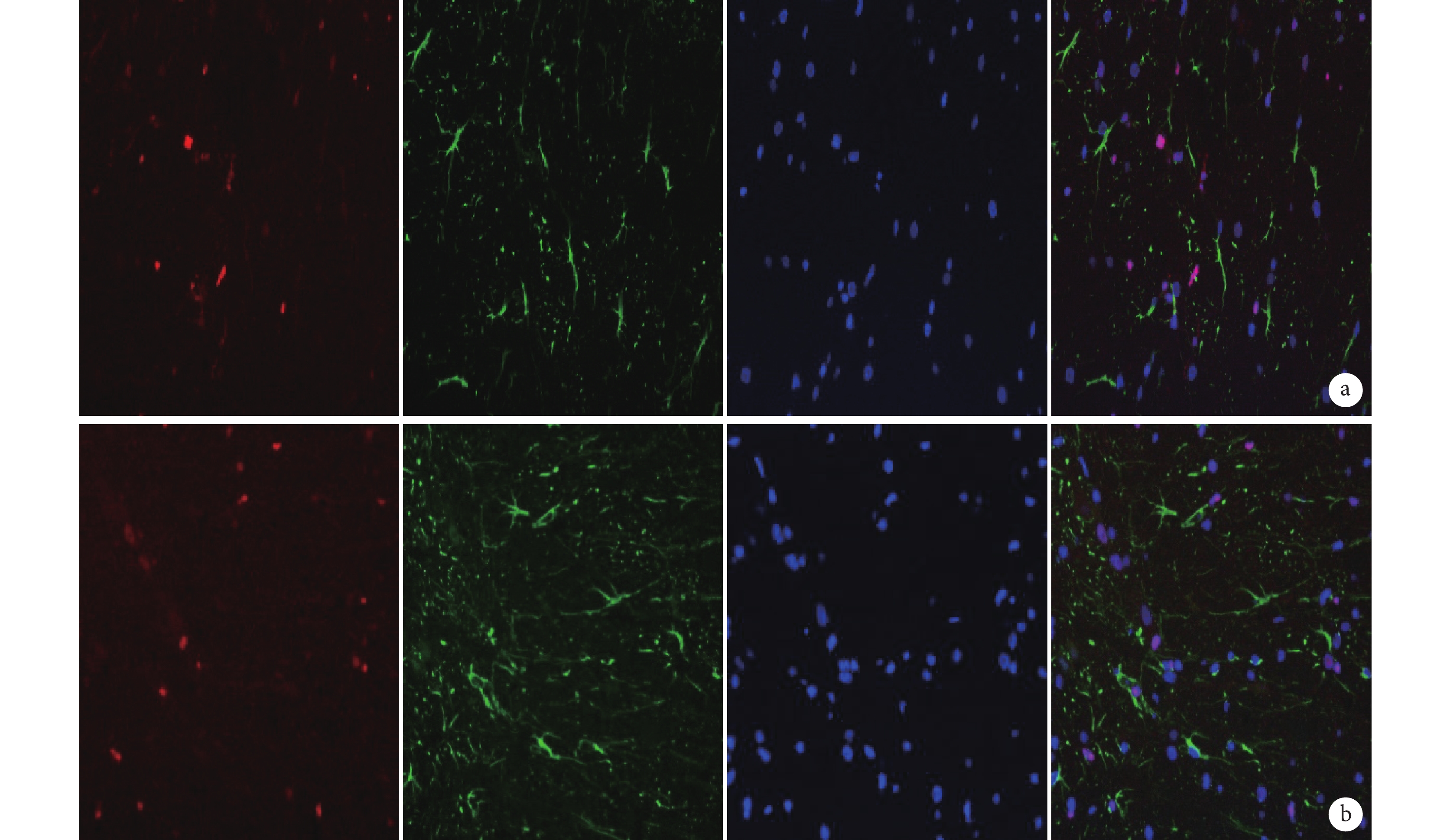
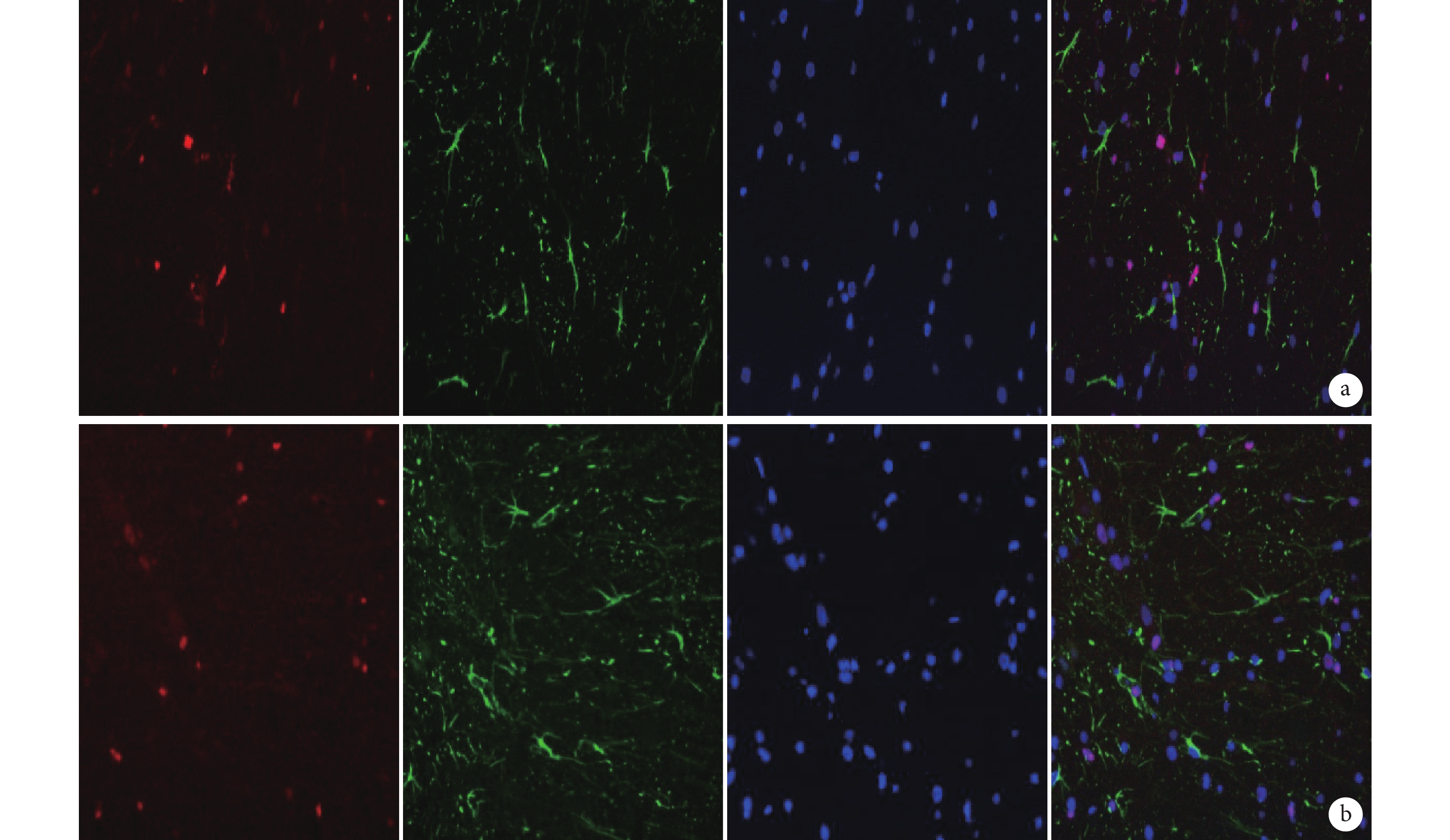 圖8
免疫熒光染色檢測 PCNA 與 GFAP 雙標染色(×400)
圖8
免疫熒光染色檢測 PCNA 與 GFAP 雙標染色(×400)
從左至右依次為 PCNA、GFAP、DAPI 以及三者重疊 a. B 組;b. C 組
Figure8. Immunofluorescence staining for double staining of PCNA and GFAP (Inverted fluorescence microscope×400)From left to right for PCNA, GFAP, DAPI, and merge a. Group B; b. Group C
3 討論
中樞神經系統炎性反應的標志是神經膠質細胞的活化,包括星形膠質細胞和小神經膠質細胞[12]。而中樞神經系統的外傷性損傷導致星形膠質細胞的肥大、增殖,其特征在于一個快速的炎性反應和增加的 GFAP 表達,導致炎癥和細胞毒性物質的釋放[13]。雖然目前有證據表明,在脊髓損傷的初始階段,活性星形膠質細胞和小膠質細胞在軸突再生和后期功能恢復中發揮神經保護和修復作用[14];但在脊髓損傷期間,活性星形膠質細胞過度激活,嚴重時會最終導致損傷部位周圍膠質瘢痕形成和分泌多種神經毒性分子,阻止傷后神經再生[15]。所以抑制星形膠質細胞過度增生和神經膠質瘢痕形成,可能有助于神經元修復和軸突再生。
脊髓損傷的繼發性損傷涉及多個信號通路如 MAPK 信號傳遞途徑,誘發并級聯放大炎性反應,最終導致神經細胞壞死。在 MAPK 靶點中,MSK1 在 p38 和 ERK1/2 的下游被激活,廣泛參與免疫和炎癥應答,在調控細胞增殖和轉化、調節突觸可塑性、神經元存活、神經元成熟和發育可塑性中起重要作用。MSK1 被 ERK 激活,通常介導生長因子、多肽類激素、神經遞質、細胞因子的生物學效應[16];MSK1 被 p38 激活,通常介導細胞炎性刺激和壓力反應,如紫外線照射、氧化應激以及茴香霉素介導的細胞反應[17]。此外,Toll 樣受體識別細菌脂多糖等病原微生物,也能激活 MSK1[18]。因此,MSK1 與細胞增殖及應激反應,特別是炎性反應關系十分密切,在多個生物學事件中發揮重要作用。
研究表明在大鼠腦內注射細菌脂多糖誘導的腦損傷模型中,MSK1 參與星形膠質細胞炎癥,抑制炎性細胞因子 TNFα、IL-6 和 IL-1β 的產生[19]。在巨噬細胞中,最近顯示 MSK1 參與負反饋途徑,這對于防止不受控制的炎癥至關重要[20]。MSK 通過控制其在巨噬細胞和樹突狀細胞中的轉錄來調節 IL-10。在一項由去除鎂來誘導培養海馬的過度興奮性和變性神經元的研究中表明,MSK1 在興奮性毒素介導的神經元損傷中,通過增強谷氨酸能神經傳遞發揮重要作用[21]。雖然 MSK1 和 MSK2 敲除小鼠在中樞神經系統發育中未表現出嚴重缺陷,但在某些情況下,MSKs 在神經元增殖或存活中起作用。在毛果蕓香堿誘導的癲癇發作后,通過 MSK1 和 MSK2 的敲除降低了小鼠齒狀回的小顆粒區中的神經元祖細胞增殖。此外,在該區域的未成熟神經元中也觀察到還原神經突的形成,表明 MSK 正在幫助推動增殖和新神經元的成熟[22]。Ning 等[23]在大鼠腦損傷的研究中證實,MSK1 在神經元和星形膠質細胞中表達,且在星形膠質細胞中與其增殖抗原 PCNA 共定位。該研究同時通過 Western blot 法檢測 MSK1 在大鼠腦損傷后的表達變化,結果發現 MSK1 在顱腦損傷 12 h 后其表達水平逐漸下降,在 3 d 時降至最低,后逐漸恢復至正常水平,而這種變化和 PCNA 的表達變化具有相反性,說明 MSK1 在大鼠腦外傷后在膠質細胞增殖中可能發揮了一定作用。
本研究在前期通過建立大鼠脊髓損傷模型,并于損傷后 8、12 h 及 1、2、3、5、7 d 取材行 Western blot 檢測 MSK1 及 PCNA 蛋白表達變化。結果顯示 MSK1 蛋白在脊髓損傷后 8 h 開始下降,傷后 3 d 降至最低,然后逐漸上升;而 PCNA 蛋白在脊髓損傷后 8 h 開始上升,至傷后 3 d 達峰值,而后逐漸下降。MSK1 與 PCNA 蛋白表現出相反的變化趨勢,這一結果與 Ning 等[23]在大鼠腦損傷中 MSK1 的表達類似。為進一步探索 MSK1 在脊髓損傷修復中的作用及意義,我們通過構建 MSK1 siRNA 重組慢病毒,并參照 Tan 等[9]和 Hu 等[10]的方法注射到大鼠脊髓損傷部位。而前期在大鼠脊髓損傷后局部注射陰性對照慢病毒,灌注取材行冰凍切片熒光顯微鏡下觀察發現,注射后 1 d 即可見綠色熒光表達,至 7 d 綠色熒光表達最強。所以我們采用脊髓損傷慢病毒注射后 7 d 這一時間點作為進一步實驗的基礎。并將大鼠分為單純脊髓損傷組、脊髓損傷后轉染陰性對照慢病毒 LV3NC 組和脊髓損傷后轉染 MSK1 siRNA 組,術后 7 d 取材行 Western blot 及免疫熒光雙標染色,結果發現注射 MSK1 siRNA 慢病毒后 MSK1 蛋白表達被有效抑制,同時伴隨著 PCNA 蛋白表達的相對增加。
PCNA 是一種重要的定位于細胞核內的 DNA 修復相關蛋白,參與多種 DNA 修復過程,如 DNA 的正常復制、堿基切除、核酸切除以及錯配切除等修復過程[24],是評價細胞增殖狀態的重要指標。有研究發現,脊髓損傷后星形膠質細胞和小膠質細胞上表達較多的 PCNA[24]。而 PCNA 是否是通過調控神經膠質細胞的增殖,在大鼠脊髓損傷中發揮作用尚不明確。因此我們進行免疫熒光染色,通過 PCNA 及 GFAP 的熒光表達情況,明確 PCNA 是否調控神經膠質細胞的增殖。結果顯示 MSK1 在脊髓表達并存在于細胞核中,并與 GFP、NeuN 及 GFAP 共定位。GFP 蛋白是構建慢病毒攜帶的綠色熒光標志蛋白,MSK1 與 GFP 共表達說明 MSK1 能成功轉染入脊髓。NeuN 和 GFAP 分別是神經元和星形膠質細胞的標志蛋白,MSK1 與 NeuN 及 GFAP 共定位,間接證明病毒轉染發生于神經元及星形膠質細胞中。
我們進一步采用 Image J 軟件進行免疫熒光染色陽性細胞相對表達面積定量分析,結果顯示注射 MSK1 siRNA 慢病毒后,MSK1 的陽性細胞相對表達面積較注射陰性對照慢病毒低,而 PCNA 的陽性細胞相對表達面積較注射陰性對照慢病毒高,這與 Western blot 檢測 MSK1 及 PCNA 的表達結果相似。而伴隨著 MSK1 的下降及 PCNA 的上調,GFAP 的陽性細胞相對表達面積也上升。
為了明確 MSK1 在脊髓損傷修復中對運動功能的影響,我們采用大鼠后肢 BBB 運動功能評分進行評價。結果顯示脊髓損傷后轉染 MSK1 siRNA 組在術后 5、7、14 d 評分均低于注射陰性對照慢病毒組及單純脊髓損傷組。可能是由于脊髓損傷后轉染 MSK1 siRNA 下調了脊髓中 MSK1 的表達,而 PCNA 在脊髓中表達增加,PCNA 又通過調控星形膠質細胞的增殖,最終導致損傷部位周圍膠質瘢痕形成,阻礙神經元修復和軸突再生,進而導致運動功能障礙。
綜上述,本研究結果表明構建的 MSK1 siRNA 重組慢病毒能成功轉染入大鼠脊髓中,并有效抑制 MSK1 的表達;MSK1 的表達被抑制后明顯降低了脊髓損傷后大鼠后肢功能的恢復;而 MSK1 沉默后,PCNA 繼發性上調并伴隨著星形膠質細胞的增殖。因此我們認為,MSK1 可能通過 PCNA 調控神經膠質細胞的增殖,在大鼠脊髓損傷后的修復中發揮一定作用。
脊髓損傷是脊柱損傷最嚴重的并發癥,往往導致損傷節段以下肢體嚴重的功能障礙。然而脊髓損傷的治療一直是臨床難題,迄今未取得有意義的突破,其原因是對脊髓損傷后病理改變缺乏有效的干預手段。脊髓損傷后的病理變化包括原發性損傷和繼發性損傷[1-2]。繼發性損傷包括原發性損傷所引起的局部缺血缺氧、細胞凋亡、免疫炎性反應、興奮性毒性、自由基損傷、脂質過氧化、星形膠質瘢痕形成等,是加重神經功能障礙的主要原因,具有可逆性且可被調控[3]。其中,反應性星形膠質細胞的過度增殖和炎性反應起著重要作用,涉及多個信號通路如絲裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)信號傳導途徑,誘發并級聯放大炎性反應,最終導致神經細胞壞死。
促分裂原和應激激活的蛋白激酶 1(mitogen- and stress-activated protein kinase 1,MSK1)和 MSK2 是核內絲氨酸/蘇氨酸蛋白激酶,在 MAPK 靶點中,MSK1 在 p38 和 ERK1/2 的下游被激活[4]。研究表明 MSK1 磷酸化多種底物,包括 cAMP 反應元件結合蛋白[5]、NF-κB 的 p65 亞基[6]、組蛋白 H3[7]、轉錄因子 1[8],廣泛參與免疫和炎癥應答,在調控細胞增殖和轉化、調節突觸可塑性、神經元存活、神經元成熟和發育可塑性中起重要作用。MSK1 在急性中樞神經系統的損傷修復中起著重要作用。本實驗通過檢測 MSK1 在大鼠脊髓損傷后表達的時空變化規律,并應用 RNA 干擾構建 MSK1 小干擾 RNA(small interfering RNA,siRNA)重組慢病毒注射入大鼠脊髓損傷部位,通過調控 MSK1 在脊髓的表達,進一步探索 MSK1 在脊髓損傷中的作用及意義。
1 材料與方法
1.1 實驗動物及主要材料、儀器
健康成年清潔級雄性 SD 大鼠 120 只,體質量 220~250 g,由上海斯萊克實驗動物公司提供;實驗前適應性喂養 1 周。
MSK1 siRNA 重組慢病毒、陰性對照慢病毒 LV3NC(上海吉瑪制藥技術有限公司)。慢病毒液滴度為 0.9×109 TU/mL,收集后用無菌生理鹽水稀釋至滴度為 0.5×109 TU/mL,置于–80℃ 備用,防止反復凍融,以免病毒顆粒失活。
兔抗 MSK1 多克隆抗體(Novus 公司,美國);兔抗增殖細胞核抗原(proliferating cell nuclear antigen,PCNA)多克隆抗體、兔抗 GAPDH 多克隆抗體(CST 公司,美國);小鼠抗神經元核抗原(neuronal nuclei,NeuN)抗體、小鼠抗神經膠質酸性蛋白(glial fibrillary acidic protein,GFAP)抗體(Abcam 公司,美國);辣根過氧化物酶標記山羊抗兔 IgG(北京中杉金橋生物技術有限公司);熒光二抗(Cy3 標記山羊抗兔 IgG、Alexa Fluor 488 標記山羊抗小鼠 IgG)、4’,6-二脒基-2-苯基吲哚(4’,6-diamidino-2-phenylindole,DAPI;湖北谷歌生物有限公司);SDS-PAGE 凝膠快速配制試劑盒、BeyoColor 彩色預染蛋白分子量標準[(6.5~270)×103]、RIPA 裂解液、BCA 蛋白濃度測定試劑盒、ECL 化學發光試劑盒(上海碧云天生物技術有限公司)。
NYU Impactor-Ⅲ打擊器(W.M.Keck 公司,美國);–80℃ 冰箱(Thermo 公司,美國);CX21FSI 電子顯微鏡(Olympus 公司,日本);凝膠電泳成像系統(Syngene 公司,英國);聚偏氟乙烯(Polyvinylidene fluoride,PVDF)膜(Millipore 公司,美國);酶標儀、電泳儀、轉膜儀(Bio-Rad 公司,美國);化學發光成像儀、HM525 冰凍切片機(Thermo Fisher Scientific 公司,美國);倒置熒光顯微鏡(Nikon 公司,日本);石蠟切片機(Leica 公司,德國)。
1.2 脊髓損傷后 MSK1 及 PCNA 蛋白的表達變化
1.2.1 實驗分組及方法
取 70 只 SD 大鼠隨機分為脊髓損傷組和假手術組,每組 35 只。所有大鼠以 10% 水合氯醛(0.3 mL/100 g)腹腔注射麻醉,俯臥位固定,常規消毒、備皮。以 T10 為中心作一長約 4 cm 的縱切口,逐層切開皮膚、皮下組織、剪開深筋膜,暴露棘突及椎旁肌肉,銳性分離椎旁肌肉并用微型自動拉鉤撐開,充分暴露 T9~T11 椎板,用咬骨鉗小心咬除 T9~T11 椎體棘突,咬除 T10 全椎板及上下關節突,充分暴露脊髓,顯露脊髓長約 1.0 cm。假手術組即行逐層縫合,不損傷脊髓。脊髓損傷組置于 NYU Impactor-Ⅲ 打擊器上,采用 Allen 法以 10 g×2.5 cm 自由落體打擊制作大鼠脊髓損傷模型。大鼠尾巴痙攣性擺動并持續數秒,雙下肢回縮撲動數秒,硬脊膜下充血,蘇醒后雙下肢呈完全癱瘓,則提示造模成功。打擊后充分止血,逐層縫合,并于一側下肢注射約 0.5 mL 慶大霉素,保溫至麻醉蘇醒。術后行人工排尿,每日早晚各 1 次,直至膀胱排尿功能恢復。
1.2.2 Western blot 檢測 MSK1 及 PCNA 蛋白表達
兩組分別于造模后 8、12 h 及 1、2、3、5、7 d 各取 5 只大鼠,深度麻醉后,經心臟灌注生理鹽水約 200 mL,然后在冰上迅速取出損傷部位脊髓,長約 1 cm,裝入 EP 管放入 –80℃ 冰箱保存備用。各脊髓組織加入適量 RAPI 裂解液冰上裂解,提取組織總蛋白上清液,采用 BCA 蛋白濃度測定試劑盒測定蛋白濃度。每組取等量蛋白上樣,進行 10%SDS-PAGE 電泳,電轉移到 PVDF 膜上,5% 脫脂牛奶室溫封閉 1 h。分別用一抗兔抗 MSK1 多克隆抗體(1∶1 000)、兔抗 PCNA 多克隆抗體(1∶1 000)和內參兔抗 GAPDH 多克隆抗體(1∶1 000)于 4℃ 冰箱中孵育過夜,TBST 沖洗后,用二抗辣根過氧化物酶標記羊抗兔 IgG(1∶2 500)室溫孵育 1 h。TBST 沖洗后根據試劑盒說明采用 ECL 發光法進行膠片曝光,用圖像分析軟件 Photoshop 進行灰度值測定,作為蛋白表達量。
1.3 最佳病毒轉染時間確定
取 20 只 SD 大鼠隨機分為脊髓損傷組和假手術組,每組 10 只,同上法制備動物模型。使用 10 μL 微量注射器,參照 Tan 等[9]和 Hu 等[10]局部椎管內注射法,在每只大鼠距背側脊髓打擊中心約 2 mm 的頭尾兩端,深約 0.8 mm 處,分別注入 3 μL 陰性對照慢病毒 LV3NC 稀釋液,共約 6 μL。注射完成后 1、3、5、7、14 d,每組各取 2 只大鼠,深入麻醉后使用生理鹽水及 4% 多聚甲醛經心臟灌注處死動物,然后取注射部位脊髓組織樣本,放入 4% 多聚甲醛于 4℃ 冰箱中固定 8 h 后置于 30% 蔗糖沉底,然后置于 O.C.T 包埋劑中,低溫恒冷冰凍切片機連續切取厚約 20 μm 的脊髓組織切片,倒置熒光顯微鏡下觀察慢病毒攜帶的綠色熒光表達情況,以綠色熒光的強弱來確定最佳病毒轉染時間點。
1.4 MSK1 慢病毒干擾載體對脊髓損傷后大鼠運動功能及 MSK1、PCNA 表達的影響
1.4.1 實驗分組及方法
取剩余 30 只 SD 大鼠隨機分為 3 組,每組 10 只。所有大鼠均同上法制備脊髓損傷模型,A 組為單純脊髓損傷組;B、C 組同上法分別轉染陰性對照慢病毒 LV3NC 和 MSK1 siRNA 重組慢病毒。
1.4.2 大鼠后肢運動功能 BBB 評分
3 組大鼠分別于造模后 1、3、5、7、14 d,采用 BBB 評分法[11]進行后肢運動功能評價,觀察各組大鼠后肢運動功能。實驗采用雙盲、雙人獨立評估,取均值。
1.4.3 Western blot 檢測 MSK1 及 PCNA 蛋白表達
每組于病毒轉染最佳時間點各取 5 只動物處死,取材采用 Western blot 檢測 MSK1 及 PCNA 蛋白表達。
1.4.4 免疫熒光雙標染色檢測 MSK1 及 PCNA 定位表達
B、C 組于病毒轉染最佳時間點取注射部位脊髓組織樣本,經 4% 多聚甲醛固定后進行組織脫水,石蠟包埋,制備 5 μm 厚石蠟切片;脫蠟至水,檸檬酸鈉高壓修復抗原,組化筆在組織周圍畫圈,在圈內加入自發熒光淬滅劑,牛血清白蛋白封閉 30 min。其中免疫熒光雙標染色,滴加一抗兔抗 MSK1 多克隆抗體(1∶1 00)或兔抗 PCNA 多克隆抗體(1∶1 00),同時滴加小鼠抗 NeuN 單克隆抗體(1∶100)或小鼠抗 GFAP 單克隆抗體(1∶3 000)于濕盒內 4°C 孵育過夜;PBS 洗滌 3 次,滴加與一抗相應種屬的二抗 Cy3 標記山羊抗兔 IgG(1∶300)和 Alexa Fluor 488 標記山羊抗小鼠 IgG(1∶400)覆蓋組織;避光室溫孵育 50 min;PBS 洗滌 3 次,滴加 DAPI 染液,避光室溫孵育 10 min 后用抗熒光淬滅封片劑封片。對于需要同時觀察慢病毒轉染后脊髓中綠色熒光蛋白(green fluorescent protein,GFP)的表達情況,則不加入自發熒光淬滅劑,滴加一抗兔抗 MSK1 多克隆抗體(1∶1 00)及 Cy3 標記山羊抗兔 IgG(1∶300),按上述方法處理后,與其他切片一起于倒置熒光顯微鏡下觀察熒光表達情況。采集圖像,用 Image J 圖像分析軟件對圖像中表達 MSK1、PCNA、GFAP 的陽性細胞相對表達面積進行半定量分析。
1.5 統計學方法
采用 SPSS19.0 統計軟件進行分析。數據以均數±標準差表示,兩組間比較采用獨立樣本 t 檢驗;多組間比較采用單因素方差分析,兩兩比較采用 SNK 檢驗;檢驗水準取雙側 α=0.05。
2 結果
2.1 脊髓損傷后 MSK1 及 PCNA 蛋白表達
Western blot 檢測示,假手術組各時間點脊髓組織中的 MSK1 及 PCNA 蛋白表達無明顯變化。脊髓損傷組 MSK1 蛋白表達于傷后 8 h 開始呈逐漸下降趨勢,至傷后 3 d 降至最低,而后呈逐漸上升趨勢;PCNA 蛋白表達于傷后 8 h 開始呈逐漸增加趨勢,傷后 3 d 達最高值,而后呈逐漸下降趨勢。脊髓損傷組傷后 1、2、3、5 d MSK1 蛋白表達量顯著低于假手術組,傷后 8 h 及 1、2、3、5、7 d PCNA 蛋白表達量顯著高于假手術組,差異均有統計學意義(P<0.05)。見圖 1。
2.2 最佳病毒轉染時間確定
倒置熒光顯微鏡觀察示,注射后 1 d 兩組大鼠脊髓組織即可見綠色熒光表達,但強度較弱;3、5 d 時熒光逐漸增強,由中心向周圍擴散;7 d 時熒光強度達到高峰,脊髓組織中可見大量綠色熒光表達;14 d 時熒光表達逐漸減弱,熒光濃聚程度降低。因此確定最佳病毒轉染時間為注射后 7 d。見圖 2。
2.3 MSK1 慢病毒干擾載體對脊髓損傷后大鼠運動功能及 MSK1、PCNA 表達的影響
2.3.1 大鼠后肢運動功能 BBB 評分
隨術后時間延長,各組 BBB 評分均呈逐漸上升趨勢。術后 5、7、14 d C 組 BBB 評分顯著低于 A、B 組,差異有統計學意義(P<0.05);術后各時間點 A、B 組間 BBB 評分比較,差異均無統計學意義(P>0.05)。見圖 3。
2.3.2 Western blot 檢測 MSK1 及 PCNA 蛋白表達
轉染 7 d 后,A、B、C 組 MSK1 蛋白表達量分別為 0.90±0.11、0.98±0.11、0.17±0.03,PCNA 蛋白表達量分別為 0.96±0.09、1.01±0.06、1.40±0.07。C 組 MSK1 蛋白表達量顯著低于 A、B 組,PCNA 蛋白表達量顯著高于 A、B 組,差異均有統計學意義(P<0.05);A、B 組間兩種蛋白表達量比較,差異均無統計學意義(P>0.05)。見圖 4。
2.3.3 免疫熒光雙標染色檢測 MSK1 及 PCNA 定位表達
免疫熒光雙標染色示,MSK1 在脊髓表達并存在于細胞核中,并與 GFP、NeuN 及 GFAP 共定位。此外,PCNA 也在脊髓表達并與 GFAP 存在共定位。見圖 5 ~ 8。B 組 MSK1、PCNA、GFAP 陽性細胞相對表達面積分別為 0.046%±0.007%、0.030%±0.003%、0.036%±0.003%,C 組分別為 0.026%±0.002%、0.046%±0.008%、0.052%±0.003%。C 組 MSK1 陽性細胞相對表達面積顯著高于 B 組,PCNA、GFAP 陽性細胞相對表達面積顯著低于 B 組,差異均有統計學意義(P<0.05)。
 圖1
Western blot 檢測各時間點假手術組及脊髓損傷組 MSK1、PCNA 蛋白表達
圖1
Western blot 檢測各時間點假手術組及脊髓損傷組 MSK1、PCNA 蛋白表達
a. 脊髓損傷組 MSK1 蛋白表達電泳圖 1:8 h 2:12 h 3:1 d 4:2 d 5:3 d 6:5 d 7:7 d;b. MSK1 蛋白表達量;c. 脊髓損傷組 PCNA 蛋白表達電泳圖 1:8 h 2:12 h 3:1 d4:2 d 5:3 d 6:5 d 7:7 d;d. PCNA 蛋白表達量
Figure1. The expressions of MSK1 and PCNA protein in sham-operation group and spinal cord injury group at different time points by Western blot analysisa. Electrophoretic diagram of MSK1 protein expression in spinal cord injury group 1: 8 hours 2: 12 hours 3: 1 day 4: 2 days 5: 3 days 6: 5 days 7: 7 days; b. Expression of MSK1 protein; c. Electrophoretic diagram of PCNA protein expression in spinal cord injury group 1: 8 hours 2: 12 hours 3: 1 day 4: 2 days 5: 3 days 6: 5 days 7: 7 days; d. Expression of PCNA protein
 圖2
陰性對照慢病毒轉染各時間點兩組大鼠脊髓組織熒光顯微鏡觀察
圖2
陰性對照慢病毒轉染各時間點兩組大鼠脊髓組織熒光顯微鏡觀察
a. 假手術組 1 d(×400);b. 假手術組 3 d(×400);c. 假手術組 5 d(×400);d. 假手術組 7 d(×40);e. 假手術組 7 d(×400);f. 假手術組 14 d(×400); g. 脊髓損傷組 1 d(×400);h. 脊髓損傷組 3 d(×400);i. 脊髓損傷組 5 d(×400);j. 脊髓損傷組 7 d(×40);k. 脊髓損傷組 7 d(×400);l. 脊髓損傷組 14 d(×400)
Figure2. Fluorescence microscopy observation of spinal cord tissue in two groups of rats transfected with negative control lentivirus at different time pointsa. The sham-operation group at 1 day (×400); b. The sham-operation group at 3 days (×400); c. The sham-operation group at 5 days (×400); d. The sham-operation group at 7 days (×40); e. The sham-operation group at 7 days (×400); f. The sham-operation group at 14 days (×400); g. The spinal cord injury group at 1 day (×400); h. The spinal cord injury group at 3 days (×400); i. The spinal cord injury group at 5 days (×400); j. The spinal cord injury group at 7 days (×40); k. The spinal cord injury group at 7 days (×400); l. The spinal cord injury group at 14 days (×400)
 圖3
轉染后各時間點各組大鼠 BBB 評分
Figure3.
BBB scores of rats in each group at different time points after lentivirus transfection
圖3
轉染后各時間點各組大鼠 BBB 評分
Figure3.
BBB scores of rats in each group at different time points after lentivirus transfection
 圖4
Western blot 檢測轉染 7 d 后各組 MSK1 及 PCNA 蛋白表達
圖4
Western blot 檢測轉染 7 d 后各組 MSK1 及 PCNA 蛋白表達
1:A 組 2:B 組 3:C 組 a. MSK1;b. PCNA
Figure4. The expressions of MSK1 and PCNA protein in spinal cord tissues of rats in each group at 7 days after transfection with lentivirus by Western blot analysis1: Group A 2: Group B 3: Group C a. MSK1; b. PCNA
 圖5
免疫熒光染色檢測 MSK1 與 GFP 雙標染色(倒置熒光顯微鏡×400)
圖5
免疫熒光染色檢測 MSK1 與 GFP 雙標染色(倒置熒光顯微鏡×400)
從左至右依次為 MSK1、GFP、DAPI 以及三者重疊 a. B 組;b. C 組
Figure5. Immunofluorescence staining for double staining of MSK1 and GFP (Inverted fluorescence microscope×400)From left to right for MSK1, GFP, DAPI, and merge a. Group B; b. Group C
 圖6
免疫熒光染色檢測 MSK1 與 NeuN 雙標染色(×400)
圖6
免疫熒光染色檢測 MSK1 與 NeuN 雙標染色(×400)
從左至右依次為 MSK1、NeuN、DAPI 以及三者重疊 a. B 組;b. C 組
Figure6. Immunofluorescence staining for double staining of MSK1 and NeuN (Inverted fluorescence microscope×400)From left to right for MSK1, NeuN, DAPI, and merge a. Group B; b. Group C
 圖7
免疫熒光染色檢測 MSK1 與 GFAP 雙標染色(×400)
圖7
免疫熒光染色檢測 MSK1 與 GFAP 雙標染色(×400)
從左至右依次為 MSK1、GFAP、DAPI 以及三者重疊 a. B 組;b. C 組
Figure7. Immunofluorescence staining for double staining of MSK1 and GFAP (Inverted fluorescence microscope×400)From left to right for MSK1, GFAP, DAPI, and merge a. Group B; b. Group C
 圖8
免疫熒光染色檢測 PCNA 與 GFAP 雙標染色(×400)
圖8
免疫熒光染色檢測 PCNA 與 GFAP 雙標染色(×400)
從左至右依次為 PCNA、GFAP、DAPI 以及三者重疊 a. B 組;b. C 組
Figure8. Immunofluorescence staining for double staining of PCNA and GFAP (Inverted fluorescence microscope×400)From left to right for PCNA, GFAP, DAPI, and merge a. Group B; b. Group C
3 討論
中樞神經系統炎性反應的標志是神經膠質細胞的活化,包括星形膠質細胞和小神經膠質細胞[12]。而中樞神經系統的外傷性損傷導致星形膠質細胞的肥大、增殖,其特征在于一個快速的炎性反應和增加的 GFAP 表達,導致炎癥和細胞毒性物質的釋放[13]。雖然目前有證據表明,在脊髓損傷的初始階段,活性星形膠質細胞和小膠質細胞在軸突再生和后期功能恢復中發揮神經保護和修復作用[14];但在脊髓損傷期間,活性星形膠質細胞過度激活,嚴重時會最終導致損傷部位周圍膠質瘢痕形成和分泌多種神經毒性分子,阻止傷后神經再生[15]。所以抑制星形膠質細胞過度增生和神經膠質瘢痕形成,可能有助于神經元修復和軸突再生。
脊髓損傷的繼發性損傷涉及多個信號通路如 MAPK 信號傳遞途徑,誘發并級聯放大炎性反應,最終導致神經細胞壞死。在 MAPK 靶點中,MSK1 在 p38 和 ERK1/2 的下游被激活,廣泛參與免疫和炎癥應答,在調控細胞增殖和轉化、調節突觸可塑性、神經元存活、神經元成熟和發育可塑性中起重要作用。MSK1 被 ERK 激活,通常介導生長因子、多肽類激素、神經遞質、細胞因子的生物學效應[16];MSK1 被 p38 激活,通常介導細胞炎性刺激和壓力反應,如紫外線照射、氧化應激以及茴香霉素介導的細胞反應[17]。此外,Toll 樣受體識別細菌脂多糖等病原微生物,也能激活 MSK1[18]。因此,MSK1 與細胞增殖及應激反應,特別是炎性反應關系十分密切,在多個生物學事件中發揮重要作用。
研究表明在大鼠腦內注射細菌脂多糖誘導的腦損傷模型中,MSK1 參與星形膠質細胞炎癥,抑制炎性細胞因子 TNFα、IL-6 和 IL-1β 的產生[19]。在巨噬細胞中,最近顯示 MSK1 參與負反饋途徑,這對于防止不受控制的炎癥至關重要[20]。MSK 通過控制其在巨噬細胞和樹突狀細胞中的轉錄來調節 IL-10。在一項由去除鎂來誘導培養海馬的過度興奮性和變性神經元的研究中表明,MSK1 在興奮性毒素介導的神經元損傷中,通過增強谷氨酸能神經傳遞發揮重要作用[21]。雖然 MSK1 和 MSK2 敲除小鼠在中樞神經系統發育中未表現出嚴重缺陷,但在某些情況下,MSKs 在神經元增殖或存活中起作用。在毛果蕓香堿誘導的癲癇發作后,通過 MSK1 和 MSK2 的敲除降低了小鼠齒狀回的小顆粒區中的神經元祖細胞增殖。此外,在該區域的未成熟神經元中也觀察到還原神經突的形成,表明 MSK 正在幫助推動增殖和新神經元的成熟[22]。Ning 等[23]在大鼠腦損傷的研究中證實,MSK1 在神經元和星形膠質細胞中表達,且在星形膠質細胞中與其增殖抗原 PCNA 共定位。該研究同時通過 Western blot 法檢測 MSK1 在大鼠腦損傷后的表達變化,結果發現 MSK1 在顱腦損傷 12 h 后其表達水平逐漸下降,在 3 d 時降至最低,后逐漸恢復至正常水平,而這種變化和 PCNA 的表達變化具有相反性,說明 MSK1 在大鼠腦外傷后在膠質細胞增殖中可能發揮了一定作用。
本研究在前期通過建立大鼠脊髓損傷模型,并于損傷后 8、12 h 及 1、2、3、5、7 d 取材行 Western blot 檢測 MSK1 及 PCNA 蛋白表達變化。結果顯示 MSK1 蛋白在脊髓損傷后 8 h 開始下降,傷后 3 d 降至最低,然后逐漸上升;而 PCNA 蛋白在脊髓損傷后 8 h 開始上升,至傷后 3 d 達峰值,而后逐漸下降。MSK1 與 PCNA 蛋白表現出相反的變化趨勢,這一結果與 Ning 等[23]在大鼠腦損傷中 MSK1 的表達類似。為進一步探索 MSK1 在脊髓損傷修復中的作用及意義,我們通過構建 MSK1 siRNA 重組慢病毒,并參照 Tan 等[9]和 Hu 等[10]的方法注射到大鼠脊髓損傷部位。而前期在大鼠脊髓損傷后局部注射陰性對照慢病毒,灌注取材行冰凍切片熒光顯微鏡下觀察發現,注射后 1 d 即可見綠色熒光表達,至 7 d 綠色熒光表達最強。所以我們采用脊髓損傷慢病毒注射后 7 d 這一時間點作為進一步實驗的基礎。并將大鼠分為單純脊髓損傷組、脊髓損傷后轉染陰性對照慢病毒 LV3NC 組和脊髓損傷后轉染 MSK1 siRNA 組,術后 7 d 取材行 Western blot 及免疫熒光雙標染色,結果發現注射 MSK1 siRNA 慢病毒后 MSK1 蛋白表達被有效抑制,同時伴隨著 PCNA 蛋白表達的相對增加。
PCNA 是一種重要的定位于細胞核內的 DNA 修復相關蛋白,參與多種 DNA 修復過程,如 DNA 的正常復制、堿基切除、核酸切除以及錯配切除等修復過程[24],是評價細胞增殖狀態的重要指標。有研究發現,脊髓損傷后星形膠質細胞和小膠質細胞上表達較多的 PCNA[24]。而 PCNA 是否是通過調控神經膠質細胞的增殖,在大鼠脊髓損傷中發揮作用尚不明確。因此我們進行免疫熒光染色,通過 PCNA 及 GFAP 的熒光表達情況,明確 PCNA 是否調控神經膠質細胞的增殖。結果顯示 MSK1 在脊髓表達并存在于細胞核中,并與 GFP、NeuN 及 GFAP 共定位。GFP 蛋白是構建慢病毒攜帶的綠色熒光標志蛋白,MSK1 與 GFP 共表達說明 MSK1 能成功轉染入脊髓。NeuN 和 GFAP 分別是神經元和星形膠質細胞的標志蛋白,MSK1 與 NeuN 及 GFAP 共定位,間接證明病毒轉染發生于神經元及星形膠質細胞中。
我們進一步采用 Image J 軟件進行免疫熒光染色陽性細胞相對表達面積定量分析,結果顯示注射 MSK1 siRNA 慢病毒后,MSK1 的陽性細胞相對表達面積較注射陰性對照慢病毒低,而 PCNA 的陽性細胞相對表達面積較注射陰性對照慢病毒高,這與 Western blot 檢測 MSK1 及 PCNA 的表達結果相似。而伴隨著 MSK1 的下降及 PCNA 的上調,GFAP 的陽性細胞相對表達面積也上升。
為了明確 MSK1 在脊髓損傷修復中對運動功能的影響,我們采用大鼠后肢 BBB 運動功能評分進行評價。結果顯示脊髓損傷后轉染 MSK1 siRNA 組在術后 5、7、14 d 評分均低于注射陰性對照慢病毒組及單純脊髓損傷組。可能是由于脊髓損傷后轉染 MSK1 siRNA 下調了脊髓中 MSK1 的表達,而 PCNA 在脊髓中表達增加,PCNA 又通過調控星形膠質細胞的增殖,最終導致損傷部位周圍膠質瘢痕形成,阻礙神經元修復和軸突再生,進而導致運動功能障礙。
綜上述,本研究結果表明構建的 MSK1 siRNA 重組慢病毒能成功轉染入大鼠脊髓中,并有效抑制 MSK1 的表達;MSK1 的表達被抑制后明顯降低了脊髓損傷后大鼠后肢功能的恢復;而 MSK1 沉默后,PCNA 繼發性上調并伴隨著星形膠質細胞的增殖。因此我們認為,MSK1 可能通過 PCNA 調控神經膠質細胞的增殖,在大鼠脊髓損傷后的修復中發揮一定作用。